Свойства воды — урок. Окружающий мир, 3 класс.
Вода — самое распространённое вещество на нашей планете. Вспомним её свойства.
При комнатной температуре вода жидкая. Она принимает форму сосуда, в котором находится.
Вода текучая, как и все жидкости. Поэтому на земле есть реки, ручьи и водопады, а в наш дом она может поступать по водопроводу.
Вода бесцветная и прозрачная, и мы хорошо видим обитателей водоёма или аквариума.
Вода не имеет запаха и вкуса.
Вода растворяет многие вещества. Если в воду насыпать соль и перемешать, то соль как бы пропадает. Вода остаётся прозрачной, но становится солёной. Это происходит потому, что частицы соли перемешиваются с частицами воды.
Растворяются в воде и другие вещества: сахар, уксус, спирт.
Но известно много веществ, которые в воде не растворяются. Если смешать с водой песок, то вода станет мутной, а песок через некоторое время осядет на дне сосуда.
Не растворяется в воде мел и некоторые жидкости, например, растительное масло и бензин.
Для очистки воды от примесей твёрдых веществ используется фильтрование. Мутную воду пропускают через фильтр (специальную бумагу или ткань). На фильтре оседают твёрдые частицы, а вода становится чистой.
При нагревании вода расширяется, а при охлаждении сжимается.
определение, образование, свойства и применение
Вода — это необыкновенная субстанция, которая не перестает нас удивлять. Она основной компонент планеты, вода необходима для жизни всего живого. Люди могут выдержать без воды только несколько дней. Если не восстановить вовремя ее потери в организме, это верная смерть. Поэтому важно научиться разумно, тратить ее и знать, что же такое вода.
Химические названия
Почему же воду назвали водой? Слово «вода» происходит от древнегерманского «мокрый, текучий». В химии могут встречаться разные названия этого соединения. Самые распространенные – гидроксид водорода и окись водорода. Также в химической литературе ее называют:
- монооксид дигидрофосфата;
- гидроксильная кислота;
- дигидромонооксид
- оксидан

Образование воды
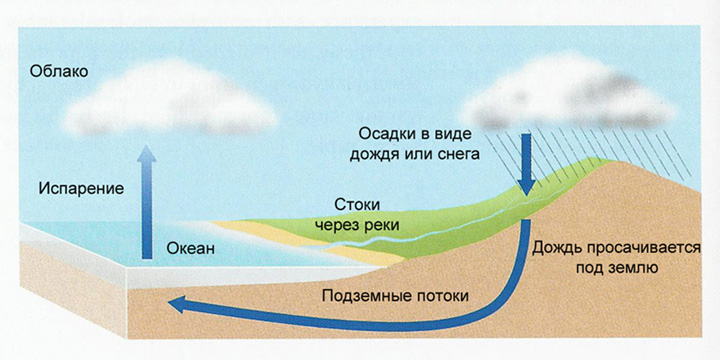
Многих интересует, какая вода находится в реках, морях, под землей. Образовавшаяся миллиарды лет назад вода сконцентрировалась в океанах. Из океанов она испаряется и поднимается, где образуются облака. После долгого путешествия она возвращается на землю в виде осадков. Вода собирается и возвращается через реки обратно в море. Часть просачивается в почву и попадает в грунтовые воды. Там формируются новые источники, которые текут в море.
В более холодном климате вода остается на ледниках, которые очень медленно, стекают к более низким высотам, где и тают. В полярных регионах этот механизм скольжения настолько медленный, что в ледниках можно найти воду, попавшую на поверхность Земли десятки тысяч лет назад. Вот откуда берется в природе вода.
Свойства
Влияние воды на жизнь на земле огромное. Это среда обитания для многих организмов. Она является хорошим растворителем не только для солей, но и для многих других веществ. Например, питательные соли присутствуют в почве в виде ионов, то есть в растворенном виде. Только в таком виде растения могут поглощать их через корни. Поэтому не случайно вода— это источник жизни на земле.
Вода является важным источником химических и биохимических реакций, например, для фотосинтеза. Это заметно, когда растение увядает из-за потери воды, а листья и цветы опадают. Не зря говорят, что вода—это главный источник жизни.

Физические свойства
- Н2О имеет высокое поверхностное натяжение, то есть тенденцию принимать сферический объем.
- Другим свойством является капиллярность. Молекула h3O способна перемещаться в очень узких пространствах.
- Удельная теплоемкость у нее примерно в 4 раза больше, чем у воздуха. Это определяет устойчивость к изменениям температуры.
- Плотность воды увеличивается с понижением температуры, примерно до 4 С. Ниже этого порога плотность уменьшается.
- Она обладает минимальной вязкостью при высоких давлениях. Поэтому, чем больше давление, тем легче ей проникать.
Агрегатные состояния
В нормальных условиях вода, является жидкостью. Это единственное известное вещество, которое существует в природе во всех трех классических состояниях материи: жидком, твердом, газообразном.
Кстати, термин вода используется для жидкого агрегатного состояния. В твердом, то есть в замороженном состоянии, она называется льдом, в газообразном состоянии— водяным паром или просто паром. Существует порог, где при определенных температурах и равновесного давления три состояния могут сосуществовать одновременно.

Оптические свойства
Когда свет пересекает границу раздела вода-воздух, полное отражение происходит под углом 49 град. Это означает, что световые лучи, попадающие на граничную поверхность, не излучаются из воды, а отражаются.
Преломление света приводит к оптическим иллюзиям. Поэтому под водой объекты видятся не в том месте, где они находятся на самом деле. То же самое происходит если смотреть через воду на воздух. Светопропускная ценность воды обеспечивает присутствие в ней водорослей и растений, которым необходим свет для жизни. Длинноволновый (красный) свет поглощается сильнее, чем коротковолновый (синий) свет.
Изотопные модификации
Химические свойства
Вода амфотерна, в зависимости от окружающей среды, может действовать как кислота и основание. В водных растворах сильные кислоты и сильные основания полностью диссоциируют на ионы H 3 O + и O H. Это называется выравнивающим эффектом воды. Чтобы иметь возможность различать очень сильные кислоты по кислотности, константы равновесия определяют в неводных растворах, и переносят в растворитель воду.

Многих интересует, вода является органическим веществом или неорганическим. С точки зрения химии, она относится к неорганическим веществам. Поскольку, в органики должен присутствовать углерод, а в воде его нет.
Волновая функция основного состояния воды
Под водой скорость звука в 4,4 раза выше, чем у поверхности, и составляет 1483 м /с при температуре 20 С. Поэтому пространственное восприятие звука под водой сильно затруднено, мозг просто не успевает обработать информацию. Важно знать, что звук под водой не только проходит быстрее, но также в большей степени чем в воздухе зависит от частоты. Поэтому глубокие частоты, такие как звуки больших морских двигателей, часто могут быть услышаны драйверами на расстоянии нескольких километров.
В природе
Вода в природе везде. Реки и океаны, облака на небе, к этому добавляются грунтовые воды и те, которые постоянно хранятся в почве и обеспечивает основу для ее плодородия. Вода в природе — это жизнь, без воды все ничто. Она— основа плодородия, без нее не было бы ни растений, ни пищи.
Атмосферные осадки
Вода в природе находится в круговороте. Испаряясь, она поднимается как водяной пар в атмосферу. За тем крошечные капельки собираются и образуют облака. Когда облака попадают в холодный воздух, маленькие капли воды конденсируются и образуют дождь, снег или град.

Вода за пределами земли
Вода за пределами Земли на одних небесных телах находится в твердом состоянии (лед), а на других как водяной пар. В виде льда, она была обнаружена в кометах («грязные снежки»), на Марсе и на некоторых других внешних планетах. Только кольца Сатурна содержат примерно в 20-30 раз больше воды, чем Земля. Доказательства присутствия льда в метеоритных кратерах вблизи полюсов можно найти даже на Меркурии, планете, ближайшей к Солнцу.
Биологическая роль
Вода является источником здоровой жизни и очень важна для организма. Как часть крови, она снабжает нас кислородом и питательными веществами. В то же время токсины транспортируются через кровоток в почки, удаляются из организма. Вода регулирует температуру тела. Если температура воздуха высокая, человек потеет, и тело охлаждается. Однако, если пот не выделяется, то поднимается температура и самочувствие ухудшается.
Многие витамины, молекулы сахара могут использоваться организмом только через воду. Органические вещества расщепляются в воде и транспортируются к нужным органам. Кроме того, она является важным компонентом клеток и тканей. Например, мозг на 90 % состоит из жидкости.
Применение
Вода используется во всех сферах жизни. Люди пьют ее, готовят пищу, поливают растения. На гидроэлектростанциях вода используется, как источник энергии. Она также необходима на фабриках, например, для производства и переработки бумаги. Кстати, для производства одного листа бумаги требуется 10 литров воды! При тушении пожаров без нее не обойтись. Сельское хозяйство было бы невозможно без Н2О.

Многие используют ее в качестве лекарства от разных болезней. Особенно много целебных свойств, приписывают органической воде.
Исследования
Вода существует миллиарды лет, и, казалось бы, что о ней знают все, но она все равно остается тайной. Создаются целые институты, которые пытаются узнать, как сделать аналог воды, откуда она появилась на Земле и в космосе. Они изучают ее влияние на жизнь, ландшафт, природу.
Происхождение воды на планете
Многих интересует, откуда все-таки взялась вода. Она родилась четыре с половиной миллиарда лет назад в глубинах вселенной. Земля, еще не полностью сформированная, состояла в основном из вулканов. Газы, богатые водяным паром, выделялись в атмосферу, там образовывались облака. За тысячелетия земля остыла, и пары, сгущаясь, падали обратно на земную кору в виде дождя. Также формированию этого очень важного источника жизни, способствовали падающие кометы, состоящие в основном изо льда и фрагментов породы. Это явление способствовало образованию рек, озер и океанов, где миллионы лет спустя появились бы первые формы жизни.
Гидрология
Понять, как вода взаимодействует с атмосферой, как влияет на жизнедеятельность, помогает наука гидрология. Она изучает, какая вода находится в водной оболочке Земли. Гидрология помогает понять, как рационально управлять водными объектами. Она составляет прогнозы состояния водных ресурсов, и дает им оценку.
Гидрогеология
Наука, которая изучает подземные воды, гидрогеохимию называется гидрогеология. Гидрогеологи занимаются поиском новых подземных водных источников, изучают, как сделать воду из подземных источников полезной для мелиорации, водоснабжения, природного ландшафта. Данные полученные учеными помогают снизить негативные влияния деятельности людей, на подземные водные источники.
Теперь вы знаете всю правду о воде, и понимаете, насколько важно бережно к ней относится. Ведь если пропадет вода, то не станет и нас.
свойства воды: физические и химические
Благодаря своим уникальным физическим и химическим свойствам, часто аномальным, вода сделала возможной жизнь на Земле. Так в чем состоят эти уникальные характеристики?
Физические свойства воды
Вода имеет высокую удельную теплоемкость, т.е. ей нужно много тепла, чтобы нагреться, и потребуется много времени, чтобы потерять накопленное тепло и остыть. Вот почему она используется в системах охлаждения (например, в автомобильных радиаторах или для охлаждения промышленного оборудования). Эта характеристика объясняет также то, почему в прибрежных (или озерных) регионах температура воздуха мягче: в этих местах, когда времена года меняются, температура воды «смягчает» температуру воздуха, так как она уменьшается или увеличивается медленнее.

При ответе на вопрос: какие физические свойства воды определяют ее особое биологическое значение, первым делом нужно вспомнить, что она имеет высокое поверхностное натяжение. Это означает, что после наливания на гладкую поверхность она имеет тенденцию образовывать сферические капли, а не растекаться в тонкую пленку. И это свойство во многом объясняет высокую биологическую активность воды. Без гравитации капля ее была бы совершенно сферической. Поверхностное натяжение позволяет растениям поглощать воду, содержащуюся в почве, через корни. И поверхностное натяжение делает кровь такой «проникающей» через ткани нашего организма.
Вода обычно находится в жидком состоянии, но может легко стать твердой или газообразной. Чистая вода переходит из жидкой в твердую, то есть замерзает при 0° С, а на уровне моря она кипит при 100 ° С (чем выше уровень, тем ниже температура, при которой вода начинает кипеть). Значения кипения и замерзания воды берут в качестве контрольной точки для калибровки термометров: в градусах Цельсия 0 ° по шкале Цельсия — это точка замерзания, а 100 ° — это точка кипения.
При замерзании вода расширяется, то есть ее плотность уменьшается, а объем остается неизменным: поэтому лед плывет по поверхности или лопается бутылка, наполненная водой и помещенная в морозильник.

Вода является особым природным ресурсом, поскольку она является единственным на Земле веществом, которое можно найти во всех трех физических состояниях в зависимости от температуры окружающей среды: жидкой, твердой (лед) и газообразной (пар).
Химические свойства воды
Химическая формула молекулы воды — h3O: два атома водорода (h3) связаны с одним атомом кислорода (O). Электроны атома (частицы с отрицательным зарядом) устанавливают связи между собой. Кислород способен держать их ближе к нему, чем водород. Молекула эта оказывается заряженной отрицательно вблизи атома кислорода и положительно вблизи атомов водорода. Поскольку противоположности притягиваются, молекулы воды имеют тенденцию соединяться вместе, как магниты.
Вода может растворять многие вещества
Воду называют универсальным растворителем, поскольку она может растворять больше веществ, чем любая другая жидкость. И нам очень с этим повезло: если бы не это химическое свойство, мы не могли бы выпить чашку горячего подслащенного чая, потому что сахар остался бы на дне чашки. Вот почему воды рек, ручьев, озер, морей и океанов, которые выглядят чистыми на первый взгляд, на самом деле содержат огромное количество растворенных элементов и минералов, выделяемых камнями или атмосферой.
Везде, где течет вода, над землей, под землей или внутри нашего тела, вода растворяет в себе и несет чрезвычайно большое количество различных веществ. Таким образом, она выполняет драгоценную задачу: переносить иногда на большие расстояния вещества, с которыми она сталкивается на своем пути. Причем, с водой при обычных климатических условиях не реагирует большинство этих веществ.

Чистая вода, как и дистиллированная вода, имеет рН 7 (средний). Морская вода в основном щелочная, имеет рН около 8. Чистая вода реагирует с немногими веществами, например, серой, некоторыми солями и металлами. Также возможен гидролиз (распад) воды при реакции с какими-то химическими веществами.
Вода может содержать огромное количество взвешенных частиц разных веществ, в т.ч. и радиоактивных. Именно этим и объясняется превращение чистой воды в радиоактивную. И в наш век вездесущей атомной энергетики глубокая и своевременная дезактивация воды – уже глобальная проблема.
Физико-химические свойства воды
То, какими свойствами обладает чистая вода, во многих случаях зависит от водородных связей внутри ее молекул. При сравнении этих свойств со свойствами атомов или не связанных с водородом молекулярных жидкостей с аналогичными размерами молекул некоторые особенности воды заслуживают внимания:
- Точка плавления льда исключительно высока среди гидридов шестой основной группы.
- Во время таяния льда при атмосферном давлении объем вещества уменьшается на 8,2%. Это аномальное сокращение объема, ведь большинство веществ расширяется во время плавления. Снижению температуры замерзания способствует увеличение давления.
- Зависимость молярного объема жидкой воды от давления и температуры показывает крайности. Плотность жидкой воды имеет максимум при 3,98 ° С.
- Коэффициент теплового расширения α жидкой воды на порядок меньше по сравнению с другими молекулярными жидкостями. Изотермическая сжимаемость χT показывает, что для молекулярной жидкости вода довольно несжимаема.
- Динамическая вязкость воды выше, чем у сопоставимых, не связанных водородом жидкостей. Более того, зависимость вязкости от давления аномальна: вязкость уменьшается с давлением и достигает минимума около 60 МПа (это давление эквивалентно толще воды в 6 км).
- Поверхностное натяжение воды выше, чем у других жидкостей, включая большинство других жидкостей, связанных водородом. В диапазоне температур от 0 до 130°С вода жидкая.
- Теплопроводность увеличивается с ростом температуры. Жидкая вода обладает высокой удельной теплоемкостью при постоянном давлении, которое изменяется незначительно до 100°C.
- Энтальпия испарения воды аномально высока. Аналогично удельной теплоемкости, она почти в четыре раза выше, чем для других сопоставимых жидкостей, не связанных с водородом. Эта разница приписывается водородной связи. Кроме того, энтальпия испарения воды очень велика по сравнению с энтальпией таяния.
Тот факт, что вода увеличивается в объеме при замерзании, приводит ко многим последствиям в природе. Именно вода и ее свойство легко проникать в расщелины скал, когда она замерзает, приводит к разрушению скал. Постепенно происходит физическое и химическое выветривание скальных пород. И, в конечном итоге, физические свойства и химические функции воды сформировали почву на нашей планете.
Тот факт, что вода имеет самую высокую плотность при 4°С, а не в точке замерзания, имеет важное значение для термического расслоения и циркуляции воды в природе. Это химико-физическое свойство воды приводит к замерзанию водоемов от их поверхности в направлении дна. Это важно не только для жизни внутренних водоемов, но и для океанов. Если бы самые холодные районы океанов должны были замерзать снизу-вверх, то солнечной энергии, полученной за время лета, было бы достаточно только для оттаивания самого верхнего слоя. Так осуществляется круговорот энергии и материи, которая опирается на циркуляции океанов частично или даже полностью.
Огромная удельная теплоемкость воды ответственна за его способность хранить огромное количество энергии. Таким образом, водные потоки, например, Гольфстрим, способны нести огромное количество тепла из более теплых климатических зон в более холодные. Таким образом, океаны работают как огромные термостаты. Не только климат Земли, но и температурное регулирование живых организмов зависит от высокой теплоемкости воды. Это способствует, например, поддержанию постоянной температуры тела у теплокровных организмов. Кроме того, относительно высокая теплопроводность воды предотвращает серьезные локальные колебания температуры.
Абсолютно чистая вода имеет электрическую проводимость 0,03 мкСм / см это связано с автопротолизом. Электропроводность, однако, на реальных водоемах значительно выше, из-за растворенных ионных компонентов. Вода, будучи сильным диэлектриком (водный диэлектрик – константа), является одним из самых лучших растворителей для солей и газов, которые способны к сольволизу с последующей диссоциацией (например, CO2).
Еще одна особенность воды, которая важна для гидрологического цикла — ее энтальпия испарения. С этим тесно связана летучесть воды. Она определяет количество воды, которое переходит в газовую фазу и может транспортироваться в атмосферу.
Таким образом, можно сделать вывод, что вода уникальна в физическом и химическом плане. Особые свойства воды сделали ее колыбелью и абсолютным условием жизни на Земле. Зная основные характеристики этого вещества, можно делать вывод: благодаря каким своим химическим и физико-химическим свойствам вода стала жидкой основой жизни.
Самое важное, уникальное по свойствам и составу вещество нашей планеты — это, конечно, вода. Ведь именно благодаря ей на Земле жизнь есть, в то время как на других известных сегодня объектах Солнечной системы ее нет. Твердая, жидкая, в виде пара — она нужна и важна любая. Вода и ее свойства составляют предмет изучения целой научной дисциплины — гидрологии.
Количество воды на планете
Если рассматривать показатель количества данного оксида во всех агрегатных состояниях, то его на планете около 75% от общей массы. При этом следует учитывать связанную воду в органических соединениях, живых существах, минералах и прочих элементах.

Если учитывать только жидкое и твердое состояние воды, показатель падет до 70,8%. Рассмотрим, как распределяются эти проценты, где содержится рассматриваемое вещество.
- Соленой воды в океанах и морях, солончаковых озерах на Земле 360 млн км2.
- Пресная вода распределена неравномерно: ее в ледниках Гренландии, Арктики, Антарктиды заковано во льды 16,3 млн км2.
- В пресных реках, болотах и озерах сосредоточено 5,3 млн км2 оксида водорода.
- Подземные воды составляют 100 млн м3.
Именно поэтому космонавтам из далекого космического пространства видно Землю в форме шара голубого цвета с редкими вкраплениями суши. Вода и ее свойства, знание особенностей строения являются важными элементами науки. К тому же, в последнее время человечество начинает испытывать явную нехватку пресной воды. Может быть, такие знания помогут в решении данной проблемы.
Состав воды и строение молекулы
Если рассмотреть эти показатели, то сразу станут понятны и свойства, которые проявляет это удивительное вещество. Так, молекула воды состоит из двух атомов водорода и одного атома кислорода, поэтому имеет эмпирическую формулу Н2О. Кроме того, при построении самой молекулы большую роль играют электроны обоих элементов. Посмотрим, что собой представляют структура воды и ее свойства.
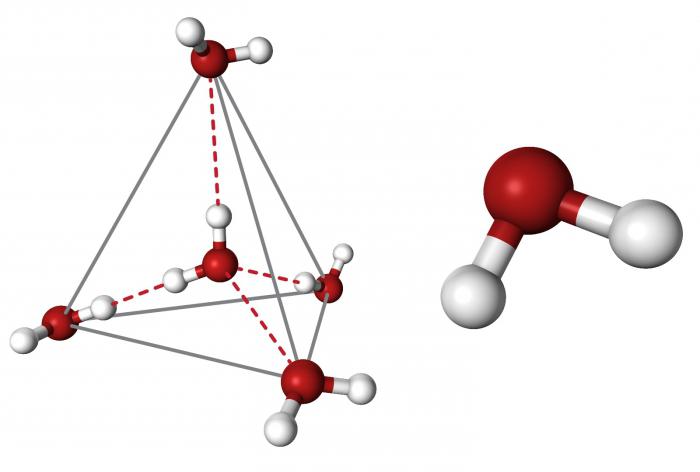
Очевидно, что каждая молекула ориентирована вокруг другой, и все вместе они формируют общую кристаллическую решетку. Интересно то, что оксид построен в форме тетраэдра — атом кислорода в центре, а две пары электронов его и два атома водорода вокруг асимметрично. Если провести через центры ядер атомов линии и соединить их, то получится именно тетраэдрическая геометрическая форма.
Угол между центром атома кислорода и ядрами водородов составляет 104,5 0С. Длина связи О-Н = 0,0957 нм. Наличие электронных пар кислорода, а также его большее в сравнении с водородами сродство к электрону обеспечивают формирование в молекуле отрицательно заряженного поля. В противовес ему ядра водородов образуют положительно заряженную часть соединения. Таким образом, выходит, что молекула воды — диполь. Это определяет то, какой может быть вода, и ее физические свойства также зависят от строения молекулы. Для живых существ эти особенности играют жизненно важную роль.
Основные физические свойства
К таковым принято относить кристаллическую решетку, температуры кипения и плавления, особенные индивидуальные характеристики. Все их и рассмотрим.
- Строение кристаллической решетки оксида водорода зависит от агрегатного состояния. Оно может быть твердым — лед, жидким — основная вода при обычных условиях, газообразным — пар при повышении температуры воды свыше 100 0С. Красивые узорные кристаллы формирует лед. Решетка в целом рыхлая, но соединение очень прочное, плотность низкая. Видеть ее можно на примере снежинок или морозных узоров на стеклах. У обычной воды решетка не имеет постоянной формы, она изменяется и переходит из одного состояния в другое.
- Молекула воды в космическом пространстве имеет правильную форму шара. Однако под действием земной силы тяжести она искажается и в жидком состоянии принимает форму сосуда.
- То, что по структуре оксид водорода — диполь, обуславливает следующие свойства: высокая теплопроводность и теплоемкость, которая прослеживается в быстром нагревании и долгом остывании вещества, способность ориентировать вокруг себя как ионы, так и отдельные электроны, соединения. Это делает воду универсальным растворителем (как полярным, так и нейтральным).
- Состав воды и строение молекулы объясняют способность этого соединения образовывать множественные водородные связи, в том числе с другими соединениями, имеющими неподеленные электронные пары (аммиак, спирт и прочие).
- Температура кипения жидкой воды — 1000С, кристаллизация наступает при +40С. Ниже этого показателя — лед. Если же увеличивать давление, то температура кипения воды резко возрастет. Так, при высоких атмосферах в ней можно растопить свинец, но она при этом даже не закипит (свыше 3000С).
- Свойства воды весьма значимы для живых существ. Например, одно из самых важных — поверхностное натяжение. Это формирование тончайшей защитной пленки на поверхности оксида водорода. Речь идет о воде в жидком состоянии. Эту пленку разорвать механическим воздействием очень сложно. Учеными установлено, что понадобится сила, равная весу в 100 тонн. Как ее заметить? Пленка очевидна, когда вода капает из крана медленно. Видно, что она словно в какой-то оболочке, которая растягивается до определенного предела и веса и отрывается в виде круглой капельки, слегка искаженной силой тяжести. Благодаря поверхностному натяжению многие предметы могут находиться на поверхности воды. Насекомые, имеющие особые приспособления, могут свободно передвигаться по ней.
- Вода и ее свойства аномальны и уникальны. По органолептическим показателям данное соединение — бесцветная жидкость без вкуса и запаха. То, что мы называем вкусом воды, — это растворенные в ней минералы и другие компоненты.
- Электропроводность оксида водорода в жидком состоянии зависит от того, сколько и каких солей в нем растворены. Дистиллированная вода, не содержащая никаких примесей, электрический ток не проводит.
Лед — это особое состояние воды. В структуре этого ее состояния молекулы связаны друг с другом водородными связями и формируют красивую кристаллическую решетку. Но она достаточно неустойчива и легко может расколоться, растаять, то есть деформироваться. Между молекулами сохраняется множество пустот, размеры которых превышают размеры самих частиц. Благодаря этому плотность льда меньше, чем жидкого оксида водорода.

Это имеет большое значение для рек, озер и прочих пресных водоемов. Ведь в зимний период вода в них не замерзает полностью, а лишь покрывается плотной коркой более легкого льда, всплывающего наверх. Если бы данное свойство не было характерно для твердого состояния оксида водорода, то водоемы промерзали бы насквозь. Жизнь под водой была бы невозможна.
Кроме того, твердое состояние воды имеет большое значение как источник огромного количества питьевых пресных запасов. Это ледники.
Особенным свойством воды можно назвать явление тройной точки. Это такое состояние, при котором лед, пар и жидкость могут существовать одновременно. Для этого требуются такие условия, как:
- высокое давление — 610 Па;
- температура 0,010С.
Показатель прозрачности воды варьируется в зависимости от посторонних примесей. Жидкость может быть полностью прозрачной, опалесцентной, мутной. Поглощаются волны желтого и красного цветов, глубоко проникают лучи фиолетовые.

Химические свойства
Вода и ее свойства — важный инструмент в понимании многих процессов жизнедеятельности. Поэтому они изучены очень хорошо. Так, гидрохимию интересуют вода и ее химические свойства. Среди них можно назвать следующие:
- Жесткость. Это такое свойство, которое объясняется наличием солей кальция и магния, их ионов в растворе. Подразделяется на постоянную (соли названных металлов: хлоридов, сульфатов, сульфитов, нитратов), временную (гидрокарбонаты), которая устраняется кипячением. В России воду перед использованием смягчают химическим путем для лучшего качества.
- Минерализация. Свойство, основанное на дипольном моменте оксида водорода. Благодаря его наличию молекулы способны присоединять к себе множество других веществ, ионов и удерживать их. Так формируются ассоциаты, клатраты и прочие объединения.
- Окислительно-восстановительные свойства. Как универсальный растворитель, катализатор, ассоциат, вода способна взаимодействовать с множеством простых и сложных соединений. С одними она выступает в роли окислителя, с другими — наоборот. Как восстановитель реагирует с галогенами, солями, некоторыми менее активными металлами, с многими органическими веществами. Последние превращения изучает органическая химия. Вода и ее свойства, в частности, химические, показывают, насколько она универсальна и уникальна. Как окислитель она вступает в реакции с активными металлами, некоторыми бинарными солями, многими органическими соединениями, углеродом, метаном. Вообще химические реакции с участием данного вещества нуждаются в подборе определенных условий. Именно от них и будет зависеть исход реакции.
- Биохимические свойства. Вода является неотъемлемой частью всех биохимических процессов организма, являясь растворителем, катализатором и средой.
- Взаимодействие с газами с образованием клатратов. Обычная жидкая вода может поглощать даже неактивные химически газы и располагать их внутри полостей между молекулами внутренней структуры. Такие соединения принято называть клатратами.
- Со многими металлами оксид водорода формирует кристаллогидраты, в которые он включен в неизменном виде. Например, медный купорос (CuSO4*5H2O), а также обычные гидраты (NaOH*H2O и другие).
- Для воды характерны реакции соединения, при которых происходит образование новых классов веществ (кислот, щелочей, оснований). Они не являются окислительно-восстановительными.
- Электролиз. Под действием электрического тока молекула разлагается на составные газы — водород и кислород. Один из способов получения их в лаборатории и промышленности.
С точки зрения теории Льюиса вода — это слабая кислота и слабое основание одновременно (амфолит). То есть можно сказать о некоей амфотерности в химических свойствах.

Вода и ее полезные свойства для живых существ
Сложно переоценить то значение, которое имеет оксид водорода для всего живого. Ведь вода и есть сам источник жизни. Известно, что без нее человек не смог бы прожить и недели. Вода, ее свойства и значение просто колоссальны.
- Это универсальный, то есть способный растворять и органические, и неорганические соединения, растворитель, действующий в живых системах. Именно поэтому вода — источник и среда для протекания всех каталитических биохимических преобразований, с формированием сложных жизненно важных комплексных соединений.
- Способность образовывать водородные связи делает данное вещество универсальным в выдерживании температур без изменения агрегатного состояния. Если бы это было не так, то при малейшем снижении градусов она превращалась бы в лед внутри живых существ, вызывая гибель клеток.
- Для человека вода — источник всех основных бытовых благ и нужд: приготовление пищи, стирка, уборка, принятие ванны, купание и плавание и прочее.
- Промышленные заводы (химические, текстильные, машиностроительные, пищевые, нефтеперерабатывающие и другие) не сумели бы осуществлять свою работу без участия оксида водорода.
- Издревле считалось, что вода — это источник здоровья. Она применялась и применяется сегодня как лечебное вещество.
- Растения используют ее как основной источник питания, за счет чего они продуцируют кислород — газ, благодаря которому существует жизнь на нашей планете.
Можно назвать еще десятки причин того, почему вода — это самое широко распространенное, важное и необходимое вещество для всех живых и искусственно созданных человеком объектов. Мы привели только самые очевидные, главные.

Гидрологический цикл воды
Иными словами, это ее круговорот в природе. Очень важный процесс, позволяющий постоянно пополнять исчезающие запасы воды. Как он происходит?
Основных участников трое: подземные (или грунтовые) воды, поверхностные воды и Мировой океан. Важна также и атмосфера, конденсирующая и выдающая осадки. Также активными участниками процесса являются растения (в основном деревья), способные поглощать огромное количество воды в сутки.
Итак, процесс происходит следующим образом. Грунтовые воды заполняют подземные капилляры и стекаются к поверхности и Мировому океану. Затем поверхностные воды поглощаются растениями и транспирируются в окружающую среду. Также происходит испарение с огромных площадей океанов, морей, рек, озер и прочих водоемов. Попав в атмосферу, вода что делает? Конденсируется и проливается обратно в виде осадков (дождь, снег, град).
Если бы не происходили эти процессы, то запасы воды, особенно пресной, давно бы уже закончились. Именно поэтому охране и нормальному гидрологическому циклу уделяется людьми большое внимание.
Понятие о тяжелой воде
В природе оксид водорода существует в виде смеси изотопологов. Это связано с тем, что водород формирует три вида изотопа: протий 1Н, дейтерий 2Н, тритий 3Н. Кислород, в свою очередь, также не отстает и образует три устойчивые формы: 16О, 17О, 18О. Именно благодаря этому существует не просто обычная протиевая вода состава Н2О (1Н и 16О), но еще и дейтериевая, и тритиевая.

При этом устойчива по структуре и форме именно дейтериевая (2Н), которая включается в состав практически всех природных вод, но в малом количестве. Именно ее называют тяжелой. Она несколько отличается от обычной или легкой по всем показателям.
Тяжелая вода и ее свойства характеризуются несколькими пунктами.
- Кристаллизуется при температуре 3,82 0С.
- Кипение наблюдается при 101,42 0С.
- Плотность составляет 1,1059 г/см3.
- Как растворитель в несколько раз хуже легкой воды.
- Имеет химическую формулу D2O.
При проведении опытов, показывающих влияние подобной воды на живые системы, было установлено, что жить в ней способны лишь некоторые виды бактерий. Для приспособления и акклиматизации колониям потребовалось время. Но, приспособившись, они полностью восстановили все жизненно важные функции (размножение, питание). Кроме того, стали очень устойчивы к воздействию радиоактивного излучения. Опыты на лягушках и рыбах положительного результата не дали.
Современные области применения дейтерия и образованной им тяжелой воды — атомная и ядерная энергетика. Получить в лабораторных условиях такую воду можно при помощи электролиза обычной — она образуется как побочный продукт. Сам дейтерий формируется при многократных перегонках водорода в специальных устройствах. Применение его основано на способности замедлять нейтронные синтезы и протонные реакции. Именно тяжелая вода и изотопы водорода — основа для создания ядерной и водородной бомбы.
Опыты на применении дейтериевой воды людьми в небольших количествах показали, что задерживается она недолго — полный вывод наблюдается через две недели. Употреблять ее в качестве источника влаги для жизни нельзя, однако техническое значение просто огромно.
Талая вода и ее применение
Свойства такой воды издревле были определены людьми как целебные. Давно было замечено, что при таянии снега животные стараются напиться водой из образовавшихся лужиц. Позже были тщательно исследованы ее структура и биологическое воздействие на организм человека.

Талая вода, ее признаки и свойства находятся посередине между обычной легкой и льдом. Изнутри она образована не просто молекулами, а набором кластеров, сформированных кристаллами и газом. То есть внутри пустот между структурными частями кристалла находятся водород и кислород. По общему виду строение талой воды сходно со строением льда — сохраняется структурность. Физические свойства такого оксида водорода незначительно меняются в сравнении с обычным. Однако биологическое воздействие на организм отличное.
При замораживании воды первой фракцией превращается в лед более тяжелая часть — это дейтериевые изотопы, соли и примеси. Поэтому эту сердцевину следует удалять. А вот остальная часть — чистая, структурированная и полезная вода. Каково воздействие на организм? Учеными Донецкого НИИ были названы следующие виды улучшений:
- Ускорение восстановительных процессов.
- Укрепление иммунитета.
- У детей после ингаляций такой водой происходит восстановление и излечение простудных заболеваний, проходит кашель, насморк и прочее.
- Улучшается дыхание, состояние гортани и слизистых оболочек.
- Общее самочувствие человека, активность повышаются.
Сегодня существует ряд сторонников лечения именно талой водой, которые пишут свои положительные отзывы. Однако есть ученые, в том числе медики, которые эти взгляды не поддерживают. Они считают, что вреда от такой воды не будет, но и пользы мало.
Энергетика
Почему свойства воды могут изменяться и восстанавливаться при переходе в разные агрегатные состояния? Ответ на этот вопрос следующий: у данного соединения существует своя информационная память, которая записывает все изменения и приводит к восстановлению структуры и свойств в нужное время. Биоэнергетическое поле, через которое проходит часть воды (та, что поступает из космоса), несет в себе мощный заряд энергии. Эту закономерность часто используют при лечении. Однако с медицинской точки зрения не каждая вода способна оказать благоприятный эффект, в том числе и информационный.
Структурированная вода — что это?
Это такая вода, которая имеет несколько иное строение молекул, расположение кристаллических решеток (такое, которое наблюдается у льда), но это все же жидкость (талая также относится к этому типу). В этом случае состав воды и ее свойства с научной точки зрения не отличаются от тех, что характерны для обычного оксида водорода. Поэтому структурированная вода не может иметь такого широкого лечебного эффекта, который ей приписывают эзотерики и сторонники нетрадиционной медицины.
Вода в жизни природы и человека
Вода, у тебя нет цвета, нет вкуса, нет запаха,
тебя невозможно описать, люди тобою наслаждаются,
при этом не ведая, что ты есть такое..
Нельзя сказать, что ты необходима для жизни —
ты есть сама жизнь.
(Антуан де Сент-Экзюпери)
Все ли мы знаем о таком привычном для нас веществе, которое всегда и в природе, и в быту сопровождает нас?
Вода — самое распространенное на Земле вещество, она занимает более 70% площади поверхности земли, и только около 30% приходится на долю суши. Вода придает Земле тот неповторимый вид, который отличает ее от других планет Солнечной системы.

С древности люди поклонялись воде и обожествляли, об этом можно посмотреть в фильме «Великая тайна воды». Видео 22.
В философии древних греков отражалось глубокое понимание значения воды во всех явлениях природы и в жизни человека. Так, Фалес Милетский, великий древнегреческий философ и математик, живший в 6-7 в.в. до н.э., высказал гениальную догадку, что вода — первооснова всего на Земле. Современная наука, в том числе экология, полностью подтвердила это. Вода — непременная составная часть всего живого, она играет первостепенную роль в жизни всех живых существ, в том числе человека.Как утверждают ученые, жизнь на Земле впервые появилась в воде, а лишь потом распространилась на сушу/ Свою зависимость от воды наземные организмы сохранили в ходе эволюции в течение многих миллионов лет.
Как Вы думаете, сколько времени может прожить человек без пищи, а сколько — без воды?
Вода обеспечивает доставку питательных веществ и кислорода ко всем клеткам тела, защиту и буферизацию жизненно важных органов, регуляцию температуры тела, помогает в преобразовании пищи в энергию, усвоении питательных веществ органами, вывод шлаков и отходов в процессе жизнедеятельности и выполнение целого ряда других функций. Видео 23.
Попробуйте подышать на холодное стекло. Что Вы увидите? Пары воды, которую Вы выдохнули, сконденсировались на холодном стекле, превратились в жидкую воду. Откуда эта вода взялась в нашем организме?
Не будем забывать, что вода — среда обитания огромного числа живых организмов, отличающихся друг от друга и определяющих различные свойства вод океанов, морей, озер, рек и болот.

Благодаря воде в природе происходитперенос веществ из почвы в растения, с суши в реки, озера и океаны, из атмосферы на сушу, питание живых организмов этих систем и вынос отходов их жизнедеятельности. Значение воды в природе иногда сравнивают с той ролью, какую выполняет кровь в живом организме.
Почему воду справедливо называют чудом природы?
Что знает о воде современная наука?
Несмотря на широкую распространенность и доступность вода все еще остается непознанным до конца веществом. Ежегодно публикуются новые работы по исследованию свойств воды, и она не перестает удивлять ученых. Без преувеличения можно сказать, что среди необозримого множества природных веществ вода является одним из самых необыкновенных. Она обладает целым рядом физических и химических свойств, которые называют уникальными или аномальными. Эти свойства воды обеспечивают протекание многих природных процессов и существование жизни на Земле в целом. Видео 24.
Необычными свойства воды кажутся по сравнению с жидкостями. Но ученые установили, что жидкая вода имеет структуру, так как ее молекулы способны сцепляться, образовывая межмолекулярные связи, которые очень легко разрываются. То есть можно сказать, что жидкая вода является полимером! Связями между молекулами воды объясняются многие ее необычные свойства. Например, для кипячения воды необходимо затратить много энергии, которая тратится на разрыв этих связей.«Аномальные» температуры кипения, а также замерзания воды обусловливают способность воды находиться в природе в трех агрегатных состояниях (жидком, твердом и газообразном). На планете нет другого вещества, которое находились бы в трех агрегатных состояниях.
Приходилось ли Вам видеть воду в природе одновременно в двух или даже в трех агрегатных состояниях? Где?
Это приводит к тому, что водная оболочка Земли (гидросфера) и, соответственно, жизнь на планете практически не прерывается на поверхности планеты, все ее компоненты объединяются в единое целое благодаря воде. Если представить, что вода обладала бы «нормальной» температурой кипения, то она бы закипала при температуре минут 70 градусов.
В каком состоянии она находилась бы в условиях существующего на Земле температурного режима? И где бы в таком фантастическом мире могли бы возникать водоемы?
Для жизни на Земле также чрезвычайно важным является такое свойство воды, как ее высокая теплоемкость, Теплоемкость - количество теплоты, поглощаемой телом при нагревании на 1 градус. она определяет стабильность температурного режима на планете. Для того чтобы нагреть какую-то массу воды на 1 градус, требуется гораздо больше тепла, чем для того, чтобы произвести нагревание на 1 градус такой же массы любого другого вещества. Благодаря исключительно высокой термической инертности воды Мировой океан, а также многочисленные водоемы суши как нельзя лучше выполняют роль гигантского планетарного терморегулятора, сглаживающего суточные и сезонные перепады температуры. В дневное время, а также летом, водные массы медленно нагреваются, поглощая при этом много тепла, что не позволяет воздуху разогреваться очень сильно. По ночам и в зимние периоды, наоборот, водные массы медленно остывают, выделяя накопленное ранее тепло, что не позволяет воздуху чрезмерно остывать.
Как Вы думаете, какой был бы климат на Земле, если бы вода не обладала такой высокой теплоемкостью?
Еще одним замечательным свойством воды является ее исключительно высокая растворяющая способность, она — универсальный растворитель огромного количества химических веществ, среда, в которой протекают все процессы жизнедеятельности.
Существуют и другие важные для природы «аномальные» свойства воды, такие какочень большая способность к капиллярному движению, Под капиллярным движением воды в грунтах понимается их способность поднимать воду по капиллярным порам снизу вверх или в стороны вследствие воздействия капиллярных сил, которые возникают на границах раздела различных компонент грунта. В их основе лежат силы взаимодействия воды и воздуха с твердыми частицами грунта, проявляющиеся в смачивании последних и в других явлениях. высокое поверхностное натяжение См.: http://theoryandpractice.ru/posts/1012-chto-takoe-poverkhnostnoe-natyazhenie-i-pochemu-vodomerki-ne-tonut .

Поверхностная пленка воды является для многих водных организмов опорой для движения
А какое колоссальное значение имеет«необычное» увеличение плотности воды при нагревании в диапазоне температур от 0 до 4 градусов! Плотность практически всех веществ уменьшается при нагревании во всем диапазоне температур. Однако плотность воды при нагревании от 0 градусов до 4 градусов возрастает. Это связано с тем, что, как мы уж говорили, вода является структурированной жидкостью, и в этом интервале имеющиеся в структуре льда полости заполняются молекулами воды. Далее от 4 градусов до 100 градусов вода ведет себя «нормально» — т.е. ее плотность при нагревании уменьшается. Видео 25.
Как Вы думаете, как это свойство воды сказывается на жизни водоемов в холодное время года? Почему в них возможна жизнь зимой?
Если бы любое из названных свойств воды каким-то невероятным способом стало «нормальным», то это имело бы самые серьезные последствия для всего происходящего на поверхности планеты. О жизни капли воды со времени ее образования на Земле и до наших дней можно написать самую удивительную и увлекательную повесть. Вместе с миллионами других капель эта капля точила и растворяла горы, в виде кристаллов льда она тысячи лет хранилась в высокогорных ледниках, совершила не одно кругосветное путешествие вместе с морскими течениями, затопляла села и города во время наводнений, плавала в облаках над океанами и морями, разбивала корабли о прибрежные скалы, насыщала влагой травы, кусты и деревья; каплей росы она сверкала в душистых лепестках розы, взращивала посевы, излечивала больного человека и несла жизнь в пустыне утомленному путнику. Посмотрите фильм «Приключения капельки воды», из него Вы узнаете много увлекательных фактов про воду. Какими путями движется вода на Земле? Как осуществляется ее круговорот?
Земля представляет собой шар, окутанный водяными парами и хотя неравномерно, но щедро смоченный и пропитанный водой. Энергия Солнца поднимает воду в виде водяных паров вверх, охлаждается, конденсируется, затем сила тяжести увлекает ее вниз. Благодаря этим двум силам вода на Земле находится в непрерывном движении. Остановить движение воды — это значит превратить Землю в безжизненное космическое тело. Видео 26.
Полная смена воды в атмосфере происходит очень быстро, приблизительно через каждые 9 дней, речная вода меняется в среднем 20 раз в году, а для полной смены подземных вод требуется по меньшей мере 8 тыс. лет.

За последнее время в естественный круговорот воды на Земле вторгся человек. Использование человеком воды достигло таких размеров, что стало оказывать заметное влияние на скорость круговорота и количество воды в его отдельных звеньях. То есть безответственная деятельность человека на планете оказывает влияние даже на такой глобальный природный процесс, как круговорот воды на планете.
Сделаем вывод. Вода благодаря своим поистине уникальным свойствам является одним из важнейших факторов жизнеобеспечения на Планете. Наша жизнь полностью зависит от воды.
Сколько нужно воды человеку и насколько важна ее экономия? Об этом мы поговорим в следующей теме.
Введение
Организм человека почти на 70% состоит из воды. Вода — прежде всего растворитель, в среде которого протекают все элементарные акты жизнедеятельности. К тому же вода — продукт и субстрат энергетического метаболизма в живой клетке. Образно говоря, вода — это арена, на которой разыгрывается действие жизни и участник основных биохимических превращений.
Известно что вода присутствует во всех частях нашего организма, хотя например в коре мозга её 85%, в коже 72%, в зубной эмали всего лишь3%. Это свидетельствует о том, что в наиболее интенсивно работающих органах содержится большее число воды.
Некоторая часть воды в организме может более или менее прочно связываться с растворёнными в ней веществами и с поверхностью биополимерных макромолекул с помощью как водородных связей, так и сил ион-дипольного взаимодействия. Это может приводить к заметному изменению конфигурации, эффективных размеров и весов тех или иных частиц, участвующих в реакции, и в некоторых случаях к существенной модификации их свойств. Например, оказывается, что натриевые каналы нервных клеток, имеющие диаметр около 0,5 нм, практически недоступны для прохождения по ним ионов калия, хотя диаметр самого иона K+ равен 0,26 нм. В действительности ион K+ гидратирован и, следовательно, для расчёта его эффективных размеров к диаметру K+ следует прибавить диаметр молекулы воды 0,28 нм. В итоге комплексный ион [K· h3O]+ диаметром почти 0,6 нм сквозь натриевый канал пройти не может, тогда как гидратированный ион [Na· h3O]+ диаметром около 0,47 нм свободно диффундирует через этот канал.
Другим примером изменения размеров биологического субстрата может быть молекула ДНК. В частности известно, что на каждый нуклеотид макромолекулы приходится около 50 молекул воды, связанных с ДНК. В общей сложности водная плёнка ДНК увеличивает эффективный диаметр цилиндрической макромолекулы ДНК с 2 нм в безводном состоянии до 2,9 нм в водном растворе, что чрезвычайно важно, например, при считывании с неё информации.
Строение воды
Вода — уникальное вещество и все её аномальные свойства: высокая температура кипения, значительная растворяющая и диссоциирующая способность, малая теплопроводность, высокая теплота испарения и другие обусловлены строением её молекулы и пространственной структурой.
У отдельно взятой молекулы воды есть качество, которое проявляется только в присутствии других молекул: способность образовывать водородные мостики между атомами кислорода двух оказавшихся рядом молекул, так, что атом водорода располагается на отрезке, соединяющем атомы кислорода. Свойство образовывать такие мостики обусловлено наличием особого межмолекулярного взаимодействия, в котором существенную роль играет атом водорода. Это взаимодействие называется водородной связью.
Каждая из присоединённых к данной молекул воды сама способна к присоединению дальнейших молекул. Этот процесс можно называть «полимеризацией». Если только одна из двух возможных связей участвует в присоединении следующей молекулы, а другая остаётся вакантной, то «полимеризация» приведёт к образованию либо зигзагообразной цепи, либо замкнутого кольца. Наименьшее кольцо, по-видимому, может состоять из четырёх молекул, но величина угла 90° делает водородные связи крайне напряжёнными. Практически ненапряжёнными должны быть пятизвенные кольца (угол 108° ), а шестизвенные (угол 120° ), также как и семизвенные — напряжённые.
Рассмотрение реальных структур гидратов показывает, что, действительно, наиболее устойчиво шестизвенное кольцо, находимое в структурах льдов. Плоские кольца являются привилегией клатратных гидратов, причём во всех известных структурах чаще всего встречаются плоские пятизвенные кольца из молекул воды. Они, как правило, чередуются во всех структурах клатратных гидратов с шестизвенными кольцами, очень редко с четырёхзвенными, а в одном случае — с плоским семизвенным.
В целом структура воды представляется как смесь всевозможных гидратных структур, которые могут в ней образоваться.
В прикладном аспекте это, например, имеет важное значение для понимания действия лекарственных веществ. Как было показано Л. Полингом структурированная клатратная форма воды в межсинаптических образованиях мозга обеспечивает, с одной стороны, передачу импульсов с нейрона на нейрон, а, с другой стороны при попадании в эти участки наркозного вещества такая передача нарушается, то есть наблюдается явление наркоза. Гидратация некоторых структур мозга является одной из основ реализации действия наркотических анальгетиков (морфина).
Биологическое значение воды
Вода как растворитель. Вода — превосходный растворитель для полярных веществ. К ним относятся ионные соединения, такие как соли, у которых заряженные частицы (ионы) диссоцииируют в воде, когда вещество растворяется, а также некоторые неионные соединения, например сахара и простые спирты, в молекуле которых присутствуют заряженные (полярные) группы (-OH).
Результаты многочисленных исследований строения растворов электролитов свидетельствуют, что при гидратации ионов в водных растворах основную роль играет ближняя гидратация — взаимодействие ионов с ближайшими к ним молекулами воды. Большой интерес представляет выяснение индивидуальных характеристик ближней гидратации различных ионов, как степени связывания молекул воды в гидратных оболочках, так и степени искажения в этих оболочках тетраэдрической льдоподобной структуры чистой воды — связи в молекуле изменяются на неполный угол. Величина угла зависит от иона.
Когда вещество растворяется, его молекулы или ионы получают возможность двигаться более свободно и, соответственно, его реакционная способность возрастает. По этой причине в клетке большая часть химических реакций протекает в водных растворах. Неполярные вещества, например липиды, не смешиваются с водой и потому могут разделять водные растворы на отдельные компартаменты, подобно тому, как их разделяют мембраны. Неполярные части молекул отталкиваются водой и в её присутствии притягиваются друг к другу, как это бывает, например, когда капельки масла сливаются в более крупные капли; иначе говоря, неполярные молекулы гидрофобны. Подобные гидрофобные взаимодействия играют важную роль в обеспечении стабильности мембран, а также многих белковых молекул, нуклеиновых кислот и других субклеточных структур.
Присущие воде свойства растворителя означают также, что вода служит средой для транспорта различных веществ. Эту роль она выполняет в крови, в лимфатической и экскреторных системах, в пищеварительном тракте и во флоэме и ксилеме растений.
Большая теплоёмкость. Удельной теплоёмкостью воды называют количество теплоты в джоулях, которое необходимо, чтобы поднять температуру 1 кг воды на 1° C. Вода обладает большой теплоёмкостью (4,184 Дж/г). Это значит, что существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение её температуры. Объясняется такое явление тем, что значительная часть этой энергии расходуется на разрыв водородных связей, ограничивающих подвижность молекул воды.
Большая теплоёмкость воды сводит к минимуму происходящие в ней температурные изменения. Благодаря этому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью и опасность нарушения этих процессов от резких отклонений температуры грозит им не столь сильно. Вода служит для многих клеток и организмов средой обитания, для которой характерно довольно значительное постоянство условий.
Большая теплота испарения. Скрытая теплота испарения есть мера количества тепловой энергии, которую необходимо сообщить жидкости для её перехода в пар, то есть для преодоления сил молекулярного сцепления в жидкости. Испарение воды требует довольно значительных количеств энергии (2494 Дж/г). Это объясняется существованием водородных связей между молекулами воды. Именно в силу этого температура кипения воды — вещества со столь малыми молекулами — необычно высока.
Энергия, необходимая молекулам воды для испарения, черпается из их окружения. Таким образом, испарение сопровождается охлаждением. Это явление используется у животных при потоотделении, при тепловой одышке у млекопитающих или у некоторых рептилий (например, у крокодилов), которые на солнцепёке сидят с открытым ртом; возможно, оно играет заметную роль и в охлаждении транспирирующих листьев.
Большая теплота плавления. Скрытая теплота плавления есть мера тепловой энергии, необходимой для расплавления твёрдого вещества (льда). Воде для плавления (таяния) необходимо сравнительно большое количество энергии. Справедливо и обратное: при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания содержимого клеток и окружающей их жидкости. Кристаллы льда особенно губительны для живого, когда они образуются внутри клеток.
Плотность и поведение воды вблизи точки замерзания. Плотность воды (максимальна при +4° С) от +4 до 0° С понижается, поэтому лёд легче воды и в воде не тонет. Вода — единственное вещество, обладающее в жидком состоянии большей плотностью, чем в твёрдом, так как структура льда более рыхлая, чем структура жидкой воды.
Поскольку лёд плавает в воде, он образуется при замерзании сначала на её поверхности и лишь под конец в придонных слоях. Если бы замерзание прудов шло в обратном порядке, снизу вверх, то в областях с умеренным или холодным климатом жизнь в пресноводных водоёмах вообще не могла бы существовать. То обстоятельство, что слои воды, температура которых упала ниже 4° С, поднимаются вверх, обусловливает перемешивание воды в больших водоёмах. Вместе с водой циркулируют и находящиеся в ней питательные вещества, благодаря чему водоёмы заселяются живыми организмами на большую глубину.
После проведения ряда экспериментов было установлено, что связанная вода при температуре ниже точки замерзания не переходит в кристаллическую решётку льда. Это энергетически невыгодно, так как вода достаточно прочно связана с гидрофильными участками растворённых молекул. Это находит применение в криомедицине.
Большое поверхностное натяжение и когезия. Когезия — это сцепление молекул физического тела друг с другом под действием сил притяжения. На поверхности жидкости существует поверхностное натяжение — результат действующих между молекулами сил когезии, направленных внутрь. Благодаря поверхностному натяжению жидкость стремится принять такую форму, чтобы площадь её поверхности была минимальной (в идеале — форму шара). Из всех жидкостей самое большое поверхностное натяжение у воды (7,6 · 10-4 Н/м). Значительная когезия, характерная для молекул воды, играет важную роль в живых клетках, а также при движении воды по сосудам ксилемы в растениях. Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения: оно позволяет им удерживаться на воде или скользить по её поверхности.
Вода как реагент. Биологическое значение воды определяется и тем, что она представляет собой один из необходимых метаболитов, то есть участвует в метаболических реакциях. Вода используется, например, в качестве источника водорода в процессе фотосинтеза, а также участвует в реакциях гидролиза.
Особенности талой воды
Уже небольшое нагревание (до 50-60° С) приводит к денатурации белков и прекращает функционирование живых систем. Между тем охлаждение до полного замерзания и даже до абсолютного нуля не приводит к денатурации и не нарушает конфигурацию системы биомолекул, так что жизненная функция после оттаивания сохраняется. Это положение очень важно для консервирования органов и тканей предназначенных для пересадки. Как указывалось выше, вода в твёрдом состоянии имеет другую упорядоченность молекул, чем в жидком и после замерзания и оттаивания приобретает несколько иные биологические свойства, что послужило причиной применения талой воды с лечебной целью. После оттаивания вода имеет более упорядоченную структуру, с зародышами клатратов льда что позволяет ей взаимодействовать с биологическими компонентами и растворёнными веществами, например с другой скоростью. При употреблении талой воды в оганизм попадают мелкие центры льдоподобной структуры, которые в дальнейшем могут разрастись и перевести воду во льдоподобное состояние и тем самым произвести оздоравливающее действие.
Информационная роль воды
При взаимодействии молекул воды со структурными компонентами клетки могут образовываться не только вышеописанные пяти-, шести- и т. д. компонентные структуры, но и трёхмерные образования могут образовываться додекаэдральные формы, которые могут обладать способностью к образованию цепочечных структур, связанных общими пятиугольными сторонами. Подобные цепочки могут существовать и в виде спиралей, что делает возможным реализацию механизма протонной проводимости по этому универсальному токопроводу. Следует также учесть данные С. В. Зенина (1997 г.), что молекулы воды в таких образованиях могут взаимодействовать между собой по принципу зарядовой комплементарности, то есть посредством дальнего кулоновского взаимодействия без образования водородных связей между гранями элементов, что позволяет рассматривать структурированное состояние воды в виде исходной информационной матрицы. Такая объёмная структура имеет возможность переориентироваться, в результате чего происходит явление «памяти воды», так как в новом состоянии отражено кодирующее действие введённых веществ или других возмущающих факторов. Известно, что такие структуры существуют непродолжительное время, но в случае нахождения внутри додекаэдра кислорода или радикалов происходит стабилизация таких структур.
В прикладном аспекте возможности «памяти воды» и передачи информации посредством структурированной воды объясняют действие гомеопатических средств и акупунктурных воздействий.
Как уже говорилось, все вещества при растворении в воде образуют гидратные оболочки и поэтому каждой частице растворённого вещества соответствует конкретная структура гидратной оболочки. Встряхивание такого раствора приводит к схлопыванию микропузырьков с диссоциацией молекул воды и образованию протонов, стабилизирующих такую воду, которая приобретает излучательные свойства и свойства памяти, присущие растворённому веществу. При дальнейшем разведении этого раствора и встряхивании образуются всё более длинные цепи — спирали и в 12-сотенном разведении уже нет самого вещества, но сохраняется память о нём. Введение этой воды в организм передаёт эту информацию в структурированные компоненты воды биологических жидкостей, которая передаётся структурным компонентам клеток. Таким образом, гомеопатический препарат действует прежде всего информационно. Добавление спирта в процессе приготовления гомеопатического средства удлиняет устойчивость во времени структурированной воды.
Не исключено, что спиралеобразные цепи структурированной воды являются возможными компонентами переноса информации из биологически активных точек (точек акупунктуры) на структурные компоненты клеток определённых органов.
Список литературы
- Садовничая Л. П. с соавт. Биофизическая химия, К.: Вища школа, 1986. — 271 с.
- Габуда С. П. Связанная вода. Факты и гипотезы, Новосибирск: Наука, 1982. — 159 с.
- Сб. Структура и роль воды в живом организме, Л.: Изд. ЛГУ, 1966. — 208 с.
- Бышевский А. Ш., Терсенов О. А. Биохимия для врача, Екатеринбург: изд. «Уральский рабочий», 1994. — 378 с.
- Грин Н., Стаут У., Тейлор Д. Биология, т. 1.: Пер. с англ. — М.: Мир, 1993. — 368 с.
- Чанг Р. Физическая химия с приложениями к биологическим системам М.: Мир, 1980. — 662 с.
- Зенин С. В. Водная среда как информационная матрица биологических процессов. В кн. Тезисы докладов 1 Международного симпозиума, Пущино, 1997, с. 12-13.
- Смит С. Электромагнитная биоинформация и вода. Вестник биофизической медицины, 1994 №1, с. 3-13.
- Антонченко В. Я., Ильин В. В. Проблемные вопросы физики воды и гомеопатии. Вестник биофизической медицины, 1992 №1, с.11-13.
При обычных условиях вода — прозрачная жидкость без вкуса и запаха. В тонком слое она бесцветна, а при толщине более \(2\) м имеет голубой оттенок.
Плотность жидкой воды максимальна при \(4\) °С и равна \(1\) г/см³ (\(1000\) г/дм³). В отличие от других веществ твёрдая вода (лёд) легче жидкой. Плотность льда при \(0\) °С составляет \(0,92\) г/см³. Поэтому айсберги плавают по поверхности океанов, а пресноводные водоёмы зимой не промерзают до дна, и обитающие в них организмы выживают во время сильных морозов.

Температура плавления воды равна \(0\) °С, а температура кипения — \(100\) °С. Это аномально высокие значения для вещества с такой низкой молекулярной массой.
Эта и другие особенности свойств воды обусловлены образованием агрегатов из полярных молекул воды за счёт межмолекулярных водородных связей.
Водородная связь — это взаимодействие между положительно заряженными атомами водорода одной молекулы и отрицательно заряженными атомами кислорода, фтора или азота другой молекулы.
Эта связь слабее ковалентной. Но благодаря ей значительно повышаются температуры плавления и кипения веществ.
Водородными связями объясняется также способность воды образовывать при замерзании снежинки разной формы.

Из всех жидких и твёрдых веществ у воды самая высокая теплоёмкость. Она медленно нагревается и так же медленно остывает. Благодаря такому свойству вода влияет на климат Земли, сглаживая колебания температуры. Моря и океаны накапливают тепло в тёплое время, а в холодное — его освобождают.
У воды высокие значения теплоты плавления и теплоты парообразования. Поэтому процессы таяния льда и снега, испарения воды происходят постепенно и приводят к медленной смене сезонов года: зима — весна — лето — осень.
Ещё одна особенность воды — высокое поверхностное натяжение. Поверхностное натяжение обуславливает капиллярные явления, собирает воду в капли, создаёт поверхностную плёнку и позволяет некоторым насекомым перемещаться по ней.
Высокая полярность молекул обуславливает способность воды растворять вещества с ионной или ковалентной полярной связью. Такие вещества часто называют гидрофильными. К ним относятся соли, щёлочи, некоторые кислоты и другие. Неполярные вещества в воде не растворяются. Их называют гидрофобными.
5 свойств воды | Owlcation
Каковы основные свойства воды?
В этой статье будут обсуждаться пять основных свойств воды:
- Его притяжение к полярным молекулам
- Высокая удельная теплоемкость
- Высокая теплота испарения
- Нижняя плотность льда
- Высокая полярность
1. Влечение воды к другим полярным молекулам
Сплоченность
Сплоченность, также известная как притяжение воды к другим молекулам воды, является одним из основных свойств воды.Полярность воды делает ее привлекательной для других молекул воды. Водородные связи в воде удерживают вместе другие молекулы воды. Из-за связности воды:
- Жидкая вода имеет поверхностное натяжение. Это позволяет насекомым, таким как Water Striders, ходить по воде.
- Вода — это жидкость при умеренных температурах, а не газ.
Адгезия
Притяжение воды между молекулами другого вещества называется адгезией. Вода является адгезивом к любой молекуле, с которой она может образовывать водородные связи.Из-за адгезии воды:
- Происходит капиллярное действие. Например, когда у вас есть узкая трубка в воде, вода поднимется вверх по трубке из-за адгезии воды к стеклу, «поднимаясь» вверх по трубке.
2. Высокая удельная теплоемкость воды
Вода может смягчать температуру благодаря двум свойствам: высокая удельная теплоемкость и высокая теплота испарения.
Высокая удельная теплоемкость — это количество энергии, которое поглощается или теряется одним граммом вещества, чтобы изменить температуру на 1 градус Цельсия.Молекулы воды образуют множество водородных связей между собой. В свою очередь, для разрушения этих связей требуется много энергии. Разрыв связей позволяет отдельным молекулам воды свободно перемещаться и иметь более высокую температуру. Другими словами: если вокруг движется много отдельных молекул воды, они создают больше трения и больше тепла, что означает более высокую температуру.
Водородные связи между молекулами воды поглощают тепло, когда они разрушаются, и выделяют тепло, когда они образуются, что сводит к минимуму изменения температуры.Вода помогает поддерживать умеренную температуру организмов и окружающей среды.
Нагрев воды занимает много времени, и она дольше удерживает свою температуру, когда тепло не подается.
3. Высокая температура испарения воды
Высокая теплота испарения воды является другим свойством, способствующим ее способности к умеренной температуре.
Высокая теплота испарения воды — это в основном количество тепловой энергии, необходимое для превращения грамма жидкости в газ. Вода также нуждается в большом количестве энергии, чтобы разрушить водородные связи.Испарение воды с поверхности вызывает охлаждающий эффект. Как и у людей — когда нам становится жарко, или энергия внутри нашего тела разрушает химические связи, мы потеем как охлаждающий эффект. В этом случае происходит тот же процесс: когда вода испаряется с поверхности кожи, она охлаждается на поверхности.
4. Нижняя плотность льда
При более низких температурах водородные связи молекул воды образуют кристаллы льда. Водородные связи более стабильны и сохранят свою кристаллическую форму.Лед — твердая форма воды — менее плотен, чем вода, потому что водородные связи разнесены и находятся относительно друг от друга. Низкая плотность позволяет плавать айсбергу и является причиной того, что только верхняя часть озер замерзла.
5. Высокая полярность воды
Вода — это полярная молекула, которая имеет высокий уровень полярности и притяжения к ионам и другим полярным молекулам.
Вода может образовывать водородные связи, что делает ее мощным растворителем. Молекулы воды притягиваются к другим молекулам, которые содержат полный заряд, например ион, частичный заряд или полярный.Соль (NA + CL-) растворяется в воде. Молекулы воды окружают молекулы соли и отделяют NA + от CL-, образуя гидратирующие оболочки вокруг этих двух отдельных ионов.
,свойств воды | Wyzant Resources
Вода встречается по всей природе и является необходимым компонентом почти во всех органических реакции. Это самое распространенное соединение на поверхности планеты. Большинство воды на Земля — это морская вода, и вода также присутствует в виде твердого льда и невидимых газообразных облаков. Вся жизнь на Земле требуется вода, чтобы выжить, и предполагается, что внеземная вода может быть признаком жизни (или, по крайней мере, предшественник жизни) в других местах вселенной.Наряду с обеспечением жизни вода оказывает влияние на неживые объекты, такие как выветривание и эрозия камней и почвы. Вода также действует как теплоотвод, поглощая избыточное тепло и предохраняя температуру Земли от экстремальных изменений. Вода является жизненно важной частью любой живой системы, от целых сред обитания до отдельных клеток. Так что же такое вода?
Химические свойства воды
Вода (также известная как H 2 O) — это полярное химическое соединение, содержащее один атом кислорода (O) и два атома водорода (H) (как видно на первом рисунке).) Эти три атома связаны вместе ковалентными связями, что означает, что они совместно используют свои пары валентных или внешних электронов. Каждый атом водорода по отдельности связан с центральным атомом кислорода, и у кислорода также есть две пары неразделенных электронов, что дает одну молекулу воды в общей сложности четырем общим и четырем неразделенным валентным электронам. Молекулы воды имеют изогнутую форму с углом 104,45 ° между двумя атомами водорода.
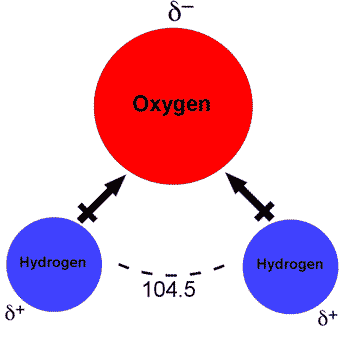
Несмотря на то, что они разделяют свои электроны, молекулы воды полярны, потому что валентные электроны распределяется неравномерно между атомами кислорода и водорода.Кислород обладает большей электроотрицательностью чем водород, это означает, что он сильно притягивается к электронам, поэтому он сильнее тянет на общий электроны и держит их ближе к себе. Это создает дипольный момент, то есть два электрических полюса. это неравное распределение электронов означает, что отрицательные заряды электронов кластеризуются на кислородном конце молекула, оставляя водородный конец молекулы, чтобы быть частично положительным, в то время как кислородный конец частично отрицательный Полярность воды приводит к ее адгезии ко многим другим веществам и помогает это отличный растворитель.
Полярные вещества хорошо растворяются в воде как «растворяется как», а неполярные вещества не растворяется так же легко (или вообще). Типичным примером этой растворимости является растворение поваренной соли (NaCl) в воде с образованием ионов Na + и Cl — , окруженных молекулами воды, положительные и отрицательные полюсы которых ориентированы в направлении или от ионов в зависимости от заряда иона. Когда полярный раствор, такой как соль, растворяется в положительных и отрицательных ионах, молекулы воды ориентируются, чтобы окружать отдельные ионы, и направляют свои соответствующие полюса на ион на основе его заряда; отрицательные полюсы воды указывают на положительные ионы и наоборот.
Когда неполярное вещество смешивается с водой, оно не растворяется, а остается комкованным вместе и как можно дальше от молекул воды. Вот почему вода и масло остаются разделить, когда смешаны вместе. Вода является хорошим растворителем гидрофильных веществ, таких как соли, в то время как плохо растворяющиеся гидрофобные вещества, такие как жиры и масла. Вещество не может раствориться в вода, когда ее притяжение к молекулам воды не перевешивает их притяжение друг к другу; Это разрушает межмолекулярные связи воды, не заменяя их, и поэтому энергетически неблагоприятны.Гидрофильный раствор, напротив, быстро окружается молекулами воды и образует новые слабые связи с ними.
Вода является амфотерным соединением, что означает, что она может выступать в качестве основания или кислоты в химическом веществе. реакция. Это позволяет ему участвовать в большом количестве реакций, как в лаборатории, так и в природа. Вода также не легко сжимается, что означает, что ее нельзя (как жидкость) легко сжать в меньший объем. Эти различные свойства воды очень важны в жизни Земли и в жизнь отдельных организмов.
Физические свойства воды
Вода является жидкостью при стандартных температуре и давлении, но также встречается в природе в ее твердом теле (замороженные) и газообразные фазы. Точка кипения воды (точка, в которой она переходит от жидкости к газу, или наоборот) находится при 100 ° С, а его точка замерзания (при которой он переходит из жидкого состояния в твердое или наоборот) находится при 0 ° С. Вода обладает высокой теплоемкостью, что означает, что она может поглощать много энергии без значительного повышения температуры.Вода также имеет относительно высокую температуру кипения по сравнению с температурами кипения аналогичных соединений, а это означает, что в воду нужно вкладывать больше энергии, чтобы отделить молекулы и превратить ее из жидкости в газ. Эти два свойства обусловлены его многочисленными межмолекулярными водородными связями (обсуждается ниже в разделе «Специальные свойства»).
В чистом виде вода не имеет вкуса и запаха, однако вода является универсальным растворителем и поэтому часто встречается с веществами, растворенными в нем, изменяя его физические характеристики.полезные ископаемые и другие примеси придают бутилированной воде ее вкус, а присутствие растворенных веществ придает воде ее умение хорошо проводить электричество. Если бы в воде не было растворенных ионов, она была бы плохим проводником электричество. Тем не менее, ни одна вода не является полностью свободной от ионов, и даже в отсутствие растворенного вещества она может автоматически ионизируется с образованием отрицательных гидроксид-анионов (OH — ) и положительных катионов гидрония (H 3 O + ). Эти ионы позволяют воде проводить некоторое электричество, даже когда она чистая или «деионизированная».«Электрическая проводимость воды, а также склонность воды к растворению гидрофильных веществ имеют большое значение в химии и биологических науках.
Особые свойства воды

Многие из особых свойств воды связаны с водородными связями. Благодаря их атомному состав и молекулярная форма, молекулы воды могут быть привлечены друг к другу через водород склеивание. Эта слабая связь возникает, когда атом водорода ковалентно связан с более электроотрицательным атом затем кратковременно электрически притягивается ко второму сильно электроотрицательному атому другого отдельного молекулы.Водород действует как липкое, привлекательное арахисовое масло между двумя кусочками электроотрицательный хлеб. Это объединяет две молекулы через двойное притяжение водорода. Таким образом, молекулы воды работают как крошечные магниты, их частично положительные и отрицательные полюса взаимодействуя вместе через водородные связи. Молекулы воды могут образовывать до четырех водородных связей каждая, создание локальной тетраэдрической структуры из пяти молекул воды, связанных водородом (как видно на втором фигура.Водородная связь дает воде ее сцепление и поверхностное натяжение, позволяя ей цепляться за себя. Это также сильно влияет на замерзание и плотность воды.
Плотность жидкой воды составляет приблизительно 1 грамм на кубический сантиметр (1 г / см 3 ). В отличие от большинства веществ, вода в жидкой фазе плотнее, чем в твердой фазе; это происходит из-за того, что молекулы воды образуют рыхлую гексагональную кристаллическую структуру, когда они охлаждаются и замерзают вместе, фиксируя их в расширенной и менее плотной форме, чем их свободно движущаяся жидкая форма.При замерзании временным водородным связям между молекулами дают возможность стабилизироваться, создавая решетку из молекул воды, которые находятся немного в стороне друг от друга. Из-за этой разницы в плотности твердый лед может плавать на жидкой воде. Благодаря этому свойству и высокой теплоемкости воды (хорошая теплоизоляция) озера и пруды на Земле медленно замерзают сверху вниз и редко замерзают полностью, что позволяет организмам в незамерзшей воде пережить зиму.
Биологические свойства воды
В организме все основные компоненты клеток, такие как белки, ДНК и органеллы растворяется в воде и клетка заполняется водянистой цитоплазмой.Это позволяет существенным молекулам быть плавно транспортируется по всей камере. Форма самой клетки сильно зависит от воды в и вокруг него; слишком много воды, и клетка может взорваться или «лизаться», и слишком мало воды, и клетка сморщиваются. Полярная природа воды предотвращает расслоение гидрофобных фосфолипидных молекул, упаковка их вместе в круглые клеточные мембраны, чтобы обеспечить как можно меньшую поверхность для воды. Неполярный характер клеточных мембран держит их закрытыми от протекания воды между ними.вода транспорт в клетку и из нее строго регулируется, а компоненты воды (кислород и водород) оба используются во многих клеточных процессах.
Способность воды проводить электрические импульсы, а также ее склонность к растворению полярных вещества позволяют нервным клеткам в нашем мозге общаться друг с другом с помощью электрического и химические сигналы. Высокая теплоемкость воды защищает наш организм от резких изменений температуры.Химические и физические свойства воды способствуют всей жизни на планете, организме, клеточный и молекулярный уровни.
,Особые свойства воды | Shmoop
Особые свойства воды
Особые свойства воды
Мы не будем обращать внимания на недобросовестность водородных связей в свете того факта, что они частично отвечают за уникальные свойства воды. Теперь все особенные, и мы не пытаемся умалить какие-либо другие химические соединения, выделяя воду, но вода действительно удивительна и очень важна для жизни на Земле. К настоящему времени вы, несомненно, находитесь на краю своего места и задаетесь вопросом, почему, так что вот пять лучших вещей, которые делают воду великолепной.
Вода обладает высокой когезией
И что? Мы скажем вам что. Водородные связи между молекулами воды заставляют их слипаться. Но ты уже знал это. Высокая когезия изящна, потому что это приводит к высокому поверхностному натяжению или к тенденции молекул воды слипаться, когда на границе газа и жидкости (или жидкости и твердого тела, или даже жидкости и жидкости … вы получить идею). Это делает довольно трудным разрушение поверхности воды по сравнению с другими жидкостями.Поверхностное натяжение — это то, что позволяет некоторым предметам плавать на воде, даже если они плотнее воды. Ошибки, например. Или этот парень. Посмотри на него иди!
Вода — отличный растворитель
Вода опасно хороша при растворении. Мастер диссольвер, если хотите. Поскольку вода является полярной молекулой, ее положительный конец притягивается к отрицательно заряженным ионам или отрицательным сторонам других полярных молекул, а ее отрицательная сторона притягивается к положительно заряженным ионам или положительным сторонам других полярных молекул.
Например, если вы уроните кристалл соли в воду, ион натрия (Na + ) будет быстро окружен энергичными молекулами воды, отрицательные стороны которых обращены к положительному иону натрия. Между тем, ион хлора (Cl — ) будет аналогичным образом окружен другими молекулами воды, положительные стороны которых обращены к отрицательному иону хлора. Это смутно напоминает то, как папарацци опускаются на знаменитостей, или как стервятники прячутся на мертвой туше.
За исключением метафор, дело в том, что Na + и Cl — отделяются друг от друга и растворяются в воде.Вещи, которые легко растворяются в воде, являются гидрофильными («любящими воду»), а свойство «растворимости» называется растворимостью .
Похоже на вечеринку!
Вы когда-нибудь пытались смешать масло и воду? Нет? Значит, не так уж много сторонников?
Это унизительный опыт, потому что все терпят неудачу. Нефть гидрофобна («боязлива воды») и немедленно останавливает весь этот растворяющийся бизнес. Жиры, включая масло, представляют собой неполярных молекул .Все составляющие атомы в неполярных молекулах делят электроны поровну между собой. Никаких ссор там нет. Но эти равные доли означают, что к воде нечего привлекать, потому что воде, полярному снобу, которому она нравится, нравятся ионы или другие полярные молекулы.
Главная точка отсчета такова: если вещество не является полярным или заряженным каким-либо образом, оно обычно не растворяется в воде (нерастворимо). Тебе не повезло, неполярные молекулы.
Вода действует как буфер
Что такое буфер? Давайте начнем с некоторой справочной информации в первую очередь.
Чтобы понять буферы, нам нужно знать кое-что о кислот, и оснований, . Кислоты — это вещества, которые выделяют ионы водорода (H + ) в раствор. HCl, или соляная кислота, представляет собой соединение, образованное ионными связями. Когда вы бросаете его в воду, H + и Cl — распадаются, потому что, как мы уже говорили, вода полярна и будет атаковать заряженные ионы. Подберите изображения папарацци и / или грифа. В результате в раствор выделяется целая группа ионов H + , что резко увеличивает концентрацию H + .Увеличение концентрации H + вызывает повышение кислотности.
основание , с другой стороны, представляет собой вещество, которое будет связываться со свободными ионами водорода (H + ), которые могут плавать в растворе. Основы также известны как щелочных .
NaOH является примером основания. Когда вы бросаете NaOH в воду, ионы Na + отделяются от гидроксид-ионов (OH — ). Несмотря на то, что кислород и водород ОН — связаны между собой ковалентно, они все равно считаются ионами, поскольку в устройстве имеется дополнительный электрон; следовательно, он имеет чистый отрицательный заряд.
Вы, вероятно, можете догадаться, что происходит, когда случайный ион ОН — встречает свободный ион Н + : это любовь с первого взгляда, и ионы связываются. Что происходит в результате? Концентрация свободных ионов H + в этом растворе уменьшается, что на увеличивает основность на . Основания содержат больше ионов ОН — , чем кислот. Таким образом, кислоты выделяют в раствор связку ионов H + , а основания вымывают их, как будто они — Swiffer.
Последнее, что нужно упомянуть, прежде чем мы вернемся к буферам, это pH .Шкала рН изменяется от 0 до 14 и является способом измерения кислотности раствора, который связан с тем, сколько ионов водорода содержится в любом данном растворе. Чистая вода имеет рН 7, который является нейтральным, и содержит ровно столько же ионов Н + , что и ионы ОН — , плавающие в ней.
Следует помнить две вещи:
- Если ионов H + относительно больше, pH снижается, что повышает кислотность. Больше H + , более кислый, более низкий pH.
- Если имеется меньше ионов H + , pH увеличивается, увеличивая основность. Меньше H + , больше основного, выше pH.
Помните, что шкала pH варьируется от 0 до 14, и каждый шаг представляет десятикратную разницу. Другими словами, раствор с pH 5 в 100 раз более кислый, чем раствор с pH 7. И раствор с pH 3 в 10 000 раз более кислый, чем раствор с pH 7. Для наглядности , сода имеет рН 3. В некотором роде вы хотите переосмыслить этот большой глоток, не так ли?
Хорошо, вернемся к буферам.Буфер — это вещество, которое помогает смягчать любые изменения рН, возникающие в результате добавления кислот или оснований. Это важно, потому что, как вы узнаете позже, большинство химических процессов, происходящих в живых организмах, очень чувствительны к pH, и резкие изменения pH могут вызвать серьезные проблемы. Буферы — это в основном благие намерения контроля.
Вода, как указано в начале этого раздела, может действовать как буфер, если происходит внезапное изменение pH. В любой момент времени существует несколько молекул Н 2 О, которые распадаются и образуют Н + и ОН — .Не беспокойся Большинство молекул воды все еще полностью связаны друг с другом, но есть кое-какие ионы водорода, которые эффективно устают «делиться» электроном с напористыми, эгоистичными атомами кислорода. Они бросают свои маленькие атомные руки и кричат: «Хорошо! Электрон — это все твое. Я отсюда!» Поэтому в растворе всегда присутствует несколько рассеянных ионов H + и соответствующих ионов OH — .
Эти несколько диссоциированных молекул воды — это то, что дает воде ее буферную способность.Если мы добавим кислоту в воду, некоторые из свободных ионов ОН — будут связываться с вновь добавленными ионами Н + , что будет сдерживать снижение рН. Точно так же, если мы добавим в воду целый пучок основания, часть добавленного основания будет связываться со свободными ионами H + в растворе, что будет сдерживать увеличение pH.
Сказав все это, в то время как вода может быть буфером, это не фантастика, поскольку большинство молекул H 2 О остаются полностью слипшимися.Он обладает небольшой буферной способностью и полезен при небольших изменениях pH, но он ни в коем случае не является лучшим и, конечно, не может компенсировать очень резкие изменения pH.
Вода противостоит изменениям температуры
Вода упряма. Почему вода такая, и кто решил, что упрямство делает тебя особенным?
Во-первых, вода имеет высокую удельную теплоемкость , то есть количество энергии, которое требуется для повышения температуры 1 грамма вещества на 1 ° C.Другими словами, для нагрева воды требуется лота из энергии.
Во-вторых, вода имеет высокую теплоту испарения , количество тепла, необходимое для превращения жидкой воды в газообразную воду (или пар). Высокая температура испарения воды происходит благодаря этим неприятным водородным связям. Молекулы воды на поверхности должны двигаться очень быстро, чтобы вырваться в воздух. Нагревание увеличивает движение молекул, но мы уже знаем, что для нагрева воды требуется много энергии, потому что вода обладает высокой удельной теплоемкостью.
Если мы объединим эти две концепции, мы обнаружим, что для нагревания молекулы воды требуется много энергии, и нам нужно ее сильно нагревать, чтобы дать ей кинетическую энергию, необходимую для разрыва водородных связей, удерживающих ее в воде. Остальные молекулы воды. Двойной удар, если вы пытаетесь заставить воду закипеть.
Наконец, вода имеет высокую температуру плавления , или тепло, которое вам нужно удалить, чтобы затвердеть (или заморозить).
Что все это означает, что вода может удерживать много тепловой энергии, прежде чем она изменит температуру и состояние (от твердого к жидкому к газу).Эти свойства воды хороши, если вы организм, который живет в воде. Почему, спросите вы? Они гарантируют, что вода защитит вас от резких перепадов температуры и обеспечит довольно стабильную среду, даже если температура воздуха сильно изменится. Спасибо, вода.
Ice Floats
Мы знаем, что вы это знаете, но выслушайте нас. Для большинства соединений твердое состояние более плотное, чем жидкое, а это означает, что твердое вещество опустится на дно контейнера, содержащего жидкость.Не для льда! Лед такой крутой. Возьми? Круто ? Сожалею. Дело в том, что вода на самом деле становится менее плотной, когда она замерзает, что позволяет твердой форме (лед) плавать на жидкой форме (вода).
Это важно для организмов, которые живут под водой. Если бы замерзшая вода затонула, малые водоёмы с большей вероятностью полностью замерзали бы зимой, что вредно для всех организмов, живущих там. И под плохим мы подразумеваем верную смерть. Вместо этого слой льда эффективно изолирует подстилающую воду, позволяя многим водным организмам выживать в течение зимы.Не за что, рыба, косатка и невероятно очаровательные щенки арктического тюленя. D’Awww.
Brain Snack
Может ли жизнь существовать без воды? На Земле мы не нашли форму жизни, которая могла бы управлять этим подвигом, но на Луне Сатурна Титане могла бы быть такая, где вся вода замерзла. Проверьте это.
Как работает вода | HowStuffWorks
Водородная связь между молекулами воды, о которой мы говорили в первом разделе, является причиной двух уникальных свойств воды: сцепление , сцепление и сцепление , . Сплоченность относится к тому факту, что вода очень легко прилипает к себе. Адгезия означает, что вода также очень хорошо прилипает к другим вещам, поэтому она распространяется в виде тонкой пленки на определенных поверхностях, таких как стекло. Когда вода вступает в контакт с этими поверхностями, силы сцепления сильнее, чем силы сцепления.Вместо того, чтобы слипаться друг с другом в шарике, он распространяется.
Вода также имеет высокий уровень поверхностного натяжения . Это означает, что молекулы на поверхности воды не окружены одинаковыми молекулами со всех сторон, поэтому их вытягивает только сплоченность других молекул глубоко внутри. Эти молекулы сильно сцепляются друг с другом, но слабо прилипают к другой среде. Одним из примеров этого является способ, которым вода накапливается на восковых поверхностях, таких как листья или вощеные машины.Поверхностное натяжение заставляет эти капли воды округляться, чтобы они покрывали наименьшую возможную площадь поверхности.
Капиллярное действие также является результатом поверхностного натяжения. Как мы уже упоминали, это происходит у растений, когда они «всасывают» воду. Вода прилипает к внутренней части трубок растения, но поверхностное натяжение пытается сгладить ее. Это заставляет воду подниматься и снова слипаться, процесс, который продолжается до тех пор, пока не накопится достаточно воды, чтобы гравитация начала тянуть ее обратно вниз.
Водные водородные связи также являются причиной того, что ее твердая форма, лед , может плавать в жидкой форме. Лед менее плотный, чем вода, потому что молекулы воды образуют кристаллические структуры при низких температурах (32 градуса по Фаренгейту или 0 градусов по Цельсию). Тепловые свойства воды также связаны с ее водородными связями. Вода имеет очень высокую удельную теплоемкость , то есть количество тепла на единицу массы, необходимое для повышения ее температуры на один градус Цельсия.Энергия, необходимая для повышения температуры воды на один градус Цельсия, составляет 4,2 Дж на грамм. Вода также обладает высокой температурой испарения , что означает, что она может принимать много тепла без значительного повышения температуры. Это играет огромную роль в климате, потому что это означает, что океанам требуется много времени, чтобы прогреться.
Вода часто известна как универсальный растворитель , что означает, что в ней растворяются многие вещества. Вещества, которые растворяются в воде, являются гидрофильными .Это означает, что они так же сильны или сильнее, чем сплоченные силы воды. Соль и сахар полярны, как вода, поэтому они очень хорошо растворяются в ней. Вещества, которые не растворяются в воде, являются гидрофобными . Это источник поговорки «масло и вода не смешиваются». Растворимость воды — вот почему вода, которую мы используем, редко бывает чистой; обычно в нем растворено несколько минералов.
Наличие этих минералов — это разница между жесткой водой и мягкой водой .Жесткая вода обычно содержит много кальция и магния, но может также содержать металлы. Мыло плохо пенится в жесткой воде, но жесткая вода обычно не опасна. Это также может вызвать отложения извести в трубах, водонагревателях и туалетах.
Некоторые последние споры о свойствах воды связаны с тем, как лед ведет себя, когда он тает. Некоторые ученые утверждают, что он выглядит примерно так же, как и в твердом состоянии, за исключением того, что некоторые из его водородных связей разрываются. Другие утверждают, что это формирует совершенно новую структуру.Таким образом, несмотря на всю его важность, мы все еще не полностью понимаем воду.
Для получения дополнительной информации о воде и смежных темах, перейдите по ссылкам на следующей странице.
,
