Полная таблица Менделеева — «Виртуальная Академия»
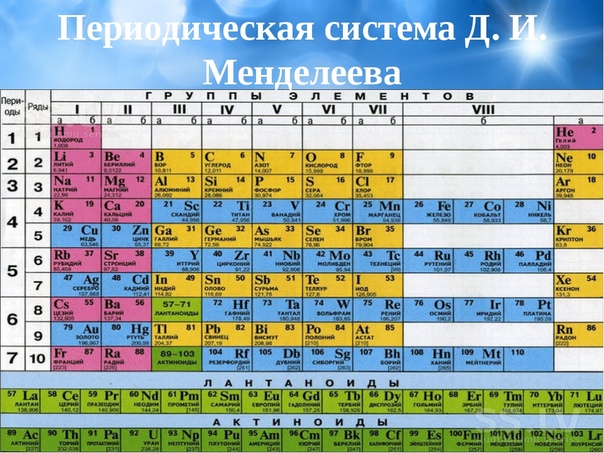
Таблица Менделеева представляет собой классификацию химических элементов, устанавливающую зависимость свойств элементов от заряда атомного ядра. Периодическая система химических элементов – это графическое выражение периодического закона, который установил великий русский химик в 1869 году. Было предложено огромное количество вариантов изображения периодической системы, однако в современном варианте полная таблица Менделеева является двумерной, и в ней столбцы определяют основные физико-химические свойства, а строки представляют собой подобные друг другу периоды.
Как гласит легенда, мысль о создании системы химических элементов пришла к ученому во сне, после чего Менеделеев написал на карточках основные свойства каждого элемента (в то время их было известно 63). Многократно переставляя эти карточки, составляя из них ряды элементов, сходных по своим свойствам, великий химик сопоставлял ряды между собой.
Первый вариант системы появился в 1869 году.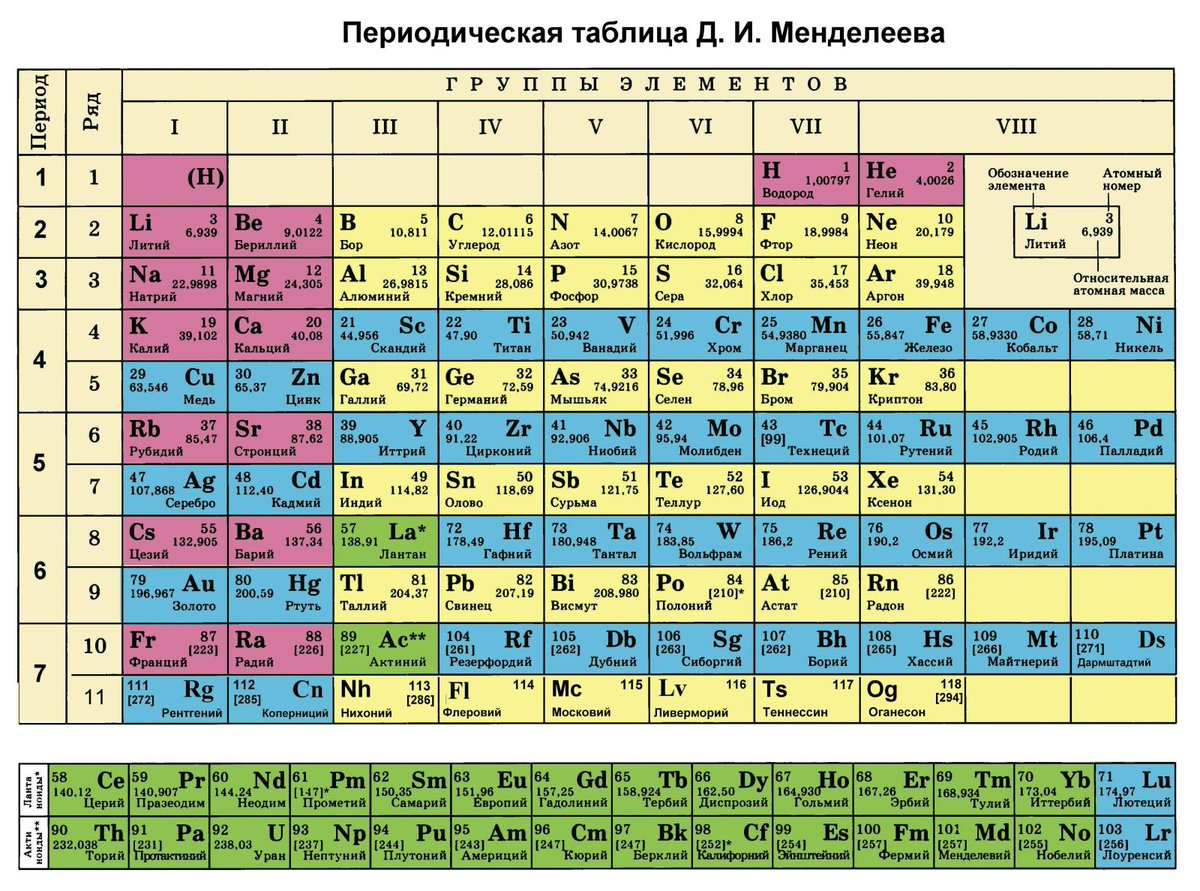
Суть открытия Менделеева заключалась в том, что с увеличением атомной массы элементов происходит периодическое изменение их свойств. После определенного количества элементов, различных по свойствам и расположенных по возрастанию атомного веса, свойства начинают повторяться.
Отличие работы Менделеева от работ его предшественников заключалось в том, что у него было две основы для классификации элементов – химическое сходство и атомная масса. Для полного соблюдения периодичности химик был вынужден исправить атомные массы некоторых элементов. Также ученый оставил в таблице пустые клетки, где, как он предполагал, должны разместиться пока еще не открытые элементы.
В 1871 году работы ученого легли в основу периодического закона, сформулированного Менделеевым. Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, куда помещались все новые и новые элементы. В 2010 году был завершен седьмой период периодической системы. Вот как сейчас выглядит полная таблица Менделеева.
Самыми распространенными являются три формы таблицы Менделеева: короткопериодная, длиннопериодная и сверхдлинная. В сверхдлинном варианте каждый период занимает одну строчку. Что касается длинного варианта, в нем из общей таблицы вынесены лантаноиды и актаноиды. В короткой форме четвертый и последующий периоды занимают по две строчки, а символы химических элементов, принадлежащих главным и побочным подгруппам, выравниваются относительно разных краев клеток.
Короткую форму таблицы, содержащей восемь групп элементов, официально отменили в 1989 году. Несмотря на рекомендацию пользоваться длинной формой, в большом числе российских справочников и пособий продолжает приводиться короткая форма.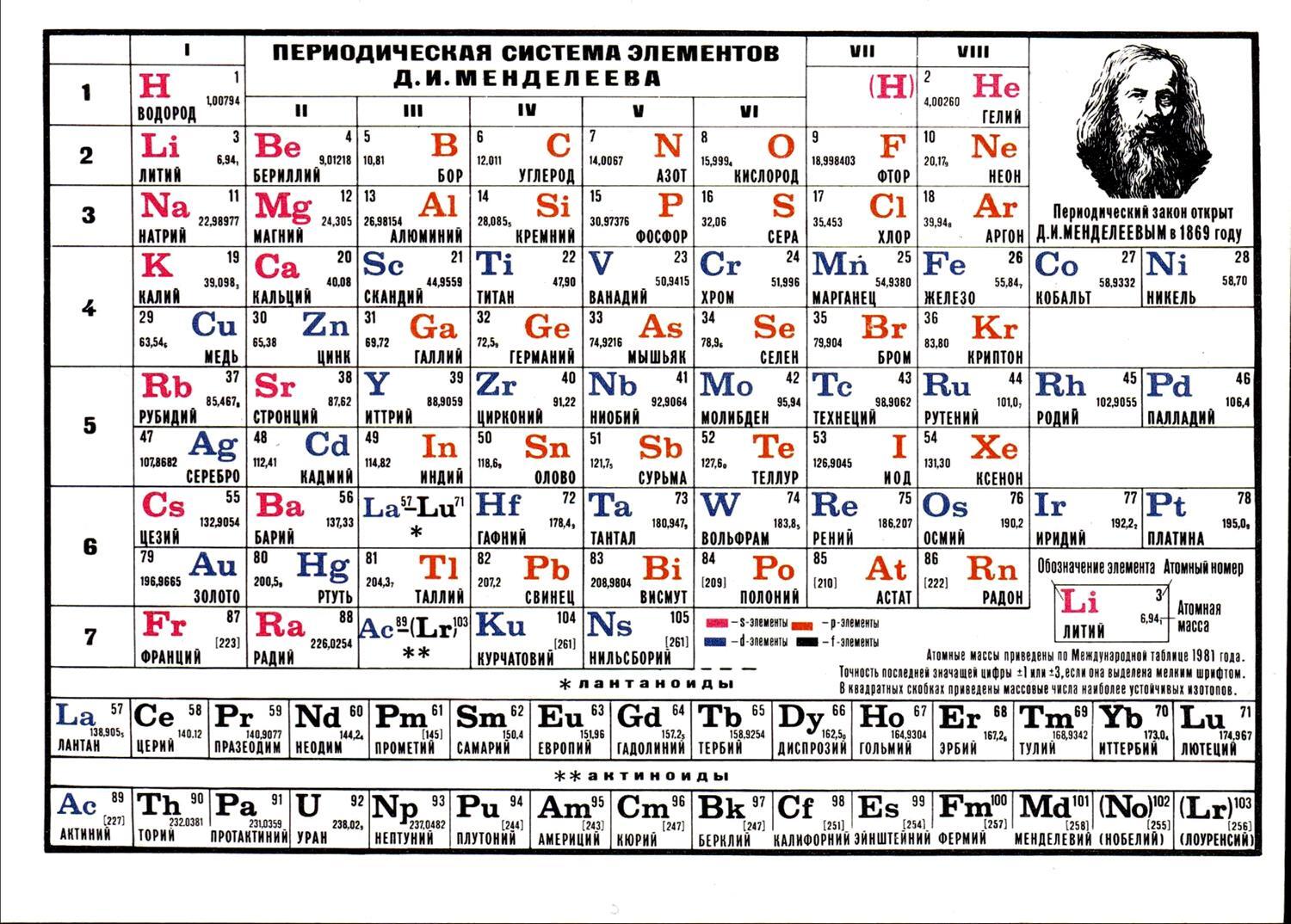
В 1970 году Теодором Сиборгом была предложена расширенная периодическая таблица элементов. Нильс Бор занимался разработкой лестничной (пирамидальной) формы периодической системы. Существует большое количество других оригинальных, но при этом редко или вовсе не используемых способов графического отображения периодического закона. На сегодняшний день существуют сотни вариантов таблицы Менделеева, и при этом ученые предлагают все новые варианты.
Периодическая система Менделеева – важнейшая веха в развитии атомно-молекулярного учения. Именно благодаря ей возникло современное понятие о химическом элементе и были уточнены представления о простых веществах и соединениях. Также периодическая таблица стала готовой систематизацией типов атомов для новых разделов физики.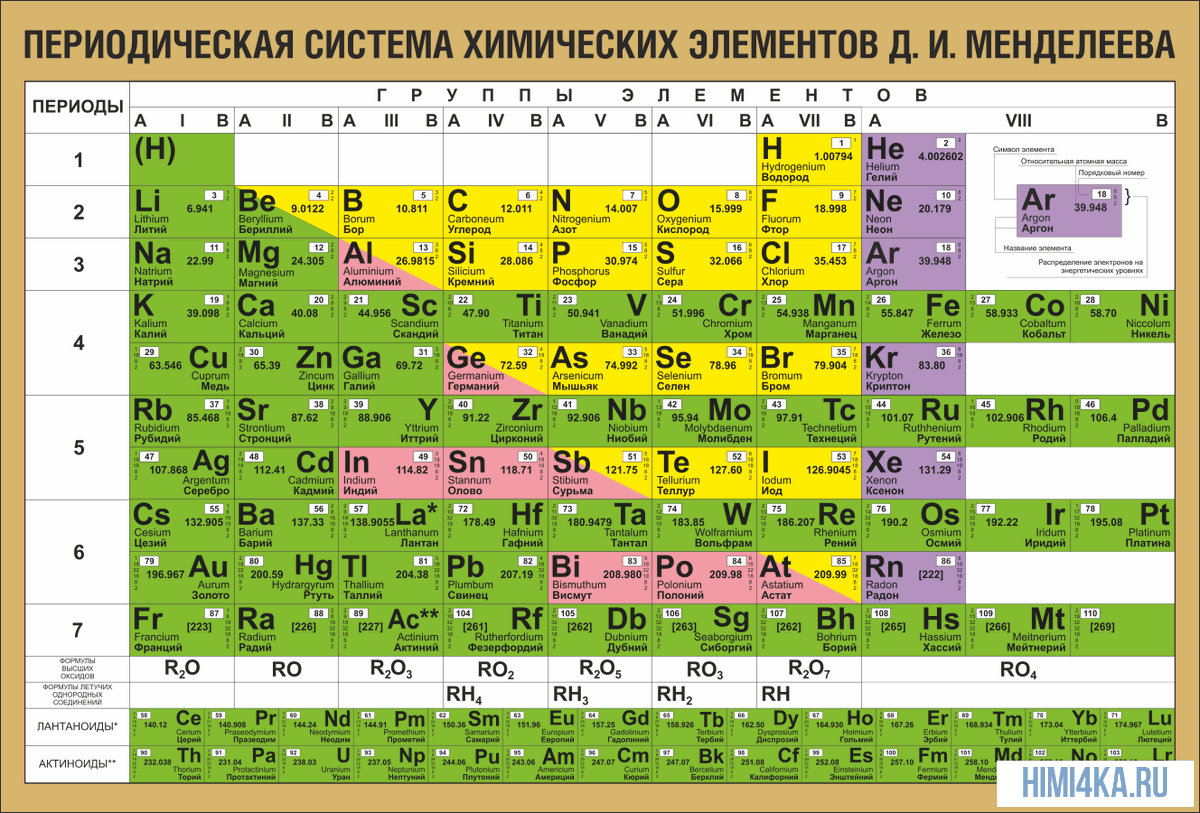 С помощью исследований атома методами физики удалось выяснить, что порядковый номер элемента является мерой электрического заряда ядра данного элемента, число электронных оболочек атома определяется номером горизонтального ряда в таблице, а номер вертикального ряда определяет квантовую структуру верхней оболочки.
С помощью исследований атома методами физики удалось выяснить, что порядковый номер элемента является мерой электрического заряда ядра данного элемента, число электронных оболочек атома определяется номером горизонтального ряда в таблице, а номер вертикального ряда определяет квантовую структуру верхней оболочки.
Появление полной системы Менделеева открыло новую научную эру в истории химии и других наук. Вместо разрозненных сведений о химических элементах и их соединениях возникла стройная система, благодаря которой стало возможным обобщать, предвидеть и делать выводы.
Ты знал, что существует круглая таблица Менделеева? А ещё спиральная! | KAMILYATOR
Рассказываю какие бывают формы у таблицы Менделеева и показываю её альтернативные варианты.
Таблица Менделеева — возможно самое важное изобретение за всю историю химии. В неё вложен огромный смысл, каждый элемент находится на своём месте. Закономерности, заложенные в основу мироздания отражены в периодической системе химических элементов.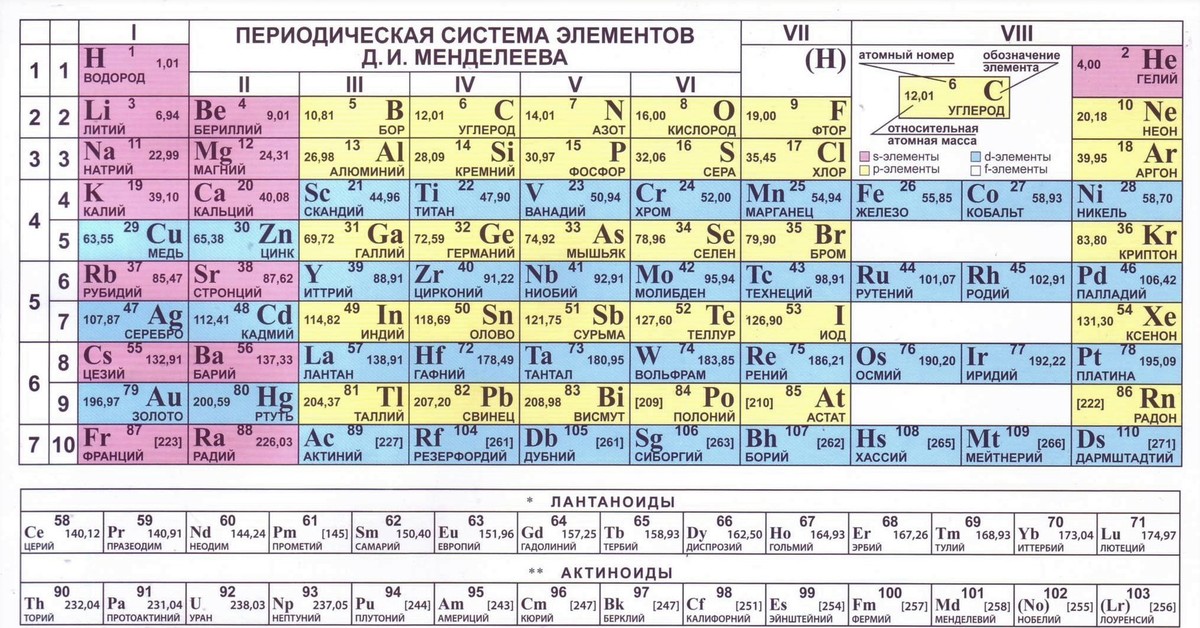
Самыми распространёнными формами таблицы Менделеева являются: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». Давайте полистаем на картинки и сравним их:
Короткая форма. https://filtravod.ru/uploads/gallery/Tablica-Elementov/periodic_table.pngДлинная форма. https://forstudents.minemegashop.ru/pictures/1017667611.jpgСверхдлинная. Свободный источникКороткая форма. https://filtravod.ru/uploads/gallery/Tablica-Elementov/periodic_table.png
Короткая форма была официально отменена ИЮПАК (Международный союз теоретической и прикладной химии) в 1989 году. Однако, её продолжают использовать во многих школьных учебниках и кабинетах химии. Из современной иностранной литературы короткая форма исключена полностью, а вместо неё используется длинная форма.
В 1970 году Теодор Сиборг предложил расширенную периодическую таблицу элементов.
С момента создания периодической таблицы прошло много времени.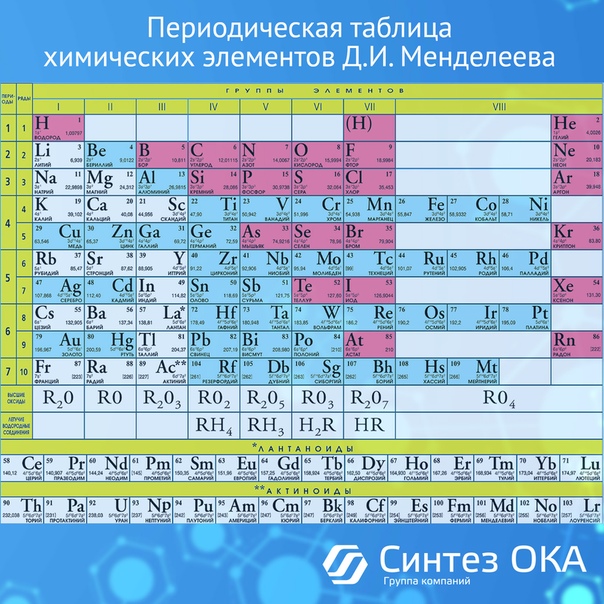 На сегодня разработано несколько сотен вариантов таблицы и не всегда они похожи на таблицу 🙂 есть даже объёмные.
На сегодня разработано несколько сотен вариантов таблицы и не всегда они похожи на таблицу 🙂 есть даже объёмные.
Альтернативные виды периодической таблицы
Альтернативная система элементов Теодора БенфеяАльтернативная система элементов Теодора Бенфея
Интересный факт: На во многих западных странах таблицу Менделеева называют без упоминания фамилии автора, просто: Periodic table (англ. Периодическая таблица). Причина такая же, что и в истории с изобретателем радио: у нас Попов Александр Степанович, в западе Гульельмо Маркони.
Спиральная таблица, автор Robert W HarrisonСпиральная таблица, автор Robert W Harrison
Интересный факт: Уран — последний по номеру химический элемент в таблице, который можно встретить в природе, остальные элементы можно создать только искусственным путем.
TROPE — это аббревиатура с анг. The Ring Of Periodic ElementsTROPE — это аббревиатура с анг. The Ring Of Periodic Elements
The Ring Of Periodic Elements
Интересный факт: Галлий (Ga) стал первым пробелом в таблице, заполненным уже после смерти ученого. Металлический галлий известен тем, что он сохраняет твердость при комнатной температуре, но в руках плавится.
Периодическая таблица с завитой лентой (J. F. Hyde)Периодическая таблица с завитой лентой (J. F. Hyde)
Интересный факт: есть версия, что изначально таблица Менделеева включала Эфир и он стоял первым номером.
Альтернативная круговая периодическая таблицаКруговая периодическая таблицаПериодическая таблица «Stowe»Версия Zmaczynski & BayleyСпиральная периодическая таблица яна ШолтенаАльтернативная круговая периодическая таблица
При изучении Периодического закона в школе меня сильно удивило, насколько Вселенная безупречна, что каждый атом, каждый электрон образует сложнейшую систему из хаоса.
Оценивай статью и пиши комментарий, для меня это будет хорошей наградой за труд 🙂Зачем нужна таблица Менделеева | Решаем химию: вопросы и ответы
Изучая неорганическую химию в школе или вузе, вы всегда будете иметь перед глазами огромную и совершенно законную подсказку – таблицу Менделеева..jpg) Таблица – справочный материал, который выдают на любом экзамене, будь то егэ по химии или сессия на первом курсе института. Самое главное – научиться пользоваться этой подсказкой.
Таблица – справочный материал, который выдают на любом экзамене, будь то егэ по химии или сессия на первом курсе института. Самое главное – научиться пользоваться этой подсказкой.
Бродит миф, что Дмитрий Иванович Менделеев увидел таблицу во сне. Но вот сам Менделеев, говорят, недюжинно обижался на эти домыслы и отвечал, что периодическая система химических элементов – результат многолетней работы. В итоге этой работы и появились таблица и периодический закон, согласно которому
свойства элементов находятся в периодической зависимости от их атомного веса.
Что таблица наглядно и отражает.
В учебниках химии и классах обычно представлен короткий вариант периодической таблицы. Но существуют ещё и длинный и сверхдлинный. Но самый компактный и удобный для школьников и студентов – короткий. Его особенность в том, что актиноиды и лантаноиды вынесены вниз, а периоды, начиная с четвёртого, имеют две строки. А вот так выглядит длинный вариант:
А вот так выглядит длинный вариант:
Фото: chem-mind.com
Теперь посмотрите на любой элемент. У него есть порядковый номер, и он (это уже подсказка) показывает заряд ядра атома. Зная заряд атома, мы может сказать, сколько протонов составляют ядро и сколько электронов имеется в атоме. Кроме того, в таблице указаны атомные массы всех элементов. И это вторая подсказка, потому что без атомных масс нельзя проводить расчёты. И ещё, зная заряд ядра (то есть число протонов) и массу атома, можно с лёгкостью узнать число нейтронов. Таким образом, даже беглый взгляд на ячейку позволяет нам многое узнать о строении атома конкретного элемента.
Как пользоваться таблицей Менделеева
В таблице есть группы (колонки, которые обозначаются римскими цифрами) и периоды (строки, которые обозначаются арабскими цифрами). Чтобы было проще, давайте рассмотрим пару примеров.
Пример 1.
Кальций имеет порядковый номер 20. В какой группе и каком периоде он находится?
В какой группе и каком периоде он находится?
Ответ: Кальций находится во II группе в 4 периоде.
Пример 2.
Элемент находится в VIII группе в 3 периоде. Что это за элемент? Каков его порядковый номер?
Ответ: это аргон и его порядковый номер 18.
Таким образом, мы можем найти элемент, зная его порядковый номер либо зная номер группы и периода.
Теперь важная ремарка. Элементы в таблице расположены в порядке увеличения заряда ядра, начиная с самого простого атома – атома водорода. Периодический закон в формулировке Менделеева говорил, что свойства элементов находятся в периодической зависимости от атомной массы. То есть элементы должны располагаться в таблице в порядке увеличения атомной массы. Но это нет всегда так: посмотрите на кобальт (порядковый номер 28) и никель (порядковый номер 29) и убедитесь, что атомная масса никеля меньше атомной массы кобальта. Значит, никель должен стоять перед кобальтом? Почему же тогда он стоит после него? Все дело в том, что в 20 веке учёные доказали, что
Значит, никель должен стоять перед кобальтом? Почему же тогда он стоит после него? Все дело в том, что в 20 веке учёные доказали, что
свойства элементов находятся в периодической зависимости от заряда ядра атома.
Именно так звучит современная формулировка периодического закона (и именно поэтому кобальт стоит перед никелем).
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Таблица Менделеева. Такая разная. : moris_levran — LiveJournal
1 марта 1869 года Менделеев закончил свою работу «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Этот день считается днём открытия периодического закона элементов Д.М. Менделеева. «Открытие Д.И.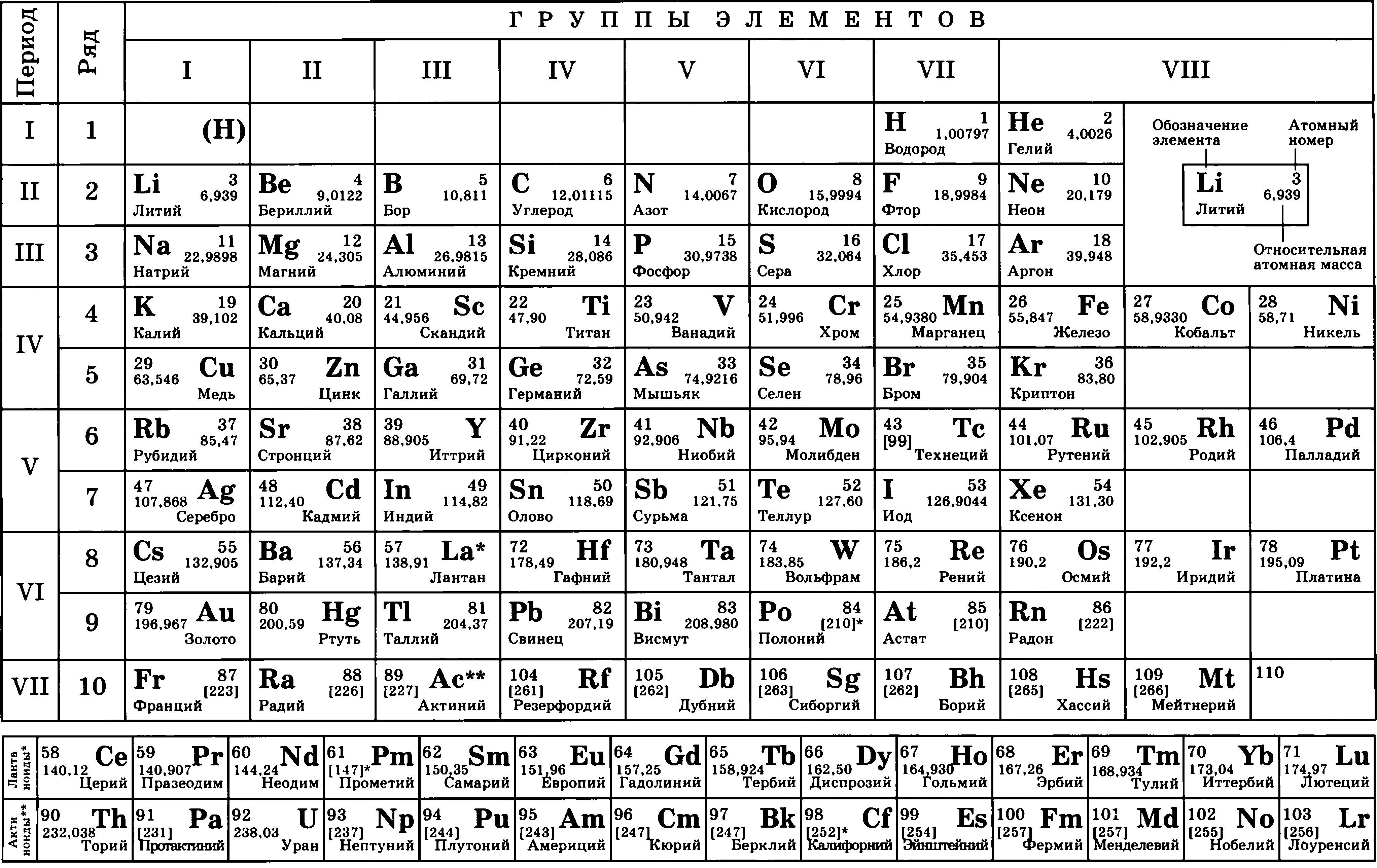 Менделеева относится к фундаментальным законам мироздания, таким как закон всемирного тяготения Ньютона или теория относительности Эйнштейна, а Д.М. Менделеев стоит в одном ряду с именами этих великих физиков». Академик А.И. Русанов.
Менделеева относится к фундаментальным законам мироздания, таким как закон всемирного тяготения Ньютона или теория относительности Эйнштейна, а Д.М. Менделеев стоит в одном ряду с именами этих великих физиков». Академик А.И. Русанов. «Периодическая система как была, так и осталась в самых новейших решениях проблемы о веществе главной путеводной звездой». Проф. А. Н. Реформатский.
«Когда подходишь к оценке личностей, подобных Д. И. Менделееву, к анализу их научного творчества, невольно является желание отыскать в этом творчестве элементы, всего более отмеченные печатью гения. Из всех признаков, отличающих гениальность и ее проявление, два, кажется, являются наиболее показательными: это, во-первых, способность охватывать и объединять широкие области знания и, во-вторых, способность к резким скачкам мысли, к неожиданному сближению фактов и понятий, которые для обыкновенного смертного кажутся далеко стоящими друг от друга и ничем не связанными, по крайнем мере до того момента, когда такая связь будет обнаружена и доказана». Л. А. Чугаев, профессор химии.
Л. А. Чугаев, профессор химии.
Да и сам Менделеев понимал огромное значение открытого им закона для науки. И верил в его дальнейшее развитие. «По видимому, периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает». Д.И. Менделеев.
Первоначальный вид таблицы, написанный рукой Д.И. Менделеева.
Если бы все научные знания мира пропали бы, из-за какого либо катаклизма, то для возрождения цивилизации одним из главных законов стал бы периодический закон Д.И. Менделеева. Успехи атомной физики, включая ядерную энергетику и синтез искусственных элементов, стали возможными лишь благодаря Периодическому закону. В свою очередь, они расширили и углубили сущность закона Менделеева.
Периодический закон сыграл огромную роль в развитии химии и других естественных наук. Была открыта взаимная связь между всеми элементами, их физическими и химическими свойствами. Это поставило перед естествознанием научно-философскую проблемы огромной важности: эта взаимная связь должно получить объяснение.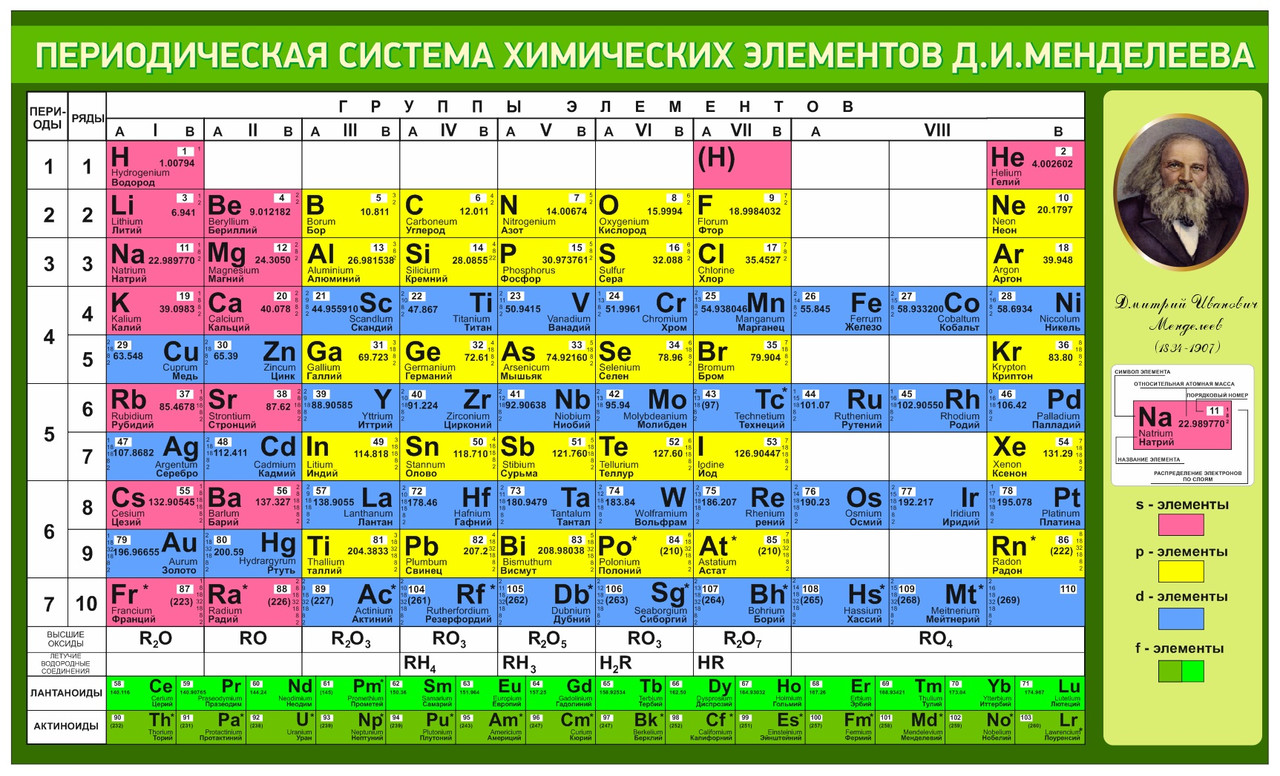
Открытию периодического закона предшествовало 15 лет напряженной работы. Ко времени открытия периодического закона было известно 63 химических элемента, существовало около 50 различных классификаций. Большинство ученых сравнивали между собой только сходные по свойствам элементы, поэтому не смогли открыть закон. Менделеев же сравнивал между собой все, в том числе и несходные элементы. Менделеев выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях, расположил их в порядке возрастания их относительных атомных масс и всесторонне проанализировал всю эту совокупность, пытаясь найти в ней определенные закономерности. В результате напряженного творческого труда он обнаружил в этой цепочке отрезки, в которых свойства химических элементов и образованных ими веществ изменялись сходным образом – периодически – периоды. С развитием учения о строении электронной оболочки атомов стало ясно, почему свойства атомов показывают периодичность с возрастанием атомной массы.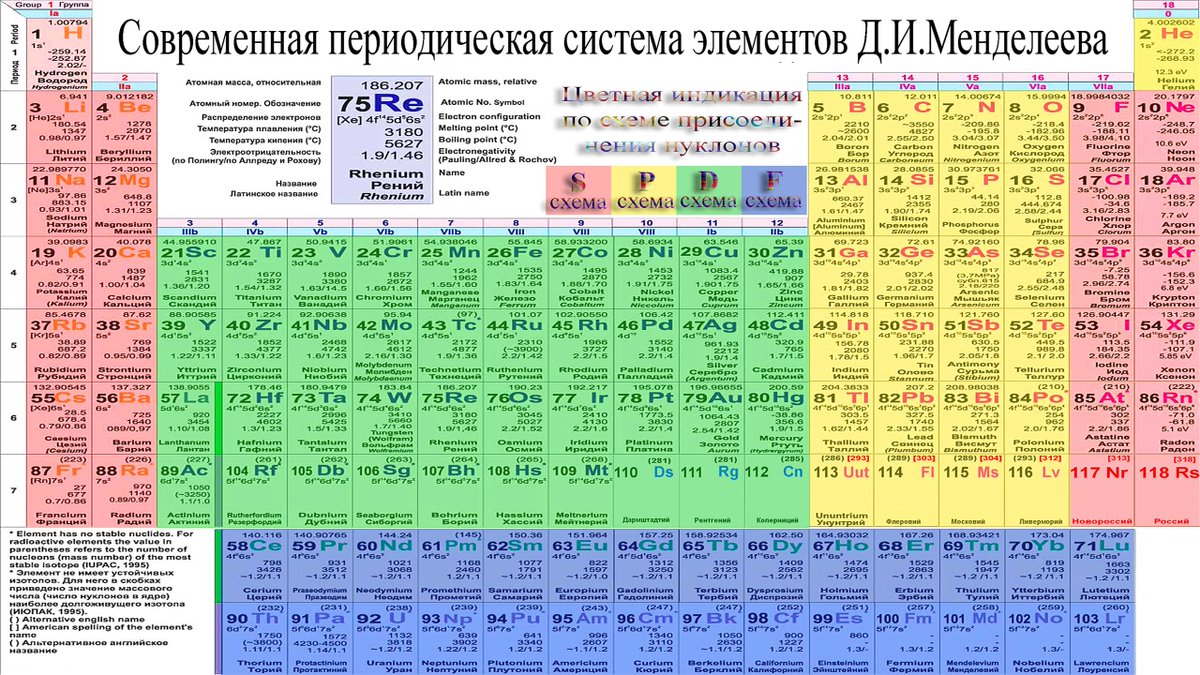 Атомы с одинаковой внешней сферой составляют одну группу. Атомы с одинаковым числом внешних сфер — составляют один ряд. Атомы с ядрами, имеющими одинаковые заряды, но разные массы, обладают одинаковыми химическими свойствами, но разными атомными весами и представляют собой изотопы одного и того же химического элемента. По существу свойства атомов отражают свойства внешних электронных оболочек, которые тесно связанны с законами квантовой физики.
Атомы с одинаковой внешней сферой составляют одну группу. Атомы с одинаковым числом внешних сфер — составляют один ряд. Атомы с ядрами, имеющими одинаковые заряды, но разные массы, обладают одинаковыми химическими свойствами, но разными атомными весами и представляют собой изотопы одного и того же химического элемента. По существу свойства атомов отражают свойства внешних электронных оболочек, которые тесно связанны с законами квантовой физики.
Сама таблица Менделеева много раз трансформировалась, отображая разную информацию о свойствах атомов. Встречаются и курьёзные таблицы.
Так называемая короткопериодная или короткая форма ТМ
Длиннопериодная или длинная форма ТМ
Сверхдлинная.
Флаги государств, обозначающие страну, где впервые открыли данный элемент.
Названия элементов, которые были отменены или оказались ошибочными, как например, история с дидимом Di — оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима.
Здесь синим цветом обозначены элементы, образованные во время Большого Взрыва, голубым — синтезированные во время первичного нуклеосинтеза, жёлтые и зелёные цвета обозначают элементы, синтезированные соответственно в недрах «малых» и «больших» звёзд. Розовым цветом — вещества (ядра), синтезируемые во время вспышек сверхновых звёзд. Кстати, золото (Au) ещё синтезируется во время столкновений нейтронных звёзд. Фиолетовые — созданные в лабораториях искусственно. Но это ещё не вся история…
Здесь разными цветами обозначены органические, неорганические и незаменимые элементы, необходимые для построения тел живых существ, в том числе и нас.
Таблица-башня
Предложена в 2006-ом Виталием Циммерманом на основе идей Чарльза Джанета. Он изучал орбитальное заполнение атомов — то, как располагаются электроны относительно ядра. И на основе этого разделил все элементы в четыре группы, рассортировав их по конфигурациям положения электронов. Таблица предельно проста и функциональна.
Таблица предельно проста и функциональна.
Таблица — спираль.
В 1964-ом Теодор Бенфей предложил поставить в центр таблицы водород (H), а прочие элементы разместить вокруг него по спирали, которая раскручивается по часовой стрелке. Уже на втором витке спираль вытягивается в петли, который соответствуют переходным металлам и лантаноидам с актиноидами, предусмотрено место для неизвестных пока суперактинидов. Это придает таблице вид экстравагантного дизайнерского решения.
Таблица — радужная спираль.
Изобретена в 1975 химиком Джеймсом Хайдом. Он увлекался кремнийорганическими соединениями, поэтому в основание таблицы попал именно кремень, так как у него большое число связей с другими элементами. Различные категории элементов так же объединены по секторам и отмечены нужным цветом. Таблица красивее аналогов, но из-за криволинейной формы пользоваться ею непросто.
Эти таблицы отображают последовательность заполнения электронных оболочек.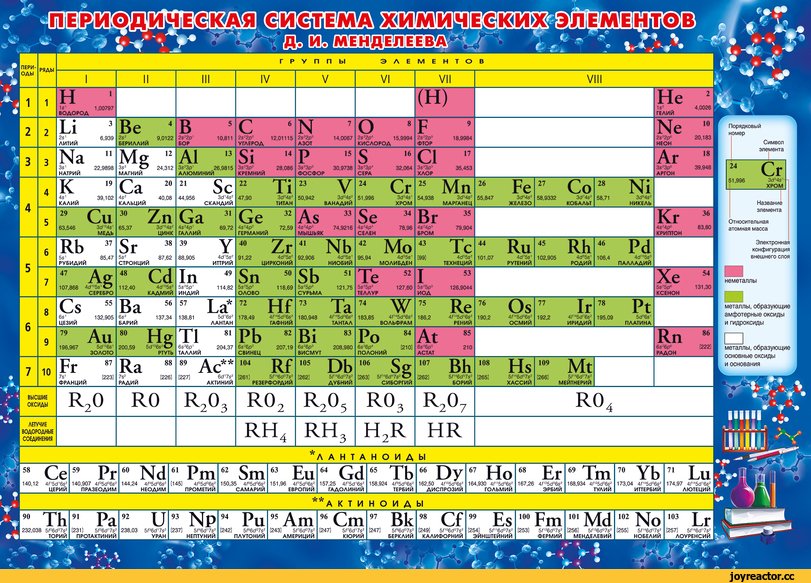 Во всяком случае некоторые из них. Все эти таблицы выглядят весьма экзотично.
Во всяком случае некоторые из них. Все эти таблицы выглядят весьма экзотично.
Таблица изотопов. Здесь отображено время «жизни» различных изотопов, их стабильность в зависимости от массы ядра. Впрочем, это уже не таблица Менделеева, это совсем другая (ядерная физика) история…
Еще одна любопытная интерактивная периодическая таблица Менделеева — Дидактор
Недавно я описывал необычную периодическую таблицу Д.И. Менделеева, представленную в видео. Впрочем, фантазиям «продвинутых» педагогов, видимо, нет предела. Учитель Кейт Эневолдсен (Keith Enevoldsen) из Сиэтла (США) создал свою версию Периодической таблицы элементов, в изображениях и словах.
Огромное преимущество данной таблицы в её практической ориентированности.
Это интерактивный сайт, в котором учащиеся видят, как каждый элемент используется или присутствует в знакомых изделиях и продуктах.
Когда ученики нажимают на химический элемент на интерактивной таблице, появляется изображение знакомого продукта или объекта вместе с описанием элемента и его характеристик.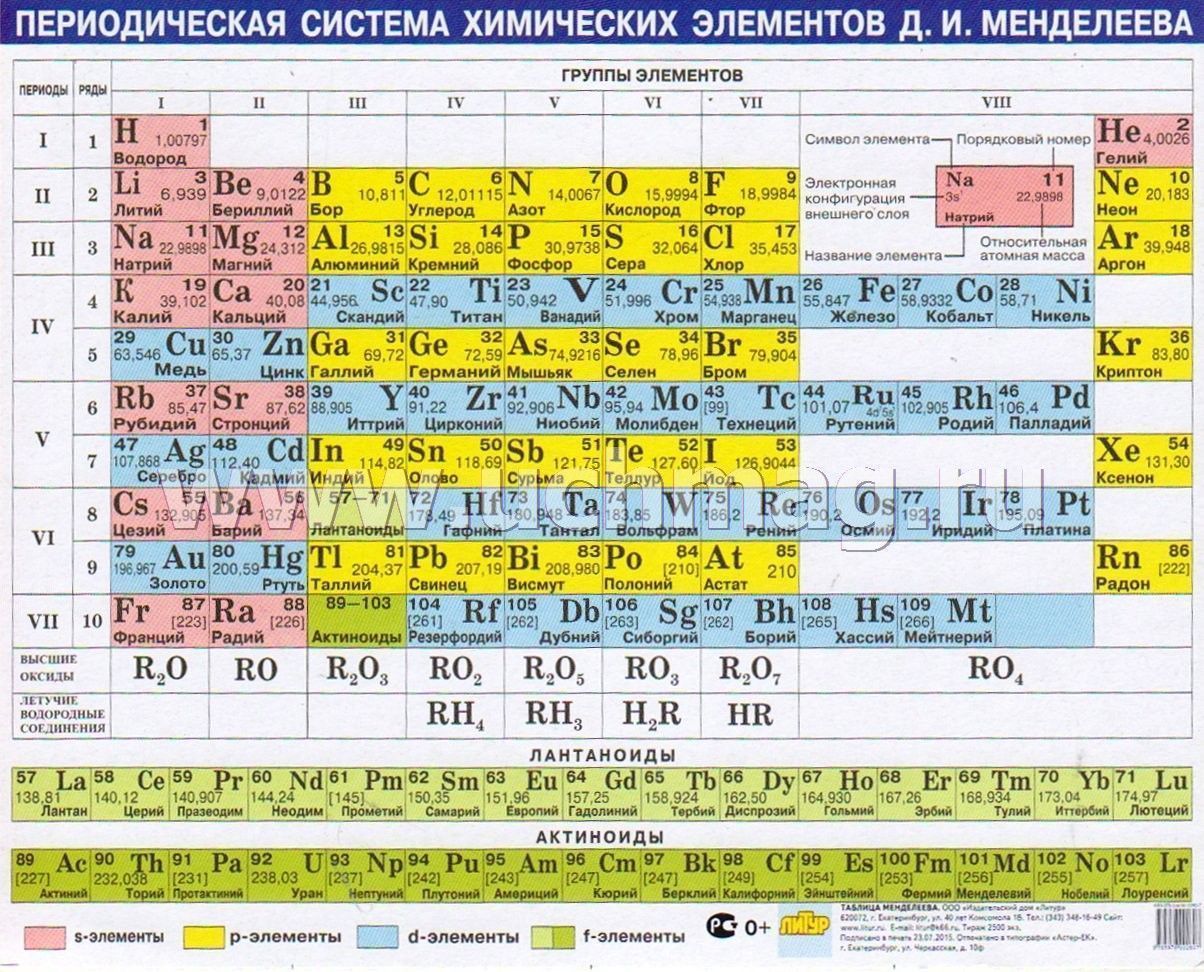
Кроме пользования интерактивной таблицей, автор этого замечательного сервиса представляет возможность загрузки бесплатных PDF-файлов из таблицы Мендеелева в картинках и словах.
Периодическая таблица элементов, в картинках и словах может стать отличным ресурсом для учителя химии.
Помню, как многим моим одноклассникам с трудом давалась периодическая система Менделеева с абстрактными названиями и числами (порядковый номер, валентность). На мой взгляд, подход Кейта Эневолдсена позволяет привить интерес к химии всем ученикам, помогает понять смысл периодической системы.
Несмотря на свою развлекательность, версия Кейта Эневолдсена научно и методически обоснована. Узнаваемые учеником фотографии и рисунки вдруг приобретают для него новый смысл, когда он узнаёт, из чего изготовлены те или иные предметы и что придаёт им особые качества.
«Учиться надо весело!»
Мы помним этот старый афоризм одного из великих педагогов.
Даже вот такая незатейливая песня о таблице Менделеева позволит ученикам снять напряжение при изучении периодической системы:
Жаль, что такой песни нет на русском языке.
Изначальная таблица Менделеева включала эфир. Зачем же его исключили? : matveychev_oleg — LiveJournal
Мировой эфир есть субстанция ВСЯКОГО химического элемента и значит — ВСЯКОГО вещества, есть Абсолютная истинная материя как Всемирная элементообразующая Сущность.Мировой эфир — это исток и венец всей подлинной Таблицы Менделеева, её начало и конец, — альфа и омега Периодической системы элементов Дмитрия Ивановича Менделеева.
В античной философии эфир (aithér-греч) наряду с землей, водой, воздухом и огнем — один из пяти элементов бытия (по Аристотелю) — пятая сущность (quinta essentia -лат.), понимаемая как тончайшая всепроникающая материя. В конце XIX века в ученых кругах получила широкое хождение гипотеза о мировом эфире (МЭ), заполняющем все мировое пространство. Он понимался как невесомая и упругая жидкость, которая пронизывает все тела. Существованием эфира пытались объяснить многие физические явления и свойства.
В конце XIX века в ученых кругах получила широкое хождение гипотеза о мировом эфире (МЭ), заполняющем все мировое пространство. Он понимался как невесомая и упругая жидкость, которая пронизывает все тела. Существованием эфира пытались объяснить многие физические явления и свойства.
У Менделеева было два фундаментальных научных открытия:
1 – Открытие Периодического закона в субстанции химии,
2 – Открытие взаимосвязи субстанции химии и субстанции Эфира, а именно: частицы Эфира формирует молекулы, ядра, электроны и т.д., но в химических реакциях не участвуют.
Эфир – частицы вещества размером ~ 10–100 метра (фактически – «первокирпичики» материи).
Факты. В подлинной таблице Менделеева был Эфир. Ячейка для Эфира располагалась в нулевой группе с инертными газами и в нулевом ряду как главный системообразующий фактор для построения Системы химических элементов. После смерти Менделеева таблицу исказили, убрав из неё Эфир и отменив нулевую группу, тем самым, скрыв фундаментальное открытие концептуального значения.
В современных таблицах Эфира: 1 – не видно, 2 – и не угадывается (из-за отсутствия нулевой группы).
Такой целенаправленный подлог сдерживает развитие прогресса цивилизации.
Техногенные катастрофы (напр. Чернобыль и Фукусима) были бы исключены, если бы в развитие подлинной таблицы Менделеева своевременно были вложены адекватные ресурсы. Сокрытие концептуальных знаний идёт на глобальном уровне для «опускания» цивилизации.
Результат. В школах и ВУЗах преподают обрезанную таблицу Менделеева.
Оценка ситуации. Таблица Менделеева без Эфира – то же самое, что человечество без детей – прожить можно, но развития и будущего не будет.
Резюме. Если враги человечества знания скрывают, то наша задача – эти знания раскрывать.
Вывод. В старой таблице Менделеева элементов меньше, а форсайта больше, чем в современной.
Заключение. Новый уровень возможен только при изменении информационного состояния общества.
Итог. Возврат к истинной таблице Менделеева – это уже вопрос не научный, а вопрос политический.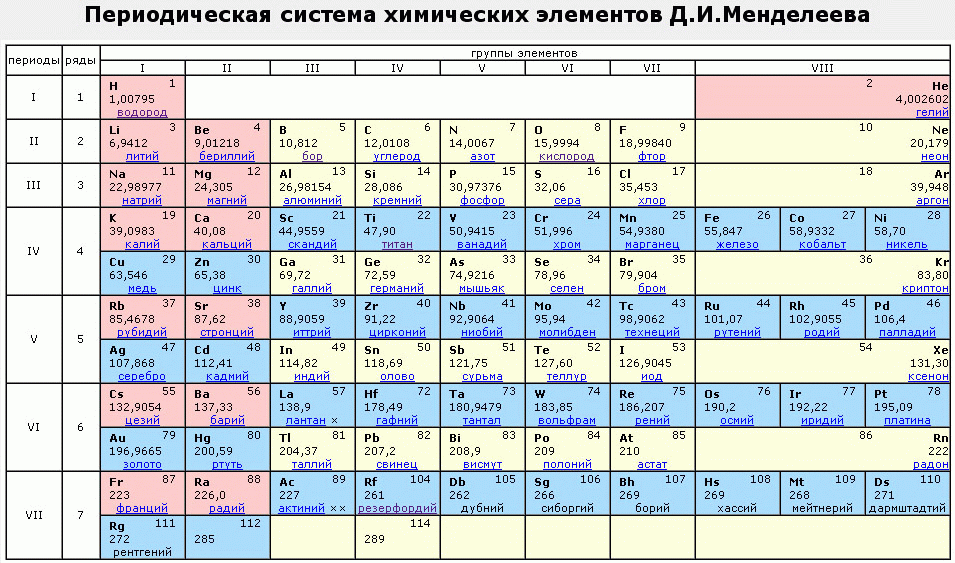
В чем же был основной политический смысл эйнштейновского учения? Он состоял в том, чтобы любыми путями перекрыть человечеству доступ к неисчерпаемым естественным источникам энергии, которые открывало изучение свойств мирового эфира. В случае успеха на этом пути, мировая финансовая олигархия теряла власть в этом мире, особенно в свете ретроспективы тех лет: Рокфеллеры сделали немыслимое состояние, превосходящее бюджет Соединенных Штатов, на нефтяных спекуляциях, и утрата той роли нефти, которую заняло «черное золото» в этом мире – роль крови мировой экономики – их не вдохновляла.
Не вдохновляло это и прочих олигархов – угольных и стальных королей. Так финансовый магнат Морган моментально прекратил финансирование экспериментов Николы Теслы, когда тот вплотную подошел к беспроводной передаче энергии и извлечению энергии «из ниоткуда» – из мирового эфира. После этого обладателю огромного количества воплощенных в практику технических решений не оказывал финансовой помощи никто – солидарность у финансовых воротил как у воров в законе и феноменальный нюх на то, откуда исходит опасность. Вот поэтому против человечества и была произведена диверсия под названием «Специальная Теория Относительности».
Вот поэтому против человечества и была произведена диверсия под названием «Специальная Теория Относительности».
Один из первых ударов пришелся на таблицу Дмитрия Менделеева, в которой эфир стоял первым номером, именно размышления об эфире породили гениальное прозрение Менделеева – его периодическую таблицу элементов.
Глава из статьи: В.Г. Родионов. Место и роль мирового эфира в истинной таблице Д.И. Менделеева
6. Argumentum ad rem
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная ф а л ь ш и в к а .
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник «Основы химии», VIII издание). И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации диссертации в журнале ЖРФМ Русского Физического Общества.
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева — сын друга и соратника Д. И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, Меншуткин действовал не в одиночку, — он лишь выполнял заказ. Ведь, новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д. И. Менделеева был фальсифицирован.
И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева — сын друга и соратника Д. И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, Меншуткин действовал не в одиночку, — он лишь выполнял заказ. Ведь, новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д. И. Менделеева был фальсифицирован.
Главное искажение Таблицы — перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент «Х» (по Менделееву — «Ньютоний»),- т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент «Х» есть аргумент всей Таблицы Менделеева.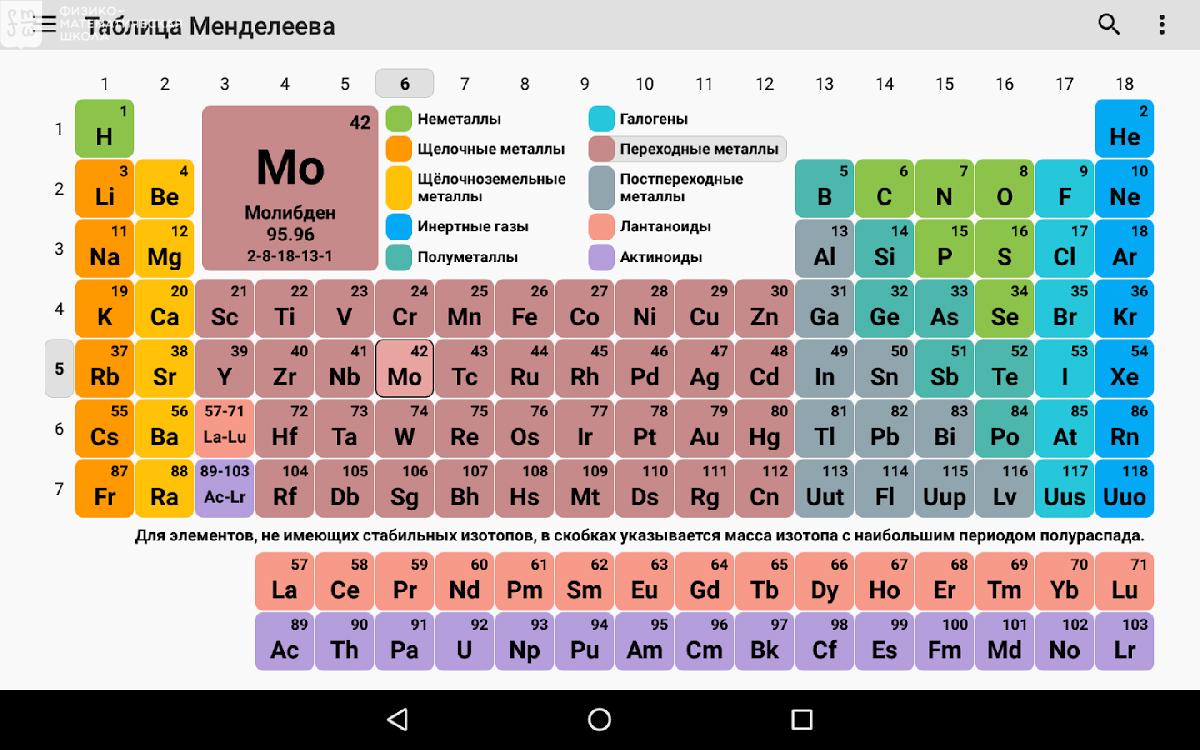 Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
«… Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую … Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими … Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород.
Из них обратим внимание сперва на элемент первого ряда 1-й группы.
 Его означим через «y». Ему, очевидно, будут принадлежать коренные свойства аргоновых газов … «Короний», плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром.
Его означим через «y». Ему, очевидно, будут принадлежать коренные свойства аргоновых газов … «Короний», плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром.Этот элемент «у», однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу «х», который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его «Ньютонием» — в честь бессмертного Ньютона … Задачу тяготения и задачи всей энергетики (!!! — В.Родионов) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом; элементарные же вещества ныне немыслимы без подчинения их периодической законности» («Попытка химического понимания мирового эфира». 1905 г., стр. 27).
«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!! — В.Родионов) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года …» («Основы химии». VIII изд., 1906 г., стр. 613 и след.)
Скачать статью В.Г. Родионова
Настоящая таблица Менделеева. Рыбников Юрий Степанович.
Запретная Физика. Теория Эфира
Полное видео лекции тут: Фальсификация таблицы Менделеева
Источники: 1, 2, 3, 4
Из комментариев:
Для химии современной периодической таблицы элементов достаточно.
Роль эфира может быть полезна в ядерных реакциях, но и это слишком не значительно.
Учёт влияния эфира наиболее близко в явлениях распада изотопов. Однако учёт этот чрезвычайно сложен и наличие закономерностей принимаются не всеми учёными.
Самое простое доказательство наличия эфира: Явление аннигиляции позитрон-электронной пары и возникновение этой пары из вакуума, а также невозможность поймать электрон в состоянии покоя. Так же электромагнитное поле и полная аналогия между фотонами в вакууме и звуковыми волнами — фононами в кристаллах.
Так же электромагнитное поле и полная аналогия между фотонами в вакууме и звуковыми волнами — фононами в кристаллах.
Оригинал у digitall_angell
реферат на тему таблица Менделеева
ТАШКЕНТСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. ИСЛАМА КАРИМОВА Энергетический факультет САМОСТОЯТЕЛЬНАЯ РАБОТА №1 ПО ПРЕДМЕТУ : ЭЛЕКТРОТЕХНИЧЕСКИЕ МАТЕРИАЛЛЫ НА ТЕМУ « ТАБЛИЦА МЕНДЕЛЕЕВА » ВЫПОЛНИЛ : Студент: Гадаев Дилшоджон Группа: 183-19 ПРОВЕРИЛА: Иванова В.П. ТАШКЕНТ 2019 Таблица Менделеева План 1. Введение 2. Основная часть: 2.1 История открытия периодического закона и периодической системы элементов; 2.2 Периодический закон и периодическая система элементов; 2.3 Структура периодической системы: периоды, группы, подгруппы; 2.4 Периодический закон и его обоснование; 3. Выводы 4. Список используемой литературы. Я считаю, что Периодический закон и Периодическая система химических элементов Д.И. Менделеева является основой современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения. Открытие периодического закона и периодической системы химических элементов было подготовлено всем ходом истории развития химии, однако потребовалась гениальность Дмитрия Ивановича, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы. 2. Основная часть 2.1 История открытия периодического закона и периодической системы химических элементов Утверждение атомно-молекулярной теории на рубеже XIIX – XIX веков сопровождалось бурным ростом числа известных химических элементов. Только за первое десятилетие 19 века было открыто 14 новых элементов. Рекордсменом среди первооткрывателей оказался английский химик Гемфри Деви , который за один год с помощью электролиза получил 6 новых простых веществ (натрий, калий, магний, кальций, барий, стронций). А к 1830 году число известных элементов достигло 55. Существование такого количества элементов, разнородных по своим свойствам, озадачивало химиков и требовало упорядочения и систематизации элементов.
Открытие периодического закона и периодической системы химических элементов было подготовлено всем ходом истории развития химии, однако потребовалась гениальность Дмитрия Ивановича, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы. 2. Основная часть 2.1 История открытия периодического закона и периодической системы химических элементов Утверждение атомно-молекулярной теории на рубеже XIIX – XIX веков сопровождалось бурным ростом числа известных химических элементов. Только за первое десятилетие 19 века было открыто 14 новых элементов. Рекордсменом среди первооткрывателей оказался английский химик Гемфри Деви , который за один год с помощью электролиза получил 6 новых простых веществ (натрий, калий, магний, кальций, барий, стронций). А к 1830 году число известных элементов достигло 55. Существование такого количества элементов, разнородных по своим свойствам, озадачивало химиков и требовало упорядочения и систематизации элементов.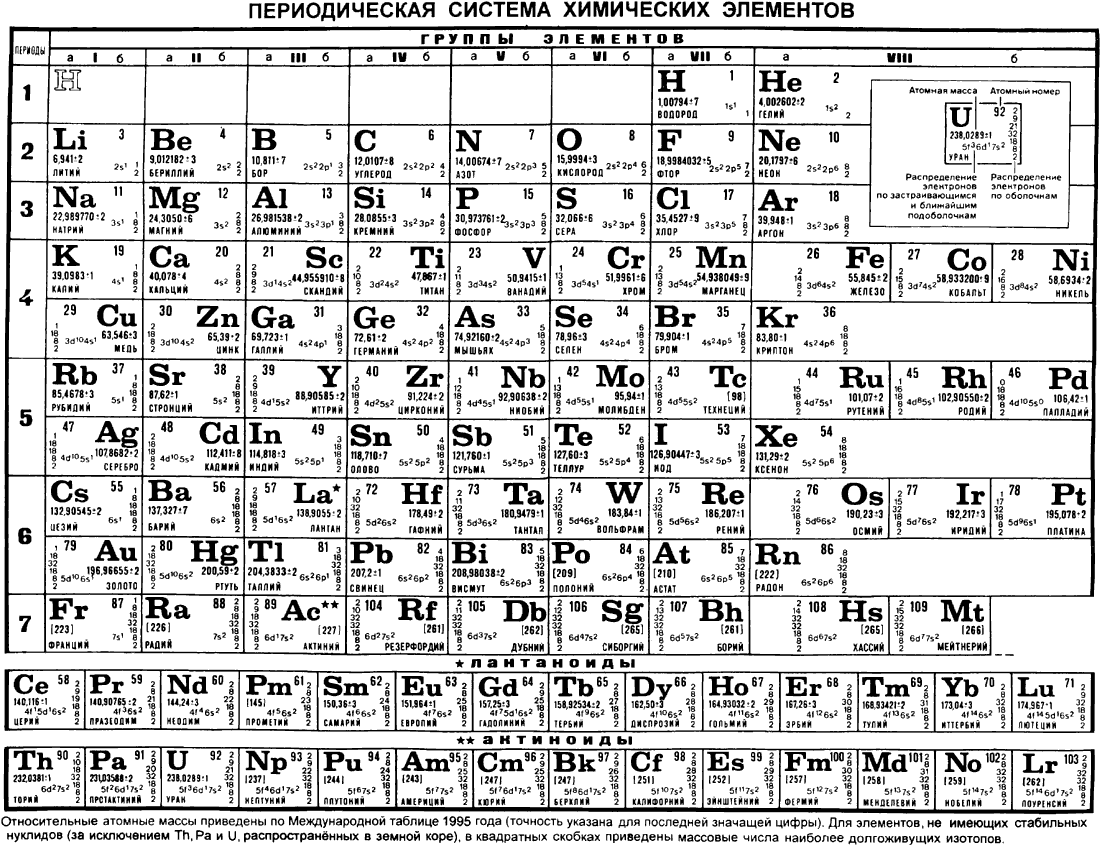 Многие учёные занимались поисками закономерностей в списке элементов и добивались определённого прогресса. Можно выделить три наиболее значительные работы, которые оспаривали приоритет открытия периодического закона у Д.И. Менделеева. В 1860 году состоялся первый Международный химический конгресс, после которого стало ясно, что основной характеристикой химического элемента является его атомный вес. Французский учёный Б. де Шанкуртуа в 1862 году впервые расположил элементы в порядке возрастания атомных весов и разместил их по спирали вокруг цилиндра. Каждый виток спирали содержал 16 элементов, сходные элементы, как правило, попадали в вертикальные столбцы, хотя были отмечены и значительные расхождения. Работа де Шанкуртуа осталась незамеченной, но выдвинутая им идея сортировки элементов в порядке возрастания атомных весов оказалась плодотворной. И двумя годами позже, руководствуясь этой идеей, английский химик Джон Ньюлендс разместил элементы в виде таблицы и заметил, что свойства элементов периодически повторяются через каждые семь номеров.
Многие учёные занимались поисками закономерностей в списке элементов и добивались определённого прогресса. Можно выделить три наиболее значительные работы, которые оспаривали приоритет открытия периодического закона у Д.И. Менделеева. В 1860 году состоялся первый Международный химический конгресс, после которого стало ясно, что основной характеристикой химического элемента является его атомный вес. Французский учёный Б. де Шанкуртуа в 1862 году впервые расположил элементы в порядке возрастания атомных весов и разместил их по спирали вокруг цилиндра. Каждый виток спирали содержал 16 элементов, сходные элементы, как правило, попадали в вертикальные столбцы, хотя были отмечены и значительные расхождения. Работа де Шанкуртуа осталась незамеченной, но выдвинутая им идея сортировки элементов в порядке возрастания атомных весов оказалась плодотворной. И двумя годами позже, руководствуясь этой идеей, английский химик Джон Ньюлендс разместил элементы в виде таблицы и заметил, что свойства элементов периодически повторяются через каждые семь номеров.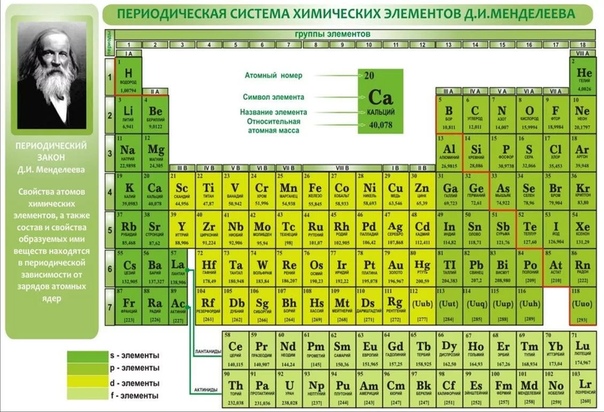 Например, хлор по свойствам похож на фтор, калий – на натрий, селен – на серу и т.д. Данную закономерность Ньюлендс назвал «законом октав», практически опередив понятие периода. Но Ньюлендс настаивал на том, что длина периода (равная семи) является неизменной, поэтому его таблица содержит не только правильные закономерности, но и случайные пары (кобальт – хлор, железо – сера и углерод – ртуть). А вот немецкий учёный Лотар Мейер в 1870 году построил график зависимости атомного объёма элементов от их атомного веса и обнаружил отчётливую периодическую зависимость, причём длина периода не совпадала с законом октав и была переменной величиной. Во всех этих работах много общего. Де Шанкуртуа, Ньюлендс и Мейер открыли проявление периодичности изменения свойств элементов в зависимости от их атомного веса. Но они не смогли создать единую периодическую систему всех элементов, поскольку в открытых ими закономерностях многие элементы не находили своего места. Никаких серьёзных выводов из своих наблюдений этим учёным так же сделать не удалось, хотя они чувствовали, что многочисленные соотношения между атомными весами элементов являются проявлением какого-то общего закона.
Например, хлор по свойствам похож на фтор, калий – на натрий, селен – на серу и т.д. Данную закономерность Ньюлендс назвал «законом октав», практически опередив понятие периода. Но Ньюлендс настаивал на том, что длина периода (равная семи) является неизменной, поэтому его таблица содержит не только правильные закономерности, но и случайные пары (кобальт – хлор, железо – сера и углерод – ртуть). А вот немецкий учёный Лотар Мейер в 1870 году построил график зависимости атомного объёма элементов от их атомного веса и обнаружил отчётливую периодическую зависимость, причём длина периода не совпадала с законом октав и была переменной величиной. Во всех этих работах много общего. Де Шанкуртуа, Ньюлендс и Мейер открыли проявление периодичности изменения свойств элементов в зависимости от их атомного веса. Но они не смогли создать единую периодическую систему всех элементов, поскольку в открытых ими закономерностях многие элементы не находили своего места. Никаких серьёзных выводов из своих наблюдений этим учёным так же сделать не удалось, хотя они чувствовали, что многочисленные соотношения между атомными весами элементов являются проявлением какого-то общего закона. Этот общий закон был открыт великим русским химиком Дмитрием Ивановичем Менделеевым в 1869 году. Менделеев сформулировал периодический закон в виде следующих основных положений: 1. Элементы, расположенные по величине атомного веса, представляют явственную периодичность свойств. 2. Должно ожидать открытия ещё многих неизвестных простых тел, например, сходных с Al и Si элементов с атомным весом 65 – 75. 3. Величина атомного веса элемента иногда может быть исправлена, зная его аналогии. Некоторые аналогии открываются по величине веса их атома. Первое положение было известно ещё до Менделеева, но именно он придал ему свойства галлия совпадают со свойствами предсказанного им экаалюминия, и сообщил Лекок де Буабодрану, что тот неверно измерил плотность галлия, которая должна быть равна 5,9-6,0 г/см3 вместо 4,7 г/см3. И действительно, более аккуратные измерения привели к правильному значению 5,904 г/см3. В 1879 году шведский химик Л. Нильсон при разделении редкоземельных элементов, полученных из минерала гадолинита, выделил новый элемент и назвал его скандием.
Этот общий закон был открыт великим русским химиком Дмитрием Ивановичем Менделеевым в 1869 году. Менделеев сформулировал периодический закон в виде следующих основных положений: 1. Элементы, расположенные по величине атомного веса, представляют явственную периодичность свойств. 2. Должно ожидать открытия ещё многих неизвестных простых тел, например, сходных с Al и Si элементов с атомным весом 65 – 75. 3. Величина атомного веса элемента иногда может быть исправлена, зная его аналогии. Некоторые аналогии открываются по величине веса их атома. Первое положение было известно ещё до Менделеева, но именно он придал ему свойства галлия совпадают со свойствами предсказанного им экаалюминия, и сообщил Лекок де Буабодрану, что тот неверно измерил плотность галлия, которая должна быть равна 5,9-6,0 г/см3 вместо 4,7 г/см3. И действительно, более аккуратные измерения привели к правильному значению 5,904 г/см3. В 1879 году шведский химик Л. Нильсон при разделении редкоземельных элементов, полученных из минерала гадолинита, выделил новый элемент и назвал его скандием. Это оказывается предсказанный Менделеевым экабор. Окончательного признания периодический закон Д.И. Менделеева добился после 1886 года, когда немецкий химик К. Винклер, анализируя серебряную руду, получил элемент, который он назвал германием. Это оказывается экасицилий. 2.2 Периодический закон и периодическая система химических элементов Периодический закон – один из важнейших законов химии. Менделеев считал, что главной характеристикой элемента является его атомная масса. Поэтому он расположил все элементы в один ряд в порядке увеличения их атомной массы. Если рассмотреть ряд элементов от Li до F, то можно увидеть, что металлические свойства элементов ослабляются, а неметаллические свойства усиливаются. Аналогично изменяются и свойства элементов в ряду от Na до Cl. Следующий знак К, как Li и Na, является типичным металлом. Высшая валентность элементов увеличивается от I y Li до V y N (кислород и фтор имеют постоянную валентность, соответственно II и I) и от I y Na до VII y Cl. Следующий элемент К, как Li и Na, имеет валентность I.
Это оказывается предсказанный Менделеевым экабор. Окончательного признания периодический закон Д.И. Менделеева добился после 1886 года, когда немецкий химик К. Винклер, анализируя серебряную руду, получил элемент, который он назвал германием. Это оказывается экасицилий. 2.2 Периодический закон и периодическая система химических элементов Периодический закон – один из важнейших законов химии. Менделеев считал, что главной характеристикой элемента является его атомная масса. Поэтому он расположил все элементы в один ряд в порядке увеличения их атомной массы. Если рассмотреть ряд элементов от Li до F, то можно увидеть, что металлические свойства элементов ослабляются, а неметаллические свойства усиливаются. Аналогично изменяются и свойства элементов в ряду от Na до Cl. Следующий знак К, как Li и Na, является типичным металлом. Высшая валентность элементов увеличивается от I y Li до V y N (кислород и фтор имеют постоянную валентность, соответственно II и I) и от I y Na до VII y Cl. Следующий элемент К, как Li и Na, имеет валентность I. В ряду оксидов от Li2O до N2O5 и гидроксидов от LiОН до HNO3 основные свойства ослабляются, а кислотные свойства усиливаются. Аналогично изменяются свойства оксидов в ряду от Na2O и NaOH до Cl2O7 и HClO4. Оксид калия К2О, как и оксиды лития и натрия Li2O и Na2O, является основным оксидом, а гидроксид калия КОН, как и гидроксиды лития и натрия LiOH и NaOH, является типичным основанием. Аналогично изменяются формы и свойства неметаллов от Ch5 до HF и от Sih5 до HCl. Такой характер свойств элементов и их соединений, какой наблюдается при увеличении атомной массы элементов, называется периодическим изменением. Свойства всех химических элементов при увеличении атомной массы изменяются периодически. Это периодическое изменение называется периодической зависимостью свойств элементов и их соединений от величины атомной массы. Поэтому Д.И. Менделеев сформулировал открытый им закон так: Свойства элементов, а так же формы и свойства соединений элементов находятся в периодической зависимости от величины атомной массы элементов.
В ряду оксидов от Li2O до N2O5 и гидроксидов от LiОН до HNO3 основные свойства ослабляются, а кислотные свойства усиливаются. Аналогично изменяются свойства оксидов в ряду от Na2O и NaOH до Cl2O7 и HClO4. Оксид калия К2О, как и оксиды лития и натрия Li2O и Na2O, является основным оксидом, а гидроксид калия КОН, как и гидроксиды лития и натрия LiOH и NaOH, является типичным основанием. Аналогично изменяются формы и свойства неметаллов от Ch5 до HF и от Sih5 до HCl. Такой характер свойств элементов и их соединений, какой наблюдается при увеличении атомной массы элементов, называется периодическим изменением. Свойства всех химических элементов при увеличении атомной массы изменяются периодически. Это периодическое изменение называется периодической зависимостью свойств элементов и их соединений от величины атомной массы. Поэтому Д.И. Менделеев сформулировал открытый им закон так: Свойства элементов, а так же формы и свойства соединений элементов находятся в периодической зависимости от величины атомной массы элементов.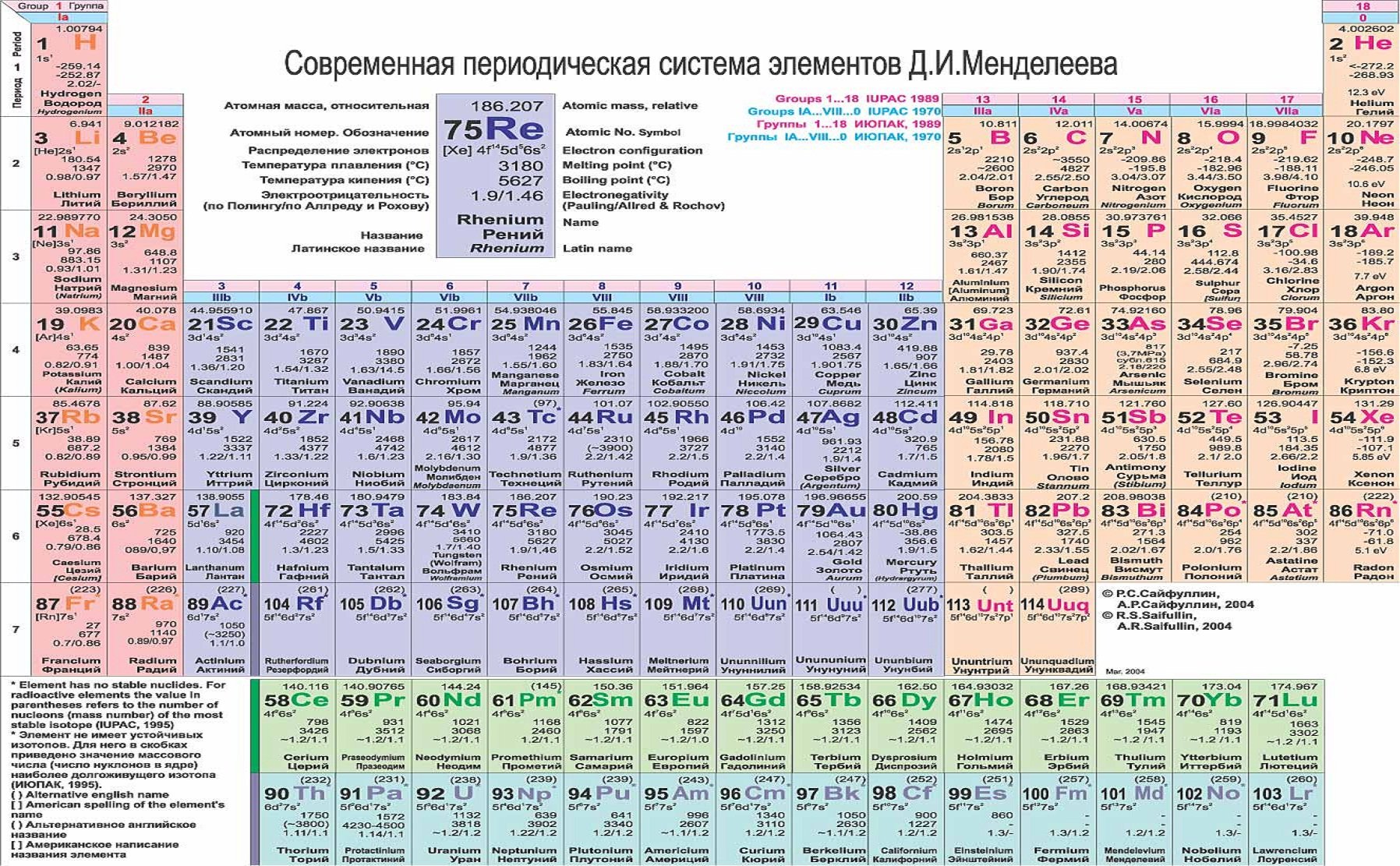 Менделеев расположил периоды элементов друг под другом и в результате составил периодическую систему элементов. Он говорил, что таблица элементов – плод не только его собственного труда, но и усилий многих химиков, среди которых он особо отмечал «укрепителей периодического закона», открывших предсказанные им элементы. Для создания современной таблицы потребовалась напряженная многолетняя работа тысяч и тысяч химиков и физиков. Если бы Менделеев был сейчас жив, он, глядя на современную таблицу элементов, вполне мог бы повторить слова английского химика Дж.У.Меллора, автора классической 16-томной энциклопедии по неорганической и теоретической химии. Закончив в 1937, после 15-летней работы, свой труд, он написал с признательностью на титульном листе: «Посвящается рядовым огромной армии химиков. Их имена забыты, их работы остались»… Периодическая система – это классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона.
Менделеев расположил периоды элементов друг под другом и в результате составил периодическую систему элементов. Он говорил, что таблица элементов – плод не только его собственного труда, но и усилий многих химиков, среди которых он особо отмечал «укрепителей периодического закона», открывших предсказанные им элементы. Для создания современной таблицы потребовалась напряженная многолетняя работа тысяч и тысяч химиков и физиков. Если бы Менделеев был сейчас жив, он, глядя на современную таблицу элементов, вполне мог бы повторить слова английского химика Дж.У.Меллора, автора классической 16-томной энциклопедии по неорганической и теоретической химии. Закончив в 1937, после 15-летней работы, свой труд, он написал с признательностью на титульном листе: «Посвящается рядовым огромной армии химиков. Их имена забыты, их работы остались»… Периодическая система – это классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона.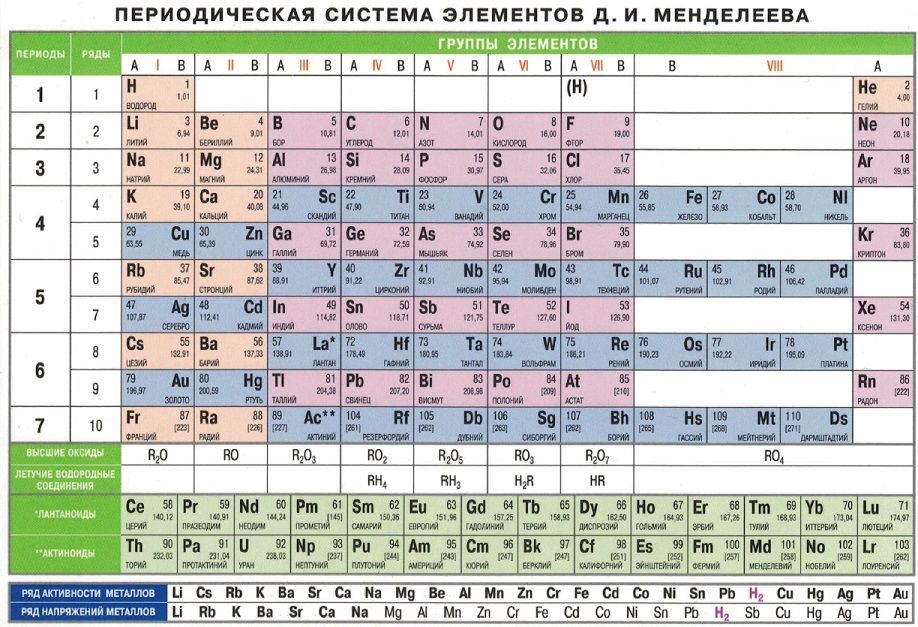 На октябрь 2009 года известно 117 химических элементов (с порядковыми номерами с 1 по 116 и 118), из них 94 обнаружены в природе (некоторые — лишь в следовых количествах). Остальные23 получены искусственно в результате ядерных реакций – это процесс превращения атомных ядер, происходящий при их взаимодействии с элементарными частицами, гамма- квантами и друг с другом, обычно приводящий к выделению колоссального количества энергии. Первые 112 элементов имеют постоянные названия, остальные — временные. Открытие 112-го элемента (самый тяжелый из официальных) признано Международным союзом теоретической и прикладной химии. Самый стабильный из известных изотопов данного элемента имеет период полураспада 34 секунды. На начало июня 2009 года носит неофициальное имя унунбий, был впервые синтезирован в феврале 1996 года на ускорителе тяжелых ионов в Институте тяжелых ионов в Дармштадте, Германия (в результате бомбардировки свинцовой мишени ядрами цинка). Первооткрыватели имеют полгода, чтобы предложить новое официальное название для добавления в таблицу (ими уже предлагались Виксхаузий, Гельмгольций, Венусий, Фриший, Штрассманий и Гейзенбергий).
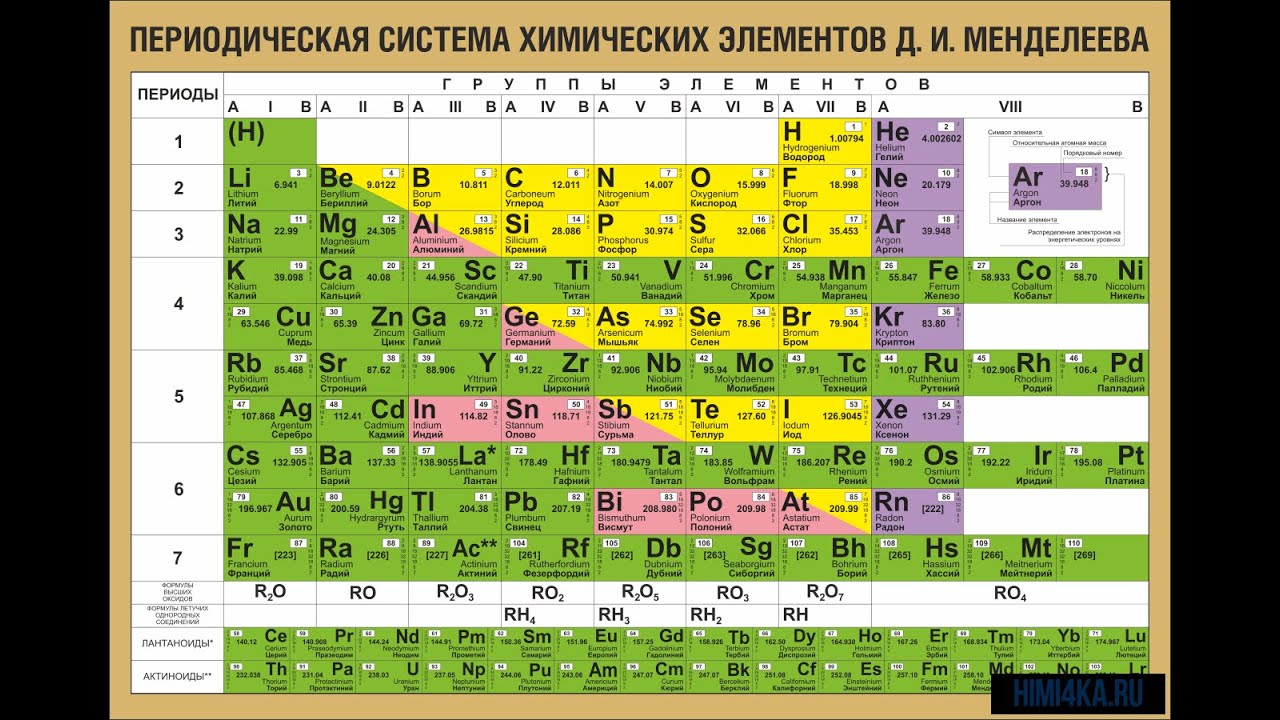
На октябрь 2009 года известно 117 химических элементов (с порядковыми номерами с 1 по 116 и 118), из них 94 обнаружены в природе (некоторые — лишь в следовых количествах). Остальные23 получены искусственно в результате ядерных реакций – это процесс превращения атомных ядер, происходящий при их взаимодействии с элементарными частицами, гамма- квантами и друг с другом, обычно приводящий к выделению колоссального количества энергии. Первые 112 элементов имеют постоянные названия, остальные — временные. Открытие 112-го элемента (самый тяжелый из официальных) признано Международным союзом теоретической и прикладной химии. Самый стабильный из известных изотопов данного элемента имеет период полураспада 34 секунды. На начало июня 2009 года носит неофициальное имя унунбий, был впервые синтезирован в феврале 1996 года на ускорителе тяжелых ионов в Институте тяжелых ионов в Дармштадте, Германия (в результате бомбардировки свинцовой мишени ядрами цинка). Первооткрыватели имеют полгода, чтобы предложить новое официальное название для добавления в таблицу (ими уже предлагались Виксхаузий, Гельмгольций, Венусий, Фриший, Штрассманий и Гейзенбергий). В настоящее время известны трансурановые элементы с номерами 113-116 и 118, полученные в Объединенном институте ядерных исследований в Дубне, однако они официально пока не признаны. Распространённее других являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды (семейство из 14 химических элементов с порядковыми номерами 58—71, расположенных в VI периоде системы) и актиноиды (семейство радиоактивных химических элементов, состоящее из актиния и 14 подобных ему по своим химическим свойствам) вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Короткая форма таблицы, содержащая восемь групп элементов, была официально отменена ИЮПАК в 1989 году.
В настоящее время известны трансурановые элементы с номерами 113-116 и 118, полученные в Объединенном институте ядерных исследований в Дубне, однако они официально пока не признаны. Распространённее других являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды (семейство из 14 химических элементов с порядковыми номерами 58—71, расположенных в VI периоде системы) и актиноиды (семейство радиоактивных химических элементов, состоящее из актиния и 14 подобных ему по своим химическим свойствам) вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Короткая форма таблицы, содержащая восемь групп элементов, была официально отменена ИЮПАК в 1989 году.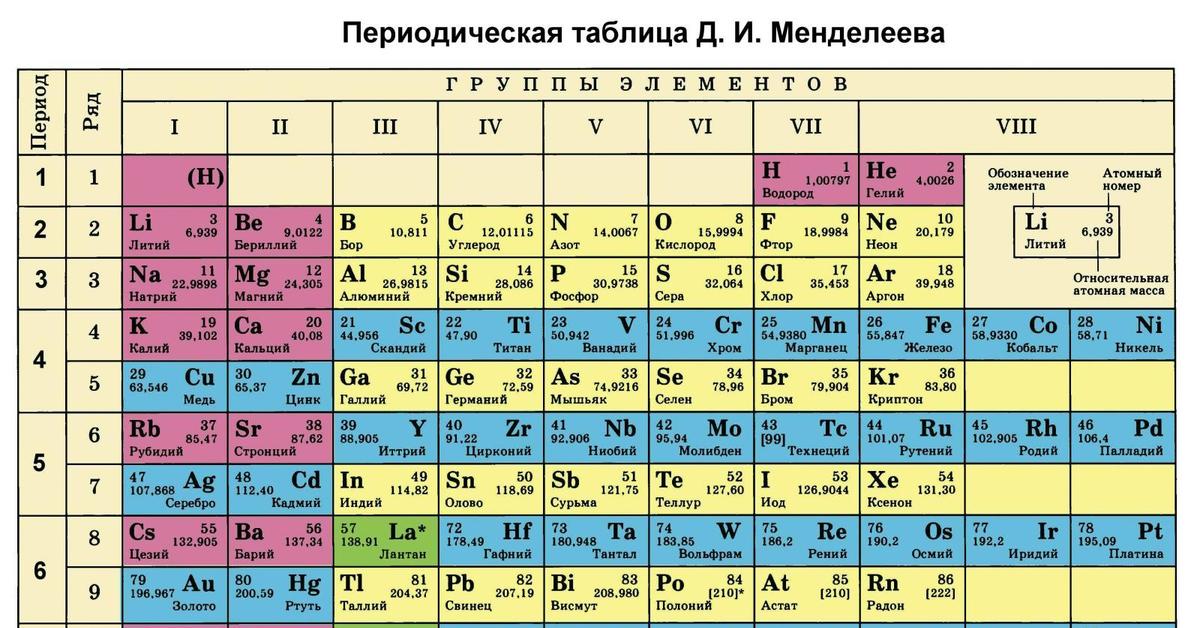 Несмотря на рекомендацию использовать длинную форму, короткая форма продолжила приводиться в большом числе российских справочников и пособий и после этого времени. Из современной иностранной литературы короткая форма исключена полностью, из двух подгрупп: главной и побочной. Главная подгруппа – А, содержит элементы малых и больших периодов. Побочная подгруппа – В, содержит элементы только больших периодов. В них входят элементы периодов, начиная с четвёртого. В главных подгруппах сверху вниз металлические свойства усиливаются, а не металлические свойства ослабляются. Все элементы побочных подгрупп являются металлами. Рис 2 Таблица Менделеева 2.4 Периодический закон и его обоснование Периодический закон позволил привести в систему и обобщить огромный объем научной информации в химии. Эту функцию закона принято называть интегративной. Особо четко она проявляется в структурировании научного и учебного материала химии. Академик А. Е. Ферсман говорил, что система объединила всю химию в рамки единой пространственной, хронологической, генетической, энергетической связи.
Несмотря на рекомендацию использовать длинную форму, короткая форма продолжила приводиться в большом числе российских справочников и пособий и после этого времени. Из современной иностранной литературы короткая форма исключена полностью, из двух подгрупп: главной и побочной. Главная подгруппа – А, содержит элементы малых и больших периодов. Побочная подгруппа – В, содержит элементы только больших периодов. В них входят элементы периодов, начиная с четвёртого. В главных подгруппах сверху вниз металлические свойства усиливаются, а не металлические свойства ослабляются. Все элементы побочных подгрупп являются металлами. Рис 2 Таблица Менделеева 2.4 Периодический закон и его обоснование Периодический закон позволил привести в систему и обобщить огромный объем научной информации в химии. Эту функцию закона принято называть интегративной. Особо четко она проявляется в структурировании научного и учебного материала химии. Академик А. Е. Ферсман говорил, что система объединила всю химию в рамки единой пространственной, хронологической, генетической, энергетической связи. Интегративная роль Периодического закона проявилась и в том, что некоторые данные об элементах, якобы выпадавшие из общих закономерностей, были проверены и уточнены как самим автором, так и его последователями. Так случилось с характеристиками бериллия. До работы Менделеева его считали трехвалентным аналогом алюминия из-за их так называемого диагонального сходства. Таким образом, во втором периоде оказывалось два трехвалентных элемента и ни одного двухвалентного. Именно на этой стадии Менделеев заподозрил ошибку в исследованиях свойств бериллия, он нашел работу российского химика Авдеева, утверждавшего, что бериллий двухвалентен и имеет атомный вес 9. Работа Авдеева оставалась не замеченной ученым миром, автор рано скончался, по-видимому, получив отравление чрезвычайно ядовитыми бериллиевыми соединениями. Результаты исследования Авдеева утвердились в науке благодаря Периодическому закону. Такие изменения и уточнения значений и атомных весов, и валентностей были сделаны Менделеевым еще для девяти элементов (In, V, Th, U, La, Ce и трех других лантаноидов).
Интегративная роль Периодического закона проявилась и в том, что некоторые данные об элементах, якобы выпадавшие из общих закономерностей, были проверены и уточнены как самим автором, так и его последователями. Так случилось с характеристиками бериллия. До работы Менделеева его считали трехвалентным аналогом алюминия из-за их так называемого диагонального сходства. Таким образом, во втором периоде оказывалось два трехвалентных элемента и ни одного двухвалентного. Именно на этой стадии Менделеев заподозрил ошибку в исследованиях свойств бериллия, он нашел работу российского химика Авдеева, утверждавшего, что бериллий двухвалентен и имеет атомный вес 9. Работа Авдеева оставалась не замеченной ученым миром, автор рано скончался, по-видимому, получив отравление чрезвычайно ядовитыми бериллиевыми соединениями. Результаты исследования Авдеева утвердились в науке благодаря Периодическому закону. Такие изменения и уточнения значений и атомных весов, и валентностей были сделаны Менделеевым еще для девяти элементов (In, V, Th, U, La, Ce и трех других лантаноидов). Еще у десяти элементов были исправлены только атомные веса. И все эти уточнения впоследствии были подтверждены экспериментально. Прогностическая (предсказательная) функция Периодического закона получила самое яркое подтверждение в открытии неизвестных элементов с порядковыми номерами 21, 31 и 32. Их существование сначала было предсказано на интуитивном уровне, но с формированием системы Менделеев с высокой степенью точности смог рассчитать их свойства. Хорошо известная история открытия скандия, галлия и германия явилась триумфом менделеевского открытия. Он все предсказания делал на основе им же самим открытого всеобщего закона природы. Всего же Менделеевым были предсказаны двенадцать элементов. С самого начала Менделеев указал, что закон описывает свойства не только самих химических элементов, но и множества их соединений. Для подтверждения этого достаточно привести такой пример. С 1929 г., когда академик П. Л. Капица впервые обнаружил неметаллическую проводимость германия, во всех странах мира началось развитие учения о полупроводниках.
Еще у десяти элементов были исправлены только атомные веса. И все эти уточнения впоследствии были подтверждены экспериментально. Прогностическая (предсказательная) функция Периодического закона получила самое яркое подтверждение в открытии неизвестных элементов с порядковыми номерами 21, 31 и 32. Их существование сначала было предсказано на интуитивном уровне, но с формированием системы Менделеев с высокой степенью точности смог рассчитать их свойства. Хорошо известная история открытия скандия, галлия и германия явилась триумфом менделеевского открытия. Он все предсказания делал на основе им же самим открытого всеобщего закона природы. Всего же Менделеевым были предсказаны двенадцать элементов. С самого начала Менделеев указал, что закон описывает свойства не только самих химических элементов, но и множества их соединений. Для подтверждения этого достаточно привести такой пример. С 1929 г., когда академик П. Л. Капица впервые обнаружил неметаллическую проводимость германия, во всех странах мира началось развитие учения о полупроводниках. Сразу стало ясно, что элементы с такими свойствами занимают главную подгруппу IV группы. Со временем пришло понимание, что полупроводниковыми свойствами должны в большей или меньшей мере обладать соединения элементов, расположенных в периодах равно удаленной от этой группы (например, с общей формулой типа АзВ). Это сразу сделало поиск новых практически важных полупроводников целенаправленным и предсказуемым. На таких соединениях основывается практически вся современная электроника. Важно отметить, что предсказания в рамках Периодической системы делались и после ее всеобщего признания. В 1913г. Мозли обнаружил, что длина волн рентгеновских лучей, которые получены от антикатодов, сделанных из разных элементов, изменяется закономерно в зависимости от порядкового номера, условно присвоенного элементам в Периодической системе. Эксперимент подтвердил, что порядковый номер элемента имеет прямой физический смысл. Лишь позднее порядковые номера были связаны со значением положительного заряда ядра.
Сразу стало ясно, что элементы с такими свойствами занимают главную подгруппу IV группы. Со временем пришло понимание, что полупроводниковыми свойствами должны в большей или меньшей мере обладать соединения элементов, расположенных в периодах равно удаленной от этой группы (например, с общей формулой типа АзВ). Это сразу сделало поиск новых практически важных полупроводников целенаправленным и предсказуемым. На таких соединениях основывается практически вся современная электроника. Важно отметить, что предсказания в рамках Периодической системы делались и после ее всеобщего признания. В 1913г. Мозли обнаружил, что длина волн рентгеновских лучей, которые получены от антикатодов, сделанных из разных элементов, изменяется закономерно в зависимости от порядкового номера, условно присвоенного элементам в Периодической системе. Эксперимент подтвердил, что порядковый номер элемента имеет прямой физический смысл. Лишь позднее порядковые номера были связаны со значением положительного заряда ядра. Зато закон Мозли позволил сразу экспериментально подтвердить число элементов в периодах и вместе с тем предсказать места еще не открытых к тому времени гафния (№ 72) и рения (№ 75). Долгое время шел спор: выделять инертные газы в самостоятельную нулевую группу элементов или считать их главной подгруппой VIII группы. Исходя из положения элементов в Периодической системе, химики- теоретики во главе с Лайнусом Полингом давно сомневались в полной химической пассивности инертных газов, напрямую указывая на возможную устойчивость их фторидов и оксидов. Но только в 1962 г. американский химик Нил Бартлетт впервые осуществил в самых обычных условиях реакцию Периодический закон и сделанные на его основе открытия в различных областях естествознания и техники являются величайшим триумфом человеческого разума, свидетельством всё более глубокого проникновения в самые сокровенные тайны природы, успешного преобразования природы на благо человека. «Редко бывает, чтобы научное открытие оказалось чем-то совершенно неожиданным, почти всегда оно предчувствуется, однако последующим поколениям, которые пользуются апробированными ответами на все вопросы, часто нелегко оценить, каких трудностей это стоило их предшественникам».
Зато закон Мозли позволил сразу экспериментально подтвердить число элементов в периодах и вместе с тем предсказать места еще не открытых к тому времени гафния (№ 72) и рения (№ 75). Долгое время шел спор: выделять инертные газы в самостоятельную нулевую группу элементов или считать их главной подгруппой VIII группы. Исходя из положения элементов в Периодической системе, химики- теоретики во главе с Лайнусом Полингом давно сомневались в полной химической пассивности инертных газов, напрямую указывая на возможную устойчивость их фторидов и оксидов. Но только в 1962 г. американский химик Нил Бартлетт впервые осуществил в самых обычных условиях реакцию Периодический закон и сделанные на его основе открытия в различных областях естествознания и техники являются величайшим триумфом человеческого разума, свидетельством всё более глубокого проникновения в самые сокровенные тайны природы, успешного преобразования природы на благо человека. «Редко бывает, чтобы научное открытие оказалось чем-то совершенно неожиданным, почти всегда оно предчувствуется, однако последующим поколениям, которые пользуются апробированными ответами на все вопросы, часто нелегко оценить, каких трудностей это стоило их предшественникам».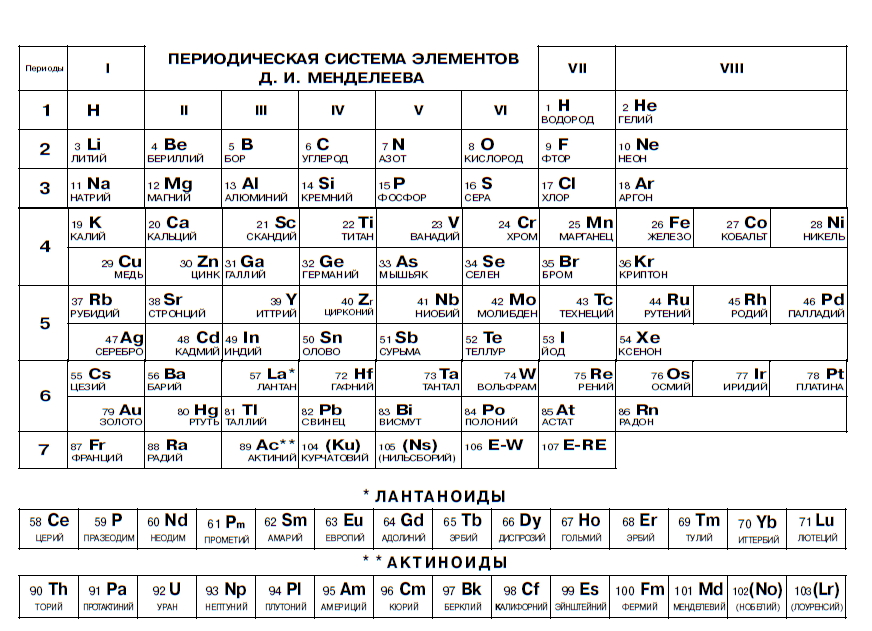 Д.И. Менделеев. 4. Список используемой литературы: 1. Глинка Н.Л.«Общая химия», Москва , изд. «Интеграл – пресс»,2002 г. 2. Ахметов Н.С. «Актуальные вопросы курса неорганической химии», Москва, изд. «Просвещение», 1991 г. 3. Макареня А.А., Рысев Ю.В, «Д.И. Менделеев», Москва, изд. «Просвещение», 1988 г. 4. Ред. Егорова А.С. «Репетитор по химии», Ростов-на-Дону, изд. «Феникс», 2006 г. 5. Кузьменко Н.Е., Ерёмин В.В., Попков В.А. «Начала химии», Москва, изд. «Экзамен», 2004 г. 6. Кошель П.А. «Большая школьная энциклопедия. 6-11 кл., Т. 2., Москва, изд. «ОЛМА – Пресс», 1999 г. 7. Авт. Сост. Савина Л.А. Я познаю мир: Детская энциклопедия: Химия, Москва, изд. «АСТ – ЛТД», 1988 г. 8. Химия. 9 класс: Учеб. Для общеобразоват. учеб. заведений. – 3-е изд., стереотип. – Москва, изд. «Дрофа», 2000 г.
Д.И. Менделеев. 4. Список используемой литературы: 1. Глинка Н.Л.«Общая химия», Москва , изд. «Интеграл – пресс»,2002 г. 2. Ахметов Н.С. «Актуальные вопросы курса неорганической химии», Москва, изд. «Просвещение», 1991 г. 3. Макареня А.А., Рысев Ю.В, «Д.И. Менделеев», Москва, изд. «Просвещение», 1988 г. 4. Ред. Егорова А.С. «Репетитор по химии», Ростов-на-Дону, изд. «Феникс», 2006 г. 5. Кузьменко Н.Е., Ерёмин В.В., Попков В.А. «Начала химии», Москва, изд. «Экзамен», 2004 г. 6. Кошель П.А. «Большая школьная энциклопедия. 6-11 кл., Т. 2., Москва, изд. «ОЛМА – Пресс», 1999 г. 7. Авт. Сост. Савина Л.А. Я познаю мир: Детская энциклопедия: Химия, Москва, изд. «АСТ – ЛТД», 1988 г. 8. Химия. 9 класс: Учеб. Для общеобразоват. учеб. заведений. – 3-е изд., стереотип. – Москва, изд. «Дрофа», 2000 г.
Периодическая таблица элементов и химия
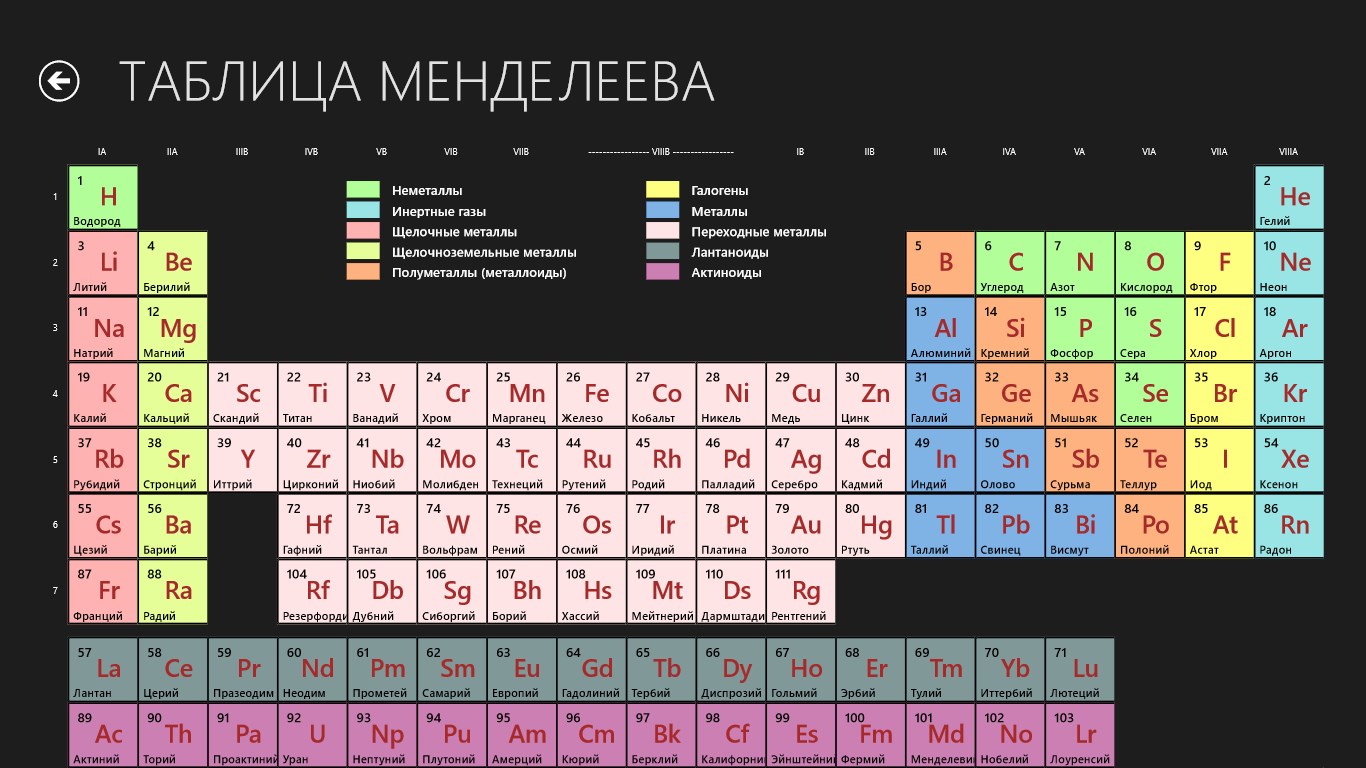
Ключ периодической таблицы
X | X | Х | Х | Щелочные металлы | Щелочноземельные металлы | Переходные металлы | Прочие металлы | Металлоиды | Прочие неметаллы | Галогены | Благородные газы | Лантаниды |
Периодическая таблица
«Если все элементы расположить в порядке их атомных весов, то получится периодическое повторение свойств.Это выражается законом периодичности».Дмитрий Менделеев, Основы химии, Том. 2, 1902, PF Collier, стр. 17. «Здесь мы имеем доказательство того, что в атоме есть фундаментальная величина, которая увеличивается правильными шагами при переходе от одного элемента к другому.
 Этой величиной может быть только заряд центрального положительного ядра, существование которого у нас уже есть определенное доказательство».
Этой величиной может быть только заряд центрального положительного ядра, существование которого у нас уже есть определенное доказательство». Генри Мозли, Philosophical Magazine, Vol. 26, 1913, стр. 1030.
Карл Саган, Космос, 1980, Рэндом Хаус, стр. 223. Фото: НАСА.
Автор: д-р Дуг Стюарт
Периодическая таблица, которой мы пользуемся сегодня, основана на таблице, разработанной и опубликованной Дмитрием Менделеевым в 1869 году.
Менделеев обнаружил, что может расположить 65 известных тогда элементов в сетке или таблице так, чтобы каждый элемент имел:
1.Более высокий атомный вес, чем тот, что слева. Например, магний (атомный вес 24,3) расположен справа от натрия (атомный вес 23,0):
Истинная основа периодической таблицы
В 1913 году химия и физика шли кувырком. Некоторые крупные ученые, в том числе Менделеев, серьезно говорили об элементах легче водорода и элементах между водородом и гелием. Визуализация атома была свободой для всех, и менделеевское обоснование периодической таблицы, основанной на атомных весах, разваливалось по швам.
Это история о том, как Генри Мозли пролил свет на тьму.
2. Сходные химические свойства с другими элементами в той же колонке – другими словами, сходные химические реакции. Магний, например, помещают в столбик щелочных земель с другими элементами, реакция которых аналогична:
. Менделеев понял, что таблица перед ним лежит в основе химии. Более того, Менделеев увидел, что его таблица была неполной — там были места, где должны были быть элементы, но их никто не открыл.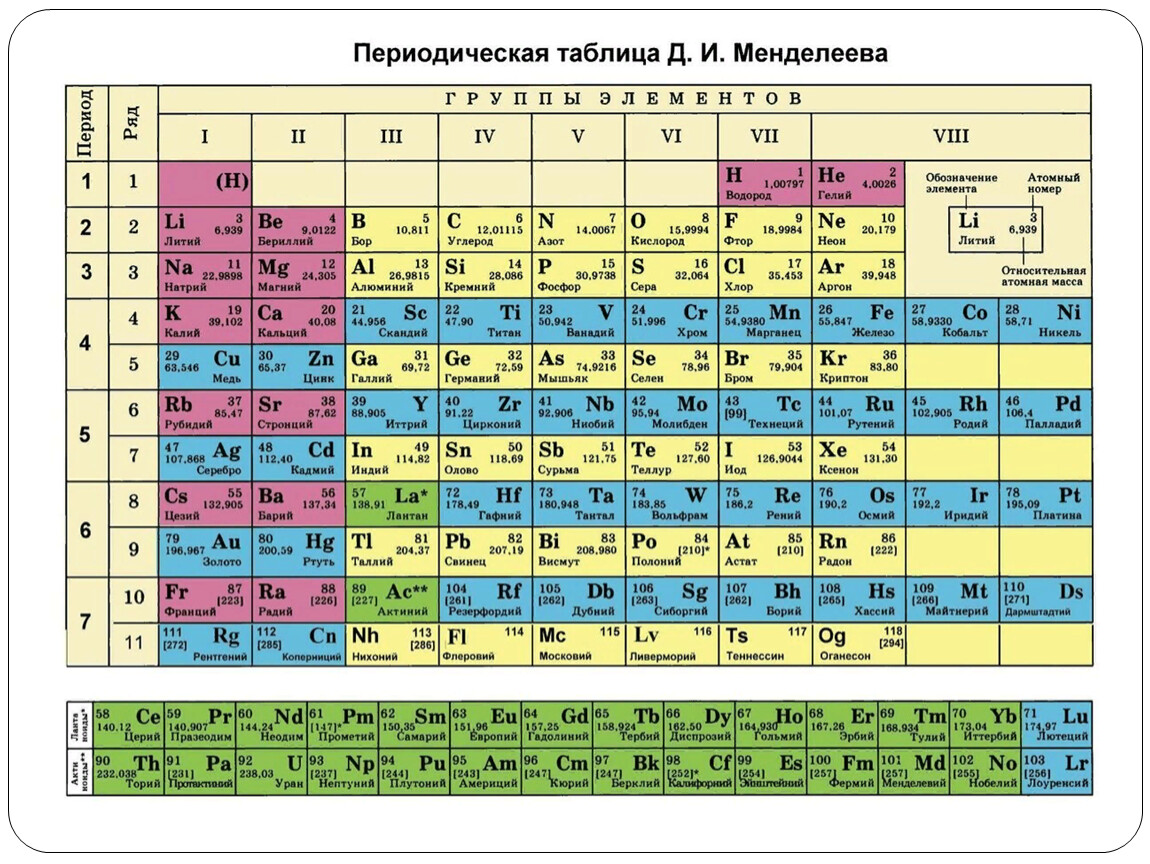
Точно так же, как можно сказать, что Адамс и Леверье открыли планету Нептун на бумаге, можно сказать, что Менделеев открыл германий на бумаге. Он назвал этот новый элемент эка-кремний после того, как заметил пробел в периодической таблице между кремнием и оловом:
.Точно так же Менделеев открыл галлий ( эка -алюминий) и скандий ( эка -бор) на бумаге, потому что он предсказал их существование и их свойства до их фактического открытия.
Изображение периодической таблицы
Нажмите на картинку, чтобы увеличить
Хотя Менделеев совершил решающий прорыв, он продвинулся немного дальше. Оглядываясь назад, мы знаем, что периодическая таблица Менделеева основывалась на ложных рассуждениях. Менделеев ошибочно полагал, что химические свойства определяются атомным весом. Конечно, это было совершенно разумно, если мы рассматриваем научное знание в 1869 году.
В 1869 году сам электрон не был открыт — этого не произошло еще 27 лет.
На самом деле понадобилось целых 44 года, чтобы найти правильное объяснение закономерностей в периодической таблице Менделеева…
Подробнее… Периодическая таблица (продолжение)
Периодической таблице элементов исполняется 150 лет | ВУВМ 89.7 FM
Может быть, вы почувствовали некую химию с 2019 годом, но не знаете почему? Может быть, потому, что в этом году исполняется 150 лет Периодической таблице элементов.Он считается основополагающим документом современной химии, который вы, возможно, изучали в школе.
UW-Madison Профессор химии Бассам Шахашири знает как историю стола, так и его современное значение. Он говорит, что таблица появилась благодаря сотрудничеству нескольких ученых, но Дмитрию Менделееву по праву принадлежит большая заслуга.
«Дмитрий Менделеев, русский химик, предложил — иногда говорят, что открыл — закономерность сходного поведения [некоторых элементов] и упорядочил их», — объясняет Шахашири.
О современном значении и о том, как меняется использование элементов, Шахашири цитирует литий (символ Li) в таблице: «Литиевые батареи очень полезны для нас. Литий также используется в медицине для различных целей. »
Шахашири также отмечает, что свинец (символ Pb) имеет менее популярный образ, чем во времена Менделеева. В настоящее время свинец часто рассматривается как загрязнитель почвы и воды.
Прочитайте полную стенограмму беседы Чака Квирмбаха и Бассама Шахашири из WUWM здесь:
Басам Шахашири: Менделеев, русский химик, читал курс, писал конспекты лекций и пытался написать книгу по неорганической химии о химических веществах. поведение веществ.И ему пришло в голову, что, возможно, существует закономерность повторяющегося сходства поведения некоторых элементов. И вот что он сделал. Он предлагал, иногда, вы знаете, люди говорят, что он открыл закономерность подобного поведения и расположил элементы в соответствии с их атомным весом. Позже оказалось, что это не так уж и правильно, но так оно и есть в науке. Мы изучаем периодическую таблицу как элементы, расположенные в соответствии с атомным номером, который является целым числом. Это количество протонов в атоме этого элемента.Таким образом, они варьируются от единицы, которая является элементом водорода, вплоть до элемента 118, который представляет собой общее количество элементов в периодической таблице на сегодняшний день,
Мы изучаем периодическую таблицу как элементы, расположенные в соответствии с атомным номером, который является целым числом. Это количество протонов в атоме этого элемента.Таким образом, они варьируются от единицы, которая является элементом водорода, вплоть до элемента 118, который представляет собой общее количество элементов в периодической таблице на сегодняшний день,
Чак Квирмбах: Он создал это и другие, которые, безусловно, могут способствовать это, они пытались обслуживать какую-то промышленность, например, производителей пушек?
Шахашири: Все люди от природы любопытны. Мы задаем вопросы, всевозможные вопросы. Знаешь, почему небо голубое? Мы делаем наблюдения и пытаемся найти смысл в этих наблюдениях, и это то, чем занимается наука.Речь идет об изучении поведения, естественного поведения и попытках описать словами, языком и символами, какой может быть модель поведения. Так что это действительно в результате любопытства. Это не должно было служить какой-либо другой цели, но любопытство ведет к открытию, а открытие ведет к применению.
Quirmbach: Какие приложения взлетели?
Шахашири: Сказочные приложения. Когда элементы были расположены на этой схеме в периодической таблице, сразу было легко увидеть, что есть недостающие элементы, которые еще не открыты, которые не идентифицированы.Таким образом, поиски продолжались, чтобы найти их, идентифицировать и охарактеризовать. Так что это было очень, очень важным следствием размещения элементов в таком организованном порядке, который мы называем периодической таблицей. Позже, когда мы добрались до так называемых тяжелых элементов, до элементов, которые имеют 92 протона и более, например, до урана. Затем, когда люди начали теоретизировать, вносить предложения, ученые говорили: может быть, мы можем синтезировать элементы, мы можем создавать новые элементы, и трансурановые элементы были синтезированы несколькими людьми.Одна группа из Калифорнийского университета в Беркли под руководством ученого Гленна Сиборга приступила к созданию новых элементов. И Гленн Сиборг предположил, что, возможно, должно быть больше элементов, о которых мы не знаем, и другие ученые, не только в Соединенных Штатах, но и в России и других странах, предприняли серьезные эксперименты, которые привели к идентификации некоторых из этих синтетических элементов. На самом деле они не были обнаружены. Они были сделаны, они были синтезированы и, что интересно, некоторые из этих тяжелых элементов не имеют длительного времени жизни, они распадаются, выделяют энергию и распадаются.Они у меня очень стабильные, у некоторых время их жизни составляет порядка секунд. И это еще одно следствие этих открытий и того, как разработать технологию для обнаружения этих преобразований, так что это просто очень, очень интригующее и очень полезное занятие. Как вы можете себе представить, это также очень сложно, но именно здесь вступает в действие награда, вознаграждающий аспект.
И Гленн Сиборг предположил, что, возможно, должно быть больше элементов, о которых мы не знаем, и другие ученые, не только в Соединенных Штатах, но и в России и других странах, предприняли серьезные эксперименты, которые привели к идентификации некоторых из этих синтетических элементов. На самом деле они не были обнаружены. Они были сделаны, они были синтезированы и, что интересно, некоторые из этих тяжелых элементов не имеют длительного времени жизни, они распадаются, выделяют энергию и распадаются.Они у меня очень стабильные, у некоторых время их жизни составляет порядка секунд. И это еще одно следствие этих открытий и того, как разработать технологию для обнаружения этих преобразований, так что это просто очень, очень интригующее и очень полезное занятие. Как вы можете себе представить, это также очень сложно, но именно здесь вступает в действие награда, вознаграждающий аспект.
Квирмбах: И напомните мне синтетические элементы, они тоже на столе, не так ли?
Шахашири: Они на столе, элементы в последней строке, которую вы видите внизу таблицы.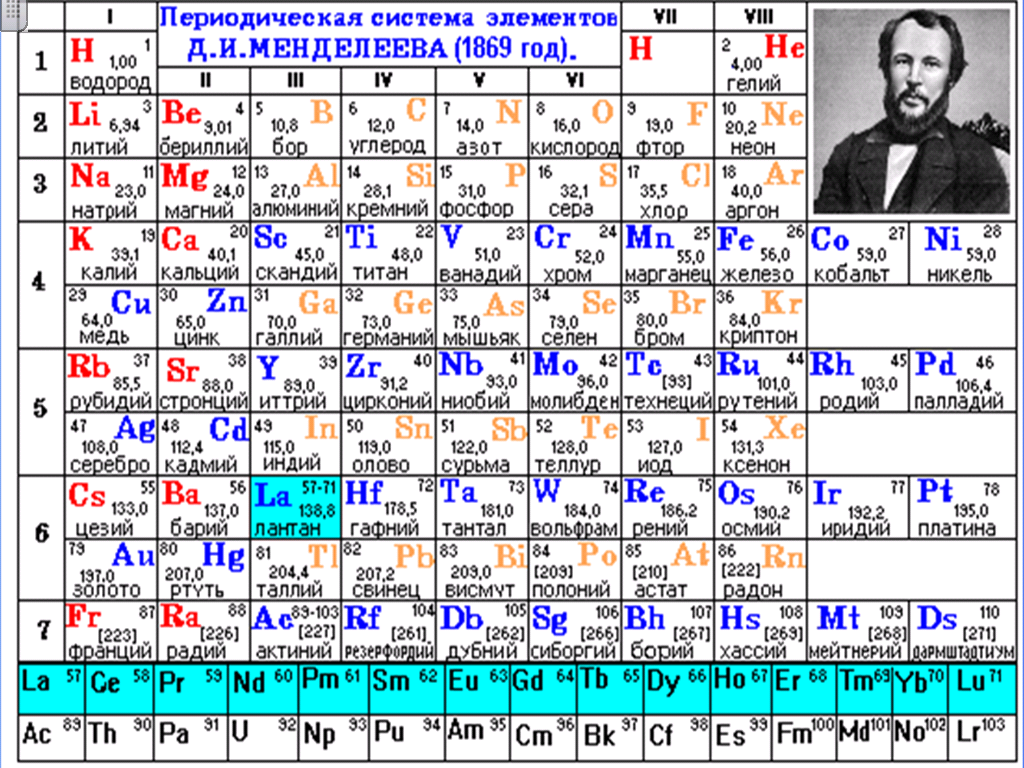 Они сделаны группами ученых, мужчин и женщин. И это еще один аспект, который я хочу включить в этот разговор. Как называются эти элементы. Первоначально элементы были названы, многие из них, большинство из них, в честь места, региона, где они были выделены и обнаружены, но с новыми синтетическими элементами эта заслуга отдается людям, которые первыми их идентифицировали. А потом идет много проверок. Есть интернациональная группа. Он называется Международный союз теоретической и прикладной химии.За этой организацией остается последнее слово по поводу названия элемента, который, по словам группы, они открыли, опять же, я намеренно использую слово «открытый», здесь они синтезируют. Но кто знает, может быть, во Вселенной некоторые из этих элементов тоже есть, но время их жизни очень короткое. Но затем Международный союз теоретической и прикладной химии, после очень тщательного изучения, принимает окончательное решение о названии элементов и, конечно же, о силе в периодической таблице в соответствии с собственным атомным номером.
Они сделаны группами ученых, мужчин и женщин. И это еще один аспект, который я хочу включить в этот разговор. Как называются эти элементы. Первоначально элементы были названы, многие из них, большинство из них, в честь места, региона, где они были выделены и обнаружены, но с новыми синтетическими элементами эта заслуга отдается людям, которые первыми их идентифицировали. А потом идет много проверок. Есть интернациональная группа. Он называется Международный союз теоретической и прикладной химии.За этой организацией остается последнее слово по поводу названия элемента, который, по словам группы, они открыли, опять же, я намеренно использую слово «открытый», здесь они синтезируют. Но кто знает, может быть, во Вселенной некоторые из этих элементов тоже есть, но время их жизни очень короткое. Но затем Международный союз теоретической и прикладной химии, после очень тщательного изучения, принимает окончательное решение о названии элементов и, конечно же, о силе в периодической таблице в соответствии с собственным атомным номером.
Quirmbach: Можно ли утверждать, что эта таблица до сих пор полезна не только учителям и классам?
Шахашири: Конечно, это полезно, но иногда учителя в классе используют его не так, как следует.Это не просто запоминание названий и символов этих элементов. Это Подумайте о моделях поведения и о том, как химические и физические свойства различных веществ, с которыми мы сталкиваемся, связаны друг с другом. Я знаю, что во многих классах, если люди говорят, что надо запомнить, я обычно говорил в своем классе, чтобы запомнить названия и символы первых 36 элементов в периодической таблице, первое задание на моих курсах химии для первокурсников UW-Madison, и студенты сказали бы, хорошо , почему я должен запоминать, и я сказал, потому что, когда вы говорите об элементе калия, вы должны знать, что он представлен символом K, а не символом P, символ P относится к фосфору.Таким образом, существуют способы, с помощью которых можно поучительно использовать периодическую таблицу как организованное средство химического поведения, чтобы учащиеся осознали ее красоту. Это то, за что я выступаю не только в своем собственном обучении, но и на семинарах, которые я провожу с учителями, с другими и с общественностью в целом. Таким образом, периодическая таблица элементов, периодическая таблица элементов могут быть использованы гораздо лучше, чем запоминание названий и символов, но знание того, что они обозначают, является идентификацией элемента.Почему символы калия K? Почему в периодической таблице элементы расположены столбцами? Какова модель поведения? Как она связана со структурой электронов вне ядра? Все виды прекрасного проявления можно различить и правильно использовать.
Это то, за что я выступаю не только в своем собственном обучении, но и на семинарах, которые я провожу с учителями, с другими и с общественностью в целом. Таким образом, периодическая таблица элементов, периодическая таблица элементов могут быть использованы гораздо лучше, чем запоминание названий и символов, но знание того, что они обозначают, является идентификацией элемента.Почему символы калия K? Почему в периодической таблице элементы расположены столбцами? Какова модель поведения? Как она связана со структурой электронов вне ядра? Все виды прекрасного проявления можно различить и правильно использовать.
Quirmbach: Давайте рассмотрим этот пример еще немного о K и калии, он больше связан по вертикали с натрием над ним или с кальцием справа от него? Другими словами, группировка более вертикальная или горизонтальная, или немного того и другого?
Шахашири: Повсюду корреляции.Это очень хороший вопрос, Чак. Шаблон, который я имел в виду, является вертикальным шаблоном. Химические свойства соединений лития, и натрия, и калия, и рубидия, и цезия очень похожи друг на друга. Есть периодическое повторение. Вот почему она называется периодической таблицей, если есть периодичность в отношениях между калием и кальцием, которая находится прямо рядом с ней на горизонтальной линии. То, что находится на горизонтальной линии, проходит через периодическую таблицу, где количество электронов начинает увеличиваться по мере того, как вы идете по таблице слева направо.И вы можете видеть, что, поскольку атомный номер отличается, атомный номер увеличивается. Поэтому количество электронов должно увеличиваться. Таким образом, прелесть периодической таблицы в том, что элементы, находящиеся в столбцах вверх и вниз, имеют схожие свойства. Но внутри группы тоже есть сходство.
Химические свойства соединений лития, и натрия, и калия, и рубидия, и цезия очень похожи друг на друга. Есть периодическое повторение. Вот почему она называется периодической таблицей, если есть периодичность в отношениях между калием и кальцием, которая находится прямо рядом с ней на горизонтальной линии. То, что находится на горизонтальной линии, проходит через периодическую таблицу, где количество электронов начинает увеличиваться по мере того, как вы идете по таблице слева направо.И вы можете видеть, что, поскольку атомный номер отличается, атомный номер увеличивается. Поэтому количество электронов должно увеличиваться. Таким образом, прелесть периодической таблицы в том, что элементы, находящиеся в столбцах вверх и вниз, имеют схожие свойства. Но внутри группы тоже есть сходство.
Quirmbach: Вы когда-нибудь задумывались о том, как образы или популярные образы некоторых из этих элементов изменились за эти годы. Я думаю, что, например, свинец и фосфор в наши дни часто рассматриваются как загрязнители воды и других мест. Литий, о котором в детстве я мало что знал, теперь мы слышим о большом количестве лития, используемого в батареях. Это хороший способ взглянуть на эту таблицу, в которой элементы часто менялись, использовались и отображались?
Литий, о котором в детстве я мало что знал, теперь мы слышим о большом количестве лития, используемого в батареях. Это хороший способ взглянуть на эту таблицу, в которой элементы часто менялись, использовались и отображались?
Шахашири: Что ж, наше собственное сознание меняется, и это снова возвращается к тому, что происходит в классе и что происходит также в популяризации понимания науки. Итак, литиевые аккумуляторы нам очень пригодятся. Литий также используется в медицине для различных целей.Свинец на моем веб-сайте saifan.org содержит одностраничное описание свойств свинца. Свинец – коварное вещество. Таким образом, понимание свойств, полезности и опасностей является очень важной частью того, что мы делаем в науке и что мы делаем в обществе. Так что очень важно, чтобы мы задали вопрос, почему левая нога была в бензине в первую очередь? Именно для улучшения детонации в двигатели ввели антидетонационные присадки. Но потом мы обнаружили, что это имеет очень плохие последствия для окружающей среды и здоровья.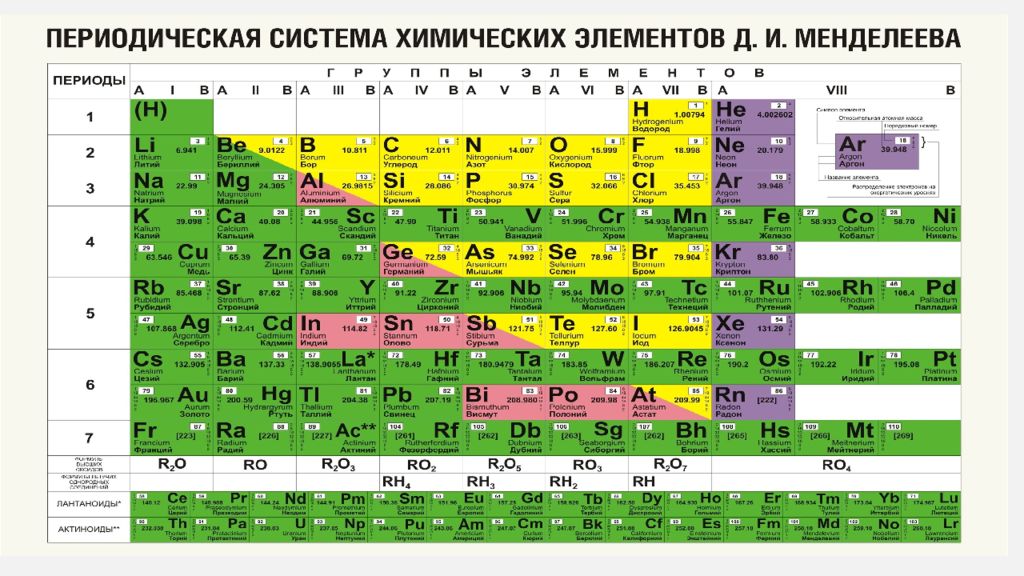 Таким образом, лозунг был таков: убери лидерство и найди других заменителей. Периодические таблицы можно найти много хорошего. И всем нам интересно задавать вопросы, которые вы здесь задаете.
Таким образом, лозунг был таков: убери лидерство и найди других заменителей. Периодические таблицы можно найти много хорошего. И всем нам интересно задавать вопросы, которые вы здесь задаете.
Квирмбах: Что ж, почти мой последний вопрос: сейчас мы на 118. Знаете ли вы, что может быть добавлено больше других людей, пытающихся синтезировать больше. Все они будут синтетическими или будут добавлены так называемые натуральные?
Шахашири: Что ж, это было одно из предсказаний, сделанных Гленном Сиборгом, его группой и другими не одному человеку.что может быть другой набор, другой ряд элементов, атомный номер которых очень, очень большой, может быть, вы знаете, вплоть до 137, может быть, даже выше этого, который был бы стабильным, но не был обнаружен пока еще не синтезированы. Это то, о чем мы все должны подумать и дать возможность ученым, которые являются специалистами в этих областях, и оказать им поддержку, обдумывать и разрабатывать эксперименты, методы и технологии для исследования прекрасного сложного мира, в котором мы живем.
Квирмбах: Потому что между 118 и 137 может быть что-то очень ценное, излечивающее множество проблем, как вы надеетесь?
Шахашири: Кто знает, вот почему мы проводим эксперименты, чтобы удовлетворить наше любопытство, и когда мы делаем открытия, я искренне надеюсь и желаю, чтобы мы использовали эти открытия с пользой. Как только вы что-то открываете, вы должны принять решение о том, как использовать это с пользой, и я надеюсь и искренне желаю, чтобы все научно-технические открытия использовались с пользой.
Поддержка предоставляется доктором Лоуренсом и миссис Ханной Гудман в области отчетности по инновациям.
У вас есть вопрос об инновациях в Висконсине, который вы хотели бы обсудить с Чаком Квирмбахом из WUWM? Отправьте его ниже.
_
Когда мы достигнем конца таблицы Менделеева? | Наука
Сколько еще мест осталось за столом? JDawnInk/iStock Учителям химии недавно пришлось обновить декор своих классов, объявив, что ученые подтвердили открытие четырех новых элементов в периодической таблице. Пока еще не названные элементы 113, 115, 117 и 118 заполнили оставшиеся пробелы в нижней части знаменитой схемы — дорожной карты строительных блоков материи, которая успешно служила химикам почти полтора века.
Пока еще не названные элементы 113, 115, 117 и 118 заполнили оставшиеся пробелы в нижней части знаменитой схемы — дорожной карты строительных блоков материи, которая успешно служила химикам почти полтора века.
Официальное подтверждение, предоставленное Международным союзом теоретической и прикладной химии (IUPAC), готовилось годами, поскольку эти сверхтяжелые элементы очень нестабильны и их сложно создать. Но у ученых были веские основания полагать, что они существуют, отчасти потому, что периодическая таблица до сих пор была удивительно последовательной.Попытки создать элементы 119 и 120, которые будут начинать новую строку, уже предпринимаются.
Но точное количество элементов остается одной из самых постоянных загадок химии, тем более что наше современное понимание физики выявило аномалии даже у опытных игроков.
«В периодической таблице начинают появляться трещины, — говорит Уолтер Лавленд, химик из Университета штата Орегон.
Современное воплощение периодической таблицы элементов организовано по строкам на основе атомного номера — числа протонов в ядре атома — и по столбцам на основе орбит их самых удаленных электронов, которые, в свою очередь, обычно определяют их личности. Мягкие металлы, склонные к сильным реакциям с другими, например литий и калий, живут в одном столбце. Неметаллические реактивные элементы, такие как фтор и йод, обитают в другом.
Мягкие металлы, склонные к сильным реакциям с другими, например литий и калий, живут в одном столбце. Неметаллические реактивные элементы, такие как фтор и йод, обитают в другом.
Французский геолог Александр-Эмиль Бегуйе де Шанкуртуа был первым, кто понял, что элементы могут быть сгруппированы в повторяющиеся структуры. Он изобразил элементы, известные в 1862 году, упорядоченные по их весу, в виде спирали, обернутой вокруг цилиндра ( см. иллюстрацию ниже ). Элементы, расположенные вертикально на одной линии друг с другом на этом цилиндре, имели сходные характеристики.
Но именно организационная схема, созданная Дмитрием Менделеевым, вспыльчивым русским, утверждавшим, что видел во сне группы элементов, выдержала испытание временем. Его периодическая таблица 1871 года не была идеальной; например, он предсказал восемь элементов, которых не существует. Однако он также правильно предсказал галлий (теперь используемый в лазерах), германий (теперь используемый в транзисторах) и другие все более тяжелые элементы.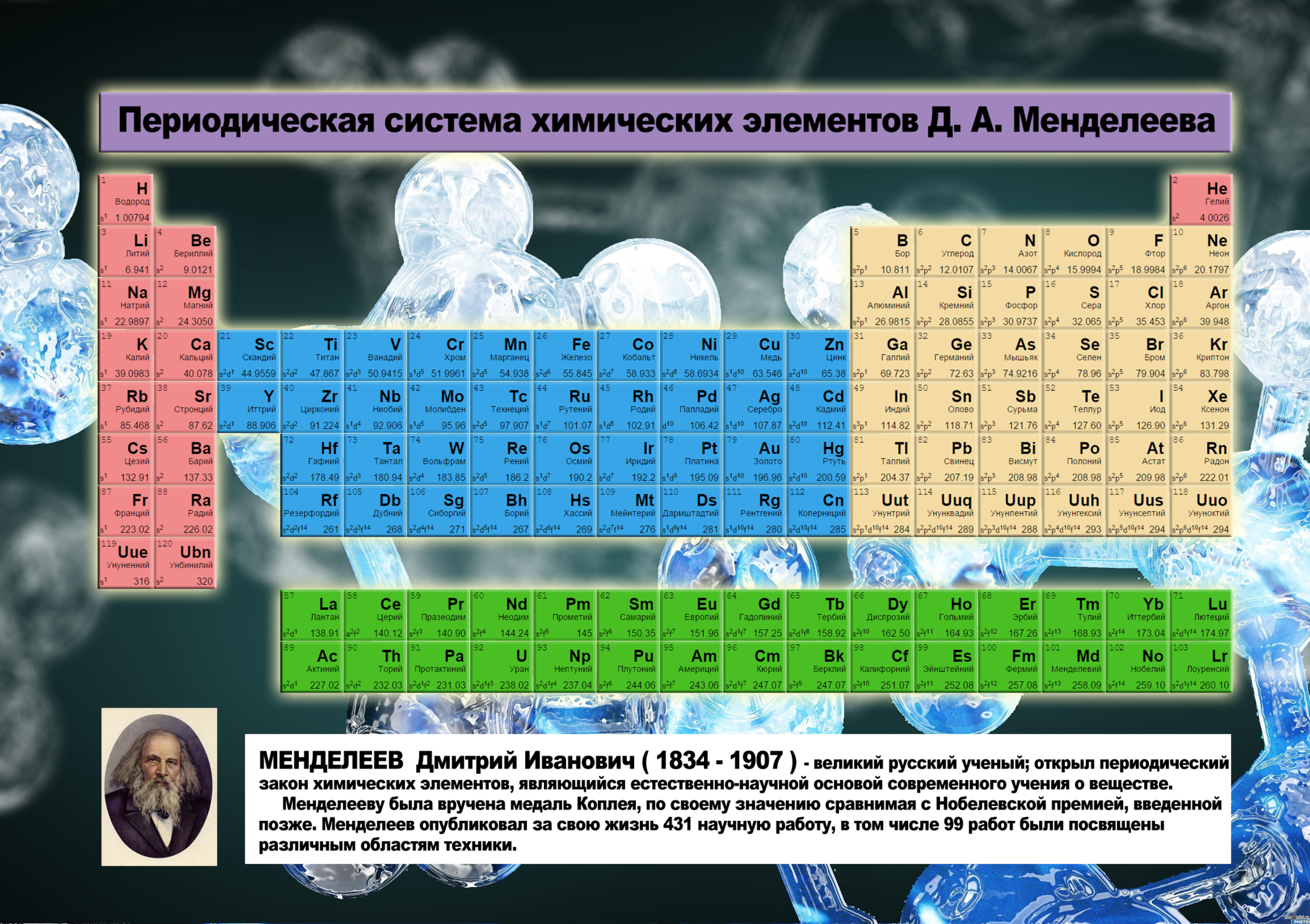
Периодическая таблица Менделеева легко приняла совершенно новую колонку для благородных газов, таких как гелий, которые ускользали от обнаружения до конца 19-го века из-за их склонности не реагировать с другими элементами.
Современная периодическая таблица более или менее согласуется с квантовой физикой, введенной в 20-м веке для объяснения поведения субатомных частиц, таких как протоны и электроны. Кроме того, группы в основном сохранились, поскольку были подтверждены более тяжелые элементы. Борий, название, данное элементу 107 после его открытия в 1981 году, настолько хорошо сочетается с другими так называемыми переходными металлами, которые его окружают, что один из исследователей, открывших его, заявил, что «борий скучен.
Но впереди могут быть интересные времена.
Один открытый вопрос касается лантана и актиния, которые имеют меньше общего с другими членами соответствующих групп, чем лютеций и лоуренсий. IUPAC недавно назначил целевую группу для изучения этого вопроса.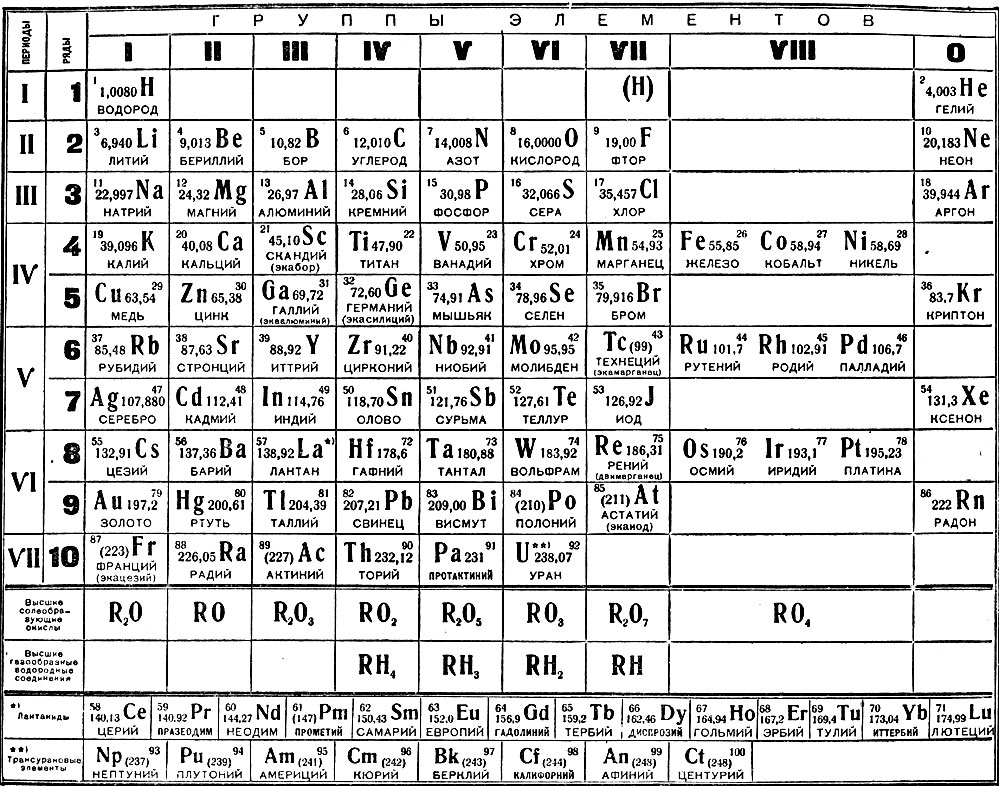 Даже гелий, элемент 2, не является простым — существует альтернативная версия периодической таблицы, в которой гелий помещается с бериллием и магнием вместо его соседей из инертных газов, исходя из расположения всех его электронов, а не только самых удаленных.
Даже гелий, элемент 2, не является простым — существует альтернативная версия периодической таблицы, в которой гелий помещается с бериллием и магнием вместо его соседей из инертных газов, исходя из расположения всех его электронов, а не только самых удаленных.
«В начале, середине и конце периодической таблицы есть проблемы», — говорит Эрик Шерри, историк с химического факультета Калифорнийского университета в Лос-Анджелесе.
Специальная теория относительности Эйнштейна, опубликованная спустя десятилетия после таблицы Менделеева, также внесла в систему некоторые пробелы. Согласно теории относительности, масса частицы увеличивается с увеличением ее скорости. Это может привести к тому, что отрицательно заряженные электроны, вращающиеся вокруг положительно заряженного ядра атома, будут вести себя странно, влияя на свойства элемента.
Рассмотрим золото: ядро состоит из 79 положительных протонов, поэтому, чтобы не упасть внутрь, электроны золота должны вращаться со скоростью, превышающей половину скорости света.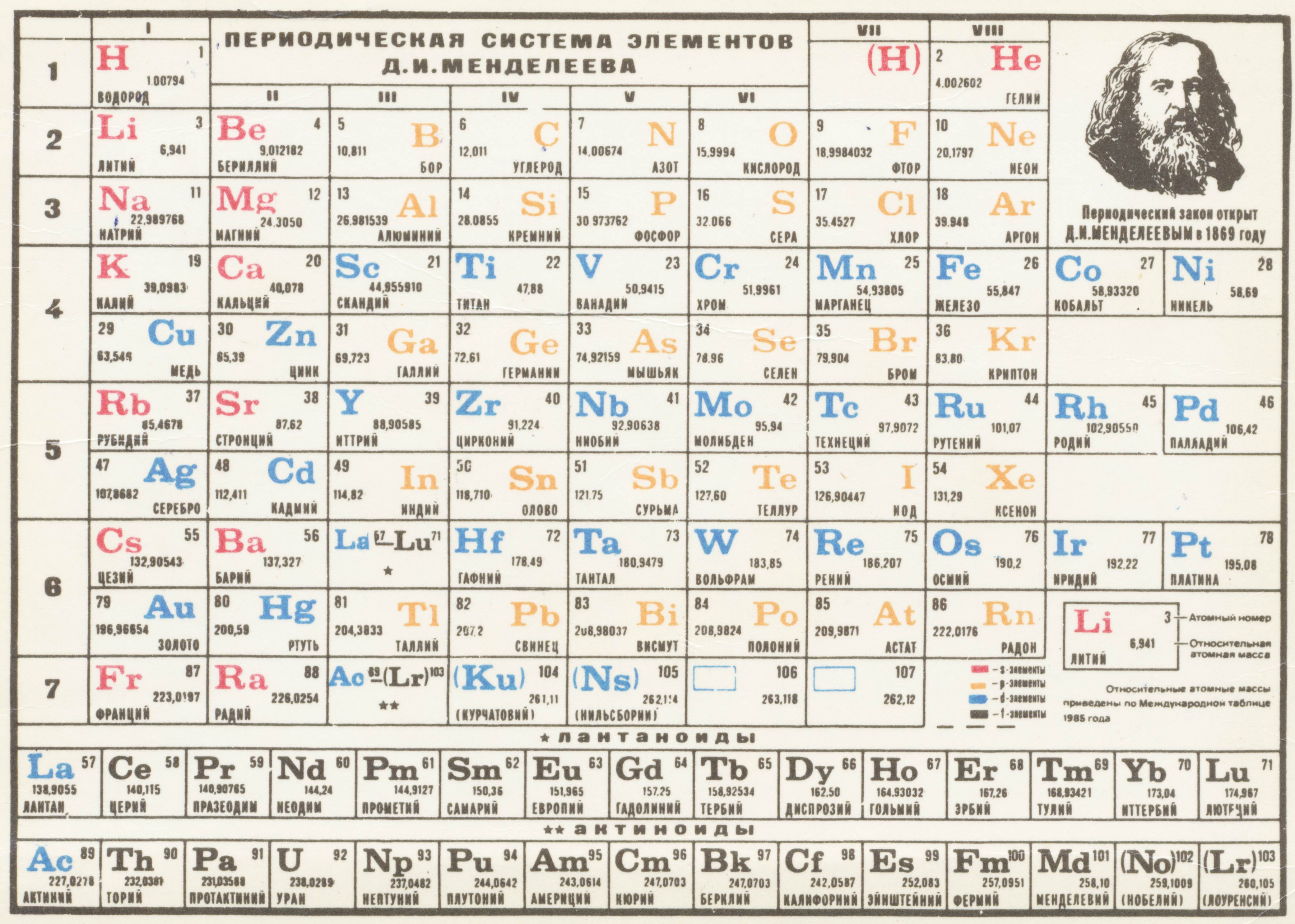 Это делает их более массивными и вытягивает на более узкую орбиту с более низкой энергией. В этой конфигурации электроны поглощают синий свет, а не отражают его, придавая обручальным кольцам характерный блеск.
Это делает их более массивными и вытягивает на более узкую орбиту с более низкой энергией. В этой конфигурации электроны поглощают синий свет, а не отражают его, придавая обручальным кольцам характерный блеск.
Говорят, что печально известный физик, играющий на бонго, Ричард Фейнман , использовал теорию относительности, чтобы предсказать конец периодической таблицы на элементе 137.Для Фейнмана число 137 было «магическим числом» — оно появилось без всякой видимой причины в других областях физики. Его расчеты показали, что электроны в элементах выше 137 должны двигаться быстрее скорости света и, таким образом, нарушать правила относительности, чтобы избежать столкновения с ядром.
Более поздние расчеты с тех пор отменили это ограничение. Фейнман рассматривал ядро как единую точку. Пусть это будет шар из частиц, и элементы могут продолжать существовать примерно до 173. Тогда начинается ад.Атомы за этим пределом могут существовать, но только как странные существа, способные вызывать электроны из пустого пространства.
Относительность — не единственная проблема. Положительно заряженные протоны отталкиваются друг от друга, поэтому чем больше вы упаковываете ядро, тем менее стабильным оно становится. Уран с атомным номером 92 является последним элементом, достаточно стабильным, чтобы встречаться в природе на Земле. У каждого элемента за его пределами есть ядро, которое быстро распадается, а их периоды полураспада — время, необходимое для распада половины материала, — могут составлять минуты, секунды или даже доли секунды.
Более тяжелые и нестабильные элементы могут существовать где-то еще во Вселенной, например внутри плотных нейтронных звезд, но ученые могут изучать их здесь, только сталкивая более легкие атомы, чтобы получить более тяжелые, а затем просеивая цепочку распада.
«Мы действительно не знаем, какой самый тяжелый элемент может существовать», — говорит физик-ядерщик Витольд Назаревич из Мичиганского государственного университета.
Теория предсказывает, что наступит момент, когда наши ядра, созданные в лаборатории, не будут жить достаточно долго, чтобы сформировать настоящий атом.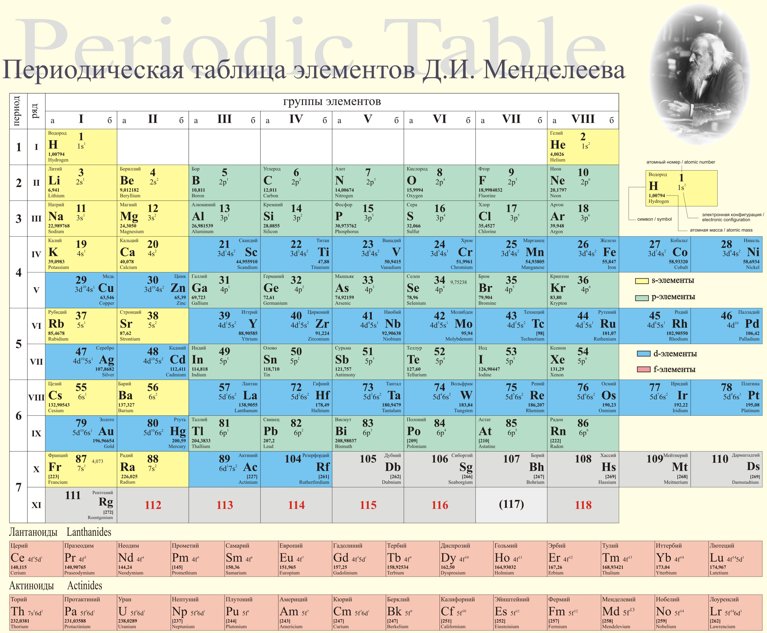 Радиоактивное ядро, которое распадается менее чем за десять триллионных долей секунды, не успеет собрать вокруг себя электроны и создать новый элемент.
Радиоактивное ядро, которое распадается менее чем за десять триллионных долей секунды, не успеет собрать вокруг себя электроны и создать новый элемент.
Тем не менее, многие ученые ожидают, что в дальнейшем будут существовать островки стабильности, где сверхтяжелые элементы имеют относительно долгоживущие ядра. Загрузка некоторых сверхтяжелых атомов большим количеством дополнительных нейтронов может обеспечить стабильность, предотвращая деформацию ядер, богатых протонами. Например, ожидается, что элемент 114 будет иметь магически стабильное число нейтронов — 184.Также было предсказано, что элементы 120 и 126 могут быть более долговечными.
Но некоторые заявления о сверхтяжелой стабильности уже развалились. В конце 1960-х химик Эдвард Андерс предположил, что ксенон в метеорите, упавшем на мексиканскую землю, появился в результате распада загадочного элемента между 112 и 119, который был бы достаточно стабилен, чтобы встречаться в природе. Потратив годы на сужение своего поиска, он в конце концов отказался от своей гипотезы в 1980-х годах.
Предсказать потенциальную стабильность тяжелых элементов непросто.Расчеты, требующие огромных вычислительных мощностей, не проводились для многих известных игроков. И даже если они это сделают, это совершенно новая область для ядерной физики, где даже небольшие изменения во входных данных могут оказать сильное влияние на ожидаемые результаты.
Одно можно сказать наверняка: создание каждого нового элемента будет становиться все труднее не только потому, что короткоживущие атомы труднее обнаружить, но и потому, что для создания сверхтяжелых атомов могут потребоваться пучки атомов, которые сами по себе радиоактивны.Независимо от того, наступит конец периодической таблицы или нет, может наступить конец нашей способности создавать новые.
«Я думаю, что мы очень далеко от конца таблицы Менделеева, — говорит Шерри. «Ограничивающим фактором сейчас, кажется, является человеческая изобретательность».
Примечание редактора: Исправлена принадлежность Витольда Назаревича.
Периодическая таблица Рекомендуемая литература
Сказка о семи элементах
КупитьАвторитетный отчет о ранней истории периодической таблицы можно найти в книге Эрика Шерри «Повесть о семи элементах» , в которой подробно рассматриваются споры, связанные с открытием семи элементов.
Периодическая таблица
КупитьЧитатели, интересующиеся Холокостом, должны взять копию трогательных мемуаров Примо Леви, Периодическая таблица. Кроме того, убедительную автобиографию, в которой периодическая таблица описывает жизнь одного из самых любимых в мире неврологов, см. в статье Оливера Сакса New York Times «Моя периодическая таблица ».
Исчезающая ложка: и другие правдивые рассказы о безумии, любви и истории мира из Периодической таблицы элементов
Купить Сэм Кин отправляет своих читателей в живую и хаотичную возню сквозь стихии в «Исчезающая ложка».
Потерянные элементы: теневая сторона периодической таблицы
КупитьНаучные энтузиасты, интересующиеся бейсболом, стоящим за элементами, которые никогда не попадали в периодическую таблицу, могут ознакомиться с хорошо изученным The Lost Elements Марко Фонтани, Мариагразией Коста и Мэри Вирджинией Орной.
ХимияРекомендуемые видео
Не пора ли перевернуть периодическую таблицу?
Лотар Мейер, немецкий химик, создал частичную периодическую таблицу в 1864 году и более полную версию в 1869 году.«Структурно таблицы Мейера и Менделеева были очень похожи», — сказал Алан Рок, историк науки из Университета Кейс Вестерн Резерв, который выступил с докладом о Мейере в A.C.S. юбилейный симпозиум.
Поначалу периодичность таблицы и ее замечательные предсказательные способности казались «нумерологической загадкой», — сказал доктор Рок. В 20-м веке периодичность стала объясняться квантовой физикой — в частности, физикой того, как электроны вращаются вокруг ядра. Литий, натрий и калий, которые хорошо выровнены в первом вертикальном столбце таблицы — первая группа, щелочные металлы, рубидий, цезий и франций — все имеют один электрон на своей внешней электронной оболочке.
В 20-м веке периодичность стала объясняться квантовой физикой — в частности, физикой того, как электроны вращаются вокруг ядра. Литий, натрий и калий, которые хорошо выровнены в первом вертикальном столбце таблицы — первая группа, щелочные металлы, рубидий, цезий и франций — все имеют один электрон на своей внешней электронной оболочке.
Оба химика за многие годы составили множество таблиц, корректируя их в соответствии с новыми открытиями и более точными данными. В конце концов Менделеев победил. Когда в шаблонах его таблиц появлялись пробелы, он предсказывал, что должно появиться. Некоторые ошибались, но он точно предсказал существование трех элементов: галлия, германия и скандия.
«Предсказания психологически драматичны, — сказал доктор Шерри. «Если ученый что-то предсказывает, и это сбывается, в некотором смысле этот ученый знает тайны природы или почти знает будущее.
Но наука редко продвигается революционным путем, сказал д-р Шерри: «Наука — это деятельность, осуществляемая сотнями тысяч исследователей, каждый из которых вносит свой вклад в общую картину, которая в конечном итоге возникает».
Это была тема юбилейного симпозиума. Бриджит Ван Тиггелен, историк химии из Института истории науки в Филадельфии, обсудила работу Иды Ноддак, немецкого химика, открывшего рений, и Лизы Мейтнер, австрийско-шведского физика, которая вместе с Отто Ганом открыла протактиний.Доктор Ван Тиггелен является редактором новой книги «Женщины в своей стихии», в которой исследуется более 30 подобных историй, в том числе, конечно же, история Марии Кюри, которая открыла два элемента, радий и полоний, и дважды выиграла премию. Нобелевская премия.
«Мы представляем эту историю как коллективное предприятие, — сказал доктор Ван Тиггелен.
До свидания, алхимия
Среди множества достижений периодическая таблица позволила химии окончательно избавиться от порока алхимии. Ньютон мало чем мог помочь в этом отношении: он был одержим «химией» — синонимом алхимии, согласно Оксфордскому словарю английского языка, — и идентификацией философского камня, который превращал неблагородные металлы в золото.
Chem4Kids.com: Элементы и периодическая таблица: Периодическая таблица
Периодическая таблица организована как большая сетка. Каждый элемент размещается в определенном месте из-за его атомарной структуры. Как и в любой сетке, в периодической таблице есть строки (слева направо) и столбцы (сверху и снизу). Каждая строка и столбец имеют определенные характеристики. Например, магний (Mg) и кальций (Mg) находятся во втором столбце и имеют определенное сходство, в то время как калий (K) и кальций (Ca) в четвертом ряду имеют разные характеристики.Магний и натрий (Na) также имеют общие свойства, потому что находятся в одном и том же периоде (сходные электронные конфигурации). Несмотря на то, что они пропускают некоторые квадраты между ними, все строки читаются слева направо. Когда вы смотрите на периодическую таблицу, каждая строка называется периодом (Понятно? Как таблица PERIODic.). Все элементы периода имеют одинаковое число атомных орбиталей.
 Например, каждый элемент в верхнем ряду (первый период) имеет одну орбиталь для своих электронов. Все элементы во втором ряду (второй период) имеют две орбитали для своих электронов.По мере продвижения вниз по таблице каждая строка добавляет орбиталь. В это время существует максимум семь электронных орбиталей. Теперь вы знаете о периодах, идущих слева направо. Периодическая таблица также имеет специальное название для своих вертикальных столбцов. Каждый столбец называется группой . Элементы в каждой группе имеют одинаковое количество электронов на внешней орбитали . Эти внешние электроны также называются валентными электронами . Это электроны, участвующие в химических связях с другими элементами.
Например, каждый элемент в верхнем ряду (первый период) имеет одну орбиталь для своих электронов. Все элементы во втором ряду (второй период) имеют две орбитали для своих электронов.По мере продвижения вниз по таблице каждая строка добавляет орбиталь. В это время существует максимум семь электронных орбиталей. Теперь вы знаете о периодах, идущих слева направо. Периодическая таблица также имеет специальное название для своих вертикальных столбцов. Каждый столбец называется группой . Элементы в каждой группе имеют одинаковое количество электронов на внешней орбитали . Эти внешние электроны также называются валентными электронами . Это электроны, участвующие в химических связях с другими элементами. Каждый элемент в первом столбце (группа один) имеет один электрон на внешней оболочке. Каждый элемент во втором столбце (вторая группа) имеет два электрона на внешней оболочке. Продолжая считать столбцы, вы узнаете, сколько электронов находится во внешней оболочке.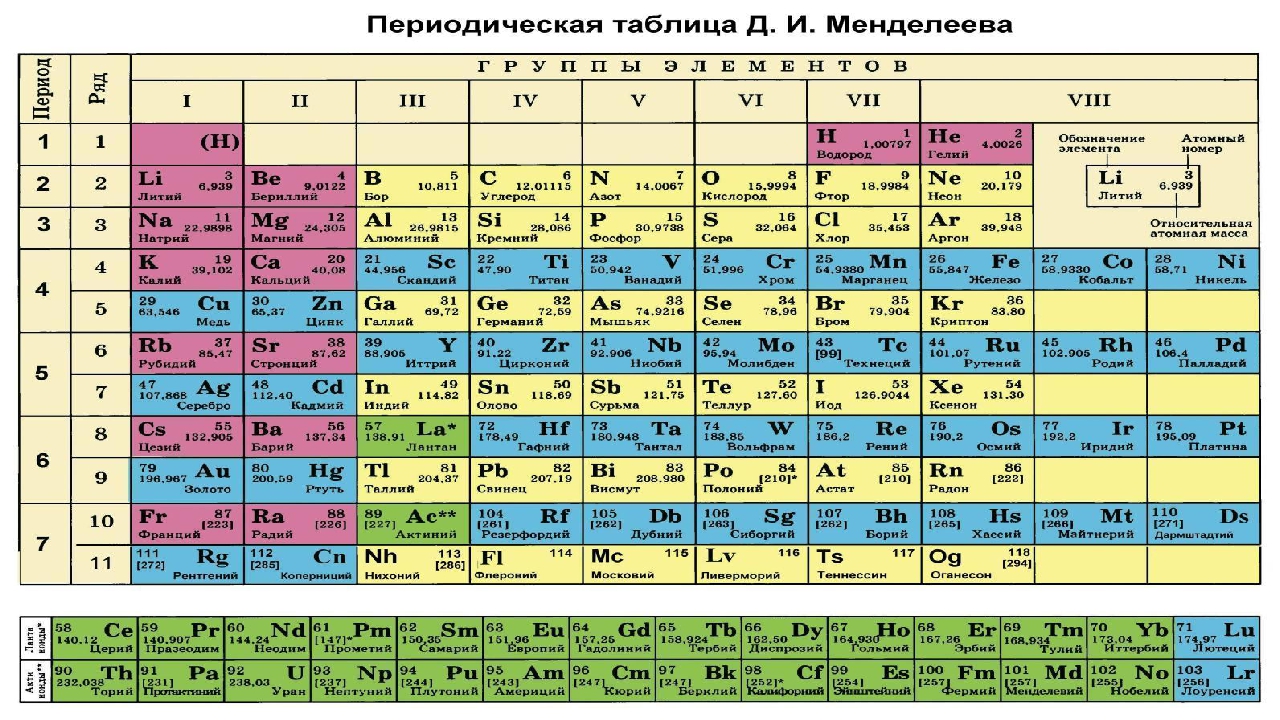 Есть исключения из порядка, когда вы смотрите на переходные элементы, но вы понимаете общую идею. Переходные элементы добавляют электроны на предпоследнюю орбиталь.
Есть исключения из порядка, когда вы смотрите на переходные элементы, но вы понимаете общую идею. Переходные элементы добавляют электроны на предпоследнюю орбиталь.
Например, азот (N) имеет атомный номер семь.Атомный номер говорит вам, что в нейтральном атоме азота семь электронов. Сколько электронов находится на его внешней орбитали? Азот находится в пятнадцатой колонке с надписью «Группа VA». «V» — это римская цифра пять, обозначающая количество электронов на внешней орбите. Вся эта информация говорит вам о том, что на первой орбитали два электрона и пять на второй (2-5).
Фосфор (P) также находится в группе VA, что означает, что он также имеет пять электронов на своей внешней орбите.Однако, поскольку атомный номер фосфора равен пятнадцати, электронная конфигурация равна 2-8-5.
Водород (H) и гелий (He) являются особыми элементами. Водород в своей нейтральной форме не имеет нейтрона. Есть только один электрон и один протон. Вы, вероятно, не найдете атомарные атомы водорода, плавающие сами по себе. Атомарный водород хочет соединиться с другими элементами, чтобы заполнить свою внешнюю оболочку. В вашей работе по химии, скорее всего, будет использоваться молекулярный водород (H 2 ) или ионы водорода (H + , протоны).
Атомарный водород хочет соединиться с другими элементами, чтобы заполнить свою внешнюю оболочку. В вашей работе по химии, скорее всего, будет использоваться молекулярный водород (H 2 ) или ионы водорода (H + , протоны). Гелий (He) отличается от всех остальных элементов. Он очень стабилен только с двумя электронами на его внешней орбитали (валентной оболочке). Несмотря на то, что у него всего два электрона, он все же сгруппирован с благородными газами, у которых восемь электронов на их самых удаленных орбиталях. Все благородные газы и гелий «счастливы», потому что их валентная оболочка заполнена.
ChemCam Rock Laser для MSL (видео в Лос-Аламосе, штат Невада)
Открытые элементы: интерактивная периодическая таблица
Газ, жидкий или твердый, радиоактивный или стабильный, реактивный или инертный, токсичный или безвредный, узнайте, что делает ваш любимый элемент уникальным
Основные источники и многое другое для изучения:
- Прочтите «В поисках сверхтяжелых элементов и остров стабильности» в номере Scientific American за март 2018 года.
 Большинство этих массивных элементов чрезвычайно недолговечны, но теория предсказывает, что если ученые смогут создать атомы с правильными комбинациями протонов и нейтронов, они могут стать стабильными и существовать минуты, дни или даже годы.
Большинство этих массивных элементов чрезвычайно недолговечны, но теория предсказывает, что если ученые смогут создать атомы с правильными комбинациями протонов и нейтронов, они могут стать стабильными и существовать минуты, дни или даже годы. - В честь встречи в Линдау 2013 года, посвященной химии, мы обновили нашу интерактивную периодическую таблицу, добавив ссылки на серию эссе In Your Element журнала Nature Chemistry. Каждое эссе рассказывает историю определенного элемента, часто описывая его открытие, историю и возможное использование.
- В номере журнала Scientific American за октябрь 2011 г. мы отмечаем Международный год химии. Узнайте больше о его влиянии на нашу повседневную жизнь в нашем специальном отчете.
- Справочник отравителя: убийство и рождение судебной медицины в эпоху джаза Нью-Йорк . Дебора Блум. Пингвин Пресс; 2010.
- Исчезающая ложка: и другие правдивые рассказы о безумии, любви и истории мира из Периодической таблицы элементов .
 Автор Сэм Кин. Литтл, Браун и компания; 2010.
Автор Сэм Кин. Литтл, Браун и компания; 2010. - В своей стихии. Ежемесячная колонка в Nature Chemistry
- История и использование химических элементов нашей Земли: Справочник . Роберт Э. Кребс.
- Химия в ее элементах подкаст от Chemistry World.
- Элементы , Том Лерер.
- «Я был подростком-хранителем элементов», Майкл Батталья.
- Трещины в периодической таблице, Эрик Шерри.
- Все элементарно: десятилетия идей нобелевских лауреатов по химии, под редакцией Ферриса Джабра, введение Стюарта Кантрила.
Интерактив Кристы Фуэнтес
ОБ АВТОРАХ
Давиде Кастельвекки — старший репортер Nature в Лондоне, освещающий вопросы физики, астрономии, математики и информатики. Следите за Давиде Кастельвекки в Твиттере
Последние статьи Давиде Кастельвекки
Информационный бюллетень
Будьте умнее.
 Подпишитесь на нашу новостную е-мэйл рассылку.
Подпишитесь на нашу новостную е-мэйл рассылку.Поддержите научную журналистику
Откройте для себя науку, которая изменит мир. Изучите наш цифровой архив с 1845 года, включая статьи более 150 лауреатов Нобелевской премии.
Подпишитесь прямо сейчас!Это элементарно — Периодическая таблица элементов
Периодическая таблица элементов
| Перечислено по химическому названию | Перечислены по атомному номеру | Перечислены по химическому символу | Водород1H Гелий-2He Литий3Li Бериллий4Be Бор5Б Углерод6C Азот7N Кислород8O Фтор9F Неон10Ne Натрий11Na Магний12Mg Алюминий13Al Кремний14Si Фосфор15P Сера16S Хлор17Cl Аргон18Ar Калий19K Кальций20Ca Скандий21Sc Титан22Ti Ванадий23В Хром24Cr Марганец25Mn Железо26Fe Кобальт27Co Никель28Ni Медь29Cu Цинк30Zn Галлий-31Ga Германий32Ge Мышьяк33As Селен34Se Бром35Br Криптон36Кр Рубидий37Rb Стронций38Sr Иттрий39Y Цирконий40Zr ниобий41Nb Молибден42Mo Технеций43Tc Рутений44Ru Родий45Rh Палладий46Pd Silver47Ag Кадмий48Cd Индий49В Олово50Sn Сурьма51Sb Теллур52Те Йод53I Ксенон54Хе Цезий55Cs Барий56Ba Лантан57La Церий58Ce Празеодим59Pr Неодим60Nd Прометий61Pm Самарий62см Европий63Eu Гадолиний-64Gd Тербий65Tb Диспрозий66Dy Холмиум67Хо Эрбий68Er Тулий69Tm Иттербий70Yb Лютеций71Lu Гафний72Hf Тантал73Ta Вольфрам74Вт Рений75Re Осмий76Os Иридий77Ir Платина78Pt Золото79Au Меркурий80Hg Таллий81Tl Lead82Pb Висмут83Би Полоний84Po Астатин85Ат Радон86Рн Франций87Fr Радий88Ra Актиний89Ac Торий90Th Протактиний91Па Уран-92U Нептуний93Np Плутоний-94Pu Америций95Am Куриум96см Берклиум97Бк Калифорния98Cf Эйнштейний99Es Фермиум100FM Менделевиум101Md Нобелий102Нет Лоуренсиум103Lr Резерфордий104Rf Дубний105Дб Сиборгиум106Sg Бориум107Bh Хассиум108Hs Мейтнериум109Mt Дармштадтиум110Ds Рентгений111Rg Копернициум112Cn Нихоний113Nh Флеровиум114Fl Московиум115Mc Ливермориум116Lv Теннессин117Ц Оганесон118OgСкачать версию для печати Периодической таблицы элементов в формате PDF:
— Цвет: базовый/расширенный
— Черно-белый: базовый/расширенный
Доступны следующие онлайн-игры на основе Периодической таблицы элементов:
— Флэш-карты Element
— Элемент Палач
— Соответствие элементов
— Математика элементов
— Элемент кроссвордов
— Концентрация элемента
— Балансировка элементов
— Скремблирование слова элемента
Доступны следующие бумажные операции:
— Элемент БИНГО
— Элемент поиска слов
В дополнение к информации, содержащейся в Периодической таблице элементов, следующие статьи могут быть полезны, если вы пишете отчет об элементе или создаете модель атома:
— Как рассчитать количество протонов, нейтронов и электронов в атоме элемента
— Как сделать модель атома
— Как нарисовать атом (видео)
— Как читать схему электронной конфигурации
— Список тех, кто открыл каждый элемент
Информация на этом сайте собрана из нескольких источников.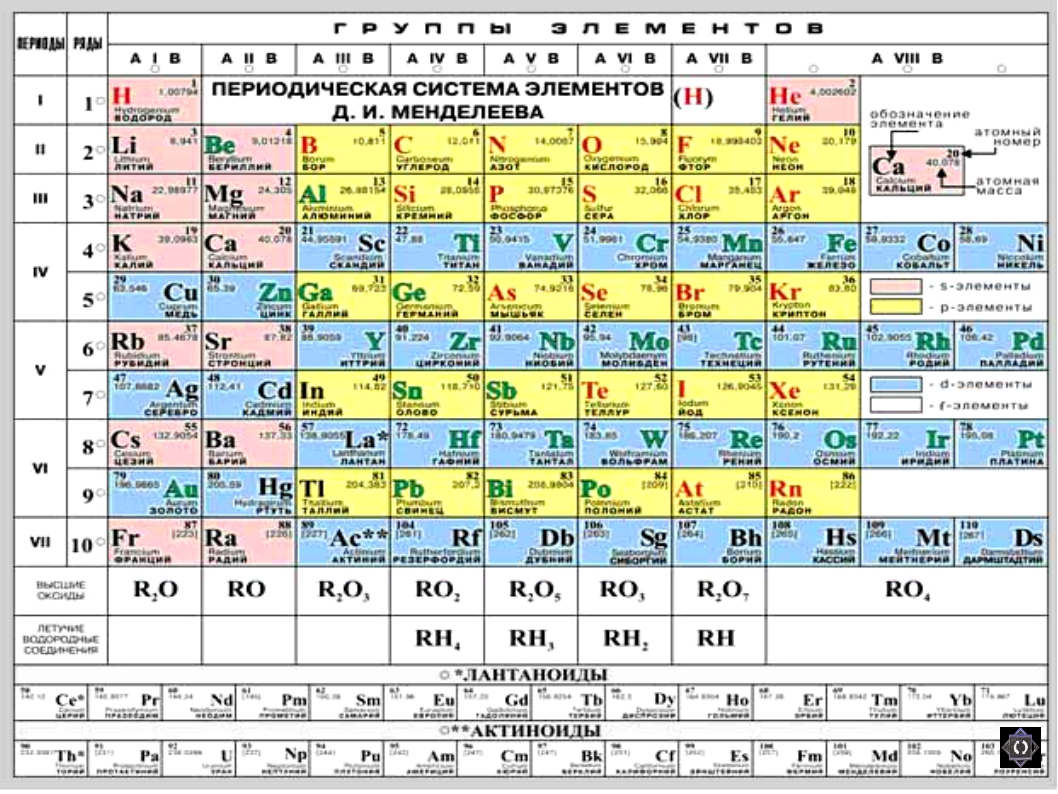

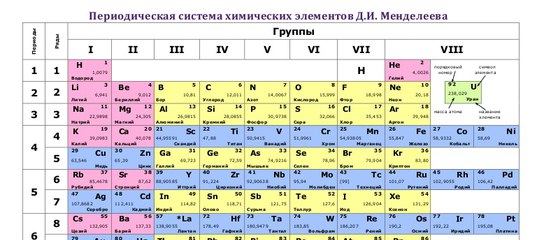
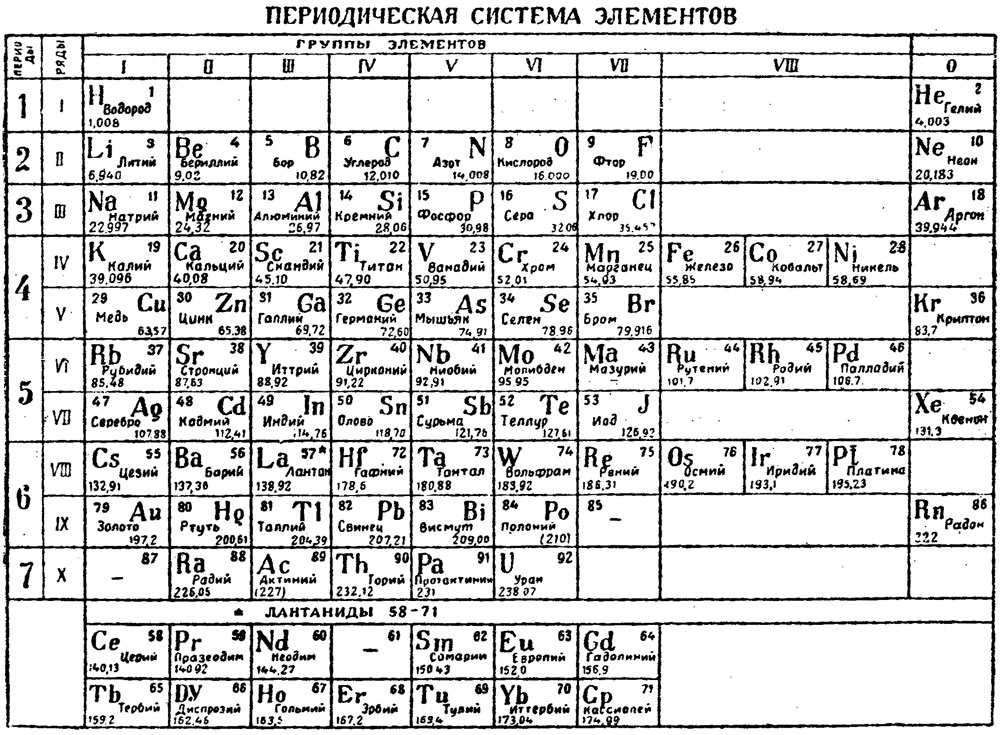 Большинство этих массивных элементов чрезвычайно недолговечны, но теория предсказывает, что если ученые смогут создать атомы с правильными комбинациями протонов и нейтронов, они могут стать стабильными и существовать минуты, дни или даже годы.
Большинство этих массивных элементов чрезвычайно недолговечны, но теория предсказывает, что если ученые смогут создать атомы с правильными комбинациями протонов и нейтронов, они могут стать стабильными и существовать минуты, дни или даже годы.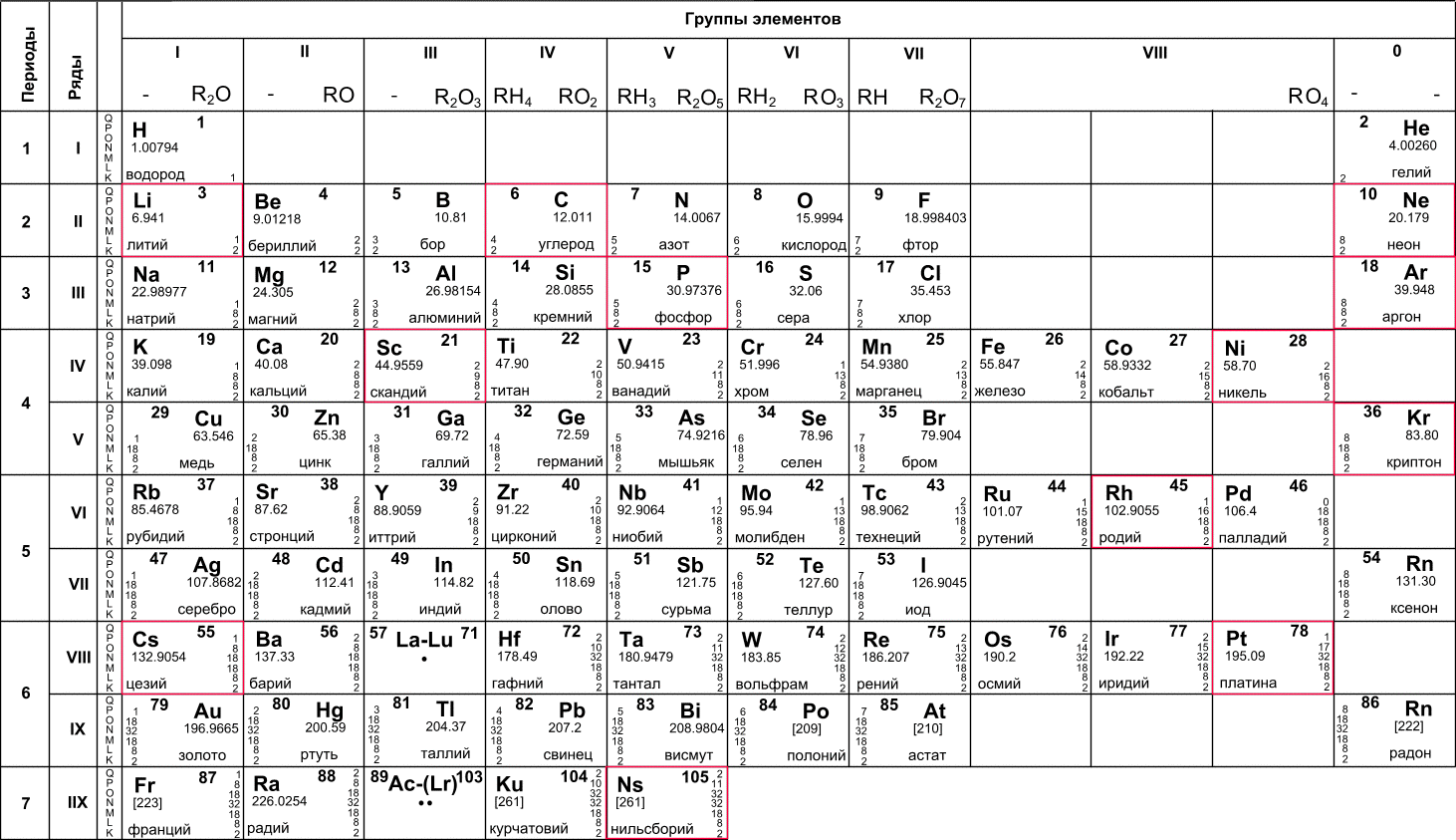 Автор Сэм Кин. Литтл, Браун и компания; 2010.
Автор Сэм Кин. Литтл, Браун и компания; 2010.