Элементы: Кислород и Кислородная катастрофа
Кислород — самый распространенный на Земле элемент. В земной коре на его долю приходится около 48 % в составе самых разных минералов. Морские и пресные воды также содержат огромное количество связанного кислорода — 89%. В атмосфере его содержание составляет 23 % по массе. Как простое вещество, при нормальных условиях он представляет собой газ без цвета и запаха, молекула которого состоит из двух атомов с формулой O2. Жидкий кислород имеет умеренно криогенные свойства: точка замерзания −222,6 °C; точка кипения −182,9 °C.
Жидкий кислород имеет голубой цвет с температурой замерзания −222,6 °C и температурой кипения −182,9 °C
Кислород открыли почти одновременно два выдающихся химика 18 века – швед Карл Шееле и англичанин Джозеф Пристли. Однако, Пристли полагал, что открыл одну из составных частей воздуха. Об этом в 1775 году он сообщил французскому химику Антуану Лавуазье. До открытия кислорода горение объясняли наличием особой огненной субстанции – «флогистона», якобы заполняющего все горючие вещества и высвобождающегося из них при горении.
Таким образом, лавры первооткрывателей кислорода принадлежат Лавуазье, Шееле и Пристли. Лавуазье назвал поддерживающий горение газ oxygene (от др.- греч. ὀξύς — «кислый» и γεννάω — «рождаю»), отсюда и русское название — «кислород».
Известно более 1400 минералов, содержащих кислород, главные из них: кварц, полевые шпаты, слюды, карбонаты.
Кварц (SiO2) – самый распространённый минерал земной коры. Содержание кислорода – 53%.
Более 99 % кислорода Земли находится в связанном состоянии. Кислород — главный фактор, регулирующий распределение элементов в планетарном масштабе. Его содержание с глубиной закономерно уменьшается: от 50 % в гранитах до 38% — в кимберлитах. Большинству современных живых существ для жизни необходим атмосферный кислород. Такие организмы называются аэробы (от греч. αηρ — воздух и βιοζ — жизнь). Но в истории Земли кислород господствовал не всегда. В раннем протерозое -2,5 миллиарда лет назад — атмосфера Земли состояла преимущественно из углекислого газа, сероводорода, аммиака и метана и подавляющая часть организмов была анаэробной — неспособной существовать при значимых концентрациях кислорода. Всё изменилось с появлением в океанах цианобактерий, способных к фотосинтезу, сопровождающемуся выделением свободного кислорода.
Такие организмы называются аэробы (от греч. αηρ — воздух и βιοζ — жизнь). Но в истории Земли кислород господствовал не всегда. В раннем протерозое -2,5 миллиарда лет назад — атмосфера Земли состояла преимущественно из углекислого газа, сероводорода, аммиака и метана и подавляющая часть организмов была анаэробной — неспособной существовать при значимых концентрациях кислорода. Всё изменилось с появлением в океанах цианобактерий, способных к фотосинтезу, сопровождающемуся выделением свободного кислорода.
Строматолиты Западной Австралии в заливе Шарк — окаменелые колонии цианобактерий.
Это событие в истории Земли теперь называют Кислородной катастрофой, так как в атмосфере появился свободный кислород, который был губителен для всех анаэробных организмов. В дальнейшем наличие молекулярного кислорода в атмосфере привело к формированию озонового слоя, существенно расширившего границы биосферы, когда живые организмы смогли выйти из океанов и возникли высокоразвитые формы жизни, включая человека.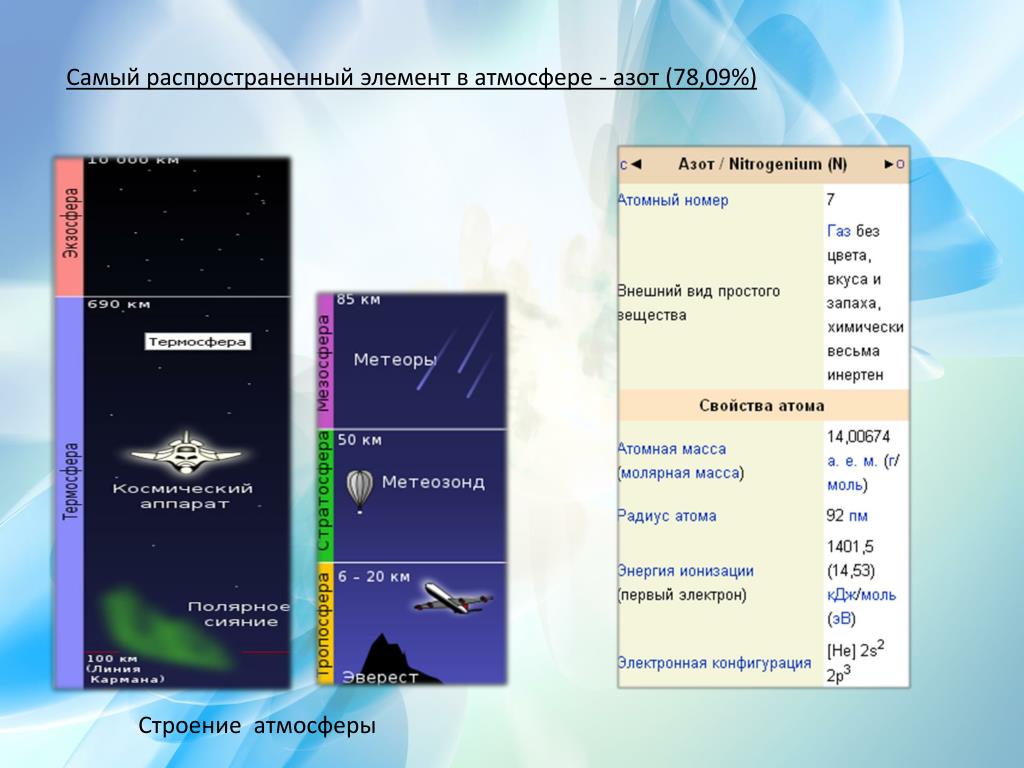
Самый распространенный на Земле газ, 4 буквы, 1-я буква А, сканворд
Самый распространенный на Земле газ
Альтернативные описания• газ, делающий металл хрупким
• газ, из которого на 78% состоит воздух
• главный «воздушный наполнитель»
• главный компонент вдыхаемого вами воздуха, которым в чистом виде дышать нельзя
• компонент воздуха
• удобрение, витающее в воздухе
• химический элемент — основа ряда удобрений
• химический элемент, один из основных питательных веществ растений
• химический элемент, составная часть воздуха
• нитрогениум
• жидкий хладагент
• химический элемент, газ
• магический меч Парацельса
• на латыни этот газ называется «nitrogenium», то есть «рождающий селитру»
• название этого газа произошло от латинского слова «безжизненный»
• этот газ — составляющая воздуха практически отсутствовал в первичной атмосфере Земли 4,5 млрд. лет назад
лет назад
• газ, чья жидкость служит для охлаждения сверхточных приборов
• какой газ в жидком состоянии хранят в сосуде Дьюара?
• газ, заморозивший Терминатора II
• газ-охладитель
• какой газ тушит огонь?
• самый распространенный элемент в атмосфере
• основа всех нитратов
• химический элемент, N
• замораживающий газ
• воздух на три четверти
• в составе аммиака
• газ из воздуха
• газ под номером 7
• элемент из селитры
• основной газ в воздухе
• газ No7
• популярнейший газ
• элемент из нитратов
• газ, N
• жидкий газ из сосуда
• газ №1 в атмосфере
• удобрение в воздухе
• 78% воздуха
• газ для криостата
• почти 80% воздуха
• самый популярный газ
• газ из сосуда Дьюара
• главный компонент воздуха
• «N» в воздухе
• нитроген
• воздух
• воздушный компонент
• древний богатый филистимский город, с храмом Дагона
• большая часть атмосферы
• преобладает в воздухе
• следом за углеродом в таблице
• между углеродом и кислородом в таблице
• 7-й у Менделеева
• перед кислородом
• предшественник кислорода в таблице
• газ, отвечающий за урожай
• «безжизненный» среди газов
• вслед за углеродом в таблице
• пес из палиндрома Фета
• газ — компонент удобрений
• до кислорода в таблице
• после углерода в таблице
• 78,09% воздуха
• какого газа больше в атмосфере?
• какой газ витает в воздухе?
• газ, занимающий большую часть атмосферы
• седьмой в строю химических элементов
• хим. элемент №7
элемент №7
• составная часть воздуха
• в таблице он после углерода
• нежизненная часть атмосферы
• «рождающий селитру»
• закись этого газа — «вселящий газ»
• основа земной атмосферы
• большая часть воздуха
• часть воздуха
• преемник углерода в таблице
• безжизненная часть воздуха
• седьмой в менделеевском строю
• газ в составе воздуха
• основная масса воздуха
• седьмой в химическом рейтинге
• N (хим.)
• седьмой химический элемент
• около 80% воздуха
• газ из таблицы
• газ, существено влияющий на урожай
• главный компонент нитратов
• основа воздуха
• главный элемент воздуха
• «нежизненный» элемент воздуха
• менделеев назначил его седьмым
• львиная доля воздуха
• седьмой в менделеевской шеренге
• главный газ в воздухе
• седьмой в химическом строю
• основной газ воздуха
• главный газ воздуха
• между углеродом и кислородом
• инертный при нормальных условиях двухатомный газ
• Газ, основной компонент воздуха
• Химический элемент, газ без цвета и запаха, главная составная часть воздуха, входящий также в состав белков и нуклеиновых кислот
• Наименование химического элемента
• «N» в воздухе
• «Безжизненный» среди газов
• «Нежизненный» элемент воздуха
• «Рождающий селитру»
• 7-я графа Менделеева
• большая часть вдыхаемого воздуха
• входит в состав воздуха
• газ
• газ — компонент удобрений
• газ, существенно влияющий на урожай
• главная состав. часть воздуха
часть воздуха
• главная часть воздуха
• главный «воздушный наполнитель»
• закись этого газа — «вселящий газ»
• какого газа больше в атмосфере
• какой газ в жидком состоянии хранят в сосуде Дьюара
• какой газ витает в воздухе
• какой газ тушит огонь
• м. химич. основание, главная стихия селитры; селитротвор, селитрород, селитряк; он же главная, по количеству, составная часть нашего воздуха (азота объемов, кислорода Азотистый, азотный, азотовый, азот в себе содержащий. Химики различают этими словами меру или степени содержания азота в сочетаниях его с другими веществами
• на латыни этот газ называется «nitrogenium», то есть «рождающий селитру»
• название этого газа произошло от латинского слова «безжизненный»
• основной компонент вдыхаем. воздуха
• перед кислородом в таблице
• последыш углерода в таблице
• седьмая графа Менделеева
• химическ. элемент с кодовым именем 7
• химический элемент
• что за химический элемент №7
• входит в состав селитры
Земли содержание водорода — Справочник химика 21
Водород — самый распространенный элемент Вселенной. Он составляет основную массу Солнца, звезд и других космических тел. В недрах звезд на определенной стадии их эволюции протекают разнообразные термоядерные реакции с участием водорода. Они и являются источником неисчислимого количества энергии, излучаемого звездами в космическое пространство. Распространенность водорода на Земле существенно иная. В свободном состоянии на Земле он встречается сравнительно редко — содержится в нефтяных и горючих газах, присут ствует в виде включений в некоторых минералах. Некоторое количество водорода появляется постоянно в атмосфере в результате разложения органических веществ микроорганизмами, но затем водород быстро перемещается в стратосферу вследствие его легкости. Основная масса водорода в земной коре находится в виде химических соединений с другими элементами большая часть его связана в форме воды, глин и углеводородов последние составляют основу нефти и входят составной частью в природные горючие газы. Кроме того, растительные и животные (организмы содержат сложные вещества, в состав которых обязательно входит водород.
Он составляет основную массу Солнца, звезд и других космических тел. В недрах звезд на определенной стадии их эволюции протекают разнообразные термоядерные реакции с участием водорода. Они и являются источником неисчислимого количества энергии, излучаемого звездами в космическое пространство. Распространенность водорода на Земле существенно иная. В свободном состоянии на Земле он встречается сравнительно редко — содержится в нефтяных и горючих газах, присут ствует в виде включений в некоторых минералах. Некоторое количество водорода появляется постоянно в атмосфере в результате разложения органических веществ микроорганизмами, но затем водород быстро перемещается в стратосферу вследствие его легкости. Основная масса водорода в земной коре находится в виде химических соединений с другими элементами большая часть его связана в форме воды, глин и углеводородов последние составляют основу нефти и входят составной частью в природные горючие газы. Кроме того, растительные и животные (организмы содержат сложные вещества, в состав которых обязательно входит водород.
Развитие планет определялось их массой и расстоянием от Солнца. Небольшие планеты земной группы потеряли значительную часть легких элементов для планет-гигантов этот процесс не был характерен, они удержали в своем составе даже водород. Вследствие этого планеты подразделяются на две группы. Мы видели, что количественный химический состав планет-гигантов Очень близок к составу Солнца. Например, наиболее массивный Юпитер, масса которого в 318 раз превосходит массу Земли, состоит из 85% водорода, 10% гелия и только около 5% приходится на содержание других элементов. В атмосфере Урана водород стоит на втором месте после гелия, а в поверхностных слоях Земли — на восьмом — десятом. Однако водорода на Земле все же достаточно для образования большого количества воды. На Марсе же, масса которого в десять раз меньше массы Земли, содержание водорода настолько мало, что на нем не обнаружено сколько- [c.
 147]
147]Водород — наиболее распространенный элемент во Вселенной, так как его атомы сосредоточены в межзвездном пространстве. На Земле содержание водорода около 1 % от общей массы земной коры. [c.240]
Если сравнить химический состав Земли с составом Вселенной, то, казалось бы, между ними не должно быть существенных различий, за исключением, пожалуй, содержания водорода, который легко уходит из атмосферы в межпланетное пространство. К сожалению, судить о составе Земли можно лишь по составам атмосферы, гидросферы и земной коры, изученной в глубину не более чем на 20 км. Главная химическая особенность этих трех сфер — необычайно высокое содержание кислорода, что объясняется уже не строением ядер его атомов, а его химическими свойствами. Атомы кислорода способны образовывать прочные химические связи с атомами многих элементов, в том числе кремния и алюминия. В процессе образования земной коры эти элементы накапливались в ней благодаря легкоплавкости их соединений со щелочами.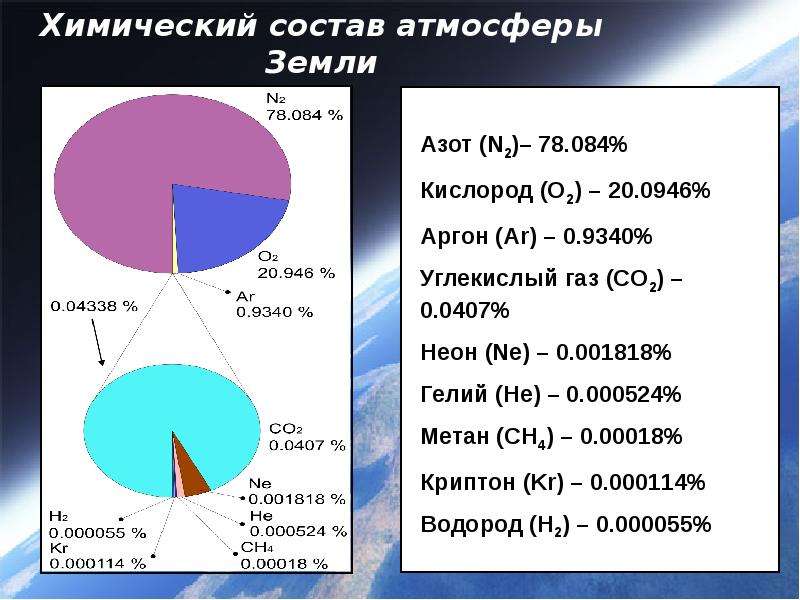 В итоге на поверхности нашей планеты выкристаллизовалась твердая кремнекислородная оболочка. Кислород, не считая воды, входит в состав 1364 минералов. В атмосфере кислород появился около 1,8 млрд лет назад в результате действия на минералы микроорганизмов. В настоящее время выделение кислорода растениями за счет фотосинтеза возмещает его убыль в атмосфере в ходе процессов окисления, горения, гниения, дыхания. По числу известных природных соединений (432) второе место занимает кремний. Далее по распростра- [c.266]
В итоге на поверхности нашей планеты выкристаллизовалась твердая кремнекислородная оболочка. Кислород, не считая воды, входит в состав 1364 минералов. В атмосфере кислород появился около 1,8 млрд лет назад в результате действия на минералы микроорганизмов. В настоящее время выделение кислорода растениями за счет фотосинтеза возмещает его убыль в атмосфере в ходе процессов окисления, горения, гниения, дыхания. По числу известных природных соединений (432) второе место занимает кремний. Далее по распростра- [c.266]
Свободного водорода на Земле немного в воздухе на уровне моря его всего лишь 0,00005 %) (об.), в верхних слоях атмосферы содержание водорода увеличивается. Он выделяется при извержении вулканов и из буровых скважин, образуется при разложении бактериями органических веществ в условиях недостатка воздуха. [c.274]
Распространение в природе. Водород — наиболее распространенный элемент в космосе (звезды, межзвездная среда, туманности, большие планеты — Юпитер, Сатурн), в состав космической материи входит 63 % Н, 36 % Не и 1 % остальных элементов.
 На Земле водород встречает(у1 главным образом в химически связанном виде (вода, живые организмы, нефть, уголь, минералы) в составе стратосферы имеется частично ионизированный свободный водород. В земной коре до глубины 17 км содержание водорода составляет [c.263]
На Земле водород встречает(у1 главным образом в химически связанном виде (вода, живые организмы, нефть, уголь, минералы) в составе стратосферы имеется частично ионизированный свободный водород. В земной коре до глубины 17 км содержание водорода составляет [c.263]Метод центрифугирования. Известно, что сила тяготения, действующая на частицу, пропорциональна ее массе. Поэтому, например, под действием силы тяготения в атмосфере Земли происходит частичное фракционирование газов относительное содержание водорода и гелия в верхних слоях атмосферы выше, чем в нижних. [c.43]
На рис. 24 показано относительное содержание различных элементов в атмосфере Солнца и на Земле. Видно, что относительное содержание тяжелых элементов, начиная с натрия, почти одинаково как в атмосфере Солнца, так и на Земле. Содержание кислорода, углерода, азота, гелия и тем более водорода в атмосфере Солнца во много десятков раз больше, чем на Земле. Особенно велика разница для водорода. Содержание его в атмосфере Солнца более чем в сто тысяч раз превышает содержание его на Земле. [c.73]
Содержание его в атмосфере Солнца более чем в сто тысяч раз превышает содержание его на Земле. [c.73]
Для предупреждения образования в аппаратуре и помещении взрыво- и пожароопасных газовых смесей состав выходящих из электролизера газов непрерывно и автоматически фиксируется приборами и, когда чистота водорода становится ниже 98,5%, а кислорода ниже 98%, подаются световой-и звуковой аварийные сигналы не менее одного раза в смену производится контрольный анализ газов переносными газоанализаторами в различных местах технологической схемы контролируется уровень жидкости в газо-сборниках, не допуская работу электролизера при отсутствии в мерном стекле видимого уровня столба жидкости систематически производится тщательная очистка опорных изоляторов электролизера для предотвращения токов утечки в землю электролизеры после остановки и перед пуском продуваются азотом. Для контроля за содержанием водорода в помещении имеются автоматически действующие газоанализаторы, включающие аварийный сигнал, когда содержание водорода в воздухе более 0,4%. При содержании водорода выше % технологическое оборудование цеха автоматически останавливается. При загорании водород тушат СОг, азотом или хладонами. [c.22]
При содержании водорода выше % технологическое оборудование цеха автоматически останавливается. При загорании водород тушат СОг, азотом или хладонами. [c.22]
Среднее содержание водорода в атмосфере вблизи земной поверхности составляет 5-10-5% (об.), т. е. в свободном состоянии он встречается крайне редко. Солнце содержит 57 % (масс.) водорода и 40 % гелия. Содержание некоторых легких элементов в оболочке земли и во вселенной показано в табл. 1.33. [c.31]
Повышение до 37 и даже до 50 /о содержания водорода в природном газе не требует серьезной реконструкции газопроводов. Трубы прокладывают в земле, причем трассы прокладки имеют наземную маркировку. [c.464]
Бурые и каменные угли в большинстве своем имеют растительное происхождение и содержат в небольшом количестве минеральные вещества. Они образовались в теплом и сыром климате в глубокой древности из сильно разросшихся растений, когда они после гибели погружались на дно водоемов и поэтому не подвергались тлению и гниению, при которых содержащийся в растениях углерод большей частью превращается в углекислый газ и другие летучие вещества. В процессах разложения этих растений (главным образом под воздействием микроорганизмов) из них высвобождаются соединения, богатые водородом и кислородом, а содержание углерода растет — образуется торф. Торф затем покрывается другими отложениями (песком, глиной) и в результате геологических движений опускается в глубь земли, где под давлением и при высокой температуре процесс торфообразования переходит в процесс угле-образования (повышения содержания углерода). В ходе связанной с этим процессом миграции элементов содержание водорода и кислорода продолжает уменьшаться, а содержание углерода — расти в результате из торфа получаются бурый уголь, каменный уголь и, наконец, антрацит. Бурые угли образуются в течение 40—60 миллионов лет, а возраст каменного угля составляет по крайней мере 200—300 миллионов лет. Степень окаменения угля (обогащения углеродом) зависит, однако, не только от возраста, а в большой степени от других факторов, прежде всего от температуры и давления. [c.33]
В процессах разложения этих растений (главным образом под воздействием микроорганизмов) из них высвобождаются соединения, богатые водородом и кислородом, а содержание углерода растет — образуется торф. Торф затем покрывается другими отложениями (песком, глиной) и в результате геологических движений опускается в глубь земли, где под давлением и при высокой температуре процесс торфообразования переходит в процесс угле-образования (повышения содержания углерода). В ходе связанной с этим процессом миграции элементов содержание водорода и кислорода продолжает уменьшаться, а содержание углерода — расти в результате из торфа получаются бурый уголь, каменный уголь и, наконец, антрацит. Бурые угли образуются в течение 40—60 миллионов лет, а возраст каменного угля составляет по крайней мере 200—300 миллионов лет. Степень окаменения угля (обогащения углеродом) зависит, однако, не только от возраста, а в большой степени от других факторов, прежде всего от температуры и давления. [c.33]
Водород в природе. Получение водорода. Водород в свободном состоянии встречается на Земле лишь в незначительных количествах. Иногда он выделяется вместе с другими газами при вулканических извержениях, а также из буровых скважин при добывании нефти. Но в виде соединений водород весьма распространен. Это видно уже из того, что он составляет девятую часть массы воды. Водород входит в состав всех растительных и животных организмов, нефти, каменного и бурого углей, природных газов и ряда минералов. На долю водорода из всей массы земной коры, считая воду и воздух, приходится около 1%. Однако при пересчете на проценты от общего числа атомов содержание водорода в земной коре равно 17% [c.342]
Получение водорода. Водород в свободном состоянии встречается на Земле лишь в незначительных количествах. Иногда он выделяется вместе с другими газами при вулканических извержениях, а также из буровых скважин при добывании нефти. Но в виде соединений водород весьма распространен. Это видно уже из того, что он составляет девятую часть массы воды. Водород входит в состав всех растительных и животных организмов, нефти, каменного и бурого углей, природных газов и ряда минералов. На долю водорода из всей массы земной коры, считая воду и воздух, приходится около 1%. Однако при пересчете на проценты от общего числа атомов содержание водорода в земной коре равно 17% [c.342]
Ископаемые твердые топлива образовались из растений, некогда покрывавших Землю. Процессы превращения растений в ископаемые горючие вещества протекали в течение миллионов лет. Из растений образовывался торф, который со временем превратился в бурый уголь, а последний затем в каменный уголь.
 В этом процессе углеобразования изменялся состав топлив, причем увеличивалось содержание в них углерода и уменьшалось содержание водорода и кислорода. Поэтому, как видно из табл. 17, наиболее богаты углеродом старые по возрасту топлива — антрацит, каменный уголь и меньше всего углерода в молодых топливах — древесине и торфе. [c.169]
В этом процессе углеобразования изменялся состав топлив, причем увеличивалось содержание в них углерода и уменьшалось содержание водорода и кислорода. Поэтому, как видно из табл. 17, наиболее богаты углеродом старые по возрасту топлива — антрацит, каменный уголь и меньше всего углерода в молодых топливах — древесине и торфе. [c.169]Водород — самый распространенный элемент во Вселенной и широко распространенный на Земле. Содержание его в земной коре составляет 3% (мол. доли). [c.385]
Количество свободного водорода на земле очень не.значительно. В воздухе на уровне моря его содержится всего лишь 0,00005% по объему в верхних слоях атмосферы содержание водорода увеличивается. Он выделяется при извержении вулканов, а также из буровых скважин при добывании нефти. [c.80]
Изменение основного энергоресурса — не только переход с твердого топлива на жидкое и газообразное, но и процесс декарбонизации . Отношение содержаний водорода и углерода 1 3 — 1 10 для дерева, 1 2 для угля, 2 1 для нефти и 4 1 для природного газа. Таким образом, в течение последних двухсот лет человечество постепенно переходило на топливо, содержащее все большее количество атомов водорода [2]. Если эта тенденция продолжится, то следующим топливом на Земле должен стать водород, наиболее распространенный элемент во Вселенной и источник энергии Солнца. [c.9]
Таким образом, в течение последних двухсот лет человечество постепенно переходило на топливо, содержащее все большее количество атомов водорода [2]. Если эта тенденция продолжится, то следующим топливом на Земле должен стать водород, наиболее распространенный элемент во Вселенной и источник энергии Солнца. [c.9]
Из всех химических реакций, которые люди научились проводить и контролировать для своих нужд, синтез аммиака из водорода и атмосферного азота, вероятно, имеет наибольшее значение. Это особенно понятно в нынешней ситуации, когда с каждым годом становится все ощутимее нехватка продовольствия. Выращивание растительных веществ требует внесения в почву значительных количеств азота в форме, легко усвояемой растениями. Количество продовольствия, необходимое, чтобы прокормить все возрастающее население земного шара, намного превосходит то, что можно произвести, полагаясь лишь на естественное содержание азота в почве. Для обеспечения высокой урожайности сельскохозяйственных культур требуются огромные количества удобрений, богатых азотом. Единственным широко доступным источником азота на земле является атмосферный N2. Таким образом, возникает проблема связывания атмосферного азота, т.е. превращения его в форму, усвояемую растениями. Этот процесс называют еще фиксацией азота. [c.40]
Единственным широко доступным источником азота на земле является атмосферный N2. Таким образом, возникает проблема связывания атмосферного азота, т.е. превращения его в форму, усвояемую растениями. Этот процесс называют еще фиксацией азота. [c.40]
Свободного водорода на Земле почти нет, в атмосфере его содержание не превышает 5-10 %. Практически весь водород находится в связанном состоянии в составе многих минералов, углей, нефти, живых и растительных организмов, но самым распространенным его соединением является вода. Основная масса воды содержится в океанах и морях (1,42-10 т), много воды находится в виде льда (3,5-10 т), масса подземных вод оценивается в -8- Ю » т, а масса пресной воды озер и рек составляет 5- 10 » т, на долю атмосферной влаги приходится 1,4-10 т. [c.211]
Водород широко распространен в природе. Содержание его на Земле 3,0% (мол. доли). Он входит в состав воды, глин, каменного и бурого угля, нефти и т.д., а также во все животные и растительные организмы. В свободном состоянии водород встречается крайне редко (в вулканических и других природных газах). Водород — самый распространенный элемент космоса он составляет до половины массы Солнца и большинства звезд. Гигантские планеты солнечной системы Юпитер и Сатурн в основном состоят из водорода. Он присутствует в атмосфере ряда планет, в кометах, газовых туманностях и межзвездном газе. [c.300]
В свободном состоянии водород встречается крайне редко (в вулканических и других природных газах). Водород — самый распространенный элемент космоса он составляет до половины массы Солнца и большинства звезд. Гигантские планеты солнечной системы Юпитер и Сатурн в основном состоят из водорода. Он присутствует в атмосфере ряда планет, в кометах, газовых туманностях и межзвездном газе. [c.300]
Времена пребывания главных ионов в морской воде (вставка 4.3) являются важным индикатором того пути, по которому происходит химический круговорот в океанах. Все эти времена пребывания очень продолжительны (от Ю до 10 лет) и близки или превышают значения для самой воды (3,8 Ю лет). Длительные времена пребывания означают, что у океанских течений суше-ствует реальная возможность тщательного перемешивания воды и составляющих ее ионов. Это обеспечивает сглаживание изменений в отношениях ионов, возникающих в результате локальных процессов привноса или выноса. Именно большие времена пребывания ионов создают высокое постоянство ионных отношений в морской воде. Времена пребывания являются результатом высокой растворимости ионов и, следовательно, их отношений zjr (см. п. З.7.1.). Остальные катионы с похожими отношениями также имеют длительные времена пребывания [например, ион цезия ( s )], но они не относятся к главным в морской воде из-за их низкого содержания в земной коре. Интересным исключением является хлор. Его много в морской воде, у него большое время пребывания и тем не менее низкое содержание в земной коре. Ббльшая часть этого С1- дегазировалась из мантии Земли в виде хлористого водорода (НС1) в очень ранний период истории Земли (см. п. 1.3.1) и с тех пор включена в круговорот эвапориты—гидросфера (см. п. 4.4.2). [c.163]
Времена пребывания являются результатом высокой растворимости ионов и, следовательно, их отношений zjr (см. п. З.7.1.). Остальные катионы с похожими отношениями также имеют длительные времена пребывания [например, ион цезия ( s )], но они не относятся к главным в морской воде из-за их низкого содержания в земной коре. Интересным исключением является хлор. Его много в морской воде, у него большое время пребывания и тем не менее низкое содержание в земной коре. Ббльшая часть этого С1- дегазировалась из мантии Земли в виде хлористого водорода (НС1) в очень ранний период истории Земли (см. п. 1.3.1) и с тех пор включена в круговорот эвапориты—гидросфера (см. п. 4.4.2). [c.163]
Смолы ИЗ нефтей можно также уда-лять, применяя адсорбирую-пще земли или животный уголь. Эта обработка является весьма важным методом очистки нефти. Адсорбированные минеральные масла могут быть удалены бензином, а смолы — соответственными растворителями. Таким образом подбором соответственных растворителей достигается также и разделение смол. Гольде и Эйхман последовательно применяли действие бепз1ша, эфира, тяжелого бензина и хлороформа на животный уголь, адсорбировавший смесь смол. С 1юмопц,ю этих растворителей они получили экстракты, у которых удельные веса и вязкости постепенно увеличивались, а содержание углерода и водорода уменьшалось за счет повышения содержания кислорода и серы. Количество смол обычно возрастает при- переходе от низших фракций к высшим. Гурвич приводит следующие цифры, относящиеся к различным дестиллатам бакинской нефти [c.114]
Гольде и Эйхман последовательно применяли действие бепз1ша, эфира, тяжелого бензина и хлороформа на животный уголь, адсорбировавший смесь смол. С 1юмопц,ю этих растворителей они получили экстракты, у которых удельные веса и вязкости постепенно увеличивались, а содержание углерода и водорода уменьшалось за счет повышения содержания кислорода и серы. Количество смол обычно возрастает при- переходе от низших фракций к высшим. Гурвич приводит следующие цифры, относящиеся к различным дестиллатам бакинской нефти [c.114]
Для атмосферы, земной коры и океана данные приводятся в частях на миллион, т. е, в кубических сантиметрах на кубический метр (атмосфера), граммах на тонну (1000 кг) или в миллиграммах на килограмм (корг Земли) Относительная распространенность элементов на Солнце взята из работы (Ross J.E., АПиг L.H. S ien e, 1976, 191, 1223 она выражена относительно водорода (распространенность которого принята равной 1-10 ). Приводится логарифм этой относительной распространенности. Эти данные можно также найти в приложении А к работе [10]. Соответствующие значения для мышьяка, селена, теллура, иода, тантала, криптона и ксенона не приве.дены, так как их спектральные линии замаскированы линиями более распростргненных элементов. Данные для некоторых других элементов, особенно для тяжелых радиоактивных, также опущены из-за слишком малого их содержания. [c.14]
Эти данные можно также найти в приложении А к работе [10]. Соответствующие значения для мышьяка, селена, теллура, иода, тантала, криптона и ксенона не приве.дены, так как их спектральные линии замаскированы линиями более распростргненных элементов. Данные для некоторых других элементов, особенно для тяжелых радиоактивных, также опущены из-за слишком малого их содержания. [c.14]
Земная кора, включая атмосферу и гидросферу, на 76,7% состоит из таких неметаллов, как кислород, кремний, водород, хлор, фосфор, углерод, сера и азот. В морской воде — колыбели жизни на Земле — господствуют три неметалла кислород, водород и хлор. Их общее содержание в морской воде составляет 99%. [c.228]
Щелочноземельные металлы и их сплавы образуют гидриды, которые характеризуются высоким содержанием водорода у гидрида бериллия — 15,6% (масс.), магния—7,65% (масс.). Гидриды трех остальных редкоземельных металлов значительно более стабильны, чем Mgh3. Диссоциация СаНа происходит при температуре 1074 °С 8гНг при 992 °С ВаНг при 943 °С. Среди сплавов редкоземельных металлов описано много важных гидридов и особенно сплавов типа АВв, где А — редкоземельный элемент, В — не образующий гидрида переходный элемент, обычно никель или кобальт,, например, LaN 5. .. Нг ЬаСоз. .. Нг. Редкие земли очень дороги, однако технические смеси редких земель — мишметаллы — могут представлять значительный интерес. [c.89]
Среди сплавов редкоземельных металлов описано много важных гидридов и особенно сплавов типа АВв, где А — редкоземельный элемент, В — не образующий гидрида переходный элемент, обычно никель или кобальт,, например, LaN 5. .. Нг ЬаСоз. .. Нг. Редкие земли очень дороги, однако технические смеси редких земель — мишметаллы — могут представлять значительный интерес. [c.89]
Между углеродистыми водородами известен лишь один, заключающий в частице 1 атом углерода и 4 атома водорода следовательно, это есть соединение с наивысшим процентным содержанием водорода (СН содержит 25°/о водорода). Этот предельный углеродистый водород СН называется болотным газом или метаном. Если приток воздуха к остаткам растений и животных ограничен, или даже не существует, то их разложение сопровождается образованием болотного газа, будет ли это разложение происходить при обыкновенной тем-температуре, или при температуре сравнительно весьма высокой. Оттого растения, разлагающиеся в болотах,под водою, выделяют этот газ.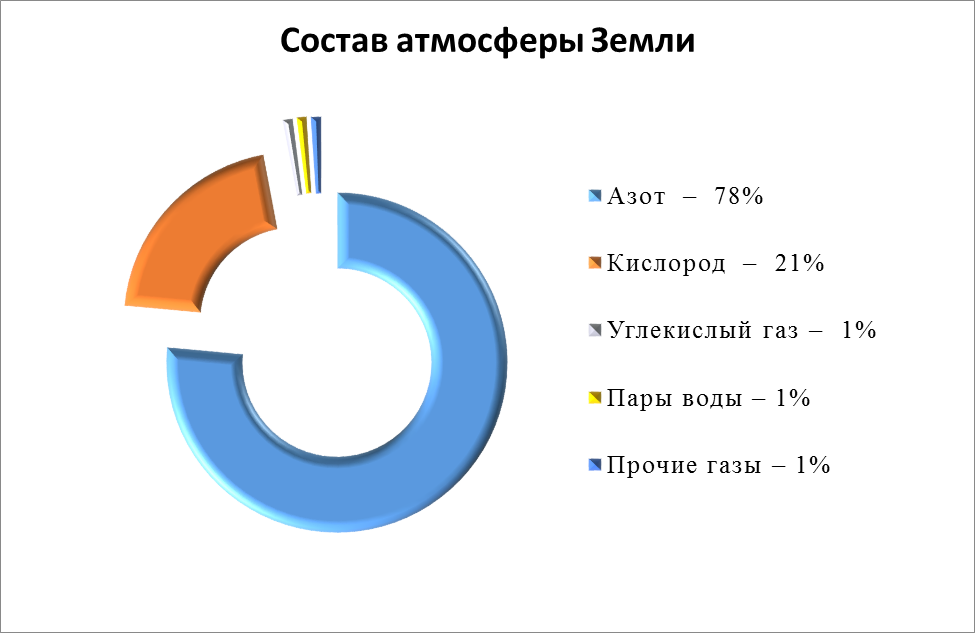 Всякий анает, что если тину болотного дна потрогать чем-нибудь, то из нее выделяется большое количество пузырей газа эти пузыри, хотя медленно, однако, выделяются и сами собою. Выделяющийся газ содержит преимущественно болотный газ, и его легко собрать, если стклянку опрокинуть в воде и в горло ее вставить (под водою же) воронку тогда пузыри газа легко уловить в отверстие воронки. Если дерево, каменный уголь и множество других растительных и животных веществ разлагаются действием жара без доступа воздуха, т.-е. подвергаются сухой перегонке, то они также выделяют вместе с другими газообразными продуктами разложения (углекислотою, водородом и различными другими веществами) много метана. Обыкновенно газ, употребляющийся для освещения — светильный газ, — получается именно этим способом, и потому он всегда содержит в себе болотный газ, смешанный с водородом и другими парами и газами, хотя он и очищается от некоторых из них [236]. А так как разложение органических остатков, образующих каменные угли, еще продолжается под землею, то в каменноугольных копях нередко продолжается еще выделение массы болотного газа, содержащего азот и СО .
Всякий анает, что если тину болотного дна потрогать чем-нибудь, то из нее выделяется большое количество пузырей газа эти пузыри, хотя медленно, однако, выделяются и сами собою. Выделяющийся газ содержит преимущественно болотный газ, и его легко собрать, если стклянку опрокинуть в воде и в горло ее вставить (под водою же) воронку тогда пузыри газа легко уловить в отверстие воронки. Если дерево, каменный уголь и множество других растительных и животных веществ разлагаются действием жара без доступа воздуха, т.-е. подвергаются сухой перегонке, то они также выделяют вместе с другими газообразными продуктами разложения (углекислотою, водородом и различными другими веществами) много метана. Обыкновенно газ, употребляющийся для освещения — светильный газ, — получается именно этим способом, и потому он всегда содержит в себе болотный газ, смешанный с водородом и другими парами и газами, хотя он и очищается от некоторых из них [236]. А так как разложение органических остатков, образующих каменные угли, еще продолжается под землею, то в каменноугольных копях нередко продолжается еще выделение массы болотного газа, содержащего азот и СО . Смешиваясь с воздухом, он дает взрывчатую смесь, составляющую одно из бедствий копей этого рода, так как подземные работы приходится вести с лампами. Но эта опасность значительно уменьшается предохранительною лампою Гумфри Деви., который заметил, что если в пламя ввести плотную металлическую сетку, то поглощается столь много тепла, что за сеткой горение не продолжается (проходящие [c.259]
Смешиваясь с воздухом, он дает взрывчатую смесь, составляющую одно из бедствий копей этого рода, так как подземные работы приходится вести с лампами. Но эта опасность значительно уменьшается предохранительною лампою Гумфри Деви., который заметил, что если в пламя ввести плотную металлическую сетку, то поглощается столь много тепла, что за сеткой горение не продолжается (проходящие [c.259]
Представляет интерес возрождение идеи Д. И. Менделеева о подземной бесшахтной газификации каменных углей, когда газификация протекает в подземном газогенераторе без извлечения топлива на поверхность, т. е. без трудоемких горных работ. Достоинство этого метода —также сохранение земельных участков от вскрытия. Метод заключается в том, что с поверхности земли к угольному пласту бурятся скважины, отстоящие друг от друга на расстоянии 25 — 30 м, после чего забои этих скважин соединяются каналом газификации по угольному пласту. Одни скважины предназначены для подвода дутья, а другие —для отвода образующихся газов. Таким образом, подземный газогенератор представляет собой систему дутьевых и газоотводящих скважин, соединенных реакционным каналом. Основной недостаток существующих способов подземной газификации на воздушном дутье — низкое содержание водорода и оксида углерода в полученном газе (Н., —12—16%, СО -—6—10%) и соответственно невысокая теплота сгорания 3000—4000 кДж/м . Такой газ целесо-эбразно применять только для энергетических целей сжиганием его на ТЭС, комбинируемых со станциями подземной газификации. Повышение содержания ценных компонентов в газе может быть достиг-.чуто применением парокислородного и кислородного дутья и совер-ленстБОванием систем подземной газификации. [c.209]
Таким образом, подземный газогенератор представляет собой систему дутьевых и газоотводящих скважин, соединенных реакционным каналом. Основной недостаток существующих способов подземной газификации на воздушном дутье — низкое содержание водорода и оксида углерода в полученном газе (Н., —12—16%, СО -—6—10%) и соответственно невысокая теплота сгорания 3000—4000 кДж/м . Такой газ целесо-эбразно применять только для энергетических целей сжиганием его на ТЭС, комбинируемых со станциями подземной газификации. Повышение содержания ценных компонентов в газе может быть достиг-.чуто применением парокислородного и кислородного дутья и совер-ленстБОванием систем подземной газификации. [c.209]
Масло МН-2 для маслонаполненных кабелей напряжением ПО—220 кв по вязкости соответствует трансформаторному. Большая подвижность этого масла необходима, чтобы масло проходило через небольшие каналы в жиле кабеля и изоляции при подпитке в процессе эксплуатации. Масло МН-2 от трансформаторного отличается применением при его изготовлении строго определенного сырья (дистиллята доссорской нефти) и проведением дополнительной очистки отбеливающей землей. Для этой цели применяют также масло МН-4 из нефти Анастаси-евского месторождения. Из-за более высокого содержания ароматических углеводородов это масло более стабильно в электрическом поле, чем масло МН-2 в процессе эксплуатации не выделяет, а поглощает водород. В масло МН-4 вводят специальные присадки для повышения термической стабильности. [c.308]
Для этой цели применяют также масло МН-4 из нефти Анастаси-евского месторождения. Из-за более высокого содержания ароматических углеводородов это масло более стабильно в электрическом поле, чем масло МН-2 в процессе эксплуатации не выделяет, а поглощает водород. В масло МН-4 вводят специальные присадки для повышения термической стабильности. [c.308]
Каким образом атмосфера Земли достигла более чем 20% содержания кислорода, в то время как в атмосферах ближайших соседей, Венеры и Марса, его концентрации менее 0,1 /о Земля обладает атмосферой, которая в течение сотен миллионов лет как бы игнорировала законы физики и химии. Малые окисляемые составляющие атмосферы, такие, как метан, аммиак, водород, моноксид углерода и оксид трехвалентного азота, сохранились в присутствии больших концентраций кислорода. Термодинамические рассуждения указывают на неизбеж- [c.211]
Водород — один из наиболее распространенных элементов на Земле. Его общее содержание в земной коре составляег 1%(масс.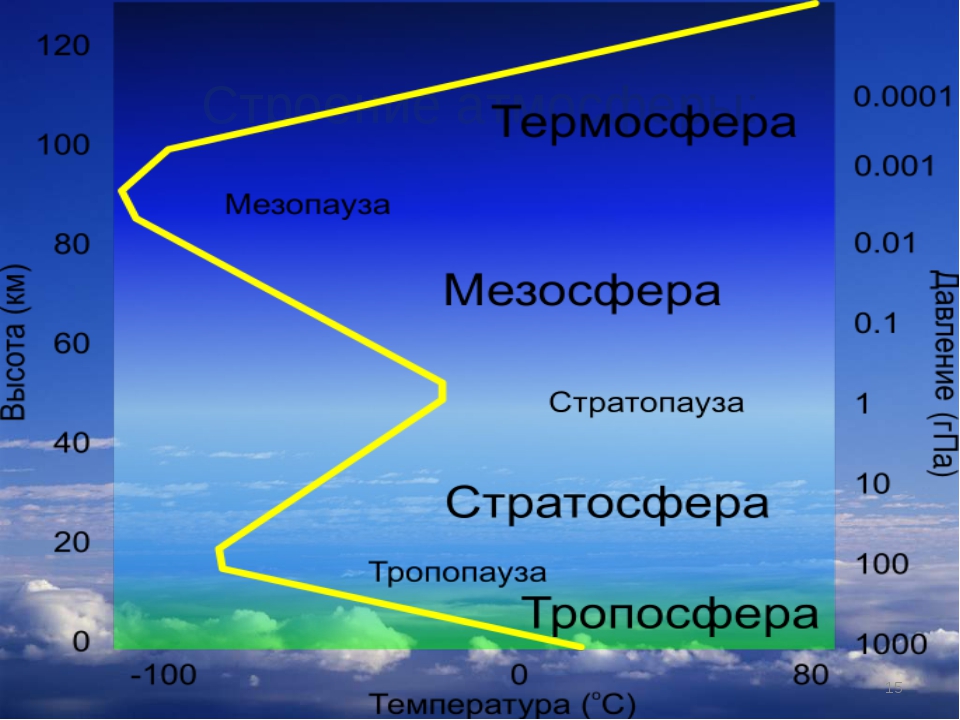 ). При пересчете на атомарные [c.251]
). При пересчете на атомарные [c.251]
Содержание гелня на Земле невелико, однако он очень распространен в космосе (занимает второе место после водорода). Впервые этот элемент был обнаружен на Солнце методом спектрального анализа, что обусловило его название гелий (от греч. helios — Солнце). [c.106]
Наибольшее распространение получило первое направление. Сначала в Ленинграде усилиями Главной геофизической обсерватории им. А. И. Воейкова [16], а затем в Москве и других промышленных городах и промышленных узлах были установлены для систематического наблюдения за состоянием воздушной среды стационарные павильоны размером в плане 2X2 м и высотой 2,9 м, в них размещаются метеорологические приборы и газоанализаторы. Пробы воздуха для анализа содержания вредных веществ отбираются на высоте около 3 м от земли. Измеряются концентрации наиболее распространенных вредных веществ диоксида серы, оксида углерода, диоксида азота и ингредиенты, характерные для промышленных, объектов данного города, например хлор, фторид водорода, фториды и др. В стенках павильона на высоте 1,5 м имеются отверстия, через которые отбирают пробы воздуха с наветренной стороны на аэрозольные примеси (пыль, сажа и др.). Переключение на забор воздуха с наветренной стороны происходит автоматически от датчиков — флюгара, установленного на мачте высотой около 8 м. Также вне павильона размещаются метеорологический прибор анеморумбограф для регистрации скорости и направления ветра. Применение автоматических газоанализаторов дает возможность централизованно контролировать загрязнение воздуха в городах и промышленных центрах (работы Берлянда М. Е. [16] и Щербань А. Н. [75]). Централизованная система контроля включает регистрацию автоматическими газоанализаторами концентраций различных вредных веществ и метеорологических [c.136]
В стенках павильона на высоте 1,5 м имеются отверстия, через которые отбирают пробы воздуха с наветренной стороны на аэрозольные примеси (пыль, сажа и др.). Переключение на забор воздуха с наветренной стороны происходит автоматически от датчиков — флюгара, установленного на мачте высотой около 8 м. Также вне павильона размещаются метеорологический прибор анеморумбограф для регистрации скорости и направления ветра. Применение автоматических газоанализаторов дает возможность централизованно контролировать загрязнение воздуха в городах и промышленных центрах (работы Берлянда М. Е. [16] и Щербань А. Н. [75]). Централизованная система контроля включает регистрацию автоматическими газоанализаторами концентраций различных вредных веществ и метеорологических [c.136]
Все Э. X. образовались в результате многообразных сложных процессов ядерного синтеза в звездах и космич. пространстве. Эти процессы описываются разл. теориями происхождения Э. X., к-рые объясняют особенности распространенности Э. X. в космосе. Наиб, распространены в космосе водород и гелий, а в целом распространенность элементов уменьшается по мере роста 2. Такая жЬ тенденция сохраняется и для распространенности Э. х. на Земле, однако на Земле наиб, распространен кислород (47% от массы земной коры), далее следуют кремний (27,6%), алюминий (8,8%), железо (4,65%). Эти элементы вместе с кальцием, натрием, калием и магнием составляют более 99% массы земной коры, так что на долю остальных Э. х. приходится менее 1% (см. Кларки химических элементов). Практич. доступность Э. х.. определяется не только величинои их распространенности, но и способностью концентрироваться в ходе геохим. процессов. Нек-рые Э.х. не образзтот собств. минералов, а присугствуют в виде примесей в минералах других. Они наз. рассеянными (рубидий, галлий, гафний и др.). Э. х., содержание к-рых в земной коре менее 10 -10 %, объединяются понятием редких (см. Редкие элементы). [c.472]
X. в космосе. Наиб, распространены в космосе водород и гелий, а в целом распространенность элементов уменьшается по мере роста 2. Такая жЬ тенденция сохраняется и для распространенности Э. х. на Земле, однако на Земле наиб, распространен кислород (47% от массы земной коры), далее следуют кремний (27,6%), алюминий (8,8%), железо (4,65%). Эти элементы вместе с кальцием, натрием, калием и магнием составляют более 99% массы земной коры, так что на долю остальных Э. х. приходится менее 1% (см. Кларки химических элементов). Практич. доступность Э. х.. определяется не только величинои их распространенности, но и способностью концентрироваться в ходе геохим. процессов. Нек-рые Э.х. не образзтот собств. минералов, а присугствуют в виде примесей в минералах других. Они наз. рассеянными (рубидий, галлий, гафний и др.). Э. х., содержание к-рых в земной коре менее 10 -10 %, объединяются понятием редких (см. Редкие элементы). [c.472]
Гидросферы состав — Справочник химика 21
Если сравнить химический состав Земли с составом Вселенной, то, казалось бы, между ними не должно быть существенных различий, за исключением, пожалуй, водорода, который легко уходит из атмосферы в межпланетное пространство. К сожалению, судить о составе Земли можно лишь по составам атмосферы, гидросферы и земной коры, изученной в глубину не более чем на 20 км. Главная химическая особенность этих трех сфер — необычайно высокое содержание кислорода, что объясняется уже не строением ядер его атомов, а его химическими свойствами. Атомы кислорода способны образовывать прочные химические связи с атомами многих элементов, в том числе кремния и алюминия. В процессе образования земной коры эти элементы накапливались в ней благодаря легкоплавкости их соединений со щелочами. В итоге на поверхности нашей планеты выкристаллизовалась твердая кремнекислородная оболочка. Кислород, не считая воды, входит в состав 1364 минералов. В атмосфере кислород появился около 1,8 млрд. лет назад в результате действия на минералы микроорганизмов. В настоящее время выделение кислорода растениями за счет фотосинтеза возмещает его убыль в атмосфере в ходе процессов окисления, горения, гниения, дыхания. По числу известных природных соединении (432) второе место занимает кремний.
К сожалению, судить о составе Земли можно лишь по составам атмосферы, гидросферы и земной коры, изученной в глубину не более чем на 20 км. Главная химическая особенность этих трех сфер — необычайно высокое содержание кислорода, что объясняется уже не строением ядер его атомов, а его химическими свойствами. Атомы кислорода способны образовывать прочные химические связи с атомами многих элементов, в том числе кремния и алюминия. В процессе образования земной коры эти элементы накапливались в ней благодаря легкоплавкости их соединений со щелочами. В итоге на поверхности нашей планеты выкристаллизовалась твердая кремнекислородная оболочка. Кислород, не считая воды, входит в состав 1364 минералов. В атмосфере кислород появился около 1,8 млрд. лет назад в результате действия на минералы микроорганизмов. В настоящее время выделение кислорода растениями за счет фотосинтеза возмещает его убыль в атмосфере в ходе процессов окисления, горения, гниения, дыхания. По числу известных природных соединении (432) второе место занимает кремний. Далее по распространенности атомов в земной коре следуют алюминий, натрий, железо, кальций, магний и калий [c.201]
Далее по распространенности атомов в земной коре следуют алюминий, натрий, железо, кальций, магний и калий [c.201]
Вода — самое распространенное на Земле соединение она составляет в основном всю гидросферу, входит в состав минералов и гарных пород, находится в растениях и животных, составляя от 50 до 99% их веса, присутствует в почве и атмосфере. Вода имеет очень важное значение в разнообразных процессах и явлениях живой и неживой природы и в практической деятельности человека. Она является наиболее изученным соединением некоторые из ее свойств использованы в качестве основы при определении единиц измерения таких физических величин, как масса, плотность, температура, теплота и теплоемкость. [c.321]
В виде оксида углерода (IV) СО2 (углекислого газа) углерод входит в состав атмосферы (0,03% по объему). В гидросфере растворено в 60 раз больше углекислого газа, чем его находится в атмосфере. [c.130]
[c.130]
Океаны, безусловно, являются крупнейшими резервуарами гидросферы (см. рис. 1.4) и существуют по меньшей мере уже 3,8 миллиардов лет. Жизнь на Земле, вероятно, возникла в морской воде, и океаны важны для смягчения колебаний глобальной температуры. Речные воды, дренирующие сушу континентов, попадают в океаны через дельты. Здесь пресные воды смешиваются с морской водой. Химический состав морской воды сильно отличается от состава пресной, и это различие оказывает влияние на транспорт некоторых растворенных и твердых компонентов. Кроме того, человек часто нарушает природные химические процессы прибрежных областей как посредством загрязнения потока пресной воды, так и за счет хозяйственной деятельности, сосредоточенной вблизи дельт и мелких морей. [c.151]
Водород широко распространен в природе. Он входит в состав воды, некоторых горных пород, ископаемого топлива, всех растительных и животных организмов. Содержание водорода в земной коре (литосфере и гидросфере) составляет около 1 % мае. , в атмосфере в свободном состоянии водород присутствует в ничтожных количествах (10″ % об.). Основными промышленными источниками водорода являются вода, природные углеводородные газы, обратный коксовый газ, генераторные газы. Помимо этого, водород — побочный продукт ряда производств синтеза ацетилена, электролитического получения щелочей. [c.204]
, в атмосфере в свободном состоянии водород присутствует в ничтожных количествах (10″ % об.). Основными промышленными источниками водорода являются вода, природные углеводородные газы, обратный коксовый газ, генераторные газы. Помимо этого, водород — побочный продукт ряда производств синтеза ацетилена, электролитического получения щелочей. [c.204]
Для А. характерен постоянный обмен в-вом и энергией с гидросферой, литосферой и живыми организмами, а также с космич, пространством. Плотность, давление и состав воздуха непрерывно меняются при увеличении расстояния от поверхности Земли. А. делят на оболочки-тропосферу, стратосферу, мезосферу, ионосферу и экзосферу. Переходные области А. между соседними оболочками называют соотв. тропопауза, стратопауза и т. п. [c.212]
Существенно иной состав гидросферы (табл. 3). [c.10]
Водород широко распространен в природе. Содержание его в земной коре (атмосфера, литосфера и гидросфера) составляет 17 ат. о. Он входит в состав воды, глин, каменного и бурого угля, нефти и т. д., а также во все животные и растительные организмы. В свободном состоянии водород встречается крайне редко (в вулканических и других природных газах). Водород — самый распространенный элемент космоса он составляет до половины массы Солнца и большинства звезд. Гигантские планеты солнечной системы Юпитер и Сатурн в основном состоят из водорода. Он присутствует в атмосфере ряда планет, в кометах, газовых туманностях и межзвездном газе. [c.288]
Содержание его в земной коре (атмосфера, литосфера и гидросфера) составляет 17 ат. о. Он входит в состав воды, глин, каменного и бурого угля, нефти и т. д., а также во все животные и растительные организмы. В свободном состоянии водород встречается крайне редко (в вулканических и других природных газах). Водород — самый распространенный элемент космоса он составляет до половины массы Солнца и большинства звезд. Гигантские планеты солнечной системы Юпитер и Сатурн в основном состоят из водорода. Он присутствует в атмосфере ряда планет, в кометах, газовых туманностях и межзвездном газе. [c.288]
Все вещества, которые нас окружают и которые мы используем в своей деятельности, условно можно разделить на две большие совокупности возникшие естественным путем в ходе эволюции Земли и полученные искусственно, синтетически. К первым можно отнести кислород воздуха, воду, глину (глинозем), различные соли, нефть, уголь, т. е. вещества минерального, растительного и животного происхождения.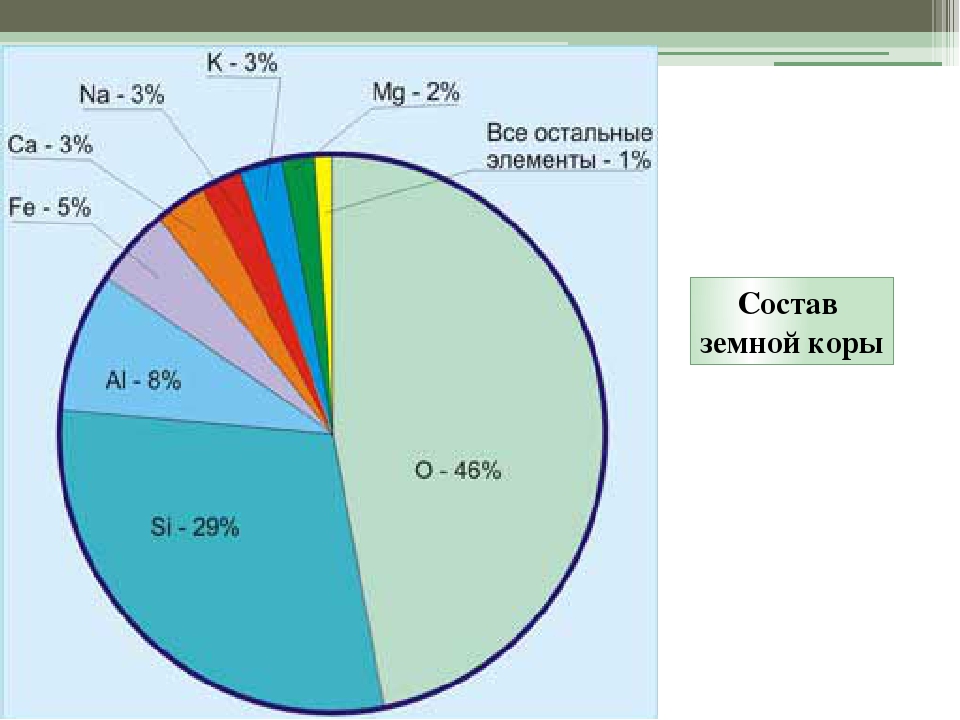 С ними вы познакомились в курсе природоведения и в начальном курсе химии. Одни из этих веществ играют очень важную и заметную роль в тех постоянно и непрерывно идущих процессах круговорота веществ, которые создают устойчивый баланс их в атмосфере и гидросфере. Так, достаточно устойчивым, постоянным оказывается и поддерживается отношение (баланс) углекислого газа и кислорода воздуха. Химическое изучение и описание этих веществ показывает, что они имеют разнообразные состав, строение и свойства. Так, в атмосфере находятся атомы инертных газов (Не, Ме, Аг, Кг, Хе), молекулы кислорода Оа, азота N2, диоксида углерода (углекислого газа) СОг, пары воды Н2О, озон Оз, некоторое количество газообразных и твердых веществ (пыль), являющихся как результатом естественных процессов, так и отходами (выбросами, побочными продуктами) химических производств, транспорта, переработки сырья и т. п. [c.5]
С ними вы познакомились в курсе природоведения и в начальном курсе химии. Одни из этих веществ играют очень важную и заметную роль в тех постоянно и непрерывно идущих процессах круговорота веществ, которые создают устойчивый баланс их в атмосфере и гидросфере. Так, достаточно устойчивым, постоянным оказывается и поддерживается отношение (баланс) углекислого газа и кислорода воздуха. Химическое изучение и описание этих веществ показывает, что они имеют разнообразные состав, строение и свойства. Так, в атмосфере находятся атомы инертных газов (Не, Ме, Аг, Кг, Хе), молекулы кислорода Оа, азота N2, диоксида углерода (углекислого газа) СОг, пары воды Н2О, озон Оз, некоторое количество газообразных и твердых веществ (пыль), являющихся как результатом естественных процессов, так и отходами (выбросами, побочными продуктами) химических производств, транспорта, переработки сырья и т. п. [c.5]
Водород является одним из наиболее распространенных в природе элементов. Содержание его в литосфере, атмосфере и гидросфере составляет 17% (ат.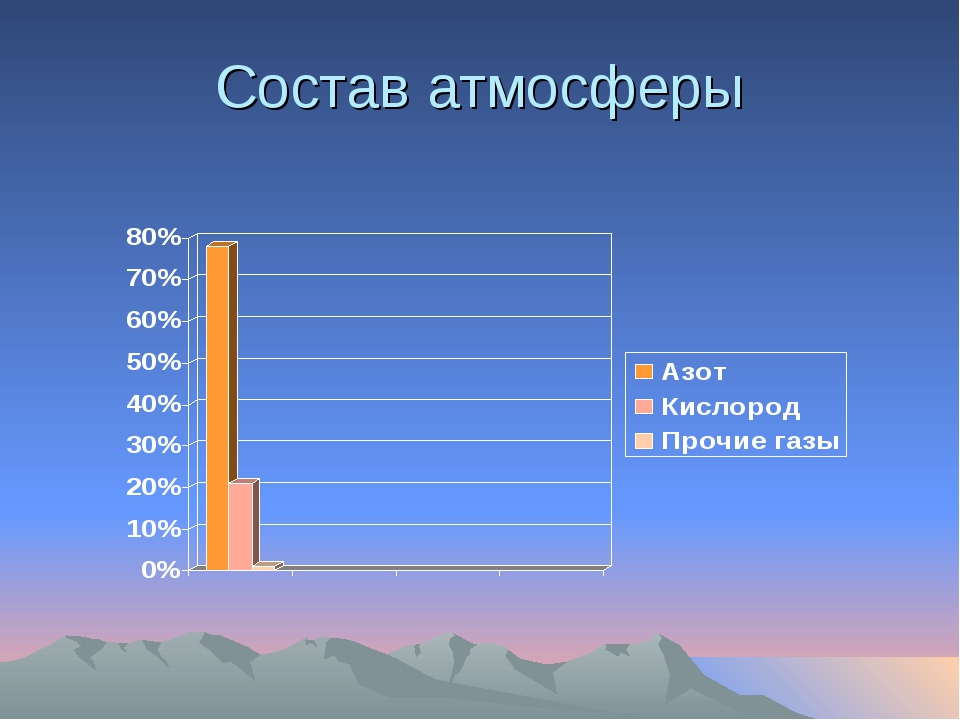 ). В свободном состоянии он встречается очень редко (вулканические и природные газы). Водород входит в состав воды, угля, нефти, природного газа и многих других минеральных и органических веществ, а также практически во все животные организмы и растения. Он самый распространенный элемент космоса. Половину массы Солнца и большинства звезд составляет водород. Юпитер и Сатурн в основном состоят из водорода. [c.18]
). В свободном состоянии он встречается очень редко (вулканические и природные газы). Водород входит в состав воды, угля, нефти, природного газа и многих других минеральных и органических веществ, а также практически во все животные организмы и растения. Он самый распространенный элемент космоса. Половину массы Солнца и большинства звезд составляет водород. Юпитер и Сатурн в основном состоят из водорода. [c.18]
Для установления вероятных путей эволюции химических систем целесообразно разделить области, в которых соверщались структурообразующие процессы, на твердофазную, жидкофазную и газообразную. На языке геологов это соответствует литосфере, гидросфере и атмосфере. Все эти системы открытые, и, руководствуясь только поисками равновесных состояний, исследователь всегда рискует совершить ошибку. Если, например, по отношению к ядру Земли и ее мантии можно обсуждать вопрос о процессах, ведущих к равновесию, и даже, с известным приближением, принимать какое-то данное состояние за равновесное, то по отношению к атмосфере и гидросфере такое утверждение было бы не-верным. Нижние слои атмосферы за периоды времени, короткие сравнительно с геологическими, сохраняют равновесный состав, но верхние части газовой оболочки ( хемосфера ) подвергаются интенсивным лучевым воздействиям и служат ареной разнообразных реакций, среди которых радикальным процессам принадлежит ведущая роль. [c.371]
Нижние слои атмосферы за периоды времени, короткие сравнительно с геологическими, сохраняют равновесный состав, но верхние части газовой оболочки ( хемосфера ) подвергаются интенсивным лучевым воздействиям и служат ареной разнообразных реакций, среди которых радикальным процессам принадлежит ведущая роль. [c.371]
Водород является одним из наиболее распространенных элементов. Общее его количество составляет 1% от общей массы атмосферы, гидросферы и литосферы, или 17 ат.%. Основная масса водорода находится в связанном состоянии — в виде различных соединений. Так, вода содержит его около 11% по массе, глина — около 1,5% и т. д. В виде соединений с углеродом водород входит в состав нефти, различных природных газов и всех живых организмов. Свободный водород содержится в вулканических газах. В природе он образуется также при разложении некоторых органических остатков. Наибольшее количество его выделяется [c.606]
Почти три четверти земной поверхности покрыто водой. Это главным образом воды океанов. Данная часть Земли называется гидросферой. Она, по существу, представляет собой водный раствор неорганического электролита сложного состава. Элементный состав гидросферы приведен ниже [c.88]
Это главным образом воды океанов. Данная часть Земли называется гидросферой. Она, по существу, представляет собой водный раствор неорганического электролита сложного состава. Элементный состав гидросферы приведен ниже [c.88]
Земная кора, гидросфера и атмосфера образовались в основном в результате высвобождения веществ из верхней мантии молодой Земли. В настоящее время формирование океанической коры происходит в срединных хребтах океанов и сопровождается выходом газов и небольщих количеств воды. Подобные процессы отвечали, по-видимому, и за образование коры на молодой Земле, за счет них сформировалась оболочка из породы толщиной менее 0,0001% объема всей планеты (см. рис. 1.2). Состав этой оболочки, образующей континентальную и океаническую кору, эволюционировал во времени прежде всего за счет возгонки элементов из мантии в результате частичного плавления на глубине примерно 100 км. Средний химический состав современной коры (рис. 1.3) показывает, что кислород содержится в ней в наибольшем количестве, сочетаясь в разных видах с кремнием, алюминием (А1) и другими элементами с образованием силикатов. [c.18]
[c.18]
Решающее влияние на эволюцию всех сфер Земли, прежде ьсего на биосферу, оказали зарождение и последующее интенсивное развитие фотосинтеза зеленых растений, затем возникновение живых организмов. Развитие фотосинтеза приводило к выделению больших количеств свободного кислорода в гидросфере, затем в с1Тмосфере и накоплению массы живого вещества сначала в океане, потом и на суше. Поглощаемый фотосинтезом углекислый газ постепенно убывал в атмосфере Земли. Аммиак и метан практически полностью исчезли из атмосферы в результате окисления. Земная атмосфера приобретала качественно новый, близкий к современному азотно-кислородный состав с небольшим количеством углекислого газа. Подобные процессы с изменением химического состава происходили как в морской воде, так и горных породах Земли. И морской воде в результате ускорения окислительных процессов кислоты превратились в соли металлов (хлориды, сульфаты натрия, 1 алия, кальция и т.
 д.). С изменением pH морской воды менялись [c.42]
д.). С изменением pH морской воды менялись [c.42]К.-наиб, распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. К., в гидросфере и литосфере — соотв. 85,82 и 47% по массе связанного К. Известно более 1400 минералов, в состав к-рых входит К. Убыль К. в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением К. растениями при фотосинтезе. К. входит в состав всех в-в, из к-рых построены живые организмы в организме человека его содержится ок. 65%. [c.387]
Сведения о составе Земли, особенно в тех ее частях, которые изучены человеком, гораздо достовернее, чем данные о происхождении элементов. Обсуждая состав Земли мы вынуждены ограничиться лишь ее доступными частями — земной корой, гидросферой и атмосферой. Внутренние части Земли — ядро и мантия,— по-видимому, со- [c.442]
Приведенный состав глубинных газов должен был определять восстановительный характер атмосферы, и если в конце концов произошел переход к современной окислительной атмосфере, то ответственным за это фактором была жизнедеятельность фотосинтезирующих организмов. С момента появления жизни на Земле дальнейшая химическая эволюция внешних ее оболочек — атмосферы, гидросферы и верхней части литосферы -определялась главным образом биотой (под биотой понимают совокупность всех живых организмов). [c.49]
С момента появления жизни на Земле дальнейшая химическая эволюция внешних ее оболочек — атмосферы, гидросферы и верхней части литосферы -определялась главным образом биотой (под биотой понимают совокупность всех живых организмов). [c.49]
Состав газожидких включений. Главная составная часть включений — вода. Ее количество во включениях и капиллярах литосферы, по В. И. Вернадскому, равно 10 г, что соизмеримо с количеством Н2О в гидросфере (1,4- 10 г). Второе место по объему занимает СО2. Количество углекислоты меньше количества воды примерно на один-два порядка. Далее идут газы, содержание которых измеряется целыми числами и десятыми долями процента, — N2, СН4, Аг, Не, НгЗ и др. [c.42]
Содержание В. в земной коре (литосфере и гидросфере) 1% по массе, или 16 ат. %, в атмосфере -10 ат, %, В природе В. распространен чаще всего в виде соед, с О, С, 8, N и С1, реже-с Р, 1, Вг и др. элементами он входит в состав всех растительных и животных организмов, нефти, ископаемых углей, прир. газа, воды, ряда минералов и пород (в форме гидратов), В своб, состоянии на Земле встречается очень редко (в небольших кол-вах — в вулканич. газах и продуктах разложения орг. остатков). В.-самый распространенный элемент Вселенной в виде плазмы он составляет ок. половниы массы Солнца и большинства звезд, осн, часть газа межзвездной среды и газовых туманностей. [c.400]
газа, воды, ряда минералов и пород (в форме гидратов), В своб, состоянии на Земле встречается очень редко (в небольших кол-вах — в вулканич. газах и продуктах разложения орг. остатков). В.-самый распространенный элемент Вселенной в виде плазмы он составляет ок. половниы массы Солнца и большинства звезд, осн, часть газа межзвездной среды и газовых туманностей. [c.400]
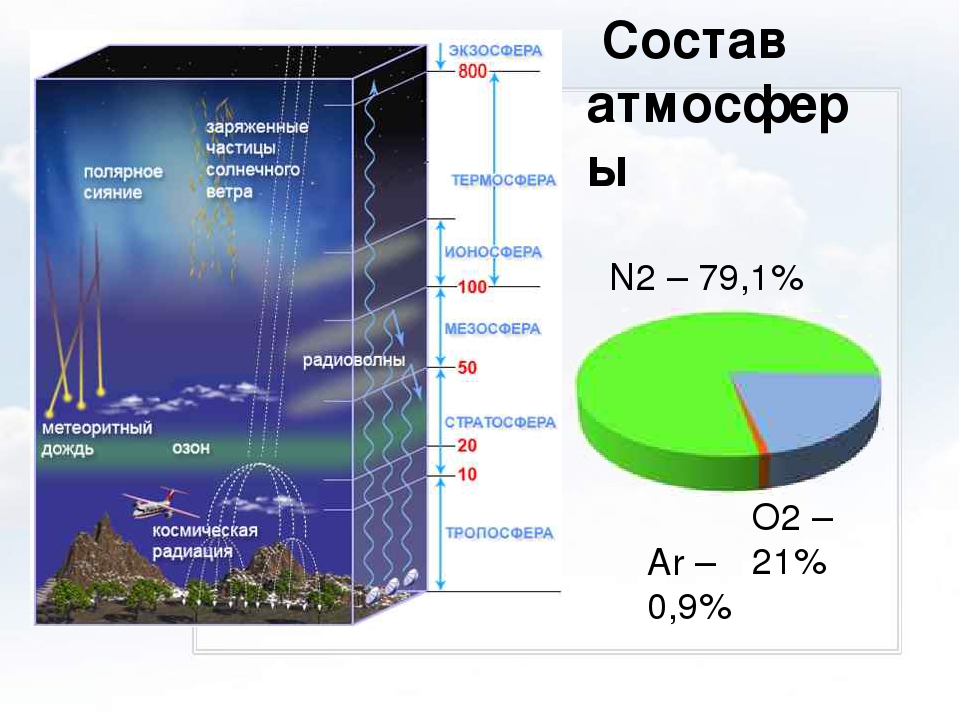
Атмосфера, так же как и Земля, имеет оболочковое строение. В первой оболочке (гомосфере) шириной примерно 85 км, которая соприкасается с литосферой и с гидросферой сосредоточено 99,999 % массы всей атмосферы. Для гомосферы характерна однородность газового состава, которая достигается интенсивным перемешиванием воздушных масс. Гомосфера (состав ее приводится в табл. 16) оказывает прямое воздействие на все природные процессы, происходящие на земной поверхности, в том числе и на формирование состава скоплений углеводородных газов. Основными компонентами гомосферы являются азот, составляющий 78,084% на сухой воздух, и кислород, содержание которого равно 20,946 %. Кроме указанных в табл. 16 газов и паров воды в атмосферном воздухе присутствуют и некоторые другие примеси, например органические фитонциды, аэрозоли, частицы пыли и др. С наступлением промышленной эры развития цивилизации в атмосферу поступают вещества промышленного происхождения углекислый газ, оксид углерода, метан, оксиды азота, сернистый газ. [c.254]
Кроме указанных в табл. 16 газов и паров воды в атмосферном воздухе присутствуют и некоторые другие примеси, например органические фитонциды, аэрозоли, частицы пыли и др. С наступлением промышленной эры развития цивилизации в атмосферу поступают вещества промышленного происхождения углекислый газ, оксид углерода, метан, оксиды азота, сернистый газ. [c.254]
Газы вулканов играют важную роль в геохимическом круговороте газов, они участвуют в формировании газов атмосферы и гидросферы. Количество выделяющихся газов при извержениях огромно. Они в определенной степени отражают газовый состав верхней мантии Земли. Однако по пути движения газы довольно сильно меняют свой состав. Благодаря снижению давления и температуры происходит частичное выпадение из газов твердой и жидкой фаз. Кроме того, горячие газы могут экстрагировать ОВ из осадочных пород, которые прорываются вулканическими извержениями. [c.263]
Формирование осадочной оболочки Земли — стратисферы происходило в тесном взаимодействии с атмосферой и гидросферой, а — кже было связано с процессами вулканизма как поставщиками газов и туфогенного материала. Состав и распространенность осадочных толщ разного геологического возраста — отражение комплекса естественных процессов в биосфере нашей планеты [6]. [c.150]
Состав и распространенность осадочных толщ разного геологического возраста — отражение комплекса естественных процессов в биосфере нашей планеты [6]. [c.150]
Гидросфера — водная оболочка Земли, включающая океаны, моря, континентальные водоемы и ледяные покровы материков. Гидросфера обуславливает существование биологической жизни на планете, так как вода — необходимый компонент всех биологических процессов. Естественные водоемы, входящие в состав гидросферы, служат источниками промышленного и бытового снабжения водой, источниками энергии, путями сообщения. Свыше 95% всех вод гидросферы приходится на долю Мирового океана, играющего важную роль в поддержании жизни на Земле путем синтеза белковых веществ и жиров в массе фитопланктона, насыщения атмосферы кислородом, регуляции обмена веществ и поддержания динамического равновесия в природе. Промышленное производство приводит к загрязнению, засорению и истощению (континентальные водоемы) гид-росфер >1, в том числе и вод Мирового океана. [c.8]
[c.8]
Магний среди металлов занимает особое место. Его плотность (1,729 г/см ) на /з меньше плотности алюминия, а прочность почти в 2 раза выше. Эти качества обеспечивают сплавам на основе магния ведущее место в авиастроении. Магний — серебристо-белый металл, довольно тягуч и может быть прокатан в тонкие листы. В природе магний широко распространен в виде соединений (восьмое место по содержанию в земной коре, или 1,87% по массе). Он имеет три стабильных изотопа Mg (78,60%), (10,11%), (11,29%). Основные минералы — магнезит Mg Oз, доломит МеСОзХ X СаСОз. Запасы их практически неисчерпаемы. В состав основных пород входят многие силикаты магния оливин, тальк, асбест и др. В гидросфере содержатся колоссальные запасы растворенных солей магния (уже сейчас магний добывают из морской воды). Зеленый пигмент растений — хлорофилл содержит 2,7% Мё. [c.147]
ГИДРОХИМИЯ, изучает хим. состав прир. вод и его зависимость от хим., физ. и биол. процессов в окружающей среде..jpg) Включает исследование св-в воды как р-рителя минералов земной коры, хим. процессов, происходящих в воде при взаимод. с породами, почвами, атмосферным воздухом и организмами, миграции хим. элементов в гидросфере. Выделяют Г. определ. видов прир. вод рек и озер, морей, гюдземных и атмосферных вод. Для гидрохим. исследований использ. разл. методы аналит. химии, в т. ч. спектральный анализ., хроматография, полярография. [c.134]
Включает исследование св-в воды как р-рителя минералов земной коры, хим. процессов, происходящих в воде при взаимод. с породами, почвами, атмосферным воздухом и организмами, миграции хим. элементов в гидросфере. Выделяют Г. определ. видов прир. вод рек и озер, морей, гюдземных и атмосферных вод. Для гидрохим. исследований использ. разл. методы аналит. химии, в т. ч. спектральный анализ., хроматография, полярография. [c.134]
ГИДРОХЙМИЯ, изучает хим. состав прир. вод и его зависимость от хим., физ. и бнол. процессов в окружающей среде. Сформировалась в 1-Й пол. 20 в. Включает исследование св-в воды как р-рителя минералов земной коры, изучение хнм. процессов в воде при ее взаимод. с породами, почвами, атмосферным воздухом и организмами, миграции хим. элементов в гидросфере. [c.570]
Вода (оксид водорода) НгО — химическое соединение водорода с кислородом. Содержит 88,8 % кислорода и 11,2 % водорода. Бесцветная жидкость, без запаха, вкуса и цвета. Состав В. был установлен А. Лавуазье в 1783 г. синтезом из водорода и кислорода. В.— самое распространенное на Земле соединение. Оно образует гидросферу, входит в состав минералов и горных пород, растений и животных. Ряд физических свойств В. аномален. Электропроводность чистой В. объясняется частичной диссоциацией ее молекул на иины Н иОН . Жидкая вода, леди пар находятся в равновесии при 6 10 Па и 0,0100°С. Процесс растворения веществ в [c.31]
Состав В. был установлен А. Лавуазье в 1783 г. синтезом из водорода и кислорода. В.— самое распространенное на Земле соединение. Оно образует гидросферу, входит в состав минералов и горных пород, растений и животных. Ряд физических свойств В. аномален. Электропроводность чистой В. объясняется частичной диссоциацией ее молекул на иины Н иОН . Жидкая вода, леди пар находятся в равновесии при 6 10 Па и 0,0100°С. Процесс растворения веществ в [c.31]
Химическая экология природных вод. Химический состав и классификация природных вод. Макрокомпоненты хлорид-, сульфат-, карбо-нат- и гидрокарбонат-ионы, катионы натрия, калия, магния, кальция. Ионы кремния, железа, алюминия, фосфора, азота в разных степенях окисления, органические вещества в природных водах. Микрокомноненты ионы лития, стронция, меди, серебра, хрома, марганца, бромид-, иодид-ионы и их способность к комилексообразовапию. Эколого-химические особенности загрязнения гидросферы. Металлы как загрязняющие вещества источники ностунления в воду, токсические эффекты, химическое состояние. Органические соединения — загрязнители вод разных типов хлорорганические, фосфорорганические соединения. Особенности нефтяного загрязнения. Детергенты в природных водах. Коллоидные ПАВ и их влияние на загрязнение природной воды. [c.4]
Органические соединения — загрязнители вод разных типов хлорорганические, фосфорорганические соединения. Особенности нефтяного загрязнения. Детергенты в природных водах. Коллоидные ПАВ и их влияние на загрязнение природной воды. [c.4]
Суть явления заключается в том, что в условиях постоянного притока солнечной радиации благодаря биоте происходит непрерывное движение биофильных элементов (С, М, Н, О, 8, Р, Са, Ге) через состояния с высоким химическим потенциалом, когда эти элементы входят в состав живых тканей, к состояниям с низкими уровнями энергии — по мере разложения тканей. Таким образом, возникает своеобразный, интерактивный по своей природе планетарный метаболизм — совокупность взаимосвязанных физических, химических и биологических процессов. Именно такая совокупность процессов определяет химический состав атмосферы, гидросферы и земной поверхности и, в конечном счете, все характеристики окружающей природной среды, делающие ее пригодной для существования современных нам форм жизни на планете. К числу таких характеристик относятся прежде всего радиационный режим и климат Земли. [c.8]
К числу таких характеристик относятся прежде всего радиационный режим и климат Земли. [c.8]
Постоянство основного состава атмосферы и гидросферы в условиях продолжающейся однонаправленной дегазации земных недр на первый взгляд кажется удивительным. В принципе, такая дегазация (даже на современном ее уровне) способна относительно быстро изменить химический состав окружающей среды, сделав ее совершенно непригодной для подавляющего большинства живых организмов. И если этого не происходит, то исключительно благодаря регулирующей деятельности биоты, образовавшей вместе с прилегающими к поверхности планеты оболочками (нижней атмосферой, гидросферой и самой верхней частью литосферы) крупнейшую из всех известных нам экологических систем — биосферу Земли. [c.73]
Наземные загрязнения. Важное значение имеют не только объемы и состав нефтяных загрязнений, но и форма их поступления в гидросферу. Обычно рассматривают варианты поступления нефти в виде нефтяных потоков или сликов, которые затем трансформируются со временем в эмульсии и другие формы.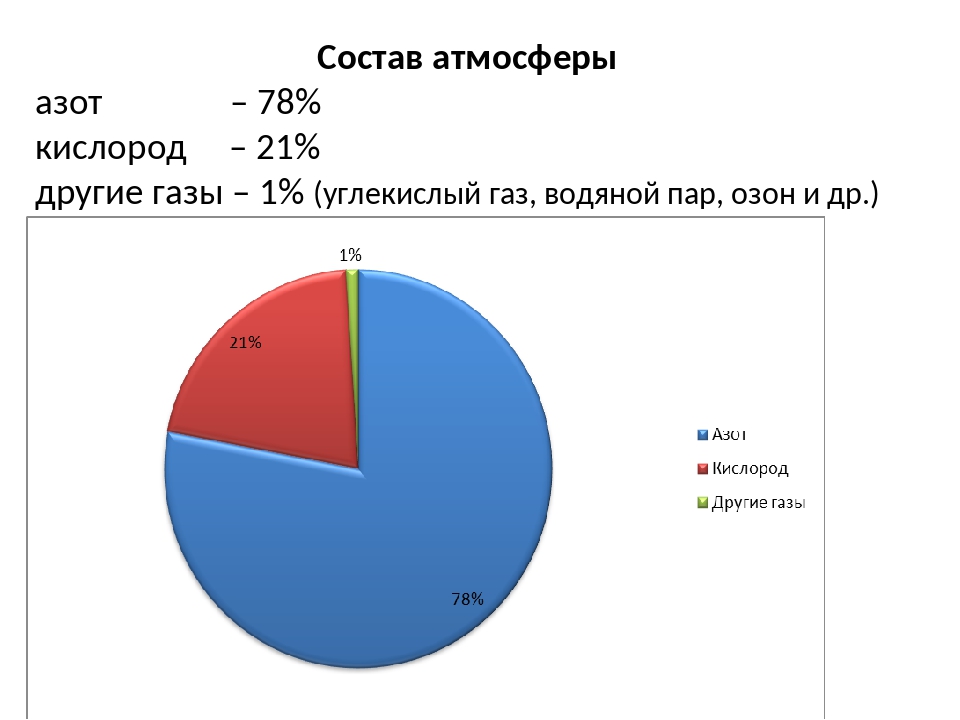 Это вероятно только при аварийных разливах нефти. Вопреки широко распространенному мнению, свыше 75 % нефтяных загрязнений, преимущественно в эмульгированном состоянии, поступают в гидросферу при безаварийных ситуациях с нефтесодержащими водами, объемы которых составляют сотни миллиардов кубических метров в год, а содержание в них нефти часто превышает ПДК в сотни тысяч раз [70]. Поступление нефтяных загрязнений в гидросферу происходит за счет добычи и хранения нефти и нефтепродуктов, эксплуатации оборудования нефтеперерабатывающих, нефтехимических, машиностроительных заводов и производств, автомобильного транспорта и т.п. По различным оценкам, в процессе добычи, подготовки и транспорта теряется от 1 до 16,5 % добываемой нефти и продуктов ее переработки. Из них до 20 % нефти попадает в водоемы [190]. [c.14]
Это вероятно только при аварийных разливах нефти. Вопреки широко распространенному мнению, свыше 75 % нефтяных загрязнений, преимущественно в эмульгированном состоянии, поступают в гидросферу при безаварийных ситуациях с нефтесодержащими водами, объемы которых составляют сотни миллиардов кубических метров в год, а содержание в них нефти часто превышает ПДК в сотни тысяч раз [70]. Поступление нефтяных загрязнений в гидросферу происходит за счет добычи и хранения нефти и нефтепродуктов, эксплуатации оборудования нефтеперерабатывающих, нефтехимических, машиностроительных заводов и производств, автомобильного транспорта и т.п. По различным оценкам, в процессе добычи, подготовки и транспорта теряется от 1 до 16,5 % добываемой нефти и продуктов ее переработки. Из них до 20 % нефти попадает в водоемы [190]. [c.14]
Минеральные соединения иода легкорастворимы, поэтому иод энергично выносится в гидросферу при выветривании opныx пород. Геохимия иода как биофильного элемента во многом обусловлена его участием в биологических процессах. Иод входит в состав тироксина — гормона щитовидной железы, и недостаток иода ослабл5 ет ее деятельность, приводя к заболеваниям человека (зоб) и животцых. [c.75]
Иод входит в состав тироксина — гормона щитовидной железы, и недостаток иода ослабл5 ет ее деятельность, приводя к заболеваниям человека (зоб) и животцых. [c.75]
Состав газов в залежах постоянно меняется под действием ряда факторов тектонического, биохимического, гидродинамического, гравитационного и т. д. Влияние этих факторов может полностью затушевать первичные генетические признаки тех или иных компонентов газа. Образование скоплений газа — весьма миграционноспособного соединения — происходит при его миграции через пористые и трещиноватые среды в земной коре в виде струй, пузырьков, а также в растворенном состоянии с водами и нефтями. Формирование химического состава газов в газовых, газонефтяных или нефтяных залежах обусловлено растворимостью индивидуальных газовых компонентов в водах и нефтях. Известно, что хорошо растворимые в воде газы (углекислота, сероводород) составляют обычно очень малую долю в свободных газах, в то время как в гидросфере и подземных водах содержание их значительно больше. Растворимость метана в нефтях в 5 и 21 раз меньше растворимости соответственно этана и пропана. Азот характеризуется тем, что он обладает в 15 раз меньшей растворимостью, чем метан. Поэтому газы в газовых шапках должны быть гораздо больше обогащены метаном и азотом, чем растворенные газы и нефти. В то же время растворимость газообразных УВ растет с увеличением в нефтях содержания легких УВ. [c.266]
Растворимость метана в нефтях в 5 и 21 раз меньше растворимости соответственно этана и пропана. Азот характеризуется тем, что он обладает в 15 раз меньшей растворимостью, чем метан. Поэтому газы в газовых шапках должны быть гораздо больше обогащены метаном и азотом, чем растворенные газы и нефти. В то же время растворимость газообразных УВ растет с увеличением в нефтях содержания легких УВ. [c.266]
Земная кора почти полностью состоит из силикатов и кремнезема эти минералы составляют основу всех горных пород и продуктов их выветривания, почвы, песка и глииы. Все неорганические строительные материалы, начиная от горных пород (например, гранит) и кончая искусственными материалами (кирпич, цемент, строительный раствор), а также различная керамика и стекла являются силикатами. Руды металлов и другие несиликатные минералы составляют лищь иезначительную часть массы земной коры. В табл. 23.2 приведен средний состав литосферы по Гольдшмидту для сравнения указан и состав гидросферы. Видно, что более чем э/ю объема земной коры приходится на долю кислорода. В структурах многих силикатов осуществляется плотнейшая упаковка атомов кислорода (которая может быть искаженной), тогда как ионы более электроположительных элементов (почти все они меньше по размеру, чем ионы кислорода) располагаются в пустотах этой упаковки. [c.120]
Видно, что более чем э/ю объема земной коры приходится на долю кислорода. В структурах многих силикатов осуществляется плотнейшая упаковка атомов кислорода (которая может быть искаженной), тогда как ионы более электроположительных элементов (почти все они меньше по размеру, чем ионы кислорода) располагаются в пустотах этой упаковки. [c.120]
Газдевайс — Счетчики газа для квартиры
Знаете ли вы, что…
Слово «газ» придумал Ян Баптиста ван Гельмонт (1577–1644),фламандский химик, в 1650–1960 гг.
Оно происходит от греческого «хаос».
Водород — самый легкий, наиболее распространенный и взрывоопасный газ на земле.
Атомный вес радона равен 222 атомных единиц массы. Это делает его самым тяжелым из известных газов.Он в 220 раз тяжелее самого легкого газа — водорода.
Высокий уровень O2 увеличивает горючесть материалов и газов: при уровне в 24 % такие предметы, как одежда, могут внезапно вспыхнуть!
Угрозу для здоровья может представлять не только газ: пыль также может быть взрывоопасной!Примерами взрывоопасной пыли могут служить полистирол, кукурузный крахмал и железо.
Точка самовоспламенения горючего газа — это температура, при которой происходит воспламенение даже без внешних искр и пламени.
Если вы почувствовали запах протухших яиц (так пахнет сероводород из-за распада органических веществ), концентрация газа составляет лишь 1 часть на миллион.Всего 1000 частей h3S на миллион достаточно для того, чтобы вас убить.
Фтор относится к наиболее реактивным и исключительно электроотрицательным элементам, что превращает элементарный фтор в опасный окислитель.Это приводит к прямым реакциям между фтором и большинством элементов, включая благородные газы криптон, ксенон и радон.
Ксенон — самый редкий нерадиоактивный газообразный элемент в атмосфере Земли.В атмосфере его 90 частей на миллиард.
Всего в естественной атмосфере земли присутствует 17 газов.В больших концентрациях в ней содержатся только кислород и азот: 20,9476 % и 78,084 % соответственно.
Сероводород, поднимающийся с морского дна, мог вызвать глобальное вымирание флоры и фауны около250 миллионов лет назад.
Директивы ATEX (сокращение от ATmospheres EXplosibles) определяют минимальные стандарты безопасности по взрывоопасным средам как для заказчика, так и для производителя.
Юпитер — самый большой газовый гигант в Солнечной системе — содержит примерно 90 % водорода и 10 % гелия.На деле его состав очень напоминает первобытную солнечную туманность (тип туманности, из которой образовалась наша Солнечная система).
Какой самый распространенный химический элемент на земле. Кислород
Кислород — самый распространённый на земле химический элемент, а какой элемент второй по распространённости?
- Самый распространнный элемент по моему АЗОТ.
- Кислород 49.5%
Кремний 25.3%P.S.
Углерод 0.1%, азот0.01%, водород 0.97% вторыми по распространнности никак быть не могут
А Н2О это не химический элемент, а вещество 🙂 - Кремний. 26% по весу в земной коре.
- Углерод, (вся ростительность).
- В чистом виде кре#769;мний был выделен в 1811 году французскими учеными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.

В 1825 году шведский химик Йнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4 получил чистый элементарный кремний. Новому элементу было дано название силиций (от лат. silex кремень) . Русское название кремний введено в 1834 году российский химиком Германом Ивановичем Гессом. В переводе в греческого kremnos утес, гора.
По распространнности в земной коре кремний среди всех элементов занимает второе место (после кислорода) . Масса земной коры на 27,629,5 % состоит из кремния. Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезм или оксид кремния (IV) SiO2 (речной песок, кварц, кремень и др.) , составляющий около 12 % земной коры (по массе) . В свободном виде кремний в природе не встречается.
Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния) , но из-за большей длины связи между атомами SiSi по сравнению с длиной связи С С твердость кремния значительно меньше, чем алмаза.
 Кремний хрупок, только при нагревании выше 800 C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению.
Кремний хрупок, только при нагревании выше 800 C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению.Элементарный кремний типичный полупроводник. Ширина запрещенной зоны при комнатной температуре 1,09 эВ. Концентрация носителей заряда в кремнии с собственной проводимостью при комнатной температуре 1,51016м-3. На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нем микропримеси. Для получения монокристаллов кремния с дырочной проводимостью в кремний вводят добавки элементов III-й группы бора, алюминия, галлия и индия, с электронной проводимостью добавки элементов V-й группы фосфора, мышьяка или сурьмы. Электрические свойства кремния можно варьировать, изменяя условия обработки монокристаллов, в частности, обрабатывая поверхность кремния различными химическими агентами.
В настоящее время кремний основной материал для электроники. Монокристаллический кремний материал для зеркал газовых лазеров.
 Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях. Соединения металлов с кремнием силициды, являются широкоупотребляемыми в промышленности (например электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.) , а также силициды ряда элементов являются важными термоэлектрическими материалами. Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент).
Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях. Соединения металлов с кремнием силициды, являются широкоупотребляемыми в промышленности (например электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.) , а также силициды ряда элементов являются важными термоэлектрическими материалами. Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент).
Вселенная скрывает в своих глубинах множество секретов. Издавна люди стремились разгадать как можно больше из них, и, несмотря на то что это не всегда получается, наука идет вперед семимильными шагами, позволяя нам все больше узнавать о своем происхождении. Так, например, многим будет интересно, какой же самый распространенный во Вселенной. Большинство сразу подумают о воде, и будут отчасти правы, потому что наиболее часто встречающимся элементом является водород.
Самый распространенный элемент во Вселенной
Крайне редко людям приходится сталкиваться с водородом в чистом виде. Тем не менее, в природе он очень часто встречается в связи с другими элементами. Например, вступая в реакцию с кислородом, водород превращается в воду. И это далеко не единственное соединение, в состав которого входит этот элемент, он встречается повсеместно не только на нашей планете, но и в космосе.
Как появилась Земля
Множество миллионов лет назад водород, без преувеличений, стал строительным материалом для всей Вселенной. Ведь после большого взрыва, который стал первой стадией создания мира, не существовало ничего, кроме этого элемента. элементарна, поскольку состоит она всего лишь из одного атома. Со временем самый распространенный элемент во Вселенной начал образовывать облака, которые впоследствии стали звездами. А уже внутри них происходили реакции, в результате которых появлялись новые, более сложные элементы, породившие планеты.
Водород
На этот элемент приходится порядка 92% атомов Вселенной. Но встречается он не только в составе звёзд, межзвездного газа, но и распространенных элементов на нашей планете. Чаще всего он существует в связанном виде, а наиболее часто встречающимся соединением является, конечно же, вода.
Но встречается он не только в составе звёзд, межзвездного газа, но и распространенных элементов на нашей планете. Чаще всего он существует в связанном виде, а наиболее часто встречающимся соединением является, конечно же, вода.
Кроме этого, водород входит в состав ряда углеродных соединений, образующих нефть и природный газ.
Вывод
Несмотря на то что это наиболее распространенный элемент во всем мире, как это ни удивительно, для человека он может быть опасен, поскольку иногда загорается, вступая в реакцию с воздухом. Чтобы понять, насколько важную роль водород сыграл в создании Вселенной, достаточно осознать, что без него не появилось бы ничего живого на Земле.
Все мы знаем, что водород наполняет нашу Вселенную на 75%. Но знаете ли вы, какие еще есть химические элементы, не менее важные для нашего существования и играющие значительную роль для жизни людей, животных, растений и всей нашей Земли? Элементы из этого рейтинга формируют всю нашу Вселенную!
10. Сера (распространенность относительно кремния – 0.38)
Сера (распространенность относительно кремния – 0.38)
Этот химический элемент в таблице Менделеева значится под символом S и характеризуется атомным номером 16. Сера очень в природе.
9. Железо (распространенность относительно кремния – 0.6)
Обозначается символом Fe, атомный номер – 26. Железо очень часто встречается в природе, особенно важную роль оно играет в формировании внутренней и внешней оболочки ядра Земли.
8. Магний (распространенность относительно кремния – 0.91)
В таблице Менделеева магний можно найти под символом Mg, и его атомный номер – 12. Что самое удивительное в этом химическом элементе, так это то, что он чаще всего выделяется при взрыве звезд в процессе их преобразования в сверхновые тела.
7. Кремний (распространенность относительно кремния – 1)
Обозначается как Si. Атомный номер кремния – 14. Этот серо-голубой металлоид очень редко встречается в земной коре в чистом виде, но довольно распространен в составе других веществ.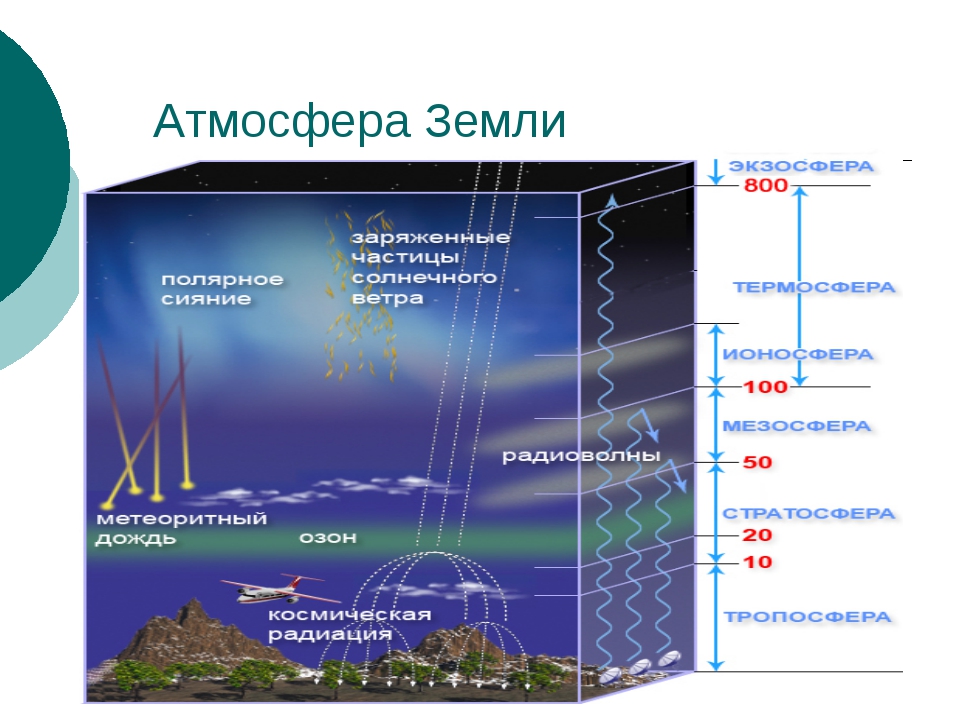 Например, его можно обнаружить даже в растениях.
Например, его можно обнаружить даже в растениях.
6. Углерод (распространенность относительно кремния – 3.5)
Углерод в таблице химических элементов Менделеева значится под символом С, его атомный номер – 6. Самой знаменитой аллотропной модификацией углерода являются одни из самых желанных драгоценных камней в мире – алмазы. Углерод активно применяют и в других в промышленных целях более будничного назначения.
5. Азот (распространенность относительно кремния – 6.6)
Символ N, атомный номер 7. Впервые открытый шотландским врачом Дэниелом Рутерфордом (Daniel Rutherford), азот чаще всего встречается в форме азотной кислоты и нитратов.
4. Неон (распространенность относительно кремния – 8.6)
Обозначается символом Ne, атомный номер — 10. Не секрет, что именно этот химический элемент ассоциируется с красивым свечением.
3. Кислород (распространенность относительно кремния – 22)
Химический элемент под символом О и с атомным номером 8, кислород незаменим для нашего существования! Но это не значит, что он присутствует только на Земле и служит только для человеческих легких. Вселенная полна сюрпризов.
Вселенная полна сюрпризов.
2. Гелий (распространенность относительно кремния – 3.100)
Символ гелия – He, атомный номер – 2. Он бесцветен, не имеет запаха и вкуса, не ядовит, и его точка кипения – самая низкая среди всех химических элементов. А еще благодаря ему шарики взмывают ввысь!
1. Водород (распространенность относительно кремния – 40.000)
Истинный номер один в нашем списке, водород находится в таблице Менделеева под символом Н и обладает атомным номером 1. Это самый легкий химический элемент периодической таблицы и самый распространенный элемент во всей изученной человеком Вселенной.
Это была сенсация — оказывается, важнейшее вещество на Земле состоит из двух не менее важных химических элементов. «АиФ» решил заглянуть в таблицу Менделеева и вспомнить, благодаря каким же элементам и соединениям существует Вселенная, а также жизнь на Земле и человеческая цивилизация.
ВОДОРОД (H)
Где встречается: самый распространённый элемент во Вселенной, её главный «строительный материал». Из него состоят звёзды, в том числе Солнце. Благодаря термоядерному синтезу с участием водорода Солнце будет греть нашу планету ещё 6,5 млрд. лет.
Из него состоят звёзды, в том числе Солнце. Благодаря термоядерному синтезу с участием водорода Солнце будет греть нашу планету ещё 6,5 млрд. лет.
Чем полезен: в промышленности — при производстве аммиака, мыла и пластмасс. Большие перспективы у водородной энергетики: этот газ не загрязняет окружающую среду, т. к. при сгорании даёт только водяной пар.
УГЛЕРОД (C)
Где встречается: любой организм в значительной степени построен из углерода. В теле человека этот элемент занимает около 21%. Так, наши мышцы состоят из него на 2/3. В свободном состоянии в природе встречается в виде графита и алмаза.
Чем полезен: пища, энергоносители и мн. др. Класс соединений на основе углерода огромен — углеводороды, белки, жиры и т. д. Этот элемент незаменим в нанотехнологиях.
АЗОТ (N)
Где встречается: атмосфера Земли на 75% состоит из азота. Входит в состав белков, аминокислот, гемоглобина и др.
Чем полезен: необходим для существования животных и растений. В промышленности используется как газовая среда для упаковки и хранения, хладагент. С его помощью синтезируют разнообразные соединения — аммиак, удобрения, взрывчатые вещества, красители.
В промышленности используется как газовая среда для упаковки и хранения, хладагент. С его помощью синтезируют разнообразные соединения — аммиак, удобрения, взрывчатые вещества, красители.
КИСЛОРОД (O)
Где встречается: Самый распространённый на Земле элемент, на его долю приходится около 47% массы твёрдой земной коры. Морские и пресные воды на 89% состоят из кислорода, атмосфера — на 23%.
Чем полезен: Благодаря кислороду живые существа могут дышать, без него не был бы возможен огонь. Этот газ широко используется в медицине, металлургии, пищевой промышленности, энергетике.
УГЛЕКИСЛЫЙ ГАЗ (CO2)
Где встречается: В атмосфере, в морской воде.
Чем полезен: Благодаря этому соединению растения могут дышать. Процесс поглощения углекислоты из воздуха называется фотосинтезом. Это основной источник биологической энергии. Стоит напомнить, что энергия, которую мы получаем при сжигании ископаемого топлива (угля, нефти, газа), накоплена в недрах земли на протяжении миллионов лет именно благодаря фотосинтезу.
ЖЕЛЕЗО (Fe)
Где встречается: один из самых распространённых в Солнечной системе элементов. Из него состоят ядра планет земной группы.
Чем полезен: металл, с древних времён применяемый человеком. Целая историческая эпоха получила название Железного века. Сейчас до 95% мирового производства металлов приходится на железо, это основной компонент сталей и чугунов.
СЕРЕБРО (Ag)
Где встречается: Один из дефицитных элементов. Раньше встречался в природе в самородном виде.
Чем полезен: С середины XIII века стал традиционным материалом для изготовления посуды. Обладает уникальными свойствами, поэтому применяется в различных отраслях — в ювелирном деле, в фотографии, электротехнике и электронике. Известны и дезинфицирующие свойства серебра.
ЗОЛОТО (Au)
Где встречается: раньше встречался в природе в самородном виде. Добывается на приисках.
Чем полезен: важнейший элемент мировой финансовой системы, т. к. запасы его невелики. Издавна использовалось в качестве денег. В настоящее время все банковские резервы золота оцениваются
к. запасы его невелики. Издавна использовалось в качестве денег. В настоящее время все банковские резервы золота оцениваются
в 32 тыс. тонн — если сплавить их воедино, получится куб со стороной всего лишь 12 м. Используется в медицине, микроэлектронике, при ядерных исследованиях.
КРЕМНИЙ (Si)
Где встречается: По распространённости в земной коре этот элемент занимает второе место (27-30% всей массы).
Чем полезен: Кремний — основной материал для электроники. Также применяется в металлургии и в производстве стекла и цемента.
ВОДА (h3O)
Где встречается: Наша планета на 71% покрыта водой. Тело человека на 65% состоит из этого соединения. Вода есть и в космическом пространстве, в теле комет.
Чем полезна: Имеет ключевое значение в создании и поддержании жизни на Земле, потому что благодаря молекулярным свойствам является универсальным растворителем. У воды много уникальных свойств, о которых мы не задумываемся. Так, если бы она при замерзании не увеличивалась в объёме, жизнь просто не зародилась бы: водоёмы каждую зиму промерзали бы до дна. А так, расширяясь, более лёгкий лёд остаётся на поверхности, сохраняя под собой жизнеспособную среду.
А так, расширяясь, более лёгкий лёд остаётся на поверхности, сохраняя под собой жизнеспособную среду.
Все мы знаем, что водород наполняет нашу Вселенную на 75%. Но знаете ли вы, какие еще есть химические элементы, не менее важные для нашего существования и играющие значительную роль для жизни людей, животных, растений и всей нашей Земли? Элементы из этого рейтинга формируют всю нашу Вселенную!
10. Сера (распространенность относительно кремния – 0.38)
Этот химический элемент в таблице Менделеева значится под символом S и характеризуется атомным номером 16. Сера очень распространена в природе.
9. Железо (распространенность относительно кремния – 0.6)
Обозначается символом Fe, атомный номер – 26. Железо очень часто встречается в природе, особенно важную роль оно играет в формировании внутренней и внешней оболочки ядра Земли.
8. Магний (распространенность относительно кремния – 0.91)
В таблице Менделеева магний можно найти под символом Mg, и его атомный номер – 12. Что самое удивительное в этом химическом элементе, так это то, что он чаще всего выделяется при взрыве звезд в процессе их преобразования в сверхновые тела.
Что самое удивительное в этом химическом элементе, так это то, что он чаще всего выделяется при взрыве звезд в процессе их преобразования в сверхновые тела.
7. Кремний (распространенность относительно кремния – 1)
Обозначается как Si. Атомный номер кремния – 14. Этот серо-голубой металлоид очень редко встречается в земной коре в чистом виде, но довольно распространен в составе других веществ. Например, его можно обнаружить даже в растениях.
6. Углерод (распространенность относительно кремния – 3.5)
Углерод в таблице химических элементов Менделеева значится под символом С, его атомный номер – 6. Самой знаменитой аллотропной модификацией углерода являются одни из самых желанных драгоценных камней в мире – алмазы. Углерод активно применяют и в других в промышленных целях более будничного назначения.
5. Азот (распространенность относительно кремния – 6.6)
Символ N, атомный номер 7. Впервые открытый шотландским врачом Дэниелом Рутерфордом (Daniel Rutherford), азот чаще всего встречается в форме азотной кислоты и нитратов.![]()
4. Неон (распространенность относительно кремния – 8.6)
Обозначается символом Ne, атомный номер — 10. Не секрет, что именно этот химический элемент ассоциируется с красивым свечением.
3. Кислород (распространенность относительно кремния – 22)
Химический элемент под символом О и с атомным номером 8, кислород незаменим для нашего существования! Но это не значит, что он присутствует только на Земле и служит только для человеческих легких. Вселенная полна сюрпризов.
2. Гелий (распространенность относительно кремния – 3.100)
Символ гелия – He, атомный номер – 2. Он бесцветен, не имеет запаха и вкуса, не ядовит, и его точка кипения – самая низкая среди всех химических элементов. А еще благодаря ему шарики взмывают ввысь!
1. Водород (распространенность относительно кремния – 40.000)
Истинный номер один в нашем списке, водород находится в таблице Менделеева под символом Н и обладает атомным номером 1. Это самый легкий химический элемент периодической таблицы и самый распространенный элемент во всей изученной человеком Вселенной.
Это самый легкий химический элемент периодической таблицы и самый распространенный элемент во всей изученной человеком Вселенной.
Самый простой и распространенный элемент
Водород имеет только один протон и один электрон (это единственный элемент без нейтрона). Он является самым простым элементом во Вселенной, что объясняет, почему он также самый распространенный, — сказала Найман. Тем не менее изотоп водорода, называемый дейтерием, содержит один протон и один нейтрон, а другой, известный как тритий, имеет один протон и два нейтрона.
В звездах атомы водорода сливаются, чтобы создать гелий — второй наиболее распространенный элемент во Вселенной. Гелий имеет два протона, два нейтрона и два электрона. Вместе гелий и водород составляют 99,9 процента всей известной материи во Вселенной.
Тем не менее во Вселенной примерно в 10 раз больше водорода, чем гелия, как говорит Найман. «Кислорода, который является третьим самым распространенным элементом, примерно в 1000 раз меньше, чем водорода», — добавила она.
Если говорить в общем, то чем выше атомный номер элемента, тем меньшее его количество можно найти во Вселенной.
Водород в составе Земли
Состав Земли, однако, отличается от того, который имеет Вселенная. Например, кислород является наиболее распространенным элементом по весу в земной коре. За ним следуют кремний, алюминий и железо. В человеческом организме наиболее распространенным элементом по весу является кислород, а затем — углерод и водород.
Роль в человеческом теле
Водород имеет ряд ключевых ролей в человеческом теле. Водородные связи помогают ДНК оставаться скрученным. Кроме того, водород способствует поддержанию правильного рН в желудке и других органах. Если ваш желудок приобретает слишком щелочную среду, выпускается водород, поскольку он связан с регулированием этого процесса. Если же среда в желудке слишком кислая, водород будет связываться с другими элементами.
Водород в составе воды
Кроме того, именно водород позволяет льду плавать на поверхности воды, так как водородные связи увеличивают расстояние между ее замороженными молекулами, что делает их менее плотными.
Как правило, вещество является более плотным, когда оно находится в твердом состоянии, а не жидком, сказала Найман. Вода является единственным веществом, которое становится менее плотным в твердом виде.
В чем опасность водорода
Тем не менее водород также может быть опасным. Его реакция с кислородом привела к катастрофе дирижабля «Гинденбург», который убил 36 человек в 1937 году. Кроме того, водородные бомбы могут быть невероятно разрушительными, хотя их никогда не использовали в качестве оружия. Тем не менее их потенциал продемонстрировали в 1950-х годах такие страны, как США, СССР, Великобритания, Франция и Китай.
Водородные бомбы, как и атомные, используют сочетание ядерного синтеза и реакций деления, что приводит к разрушениям. При взрыве они создают не только механические ударные волны, но и радиацию.
Это была сенсация — оказывается, важнейшее вещество на Земле состоит из двух не менее важных химических элементов. «АиФ» решил заглянуть в таблицу Менделеева и вспомнить, благодаря каким же элементам и соединениям существует Вселенная, а также жизнь на Земле и человеческая цивилизация.
ВОДОРОД (H)
Где встречается: самый распространённый элемент во Вселенной, её главный «строительный материал». Из него состоят звёзды, в том числе Солнце. Благодаря термоядерному синтезу с участием водорода Солнце будет греть нашу планету ещё 6,5 млрд. лет.
Чем полезен: в промышленности — при производстве аммиака, мыла и пластмасс. Большие перспективы у водородной энергетики: этот газ не загрязняет окружающую среду, т. к. при сгорании даёт только водяной пар.
УГЛЕРОД (C)
Где встречается: любой организм в значительной степени построен из углерода. В теле человека этот элемент занимает около 21%. Так, наши мышцы состоят из него на 2/3. В свободном состоянии в природе встречается в виде графита и алмаза.
Чем полезен: пища, энергоносители и мн. др. Класс соединений на основе углерода огромен — углеводороды, белки, жиры и т. д. Этот элемент незаменим в нанотехнологиях.
АЗОТ (N)
Где встречается: атмосфера Земли на 75% состоит из азота. Входит в состав белков, аминокислот, гемоглобина и др.
Входит в состав белков, аминокислот, гемоглобина и др.
Чем полезен: необходим для существования животных и растений. В промышленности используется как газовая среда для упаковки и хранения, хладагент. С его помощью синтезируют разнообразные соединения — аммиак, удобрения, взрывчатые вещества, красители.
КИСЛОРОД (O)
Где встречается: Самый распространённый на Земле элемент, на его долю приходится около 47% массы твёрдой земной коры. Морские и пресные воды на 89% состоят из кислорода, атмосфера — на 23%.
Чем полезен: Благодаря кислороду живые существа могут дышать, без него не был бы возможен огонь. Этот газ широко используется в медицине, металлургии, пищевой промышленности, энергетике.
УГЛЕКИСЛЫЙ ГАЗ (CO2)
Где встречается: В атмосфере, в морской воде.
Чем полезен: Благодаря этому соединению растения могут дышать. Процесс поглощения углекислоты из воздуха называется фотосинтезом. Это основной источник биологической энергии. Стоит напомнить, что энергия, которую мы получаем при сжигании ископаемого топлива (угля, нефти, газа), накоплена в недрах земли на протяжении миллионов лет именно благодаря фотосинтезу.
Стоит напомнить, что энергия, которую мы получаем при сжигании ископаемого топлива (угля, нефти, газа), накоплена в недрах земли на протяжении миллионов лет именно благодаря фотосинтезу.
ЖЕЛЕЗО (Fe)
Где встречается: один из самых распространённых в Солнечной системе элементов. Из него состоят ядра планет земной группы.
Чем полезен: металл, с древних времён применяемый человеком. Целая историческая эпоха получила название Железного века. Сейчас до 95% мирового производства металлов приходится на железо, это основной компонент сталей и чугунов.
СЕРЕБРО (Ag)
Где встречается: Один из дефицитных элементов. Раньше встречался в природе в самородном виде.
Чем полезен: С середины XIII века стал традиционным материалом для изготовления посуды. Обладает уникальными свойствами, поэтому применяется в различных отраслях — в ювелирном деле, в фотографии, электротехнике и электронике. Известны и дезинфицирующие свойства серебра.
ЗОЛОТО (Au)
Где встречается: раньше встречался в природе в самородном виде. Добывается на приисках.
Чем полезен: важнейший элемент мировой финансовой системы, т. к. запасы его невелики. Издавна использовалось в качестве денег. В настоящее время все банковские резервы золота оцениваются
в 32 тыс. тонн — если сплавить их воедино, получится куб со стороной всего лишь 12 м. Используется в медицине, микроэлектронике, при ядерных исследованиях.
КРЕМНИЙ (Si)
Где встречается: По распространённости в земной коре этот элемент занимает второе место (27-30% всей массы).
Чем полезен: Кремний — основной материал для электроники. Также применяется в металлургии и в производстве стекла и цемента.
ВОДА (h3O)
Где встречается: Наша планета на 71% покрыта водой. Тело человека на 65% состоит из этого соединения. Вода есть и в космическом пространстве, в теле комет.
Чем полезна: Имеет ключевое значение в создании и поддержании жизни на Земле, потому что благодаря молекулярным свойствам является универсальным растворителем. У воды много уникальных свойств, о которых мы не задумываемся. Так, если бы она при замерзании не увеличивалась в объёме, жизнь просто не зародилась бы: водоёмы каждую зиму промерзали бы до дна. А так, расширяясь, более лёгкий лёд остаётся на поверхности, сохраняя под собой жизнеспособную среду.
У воды много уникальных свойств, о которых мы не задумываемся. Так, если бы она при замерзании не увеличивалась в объёме, жизнь просто не зародилась бы: водоёмы каждую зиму промерзали бы до дна. А так, расширяясь, более лёгкий лёд остаётся на поверхности, сохраняя под собой жизнеспособную среду.
Викторина по химии на тему «Металлы и неметаллы»
Вопросы викторины по химии
Металл, вызывающий лихорадку. (Золото)
Атом, лишённый всех электронов. (Ядро)
Самый распространённый элемент в земной коре.(Кислород)
Какой камень искали алхимики? (Философский)
Мельчайшая химически неделимая частица. (Атом)
Металл, который используют служители церкви для получения «святой воды».
 (Серебро)
(Серебро)
Газ жёлто – зелёного цвета с резким удушливым запахом, почти в 2,5 раза тяжелее воздуха. (Хлор)
Оксид водорода. (Вода)
Самое распространённое вещество на земле. (Вода)
Французский химик, который экспериментально доказал состав воздуха. (А. Лавуазье)
Самый распространённый химический элемент во Вселенной.(Водород)
Самый лёгкий газ. (Водород)
Система, состоящая из двух и более веществ, не вступающих в химическое взаимодействие. (Смесь)
При Петре I вручалась медаль за пьянство. Из чего она была сделана?(Из чугуна)
Самый лёгкий металл.
 (Литий)
(Литий)
Самый тяжёлый металл. (Осмий)
Из какого сплава отлиты знаменитые царь – колокол и царь – пушка в Московском Кремле? (Из бронзы)
Смесь 3 объёмов концентрированной соляной кислоты и 1 объёма концентрированной азотной кислоты. («Царская водка»)
С глубокой древности известна я.
Желчью бога Вулкана прозвали не зря.
Я желта, непрозрачна, тверда,
В нескольких аллотропных модификациях
Встретишь меня.
(Сера)
Техническое название гидрокарбоната натрия. (Питьевая сода, двууглекислая сода)
Наука о промышленных способах получения металлов из природного сырья.

(Металлургия)
Известный химик и композитор. Написал оперу «Князь Игорь».(А. П. Бородин)
С какой планетой связывали наши предки железо? (С Марсом)
Биологические катализаторы белковой природы. (Ферменты)
Великий русский учёный – энциклопедист, первый русский академик.(М. В. Ломоносов)
Важнейшая соль, из которой многочисленные морские животные (моллюски, раки, простейшие) строят покровы своего тела – разнообразные по форме, многоцветные по окраске раковины. (Карбонат кальция)
С каким металлом наши предки связывали Солнце? (С золотом)
Основатель ятрохимии в 16 веке. Замечательный врач. Его идеи способствовали быстрому развитию фармакологии.
 (Парацельс)
(Парацельс)
Какую кислоту выделяют голожаберные (морские моллюски), защищаясь?
(Серную кислоту)
Какой газ используется в производстве газированной воды и при тушении пожаров.
(Углекислый газ)
Химический элемент, который занимает 2 место после кислорода по распространённости в земной коре. (Кремний)
Какой химический элемент назван в честь России?(От лат. Рутения – Россия)
Ковал победу тот металл
Для танков на Урале.
Он стойкость сплаву придавал
И нити лампы при накале.
(Вольфрам)
Какой химический элемент назван в честь Луны? (Селен)
«Сухой лёд» — это…(Твёрдый оксид углерода (IV).
 )
)
Какой элемент сыграл роковую роль в жизни Наполеона Бонапарта?(Мышьяк)
Как собирать водород в пробирку – держа её вверх дном или вниз дном?
(Вверх дном)
Для чего в зимнее время между рамами иногда помещают сосуд с концентрированной серной кислотой?(Концентрированная серная кислота обладает способностью поглощать влагу)
Какой учёный в 1887 году один в аэростате поднялся в воздух, чтобы наблюдать затмение Солнца, и приземлился в другой губернии?(Д. И. Менделеев)
В какой части огурца содержится больше нитратов – в кожуре или в сердцевине?
(В кожуре)
Что образуется при взаимодействии натрия с водой?(NaOH и h3)
Газообразное вещество, которое дезинфицирует воду, не оставляя привкуса.

(Озон)
Император Наполеон III на банкете велел подать для почётных гостей приборы из очень дорогого серебристо белого металла. А всем прочим было обидно до слёз: им пришлось пользоваться обычной золотой и серебряной посудой. Из чего были изготовлены вилки?
(Из алюминия)
Биологически активное вещество, регулирующее работу органов и тканей человека и животного.(Гормон)
Что вызывает повышение содержания углекислого газа в атмосфере?(Парниковый эффект)
Французский химик, основоположник учения о смещении химического равновесия.
(А. Л. Ле — Шателье)
Какая формула у плавиковой кислоты?(HF)
Кто разработал современную химическую символику в 1814 году?(Й.
 Берцелиус)
Берцелиус)
В стальных баллонах какого цвета хранят газообразный кислород?(Синего)
Самый лёгкий после водорода газ. Он более чем в 7 раз легче воздуха.(Гелий)
51.Почему свежий разрез яблока на воздухе постепенно буреет и приобретает цвет ржавчины?(Так как находящееся в плоде железо окисляется.)
52.Какой химический элемент изображали в 18 веке в виде воина?
(Железо, т. к. его широко использовали при изготовлении оружия.)
Почему мёрзлое бельё сушат на морозе?(Лёд способен к возгонке.)
54.Какая вода содержит меньше всего примесей?
а) морская, б) дождевая, в) речная, г) минеральная.
(Дождевая)
55Известный «автомобильный король» Форд сказал «Если бы не было …,- не было бы автомобиля». О каком металле говорил Форд? (ванадий).
О каком металле говорил Форд? (ванадий).
До 1795г. титан назывался «менакином». Кто из английских ученых дал это название? (У. Грегор).
Кто впервые стал применять никель? (ювелиры).
Какой главный металл электротехники? (медь).
Какой металл называют свидетелем гения Менделеева? (галлий).
Какой из металлов является важнейшим полупроводниковым материалом? (германий).
Явление намагничивания железа и его сплавов (ферромагнетизм) нашло широкое применение в:
а) строительстве; б) теплотехнике; в) радиотехнике. (радиотехнике).
60Какой металл человек обработал первым? (медь).
61 Какой драгоценный металл является одним из лучших катализаторов для различных химических процессов? (платина).
Замечательной особенностью этого металла является его вес.
 Он самый тяжелый металл на Земле? (осмий).
Он самый тяжелый металл на Земле? (осмий).Какой металл академик А. Е. Ферсман назвал «металлом красных огней»? (стронций).
От серебра произошло название одной из стран Южной Америки. Назовите эту страну. (Аргентина).
Сколько всего в периодической системе химических элементов неметаллов? (22).
Название какого неметалла связано с именем богини Луны в греческой мифологии? (селен).
Какой неметалл алхимики назвали «желчью бога Вулкана»? (сера).
Название какого неметалла означает – разрушающий, смертоносный? (фтор).
Какой неметалл академик А. Е. Ферсман называл «элементом жизни и мысли»? (фосфор).
Какой неметалл получил свое название в связи с неприятным запахом его паров? (бром).
Какой из всех газов – простых веществ – самый тяжелый? (радон).

С каким неметаллом при сильном нагревании реагирует золото? (хлор).
Назовите инертный газ, которого в земной атмосфере гораздо больше, чем всех остальных инертных газов, вместе взятых? (аргон).
Какой неметалл считают вторым по распространению на Земле после кислорода? (кремний).
Какой самый распространенный элемент – неметалл в атмосфере Земли? (азот).
Смесью каких двух газов заполняют лампы накаливания? ( смесью аргона (86%) и азота (14%)).
Какой галоген регулирует процессы возбуждения и торможения нервной системы? (бром).
Неметалл, известный с древнейших времен. Простое вещество используют для приготовления красок, косметических и медицинских препаратов, уничтожения вредных насекомых. (сера).
Этот элемент – неотъемлемая часть живых организмов, но своим греческим названием он отрицает жизнь? (азот).

Какой элемент сыграл роковую роль в жизни Наполеона Бонапарта? (Мышьяк)
Самый лёгкий после водорода газ. Он более чем в 7 раз легче воздуха. (Гелий)
Известно, что падение Рима вызвано многими социальными, политическими и экономическими причинами. Но американские учёные – токсикологи считают, что в падении Рима повинен металл. Он входил в состав посуды, косметических красок, а также из него были сделаны трубы водопроводов. Люди вымирали. Империя чахла. Подтверждения учёных подтвердились: обнаруженные останки древних римлян содержат большое количество этого метала. Какой металл, по мнению учёных США, повинен в гибели Рима? (Свинец)
Что такое снег с точки зрения химика? Это вода в твёрдом состоянии — ледяные кристаллы. Оказывается, снег горит. Как это сделать? (В сосуд положить немного чистого снега и пропустить через него фтор, снег вспыхнет ярким пламенем).

В конце XIX века из Голландии в Россию был отправлен железнодорожный состав, гружённый брусками олова. Когда в Москве вагоны открыли, в них обнаружили серый ни на что не пригодный порошок – русская зима сыграла с получателями олова злую шутку. Какое название носит это с давних пор известное явление?
(Оловянная чума – полиморфное превращение белого олова в серое за счёт резкого
увеличения объёма металла при температуре – 33о С. Свинец и другие примеси
задерживает это явление. В результате разрушения “чумой” паянных оловом
сосудов с жидким топливом. В1912 г. погибла экспедиция Р.Скотта к Южному
полюсу).
В каком состоянии медь содержится в организме человека, и какие заболевания вызываются её недостатком и избытком в организме? (Медь содержится в виде ионов. Недостаток её в организме ведёт к развитию анемии, а излишек – к тяжёлому заболеванию печени)
Как можно сварить куриное яйцо вкрутую, даже не разводя огня? (В химический стакан положить негашеную известь и яйцо.
 Заливают водой содержимое стакана. Через некоторое время начинается реакция, появляется пар и кипение жидкости в стакане. Яйца свариваются вкрутую).
Заливают водой содержимое стакана. Через некоторое время начинается реакция, появляется пар и кипение жидкости в стакане. Яйца свариваются вкрутую).Кто впервые предположил, что воздух есть смесь газов? (Знаменитый учёный и художник Леонардо да Винчи, убедившись в том, что воздух состоит не из одного газа, а из смеси).
Из чего добывают лимонную кислоту? (Не из лимона, а из сахара или мелисы с помощью особого плесневого грибка).
Назовите горы Южной Америки, получившие своё название от этого химического элемента. (Анды, которые в переводе с индийского означают “медь”).
Газ, применяемый для заполнения рекламных трубок. (Неон).
Какие 2 элемента вместе составляют 75% от массы земной коры? (Кислород – 49%, кремний – 26%)
Какой(-ие) элемент(-ы)…:
…всегда радуются? (радий, радон)
…утверждает, что он – это не он? (неон)
…назван в честь Франции? (франций)
…назван в честь Польши? (полоний)
…назван в честь России? (рутений)
…открыт впервые на Солнце? (гелий)
…названы в честь учёных? (кюрий, менделевий, нобелий, резерфордий и т.
 д.)
д.)…названы в честь планет? (уран, нептуний, плутоний)
…открыт в одном из городов Московской области и назван в честь него? (дубний)
В названии какого элемента заключено название…:
…двух животных? (мышьяк)
…волшебника? (магний)
…увеселительного заведения? (цирконий)
…настольной игры? (золото)
…напитка пиратов? (хром, бром)
…американского штата? (калифорний)
…человеческой кости? (серебро)
…цифры 3? (натрий, иттрий)
…хвойного дерева? (никель)
Назовите элемент…:
…самый распространённый на Земле (кислород)
…самый распространённый в земной атмосфере (азот)
…самый распространённый в космосе (водород)
…самый редкий из содержащихся в земной коре (астат)
…имеющий наибольшее количество аллотропных модификаций (плутоний)
…входящий в наибольшее число разнообразных соединений (углерод)
Назовите:
самый лёгкий газ (водород)
самый тяжёлый газ (радон)
самый лёгкий металл (литий)
самый тяжёлый металл (иридий, осмий)
Известно, что Д.
 И. Менделеев очень любил своих детей. А сколько их было? (шесть)
И. Менделеев очень любил своих детей. А сколько их было? (шесть)Какой металл в XIX веке был дороже золота? (алюминий)
Какой металл часто используют юные пиротехники? (магний)
Какой неметалл помог открыть учёному кот? (йод)
1. Я дружу с человеком очень давно. Я красив, больше всего мне идёт жёлтый цвет. Меня легко повредить, так как характер у меня очень мягкий, но многие ругают меня, называют кровожадным. Никто не может обойтись без меня, когда совершает покупки, строит храмы, запускает искусственные спутники Земли. Мой небесный покровитель – Солнце. Меня называют царём металлов и металлом царей. Кто я? (Золото)
2. Я не менее красива, чем золото. Мой род древний, ему примерно 7 тыс. лет. С моей помощью 5 тыс. лет назад соорудили 147-метровыю пирамиду Хеопса. Из меня изготовили щит герою Троянской войны Ахиллу.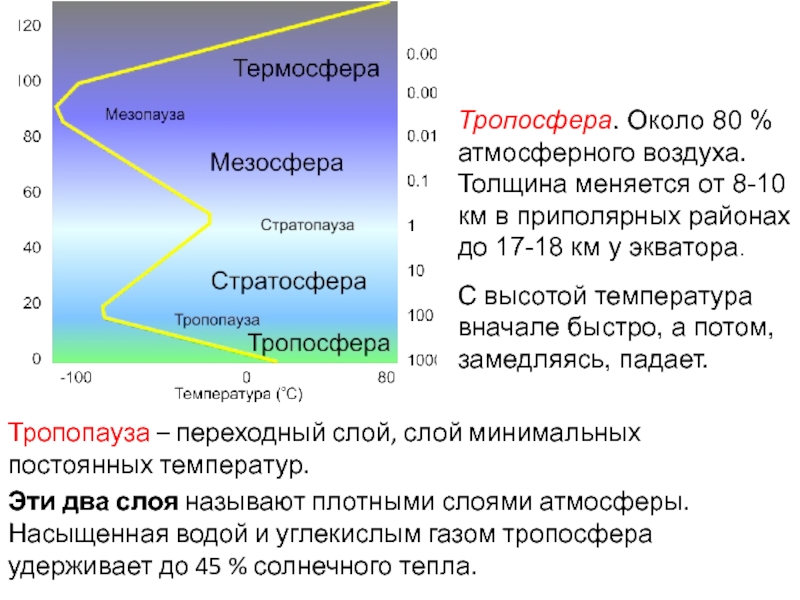 Я очень музыкальна, у меня прекрасный голос. Я умею исцелять, без меня у человека развивается малокровие, слабость. Кто я? (Медь)
Я очень музыкальна, у меня прекрасный голос. Я умею исцелять, без меня у человека развивается малокровие, слабость. Кто я? (Медь)
3. В древности некоторые народы ценили меня больше, чем золото.Считается, что я пришелец из космоса. Я и воин, и труженик. У меня настоящая мужская работа. Без меня человек слаб и немощен. Мой покровитель – бог войны.Кто я? (Железо)
4. Моя структура аналогична структуре алмаза. Меня используют в качестве полупроводника. При высокой температуре восстанавливаю многие металлы из оксидов. Я второй по распространённости из элементов на Земле. Вхожу в состав речного песка. Кто я? (Кремний)
5. В газообразном виде я оказываю сильное раздражающее действие на глаза и дыхательную систему. Я вхожу в состав некоторых гербицидов, инсектицидов и других пестицидов. Главным образом я появляюсь на свет в результате электролиза солей. Меня используют для дезинфекции воды в плавательных бассейнах. Кто я? (Хлор)
Кто я? (Хлор)
6. Я аналог азота и у нас сходные электронные конфигурации.Живу я на Кольском полуострове в залежах минералов. У меня есть несколько братьев – аллотропных модификаций. Один брат принимает активное участие при изготовлении спичек. Меня постоянно приглашают поучаствовать в получении дымовых завес. Кто я? (Фосфор)
Вопросы.
1. Какой воздух тяжелее:а) сухой; б) влажный?
Ответ. а) сухой. (Влажный воздух легче сухого, т. к. молярная масса паров воды
M(паров) = 18 г/моль, а M(воздуха) = 29 г/моль.)
В 2008 году в нашей стране проходил конкурс «Семь чудес России». На первом этапе конкурса путём Интернет — голосования были отобраны 49 чудес – по 7 от каждого федерального округа. На втором этапе были определены 14 финалистов. И 12 июня в День России во время концерта на Красной площади торжественно объявили победителей конкурса.
 Финалистами стали Собор Василия Блаженного в Москве, Статуя Родина — мать на Мамаевом кургане в Волгограде, Долина гейзеров на Камчатке, вулкан Эльбрус на Кавказе, Петергоф, Столбы выветривания в Коми и, конечно же, великое озеро Байкал. Байкал заставляет нас восхищаться своей красотой и не перестает удивлять тайнами и загадками. Так, например, известно, что Байкал питают свыше 300 рек и речушек, которые ежегодно приносят в него более 6 000 тонн соединений кремния. А вытекает только одна красавица Ангара, забирая всего 1000 тонн силикатов. Несмотря на это, содержание кремния в водах Байкала остается неизменным на протяжении многих сотен лет. Попробуйте объяснить этот факт, установив неизвестное звено в круговороте кремния.
Финалистами стали Собор Василия Блаженного в Москве, Статуя Родина — мать на Мамаевом кургане в Волгограде, Долина гейзеров на Камчатке, вулкан Эльбрус на Кавказе, Петергоф, Столбы выветривания в Коми и, конечно же, великое озеро Байкал. Байкал заставляет нас восхищаться своей красотой и не перестает удивлять тайнами и загадками. Так, например, известно, что Байкал питают свыше 300 рек и речушек, которые ежегодно приносят в него более 6 000 тонн соединений кремния. А вытекает только одна красавица Ангара, забирая всего 1000 тонн силикатов. Несмотря на это, содержание кремния в водах Байкала остается неизменным на протяжении многих сотен лет. Попробуйте объяснить этот факт, установив неизвестное звено в круговороте кремния.
ОТВЕТ: Ежегодно реки, впадающие в Байкал, приносят более 600 тыс. т кремния, а содержание его в воде очень мало и не возрастает.
Кремнекислоту потребляет для построения панциря (наружного скелета) самая многочисленная по видовому составу и самая большая по биомассе группа диатомовых водорослей, а также губки и некоторые моллюски. Клетки диатомовых водорослей покрыты кремнистым панцирем, который состоит из двух створок (поэтому они и получили свое название от греч. diatomos -разделенные пополам). Кремниевая кислота захватывается клетками диатомей из среды и переносится в специальные органеллы, в которых образуются створки. Выпадая на дно водоемов, створки формируют донные отложения, а после их высыхания — породы. Около 500 тыс. т кремния в год увлекается в донные отложения озера в виде панцирей отмирающих диатомовых водорослей, спикул губок и створок некоторых моллюсков. Массовые скопления скелетов диатомовых водорослей образуют горную породу диатомит.
Клетки диатомовых водорослей покрыты кремнистым панцирем, который состоит из двух створок (поэтому они и получили свое название от греч. diatomos -разделенные пополам). Кремниевая кислота захватывается клетками диатомей из среды и переносится в специальные органеллы, в которых образуются створки. Выпадая на дно водоемов, створки формируют донные отложения, а после их высыхания — породы. Около 500 тыс. т кремния в год увлекается в донные отложения озера в виде панцирей отмирающих диатомовых водорослей, спикул губок и створок некоторых моллюсков. Массовые скопления скелетов диатомовых водорослей образуют горную породу диатомит.
1) В русских произведениях глаза красивых девушек «как яхонты горят». Какого же цвета глаза у этих красавиц? Яхонт — одно из устаревших названий красного и синего ювелирных минералов корундов. Красным яхонтом называли рубин, а «яхонтом лазоревым» или синим — сапфир. В современной минералогической терминологии не используется.
2) Средневековые алхимики обозначали химические элементы специальными значками: золото обозначалось символом Солнца — круг с точкой в центре, железо символом Марса (круг с отходящей от него стрелкой, аналогом копья). А с какой планетой алхимики связывали элемент медь? Какой женский атрибут послужил для алхимического значка меди? Латинское название меди (Cuprum) происходит от названия острова Кипр. Киприда – второе имя богини красоты Венеры.
Значит, алхимический значок меди – зеркало.
3) Этот химический элемент составляет 40% (по массе) основного состава скорлупы второго яйца Курочки Рябы. В скорлупе при постоянном содержании 1-2 % воды в основном находится карбонат кальция. Также содержится ничтожное количество карбоната магния, фосфатов магния и кальция.
40% от основного состава составляет элемент кальций (Са).
W(Ca/CaCO3=40:100=0,4=40% Кальций – строительный материал для костей, поэтому вылупившийся цыпленок съедает свою скорлупу.
4) По мнению китайцев окружающий нас мир образован их сочетаниями. Китайцы, как и мы, знают их более ста и располагают их в строгой последовательности: ЦИН, ХАЙ, ЛИ, ПИ, ПЭН, ТАН, ДАНЬ, ЯН и т.д. А вот ШУЙ не входит в их число, а рождается от сочетания двух ЦИН и одного ЯН. Как мы называем ШУЙ на русском языке? В переводе на русский язык слово «шуй» означает вода.
«Шуй» — это вода, которая содержится в земле и питает её.
Она состоит из двух цин и одного ян, то есть из двух атомов водорода и одного атома кислорода.
Слово «ШУЙ» входит в состав названия философии «Фэн-шуй». Фэн — ветер, его нельзя составить из химических элементов.
5) В состав хрустального стекла входят оксиды кремния, свинца и кальция. Можно ли хранить в хрустальной посуде маринад или квашеную капусту? Поясните Ваш ответ. (1-2 предложения). Хранить маринады или квашеную капусту в хрустальной посуде нельзя, так как в маринадах содержится уксусная кислота, а в квашеной капусте — молочная кислота. Кислоты вступают в реакцию с основными оксидами (PbO, CaO), которые входят в состав хрусталя, образуя соли, в том числе — растворимый ацетат свинца(«свинцовый сахар» ). Между тем известно, что все растворимые соли свинца очень ядовиты!(пишут «100%»). Поступая даже в малых количествах, свинец задерживается в организме и постепенно замещает кальций, который входит в состав костей. Это приводит к хроническим заболеваниям!
Кислоты вступают в реакцию с основными оксидами (PbO, CaO), которые входят в состав хрусталя, образуя соли, в том числе — растворимый ацетат свинца(«свинцовый сахар» ). Между тем известно, что все растворимые соли свинца очень ядовиты!(пишут «100%»). Поступая даже в малых количествах, свинец задерживается в организме и постепенно замещает кальций, который входит в состав костей. Это приводит к хроническим заболеваниям!
Кроме того, длительное хранение кислотосодержащих продуктов портит внешний вид хрустальных изделий, делая их мутными.
6) Если отбросить первую букву в названии химического элемента, то он превращается в напиток; если изменить первую – в другой химический элемент; а если изменить третью букву – в церковь. Назовите эти элементы, напиток и церковь. Бром-ром-хром-храм
7) «Видели ли вы на Литейном, близ Невского, магазин игрушек с вывеской «Забава и дело»? Так вот, для меня музыка – забава, а химия – дело». Кто автор этих слов? Автор этих слов – великий химик и талантливейший композитор Александр Порфирьевич Бородин . «Бородин – первоклассный химик, которому многим обязана химия. Бородин стоял бы еще выше по химии, если бы музыка не отвлекала его слишком много. Он – равно могуч и талантлив как в симфонии, так и в опере, и в романсе», — так говорили Д.И.Менделеев и В.В.Стасов.Его перу принадлежат более 40 работ по химии, музыкальные произведения — «Половецкий марш”, «Плач Ярославны”, опера «Князь Игорь» и многие другие. Но,все эти гениальные творения в музыке он совершил только когда был нездоров или летом на отдыхе.
«Бородин – первоклассный химик, которому многим обязана химия. Бородин стоял бы еще выше по химии, если бы музыка не отвлекала его слишком много. Он – равно могуч и талантлив как в симфонии, так и в опере, и в романсе», — так говорили Д.И.Менделеев и В.В.Стасов.Его перу принадлежат более 40 работ по химии, музыкальные произведения — «Половецкий марш”, «Плач Ярославны”, опера «Князь Игорь» и многие другие. Но,все эти гениальные творения в музыке он совершил только когда был нездоров или летом на отдыхе.
8) Один из ИХ вариантов действовал при соприкосновении с серной кислотой, другой — когда стеклянную головку раздавливали щипцами. Шведский вариант давал результат при трении о шершавую поверхность. Усовершенствованным вариантом мы пользуемся и сейчас довольно часто. О чем идет речь? Это спички! Французский химик Клод Бертолле получил соль – хлорат калия КСlО3, названную позднее бертолетовой. Хлорат калия вместе с серой, смолой, сахаром и другими веществами наносился на деревянную палочку. Головка погружалась в серную кислоту, происходила вспышка и лучинка загоралась. Такие спички часто называют «макальными». Спички усовершенствовали – кислоту стали запаивать в стеклянную трубку. Производство таких спичек было сложным и дорогостоящим. Густав Эрик Паш, запатентовал в 1844 году знаменитую шведскую спичку. В качестве горючего материала он использовал безопасный красный фосфор, нанеся его на боковую грань коробка. На саму же спичку Паш предложил наносить слабо воспламеняющийся материал, создававший трение. Лавры первооткрывателей спичек стремились получить многие, но история сохранила для нас из всех претендентов имя Якоба Каммерера.
9) В Англии на одной из площадей города Лидса стоит бронзовая скульптура молодого человека в костюме XVIII века. В правой руке он держит линзу, а в левой – тигель с «ртутной окалиной». Поворот головы, пристальный взгляд выражает внимание и терпеливое ожидание результата опыта. Какому ученому и открытию какого вещества посвящен этот памятник? В бронзе благодарные соотечественники запечатлели известного химика Джозефа Пристли в момент проведения знаменитого опыта1 августа 1774 г. он наблюдал выделение «нового воздуха» при нагревании с помощью двояковыпуклой линзы без доступа воздуха ртутной окалины, находящейся под стеклянным колпаком. Памятник посвящен открытию кислорода.
10) Русское и латинское названия этого химического элемента не совпадают. Латинское происходит от греч. аrsen — сильный, мужественный. А русское – от названия животного и роли, которую выполняет вещество, содержащее этот элемент, для этого животного. Назовите элемент, животное и вещество. Элемент – мышьяк, происходит от русских слов «мышь» и «яд», потому что первоначально вещества, содержащее его, использовалось в качестве отравы для этих грызунов. Простое вещество мышьяк неядовито. Но все соединения этого элемента, растворимые в воде и слабокислых средах чрезвычайно ядовиты!(Соединения As (III) более ядовиты, чем соединения As(V)). В качестве яда для мышей применяли оксид мышьяка (III)
11) Среди ярких вольфрамово-галоидных и ртутных ламп фонарей на улицах города встречаются лампы с желтым свечением. А пары КАКОГО вещества используются в таких лампах? Желтое свечение объясняется использованием натриевых ламп в которых используются пары натрия (Na). Пары натрия светятся желтым светом и не похожи на солнечный свет, поэтому к натрию добавляют и другие металлы, что делает свечение желто-оранжевым. Натриевые лампы намного экономичнее, т.к. дают при той же затрате электроэнергии большую освещенность.
12) После суровой зимы при проверке большого не отапливаемого интендантского склада в Петербурге, где хранились оловянные пуговицы, обнаружилось, что этих-то самых пуговиц и не оказалось. Вместо пуговиц, числившихся по описи, была обнаружена…труха. Интенданту склада грозило судебное разбирательство. Чем оно закончилось? Дайте краткое пояснение (1-2 предложения) к своему ответу. Скорее всего, дело закончилось помилованием интенданта. Оставшаяся труха появилась в следствии процесса, который называется «оловянная чума». При низких температурах белое олово переходит в серое. Металл превращается в серый порошок и теряет металлические свойства. При этом процессе незараженные участки олова могут «заразиться» от зараженных.
«Оловянная чума», в свое время оставила «трактиры без ложек и мисок, а солдат без пуговиц». Она погубила многие ценнейшие коллекции солдатиков. Например, в запасниках Питерского музея Александра Суворова превратились в труху десятки фигурок – в подвале, где они хранились, лопнули зимой батареи отопления.
В 1912 году погибла отправившаяся на штурм Южного полюса экспедиция Скотта. Среди снежной пустыни люди остались без горючего, поскольку керосин вытек из разрушившихся жестяных баков, пропаянных оловом.
12. Какой “лед” получают из продуктов горения угля? Продуктом горения угля является углекислый газ. При его охлаждении приповышенном давлении получают «сухой лёд». Углекислый газ обладает уникальным свойством переходить из твердого агрегатного состояния в газообразное минуя жидкое.
13 Это название лабораторной измерительной посуды или мужской высокой шляпы с неширокими полями. Цилиндр
Что представляют собой ядрышки орехов, которые грызла белка в «Сказке о царе Салтане»? Каков их химический состав? Изумруд — разновидность берилла 3BeOxAl2O3x6SiO2
Император Китая Цин Шихуан (III век до н.э.), во время правления которого появилась Великая китайская стена, использовал для своих писем густой рисовый отвар, который, после высыхания написанных иероглифов не оставлял никаких следов. Каким веществом можно было проявить сделанную надпись? Император использовал отвар бурых водорослей, содержащих большое количество иода.Проявить подобную надпись в современных условиях можно спиртовым раствором йода. При обработке она посинеет
Старинные стальные доспехи подвергались коррозии, принося неудобства своему владельцу. Чем пользовались древние рыцари и воины, оберегая свои доспехи от этой реакции? Для предохранения от коррозии доспехи рыцари смазывали воском или жиром. Кольчугу тяжело содержать чистой: слишком слабо намасленная она будет ржаветь, слишком сильно — будет собирать на себя пыль и пачкать одежду жирной грязью. Кольчуги сворачивались в мешки с песком и уксусом или просто клались в бочки с песком.
Какой химический элемент «замаскировался» в надписи «Периодическая таблица». Какое домашнее животное помогло его открыть? В надписи «перИОДическая таблица» спрятвлся элемент ИОД. По легенде открыть его помогла кошка.
Бернар Куртуа собирался провести несколько опытов. На столе стояли сосуды, в одном из которых была настойка морских водорослей на спирту, а в другом — смесь серной кислоты с железом.На плечах у ученого сидела его любимая кошка.В дверь постучали, и напуганная кошка спрыгнула и убежала, хвостом смахнув колбы на столе. Сосуды разбились, содержимое смешалось, и внезапно началась бурная химическая реакция, сопровождавшаяся выделением фиолетовых паров неизвестного вещества. Осевшие кристаллики и оказались до тех пор неизвестным простым веществом иодом.
18 Для чего китобои иногда замораживали морскую воду и затем снимали верхний слой? Для получения пресной воды.
19 Этот химический элемент называют элементом-тружеником, ему даже установлен памятник. О каком элементе идет речь? Как выглядит этот памятник? Памятник железу установлен в Брюсселе в 1958 году и называется Атомиум. Атомиум- это 9 громадных металлических шаров(диаметр 18м.), как бы весели в воздухе: 8 по вершинам куба, 9 в центре. Это была модель кристаллической решетки железа, в увеличенной в 165 миллиардов раз. Атомиум символизировал величие железа — металла-труженика, главного металла промышленности.
Сразу 4 элемента — иттрий, иттербий, тербий и эрбий — были названы в честь одной из шведских деревень. Назовите эту деревню и поясните — чем это было вызвано.
Множество химических элементов получили своё название в честь стран или других географических объектов. Сразу 4 элемента — иттрий, иттербий, тербий и эрбий — были названы в честь шведской деревни Иттербю, около которой обнаружили крупное месторождение редкоземельных металлов.
21.В японской кухне существует блюдо «танцующий кальмар». Недавно убитого кальмара помещают в чашку с рисом, а затем поливают соевым соусом — и в это время моллюск начинает «танцевать», перебирая своими щупальцами. Как этот факт связан с химическими элементами?
Данный эффект объясняется особым строением нервных волокон кальмаров, которые даже после их смерти реагируют с содержащимся в соусе натрием и заставляют мышцы сокращаться.
22.В Антарктиде из ледника Тейлора временами выходит Кровавый водопад. Благодаря чему он получил такое название и какие живые существа к этому причастны?
В Антарктиде из ледника Тейлора временами выходит Кровавый водопад. Вода в нём содержит двухвалентное железо, которое, соединяясь с атмосферным воздухом, окисляется и образует ржавчину. Это и придаёт водопаду кроваво-рыжий цвет. Однако двухвалентное железо в воде возникает не просто так — его производят бактерии, живущие в изолированном от внешнего мира водоёме глубоко подо льдом. Эти бактерии сумели организовать жизненный цикл при полном отсутствии солнечного света и кислорода. Они перерабатывают остатки органики, а «дышат» трёхвалентным железом из окружающих пород.
23. Академик Семён Вольфкович был в числе первых советских химиков, проводивших опыты с этим химическим элементом. Когда Вольфкович возвращался домой по тёмным улицам, его одежда излучала голубоватое свечение, а из-под ботинок высекались искры. Каждый раз за ним собиралась толпа и принимала учёного за потустороннее существо, что привело к распространению по Москве слухов о «светящемся монахе». С каким элементом он работал и за что получил такое прозвище?
Академик Семён Вольфкович был в числе первых советских химиков, проводивших опыты с фосфором. Тогда необходимые меры предосторожности ещё не принимались, и газообразный фосфор в ходе работы пропитывал одежду. Когда Вольфкович возвращался домой по тёмным улицам, его одежда излучала голубоватое свечение, а из-под ботинок высекались искры. Каждый раз за ним собиралась толпа и принимала учёного за потустороннее существо, что привело к распространению по Москве слухов о «светящемся монахе».
24.В состав пластмассы для деталей конструктора «Лего» входит сульфат бария. С какой целью он применяется и чем удобен в использовании?
В состав пластмассы для деталей конструктора «Лего» входит сульфат бария. Эта соль не растворяется в воде, что делает её нетоксичной для организма, и хорошо видна на рентгеновских снимках. Таким образом, если ребёнок проглотит деталь, её будет легко найти по этим снимкам.
25.Какому знаменитому физику вручили Нобелевскую премию в области химии?
Эрнест Резерфорд занимался исследованиями в основном в области физики и однажды заявил, что «все науки можно разделить на две группы — на физику и коллекционирование марок». Однако Нобелевскую премию ему вручили по химии, что стало неожиданностью как для него, так и для других учёных. Впоследствии он замечал, что из всех превращений, которые ему удалось наблюдать, «самым неожиданным стало собственное превращение из физика в химика».
26.Американцы добавляют в газ, идущий по газопроводам, химическое вещество с запахом тухлого мяса. С какой целью они это делают?
Грифы-индейки имеют очень острый нюх, особенно хорошо они чуют этантиол — газ, который выделяется при гниении трупов животных. Искусственно полученный этантиол добавляют в природный газ, который сам по себе не имеет запаха, чтобы мы могли почуять утечку газа из незакрытой комфорки. В малонаселённых районах США инженеры-обходчики иногда обнаруживают утечки на магистральных трубопроводах именно по кружению над ними грифов-индеек, привлекаемых привычным им запахом
27.В 1985 году группа американских и английских исследователей открыли молекулярные соединения из углерода, сильно напоминающие своей формой футбольный мяч. В честь него и хотели назвать открытие, однако учёные не договорились, какой термин использовать — football или soccer (как зовут футбол в США). Как в итоге было названо это соединение?
В 1985 году группа американских и английских исследователей открыли молекулярные соединения из углерода, сильно напоминающие своей формой футбольный мяч. В честь него и хотели назвать открытие, однако учёные не договорились, какой термин использовать — football или soccer (как зовут футбол в США). В итоге соединения назвали фуллеренами в честь архитектора Фуллера, который придумал геодезический купол, составленный из тетраэдров.
28. В 1903 году французский химик Эдуард Бенедиктус нечаянно уронил колбу, заполненную нитроцеллюлозой. Какое изобретение позже было изобретено благодаря этой оплошности? Небьющееся стекло было изобретено случайно. В 1903 году французский химик Эдуард Бенедиктус нечаянно уронил колбу, заполненную нитроцеллюлозой. Стекло треснуло, но не разлетелось на мелкие кусочки. Поняв, в чём дело, Бенедиктус изготовил первые лобовые стёкла современного типа, чтобы уменьшить количество жертв автомобильных аварий.
29.В своё время шахтёры, которые, спускаясь под землю, брали с собой клетку с канарейкой. Если пения давно не было слышно, значит, следовало подниматься наверх как можно быстрее. Объясните их поведение. Канарейки очень чувствительны к содержанию в воздухе метана. Эту особенность использовали в своё время шахтёры, которые, спускаясь под землю, брали с собой клетку с канарейкой. Если пения давно не было слышно, значит следовало подниматься наверх как можно быстрее.
30.В IV веке до нашей эры войска Александра Македонского вторглись в Индию. На берегах реки Инд в войсках разразилась эпидемия желудочно-кишечных заболеваний, которая, как ни странно, не затронула ни одного военачальника. Лечебные свойства какого химического элемента были открыты? Серебра.
Дышите глубже — на август это кислород
В этом году мы отмечаем 150-летие периодической таблицы химических элементов Дмитрия Менделеева, выделяя важные для жизни элементы. До сих пор мы рассмотрели водород, железо, натрий, калий, хлор, медь, кальций, фосфор, углерод и азот.
Фотосинтезирующие организмы улавливают энергию солнечного света и используют ее для производства органических молекул из углекислого газа и воды, которые они получают из окружающей среды. При этом в атмосферу выделяется кислород.Для августа мы выбрали кислород, высокореактивный неметалл с химическим символом O и атомным номером 8. Кислород имеет тенденцию заполнять свои две неспаренные электронные оболочки, принимая электроны от других атомов посредством ковалентной связи. Он образует оксидные соединения с различными элементами, и его наиболее распространенная степень окисления — — 2, но он также может существовать в степенях окисления — 1, + 1 и + 2.
После водорода и гелия кислород является третьим по распространенности химическим элементом в известной Вселенной.Это второй по распространенности элемент в геосфере Земли после железа и самый распространенный элемент по массе в земной коре — примерно от 47% до 49%. Кислород составляет около 89% мировых океанов, а двухатомный газообразный кислород составляет около 20% атмосферы Земли, уступая только азоту.
Кислород играет важную роль в эволюции всего живого на Земле. Самые ранние клетки использовали компоненты атмосферы ранней Земли — CO, CO 2 , N 2 и CH 4 — для синтеза органических соединений с помощью вулканического тепла и молнии.Клетки постепенно выработали пигменты, улавливающие видимый солнечный свет, приобрели способность использовать H 2 O в качестве донора электронов в реакциях фотосинтеза и начали выделять O 2 в качестве отходов. В этих условиях земная атмосфера обогащалась кислородом.
Аэробные организмы, живущие в средах с обильным поступлением O 2 , переносят электроны от топливных молекул к кислороду, получая энергию для сохранения и роста. Их анаэробные аналоги развились в среде, лишенной кислорода, и передают свои электроны нитратам, сульфатам или углекислому газу, образуя диазот, сероводород и метан соответственно.
Клетки Aerobe получают молекулярный кислород из окружающей среды путем диффузии через их плазматическую мембрану. Однако кислород плохо растворим в цитоплазме и внеклеточной среде и не может диффундировать на большие расстояния. Организмы выработали водорастворимые белки, которые используют переходные металлы, такие как железо и медь, для хранения и транспортировки кислорода в водной среде. Белки, такие как гемоглобин и миоглобин, используют железо в составе гема простетической группы для обратимого связывания кислорода и перемещения его по тканям.
Цитохромы также используют гем для переноса электронов в окислительно-восстановительных реакциях во время клеточного дыхания и фотосинтеза. Постоянное движение электронов внутри клетки приводит к образованию активных форм кислорода в качестве побочных продуктов, в основном ионов супероксида и перекиси водорода. Иммунные клетки некоторых позвоночных и некоторых растений используют эти реактивные виды для уничтожения вторгающихся микроорганизмов и патогенов.
Кислород является основным компонентом биологических молекул живых существ.Химические группы, содержащие кислород, включают гидроксилы, карбонилы и карбоксилы в спиртах, а также альдегиды, кетоны, карбоновые кислоты и сложные эфиры. Эти органические соединения являются строительными блоками для белков, нуклеиновых кислот, углеводов и жиров, структурных компонентов клеток и тканей. Кислород также является важным компонентом неорганических соединений, важных для жизни, таких как вода и фосфаты.
Год (био)химических элементов
Читать всю серию:
Для января это атомный номер.1
На февраль это железо — атомный №26
Для марта это почечный трифермент: натрий, калий и хлор
За апрель это медь — атомный №29
На май, это в твоих костях: кальций и фосфор
Для июня и июля это атомные номера 6 и 7
Дышите глубже — для августа это кислород
Марганец редко путешествует в одиночку
В октябре магний помогает листьям оставаться зелеными
Ноябрь, это запах серы
Завершение года с никелем и цинком
Содержание элементов в атмосфере Земли
Элемент | Содержание элементов в атмосфере ЗемлиНажмите, чтобы увидеть цитаты | Notes | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| O2 | ||||||||||||||||||||||||||||||||||||||||||||||||
Вода |
| Н3О (сильно варьирует) | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Диоксид углерода |
| CO2 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| 9009 | |||||||||||||||||||||||||||||||||||||||||||||||||
ImitaliGyology.Leckures 3-4Я могу предположить, что в классе есть ученики, которые не изучали химию в старшей школе или перевели ее из другого колледжа. Потребуются некоторые фундаментальные знания по химии, а лекции и текст должны предоставить вам достаточную базу.Не паникуйте, если это новый материал. Читайте тексты, читайте это резюме и задавайте вопросы! Обычно эти сводки не содержат столько «текста», сколько содержит этот. Это связано с тем, что прошлый опыт подсказывает, что в этом разделе необходим дополнительный материал, чтобы привести всех примерно к одному и тому же уровню понимания. Одна цель — познакомить вас с некоторыми важными земными материалами; показанные выше кристаллы аметиста высоко ценятся за их эстетическое качество. [Иллюстрация из — http://www.носк. mil/planet_earth/photos.html ] Состояние вещества Все, что имеет массу и занимает пространство, является материей. Следующая классификация поможет определить состояния, в которых может находиться материя.
Прочитайте этот материал, пока не дойдете до раздела, посвященного горным породам. Минерал:
Вся материя состоит из химических элементов, каждый из которых состоит из частиц, называемых атомами. Довольно грубое, но полезное представление об атоме — это жесткая сфера. Радиусы этих атомов составляют несколько ангстрем (где ангстрем равен 10-10 см.Существует 92 так называемых природных элемента, из которых 89 можно обнаружить на Земле в настоящее время. О том, что случилось с «пропавшими тремя», вам остается подумать. Эти сферы содержат центральное ядро, которое содержит два типа частиц:
Атомный номер — это число протонов в ядре атома. Атомное массовое число — это число протонов и нейтронов в ядре.Все атомы элемента имеют одинаковое количество протонов — следовательно, одинаковый атомный номер; например, все атомы водорода имеют один протон в ядре. Каждому элементу присвоен символ — Н для водорода. Вы должны выучить символы для восьми самых распространенных элементов в земной коре (кислород (O), кремний (Si), алюминий (Al), кальций (Ca), железо (Fe), магний (Mg), натрий ( Na) и калий (K). нейтронов в их ядре, так как все они должны иметь одинаковое количество протонов.Атомы с одинаковым атомным номером, но разными массовыми числами — это изотопов . Например, все атомы углерода имеют атомный номер 6, но есть три изотопа углерода -12, 13 и 14. (Сколько нейтронов у каждого изотопа?) Кроме частиц в ядре есть отрицательно заряженные частицы — электронов, которые «вращаются» вокруг центрального ядра. Признание того, что распределение электронов вокруг ядра не является случайным, было одним из великих достижений физиков 1920-х годов — квантовой механики.Электроны занимают «уровни», которые отделены друг от друга некоторым объемом пространства, через который электроны могут пройти, но не остаться. На самом деле большая часть объема атома состоит из пустого пространства. [Я помню, что именно так Супермен мог проходить сквозь твердые объекты!] Электроны «притягиваются» к ядру (притягиваются положительные и отрицательные заряды). Первичное деление этих уровней называется главным квантовым числом. Первый уровень (К) наиболее близок к ядру. По мере увеличения главного числа на 1…2….3….4 число электронов, которые могут находиться на уровне, увеличивается. Электроны уровня 1 = К 2 2 = Л 8 3 = М 18 4 = N 32Максимальная заполняемость = 2n2 (два раза n в квадрате) В нейтральном атоме число отрицательных частиц равно число положительных частиц (электроны = протоны). Полезным упражнением будет начать с первого элемента (водорода) с одним протоном и одним электроном и добавить один протон и один электрон, чтобы построить остальные химические элементы.Процесс наращивания работает следующим образом. Начните с одного электрона — он занимает пустое место. ближайший к ядру уровень второй электрон переходит на первый уровень (атомарный гелий) и оболочка К) заполнена. На самом деле внутри основного уровня есть подуровни (кроме К-оболочка). Максимальное количество электронов в подоболочке с 2 стр. 6 д 10 ф 14Для элемента 11 (натрий — Na) имеется 11 электронов и 11 протонов. Два электрона находятся в оболочке K, 8 в оболочке L и один в оболочке M.Самые внешние электроны называются валентными электронами. Если бы один электрон был удален каков баланс между положительными и отрицательными зарядами? Ан ион — заряженный атом; то есть имеется избыток положительных ( катион ) или отрицательный заряд (анион ). Если электрон удален, катион сформировался. Если добавить электрон, образуется анион. Из восьми наиболее распространенных в земной коре элементов только кислород образует анионы; остальные образуют катионы, теряя один или несколько электронов.Когда на s- и p-подоболочках находится 8 самых внешних электронов, атом имеет тенденцию сопротивляться изменениям, а ионы образуются с большим трудом, если вообще образуются. Орбиты основного уровня K 1 с (макс. = 2) Всего = 2 Л 2с (макс = 2), 2п (макс = 6) Итого = 8 М 3с (макс = 2), 3п (макс = 6), 3п (макс = 10) Итого = 18Химическая связь. Большинство элементов на Земле вступают в реакцию, образуя соединения, хотя некоторые из них стабильны как элементы (например, золото). Существует несколько «моделей связи», которые необходимо обобщить.
Признание того, что элементы можно систематизировать таким образом, чтобы подчеркнуть связи между атомами, стало крупным прорывом в истории химии.Например, все элементы в первой колонке (щелочные металлы) имеют одну самый внешний электрон в своей самой внешней подоболочке (подоболочке s). Все эти элементы могут потерять один электрон, образуя катион с зарядом +1. Все элементы в крайнем правом столбце (инертные или нобелевские газы) имеют два s-электрона и восемь p-электронов на самом внешнем уровне (называемом валентным уровнем). Обратите внимание, что Периодическая таблица имеет форму искаженной буквы «Н». Вертикальные полосы (стороны буквы Н) содержат элементы группы А.Центральная полоса содержит «переходные» элементы. Внизу страницы две строки — «Лантаноиды» и «Актиниды». Посмотрите, где эти строки вписываются в букву «Н». Если бы эти строки отображались в правильном положении, периодическая таблица была бы менее компактной. Вопросы
Задумайтесь над утверждением, что кислород занимает 95% объема земной коры. Если бы кислород был кубиками, его можно было бы сложить вместе, чтобы заполнить пространство. Однако кислород считается сферой, и вы не можете упаковать сферы одинакового размера, чтобы заполнить все пространство; некоторые открытые пространства останутся внутри каркаса, созданного кислородом.В эти открытые пространства вписываются другие ионы. В общем случае эти пространства являются «регулярными». Один из распространенных типов пространства создается, когда есть три кислорода внизу и один наверху. Это называется «тетраэдрической пустотой». (Тетраэдр — это правильное твердое тело, состоящее из четырех граней, каждая из которых представляет собой равносторонний треугольник.) Чем больше ион, тем больше предпочтительное место. Координационное число катиона – это число ближайших соседних анионов. Кремний, за одним исключением, предпочитает «сидеть» в тетраэдрической пустоте, образованной упаковкой анионов кислорода вместе.Таким образом, кремний обычно имеет координационное число 4. Координационные числа используются для получения структурной формулы. Помните, что нижние индексы дают количество ионов в одной формульной единице, а числа над химическими символами дают координационные числа. Кварц 4 SiO2 стишовец 6 SiO2Кварц и стишовит являются полиморфами (множество форм). Они имеют одинаковый химический состав, но различаются по структуре и, следовательно, по физическим свойствам. Повышение давления способствует большему координационному числу.Температура имеет обратный эффект. Если бы большой метеорит столкнулся с кварцем, то мог бы образоваться стишовит (если бы давление было достаточно высоким). Другие полиморфы
Форстерит 6 4 Mg2SiO4 фаялит 6 4 Fe2SiO4 Обратите внимание, что два минерала химически различаются тем, что в одном есть Mg (магний), а в другом Fe (железо). Остальные химические формулы идентичны. Обратите внимание, что и Mg, и Fe находятся в 6-кратных позициях (октаэдрические). Размеры этих двух ионов почти идентичны, заряд обоих равен +2, а связи Mg-O и Fe-O преимущественно ионные по своей природе. Когда такое сходство имеет место, ионы могут замещать друг друга, образуя серию твердых растворов .Серия между этими двумя концевыми элементами называется серией оливина . Составы варьируются от чистого форстерита до чистого фаялита. Не все серии твердых растворов полны; некоторые демонстрируют ограниченное количество замещения. Почти все распространенные минералы, с которыми мы будем работать, относятся к серии твердых растворов. Кварц является заметным исключением. Классификация полезных ископаемых Самая широкая классификация почти 3500 известных минералов основана на химическом составе.Таким образом, мы признаем природные элементы (отдельные химические элементы), карбонаты (содержащие группу CO3, силикаты (содержащие кремний и кислород) и другие широкие химические группы. Химически силикаты очень сложны, и в их понимании не было большого прогресса, пока не была разработана структурная классификация. Наиболее распространенным «структурным элементом» является тетраэдр кремний/кислород. Простейший структурный класс силикатов состоит из тех соединений (минералов), которые состоят из изолированных одиночных тетраэдров — несосиликатов.Тетраэдры могут делиться кислородом между собой. Два, три и четыре атома кислорода на тетраэдр могут быть общими, а в некоторых структурах существуют две или более схемы совместного использования. Ниже перечислены наиболее распространенные минералы. (имейте в виду, что все они содержат Si и O. Многие также содержат Al).
Кроме того, важны следующие группы минералов, особенно в осадочных породах Карбонаты Структурная классификация силикатов .[тогда вернитесь на эту страницу] Вопросы Используйте раздел Свойства , чтобы ответить на следующие вопросы.
Хороший указатель полезных ископаемых и драгоценных камней доступен для студентов в Университете Висконсина . Если вам нравится рассматривать образцы минералов, вы, вероятно, захотите взглянуть на некоторые изображения из Смитсоновской коллекции минералов Smithsonian Minerals Вернуться к списку литературы по физической геологии Вернуться на домашнюю страницу физической геологии Происхождение кислорода в атмосфере ЗемлиМолекулы кислорода трудно удержать рядом, несмотря на то, что это третий по распространенности элемент во Вселенной, выкованный в сверхгорячих и сверхплотных ядрах звезд.Это потому, что кислород хочет реагировать; он может образовывать соединения практически с любым другим элементом периодической таблицы. Так как же Земля оказалась с атмосферой, состоящей примерно из 21 процента вещества? Ответ: крошечные организмы, известные как цианобактерии или сине-зеленые водоросли. Эти микробы проводят фотосинтез: используя солнечный свет, воду и углекислый газ для производства углеводов и, да, кислорода. Фактически, все растения на Земле содержат симбиотических цианобактерий (известных как хлоропласты), которые и по сей день осуществляют фотосинтез за них. В течение нескольких неисчислимых эпох до эволюции этих цианобактерий, в течение архейской эпохи, более примитивные микробы жили по-настоящему старомодным образом: анаэробно. Эти древние организмы — и их «экстремофилы» сегодня — процветали в отсутствие кислорода, полагаясь на сульфаты для удовлетворения своих энергетических потребностей. Но примерно 2,45 миллиарда лет назад соотношение изотопов серы изменилось, указывая на то, что впервые кислород стал важным компонентом атмосферы Земли, согласно статье 2000 года в Science .Примерно в то же время (и в последующие эпохи) в древних почвах начало появляться окисленное железо, а на морском дне откладывались полосы железа, являющиеся продуктом реакций с кислородом в морской воде. «Похоже, что кислород впервые образовался где-то от 2,7 до 2,8 миллиардов лет назад. Он поселился в атмосфере около 2,45 миллиардов лет назад», — говорит геохимик Дик Холланд, приглашенный ученый из Пенсильванского университета. «Похоже, что существует значительный временной интервал между появлением организмов, производящих кислород, и фактическим насыщением атмосферы кислородом.» Таким образом, можно установить дату и виновника того, что ученые называют Великим событием окисления, но загадки остаются. Что произошло 2,45 миллиарда лет назад, что позволило цианобактериям захватить власть? Каким был уровень кислорода в то время? Почему потребуется еще один миллиард лет, который ученые назвали «скучным миллиардом», чтобы уровень кислорода поднялся достаточно высоко, чтобы обеспечить эволюцию животных? Самое главное, как количество атмосферного кислорода достигло нынешнего уровня? так просто, почему он должен балансировать на уровне 21 процента, а не 10 или 40 процентов», — отмечает геолог Джеймс Кастинг из Университета штата Пенсильвания.«Мы не очень хорошо понимаем современную систему контроля кислорода». Климат, вулканизм, тектоника плит — все это играло ключевую роль в регулировании уровня кислорода в различные периоды времени. Тем не менее, никто не придумал надежного теста для определения точного содержания кислорода в атмосфере в любой момент времени на основе геологических данных. Но ясно одно: происхождение кислорода в атмосфере Земли связано с одним: с жизнью. Планетарная среда, богатая фтором, как возможная среда обитания для жизниLife (Базель).2014 сен; 4(3): 374–385. Nediljko Budisa1 Химический факультет Берлинского технического университета, Müller-Breslau-Straße 10, 10623 Berlin, Germany; E-Mail: ed.nilreb-ut.niw@nikhsybuk Владимир Кубышкин1 Химический факультет Берлинского технического университета, Мюллер-Бреслау-Штрассе 10, 10623 Берлин, Германия; Электронная почта: ed.nilreb-ut.niw@nikhsybuk Дирк Шульце-Макух2 Школа окружающей среды Вашингтонского государственного университета, Webster Hall 1148, Pullman, WA 99164, США; Электронная почта: ude.usw@mskrid 3 Центр астрономии и астрофизики Берлинского технического университета, Hardenbergstraße 36, 10623 Berlin, Germany 1 Химический факультет Берлинского технического университета, Müller-Breslau-Straße 10, 10623 Berlin, Germany ; Электронная почта: ed.nilreb-ut.niw@nikhsybuk 2 Школа окружающей среды Вашингтонского государственного университета, Webster Hall 1148, Pullman, WA 99164, США; E-Mail: ude.usw@mskrid3 Центр астрономии и астрофизики Берлинского технического университета, Hardenbergstraße 36, 10623 Berlin, Germany Поступила в редакцию 7 июля 2014 г.; Пересмотрено 4 августа 2014 г .; Принято 5 августа 2014 г. Авторские права © 2014 принадлежат авторам; лицензиат MDPI, Базель, Швейцария. Эта статья цитировалась другими статьями в PMC.AbstractВ полярных апротонных органических растворителях фтор может быть предпочтительным элементом для жизни, которая использует выбранные фторированные строительные блоки в качестве предпочтительных мономеров для самосборки своих каталитических полимеров. Фторорганические соединения чрезвычайно редки в химии жизни, какой мы ее знаем. Биомолекулы при фторировании, такие как пептиды или белки, проявляют «эффект фторирования », i.е. , они флуорофильные (ни гидрофильные, ни липофильные). Такие полимеры, способные образовывать самосортирующиеся сборки, сопротивляются денатурации органическими растворителями за счет исключения фторуглеродных боковых цепей из органической фазы. Сердечники Fluorous состоят из компактной внутренней части, защищенной от окружающего растворителя. Таким образом, мы можем ожидать, что фторсодержащие «тефлоновые» или «неприлипающие» строительные блоки могут быть предпочтительными мономерами для синтеза организованных полимерных структур в планетарной среде, богатой фтором.Хотя планетарная среда, богатая фтором, неизвестна, теоретические соображения могут помочь нам определить химический состав, который может поддерживать жизнь в такой среде. Например, один сценарий заключается в том, что весь молекулярный кислород может быть израсходован в результате реакций окисления на поверхности планеты, а газообразный фтор может быть высвобожден из магмы, богатой фтором, позже в истории планетарного тела, что приведет к образованию богатой фтором планетарной среды. Ключевые слова: фтор, обитаемость, жизнь, планетарное тело, атмосфера, растворитель, органический синтез, органическая химия, альтернативная биохимия 1.ВведениеФтор является 24-м наиболее распространенным элементом во Вселенной (4 × 10 90 584 −5 90 585 %), и поэтому относительно редок. Однако в земной коре он обогащен и является 13-м по распространенности элементом по весу (0,054%), сразу после углерода (0,02%). Элементы, к которым фтор имеет высокое сродство, Si, Al, Ca и Mg, также распространены как в земной коре, так и во Вселенной (28,2/0,07%, 8,1/0,005%, 4,1/0,007% и 2,3/0,06%). , соответственно). Вот почему фтор, вероятно, будет тесно связан с стабильными веществами вне жидких условий. С химической точки зрения фтор является наиболее электроотрицательным элементом в периодической таблице и может рассматриваться как альтернативный заменитель кислорода. Однако кислорода гораздо больше: его на пять порядков больше, чем во Вселенной, и на три порядка больше, чем в земной коре. Доминирование кислорода по сравнению с фтором становится еще более очевидным при сравнении обилия этих элементов в организмах на Земле: водород и кислород — наиболее распространенные элементы [1,2], а фтор — лишь редкий микроэлемент, который, по-видимому, не необходимо для жизни.В земной коре фтор чаще всего встречается в виде фторида кальция, который является основным компонентом минералов, таких как фторапатит, криолит и топаз. Хотя содержание фтора в земной коре довольно велико, в океанах он встречается редко, вероятно, из-за низкой растворимости его солей (фторидов) в воде. Вот почему, например, хлориды гораздо чаще встречаются в морской воде, чем фториды (19 000 90 566 против 90 567 1,3 ppm), несмотря на то, что последних больше в земной коре [3,4]. Это также может быть одной из причин редкости метаболически генерируемых фторированных соединений (до сих пор обнаружено только 30 встречающихся в природе фторорганических соединений и один фермент — фториназа, который катализирует образование связи C-F), тогда как существует более 3500 органогалогенов биогенного происхождения. [4,5].Все галогены, в том числе и фтор, первоначально попадают на поверхность планеты в результате вулканической деятельности, в частности геотермальных процессов [6]. В то время как биогенные соединения фтора довольно редки, существует большое количество промышленных фторсодержащих соединений, которые все имеют антропогенное происхождение [7]. Таким образом, хотя фтор редко используется жизнью в том виде, в каком мы его знаем, он имеет большой потенциал для применения в биотехнических целях. Особый интерес в этом контексте представляют попытки создания биохимических структур с использованием фтора — в основном полимеров аминокислот (белков) и нуклеиновых кислот (ДНК/РНК), а также липидов и малых метаболитов и промежуточных продуктов метаболизма (4-фтортреонин, фторацетат, фторцитрат ). и т.д. . ; дополнительную информацию см. в [8]). Жизнь, по-видимому, не использовала фторорганические мотивы из-за низкой доступности фторидов в растворе и их относительно низкой доступности по сравнению с прямыми конкурентами фтора, такими как кислород, хлор и водород. 2. Плавиковая кислота как растворитель для жизни?Вода, безусловно, является растворителем, имеющим огромное значение для эволюции жизни на Земле. Однако существуют альтернативные растворители, и фтористоводородная кислота (HF) является одним из них с более высоким потенциалом замены воды [9].Плавиковая кислота имеет некоторые сходные свойства с водой. Его общий диапазон температуры жидкости при давлении 1 бар составляет 103,4 градуса, от -83,4 °C до +20,0 °C. Таким образом, HF в качестве растворителя доступен при более низких температурах, чем вода, поэтому он больше подходит для несколько более холодных планетарных тел. Его энтальпия плавления и энтальпия испарения составляют 4,6 и 30,3 кДж/моль соответственно, что лишь немного ниже, чем у воды, а это означает, что он по-прежнему является хорошим замедлителем температурных перепадов. Диэлектрическая проницаемость HF немного больше (83.6 против 80,1), а его дипольный момент немного ниже, чем у воды (1,83 против 1,85). Однако вязкость плавиковой кислоты составляет лишь около половины вязкости воды, а ее поверхностное натяжение в 4 раза меньше (18,1 × 10 −3 Дж/м 2 против 71,99 × 10 −3 Дж/м). м 2 ). И вода, и HF являются автопротолитическими растворителями, образующими водородные связи. Кроме того, диффузия зарядов может происходить через сетку водородных связей (структурная диффузия) в обеих средах.Поэтому HF способен поддерживать кислотно-щелочной химический состав так же, как и вода. Одним из свойств, приписываемых воде и считающихся важными для жизни, является существование разделения углеводородной фазы за счет гидрофобного эффекта. Интересно, что неполярные углеводородные соединения плохо растворяются в плавиковой кислоте, но многие из них полимеризуются, разлагаются или переходят в проводящие растворы с комплексными катионами, в которых органическая молекула связывается с протоном HF [10].Таким образом, если бы HF присутствовал в планетарной среде в достаточном количестве, он мог бы в принципе быть подходящим растворителем для органических соединений, либо сам по себе, либо в водном растворе. Чистая HF является одной из самых сильных обнаруженных кислот и имеет универсальный параметр кислотности H 0 , равный -15,0 [11]. Таким образом, крайне маловероятно, что он будет использоваться биологией. Сольватация HF в воде превращает его в кислоту средней силы (pK a 3,19 [12]), что делает его более подходящим для использования в жизни в качестве растворителя.Тем не менее планета, на которой существовала бы смесь HF-H 2 O в качестве единственного потенциального растворителя, несомненно, потребовала бы развития другой биохимии, например, другого набора макромолекул, которые взяли бы на себя функцию нуклеиновых кислот (как информационных полимеры) и белки (как каталитические полимеры), чем используются жизнью, какой мы ее знаем. Жидкий HF также задерживает ионы Ca 2+ и Mg 2+ в жидкой среде и исключает их функцию адгезионных мостиков, скелетных элементов, вторичных мессенджеров и т.д. Следовательно, было бы необходимо разработать другую неорганическую биохимию для гипотетического метаболизма, где в качестве растворителя используется HF. 3. Фторсодержащие органические соединения как возможные строительные блоки жизни3.1. Фторсодержащие органические соединенияБиосфера в значительной степени игнорирует фтор как строительный материал для жизни. Но люди уже давно извлекают выгоду из химии фторорганических соединений. Замечательное развитие фторорганической химии в материаловедении и медицине получило широкое распространение благодаря свойствам фтора на молекулярном уровне.Хорошим примером является 5-фторурацил, который используется в качестве обычного противоопухолевого препарата уже более 50 лет из-за сходства этой молекулы с природным нуклеооснованием урацилом [13]. Клеточный механизм будет использовать фторурацил в качестве субстрата для производства тимидина, потому что группы C-H (в урациле) и C-F (во фторурациле) очень похожи по размеру. Однако стабильность и инверсия полярности в последнем случае будут ингибировать существенное метилирование этой группы, например, блокируя синтез ДНК. Этот пример представляет подход медицинской химии к сайт-специфическим модификациям фтора в молекулах природного субстрата [14].Фтор может служить для некоторой биосовместимой настройки молекулярных свойств, таких как полярность, стерический размер, липо- и гидрофильность [15]. Присутствие атомов фтора в органическом химическом веществе увеличивает полярность этого вещества. Наоборот, гидрофобность вещества можно увеличить путем добавления полифторированных групп в случае CF 3 –, SF 5 – или подобных группировок. Дальнейшее повышение уровня фторирования в алифатической цепи приводит к появлению эффекта фтористого ( см. ниже ), который не может быть явно описан в терминах гидрофильно-липофильного дуализма, что открывает совершенно новую возможность для фазового разделения. Электроноакцепторный эффект фтора в ароматических структурах, таких как пентафторфенильная группа, значительно увеличивает силу взаимодействия π-стэкинга [16,17]. В частности, было показано, что перфторированные ароматические кольца могут служить для стабильности двухцепочечной ДНК на основе мотива гидрофобности в качестве альтернативы парированию Уотсона-Крика [18]. 3.2. Эффект фтора и сворачивание высокофторированных биомолекулПовышенное содержание фтора в алифатической органической молекуле или полимере приводит к разделению высокофторированных частиц на особую фазу, которая не является ни гидрофильной, ни липофильной в их стандартных значениях.Крайним примером может быть Teflon ® , наиболее химически инертный органический полимер. Кроме того, высокая плотность перфторированных соединений вызывает расслоение фаз макроскопическим образом (). Высокофторированные вещества называются фтористыми , и их свойства нашли многочисленные применения в области материаловедения [19]. Было обнаружено, что перфторированные цепи образуют спирали и двойные спирали, образуя высокоупорядоченные жидкие кристаллы в гидрофобных средах [20].Это свойство имеет большое значение, учитывая упорядоченную самосборку биологических молекул и молекулярных машин. Физико-химическая природа фтористого эффекта. Слева : разделение фаз перфторированных соединений/растворителей, которые не смешиваются как с органической, так и с водной фазами. В современной литературе термин « фтористый » используется для высокофторированных ( т.е. , перфторированных) растворителей по аналогии «водный» для систем на водной основе [30]. Правый : углеводород против Белковое ядро fluorous (темные структуры — водный растворитель, бледные пятна — органический растворитель). Углеводородное ядро полимера (вверху) раскрывается при добавлении органического растворителя, что приводит к денатурации, тогда как фтористое ядро (внизу) остается нетронутым. Эффект фтористого очень похож на эффект, отвечающий за неприлипающие свойства тефлона [31]. Как правило, полимерные материалы, модифицированные несколькими фторированными углеродами, обладают повышенной гидрофобностью и стабильностью.Эти соображения могут иметь особое значение при оценке того, может ли жизнь существовать в гидрофобных растворителях [9,32] в условиях «обратной фазы». Рисунок изменен из [33]. Классические фторсодержащие материалы состоят из перфторированных цепей F 2n+1 C n , за которыми следует «нормальный» углеводородный спейсер и функциональная группа. Эти конструкции, названные хвостиками , использовались в качестве строительных блоков для фосфолипидов. Интересно, что было продемонстрировано, что такие липиды склонны к построению ламеллярных фаз, а также везикул с низкой склонностью к старению [21].Помимо высокой стабильности полифторированные фосфолипиды демонстрируют полиморфные фазовые переходы [22], повышенную жесткость мембран [23] и сегрегацию липидных фракций на мембраноподобных липидных рафтах [24]. Такие же эффекты обычно создает жизнь на Земле с эфирными липидами (стабильность), сфингомиелином (плоты), холестерином (жесткость) и сложными составами липидов (фазовые переходы). Fluorous липиды могут представлять собой хорошую альтернативу. Тем не менее, эффективное накопление энергии является одной особенно важной функцией, которую не могут взять на себя фтористые липиды. Экспериментально подтверждено, что полипептиды, содержащие боковые цепи перфторированных аминокислот, проявляют липофобный эффект в отношении сильно фторированных алкильных групп [25,26]. Сильно фторированные биополимеры, такие как перфторированные полимеры, содержащие аминокислоты, устойчивы к высоким температурам и демонстрируют необычное фазовое расслоение: они одновременно гидрофобны и липофобны, и они преимущественно взаимодействуют с другими фторуглеродными соединениями [27]. Напротив, складчатые полимерные структуры на основе углеводородов, такие как белки, складываются в стабильные трехмерные структуры посредством гидрофобного эффекта, т.е.е. путем исключения неполярных остатков из водной фазы. Фактически белки складываются в плотную молекулу с внутренним гидрофобным ядром, которое защищено от окружающего водного растворителя в соответствии с общим принципом складывания «аполярный инполярный наружу» [28]. Это справедливо и для свернутых перфторированных белков. Перфторированные боковые цепи обладают способностью вызывать гидрофобный коллапс за счет их исключения из водной или органической фазы, как показано на рис. Перфторуглероды были описаны как фторофильные ( i.е. , ни липофильный, ни гидрофильный), и ожидается, что они не будут взаимодействовать с гидрофильными или гидрофобными растворителями [29]. Поэтому неудивительно, что производство высокоперфторированных соединений привлекло внимание не только научных кругов, но и биотехнологических компаний, например, ферменты с такими высокофторированными структурными заместителями решат две основные проблемы биотрансформаций на основе ферментов (i) устойчивость к различным органическим (и, возможно, другим неблагоприятным) растворителям и (ii) поиск новых инновационных решений проблем в производстве новых биоматериалов, биосенсоров и белковых терапевтических средств [33].Основной причиной этих усилий является попытка рационального проектирования и конструирования новых структур, наделенных предопределенными и необычными функциями, которые можно использовать в исследованиях ксенобиотиков для увеличения проницаемости мембран фармакологически активных веществ, тем самым повышая активность лекарств. 3.3. От фторированных аминокислот к белкам и пептидамПростейший экспериментальный подход к введению фтора в структуру белка заключается в проведении биосинтеза белка с аналогами аминокислот, в которых отдельные атомы водорода заменены аналогами фтора [34].Поскольку фтор гораздо менее объемный, чем хлор, он вызывает меньше стерических возмущений в белковых структурах. С другой стороны, фтор является наиболее электроотрицательным элементом, и поэтому связи C–F резко изменяют зарядовые свойства молекул по сравнению со связью C–H [35]. Например, его дипольный момент противоположен дипольному моменту связи C–H, и возникает сильный индуктивный эффект [36]. Фтор обладает очень высоким потенциалом ионизации и малой поляризуемостью, поэтому фторированные молекулы проявляют лишь слабые межмолекулярные взаимодействия , т. е.е. , высокофторированные соединения характеризуются слабой поверхностной энергией, малыми диэлектрическими постоянными и показателями преломления [37]. Из-за его электроотрицательности связи фтор-углерод сильно поляризованы с положительным частичным зарядом на атоме углерода. Связи C – F имеют более высокую энергию, чем другие C-галогенные связи, а также имеют высокую энергию диссоциации связи. Например, фторалкильные цепи чрезвычайно устойчивы к химическим превращениям. Однако для аминокислотных строительных блоков с одиночными заменами H→F ( i.е. , монофторированные аминокислоты), атом фтора не является стерически требовательным заместителем, хотя связь C-F на 0,4 Å длиннее, чем связь C-H. Поэтому монофторированные аналоги аминокислот часто используются в качестве заменителей в биосинтезе белка [38,39,40]. Гидрофобность молекулы может быть усилена введением атомов фтора. Однако по отношению к монофторированным аминокислотам экстенсивно фторированные аминокислоты демонстрируют гораздо более существенные различия по сравнению с природными аналогами углеводородов.Например, они имеют заметно увеличенный молекулярный объем, проявляют устойчивость к высоким температурам и проявляют необычное фазовое расслоение [41]. В частности, замена CH 3 → CF 3 увеличивает стерический объем более чем на 12 Å 3 за одну замену [42]. обобщает некоторые часто используемые трифторированные аминокислоты в исследованиях пептидов и белков. Наиболее заметным свойством трифторметильной группы является ее повышенная гидрофобность (она почти в два раза более гидрофобна, чем метильная группа).Однако до сих пор есть нерешенные вопросы. Например, углеводороды более поляризуемы, чем фторуглероды (поскольку когезионные дисперсионные силы между двумя молекулами углеводородов больше, чем между двумя фторуглеродами [43]), и у нас все еще нет убедительных доказательств самосегрегационных свойств сложных перфторуглеродсодержащих белков. А именно, большинство исследований «белков fluorous » было проведено с использованием пептидов, в основном синтезированных химическим путем, таких как биоактивные пептиды fluorous или антимикробные пептиды fluorous [44].Обширное фторирование таких небольших пептидов сохраняет форму родственных боковых цепей, что имеет решающее значение для правильной упаковки боковых цепей внутри гидрофобного ядра, в то время как увеличенный размер и гидрофобность хорошо переносятся [45]. Гидрофобные канонические (Ala, Val, Leu, Ile, Met) и неканонические аминокислоты (норвалин, Nva; α-аминобутират, Abu; норлейцин, Nle), используемые для построения белковых ядер. По крайней мере следы Nle, Nva и Abu были обнаружены в межзвездной среде и углеродистых метеоритах, помимо некоторых канонических аминокислот [28].Эти аминокислоты имеют перфторированные аналоги антропогенного происхождения, обладающие особыми свойствами. Часто используемые трифторированные аминокислоты: TFMet (6,6,6-трифторметионин), TFLeu (5,5,5-трифторлейцин), HFLeu — (5,5,5,5′,5′,5′-гексафторлейцин), TFVal — (2 S , 3 R )-4,4,4-трифторвалин; 5TFIle [(2S,3S)-5,5,5-трифторизолейцин] и 3TFIle-[(2S,3S)-3,3,3-трифторизолейцин]. Звездочка в структуре указывает на неопределенную стереогенность ( i.е. , хиральный) углеродный центр. Напротив, включение перфторированных аминокислот в белки живых клеток по-прежнему является сложной задачей для исследований [46]. Инженерия генетического кода в последнее время стала важной дисциплиной в химической биологии [28], поскольку она обеспечивает эффективную платформу для переноса многочисленных синтетических молекул из лаборатории в биохимию живых клеток, включая использование фторированных молекул. Имеется несколько недавних экспериментальных сообщений о глобальном включении трифторированных алифатических аминокислот в белки живых клеток [29].Первые пионерские работы Реннерта и Анкера показали, что некоторые лейциновые ауксотрофы E. coli способны в определенной степени расти на синтетических средах, содержащих трифторлейцин () вместо лейцина [34]. Важным наблюдением было то, что транспортные системы аминокислот не способны различать стерически сходные аминокислоты лейцин (Leu) и трифторлейцин (TFLeu). С другой стороны, механизм того, как им удалось адаптировать ауксотрофы к росту на TFLeu, до сих пор оставался неясным, поскольку это вещество является сильным ингибитором клеточного роста [47].Однако резидент-специфическое включение неканонических аминокислот позволяет обойти эту токсичность довольно простым и прямым способом [48]. Активность гена-мишени должна быть скрыта при выращивании клеток-хозяев до соответствующего уровня. После образования достаточного количества «здоровых» клеток индуцируется синтез целевого белка. С этого момента клетки-хозяева служат лишь «фабрикой» по производству нужного рекомбинантного белка, и их дальнейший рост имеет второстепенное значение. Дополнительным требованием является то, что метаболический путь, который снабжает клетку определенной канонической аминокислотой (например,г., лейцин) выключается. Это делает клетки-хозяева ауксотрофными, , т.е. , в зависимости от количества канонической аминокислоты, присутствующей в определенной минимальной среде. Кроме того, ферментация в минимальных средах с лимитирующими рост концентрациями нативной аминокислоты как природного субстрата приводит к ее истощению из среды. В этот момент добавляется неканоническая аминокислота и индуцируется синтез белка, что приводит к накоплению исключительно меченых белков [49]. 4.Жизнь, основанная на химии фтора?Возможна ли жизнь на основе химии фтора? Очевидно, что естественные каркасы, которые возникли на Земле, обычно не подходят для размещения перфторированных аминокислот в качестве строительных блоков белков. А именно, белковые структурные каркасы с углеводородными ядрами формируются и оптимизируются миллиардами лет эволюции на Земле и не очень подходят для размещения большого количества атомов фтора. Таким образом, создание биохимии на основе фтора кажется сложной задачей.Однако мы должны освободиться от наших предубеждений, которые исходят исключительно из жизни на Земле, и осознать, что жизнь адаптируется к окружающей среде и использует имеющиеся ресурсы в полной мере [50]. Но, учитывая тот факт, что жизнь во всем своем разнообразии на Земле никогда не принимала фтор в качестве биогенного элемента, его приспособление к метаболизму и физиологии организмов действительно является серьезной проблемой. Остается вопрос, относится ли это только к жизни на Земле, для которой фтор мог быть недостаточно доступен в добиотической эволюции к жизни.Или у фтора есть свойства, делающие его вообще непригодным для жизни? Конечно, фтор является элементом с самой высокой электроотрицательностью, превосходящей кислород, и очень агрессивен во многих соединениях, особенно в виде плавиковой кислоты. И, находясь в единственной степени окисления -1, он не может использоваться в метаболических окислительно-восстановительных реакциях, в которых изменяется его степень окисления (например, углерод). Однако клетки способны вырабатывать ферменты для образования связи углерод-фтор [4], что указывает на то, что метаболическая инженерия с помощью органического фтора действительно возможна.Кроме того, в литературе уже есть убедительные доказательства того, что введение фтора в протеоме возможно [51]. Аргументы, выдвинутые против фтора как основной универсальной молекулы жизни, отражают аргументы, которые можно было бы выдвинуть против кислорода. Кислород имеет вторую по величине электроотрицательность, может быть чрезвычайно агрессивным (например, как радикал ОН) и высокотоксичен для анаэробных организмов. Цианобактерии были первыми организмами на ранней Земле, которые выбрасывали в атмосферу огромное количество кислорода, вызвав глобальную экологическую катастрофу для ранней биосферы на Земле более 2 миллиардов лет назад [52].В то время биосфера Земли состояла в основном из анаэробных микробных сообществ. Однако сегодня жизнь без кислорода, особенно сложная жизнь без кислорода, немыслима. Связанная с этим энергия и энергетические реакции трудны для биологии, но как только с ними можно справиться, эти пути становятся предпочтительными для эволюции и намного превосходят менее энергичные реакции. Учитывая, что фтор является 13-м наиболее распространенным элементом на Земле, планета земной группы; он может чаще использоваться в биологической схеме другого мира.Конечно, там должны быть планеты и луны, где фтор более распространен и доступен, чем на Земле. Один из возможных сценариев на экзопланете состоит в том, что весь молекулярный кислород может быть израсходован в реакциях окисления на поверхности планеты, а газообразный фтор высвобождается из магмы, богатой фтором, позже в истории этого планетарного тела [9]. Или фтор может быть гораздо более распространен в растворе на планете, где вода не является основным растворителем, что связано с низкой растворимостью фтора в воде. Там фтор может играть ту же роль, что и кислород в жизни на Земле, и может даже привести к эволюции животных подобных организмов, обеспечивающих достаточное количество энергии (или даже больше), чем кислород в аэробном метаболизме. Мы могли бы получить некоторое представление о потенциале фтора из недавних лабораторных работ в области синтетической биологии и ксенобиологии [53]. Например, экспериментальная работа по эволюции микробных клеток может привести к клеткам с протеомом, состоящим из нового химического состава, включая альтернативную физиологию или новый метаболизм [54,55,56]. 5. РезюмеЖизнь на Земле, особенно сложная жизнь, использует кислород для метаболизма и множества других важных биохимических процессов.Таким образом, возможен сценарий, в котором F, который может быть использован для потенциально еще более энергичных реакций, мог бы использоваться биологией. Тот факт, что он не используется жизнью на Земле сколь-либо значительным образом, не обязательно означает, что это невозможно. Скорее всего, отсутствие использования фтора в биохимии Земли связано с плохой доступностью фтора в условиях ранней Земли. Сценарий может быть совершенно другим на другом планетарном теле с расходящейся планетарной историей, возможность, подчеркнутая недавно полученными знаниями при производстве искусственных фторированных биомолекул. Вклад авторовНедилько Будиса написал первый черновой вариант с упором на биохимию фтора и подготовил графический материал. Владимир Кубышкин существенно усовершенствовал первоначальный вариант первого проекта с химической точки зрения и ввел идею о фторированных биологических мембранах. Дирк Шульце-Макух написал первый набросок обитаемой и биологически значимой части рукописи. Все авторы повторяли друг друга в более поздних версиях статьи. Конфликт интересовАвторы заявляют об отсутствии конфликта интересов. Каталожные номера1. Лиде Д.Р. Справочник по химии и физике. КПР Пресс; Бока-Ратон, Флорида, США: 2001. [Google Scholar]2. Голдсмит Д., Оуэн Т. Поиски жизни во Вселенной. университетские научные книги; Саусалито, Калифорния, США: 2003. [Google Scholar]3. Кирк К.Л. Биохимия галогенорганических соединений. Том 9Б. пленум; Нью-Йорк, штат Нью-Йорк, США: 1991. стр. 127–150. [Google Академия]4. О’Хаган Д., Шаффрат К., Кобб С.Л., Гамильтон Дж.Т.Г., Мерфи К.Д. Биохимия: биосинтез фторорганической молекулы. Природа. 2002; 416:279. doi: 10.1038/416279a. [PubMed] [CrossRef] [Google Scholar]5. Гриббл Г.В. Разнообразие встречающихся в природе броморганических соединений. хим. соц. Ред. 1999; 28:335–346. doi: 10.1039/a1d. [Перекрестная ссылка] [Академия Google] 6. Гриббл Г.В. Фторорганические соединения природного происхождения. В: Neilson AH, редактор. Фторорганические соединения. Спрингер-Верлаг; Берлин/Гейдельберг, Германия: 2002 г.стр. 121–136. [Google Академия]7. О’Хаган Д., Рзепа Х.С. Некоторые влияния фтора в биоорганической химии. хим. коммун. 1997: 645–652. [Google Академия]8. Харпер Д.Б., О’Хаган Д. Фторированные натуральные продукты. Нац. Произв. Представитель 1994; 11: 123–133. doi: 10.1039/np9941100123. [PubMed] [CrossRef] [Google Scholar]9. Шульце-Макух Д., Ирвин Л.Н. Жизнь во Вселенной: ожидания и ограничения. 2-е изд. Спрингер-Верлаг; Берлин/Гейдельберг, Германия: 2008 г. [Google Scholar]10. Фирсофф В.А. Жизнь за пределами Земли.Основные книги; Нью-Йорк, штат Нью-Йорк, США: 1963. [Google Scholar]11. Ола Г.А. Пересечение общепринятых границ за полвека исследований. Дж. Орг. хим. 2005;70:2413–2429. doi: 10.1021/jo040285o. [PubMed] [CrossRef] [Google Scholar] 12. Вандерборг Н.Э. Оценка отклика мембранного электрода из фторида лантана в кислых растворах. Таланта. 1968; 15: 1009–1013. doi: 10.1016/0039-9140(68)80108-0. [PubMed] [CrossRef] [Google Scholar] 13. Гейдельбергер К., Чаудхури Н.К., Даннеберг П., Мурен Д., Грисбах Л., Душинский Р., Шнитцер Р.Дж., Плевен Э., Шайнер Дж. Фторированные пиримидины, новый класс соединений, ингибирующих опухоль. Природа. 1957; 179: 663–666. дои: 10.1038/179663a0. [PubMed] [CrossRef] [Google Scholar] 14. Кирк К.Л. Фтор в медицинской химии: недавнее терапевтическое применение фторированных малых молекул. Дж. Флуор. хим. 2006; 127:1013–1029. doi: 10.1016/j.jfluchem.2006.06.007. [Перекрестная ссылка] [Академия Google] 15. Purcer S., Moore P.R., Swallow S., Gouverneur V. Фтор в медицинской химии.хим. соц. 2008; 37:320–330. doi: 10.1039/b610213c. [PubMed] [CrossRef] [Google Scholar] 16. Гунг Б.В., Патель М., Сюэ С. Порог переноса заряда в ароматических взаимодействиях? Количественное исследование взаимодействий π-стекинга. Дж. Орг. хим. 2005; 70:10532–10537. doi: 10.1021/jo051808a. [PubMed] [CrossRef] [Google Scholar] 17. Сейас М.А., Кинни В.А., Чен С., Винтер Дж.Г., Алмонд Х.Р., Балсс К.М., Марьянофф К.А., Шмидт У., Бреаслав М., Махан А., Лейси Э., Марьянофф Б.Е. Тромбогенные пептиды-миметики коллагена: самосборка фибрилл на основе тройной спирали, управляемая гидрофобными взаимодействиями.проц. Натл. акад. науч. США. 2008; 105:8513–8518. doi: 10.1073/pnas.0800291105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]18. Лай Дж.С., Кул Э.Т. Селективное спаривание полифторированных оснований ДНК. Варенье. хим. соц. 2004; 126:3040–3041. doi: 10.1021/ja039571s. [PubMed] [CrossRef] [Google Scholar] 19. Каметти М., Крус Б., Метранголо П., Милани Р., Реснати Г. Эффект флюоризации в биомолекулярных приложениях. хим. соц. 2012; 41:31–42. doi: 10.1039/c1cs15084g. [PubMed] [CrossRef] [Google Scholar] 20.Гладыш Дж. А., Юриш М. Луорус Химия. Том 308. Springer-Verlag; Берлин/Гейдельберг, Германия: 2012. Структурные, физические и химические свойства фтористых соединений; стр. 1–23. Серия Темы современной химии. [PubMed] [Google Scholar] 21. Сантаэлла К., Вирлинг П., Рисс Дж.Г. Высокостабильные липосомы, полученные из перфторалкилированных глицерофосфохолинов. Ангью. хим. Междунар. Эд. 1991; 30: 567–568. doi: 10.1002/anie.199105671. [Перекрестная ссылка] [Академия Google] 22. Сантаэлла К., Вирлинг П., Рисс Дж.Г., Гулик-Кживицкий Т., Гулик А., Монассе Б. Полиморфное фазовое поведение перфторалкилированных фосфатидилхолинов. Биохим. Биофиз. Акта. 1994;1190:25–39. doi: 10.1016/0005-2736(94)-0. [PubMed] [CrossRef] [Google Scholar] 23. Сантаэлла К., Вирлинг П. Молекулярный порядок и подвижность липосомальной мембраны, изготовленной из высокофторированных фосфолипидов. хим. физ. Липиды. 1995; 77: 173–177. [Google Академия] 24. Геге К., Шнайдер М.Ф., Шумахер Г., Лимозин Л., Роте У., Бендас Г., Танака М., Шмидт Р.R. Функциональные микродомены гликолипидов с частично фторированными мембранными якорями: влияние на клеточную адгезию. ХимФизХим. 2004; 5: 216–224. doi: 10.1002/cphc.200300947. [PubMed] [CrossRef] [Google Scholar] 25. Марш Э.Н.Г. Фторированные белки: от дизайна и синтеза до структуры и стабильности. Акк. хим. Рез. 2014 г.: 10.1021/ar500125m. [PubMed] [CrossRef] [Google Scholar] 26. Йодер Н.К., Кумар К. Фторированные аминокислоты в дизайне белков. хим. соц. 2002; 31:335–341. doi: 10.1039/b201097f.[PubMed] [CrossRef] [Google Scholar] 27. Биффингер Дж. К., Ким Х. В., ДиМагно С. Г. Полярная гидрофобность фторированных соединений. ХимБиоХим. 2004; 5: 622–627. doi: 10.1002/cbic.200300910. [PubMed] [CrossRef] [Google Scholar] 28. Будиса Н. Разработка генетического кода — расширение репертуара аминокислот для создания новых белков. Уайли; Вайнхайм, Германия: 2005. [Google Scholar]29. Меркель Л., Будиса Н. Органический фтор как полипептидный строительный элемент: In vivo экспрессия фторированных пептидов, белков и протеомов.Орг. биомол. хим. 2012; 10:7241–7261. doi: 10.1039/c2ob06922a. [PubMed] [CrossRef] [Google Scholar] 30. Доббс А.П., Кимберли М.Р. Химия фтористых фаз: новая промышленная технология. Дж. Флуор. хим. 2002; 118:3–17. doi: 10.1016/S0022-1139(02)00202-6. [Перекрестная ссылка] [Академия Google] 31. Марш Э.Н.Г. К яйцу с антипригарным покрытием: разработка фтористых белков. хим. биол. 2000; 7: Р153–Р157. doi: 10.1016/S1074-5521(00)00139-3. [PubMed] [CrossRef] [Google Scholar] 32. Шульце-Макух Д., Хак С., Антонио М.Р.С., Али Д., Хосейн Р., Сонг Ю.С., Ян Дж., Зайкова Э., Беклес Д.М., Гинан Э., Лехто Х.Дж., Халлам С.Дж. Микробная жизнь в жидкой асфальтовой пустыне. Астробиология. 2011; 11: 241–258. [PubMed] [Google Scholar] 33. Биава Х., Будиса Н. Эволюция фторированных ферментов: новая тенденция стабилизации биокатализаторов. англ. Жизнь наук. 2014; 14:340–351. doi: 10.1002/elsc.201300049. [Перекрестная ссылка] [Академия Google] 34. Реннерт О.М., Анкер Х.С. О включении 5′,5′,5′-трифторлейцина в белки E.палочка . Биохимия. 1963; 2: 471–476. doi: 10.1021/bi00903a013. [PubMed] [CrossRef] [Google Scholar] 35. О’Хаган Д. Понимание химии фторорганических соединений. Введение в связь C – F. хим. соц. 2008; 37:308–319. [PubMed] [Google Scholar] 36. Сальвичек М., Ньякатура Э.К., Герлинг У.И.М., Е С., Кокш Б. Фторированные аминокислоты: совместимость с нативными белковыми структурами и влияние на белок-белковые взаимодействия. хим. соц. 2012; 41:2135–2171. doi: 10.1039/c1cs15241f. [PubMed] [CrossRef] [Google Scholar] 37.Jäckel C., Salwiczek M., Koksch B. Фтор в нативной белковой среде — как пространственное требование и полярность фторалкильных групп влияют на укладку белка. Ангью. хим. Междунар. Эд. 2006;45:4198–4203. [PubMed] [Google Scholar] 38. Пратт Э.А., Хо С. Включение фтортриптофана в белки Escherichia coli . Биохимия. 1975; 14:3035–3040. doi: 10.1021/bi00684a037. [PubMed] [CrossRef] [Google Scholar] 39. Реннер С., Алефельдер С., Бэ Дж. Х., Будиса Н., Хубер Р., Мородер Л. Фторпролины как инструменты для дизайна и инженерии белков.Ангью. хим. Междунар. Эд. 2001;40:923–925. doi: 10.1002/1521-3773(20010302)40:5<923::AID-ANIE923>3.0.CO;2-#. [PubMed] [CrossRef] [Google Scholar]40. Китевски-ЛеБлан Дж.Л., Проссер Р.С. Текущие применения 19 F ЯМР для изучения структуры и динамики белков. прог. Нук. Маг. Рез. 2012; 62:1–33. [PubMed] [Google Scholar]41. Буэр Б.К., Левин Б.Дж., Марш Э.Н.Г. Влияние фторирования на термодинамику фолдинга белков. Варенье. хим. соц. 2012; 134:13027–13034. doi: 10.1021/ja303521h.[PubMed] [CrossRef] [Google Scholar]42. Дьюэл Х.С., Дауб Э., Робинсон В., Хонек Дж.Ф. Выяснение воздействия растворителя, реактивности боковой цепи и стерических требований остатка трифторметионина в рекомбинантном белке. Биохимия. 2001;40:13167–13176. doi: 10.1021/bi011381b. [PubMed] [CrossRef] [Google Scholar]44. Ли К.-Х., Ли Х.-Ю., Слуцкий М.М., Андерсон Дж.Т., Марш Э.Н.Г. Эффект фтора в белках: дизайн de novo и характеристика белка пучка из четырех α-спиралей, содержащего гексафторлейцин.Биохимия. 2004;43:16277–16284. doi: 10.1021/bi049086p. [PubMed] [CrossRef] [Google Scholar]45. Билгичер Б., Фичера А., Кумар К. Спиральная катушка с фтористым сердечником. Варенье. хим. соц. 2001; 123:4393–4399. [PubMed] [Google Scholar]46. Буэр Б.К., Мигер Дж.Л., Стаки Дж.А., Марш Э.Н.Г. Структурная основа повышенной стабильности высокофторированных белков. проц. Натл. акад. науч. США. 2012;109:4810–4815. doi: 10.1073/pnas.1120112109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]47.Будиса Н. Пролегомена к будущим усилиям по инженерии генетического кода за счет расширения репертуара аминокислот. Ангью. хим. Междунар. Эд. 2004;43:6426–6463. doi: 10.1002/anie.200300646. [PubMed] [CrossRef] [Google Scholar]48. Джонсон Дж.А., Лу Ю.Ю., ван Девентер Дж.А., Тиррелл Д.А. Остаточно-специфическое включение неканонических аминокислот в белки: последние разработки и приложения. Курс. мнение хим. биол. 2010; 14:774–780. doi: 10.1016/j.cbpa.2010.09.013. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]49.Будиса Н., Пипитоне О., Сиванович И., Рубини М., Пал П.П., Холак Т.А., Гельми М.Л. Усилия по созданию «тефлоновых» белков: трансляция in vivo с трифторированными аналогами лейцина и метионина. хим. Биодайверы. 2004; 1:1465–1475. doi: 10.1002/cbdv.2004 | . [PubMed] [CrossRef] [Google Scholar]50. Шульце-Макух Д., Ирвин Л.Н. Экзотические формы жизни во Вселенной. Натурвиссеншафтен. 2006; 93: 155–172. [PubMed] [Google Scholar]51. Вонг Дж.Т.Ф. Эволюция генетического кода. микробиол.науч. 1988; 5: 174–181. [PubMed] [Google Scholar]52. Кастинг Дж. Ф., Зиферт Дж. Л. Жизнь и эволюция атмосферы Земли. Наука. 2002; 296:1066–1068. doi: 10.1126/science.1071184. [PubMed] [CrossRef] [Google Scholar]53. Будиса Н. Ксенобиология, новые для природы синтетические клетки и генетический брандмауэр. Курс. Орг. хим. 2014;18:936–943. doi: 10.2174/138527281808140616154301. [CrossRef] [Google Scholar]54. Марльер П. Чем дальше, тем безопаснее: манифест для надежной навигации синтетических видов от старого живого мира.Сист. Синтез. биол. 2009; 3:77–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]55. Марльер П., Патруи Дж., Деринг В., Хердевейн П., Трико С., Крувелье С., Бузон М., Мутцель Р. Химическая эволюция бактериального генома. Ангью. хим. Междунар. Эд. 2011;50:7109–7114. [PubMed] [Google Scholar]56. Асеведо-Роча К.Г., Будиса Н. На пути к химически модифицированным организмам, наделенным генетическим брандмауэром. Ангью. хим. Междунар. Эд. 2011;50:6960–6962. [PubMed] [Google Scholar]||||||
Глядя на график, десять самых распространенных элементов на Земле с точки зрения количества атомов и в порядке убывания:
- Кислород
- Кремний
- Алюминий
- Натрий
- Водород
- Калий
- Кальций
- Железо
- Титан
- Фтор
Обратите внимание, что только три из них являются газами.Причина, по которой Земля состоит в основном из металлов, заключается в ее близости к Солнцу. Солнечный ветер вытолкнул большую часть газов во внешние пределы Солнечной системы. Относительно высокие температуры из-за близости к солнцу заставили эти элементы сконденсироваться в небольшие комки массы, которые в конечном итоге сформировали землю.
Итак, каково общее количество элементов, которые естественным образом существуют во Вселенной? Ответ 98. Остальные элементы производятся синтетическим путем в ядерных реакторах.Возможно, когда-нибудь эти элементы будут обнаружены в природе, но это еще предстоит выяснить.
Краткое содержание урока
Звезды ответственны за образование 98 элементов периодической таблицы. Самые большие звезды могут производить все элементы от гелия до железа. Остальные элементы образуются в результате взрывов сверхновых (коллапс, который запускает нейтроны в уже существующие атомы, создавая новые и более тяжелые элементы) и в результате радиоактивного распада.


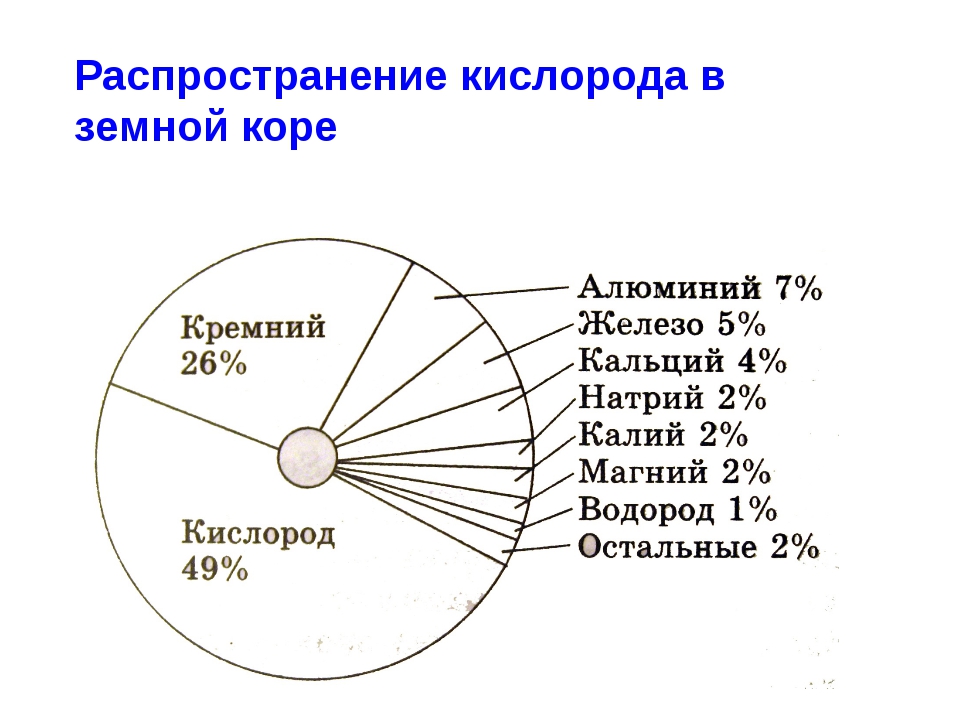 Кремний хрупок, только при нагревании выше 800 C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению.
Кремний хрупок, только при нагревании выше 800 C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению. Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях. Соединения металлов с кремнием силициды, являются широкоупотребляемыми в промышленности (например электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.) , а также силициды ряда элементов являются важными термоэлектрическими материалами. Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент).
Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях. Соединения металлов с кремнием силициды, являются широкоупотребляемыми в промышленности (например электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.) , а также силициды ряда элементов являются важными термоэлектрическими материалами. Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент). (Серебро)
(Серебро) (Литий)
(Литий)
 (Парацельс)
(Парацельс) )
)
 Берцелиус)
Берцелиус) Он самый тяжелый металл на Земле? (осмий).
Он самый тяжелый металл на Земле? (осмий).


 Заливают водой содержимое стакана. Через некоторое время начинается реакция, появляется пар и кипение жидкости в стакане. Яйца свариваются вкрутую).
Заливают водой содержимое стакана. Через некоторое время начинается реакция, появляется пар и кипение жидкости в стакане. Яйца свариваются вкрутую). д.)
д.) И. Менделеев очень любил своих детей. А сколько их было? (шесть)
И. Менделеев очень любил своих детей. А сколько их было? (шесть)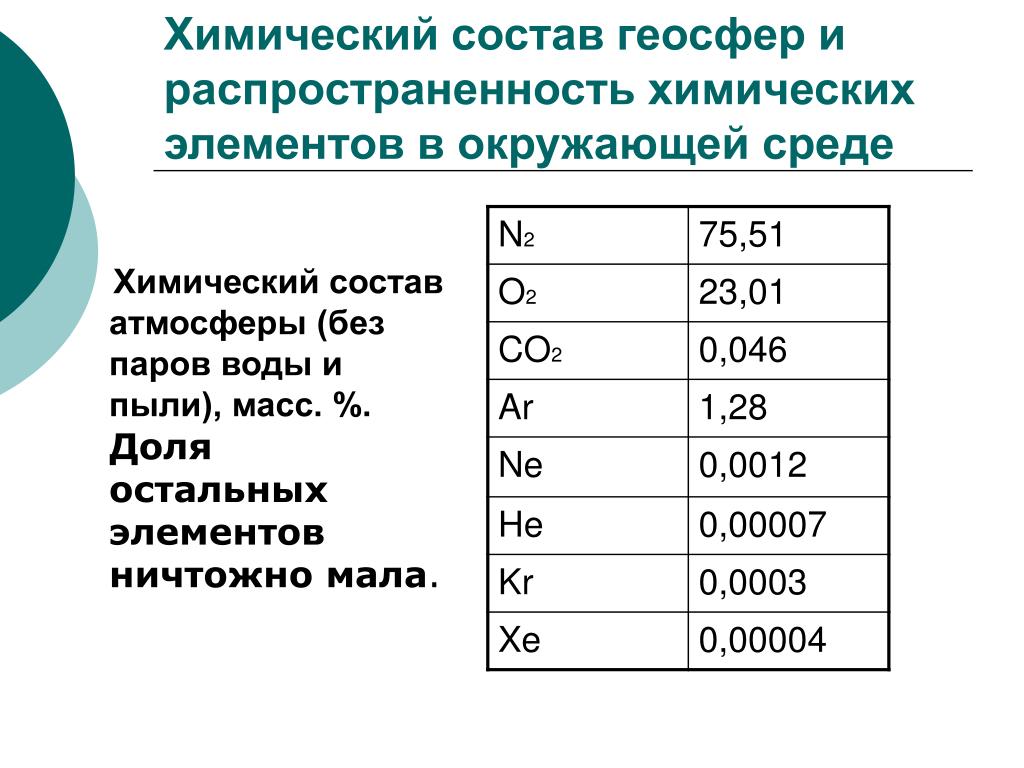 Финалистами стали Собор Василия Блаженного в Москве, Статуя Родина — мать на Мамаевом кургане в Волгограде, Долина гейзеров на Камчатке, вулкан Эльбрус на Кавказе, Петергоф, Столбы выветривания в Коми и, конечно же, великое озеро Байкал. Байкал заставляет нас восхищаться своей красотой и не перестает удивлять тайнами и загадками. Так, например, известно, что Байкал питают свыше 300 рек и речушек, которые ежегодно приносят в него более 6 000 тонн соединений кремния. А вытекает только одна красавица Ангара, забирая всего 1000 тонн силикатов. Несмотря на это, содержание кремния в водах Байкала остается неизменным на протяжении многих сотен лет. Попробуйте объяснить этот факт, установив неизвестное звено в круговороте кремния.
Финалистами стали Собор Василия Блаженного в Москве, Статуя Родина — мать на Мамаевом кургане в Волгограде, Долина гейзеров на Камчатке, вулкан Эльбрус на Кавказе, Петергоф, Столбы выветривания в Коми и, конечно же, великое озеро Байкал. Байкал заставляет нас восхищаться своей красотой и не перестает удивлять тайнами и загадками. Так, например, известно, что Байкал питают свыше 300 рек и речушек, которые ежегодно приносят в него более 6 000 тонн соединений кремния. А вытекает только одна красавица Ангара, забирая всего 1000 тонн силикатов. Несмотря на это, содержание кремния в водах Байкала остается неизменным на протяжении многих сотен лет. Попробуйте объяснить этот факт, установив неизвестное звено в круговороте кремния.