Прионовые болезни
Прионовые болезни
Прионовые болезни – это прогрессирующие нейродегенеративные заболевания с летальным исходом. Механизм возникновения прионовых болезней изучен не до конца, однако в настоящее время считается, что заболевание развивается при накоплении в клетках центральной нервной системы избыточного количества патологического прионного белка.
Прионовые болезни встречаются очень редко – ежегодно регистрируется один случай на миллион человек. На данный момент известны 5 разновидностей этой патологии – спорадическая болезнь Крейцфельда-Якоба, новый вариант болезни Крейцфельда-Якоба, куру, синдром Герстманна-Штройслера-Шейнкера и фатальная семейная инсомния. Наиболее широко распространена спорадическая болезнь Крейцфельда-Якоба.
Болезнь может возникать попадании в организм патологического прионного белка извне (от человека или животного), иметь наследственную природу или возникать спонтанно как следствие генетических аномалий de novo.
Синонимы русские
Трансмиссивная губчатая энцефалопатия.
Синонимы английские
Human prion diseases, transmissible spongiform encephalopathies, TSE.
Симптомы
Симптомыпатологии могут возникнуть в период от полугода до 10-15 лет после заражения. Проявления болезни могут развиваться постепенно, с неспецифических симптомов – бессонницы, вялости, апатии, заторможенности. В ряде случаев болезнь начинается внезапно и может напоминать делирий. Наиболее частыми проявлениями прионовых болезней являются:
- Прогрессирующая деменция
- Нарушение зрения
- Нарушение координации
- Нарушение речи
- Тремор
- Ригидность мышц
- Миоклонии
- Депрессия
- Тревожность
- Эмоциональная лабильность
Все проявления прионных болезней неуклонно прогрессирую, приводя в конечных стадиях болезни к акинетическому мутизму и коме.
Общая информация о заболевании
Прионные болезни встречаются как у человека, так и среди животных. Патогенез прионных болезней связывают с накоплением в организме патологического прионного белка. Прионный белок в норме присутствует в клетках организма животных и человека – это так называемый нормальный прионный белок. Он находится в наибольших количествах в нейронах и частично в клетках лимфоидной ткани. Прионный белок устойчив к высоким температурам, радиации, действию протеаз и химических веществ – алкоголя, формалина и других. Функции прионных белков неизвестны. Информация о структуре этих полипептидов закодирована в коротком плече 20 хромосомы у человека.
При изменении конфигурации нормальный прионный белок может превращаться в патологический. Патологический прионный белок, в свою очередь, способен запускать механизм преобразования нормального прионного белка в патологическую форму. Патологический прионный белок может возникать в организме спонтанно. В некоторых случаях накопление патологического прионного белка связано с наследственными генетическими нарушениями. На данный момент известно порядка 30 вариантов генетических нарушений, в результате которых меняется структура прионного белка. В ряде случае прионные болезни носят инфекционную природу. Это означает, что патологический прионный белок может попасть в организм человека извне – при пересадке роговицы, твердой мозговой оболочки, нейрохирургических операциях. В данном случае большое значение имеет устойчивость прионов к любым видам стерилизации. Известны случаи заражения патологоанатомов. Считается, что существует вероятность заражения человека при употреблении мяса коров, зараженных коровьим бешенством.
В некоторых случаях накопление патологического прионного белка связано с наследственными генетическими нарушениями. На данный момент известно порядка 30 вариантов генетических нарушений, в результате которых меняется структура прионного белка. В ряде случае прионные болезни носят инфекционную природу. Это означает, что патологический прионный белок может попасть в организм человека извне – при пересадке роговицы, твердой мозговой оболочки, нейрохирургических операциях. В данном случае большое значение имеет устойчивость прионов к любым видам стерилизации. Известны случаи заражения патологоанатомов. Считается, что существует вероятность заражения человека при употреблении мяса коров, зараженных коровьим бешенством.
Несмотря на то, что часть прионных заболеваний имеет инфекционную природу, прионы отличаются от других инфекционных агентов – в их составе отсутствуют нуклеиновые кислоты (ДНК или РНК). Это осложняет процесс изучения патогенеза прионовых болезней. Известно, что накопление патологического прионового белка приводит к разрушению клеток нервной системы, мультифокальным спонгиоформным (губкоподобным) повреждениям тканей нервной системы, астроглиозу при отсутствии признаков воспалительной реакции.
Кто в группе риска?
- Люди определенных профессий (медицинские работники, ветеринары, работники скотобоен, зоологи)
- Люди, перенесшие хирургические вмешательства, в том числе гемотрансфузии
- Люди, среди родственников которых были выявлены случаи наследственных прионных болезней
- Люди, употребляющие плохо термически обработанное мясо
Диагностика
К сожалению, на данный момент диагностика прионных болезней возможна лишь после возникновения клинических проявлений, то есть на этапе, когда болезнь зашла уже достаточно далеко. Раннее, пресимптоматическое выявление данной патологии невозможно. Схема диагностики прионных болезней не разработана окончательно.
Лабораторная диагностика:
- Исследование состава спинномозговой жидкости.

- Выявление в крови патологического прионного белка методом вестерн-блоттинга.
- Исследование аутопсийного материала. Позволяет выявить признаки характерных атрофических изменений в тканях нервной системы пациента.
- Генетические исследования. Позволяют выявить аномалии в структуре генов, кодирующих прионные белки.
Инструментальная диагностика:
- Электроэнцефалография (ЭЭГ). Признаки патологических изменений в структуре головного выявляются на ЭЭГ приблизительно у половины пациентов с прионными болезнями.
- Магнитно-резонансная и компьютерная томография (МРТ и КТ). Позволяют выявить признаки атрофии коры головного мозга, расширения ликворопроводящей системы.
Лечение
Лечениетолько симптоматическое.
Профилактика
- Использование стерильных и, в определенных случаях, одноразовых хирургических инструментов, индивидуальных средств защиты
- Контроль качества мясных продуктов
Рекомендуемые анализы
что это такое, какие болезни вызывают
Инфекционные болезни могут развиваться не только из-за бактерий, вирусов и других хорошо известных врачам микроорганизмов - это ошеломляющее заявление в медицинской среде было сделано после того, как в 1982 году профессор неврологии и биохимии Стэнли Прузинер (США) обнаружил белковые соединения, способные вызывать заболевания.
Прионы: биологическая сущность, свойства, среда обитания таинственных молекул
До недавнего времени исследователи считали, что в составе любой «живой» субстанции должны быть молекулы ДНК или РНК — нуклеиновых кислот, обусловливающих способность вирусов, бактерий, грибов и прочих организмов размножаться. Однако открытие прионов полностью трансформировало это представление. Устойчивость к высоким температурам, к различным видам излучений, действию нуклеаз (ферментов, способных расщеплять нуклеиновые кислоты), отсутствие роста на питательных средах – такими необычными свойствами обладал ранее не известный возбудитель.
Белковые соединения с определённой конфигурацией, способные трансформироваться в патогенные и вызывать нейродегенеративные процессы в организме, были названы прионами. Термин «прион» (prion) предложил Стэнли Прузинер.
Молекула приона в «нормальной» форме имеется на поверхности нервных клеток у каждого человека. Обычные молекулы белка, вступая в контакт с патологическими, сами превращаются в них, изменяя при этом собственную пространственную структуру. Что является пусковым механизмом подобной трансформации, до конца не известно. Из этого следует, что прион, выступая в роли инфекционного агента, заражает нормальные молекулы, вызывая «молекулярную эпидемию».
Токсичные белковые бляшки на клетке приводят к её гибели, а на месте погибшей клетки образуется пустота, которая заполняется жидкостью. Количество пустот в головном мозге с течением времени будет увеличиваться, пока он не превратится в «губку».
Как можно заразиться прионами?
На сегодняшний день выделяют следующие основные пути заражения инфекционным белком-прионом:
1. Трансмиссивный. В этом случае молекулы белка передаются от одного вида млекопитающего к другому — например, от инфицированной коровы или овцы человеку. Заражение происходит при употреблении в пищу мяса или молока заражённого животного, либо использовании его тканей (роговицы, препаратов крови и т.п.), применении во время оперативных вмешательств биологического шовного материала.
2. Наследственный. Заболевание развивается на фоне генетической мутации, затрагивающей область 20-й хромосомы. Несмотря на слабую изученность функционирования этого участка генома, достоверно известно его участие в синтезе нормального прионного белка. В случае генных мутаций вместо здорового приона образуется патологический, а это приводит к развитию болезней.
3. Спорадический. При этом аномальный белок появляется в организме спонтанно, без видимых причин.
Вне зависимости от способа появления аномальный белок может стать причиной заражения других людей.
Прионные заболевания: особенности течения, лечения, прогноз
Отличительной особенностью болезней, вызываемых прионами, является длительный инкубационный период - от 2-3 месяцев до нескольких десятилетий. Подавляющее большинство прионных заболеваний человека являются спорадическими и имеют семейный характер наследования.
Куру, синдром Герстманна-Штреусслера-Шейнкера, болезнь Крейтцфельдта-Якоба, скрэпи – прионы вызывают заболевания, сопровождаемые поражением центральной нервной системы. Для них характерны такие признаки как деменция (слабоумие), зрительные и мозжечковые нарушения. При этом у больного могут отмечаться двигательные расстройства, бессонница, галлюцинации, нарушение речи.
К сожалению, эффективных методов лечения прионных болезней на сегодняшний день нет, хотя учёные пытаются предотвращать переход нормального белка в аномальный. Пациентам назначается симптоматическая терапия с использованием противосудорожных средств для облегчения страданий. Прогноз пока неутешителен, так как все вышеперечисленные заболевания завершаются летальным исходом.
Пациентам назначается симптоматическая терапия с использованием противосудорожных средств для облегчения страданий. Прогноз пока неутешителен, так как все вышеперечисленные заболевания завершаются летальным исходом.
Перспективы
Недостаточная изученность проблемы прионов и прионных болезней способствует углублению исследований в этой области — учёные занимаются активным поиском средств борьбы с патогенными белками. Актуальность этого вопроса растёт в связи с возможностью возникновения «прионной эпидемии», например, из-за приёма лекарственных средств животного происхождения.
Раскрытие загадочных явлений, которыми окутаны прионы, возможно, поможет в понимании ряда серьёзных биомедицинских проблем человечества.
Севиля Ибраимова
Редакция рекомендует:
Не антибиотиком единым: «киллеры» бактерий – бактериофаги
Риск на грани. Как открыли хеликобактер пилори?
Заразные прионы оказались нетоксичными для нервных клеток
Очищенные инфекционные прионные белки, собранные в палочковидные структуры
Cassandra Terry
Прионы-передатчики нейродегенеративных заболеваний, и прионы, которые повреждают нейроны, — это разные молекулы, сообщается в Proceedings of the National Academy of Sciences. Это выяснилось в ходе экспериментов, в которых к питательной среде культур нервных клеток добавляли либо экстракт очищенных прионов (переносчики инфекций), либо гомогенизированную ткань мозга животных, демонстрировавших симптомы прионных заболеваний, в том числе нейродегенерацию. В первом случае клетки в культурах оставались нетронутыми, во втором повреждались.
Это выяснилось в ходе экспериментов, в которых к питательной среде культур нервных клеток добавляли либо экстракт очищенных прионов (переносчики инфекций), либо гомогенизированную ткань мозга животных, демонстрировавших симптомы прионных заболеваний, в том числе нейродегенерацию. В первом случае клетки в культурах оставались нетронутыми, во втором повреждались.
Прионы — это белковые инфекционные агенты, а от прочих протеинов они отличаются способностью принимать очень устойчивые конформации и «заражать» ими соседние молекулы такого же состава. В результате белки особой, патологической конформации образуют скопления и деформируют клетки, в которых находятся. Особенно часто это происходит в нервных клетках, и многие прионные болезни поражают мозг. Повреждения получаются очень сильными и необратимыми, и больной, как правило, погибает. Лечения прионных заболеваний пока не существует.
Прионные заболевания могут быть наследственными, если имеются мутации в генах соответствующих белков. Кроме того, ими можно заразиться, если съесть мозг или мясо инфицированных особей (термическая обработка и многие пищеварительные ферменты, как правило, не разрушают прионные скопления) или вступить в контакт с жидкостями их тела. Однако на молекулярном уровне детали заражения прионными инфекциями еще неясны.
Кроме того, ими можно заразиться, если съесть мозг или мясо инфицированных особей (термическая обработка и многие пищеварительные ферменты, как правило, не разрушают прионные скопления) или вступить в контакт с жидкостями их тела. Однако на молекулярном уровне детали заражения прионными инфекциями еще неясны.
Исследователи из Университетского колледжа в Лондоне во главе с Джоном Коллинджем (John Collinge) проверили, как действуют на первичные культуры нейронов (то есть «готовые» нервные клетки, изъятые непосредственно из организма животного) новой коры больших полушарий и гиппокампа мышей различные прионы.
К питательной среде, в которой находились одни культуры, исследователи на 72 часа добавляли в разных концентрациях очищенные палочковидные скопления молекул прионного белка, кодируемого геном Prnp, выделенные из мозга мышей с симптомами прионного нейродегенеративного заболевания (от 107,7 до 108,1инфекционных единиц на миллилитр). В других случаях вместо очищенных белков использовали гомогенизированную ткань мозга больных мышей, в ней содержалось от 104,2 до 105,7 инфекционных единиц прионов на миллилитр. Наконец, в часть культур ввели гомогенаты мозга здоровых животных, куда предварительно добавили очищенные «заразные» прионные белки. Для контроля использовали белки со «здоровой» конформацией, не способные инфицировать клетки.
Наконец, в часть культур ввели гомогенаты мозга здоровых животных, куда предварительно добавили очищенные «заразные» прионные белки. Для контроля использовали белки со «здоровой» конформацией, не способные инфицировать клетки.
За состоянием нейронов в культуре — количеством, длиной и степенью ветвления их отростков, а также тем, живы ли они, наблюдали с помощью флуоресцентной микроскопии: подбирали к молекулам, характерным для разных регионов и функциональных состояний нервной клетки, антитела, связанные с флуоресцентными белками, дающими свечение разных цветов, и смотрели, где и с какой интенсивностью оно проявится.
Состояние нейронов в культуре в различные дни после добавления очищенных прионов или гомогенизатов мозга больных животных. На графиках указаны длины отростков в зависимости от того, чем и в какой концентрации обрабатывали культуры.
Iryna Benilova et al. / Proceedings of the National Academy of Sciences, 2020
/ Proceedings of the National Academy of Sciences, 2020
Из этих данных исследователи сделали вывод, что у прионов функция заражения клеток и токсическое действие на эти клетки не связаны жестко друг с другом. Вероятно, они обеспечиваются различными типами молекул и (или) формами их скоплений. Видимо, прионы, образующие палочковидные скопления, нетоксичны для нейронов, а белки в составе скоплений какой-то другой формы, напротив, им вредят. Известно, что плохо очищенные прионы повреждают нервные клетки, но в предыдущих исследованиях не уточнялось, какой формы должны быть их группы, чтобы быть токсичными. Это и непросто установить: в таких смесях встречаются прионные скопления самых разных форм и размеров. Новые исследования должны быть направлены на то, чтобы все-таки это проверить.
Видимо, прионы, образующие палочковидные скопления, нетоксичны для нейронов, а белки в составе скоплений какой-то другой формы, напротив, им вредят. Известно, что плохо очищенные прионы повреждают нервные клетки, но в предыдущих исследованиях не уточнялось, какой формы должны быть их группы, чтобы быть токсичными. Это и непросто установить: в таких смесях встречаются прионные скопления самых разных форм и размеров. Новые исследования должны быть направлены на то, чтобы все-таки это проверить.
Не вызывающие заболеваний прионы уже находили. В 2016 году итальянские ученые выделили из мозга овец, больных почесухой (скрейпи), молекулы PrPSc, размножили их, «адаптировали» под строение прионов у восприимчивых к скрейпи рыжих полевок (Myodes glareolus) и попробовали этими веществами инфицировать грызунов. Одна из разновидностей PrPSc овец по какой-то причине не могла спровоцировать у полевок почесуху — вероятно, из-за особенностей структуры молекулы.
Светлана Ястребова
Прижизненная диагностика прионных болезней | Кальнов
1. Gambetti P., Russo C. Human brain amyloidosis. Nephrol. Dial. Transplant. 1998; 13(Suppl. 7): 33–40. https://doi.org/10.1093/ndt/13.suppl_7.33.
Gambetti P., Russo C. Human brain amyloidosis. Nephrol. Dial. Transplant. 1998; 13(Suppl. 7): 33–40. https://doi.org/10.1093/ndt/13.suppl_7.33.
2. Lachmann H.J., Hawkins P.N. Systemic amyloidosis. Curr. Opin. Pharm. 2006; 6(2): 214–20. https://doi.org/10.1016/j.coph.2005.10.005.
3. McKinley M.P., Prusiner S.B. Ultrastructural Studies of Prions. In: Chesebro B.W., ed. Transmissible Spongiform Encephalopathies: Current Topics in Microbiology and Immunology. Berlin, Heidelberg: Springer; 1991. https://doi.org/10.1007/978-3-642-76540-7_5.
4. Prusiner S.B. Novel proteinaceous infection particles cause scrapie. Science. 1982; 216(4542): 136–44. https://doi.org/10.1126/science.6801762.
5. Laurent M. Autocatalytic processes in cooperative mechanisms of prion diseases. FEBS Lett. 1997; 407(1): 1–6. https://doi.org/10.1016/s0014-5793(97)00310-4.
Laurent M. Autocatalytic processes in cooperative mechanisms of prion diseases. FEBS Lett. 1997; 407(1): 1–6. https://doi.org/10.1016/s0014-5793(97)00310-4.
6. Bieschke J., Weber P., Sarafoff N., Beekes M., Giese A., Kretzschmar H. Autocatalytic self-propagation of misfolded prion protein. Proc. Natl. Acad. Sci. USA. 2004; 101(33): 12207–11. https://doi.org/10.1073/pnas.0404650101.
7. Harris D.A. Cellular biology of prion diseases. Clin. Microbiol. Rev. 1999; 12(3): 429–44.
8. Hegde R.S., Mastrianni J.A., Scott M.R., DeFea K.A., Tremblay P., Torchia M., et al. A transmembrane form of the prion protein in neurodegenerative disease. Science. 1998; 279(5352): 827–34. https://doi.org/10.1126/science.279.5352.827.
9. Mead S. Prion disease genetics. Eur. J. Hum. Genet. 2006; 14(3): 273–81. https://doi.org/10.1038/sj.ejhg.5201544.
Mead S. Prion disease genetics. Eur. J. Hum. Genet. 2006; 14(3): 273–81. https://doi.org/10.1038/sj.ejhg.5201544.
10. Bessen R.A., Kocisko D.A., Raymond G.J., Nandan S., Lansbury P.T., Caughey B. Non-genetic propagation of strain-specific properties of scrapie prion protein. Nature. 1995; 375(6533): 698–700. https://doi.org/10.1038/375698a0.
11. Collinge J., Clarke A.R. A general model of prion strains and their pathogenicity. Science. 2007; 318(5852): 930–6. https://doi.org/10.1126/science.1138718.
12. Prusiner S.B. Prions. Proc. Natl. Acad. Sci. USA. 1998; 95(23): 13363–83. https://doi.org/10.1073/pnas.95.23.13363.
13. Baskakov I. V., Breydo L. Converting the prion protein: what makes the protein infectious. Biochim. Biophys. Acta. 2007; 1772(6): 692–703. https://doi.org/10.1016/j.bbadis.2006.07.007.
V., Breydo L. Converting the prion protein: what makes the protein infectious. Biochim. Biophys. Acta. 2007; 1772(6): 692–703. https://doi.org/10.1016/j.bbadis.2006.07.007.
14. Benestad S.L., Telling G.C. Chronic wasting disease: an evolving prion disease of cervids. Handb. Clin. Neurol. 2018; 153: 135–51. https://doi.org/10.1016/B978-0-444-63945-5.00008-8.
15. Sakudo A. Chronic wasting disease: current assessment of transmissibility. Curr. Issues Mol. Biol. 2020; 36: 13–22. https://doi.org/10.21775/cimb.036.013.
16. Зуев В.А., Завалишин И.А., Ройхель В.М. Прионные болезни человека и животных. Руководство для врачей. М.: Медицина; 1999.
17. Зуев В.А. Медленные инфекции человека и животных. Вопросы вирусологии. 2014; 59(5): 5–12.
Зуев В.А. Медленные инфекции человека и животных. Вопросы вирусологии. 2014; 59(5): 5–12.
18. Надточей Г.А., Шубин В.А., Юров К.П., Коромыслов Г.Ф. Экспериментальные прионные инфекции у животных. Труды Всероссийского НИИ экспериментальной ветеринарии им. Я.Р. Коваленко. 1999; 72: 299–305.
19. Рыбаков С.С. Скрепи и другие прионные болезни животных и человека. Владимир: Фолиант; 2003.
20. Рыбаков С.С. Губкообразная энцефалопатия крупного рогато- го скота. Владимир: Фолиант; 2007.
21. Надточей Г.А. Прионные инфекции: диагностика, профилактика и меры борьбы. Бюллетень Всесоюзного ордена Ленина научно-исследовательского института экспериментальной ветеринарии им.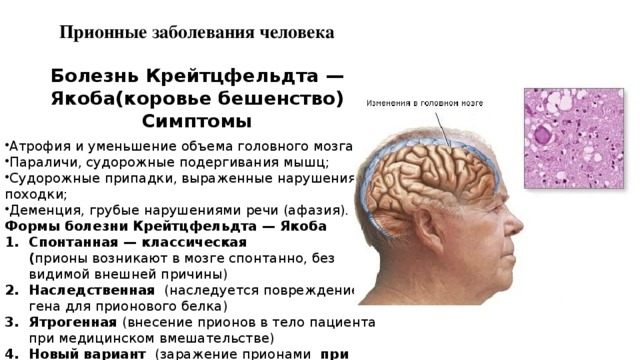 Я.Р. Коваленко. 1996; 77: 5–10.
Я.Р. Коваленко. 1996; 77: 5–10.
22. Суворов В.С., Шубин В.А., Надточей Г.А., Юров К.П., Санджаев Д.Д. Патоморфологическая дифференциация прионных инфекций: скрепи овец и губкообразная энцефалопатия крупного рогатого скота. Труды Всероссийского НИИ экспериментальной ветеринарии им. Я.Р. Коваленко. 2003; 73: 60–3.
23. Кальнов С.Л., Григорьев В.Б., Алексеев К.П., Власова А.Н., Гибадулин Р.А., Покидышев А.Н. и др. Получение и характеристика полноразмерного рекомбинантного PrPc белка крупного рогатого скота. Бюллетень экспериментальной биологии и медицины. 2006; 141(1): 68–71.
24. Grigorjev V.B., Kal’nov S.L., Pokidyshev A.N., Tsibezov V.V., Balandina M.V., Gibadulin R.A., et al. Fibrillization of recombinant bovine prion protein (rec-PrP) in vitro.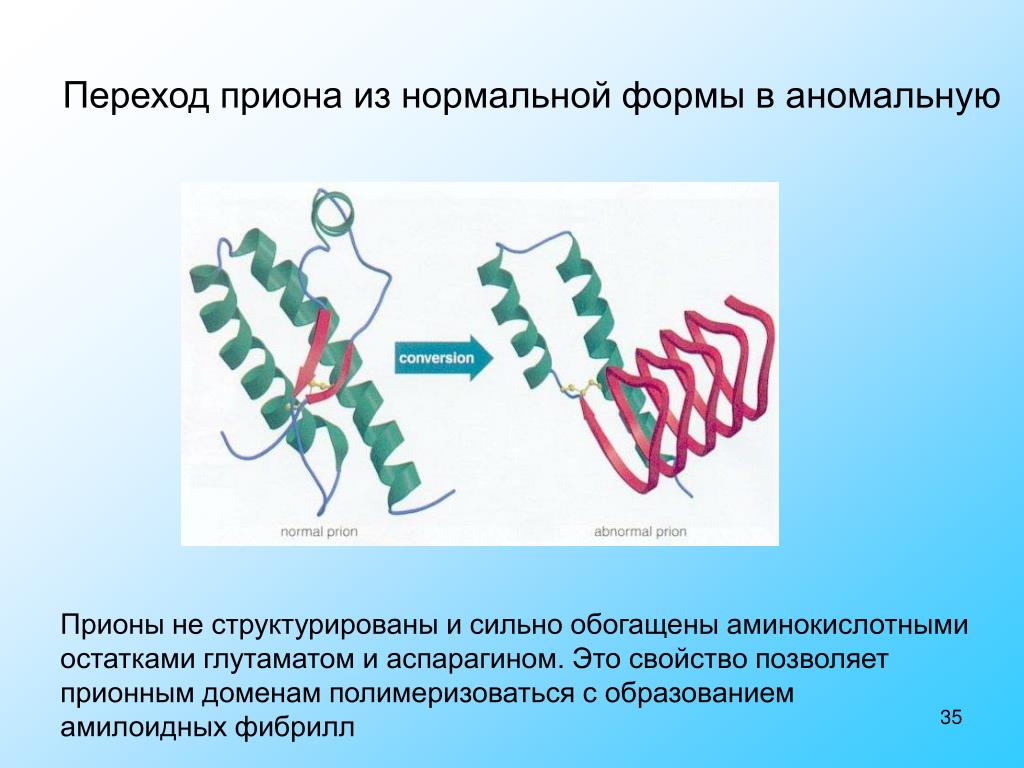 Dokl. Biochem. Biophys. 2008; 420: 112–4. https://doi.org/10.1134/S1607672908030046.
Dokl. Biochem. Biophys. 2008; 420: 112–4. https://doi.org/10.1134/S1607672908030046.
25. Кальнов С.Л., Верховский О.А., Алипер Т.И. Прионные болезни животных. В кн.: Львов Д.К., ред. Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных. М.: МИА; 2013: 910–21.
26. Покидышев А.Н. Характеристика рекомбинантного прионного белка крупного рогатого скота (Bos taurus) и разработка методов выявления патологической изоформы прионов: Дис. … канд. биол. наук. М.; 2009.
27. Григорьев В.Б., Покидышев А.Н., Кальнов С.Л., Клименко С.М. Методы диагностики прионных заболеваний. Вопросы вирусологии. 2009; 54(5): 4–9.
28. O’Rourke K.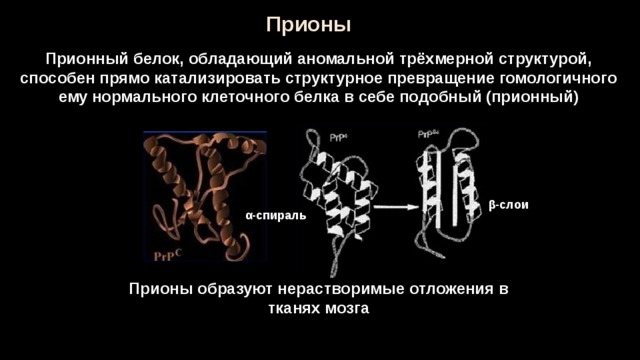 I., Baszler T.V., Parish S.M., Knowles D.P. Preclinical detection of PrPSc in nictitating membrane lymphoid tissue of sheep. Vet. Rec. 1998; 142(18): 489–91. https://doi.org/10.1136/vr.142.18.489.
I., Baszler T.V., Parish S.M., Knowles D.P. Preclinical detection of PrPSc in nictitating membrane lymphoid tissue of sheep. Vet. Rec. 1998; 142(18): 489–91. https://doi.org/10.1136/vr.142.18.489.
29. O’Rourke K.I., Baszler T.V., Besser T.E., Miller J.M., Cutlip R.C., Wells G.A., et al. Preclinical diagnosis of scrapie by immunohistochemistry of third eyelid lymphoid tissue. J. Clin. Microbiol. 2000; 38(9): 3254–9. https://doi.org/10.1128/JCM.38.9.3254-3259.2000.
30. Spraker T.R., VerCauteren K.C., Gidlewski T., Schneider D.A., Munger R., Balachandran A., et al. Antemortem detection of PrPCWD in pre-clinical, ranch-raised Rocky Mountain Elk (Cervus elaphus nelsoni) by biopsy of the rectal mucosa. J. Vet. Diagn. Invest. 2009; 21(1): 15–24. https://doi.org/10.1177/104063870902100103.
31. Andréoletti O., Berthon P., Marc D., Sarradin P., Grosclaude J., van Keulen L., et al. Early accumulation of PrPsc in gut-associated lymphoid and nervous tissues of susceptible sheep from a Romanov flock with natural scrapie. J. Gen. Virol. 2000; 81(12): 3115–26. https://doi.org/10.1099/0022-1317-81-12-3115.
Andréoletti O., Berthon P., Marc D., Sarradin P., Grosclaude J., van Keulen L., et al. Early accumulation of PrPsc in gut-associated lymphoid and nervous tissues of susceptible sheep from a Romanov flock with natural scrapie. J. Gen. Virol. 2000; 81(12): 3115–26. https://doi.org/10.1099/0022-1317-81-12-3115.
32. Hilton D.A., Ghani A.C., Conyers L., Edwards P., McCardle L., Ritchie D., et al. Accumulation of prion protein in tonsil and appendix: review of tissue samples. Brit. Med. J. 2002; 325(7365): 633–4. https://doi.org/10.1136/bmj.325.7365.633.
33. Saborio G.P., Permanne B., Soto C. Sensitive detection of pathological prion protein by cyclic amplification of protein misfolding. Nature. 2001; 411(6839): 810–3. https://doi.org/10.1038/35081095.
34. Saa P., Castilla J., Soto C. Presymptomatic detection of prions in blood. Science. 2006; 313(5783): 92–4. https://doi.org/10.1126/science.1129051.
Saa P., Castilla J., Soto C. Presymptomatic detection of prions in blood. Science. 2006; 313(5783): 92–4. https://doi.org/10.1126/science.1129051.
35. Atarashi R., Wilham J.M., Christensen L., Hughson A.G., Moore R.A., Johnson L.M., et al. Simplified ultrasensitive prion detection by recombinant PrP conversion with shaking. Nat. Methods. 2008; 5(3):211–2. https://doi.org/10.1038/nmeth0308-211.
36. Atarashi R., Sano K., Satoh K., Nishida N. Real-time quaking-induced conversion: a highly sensitive assay for prion detection. Prion. 2011; 5(3): 150–3. https://doi.org/10.4161/pri.5.3.16893.
37. Henderson D.M., Davenport K.A., Haley N.J., Denkers N.D., Mathiason C.K., Hoover E.A. Quantitative assessment of prion infectivity in tissues and body fluids by real-time quaking-induced conversion.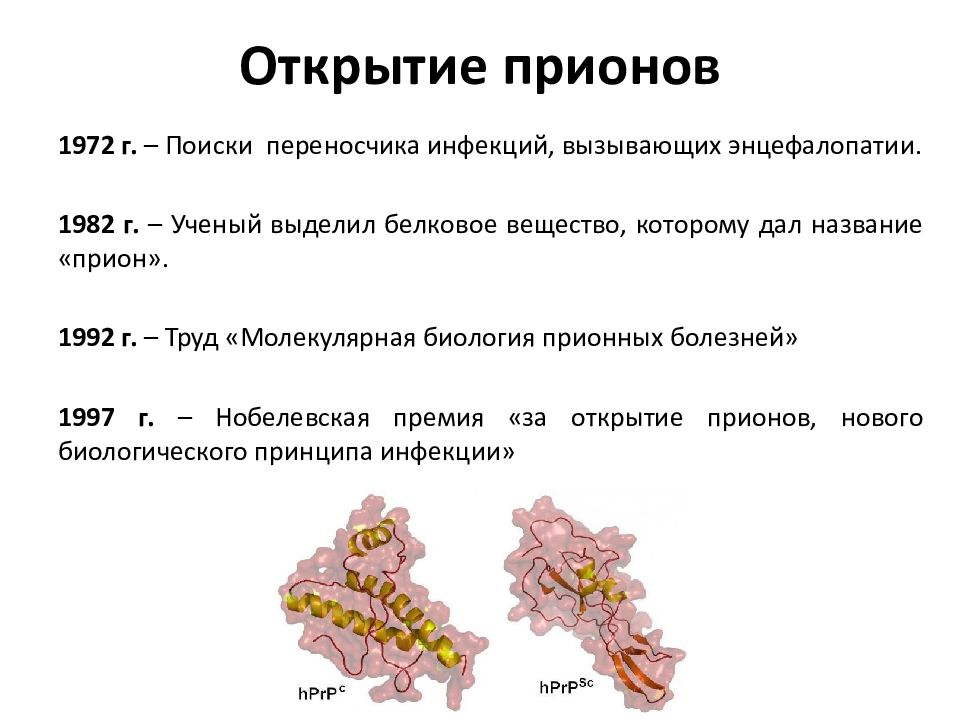 J. Gen. Virol. 2015; 96(Pt. 1): 210–9. https://doi.org/10.1099/vir.0.069906-0.
J. Gen. Virol. 2015; 96(Pt. 1): 210–9. https://doi.org/10.1099/vir.0.069906-0.
38. Dassanayake R.P., Orrú C.D., Hughson A.G., Caughey B., Graça T., Zhuang D., et al. Sensitive and specific detection of classical scrapie prions in the brains of goats by real-time quaking-induced conversion. J. Gen. Virol. 2016; 97(3): 803–12. https://doi.org/10.1099/jgv.0.000367.
39. Orrú C.D., Groveman B.R., Raymond L.D., Hughson A.G., Nonno R., Zou W., et al. Bank vole prion protein as an apparently universal substrate for RT-QuIC-based detection and discrimination of prion strains. PLoS Pathog. 2015; 11(6): e1004983. https://doi.org/10.1371/journal.ppat.1004983.
40. Favole A., Mazza M., Vallino Costassa E., D’Angelo A., Lombardi G., Marconi P.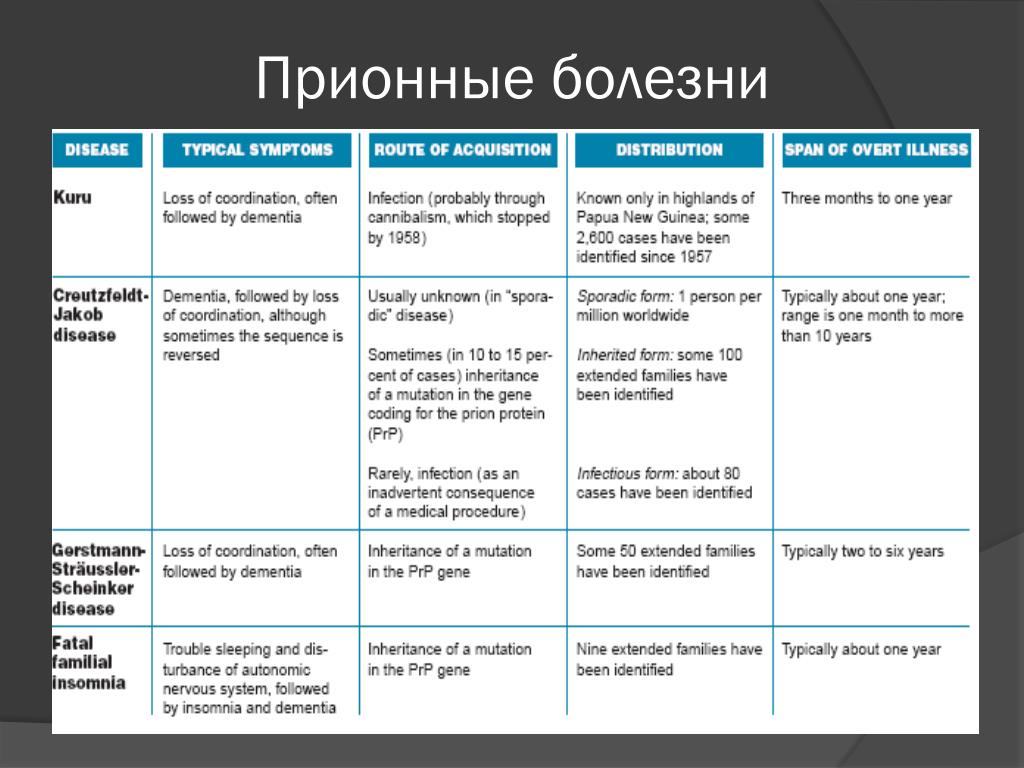 , et al. Early and pre-clinical detection of prion seeding activity in cerebrospinal fluid of goats using real-time quaking- induced conversion assay. Sci. Rep. 2019; 9(1): 6173. https://doi.org/10.1038/s41598-019-42449-7.
, et al. Early and pre-clinical detection of prion seeding activity in cerebrospinal fluid of goats using real-time quaking- induced conversion assay. Sci. Rep. 2019; 9(1): 6173. https://doi.org/10.1038/s41598-019-42449-7.
41. Davenport K.A., Hoover C.E., Denkers N.D., Mathiason C.K., Hoover E.A. Modified protein misfolding cyclic amplification overcomes real-time quaking-induced conversion assay inhibitors in deer saliva to detect Chronic Wasting Disease prions. J. Clin. Microbiol. 2018; 56(9): e00947-18. https://doi.org/10.1128/JCM.00947-18.
42. Mammana A., Baiardi S., Rossi M., Franceschini A., Donadio V., Capellari S., et al. Detection of prions in skin punch biopsies of Creutzfeldt-Jakob disease patients. Ann. Clin. Translat. Neurol. 2020; 7(4): 559–64. https://doi.org/10.1002/acn3.51000.
43. Bongianni M., Orrú C.D., Groveman B.R., Sacchetto L., Fiorini M., Tonoli G., et al. Diagnosis of human prion disease using real-time quaking-induced conversion testing of olfactory mucosa and cerebrospinal fluid samples. JAMA Neurol. 2017; 74(2): 155–62. https://doi.org/10.1001/jamaneurol.2016.4614.
Bongianni M., Orrú C.D., Groveman B.R., Sacchetto L., Fiorini M., Tonoli G., et al. Diagnosis of human prion disease using real-time quaking-induced conversion testing of olfactory mucosa and cerebrospinal fluid samples. JAMA Neurol. 2017; 74(2): 155–62. https://doi.org/10.1001/jamaneurol.2016.4614.
44. McGuire L.I., Poleggi A., Poggiolini I., Suardi S., Grznarova K., Shi S., et al. Cerebrospinal fluid real-time quaking-induced conversion is a robust and reliable test for sporadic Creutzfeldt-Jakob disease: An international study. Ann. Neurol. 2016; 80(1): 160–5. https://doi.org/10.1002/ana.24679.
45. Cramm M., Schmitz M., Karch A., Mitrova E., Kuhn F., Schroeder B., et al. Stability and reproducibility underscore utility of RT-QuIC for diagnosis of Creutzfeldt-Jakob disease. Mol. Neurobiol. 2016; 53(3): 1896–904. https://doi.org/10.1007/s12035-015-9133-2.
https://doi.org/10.1007/s12035-015-9133-2.
46. Haley N.J., Donner R., Henderson D.M., Tennant J., Hoover E.A., Manca M., et al. Cross-validation of the RT-QuIC assay for the antemortem detection of chronic wasting disease in elk. Prion. 2020; 14(1): 47–55. https://doi.org/10.1080/19336896.2020.1716657.
47. Hwang S., Tatum T., Lebepe-Mazur S., Nicholson E.M. Preparation of lyophilized recombinant prion protein for TSE diagnosis by RTQuIC. BMC Res. Notes. 2018; 11(1): 895. https://doi.org/10.1186/s13104-018-3982-5.
48. Koutsoumanis K., Allende A., Alvarez-Ordoñez A., Bolton D., Bover-Cid S., Chemaly M., et al. Update on chronic wasting disease (CWD). EFSA J. 2019; 17(11): e05863. https://doi.org/10.2903/j.efsa.2019.5863.
49. Schaetzl H. One Health Workshop Series 2020: Chronic Wasting Disease. Zoonotic potential of CWD. Available at: https://ucalgary.zoom.us/rec/play/hja-r64RAavwd07Wv9-D4QAly-36SAILGC_QNqu6j2f6c2F4WhsgM-opx5x56pIDu41zgUwR4moiOAkPf.9-DQ27JE9yCVhyA-?startTime=1602079098000.
Schaetzl H. One Health Workshop Series 2020: Chronic Wasting Disease. Zoonotic potential of CWD. Available at: https://ucalgary.zoom.us/rec/play/hja-r64RAavwd07Wv9-D4QAly-36SAILGC_QNqu6j2f6c2F4WhsgM-opx5x56pIDu41zgUwR4moiOAkPf.9-DQ27JE9yCVhyA-?startTime=1602079098000.
50. Orrú C.D., Wilham J.M., Raymond L.D., Kuhn F., Schroeder B., Raeber A.J., et al. Prion disease blood test using immunoprecipitation and improved quaking-induced conversion. mBio. 2011; 2(3):e00078-11. https://doi.org/10.1128/mBio.00078-11.
51. Denkers N.D., Henderson D.M., Mathiason C.K., Hoover E.A. Enhanced prion detection in biological samples by magnetic particle extraction and real-time quaking-induced conversion. J. Gen. Virol. 2016; 97(8): 2023–9. https://doi.org/10.1099/jgv.0.000515.
52. Haley N.J., Richt J.A., Davenport K.A., Henderson D.M., Hoover E.A., Manca M., et al. Design, implementation, and interpretation of amplification studies for prion detection. Prion. 2018; 12(2): 73–82. https://doi.org/10.1080/19336896.2018.1443000.
Haley N.J., Richt J.A., Davenport K.A., Henderson D.M., Hoover E.A., Manca M., et al. Design, implementation, and interpretation of amplification studies for prion detection. Prion. 2018; 12(2): 73–82. https://doi.org/10.1080/19336896.2018.1443000.
53. Metrick M.A., do Carmo Ferreira N., Saijo E., Hughson A.G., Kraus A., Orrú C.D., et al. Million-fold sensitivity enhancement in proteopathic seed amplification assays for biospecimens by Hofmeister ion comparisons. Proc. Natl. Acad. Sci. USA. 2019; 116(46): 23029–39. https://doi.org/10.1073/pnas.1909322116.
54. Saa P., Cervenakova L. Protein misfolding cyclic amplification (PMCA): Current status and future directions. Virus Res. 2015; 207:47–61. https://doi.org/10.1016/j.virusres.2014.11.007.
55. Seed C.R., Hewitt P.E., Dodd R.Y., Houston F., Cervenakova L. Creutzfeldt-Jakob disease and blood transfusion safety. Vox Sang. 2018; 113(3): 220–31. https://doi.org/10.1111/vox.12631.
Seed C.R., Hewitt P.E., Dodd R.Y., Houston F., Cervenakova L. Creutzfeldt-Jakob disease and blood transfusion safety. Vox Sang. 2018; 113(3): 220–31. https://doi.org/10.1111/vox.12631.
56. Kim C., Xiao X., Chen S., Haldiman T., Smirnovas V., Kofskey D., et al. Artificial strain of human prions created in vitro. Nat. Commun. 2018; 9(1): 2166. https://doi.org/10.1038/s41467-018-04584-z.
57. Barria M.A., Libori A., Mitchell G., Head M.W. Susceptibility of human prion protein to conversion by Chronic Wasting Disease prions. Emerg. Infect. Dis. 2018; 24(8): 1482–9. https://doi.org/10.3201/eid2408.161888.
58. Зуев В.А., Кальнов С.Л., Куликова Н.Ю., Гребенникова Т.В. Современное состояние проблемы прионных болезней и причины их опасности для человека и животных. Вопросы вирусологии. 2020; 65(2): 71–6. https://doi.org/10.36233/0507-4088-2020-65-2-71-76.
Вопросы вирусологии. 2020; 65(2): 71–6. https://doi.org/10.36233/0507-4088-2020-65-2-71-76.
59. Saijo E., Groveman B.R., Kraus A., Metrick M., Orrú C.D., Hughson A.G., et al. Ultrasensitive RT-QuIC seed amplification assays for disease-associated Tau, α‑synuclein, and prion aggregates. Methods Mol. Biol. 2019; 1873: 19–37. https://doi.org/10.1007/978-1-4939-8820-4_2.
Прионы и прионные болезни | КМАХ
Аннотация
Прионные болезни относятся к группе нейродегенеративных заболеваний. В общей популяции встречаются очень редко и регистрируются в виде спорадических, инфекционных и наследственных форм. Этиологически эти заболевания связаны с инфекционным белком (прионом), который возникает на посттрансляционном этапе в результате конформационных изменений нормального прионного белка хозяина. Фенотипическая гетерогенность прионных болезней является результатом взаимодействия ряда переменных составляющих. При этом главными факторами, по-видимому, служат экспрессия протеина PrPres и полиморфизм кодона 129. Прижизненная диагностика прионных болезней разработана недостаточно. Лечения этих болезней не существует. Возможности профилактики ограниченны.
При этом главными факторами, по-видимому, служат экспрессия протеина PrPres и полиморфизм кодона 129. Прижизненная диагностика прионных болезней разработана недостаточно. Лечения этих болезней не существует. Возможности профилактики ограниченны.
- 1. Palmer M.S., Collinge J. Prion diseases: an introduction. In: Collinge J., Palmer M.S., editors. Prion Diseases. Oxford: Oxford University Press; 1997.
- 2. Prusiner S.B. Human prion diseases and neurodegeneration: prions, prions, prions. Berlin. Heidelberg; 1998. p.1-17.
- 3. Зуев В.А. Медленные вирусные инфекции человека и животных. М.: Медицина; 1988.
- 4. Korczyn A.D. Human prion diseases. Proceedings of 49th Annual meeting of American Academy of Neurology; 1997 Apr 12-19, Boston, MA. p.1-19.
- 5. Chazot G., Brousolle E., Lapras CI., Blatter T., Aguzzi A., Kopp N. New variant of Creutzfeld-Jacob Disease in a 26-year-old French man. Lancet 1996; 347:1181.
- 6.
Will R.G., Ironside J.W., Zeidler M., et al.
 A new variant of Creutzfeldt-Jacob Disease in the UK. Lancet 1996; 347:921-5.
A new variant of Creutzfeldt-Jacob Disease in the UK. Lancet 1996; 347:921-5. - 7. Bruce M.E., Will R.G., Ironside J.W., McConnell J., et al. Transmissions to mice indicate that «new variant» Creutzfeldt-Jacob disease is caused by the BSE agent. Nature 1997; 389:498-501.
- 8. Hill A.F., Zeidler M., Ironside J., Collinge J. Diagnosis of new variant Creutzfeldt-Jacob disease by tonsil biopsy. Lancet 1996; 347:921-5.
- 9. Brandner S., Iseman S., Raeber A., et al. Normal host prion protein necessary for scrapie-induced neurotoxicity. Nature 1996; 379:339-40.
- 10. Prusiner S.B. Prions causing neurodegenerative diseases of humans and animals. In: Jolles G., Stutzmann J.M., editors. Neurodegenerative diseases. Acad Press; 1996. p.23-80.
- 11. Зуев В.А., Завалишин И.А., Ройхель В.М. Прионные болезни человека и животных. Руководство для врачей. М.: Медицина; 1999.
- 12. Hay B., Prusiner S.B., Lingappa V.R. Biochemistry 1987; 26:8110-4.
- 13.
Ironside I.
 W. Human prion diseases. J Neural Transm 1996; 47:231-46.
W. Human prion diseases. J Neural Transm 1996; 47:231-46. - 14. Prusiner S.B. Human prion diseases and neurodegeneration. Cur Topics in Microb Immunol 1996; 207:1-17.
- 15. Gambetti P. Human prion diseases. Proceedings of the 49th Annual meeting of American Academy of Neurology; 1997 Apr 12-19; Boston, MA. p.43-62.
- 16. Alperovitch A. Epidemiology of Creutzfeldt-Jacob disease – past and present uncertainties. Eur J Neurol 1996; 3:500-6.
- 17. Bell J., Ironside J. Neuropathology of spongiform encephalopathies in humans. Br Med Bull 1993; 49:738-77.
- 18. Budka H., Aguzzi A., Brown P. Neuropathological diagnostic criteria for Creutzfeldt-Jakob disease (CJD) and other human spongiform encephalopathies (Prion diseases). Brain Pathol 1995; 5:459-66.
- 19.
Report of a WHO Consultation on Clinical and Neuropathological Characteristics of the New Variant of Creutzfeldt-Jacob disease and other Human and Animal Transmissible Spongiform encephalopathies; 1996, 1997, 1998, Geneva.

- 20. Matsuda H. Chicken monoclonal antibodies with specificity for the N-terminal of human prion protein. FIMS Immunol Med Microbiol 1999; 23:189-94.
- 21. Hsich G., Kenney K., Gibbs C.J., Lee K.H., Harrington M.G. The 14-3-3 brain protein in cerebrospinal fluid as a marker for transmissible spongiform encephalopaties. N Engl J Med 1996; 335:924-30.
- 22. Завалишин И.А., Адарчева Л.С., Ройхель В.М., Фомина Г.И., Кондакова Л.И., Соболев С.Г., Погодина В.В. Синдром Герстманна-Штреусслера: новые возможности диагностики. Журн невропатол и психиатр 1995; 1:58-63.
- 23. Medori R., Tritchler H-J., LeBlanc A., et al. Fatal familial insomnia, a prion disease with a mutation at codon 178 of the prion protein gene. N Engl J Med 1992; 326:444-9.
- 24. Gambetti P., Parchi P. Insomnia in prion diseases: sporadic and familial. N Engl J Med 1999; 340:1675-7.
- 25.
Gajdusek D.C. Infectious amyloids: subacute spongiform encephalopathies as transmissible cerebral amyloidoses.
 In: Fields B.N., et al., editors. Fields Virology. Philadelphia: Lippincott Raven Publishers; 1996. p.2851-900.
In: Fields B.N., et al., editors. Fields Virology. Philadelphia: Lippincott Raven Publishers; 1996. p.2851-900. - 26. Collinge J., Palmer M.S., Sidle K.C., et al. Unaltered susceptibility to BSE in transgenic mice expressing human prion protein. Nature 1995; 378:779-83.
- 27. Cousens S.N., et al. Predicting the CJD epidemic in humans. Nature 1997; 385:197-8.
Просмотров
Поделились
Процитировали Crossref
идеальные убийцы и возможный ключ к бессмертию – Москва 24, 17.06.2015
Фото: M24.ru/Евгения Смолянская
За свою историю человечество сталкивалось с огромным количеством войн, эпидемий, стихийных бедствий и других катаклизмов. В XXI веке, когда с эпидемиями, казалось, было покончено, у человечества появился новый вызов – прионы. Что это такое, чем они грозят людям и почему прионами так интересуются ученые всего мира – в материале M24.ru.
Ты помнишь, как все начиналось
В двадцатые годы прошлого столетия врачи столкнулись с новым и неизведанным доселе заболеванием.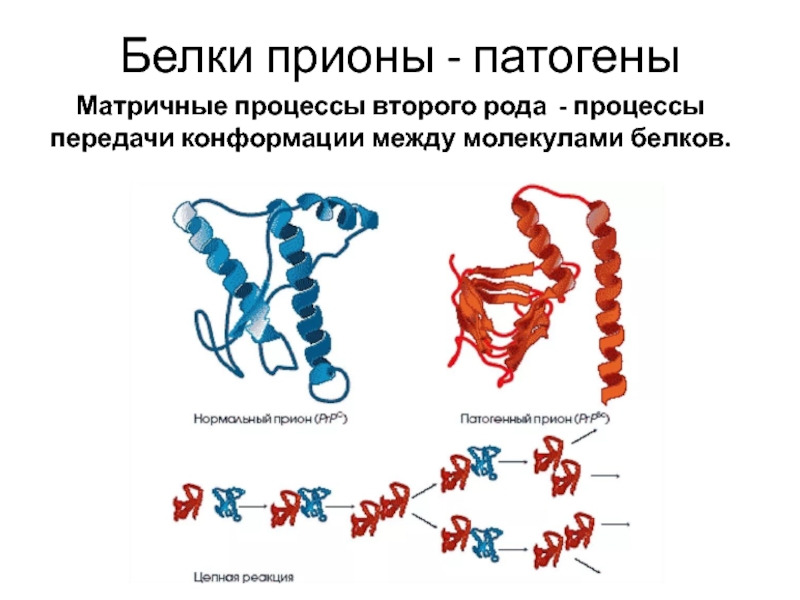 Немецкий невропатолог Ганс Герхард Крейтцфельдт наблюдал в своей клинике одну пациентку – 20-летнюю девушку. На начальной стадии болезни у нее была нарушена чувствительность в руках и ногах, быстро прогрессировали расстройства памяти, нервной деятельности, больная все чаще впадала в бессознательное состояние. Через несколько месяцев девушка умерла от расстройств дыхания и сердечной деятельности. Невропатолог, который в будущем станет видным нацистским врачом и будет принимать участие в программе «Эвтаназия», задокументировал ход болезни.
Немецкий невропатолог Ганс Герхард Крейтцфельдт наблюдал в своей клинике одну пациентку – 20-летнюю девушку. На начальной стадии болезни у нее была нарушена чувствительность в руках и ногах, быстро прогрессировали расстройства памяти, нервной деятельности, больная все чаще впадала в бессознательное состояние. Через несколько месяцев девушка умерла от расстройств дыхания и сердечной деятельности. Невропатолог, который в будущем станет видным нацистским врачом и будет принимать участие в программе «Эвтаназия», задокументировал ход болезни.
Спустя несколько месяцев доктор Альфонс Мария Якоб из Гамбурга столкнулся с тремя аналогичными пациентами. Молодые люди страдали от расстройств нервной деятельности, глотания, практически не осознавали происходящее вокруг и вскоре умерли. При вскрытии Якоб увидел интересное явление, которое раньше врачам наблюдать не приходилось, – поражен у больных был только мозг. Была зафиксирована массовая гибель клеток серого вещества головного мозга, а сохранившиеся нейроны отличались необычным набуханием. Ни в одном другом органе не было зафиксировано никаких патологических изменений. В память о двух первооткрывателях заболевание получило название болезни Крейтцфельдта – Якоба.
Ни в одном другом органе не было зафиксировано никаких патологических изменений. В память о двух первооткрывателях заболевание получило название болезни Крейтцфельдта – Якоба.
Ссылки по теме
В те далекие годы вирусология как наука находилась еще в зачаточной стадии. Поэтому заболеванию было суждено долгое время оставаться в забвении. Этому поспособствовали Великая депрессия и Вторая мировая война. И лишь в пятидесятые годы прошлого века ученые начали активно интересоваться, что же все-таки происходит с людьми, которым не посчастливилось подхватить болезнь Крейтцфельдта – Якоба.
В то же время ученые открывают еще два заболевания, которые по своим симптомам и течению весьма и весьма напоминают описанный выше страшный недуг – куру и скрейпи. Первая болезнь была распространена среди народности форе на острове Папуа – Новая Гвинея, а вторым страдали овцы по всему миру. Но важным оказалось другое: симптомы болезней несколько отличались от болезни Крейтцфельдта – Якоба, но характер поражений был практически идентичен – образование пустот в тканях головного мозга и массовая гибель нервных клеток.
Казалось бы, все ясно. Имеется болезнь, ее вызывает какой-то вирус или бактерия, давайте разберемся, кто является возбудителем и устраним причину. Но не тут-то было! Все оказалось не так просто…
Исследования
Ученым удалось достаточно быстро установить, почему болеют папуасы. Выяснилось, что заболевают только те из них, кто участвовал в ритуальном поедании тел погибших от куру родственников. Согласно местным верованиям того времени, дети должны были обязательно отведать мозга умершего, считалось, что от этого у них прибавится ума. Неизвестно, прибавлялось ли у детей от этого ума, но все малолетние, участвовавшие в таких трапезах, обязательно оказывались зараженными куру.
Особенно масштабные исследования развернулись с агентом скрейпи. Для начала определили его размеры, они оказались стандартными для вирусов – 17–27 нанометров. После этого вирусологи всего мира стали разбираться в свойствах неизвестного возбудителя заболевания, и тут их ждали сюрпризы. Оказалось, что инфекционный агент совершенно невосприимчив к формалину, пепсину и трипсину, не реагирует на ферменты, разрушающие ДНК и РНК, устойчив к кипячению, ультрафиолетовому излучению и. .. проникающей радиации! С такими вирусами ученым сталкиваться еще не приходилось.
.. проникающей радиации! С такими вирусами ученым сталкиваться еще не приходилось.
Фото: M24.ru/Александр Авилов
Больше того, возбудителя заболевания никак не удавалось увидеть в электронный микроскоп, что было уж совсем странно. В то время ученые уже умели распознавать вирусные частицы намного мельче, чем 17 нанометров, но вирус скрейпи (почесуха) так никто и не увидел – наблюдали лишь фрагменты клеточных мембран.
Еще одной интересной загадкой оказалось всякое отсутствие иммунного ответа организма больных. Организм людей, больных куру, и овец, страдавших от скрейпи, никак не реагировал на течение заболевания. При обычных болезнях, вроде гриппа и простуды, в организме увеличивается синтез интерферона (отвечает за иммунитет), что ведет к быстрому выпуску антител, которые соединяются с вирусными частицами и растворяют их. Ученые пытались обнаружить признаки хоть каких-либо антител, но потерпели неудачу.
Отчаявшиеся исследователи начали выдвигать гипотезы, что возбудителем является не вирус, а молекула полисахарида или же белка, но подтверждения эта версия так и не нашла. Ученые топтались на месте, пока в 1982 году американский невролог Стэнли Прузинер не заявил об открытии нового класса инфекционных агентов – прионах.
Ученые топтались на месте, пока в 1982 году американский невролог Стэнли Прузинер не заявил об открытии нового класса инфекционных агентов – прионах.
Что такое прион
До открытия прионов считалось, что болезни человека и животных могут вызываться исключительно живыми организмами или хотя бы вирусами, содержащими нуклеиновую кислоту. Однако все оказалось не так просто. Прион – это особый вид белка, который присутствует в любом человеческом организме.
Выяснилось, что либо под воздействием непонятных факторов, либо из-за мутаций в организме некоторых людей нормальный прионный белок, входящий в состав клеточных мембран, заменяется «неправильным». Второй вид прионного белка имеет другую структуру, вызывает гибель клеток, но самое интересное – способен самостоятельно размножаться (без каких-либо ДНК и РНК!) и менять нормальные прионы в соседних клетках на дефектные.
Таким образом, прионы оказались единственным видом инфекционных агентов, которых никак нельзя причислить к живым существам. Ведь, по своей сути, они не содержат никакой генетической информации и самостоятельно синтезируются организмом.
Ведь, по своей сути, они не содержат никакой генетической информации и самостоятельно синтезируются организмом.
Естественно, исследователей заинтересовал самый главный вопрос – а зачем вообще в человеческом организме нужны прионы? В настоящее время известно уже достаточно много прионных болезней. Все они являются экстремально редкими, самая распространенная – болезнь Крейтцфельдта – Якоба – наблюдается у одного из миллиона человек. Также известно о синдроме Герстманна – Штраусслера – Шайнкера, фатальной семейной бессонице и куру. Некоторые исследователи включают в группу прионных заболеваний человека также болезнь Альперса у детей, амиотрофический лейкоспонгиоз (описан белорусскими учеными в конце прошлого века, болели работники одной из ферм) и спонгиоформный миозит (мышечное истощение).
Все эти заболевания являются смертельными, и лекарств от них пока не предложено. Но все же зачем организм синтезирует прионы? Какую он отводит роль для них?
Зачем нужны прионы?
В 70-е годы прошлого века два английских исследователя – Паттисон и Джебет – изучали на мышах действие вещества под названием купризон. В нормальных условиях оно связывает в организме ионы меди. Животным включили купризон в обязательную диету с целью посмотреть, какое действие он произведет на грызунов. И поразились! После 30 с лишним дней купризоновой диеты совершенно здоровые до этого мыши превратились в тяжелобольных. Причем все признаки заболевания полностью отвечали симптомами скрепи. Часть мышей, участвовавших в эксперименте, вскрыли и посмотрели – оказалось, что в головном мозгу животных произошли абсолютно те же изменения, что и при прионных болезнях.
В нормальных условиях оно связывает в организме ионы меди. Животным включили купризон в обязательную диету с целью посмотреть, какое действие он произведет на грызунов. И поразились! После 30 с лишним дней купризоновой диеты совершенно здоровые до этого мыши превратились в тяжелобольных. Причем все признаки заболевания полностью отвечали симптомами скрепи. Часть мышей, участвовавших в эксперименте, вскрыли и посмотрели – оказалось, что в головном мозгу животных произошли абсолютно те же изменения, что и при прионных болезнях.
Возник вопрос: а что если купризон мышам больше не давать? Попробовали – и через несколько дней грызуны выздоровели. Уже через 30 дней у них исчезли и вызванные купризоном изменения в мозговой ткани.
Спустя много лет было выяснено, что прионы весьма и весьма похожи на положительно заряженные частицы двухвалентной меди. И изменения, которые они вызывают в организме, практически идентичны. Таким образом, исследователи сделали вывод о том, что в нормальном состоянии прионы отвечают за оборот металлов, в частности меди. Но эти данные пока остаются лишь гипотезой.
Но эти данные пока остаются лишь гипотезой.
Фото: ТАСС/Станислав Красильников
Еще одна группа американских исследователей принялась копать в другом направлении. Им удалось получить данные, что прионы помогают клеткам мозга прикрепляться друг к другу и участвуют в передаче сигналов внутри клетки. Это означает, что отсутствие прионов или их дефекты не позволяют клеткам мозга получать сигнал о других клеток, что ведет к развитию тяжелых нарушений в работе нервной и других систем организма.
Но самым интересным является предположение о том, что прионы участвуют в механизмах клеточного старения. Не секрет, что долгое время прионные болезни относили к группе старческих болезней, потому что вызываемые ими изменения весьма сходны с другими заболеваниями (вроде болезни Пика, Альцгеймера и других неврологических недугов). Наличие прионной инфекции как бы подталкивает организм к ускоренному старению. Естественно, это ставит очень важный вопрос: если лекарство от таких болезней будет найдено, не станет ли оно своеобразным ключом к долголетию или даже бессмертию организма? Но ответ на этот вопрос пока дать невозможно, поскольку функции прионов изучены еще недостаточно хорошо.
Способы заражения
В заключение поговорим о способах заражения. Их четыре. В первом и самом распространенном случае заболевание возникает как бы из ниоткуда. То есть жил себе человек, да вдруг взял и заболел. Этот путь возникновения болезни называется спорадическим и, кстати сказать, является наиболее распространенным. По нынешним представлениям, это происходит спонтанно под действием каких-то пока не установленных факторов.
Второй способ – наследственный. Некоторые виды болезней являются семейными и возникают из-за мутаций. В свою очередь, гены передаются потомству. Известно около 40 семей, страдающих фатальной бессоницей. Каждый десятый страдающий болезнью Крейтцфельдта – Якоба – страдает семейной формой этого заболевания.
Фото: M24.ru/Михаил Сипко
Третий способ – ятрогенный. Это означает, что заражение прионами произошло по вине медицинских работников при проведении каких-либо оперативных вмешательств. Однако описаны лишь несколько таких случаев, и все они произошло в 70-е годы прошлого века, когда о свойствах прионов еще никто не знал. Так, одна женщина заболела после того, как ей пересадили роговицу глаза от страдавшего болезнью Крейтцфельдта – Якоба мужчины.
Так, одна женщина заболела после того, как ей пересадили роговицу глаза от страдавшего болезнью Крейтцфельдта – Якоба мужчины.
А вот последний способ наиболее коварен и опасен. Дело в том, что человек восприимчив к прионам, которые поражают крупный рогатый скот. И при употреблении в пищу мяса больных животных заболевают и люди – у них развивается болезнь Крейтцфельдта – Якоба. В девяностые годы прошлого века настоящая эпидемия этого страдания разразилась в Англии.
Лечения пока нет. Однако ученые уже выяснили, что некоторые виды прионов разлагаются лишайниками, другим удалось описать особые антиприонные антитела (к инфекционным прионам).
Иными словами, перед исследователями стоит весьма непростая задача, которая не только поможет найти лекарство от тяжелых заболеваний, но и, возможно, поможет открыть секрет долголетия. Для этого нужно только одно – понять прионы.
Паразиты мозга: ученые нашли новые подтверждения опасности прионов
https://ria. ru/20190117/1549448358.html
ru/20190117/1549448358.html
Паразиты мозга: ученые нашли новые подтверждения опасности прионов
Паразиты мозга: ученые нашли новые подтверждения опасности прионов
Большинство случаев коровьего бешенства у людей выявлено в Великобритании. Часть британцев, полагают ученые, генетически предрасположена к этой болезни… РИА Новости, 17.01.2019
2019-01-17T08:00
2019-01-17T08:00
2019-01-17T11:22
наука
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn22.img.ria.ru/images/153246/52/1532465216_0:3:1036:586_1920x0_80_0_0_d3c10797152bf9fea9762e707183be16.jpg
МОСКВА, 17 янв — РИА Новости, Татьяна Пичугина. Большинство случаев коровьего бешенства у людей выявлено в Великобритании. Часть британцев, полагают ученые, генетически предрасположена к этой болезни. Считается, что ее вызывают прионы — белки с нарушенной структурой, действующие подобно инфекции. Несмотря на серьезные исследования, природа прионов до сих пор остается непонятной. Европа напугана В 1995 году в Великобритании у двух подростков диагностировали очень редкую форму губчатой энцефалопатии, или болезни Крейтцфельдта — Якоба. В марте 1996-го зафиксировали уже десять случаев. Пациенты страдали от болей, психических и нейродегенеративных расстройств, вскоре погибали. Болезнь связали с распространением новой формы коровьего бешенства — инфекционной болезни, поражающей крупный рогатый скот, овец, оленей. Спекуляции, может ли вирус передаваться от домашних животных к людям, ходили давно. Лабораторные эксперименты показали, что существует препятствующий этому межвидовой барьер, однако, судя по вспышке середины 1990-х, этого оказалось недостаточно.Распространение болезни вызвало широкий общественный резонанс в мире, заговорили о кризисе здравоохранения в Европейском союзе и о провале в знаниях, касающихся причин коровьего бешенства. Начались масштабные исследования, но и спустя тридцать лет ученые не могут четко ответить на ключевой вопрос — каковы риски заразиться прионными болезнями при употреблении мяса выращенных животных.
Европа напугана В 1995 году в Великобритании у двух подростков диагностировали очень редкую форму губчатой энцефалопатии, или болезни Крейтцфельдта — Якоба. В марте 1996-го зафиксировали уже десять случаев. Пациенты страдали от болей, психических и нейродегенеративных расстройств, вскоре погибали. Болезнь связали с распространением новой формы коровьего бешенства — инфекционной болезни, поражающей крупный рогатый скот, овец, оленей. Спекуляции, может ли вирус передаваться от домашних животных к людям, ходили давно. Лабораторные эксперименты показали, что существует препятствующий этому межвидовой барьер, однако, судя по вспышке середины 1990-х, этого оказалось недостаточно.Распространение болезни вызвало широкий общественный резонанс в мире, заговорили о кризисе здравоохранения в Европейском союзе и о провале в знаниях, касающихся причин коровьего бешенства. Начались масштабные исследования, но и спустя тридцать лет ученые не могут четко ответить на ключевой вопрос — каковы риски заразиться прионными болезнями при употреблении мяса выращенных животных. Ужасные прионы Белки — основной строительный материал живых организмов. Они синтезируются в клетках, согласно заложенной в ДНК информации. Чтобы выполнять свои функции, молекулы белков определенным образом скручиваются и упаковываются. Нарушение этих процессов отравляет организм и может вызвать заболевания. Класс таких патогенных белков, за синтез которых отвечают ошибки в гене PRNP, называют прионами. По одной из распространенных гипотез, именно прионы вызывают различные формы губчатой энцефалопатии у животных и людей. Они способны заражать здоровые белки и размножаться, используя своего рода «семена» полимерных цепей. Из-за своей неправильной структуры они слипаются и образуют бляшки в мозге, нарушая работу нейронов. В результате мозг постепенно перестает нормально работать и погибает. Прионные болезни у людей очень редки. На сегодня в мире известен 231 случай, причем 178 из них — среди жителей Великобритании. После пика 2001-2002 годов количество их снижается. У заболевших выявили мутацию в 129-м кодоне 20-й хромосомы, что указывает на генетическую предрасположенность к этой болезни.
Ужасные прионы Белки — основной строительный материал живых организмов. Они синтезируются в клетках, согласно заложенной в ДНК информации. Чтобы выполнять свои функции, молекулы белков определенным образом скручиваются и упаковываются. Нарушение этих процессов отравляет организм и может вызвать заболевания. Класс таких патогенных белков, за синтез которых отвечают ошибки в гене PRNP, называют прионами. По одной из распространенных гипотез, именно прионы вызывают различные формы губчатой энцефалопатии у животных и людей. Они способны заражать здоровые белки и размножаться, используя своего рода «семена» полимерных цепей. Из-за своей неправильной структуры они слипаются и образуют бляшки в мозге, нарушая работу нейронов. В результате мозг постепенно перестает нормально работать и погибает. Прионные болезни у людей очень редки. На сегодня в мире известен 231 случай, причем 178 из них — среди жителей Великобритании. После пика 2001-2002 годов количество их снижается. У заболевших выявили мутацию в 129-м кодоне 20-й хромосомы, что указывает на генетическую предрасположенность к этой болезни. Есть данные о том, что каждый двухтысячный в популяции Великобритании имеет эту мутацию. Ученые полагают, что у этих людей болезнь может внезапно возникнуть через семь-десять лет инкубационного периода. Или ее носители могут никогда не заболеть, но заразить других через донорство крови и органов, например сетчатки глаза. Этот путь распространения болезни сейчас активно изучают. Старение и неправильные белки За последние годы открыты новые формы прионных болезней у животных и людей. Например, их выявили у верблюдов и кошек, доказали, что можно заразить ими мартышек. В 1992 году выяснили прионную природу очень редкого наследственного заболевания — фатальной семейной бессонницы. Болезнь проявляется у взрослых, человек теряет сон, видит галлюцинации, а затем погибает. Причина — также в мутации в гене PRNP, превращающей нормальный белок в прион. Ученые выяснили, что белок, за который отвечает ген PRNP, имеет несколько форм, лишь одна из которых токсична. Опыты на мышах показали, что нормальные прионы появляются уже в мозге эмбриона и сопровождают его в процессе развития.
Есть данные о том, что каждый двухтысячный в популяции Великобритании имеет эту мутацию. Ученые полагают, что у этих людей болезнь может внезапно возникнуть через семь-десять лет инкубационного периода. Или ее носители могут никогда не заболеть, но заразить других через донорство крови и органов, например сетчатки глаза. Этот путь распространения болезни сейчас активно изучают. Старение и неправильные белки За последние годы открыты новые формы прионных болезней у животных и людей. Например, их выявили у верблюдов и кошек, доказали, что можно заразить ими мартышек. В 1992 году выяснили прионную природу очень редкого наследственного заболевания — фатальной семейной бессонницы. Болезнь проявляется у взрослых, человек теряет сон, видит галлюцинации, а затем погибает. Причина — также в мутации в гене PRNP, превращающей нормальный белок в прион. Ученые выяснили, что белок, за который отвечает ген PRNP, имеет несколько форм, лишь одна из которых токсична. Опыты на мышах показали, что нормальные прионы появляются уже в мозге эмбриона и сопровождают его в процессе развития. У взрослых особей они есть в сердечных и скелетных мышцах, в иммунных клетках. Хорошие прионы играют роль в сродстве клеток, передаче сигналов через клеточные мембраны, в метаболизме ионов меди, возможно, служат нейропротекторами. Белки неправильной структуры (бета-амилоиды) сопровождают возрастные неизлечимые нарушения, в том числе болезни Альцгеймера, Паркинсона, Гентингтона, деменцию. В последнее время ученые стали всерьез рассматривать гипотезу о том, что бета-амилоиды так же накапливаются и распространяются в организме, как и патогенные прионы. Несмотря на активные поиски, до сих пор неизвестно, зачем в организме возникают прионы и бета-амилоиды, служат они причиной нарушений работы мозга или наоборот. Связанные с ними заболевания по-прежнему неизлечимы.
У взрослых особей они есть в сердечных и скелетных мышцах, в иммунных клетках. Хорошие прионы играют роль в сродстве клеток, передаче сигналов через клеточные мембраны, в метаболизме ионов меди, возможно, служат нейропротекторами. Белки неправильной структуры (бета-амилоиды) сопровождают возрастные неизлечимые нарушения, в том числе болезни Альцгеймера, Паркинсона, Гентингтона, деменцию. В последнее время ученые стали всерьез рассматривать гипотезу о том, что бета-амилоиды так же накапливаются и распространяются в организме, как и патогенные прионы. Несмотря на активные поиски, до сих пор неизвестно, зачем в организме возникают прионы и бета-амилоиды, служат они причиной нарушений работы мозга или наоборот. Связанные с ними заболевания по-прежнему неизлечимы.
https://ria.ru/20181123/1533337929.html
https://ria.ru/20170113/1485646029.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn24.img.ria.ru/images/153246/52/1532465216_127:0:911:588_1920x0_80_0_0_bcee312641ad18eda0cc36482200bd9f.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
МОСКВА, 17 янв — РИА Новости, Татьяна Пичугина. Большинство случаев коровьего бешенства у людей выявлено в Великобритании. Часть британцев, полагают ученые, генетически предрасположена к этой болезни. Считается, что ее вызывают прионы — белки с нарушенной структурой, действующие подобно инфекции. Несмотря на серьезные исследования, природа прионов до сих пор остается непонятной.
Большинство случаев коровьего бешенства у людей выявлено в Великобритании. Часть британцев, полагают ученые, генетически предрасположена к этой болезни. Считается, что ее вызывают прионы — белки с нарушенной структурой, действующие подобно инфекции. Несмотря на серьезные исследования, природа прионов до сих пор остается непонятной.
Европа напугана
В 1995 году в Великобритании у двух подростков диагностировали очень редкую форму губчатой энцефалопатии, или болезни Крейтцфельдта — Якоба. В марте 1996-го зафиксировали уже десять случаев. Пациенты страдали от болей, психических и нейродегенеративных расстройств, вскоре погибали.
Болезнь связали с распространением новой формы коровьего бешенства — инфекционной болезни, поражающей крупный рогатый скот, овец, оленей. Спекуляции, может ли вирус передаваться от домашних животных к людям, ходили давно. Лабораторные эксперименты показали, что существует препятствующий этому межвидовой барьер, однако, судя по вспышке середины 1990-х, этого оказалось недостаточно.
Распространение болезни вызвало широкий общественный резонанс в мире, заговорили о кризисе здравоохранения в Европейском союзе и о провале в знаниях, касающихся причин коровьего бешенства. Начались масштабные исследования, но и спустя тридцать лет ученые не могут четко ответить на ключевой вопрос — каковы риски заразиться прионными болезнями при употреблении мяса выращенных животных.
23 ноября 2018, 07:09НаукаВ глазах людей нашли смертельно опасные белки-прионыУжасные прионы
Белки — основной строительный материал живых организмов. Они синтезируются в клетках, согласно заложенной в ДНК информации. Чтобы выполнять свои функции, молекулы белков определенным образом скручиваются и упаковываются. Нарушение этих процессов отравляет организм и может вызвать заболевания. Класс таких патогенных белков, за синтез которых отвечают ошибки в гене PRNP, называют прионами.
По одной из распространенных гипотез, именно прионы вызывают различные формы губчатой энцефалопатии у животных и людей. Они способны заражать здоровые белки и размножаться, используя своего рода «семена» полимерных цепей. Из-за своей неправильной структуры они слипаются и образуют бляшки в мозге, нарушая работу нейронов. В результате мозг постепенно перестает нормально работать и погибает. Прионные болезни у людей очень редки. На сегодня в мире известен 231 случай, причем 178 из них — среди жителей Великобритании. После пика 2001-2002 годов количество их снижается.
Они способны заражать здоровые белки и размножаться, используя своего рода «семена» полимерных цепей. Из-за своей неправильной структуры они слипаются и образуют бляшки в мозге, нарушая работу нейронов. В результате мозг постепенно перестает нормально работать и погибает. Прионные болезни у людей очень редки. На сегодня в мире известен 231 случай, причем 178 из них — среди жителей Великобритании. После пика 2001-2002 годов количество их снижается.У заболевших выявили мутацию в 129-м кодоне 20-й хромосомы, что указывает на генетическую предрасположенность к этой болезни. Есть данные о том, что каждый двухтысячный в популяции Великобритании имеет эту мутацию. Ученые полагают, что у этих людей болезнь может внезапно возникнуть через семь-десять лет инкубационного периода. Или ее носители могут никогда не заболеть, но заразить других через донорство крови и органов, например сетчатки глаза. Этот путь распространения болезни сейчас активно изучают.
Старение и неправильные белки
За последние годы открыты новые формы прионных болезней у животных и людей. Например, их выявили у верблюдов и кошек, доказали, что можно заразить ими мартышек.
Например, их выявили у верблюдов и кошек, доказали, что можно заразить ими мартышек.
В 1992 году выяснили прионную природу очень редкого наследственного заболевания — фатальной семейной бессонницы. Болезнь проявляется у взрослых, человек теряет сон, видит галлюцинации, а затем погибает. Причина — также в мутации в гене PRNP, превращающей нормальный белок в прион.
Ученые выяснили, что белок, за который отвечает ген PRNP, имеет несколько форм, лишь одна из которых токсична. Опыты на мышах показали, что нормальные прионы появляются уже в мозге эмбриона и сопровождают его в процессе развития. У взрослых особей они есть в сердечных и скелетных мышцах, в иммунных клетках.
Хорошие прионы играют роль в сродстве клеток, передаче сигналов через клеточные мембраны, в метаболизме ионов меди, возможно, служат нейропротекторами.
Белки неправильной структуры (бета-амилоиды) сопровождают возрастные неизлечимые нарушения, в том числе болезни Альцгеймера, Паркинсона, Гентингтона, деменцию. В последнее время ученые стали всерьез рассматривать гипотезу о том, что бета-амилоиды так же накапливаются и распространяются в организме, как и патогенные прионы.
В последнее время ученые стали всерьез рассматривать гипотезу о том, что бета-амилоиды так же накапливаются и распространяются в организме, как и патогенные прионы.
Несмотря на активные поиски, до сих пор неизвестно, зачем в организме возникают прионы и бета-амилоиды, служат они причиной нарушений работы мозга или наоборот. Связанные с ними заболевания по-прежнему неизлечимы.
13 января 2017, 13:06НаукаУченые нашли белок «коровьего бешенства» внутри бактерийБиологи нашли в микробах следы так называемых прионов – неправильно свернутых белков, считающихся сегодня причиной развития «коровьего бешенства» и болезни Альцгеймера.прионных болезней | NIH: Национальный институт аллергии и инфекционных заболеваний
Прионный белок, показанный красным цветом, может стать инфекционным и вызвать нейродегенеративное заболевание. Здесь четыре нервных клетки мыши иллюстрируют, как инфекционный прионный белок перемещается внутри клеток вдоль нейритов — проводных соединений, которые нервные клетки используют для связи с соседними клетками.
Кредит: НИАИД
Прионные болезни, также известные как трансмиссивные губчатые энцефалопатии или TSE, представляют собой группу редких смертельных заболеваний головного мозга, поражающих животных и людей.Они вызываются инфекционным агентом, известным как прион, который происходит из неправильно свернутой версии нормального белка-хозяина, известного как прионный белок. Прионные заболевания включают губчатую энцефалопатию крупного рогатого скота (BSE или «коровье бешенство») у крупного рогатого скота, болезнь Крейтцфельдта-Якоба (CJD) и вариант CJD у людей, скрейпи у овец и хроническую болезнь истощения (CWD) у оленей, лосей, лосей и северных оленей. .
Почему исследование прионных болезней является приоритетом для NIAID?
Прионные болезни представляют собой серьезную проблему для общественного здравоохранения и, как известно, передаются от животных к людям, а в случае варианта болезни Крейтцфельдта-Якоба — от человека к человеку через кровь. Прионные заболевания у людей трудно диагностировать, а когда они диагностируются, не существует эффективных методов лечения. В результате они неизбежно фатальны. Однако многое о прионных заболеваниях остается неизвестным, и понимание того, как они работают, важно для разработки как диагностических тестов, так и эффективных методов лечения. Прионные болезни также связаны с другими заболеваниями неправильного связывания белков, такими как болезнь Альцгеймера, болезнь Паркинсона и деменция с тельцами Леви. Прионные заболевания также связаны с заболеваниями, связанными с неправильной укладкой тау-белка, включая хроническую травматическую энцефалопатию (ХТЭ), которая связана с повреждением головного мозга в результате повторных травм головы.Таким образом, исследования прионных болезней также могут помочь ученым лучше понять другие связанные с ними болезни.
Прионные заболевания у людей трудно диагностировать, а когда они диагностируются, не существует эффективных методов лечения. В результате они неизбежно фатальны. Однако многое о прионных заболеваниях остается неизвестным, и понимание того, как они работают, важно для разработки как диагностических тестов, так и эффективных методов лечения. Прионные болезни также связаны с другими заболеваниями неправильного связывания белков, такими как болезнь Альцгеймера, болезнь Паркинсона и деменция с тельцами Леви. Прионные заболевания также связаны с заболеваниями, связанными с неправильной укладкой тау-белка, включая хроническую травматическую энцефалопатию (ХТЭ), которая связана с повреждением головного мозга в результате повторных травм головы.Таким образом, исследования прионных болезней также могут помочь ученым лучше понять другие связанные с ними болезни.
Как NIAID решает эту критическую тему?
Ученые NIAID изучают, как прионные заболевания развиваются и распространяются между людьми и животными, как их можно диагностировать и как их лечить. NIAID проводит исследования прионных заболеваний в своих лабораториях Rocky Mountain в Гамильтоне, штат Монтана, а также финансирует исследования прионных заболеваний в университетских лабораториях. Важное значение имеет также сотрудничество NIAID с другими группами NIH, изучающими нарушения старения и неврологические заболевания.Два других института при Национальных институтах здравоохранения также финансируют исследования прионных заболеваний — Национальный институт неврологических расстройств и инсульта и Национальный институт старения.
NIAID проводит исследования прионных заболеваний в своих лабораториях Rocky Mountain в Гамильтоне, штат Монтана, а также финансирует исследования прионных заболеваний в университетских лабораториях. Важное значение имеет также сотрудничество NIAID с другими группами NIH, изучающими нарушения старения и неврологические заболевания.Два других института при Национальных институтах здравоохранения также финансируют исследования прионных заболеваний — Национальный институт неврологических расстройств и инсульта и Национальный институт старения.
Биология и генетика
Прионные заболевания связаны с прионным белком, который содержится во многих тканях организма, включая мозг.Обычно прионный белок не вызывает заболеваний и находится на поверхности многих типов клеток. Хотя сейчас ведутся исследования, ученые считают, что нормальный прионный белок может помочь защитить мозг от повреждений. Они действительно знают, что когда многие молекулы нормального прионного белка меняют свою форму и слипаются, они могут агрегироваться в ткани мозга и образовывать инфекционные прионы, вызывающие прионную болезнь. Следовательно, прионные заболевания вызываются инфекционным, агрегированным прионным белком аномальной формы. Ученые не уверены, почему нормальный прионный белок деформируется.Ученые NIAID совместно открыли ген прионного белка и были одними из первых, кто показал, что аномальный прионный белок может преобразовывать нормальный прионный белок в аномальную инфекционную форму.
Они действительно знают, что когда многие молекулы нормального прионного белка меняют свою форму и слипаются, они могут агрегироваться в ткани мозга и образовывать инфекционные прионы, вызывающие прионную болезнь. Следовательно, прионные заболевания вызываются инфекционным, агрегированным прионным белком аномальной формы. Ученые не уверены, почему нормальный прионный белок деформируется.Ученые NIAID совместно открыли ген прионного белка и были одними из первых, кто показал, что аномальный прионный белок может преобразовывать нормальный прионный белок в аномальную инфекционную форму.
Подробнее о биологии и генетике прионных болезней
Терапевтические подходы
Хотя способов лечения прионных болезней не существует, ученые всего мира работают над разработкой методов лечения и диагностики. Исследователи NIAID разработали экспресс-тест для диагностики прионных заболеваний. Используя пробирочные или клеточные модели прионной инфекции для быстрого первоначального скрининга, исследователи NIAID также протестировали тысячи соединений и идентифицировали сотни молекул, которые ингибируют образование аномальной инфекционной формы прионного белка. Дальнейшие испытания наиболее сильных из этих ингибиторов выявили, что некоторые из них могут продлить жизнь грызунам, даже если лечение начинается после заражения.
Исследователи NIAID разработали экспресс-тест для диагностики прионных заболеваний. Используя пробирочные или клеточные модели прионной инфекции для быстрого первоначального скрининга, исследователи NIAID также протестировали тысячи соединений и идентифицировали сотни молекул, которые ингибируют образование аномальной инфекционной формы прионного белка. Дальнейшие испытания наиболее сильных из этих ингибиторов выявили, что некоторые из них могут продлить жизнь грызунам, даже если лечение начинается после заражения.
Подробнее о терапевтических подходах при прионных заболеваниях
Прионные болезни животных и люди
Существует 3 основных прионных заболевания животных: скрейпи у овец, губчатая энцефалопатия крупного рогатого скота (BSE) у крупного рогатого скота и хроническая болезнь истощения (CWD) у оленей, лосей и других цервид. Ученые NIAID используют различные экспериментальные модели для изучения того, как прионы одного вида животных могут инфицировать разные виды животных. К ним относятся исследования, чтобы определить, могут ли болезни животных, такие как CWD, инфицировать людей и вызывать болезнь Крейтцфельдта-Якоба (CJD).
Ученые NIAID используют различные экспериментальные модели для изучения того, как прионы одного вида животных могут инфицировать разные виды животных. К ним относятся исследования, чтобы определить, могут ли болезни животных, такие как CWD, инфицировать людей и вызывать болезнь Крейтцфельдта-Якоба (CJD).
Подробнее о прионных заболеваниях животных и человека
Прионная болезнь: MedlinePlus Genetics
От 10 до 15 процентов всех случаев прионной болезни вызваны мутациями в гене PRNP .Поскольку они могут передаваться по наследству, эти формы прионных болезней классифицируются как семейные. Семейные прионные заболевания, признаки и симптомы которых совпадают, включают семейную болезнь Крейтцфельдта-Якоба (CJD), синдром Герстманна-Штройсслера-Шейнкера (GSS) и фатальную семейную бессонницу (FFI).
Ген PRNP предоставляет инструкции по созданию белка, называемого прионным белком (PrP). Хотя точная функция этого белка неизвестна, исследователи предложили роль в нескольких важных процессах.К ним относятся транспортировка меди в клетки, защита клеток мозга (нейронов) от повреждений (нейрозащита) и связь между нейронами. При семейных формах прионного заболевания мутации гена PRNP приводят к образованию белка аномальной формы, известного как PrP Sc , из одной копии гена. В процессе, который до конца не изучен, PrP Sc может присоединяться (связываться) с нормальным белком (PrP C ) и способствовать его превращению в PrP Sc .Аномальный белок накапливается в головном мозге, образуя сгустки, которые повреждают или разрушают нейроны. Утрата этих клеток приводит к образованию микроскопических губчатых отверстий (вакуолей) в головном мозге, что приводит к появлению признаков и симптомов прионной болезни.
Хотя точная функция этого белка неизвестна, исследователи предложили роль в нескольких важных процессах.К ним относятся транспортировка меди в клетки, защита клеток мозга (нейронов) от повреждений (нейрозащита) и связь между нейронами. При семейных формах прионного заболевания мутации гена PRNP приводят к образованию белка аномальной формы, известного как PrP Sc , из одной копии гена. В процессе, который до конца не изучен, PrP Sc может присоединяться (связываться) с нормальным белком (PrP C ) и способствовать его превращению в PrP Sc .Аномальный белок накапливается в головном мозге, образуя сгустки, которые повреждают или разрушают нейроны. Утрата этих клеток приводит к образованию микроскопических губчатых отверстий (вакуолей) в головном мозге, что приводит к появлению признаков и симптомов прионной болезни.
Остальные 85–90 процентов случаев прионной болезни классифицируются как спорадические или приобретенные. Люди со спорадической прионной болезнью не имеют семейного анамнеза болезни и не имеют выявленной мутации в гене PRNP . Спорадическое заболевание возникает, когда PrP C спонтанно и по неизвестным причинам превращается в PrP Sc .Спорадические формы прионной болезни включают спорадическую болезнь Крейтцфельда-Якоба (sCJD), спорадическую фатальную бессонницу (sFI) и прионопатию, чувствительную к различным протеазам (VPSPr).
Спорадическое заболевание возникает, когда PrP C спонтанно и по неизвестным причинам превращается в PrP Sc .Спорадические формы прионной болезни включают спорадическую болезнь Крейтцфельда-Якоба (sCJD), спорадическую фатальную бессонницу (sFI) и прионопатию, чувствительную к различным протеазам (VPSPr).
Приобретенная прионная болезнь возникает в результате воздействия PrP Sc из внешнего источника. Например, вариант болезни Крейтцфельдта-Якоба (vCJD) представляет собой тип приобретенной прионной болезни у людей, которая возникает в результате употребления в пищу продуктов из говядины, содержащих PrP Sc , от крупного рогатого скота с прионной болезнью. У коров эта форма заболевания известна как губчатая энцефалопатия крупного рогатого скота (BSE) или, чаще, «коровье бешенство».Другим примером приобретенной прионной болезни человека является куру, которая была выявлена в популяции Саут-Форе в Папуа-Новой Гвинее. Заболевание передавалось, когда люди ели пораженные человеческие ткани во время каннибалистических похоронных ритуалов.
В редких случаях прионная болезнь может передаваться через случайное воздействие на ткани, загрязненные PrP Sc , во время медицинской процедуры. Этот тип прионного заболевания, на который приходится от 1 до 2 процентов всех случаев, классифицируется как ятрогенный.
Редкая причина серьезной деменции
Что такое прионные заболевания ?
Прионные болезни — это группа различных состояний, которые влияют на ваш мозг и нервную систему.Они могут вызвать тяжелое слабоумие или проблемы с контролем тела, которые очень быстро ухудшаются. Они редки — в США ежегодно регистрируется всего около 350 случаев прионных заболеваний.
Прионы — это крошечные белки, которые по какой-то причине сворачиваются таким образом, что повреждают здоровые клетки мозга. Вы можете иметь их в течение многих лет, прежде чем заметите какие-либо симптомы.
Прионные болезни вызывают деменцию, но не болезнь Альцгеймера. В болезнь Альцгеймера вовлечены разные гены и белки. Но причиной всех этих заболеваний, включая болезнь Альцгеймера, являются белки, которые не работают должным образом и повреждают клетки мозга.
Симптомы Альцгеймера могут ухудшаться медленно и постепенно в течение нескольких лет. Прионные заболевания быстро обостряются. Но, как и болезнь Альцгеймера, от прионных болезней нет лекарства.
Типы прионных болезней
Прионные болезни также называют трансмиссивными губчатыми энцефалопатиями или TSE. Их могут получить как люди, так и животные.
Продолжение
Прионные заболевания, поражающие людей, включают:
- Болезнь Крейтцфельдта-Якоба (CJD)
- Вариант болезни Крейтцфельдта-Якоба (VCJD)
- Герстманна-Штрауслера-Шейнкера
- Смертельная семейная бессонница
- Прионопатия с переменной чувствительностью к протеазам
Болезнь Крейтцфельдта-Якоба является наиболее распространенной.Обычно он поражает людей в возрасте около 60 лет. Вариант болезни Крейтцфельдта-Якоба может поражать более молодых людей.
Симптомы прионных заболеваний
Признаки прионных заболеваний включают внезапные изменения в настроении, памяти и движениях, в том числе:
Причины прионных заболеваний
Прионы — это крошечные белки в вашем мозгу, которые не действуют должным образом. Они неправильно складываются, растекаются, а затем заставляют другие белки принимать ту же неправильную форму.
Эти прионы неправильной формы накапливаются и образуют сгустки в вашем мозгу.Затем они убивают нейроны или клетки мозга, контролирующие вашу память, баланс и движения. Ваша иммунная система не может с ними бороться, поэтому погибает больше здоровых клеток.
Продолжение
Факторы риска прионной болезни
Большинство людей без видимых причин болеют прионными заболеваниями, такими как CJD. Факторы риска прионных заболеваний включают:
- Семейный анамнез. Около 15% людей заболевают прионными заболеваниями, потому что у них есть проблемный ген, называемый PRNP. Он может работать в семьях.
- Инфекции. Очень редко люди заражаются прионными заболеваниями от инфицированной ткани при операции по трансплантации или от нечистых инструментов, которые использовал хирург.
- Есть зараженное мясо. Возможно заразиться VCJD, если вы едите говядину, зараженную губчатой энцефалопатией крупного рогатого скота или коровьим бешенством.
Когда коровье бешенство разразилось среди крупного рогатого скота в Европе в 1990-х годах, у небольшого числа людей развился VCJD и они умерли. Четыре человека также заразились VCJD в результате переливания крови, когда донор был инфицирован.Чтобы снизить риск VCJD, страны изменили способ кормления крупного рогатого скота, а также методы сбора и обработки донорской крови.
Диагностика прионной болезни
Диагностировать прионную болезнь сложно. Если у вас есть такие симптомы, как слабоумие, ваш врач может сначала исключить другие возможные причины. Следующие тесты могут показать, вызваны ли ваши симптомы инсультом, опухолью головного мозга или воспалением:
- Спинальная пункция (также называемая люмбальной пункцией): врач вводит иглу между двумя вашими позвонками (костями в спине), чтобы извлечь образец жидкости вокруг головного и спинного мозга.
- МРТ (магнитно-резонансная томография): мощные магниты и радиоволны используются для получения подробных изображений вашего мозга.
- Компьютерная томография (компьютерная томография): несколько рентгеновских снимков, сделанных под разными углами, объединены, чтобы показать более четкое изображение вашего мозга.
Ваш врач может убедиться, что у вас прионное заболевание, только если он возьмет образец ткани вашего мозга (так называемая биопсия головного мозга). Но это опасная операция, поэтому она проводится только в том случае, если ваш врач считает, что у вас может быть другое заболевание, которое можно лечить по-другому.
Лечение прионных болезней
На данный момент лечение прионных заболеваний только облегчает симптомы. Среди них:
Людям с прионными заболеваниями часто становится хуже, и им требуется помощь в уходе за собой. Вам может понадобиться помощь в повседневных делах. Вам также может понадобиться катетер, чтобы помочь слить мочу, жидкости, чтобы избежать обезвоживания, или зонд для кормления, чтобы помочь вам есть.
Профилактика прионных заболеваний
Невозможно предотвратить прионные болезни, передаваемые в семьях. Эти шаги помогают снизить вероятность заражения прионными болезнями от инфекции или инфицированного мяса:
- Очистите и стерилизуйте медицинское оборудование.
- Не сдавайте ткани, если у вас прионная болезнь.
- Убедитесь, что мясо, которое вы едите, безопасно.
Новые правила, касающиеся коров и использования коровьих частей в кормах, ограничили распространение коровьего бешенства.
Прионные болезни | Центр памяти и старения
Прионные болезни вызываются аномальными прионами, микроскопическими инфекционными агентами, состоящими из белка. Прионы вызывают ряд заболеваний у различных млекопитающих, в том числе губчатую энцефалопатию крупного рогатого скота (коровье бешенство или ) у крупного рогатого скота и скрейпи у овец.
Существует три различных подтипа прионной болезни, разделенных на категории в зависимости от того, как болезнь передается. Все они немного отличаются по типичным признакам, симптомам и продолжительности болезни. Подтипы — спорадические, генетические и приобретенные.
Спорадические прионные болезни
- Спорадическая болезнь Крейтцфельда-Якоба (sCJD)
Причина «классической» или «спорадической» CJD неизвестна, что означает, что она возникает у людей без каких-либо известных факторов риска или генных мутаций.Типичные симптомы включают дисбаланс и нарушение координации, потерю памяти и нарушение мышления, а также психиатрические симптомы, такие как тревога или депрессия. Как только симптомы действительно появляются, CJD очень быстро прогрессирует и обычно заканчивается летальным исходом в течение нескольких месяцев после появления симптомов. sCJD обычно поражает людей в возрасте от 60 лет и редко встречается у людей моложе 40 лет. Спорадическая CJD — наиболее распространенная форма. - Спорадическая фатальная бессонница (sFI)
Подобно sCJD, sFI вызывается неправильно свернутым белком, но также, как sCJD, причина неправильного складывания этого белка неизвестна.Симптомы включают трудности с засыпанием (бессонницу), трудности при ходьбе, потерю веса и чрезмерные слезы на глазах. Симптомы быстро прогрессируют до потери сознания и смерти.
Генетические прионные болезни
- Семейная болезнь Крейтцфельда-Якоба (fCJD)
Унаследованные мутации в гене прионного белка ( PRNP ) вызывают семейную форму прионной болезни. Этот прионный ген предоставляет вашим клеткам инструкции относительно того, как производить прионный белок.При fCJD мутации в этом гене заставляют клетки производить аномальную форму прионного белка вместо нормальной формы. В большинстве случаев пациент с fCJD наследует измененный ген от одного больного родителя. У некоторых людей новая мутация в гене вызывает fCJD. Хотя у таких людей, скорее всего, нет пострадавшего родителя, они могут передать генетическое изменение своим детям. Симптомы зависят от типа мутации, но часто выглядят как классический CJD: проблемы с балансом и координацией, потеря памяти и нарушение мышления.Обычно эти симптомы появляются раньше при fCJD, чем при sCJD. Продолжительность болезни обычно больше, чем при спорадической форме. На генетически унаследованный подтип приходится около 15% случаев CJD. - Синдром Герстмана-Штраусслера-Шейнкера (GSS)
Болезнь Герстмана-Штрауслера-Шейнкера (GSS) — чрезвычайно редкое нейродегенеративное заболевание головного мозга. Он почти всегда передается по наследству и встречается только в нескольких семьях по всему миру. Заболевание обычно возникает в возрасте от 35 до 55 лет.На ранних стадиях пациенты могут испытывать атаксию различной степени (отсутствие мышечной координации), включая неуклюжесть, неустойчивость и трудности при ходьбе. По мере прогрессирования заболевания атаксия становится более выраженной, и у большинства пациентов развивается деменция. Другие симптомы могут включать дизартрию (невнятную речь), нистагм (непроизвольные движения глаз), спастичность (жесткий мышечный тонус) и нарушения зрения, иногда приводящие к слепоте. Также может возникнуть глухота. В некоторых семьях присутствуют черты паркинсонизма.Он наследуется по аутосомно-доминантному типу из-за изменения гена приона на хромосоме 20pter-p12. - Фатальная семейная бессонница (FFI)
Фатальная семейная бессонница (FFI) — очень редкое аутосомно-доминантное наследственное заболевание головного мозга. Ответственный за это доминантный ген был обнаружен всего в 28 семьях по всему миру; если ген есть только у одного из родителей, потомство имеет 50% шанс унаследовать его и заболеть. Переход пациента к полной бессоннице неизлечим и в конечном итоге фатален.Выделяют четыре стадии болезни. Первая стадия — прогрессирующая бессонница, признак фатальной семейной бессонницы. Первая стадия длится примерно четыре месяца и включает в себя набор психиатрических проблем, таких как панические атаки и причудливые фобии. Вторая стадия включает галлюцинации, панику, возбуждение и потливость и длится около пяти месяцев. Третий этап длится около трех месяцев и представляет собой полную бессонницу с похуданием. В этот момент человек выглядит намного старше и может испытывать недержание мочи.Четвертая стадия длится около шести месяцев и распознается как деменция, полная бессонница и внезапная смерть после потери речи.
Приобретенные прионные болезни
CJD, приобретенный в результате воздействия аномального прионного белка, составляет менее 1% известных случаев CJD . Важно понимать, что CJD, вызванный воздействием прионов, встречается крайне редко, — редкость. Есть три подтипа этой формы:
- Ятрогенная болезнь Крейтцфельда-Якоба (iCJD)
«Ятрогенная болезнь» буквально означает «вызванная врачом».«Таким образом, ятрогенное заболевание — это заболевание, связанное с врачом или лечением. Признаки и симптомы часто напоминают классический CJD. Возраст начала заболевания зависит от возраста экспозиции и времени инкубации. Число новых случаев iCJD резко упало, поскольку практика предотвращения заражения изменилась. Случаи CJD были связаны с лечением с использованием гормона роста, полученного из гипофиза человека. К счастью, в 1980-х годах была разработана синтетическая версия гормона роста человека, поэтому теперь гормон роста создается в лаборатории, а не у людей.Несколько случаев CJD были связаны с трансплантатами инфицированных тканей и трансплантатами от доноров, у которых оказалось, что CJD. Нет известных случаев, когда спорадическая или семейная форма CJD передавалась другим людям при переливании крови. Несколько случаев типа CJD, связанного с употреблением в пищу инфицированной говядины, передавались через переливание крови (см. Описание ниже). Доноры органов, тканей и крови теперь проходят скрининг на факторы риска БКЯ, и им не разрешается сдавать кровь, если они потенциально могут передать аномальные прионы реципиенту.Также было несколько случаев, связанных с зараженными инструментами, используемыми в хирургии головного мозга. Поскольку типичные процедуры стерилизации не устраняют аномальные прионы, текущие рекомендации состоят в том, чтобы уничтожить инструменты, которые использовались у пациента с CJD или подозрением на CJD. - Вариант болезни Крейтцфельда-Якоба (vCJD)
Эта форма была связана с употреблением в пищу говядины, зараженной губчатой энцефалопатией крупного рогатого скота (BSE или «коровье бешенство») у крупного рогатого скота. На ранних стадиях у пациентов часто наблюдаются изменения личности и психиатрические симптомы, такие как депрессия или ломка.Психиатрические симптомы часто являются наиболее заметным признаком ранней болезни БКЯ, но деменция развивается позже. Двигательные симптомы vCJD (спотыкание, падения и затруднения при ходьбе) также имеют тенденцию проявляться раньше при vCJD, чем при классической CJD. Расчетный инкубационный период составляет от 5 до 40 лет, а продолжительность болезни обычно составляет 12–14 месяцев после появления признаков и симптомов. vCJD поражает людей в возрасте от 20 лет, что намного раньше, чем у людей со спорадической CJD. Один человек с вариантом CJD был выявлен в Соединенных Штатах и один в Канаде, однако оба жили в Великобритании во время эпидемии BSE и заразились от заражения в Великобритании. - Куру
В 1950–1960-х годах куру достигло масштабов эпидемии в племени Саут-Форе в Папуа-Новой Гвинее. Хотя исследователи не знают, как это началось, они знают, что это распространилось, когда члены племени ритуально потребляли ткани пострадавших людей во время погребальных обрядов. Куру характеризуется проблемами при ходьбе, дрожанием конечностей, невнятной речью и изменениями настроения, но незначительным слабоумием или его отсутствием. Обычно это приводит к летальному исходу в течение 6–12 месяцев. Куру исчез с прекращением каннибалистических практик в Новой Гвинее.
Что такое прионные болезни человека?
Этот пост является частью серии, посвященной основам прионной болезни. Прочтите всю серию здесь.
Прионные болезни — это группа нейродегенеративных заболеваний, вызываемых прионами , которые представляют собой «белковые инфекционные частицы». Чтобы получить некоторую предысторию, сначала посмотрите это введение в прионы. Прионные заболевания вызываются неправильно свернутыми формами прионного белка, также известного как PrP. Эти болезни поражают не только людей, но и многих млекопитающих — например, скрепи у овец, коровье бешенство у коров и хроническое истощение у оленей.
Человеческие формы прионной болезни чаще всего называются болезнь Крейтцфельдта-Якоба (CJD), фатальная семейная бессонница (FFI), синдром Герцмана-Штрауслера-Шейнкера (GSS), kuru и variably -чувствительная прионопатия (VPSPr). Все эти заболевания вызываются лишь немного разными версиями одного и того же белка, поэтому мы называем их все прионными заболеваниями.
Несмотря на то, что прионные болезни имеют несколько разные формы, у них много общего.При каждом заболевании прионный белок (PrP) сворачивается неправильно, превращаясь в прион , а затем заставляет другие молекулы PrP делать то же самое. Затем прионы могут «тихо» распространяться по мозгу человека в течение многих лет, не вызывая никаких симптомов. В конце концов прионы начинают убивать нейроны, и как только проявляются симптомы, у человека происходит очень быстрое снижение когнитивных функций. Большинство прионных заболеваний приводит к летальному исходу в течение нескольких месяцев, хотя некоторые могут длиться несколько лет [Pocchiari 2004].
Прионные болезни у людей встречаются довольно редко — от 1 до 2 человек на 1 миллион человек ежегодно умирают от прионной болезни [Klug 2013].Прионные заболевания могут возникать одним из трех способов: приобретенным, генетическим или спорадическим.
Приобретенный означает, что человек подвергается воздействию прионов и заражается. Несмотря на то, что прионы опасны, их очень трудно поймать, поэтому инфекция — наименее распространенный способ заражения прионным заболеванием. В Папуа-Новой Гвинее была знаменитая эпидемия куру , прионной болезни, которая передавалась от человека к человеку в результате каннибализма, но сейчас она в основном утихла. Затем идет коровье бешенство, болезнь или губчатая энцефалопатия крупного рогатого скота, .Это заболевание передалось от коров к человеку через зараженную пищу. Человеческая форма болезни называется вариант болезни Крейтцфельда-Якоба (vCJD) и с 1994 года унесла жизни около 200 человек в Великобритании [UK CJD Survelliance]. Сегодня ежегодно от этой болезни умирает всего несколько человек. Также были случаи, когда прионная болезнь передавалась через зараженные хирургические инструменты, добавки с гормоном роста человека или трансплантаты твердой мозговой оболочки (ткани, окружающей мозг).Эти медицинские инфекции называются « ятрогенными » инфекциями.
Прионные болезни также могут быть генетическими . Для начала вспомним основы биологии. ДНК содержит инструкции, которые переписываются в РНК, а затем инструкции в РНК переводятся в белок. Таким образом, изменения в ДНК человека могут вызывать изменения в белках, производимых их клетками. У каждого есть ген под названием PRNP , который кодирует белок под названием PrP, и в большинстве случаев этот белок совершенно здоров и прекрасен.У некоторых людей есть мутации в ДНК их гена PRNP , которые заставляют его продуцировать мутантные формы PrP. Эти мутантные формы не образуют прионы мгновенно, и большинство людей с мутациями PRNP живут совершенно здоровыми в течение десятилетий. Но по мере того, как люди становятся старше, мутантные формы PrP с большей вероятностью складываются неправильным образом и образуют прионы. Как только они это сделают, у человека будет быстрое нейродегенеративное заболевание.
Некоторые люди называют генетические прионные болезни « унаследованными » или « семейными » прионными болезнями.Мы предпочитаем не использовать эти термины: только потому, что болезнь является генетической, не означает, что она наследственная или семейная. Каждая мутация ДНК должна где-то начинаться, поэтому некоторые люди с генетическим прионным заболеванием являются первыми в своей семье — они не унаследовали мутацию, и она не является семейной. Согласно одной из оценок, 60% пациентов с генетической прионной болезнью не имеют семейной истории болезни [Bechtel & Geschwind 2013].
Наконец, прионные заболевания могут быть просто спорадическими , что означает, что мы не знаем, почему они возникают.Некоторые люди думают, что спорадические прионные заболевания возникают, когда один прионный белок случайно неправильно складывается, а затем распространяется оттуда. Другие считают, что болезнь может начаться с одной клетки, которая имеет спонтанную мутацию ДНК и начинает продуцировать мутантный PrP. Мы не знаем, каков настоящий ответ. В любом случае, эффект заключается в том, что люди, ранее не подвергавшиеся воздействию прионов и не имевшие мутаций в (большей части) своей ДНК, в конечном итоге получали прионную болезнь из ниоткуда.
Спорадическая форма прионной болезни является наиболее распространенной.Часто считается, что случаи прионной болезни человека на 85% являются спорадическими, 15% — генетическими и <1% - приобретенными [Appleby & Lyketsos 2011, CDC Fact Sheet, UCSF Primer].
Таким образом, прионные заболевания можно разделить на категории по происхождению: приобретенные, спорадические и генетические. Но, как упоминалось в начале этого поста, вы также услышите, что прионные заболевания классифицируются по-другому, чаще всего как болезнь Крейтцфельдта-Якоба (CJD) , фатальная семейная бессонница (FFI) и Gerstmann-Straussler- Синдром Шейнкера (GSS) .Происхождение и использование этих имен может сбивать с толку. Первоначально эти имена использовались для классификации пациентов по их симптомам, но позже стали относиться к конкретным штаммам или генетическим разновидностям прионных заболеваний.
Например, название «фатальная семейная бессонница» первоначально применялось к семье с генетическим заболеванием с бессонницей в качестве первого и главного симптома [Lugaresi 1986]. После того, как позже было обнаружено, что конкретная генетическая мутация вызвала это заболевание [Medori 1992], люди начали использовать FFI для обозначения болезни, вызванной этой конкретной мутацией, хотя для некоторых пациентов бессонница не является основной частью болезни [ Zarranz 2005].Позже ученые открыли негенетическую форму FFI и назвали ее спорадической фатальной бессонницей (SFI) [Parchi 1999], но другие люди рассматривают ее как подтип CJD и называют ее «таламической болезнью Крейтцфельдта-Якоба MM2» [Moda 2012].
Чтобы добавить еще один уровень сложности, все еще открываются новые типы прионных болезней, которые не вписываются ни в одну из трех исходных категорий (CJD, FFI или GSS). Например, самая последняя новая форма получила название «прионопатия с переменной чувствительностью к протеазам» (VPSPr) [Zou 2010].Это довольно тяжело.
Поскольку система именования может сбивать с толку, мы обычно вообще избегаем ее и просто относим все эти болезни к прионным болезням . Для генетических прионных заболеваний полезно назвать точную мутацию — например, E200K или P102L (о том, как интерпретировать эти цифры и буквы, см. В нашем готовящемся учебнике по генетическим прионным заболеваниям). Что касается спорадических прионных заболеваний, у ученых есть система биохимических подтипов, таких как «MV1 ″,« VV2 ″, «MM2 кортикальный» и так далее.
Одна из удивительных особенностей прионного белка заключается в том, что этот единственный белок может сворачиваться множеством различных способов, которые являются токсичными и вызывают болезнь. На диаграмме ниже показано, как только один белок — PrP (зеленый) — может сворачиваться несколькими разными способами, создавая несколько разных штаммов приона (красный).
На самом деле существует головокружительное количество различных форм прионной болезни человека. Куру и vCJD, два штамма, которые люди заразились в результате инфекции, вероятно, самые известные, но также и самые редкие.Существует также по крайней мере 6 штаммов спорадической прионной болезни [Parchi 2011] и более 40 генетических мутаций, вызывающих прионную болезнь [Beck 2010].
Многие из этих различных штаммов прионов действуют по-разному. Они происходят из разных источников, вызывают разные симптомы заболевания и поражают людей разного возраста. Но поскольку все они вызваны одним и тем же белком — PrP — мы надеемся, что удастся найти одно лекарство, которое будет лечить все эти различные заболевания.
Прионные болезни: ПРОДОЛЖЕНИЕ: Непрерывное обучение в неврологии
В этой статье представлена обновленная информация о клинических аспектах прионной болезни человека, включая широкий спектр их проявлений.
Прионные болезни, группа заболеваний, вызываемых белками аномальной формы, называемыми прионами, возникают спорадически (болезнь Якоба-Крейтцфельдта), генетически (генетическая болезнь Якоба-Крейтцфельдта, синдром Герстмана-Штраюсслера-Шейнкера и фатальная семейная бессонница) и приобретенные (Куру, вариант болезни Якоба-Крейтцфельдта и ятрогенная болезнь Якоба-Крейтцфельдта) формы. В статье представлена обновленная информация о клинических особенностях и методах диагностики прионных заболеваний человека. Новые прижизненные потенциальные диагностические тесты, основанные на амплификации прионов для их обнаружения, демонстрируют очень высокую специфичность.Понимание разнообразия возможных проявлений прионных заболеваний человека продолжает развиваться, при этом некоторые генетические формы медленно прогрессируют в течение десятилетий, начиная с дизавтономии и невропатии и заканчивая лобно-исполнительной деменцией с патологией комбинированной прионопатии и таупатии. К сожалению, на сегодняшний день все клинические испытания прионной болезни человека не показали положительного эффекта в отношении выживаемости. Недавно был идентифицирован очень редкий полиморфизм в гене прионного белка, который, по-видимому, защищает от прионной болезни; это открытие, в дополнение к более глубокому пониманию прионоподобных механизмов нейродегенеративных расстройств, может привести к потенциальным методам лечения.
Спорадическая болезнь Якоба-Крейтцфельдта — наиболее распространенная форма прионной болезни человека. Генетические прионные заболевания, возникающие в результате мутаций в гене прионного белка ( PRNP ), классифицируются на основе мутации, клинического фенотипа и невропатологических особенностей и могут быть трудными для диагностики из-за их разнообразного проявления. Возможно, наиболее актуальным для этой проблемы Continuum о нейроинфекционных заболеваниях являются приобретенные прионные заболевания, вызываемые случайной передачей человеку, но, к счастью, они являются наименее распространенной формой и становятся все реже, поскольку осознание риска передачи привело к принятию мер по предотвращению такие случаи.
Прионных болезней — близко к эффективной терапии?
Will, R.G. et al. Новый вариант болезни Крейтцфельдта – Якоба в Великобритании. Ланцет 347 , 921–925 (1996). Первое признание удивительного зооноза: губчатой энцефалопатии крупного рогатого скота у людей.
CAS Статья PubMed Google Scholar
Култхарт, М. Б. и Кэшман, Н. Р. Вариант Болезнь Крейтцфельдта – Якоба: обзор современных научных знаний в отношении общественного здравоохранения. CMAJ 165 , 51–58 (2001).
CAS PubMed PubMed Central Google Scholar
Гани, А. К., Доннелли, К. А., Фергюсон, Н. М. и Андерсон, Р. М. Обновленные прогнозы будущих смертей от vCJD в Великобритании. BMC Infect. Дис. 3 , 4 (2003).
PubMed PubMed Central Статья Google Scholar
Ллевелин, К.A. et al. G. Возможная передача варианта болезни Крейтцфельдта – Якоба при переливании крови. Ланцет 363 , 417–421 (2004). Второе описание передачи через кровь любого прионного заболевания человека на хорошо известном фоне ятрогенной передачи через загрязненный прионами гормон роста, твердую мозговую оболочку, роговицу и нейрохирургические инструменты.
CAS PubMed PubMed Central Статья Google Scholar
Коллинз, С.J. et al. Хинакрин не продлевает выживаемость на мышиной модели болезни Крейтцфельдта – Якоба. Ann. Neurol. 52 , 503–506 (2002).
CAS PubMed Статья Google Scholar
Wadsworth, J. D. et al. Тканевое распределение протеазорезистентного прионного белка при варианте болезни Крейтцфельдта – Якоба с использованием высокочувствительного анализа иммуноблоттинга. Ланцет 358 , 171–180 (2001).
CAS PubMed PubMed Central Статья Google Scholar
Bruce, M. E. et al. Передача мышам указывает на то, что «новый вариант» CJD вызывается агентом BSE. Nature 389 , 498–501 (1997).
CAS PubMed Статья Google Scholar
Hill, A. F. et al. Один и тот же штамм прионов вызывает vCJD и BSE. Nature 389 , 448–450 (1997).
CAS PubMed Статья Google Scholar
Департамент окружающей среды, продовольствия и сельских районов: веб-страница BSE [онлайн], & lt; http: //www.defra.gov.uk/animalh/bse/index.html> (2004).
Доннелли, К. А., Фергюсон, Н. М., Гани, А. К. и Андерсон, Р. М. Значение данных скрининга на инфекцию ГЭКРС для масштабов эпидемии ГЭКРС в Великобритании и текущих уровней инфицирования в Европе. Proc.R. Soc. Лондон. B Biol. Sci. 269 , 2179–2190 (2002).
Артикул Google Scholar
Шредер Б. Э. и Сомервилл Р. А. Губчатая энцефалопатия крупного рогатого скота у овец? Rev. Sci. Tech. 22 , 103–120 (2003).
CAS PubMed Статья Google Scholar
Baylis, M. et al. BSE — волк в овечьей шкуре. Trends Microbiol. 10 , 563–570 (2002).
CAS PubMed Статья Google Scholar
Houston, F. et al. Прионные болезни: BSE у овец, разводимых на устойчивость к инфекциям. Природа 423 , 498 (2003).
CAS PubMed Статья Google Scholar
Уильямс, Э. С. и Янг, С. Хроническая болезнь истощения у содержащихся в неволе оленей-мулов: губчатая энцефалопатия. J. Wildl. Дис. 16 , 89–98 (1980).
CAS PubMed Статья Google Scholar
Браун П. и Брэдли Р. 1755 и все такое: исторический учебник по трансмиссивной губчатой энцефалопатии. BMJ 317 , 1688–1692 (1998).
CAS PubMed PubMed Central Статья Google Scholar
Страховка, Е.D. et al. Хроническая болезнь истощения и потенциальная передача людям. Emerging Infect. Дис. 10 , (2004).
Riesner, D. et al. Прионы и нуклеиновые кислоты: поиск «остаточных» нуклеиновых кислот и скрининг мутаций в гене PrP. Dev. Биол. Стоять. 80 , 173–181 (1993).
CAS PubMed Google Scholar
Гриффит Дж. С. Самовоспроизведение и скрепи. Nature 215 , 1043–1044 (1967). Первое предложение вероятных механизмов, с помощью которых агенты TSE (теперь называемые прионами) могли реплицироваться как инфекционные белки. Представленные механизмы на удивление близки к тем, которые сегодня предпочитают; то есть, патологический агент, как предполагалось, представляет собой аномальное олигомерное состояние белка-хозяина, которое матрицирует, автокатализирует или зародышеобразовывает посттрансляционные конформационные изменения в своем нормальном аналоге.
CAS PubMed Статья Google Scholar
Прусинер, С.Б. Новые белковые инфекционные частицы вызывают скрейпи. Наука 216 , 136–144 (1982). Эта статья была первой монетой для термина «прионы» для инфекционных агентов TSE, и убедительно возобновляет аргумент, что эти агенты образуют новый класс патогенов, лишенных нуклеиновых кислот. Предлагаемые здесь только белковые механизмы для репликации прионов включают обратную трансляцию, белок-направленный синтез белка и направленное белком изменение экспрессии гена прионного белка, ни один из которых, похоже, сегодня не применим.
CAS PubMed PubMed Central Статья Google Scholar
Прусинер, С. Б. Прионс. Proc. Natl Acad. Sci. USA 95 , 13363–13383 (1998).
CAS PubMed PubMed Central Статья Google Scholar
Браун П., Гольдфарб Л. Г. и Гайдусек Д. К. Новая биология губчатой энцефалопатии: инфекционные амилоидозы с генетической особенностью. Ланцет 337 , 1019–1022 (1991).
CAS PubMed Статья Google Scholar
Caughey, B. W. et al. Анализ вторичной структуры белка PrP 27-30, связанного со скрепи, в воде с помощью инфракрасной спектроскопии. Биохимия 30 , 7672–7680 (1991). Первое исследование, выявившее высокое содержание β-листов в инфекционных препаратах PrP Sc .
CAS PubMed PubMed Central Статья Google Scholar
Сафар, Дж., Роллер, П. П., Гайдусек, Д. К. и Гиббс, К. Дж. Мл. Конформационные переходы, диссоциация и развертывание амилоидного (прионного) белка скрепи. J. Biol. Chem. 268 , 20276–20284 (1993).
CAS PubMed Google Scholar
Пан, К. -М.и другие. Превращение α-спиралей в β-листы участвует в образовании прионного белка скрепи. Proc. Natl Acad. Sci. USA 90 , 10962–10966 (1993). Первое исследование, показывающее высокое α-спиральное содержание PrP C , предоставляющее доказательства того, что конформационные изменения в PrP C важны для его преобразования в PrP Sc .
CAS Статья PubMed Google Scholar
Риек, Р., Hornemann, S., Wider, G., Glockshuber, R. & Wuthrich, K. ЯМР-характеристика полноразмерного рекомбинантного мышиного прионного белка, m PrP (23-21). FEBS Lett. 413 , 282–288 (1997). Первое знакомство с полноразмерным нормальным прионным белком при атомном разрешении. Следует за первым определением трехмерной структуры фрагмента PrP теми же группами.
CAS PubMed PubMed Central Статья Google Scholar
Оеш, Б.и другие. Клеточный ген кодирует белок PrP 27-30 скрепи. Cell 40 , 735–746 (1985).
CAS PubMed Статья PubMed Central Google Scholar
Мейер, Р. К. и др. Разделение и свойства клеточного и прионного белка скрепи. Proc. Natl Acad. Sci. USA 83 , 2310–2314 (1986).
CAS PubMed Статья Google Scholar
Caughey, B., Race, R. E. & Chesebro, B. Обнаружение мРНК прионного белка в нормальных и инфицированных скрепи тканях и клеточных линиях. J. Gen. Virol. 69 , 711–716 (1988).
CAS PubMed Статья Google Scholar
Bendheim, P.E. et al. Практически повсеместное распространение белка-предшественника агента скрепи в тканях. Неврология 42 , 149–156 (1992).
CAS PubMed Статья PubMed Central Google Scholar
Прусинер, С.Б. Молекулярная биология прионных болезней. Наука 252 , 1515–1522 (1991).
CAS PubMed Статья Google Scholar
Коме, Дж. Х., Фрейзер, П. Э. и Лэнсбери, П. Т. младший. Кинетическая модель образования амилоида при прионных заболеваниях: важность посева. Proc. Natl Acad. Sci. США 90 , 5959–5963 (1993).
CAS PubMed PubMed Central Статья Google Scholar
Коциско, Д.A. et al. Бесклеточное образование протеазорезистентного прионного белка. Nature 370 , 471–474 (1994).
CAS Статья PubMed Google Scholar
Bessen, R.A. et al. Негенетическое распространение штамм-специфичных фенотипов прионного белка скрепи. Nature 375 , 698–700 (1995).
CAS PubMed Статья Google Scholar
Caughey, B.и другие. Взаимодействия и превращения изоформ прионных белков. Adv. Protein Chem. 57 , 139–169 (2001).
CAS Статья PubMed Google Scholar
Саборио, Г. П., Перманн, Б. и Сото, С. Чувствительное обнаружение патологического прионного белка путем циклической амплификации неправильного свертывания белка. Nature 411 , 810–813 (2001).
CAS Статья PubMed Google Scholar
Хилл, А.F., Antoniou, M. и Collinge, J. Протеазо-устойчивый прионный белок, продуцируемый in vitro , не обладает обнаруживаемой инфекционностью. J. Gen. Virol. 80 , 11–14 (1999).
CAS PubMed PubMed Central Статья Google Scholar
Бессен, Р. А. и Марш, Р. Ф. Отличительные свойства PrP предполагают молекулярную основу вариабельности штаммов при трансмиссивной энцефалопатии норок. J. Virol. 68 , 7859–7868 (1994).
CAS PubMed PubMed Central Google Scholar
Ласмезас, К. И. и др. Передача агента BSE мышам в отсутствие обнаруживаемого аномального прионного белка. Наука 275 , 402–405 (1997).
CAS Статья PubMed Google Scholar
Manson, J. C. et al.Изменение одной аминокислоты (101L), введенное в мышиный PrP, резко изменяет время инкубации трансмиссивной губчатой энцефалопатии. EMBO J. 18 , 6855–6864 (1999).
CAS PubMed PubMed Central Статья Google Scholar
Caughey, B., Kocisko, D. A., Raymond, G. J. & Lansbury, P. T. Агрегаты прионного белка, ассоциированного со скрепи, индуцируют бесклеточное преобразование протеазочувствительного прионного белка в устойчивое к протеазе состояние. Chem. Биол. 2 , 807–817 (1995).
CAS PubMed Статья Google Scholar
Коциско, Д. А., Лэнсбери, П. Т. мл. И Коуги, Б. Частичное разворачивание и рефолдинг прионного белка, ассоциированного со скрепи: доказательства критического С-концевого домена размером 16 кДа. Биохимия 35 , 13434–13442 (1996).
CAS PubMed Статья Google Scholar
Сафар, Дж.и другие. Восемь штаммов прионов имеют молекулы PrP (Sc) с различной конформацией. Nature Med. 4 , 1157–1165 (1998).
CAS Статья PubMed Google Scholar
Caughey, B., Raymond, G.J., Kocisko, D. A. & Lansbury, P. T., Jr. Инфекционность Scrapie коррелирует с конвертирующей активностью, устойчивостью к протеазам и агрегацией прионного белка, связанного со скрепи, в исследованиях денатурации гуанидина. J. Virol. 71 , 4107–4110 (1997).
CAS PubMed PubMed Central Google Scholar
Chiesa, R. et al. Накопление протеазо-устойчивого прионного белка (PrP) и апоптоз гранулярных клеток мозжечка у трансгенных мышей, экспрессирующих инсерционную мутацию PrP. Proc. Natl Acad. Sci. USA 97 , 5574–5579 (2000).
CAS PubMed Статья Google Scholar
Tremblay, P.и другие. Мутантные конформеры PrP Sc , индуцированные синтетическим пептидом и несколькими штаммами прионов. J. Virol. 78 , 2088–2099 (2004).
CAS PubMed PubMed Central Статья Google Scholar
Legname, G. et al. Синтетические прионы млекопитающих. Наука 305 , 673–676 (2004).
CAS Статья PubMed PubMed Central Google Scholar
Бюлер, Х.и другие. Мыши, лишенные PrP, устойчивы к скрепи. Cell 73 , 1339–1347 (1993).
CAS PubMed Статья Google Scholar
Caughey, B., Ernst, D. & Race, R.E. Ингибирование репликации скрепи-агента Конго красным. J. Virol. 67 , 6270–6272 (1993).
CAS PubMed PubMed Central Google Scholar
Бонс, Н.и другие. Естественное и экспериментальное заражение полости рта нечеловеческих приматов агентами губчатой энцефалопатии крупного рогатого скота. Proc. Natl Acad. Sci. США 96 , 4046–4051 (1999).
CAS PubMed Статья Google Scholar
Сигурдсон, К. Дж., Спракер, Т. Р., Миллер, М. В., Ош, Б. и Гувер, Е. А. ПрП (CWD) в миентеральном сплетении, вагосимпатическом стволе и эндокринных железах оленей с хронической болезнью истощения. J. Gen. Virol. 82 , 2327–2334 (2001).
CAS PubMed PubMed Central Статья Google Scholar
Бикс, М. и Макбрайд, П. А. Раннее накопление патологического PrP в кишечной нервной системе и кишечной лимфоидной ткани хомяков, перорально инфицированных скрепи. Neurosci. Lett. 278 , 181–184 (2000).
CAS PubMed PubMed Central Статья Google Scholar
Мабботт, Н.А. и Брюс, М. Е. Иммунобиология заболеваний TSE. J. Gen. Virol. 82 , 2307–2318 (2001).
CAS PubMed Статья Google Scholar
Кимберлин Р. Х. и Уокер К. А. Роль селезенки в нейроинвазии скрепи у мышей. Virus Res. 12 , 201–212 (1989).
CAS Статья PubMed Google Scholar
Брюс, М.Е., МакКоннелл, И., Уилл, Р. Г. и Айронсайд, Дж. У. Выявление вариантной инфекционности болезни Крейтцфельда – Якоба в экстраневральных тканях. Ланцет 358 , 208–209 (2001).
CAS PubMed Статья Google Scholar
Брюс М. Э., Браун К. Л., Мабботт Н. А., Фаркуар С. Ф. и Джеффри М. Фолликулярные дендритные клетки в патогенезе TSE. Immunol. Сегодня 21 , 442–446 (2000).
CAS PubMed Статья Google Scholar
Montrasio, F. et al. Нарушение репликации прионов в селезенке мышей, лишенных функциональных фолликулярных дендритных клеток. Наука 288 , 1257–1259 (2000).
CAS PubMed PubMed Central Статья Google Scholar
Klein, M.A. et al. Решающая роль В-клеток в нейроинвазивном скрейпи. Nature 390 , 687–690 (1997).
CAS Статья PubMed Google Scholar
Mabbott, N.A. et al. Мыши с α-дефицитом фактора некроза опухоли, но не с дефицитом интерлейкина-6, сопротивляются периферической инфекции с помощью скрепи. J. Virol. 74 , 3338–3344 (2000).
CAS PubMed PubMed Central Статья Google Scholar
Коричневый, К.L. et al. Репликация скрепи в лимфоидных тканях зависит от фолликулярных дендритных клеток, экспрессирующих прионный белок. Nature Med. 5 , 1308–1312 (1999).
CAS PubMed PubMed Central Статья Google Scholar
Matsumoto, M. et al. Роль лимфотоксина и рецептора TNF типа I в формировании зародышевых центров. Наука 271 , 1289–1291 (1996).
CAS PubMed PubMed Central Статья Google Scholar
Мабботт, Н.А., Брюс, М. Е., Ботто, М., Уолпорт, М. Дж. И Пепис, М. Б. Временное истощение компонента С3 комплемента или генетический дефицит C1q значительно задерживают начало скрейпи. Nature Med. 7 , 485–487 (2001).
CAS Статья PubMed Google Scholar
McBride, P.A., Eikelenboom, P., Kraal, G., Fraser, H. & Bruce, M.E. Белок PrP связан с фолликулярными дендритными клетками селезенки и лимфатических узлов у неинфицированных и инфицированных скрепи мышей. J. Pathol. 168 , 413–418 (1992).
CAS PubMed Статья Google Scholar
Хайкенвальдер М., Принц М., Хеппнер Ф. Л. и Агуцци А. Современные концепции и противоречия в прионной иммунопатологии. J. Mol. Neurosci. 23 , 3–12 (2004).
CAS PubMed Статья Google Scholar
Браун, Д.Р., Шмидт Б. и Кретчмар Х. А. Роль микроглии и прионного белка хозяина в нейротоксичности фрагмента прионного белка. Nature 380 , 345–347 (1996).
CAS PubMed Статья Google Scholar
Klein, M.A. et al. Комплемент способствует раннему патогенезу прионов. Nature Med. 7 , 488–492 (2001).
CAS Статья PubMed Google Scholar
Гадюсек, Д.C. в Field’s Virology , 3-е издание (ред. Филдс, Б. Н., Книп, Д. М. и Хоули, П. М.) 2851–2900 (Липпинкотт – Рэйвен, Филадельфия, 1996).
Google Scholar
Enari, M., Flechsig, E. & Weissmann, C. Накопление прионного белка Скрепи инфицированными скрепи клетками нейробластомы прекращается воздействием антитела к прионному белку. Proc. Natl Acad. Sci. США 98 , 9295–9299 (2001). Первая из серии статей, вселяющих надежду на иммунотерапию прионной инфекции, которая следует за демонстрацией антителами ингибирования бесклеточной конверсии PrP в ссылке 75.
CAS PubMed PubMed Central Статья Google Scholar
Peretz, D. et al. Антитела подавляют размножение прионов и очищают культуры клеток от инфекционности прионов. Nature 412 , 739–743 (2001)
CAS Статья PubMed Google Scholar
Perrier, V., et al. Антитела против PrP блокируют репликацию PrPSc в культурах клеток, инфицированных прионами, ускоряя деградацию PrPC. J. Neurochem. 89 , 454–463 (2004).
CAS PubMed PubMed Central Статья Google Scholar
Heppner, F. L. et al. Предотвращение патогенеза скрепи путем трансгенной экспрессии антител к прионному белку. Наука 294 , 178–182 (2001).
CAS PubMed PubMed Central Статья Google Scholar
Белый, А.R. et al. Моноклональные антитела подавляют репликацию прионов и задерживают развитие прионной болезни. Nature 422 , 80–83 (2003).
CAS PubMed Статья Google Scholar
Solforosi, L. et al. Сшивающий клеточный прионный белок запускает апоптоз нейронов in vivo . Наука 303 , 1514–1516 (2004).
CAS Статья PubMed Google Scholar
Mouillet-Richard, S.и другие. Передача сигнала через прионный белок. Наука 289 , 1925–1928 (2000).
CAS PubMed Статья Google Scholar
Cashman, N. R. et al. Клеточная изоформа белка агента скрепи участвует в активации лимфоцитов. Cell 61 , 185–192 (1990).
CAS PubMed Статья Google Scholar
Хориучи, М., Chabry, J. & Caughey, B. Специфическое связывание нормального прионного белка с формой скрепи через локализованный домен инициирует его преобразование в состояние, устойчивое к протеазам. EMBO J. 18 , 3193–3203 (1999).
CAS PubMed PubMed Central Статья Google Scholar
Caughey, B. & Raymond, G.J. Ассоциированная со скрепи форма PrP производится из предшественника клеточной поверхности, который является чувствительным как к протеазе, так и к фосфолипазе. J. Biol. Chem. 266 , 18217–18223 (1991).
CAS PubMed Google Scholar
Caughey, B., Raymond, GJ, Ernst, D. & Race, RE Укорочение N-конца связанной со скрепи формы PrP лизосомной протеазой (ами): последствия, касающиеся сайта превращения PrP в состояние, устойчивое к протеазам. J. Virol. 65 , 6597–6603 (1991).
CAS PubMed PubMed Central Google Scholar
Борчелт, Д.Р., Тарабулос, А. и Прусинер, С. Б. Доказательства синтеза прионного белка скрепи в эндоцитарном пути. J. Biol. Chem. 267 , 16188–16199 (1992).
CAS PubMed Google Scholar
Тарабулос А., Ребер А. Дж., Борчелт Д. Р., Сербан Д. и Прусинер С. Б. Синтез и транспортировка прионных белков в культивируемых клетках. Мол. Биол. Клетка. 3 , 851–863 (1992).
CAS PubMed PubMed Central Статья Google Scholar
Paramithiotis, E. et al. Эпитоп прионного белка, селективный в отношении патологически неправильно свернутой конформации. Nature Med. 9 , 893–899 (2003). Первый прионный эпитоп, основанный на гипотезе.
CAS PubMed PubMed Central Статья Google Scholar
Лехто, М.Т., Эшман Д. А. и Кэшман Н. Р. Обработка клеток ScN2a прион-специфическими антителами против YYR. Proc. Первая международная конференция. Совершенство сети: Neuroprion (Париж, 2004 г.).
Google Scholar
Schenk, D. et al. Иммунизация амилоидом-β ослабляет патологию, подобную болезни Альцгеймера, у мышей PDAPP. Nature 400 , 173–177 (1999).
CAS Статья PubMed Google Scholar
Orgogozo, J.M. et al. Подострый менингоэнцефалит в подгруппе пациентов с БА после иммунизации Aβ42. Неврология 61 , 46–54 (2003).
CAS PubMed Статья Google Scholar
Mallucci, G. et al. Истощение нейронального PrP при прионной инфекции предотвращает заболевание и обращает вспять спонгиоз. Наука 302 , 871–874 (2003). В сочетании со ссылкой 158 эта статья предоставляет доказательства того, что снижение экспрессии PrP C может быть разумным терапевтическим подходом.
CAS PubMed Статья Google Scholar
Shyng, S. L., Lehmann, S., Moulder, K. L. & Harris, D. A. Сульфатированные гликаны стимулируют эндоцитоз клеточной изоформы прионного белка PrP C в культивируемых клетках. J. Biol. Chem. 270 , 30221–30229 (1995).
CAS PubMed Статья Google Scholar
Тарабулос, А.и другие. Истощение холестерина и модификация СООН-концевой нацеливающей последовательности прионного белка ингибируют образование изоформы скрепи. J. Cell. Биол. 129 , 121–132 (1995).
CAS PubMed Статья Google Scholar
Рэйс, Р. Э., Фаднесс, Л. Х. и Чезебро, Б. Характеристика инфекции скрепи в клетках нейробластомы мыши. J. Gen. Virol. 68 , 1391–1399 (1987).
PubMed Статья Google Scholar
Батлер, Д. А. и др. Клетки нейробластомы мыши, инфицированные скрепи, продуцируют устойчивые к протеазе прионные белки. J. Virol. 62 , 1558–1564 (1988).
CAS PubMed PubMed Central Google Scholar
Кларк М. и Хейг Д. А. Доказательства размножения возбудителя скрепи в культуре клеток. Природа 225 , 100–101 (1970).
CAS PubMed Статья Google Scholar
Schatzl, H. M. et al. Линия нейронных клеток гипоталамуса, постоянно инфицированная прионами скрепи, демонстрирует апоптоз. J. Virol. 71 , 8821–8831 (1997).
CAS PubMed PubMed Central Google Scholar
Ворберг, И., Рейнс, А., Стори, Б. и Приола, С. А. Восприимчивость обычных клеточных линий фибробластов к возбудителям трансмиссивной губчатой энцефалопатии. J. Infect. Дис. 189 , 431–439 (2004).
CAS PubMed PubMed Central Статья Google Scholar
Sabuncu, E. et al. Полиморфизм PrP строго контролирует репликацию прионов овцы в культивируемых клетках. J. Virol. 77 , 2696–2700 (2003).
CAS PubMed PubMed Central Статья Google Scholar
Рудык, Х. и др. Скрининг Congo Red и его аналогов на их способность предотвращать образование PrP-res в клетках, инфицированных скрепи. J. Gen. Virol. 81 , 1155–1164 (2000).
CAS PubMed Статья Google Scholar
Коциско Д.А. и др.Новые ингибиторы образования прионных белков, связанных со скрепи, в библиотеке из 2000 лекарственных и натуральных продуктов. J. Virol. 77 , 10288–10294 (2003). Широкий и высокопроизводительный скрининг широкого спектра соединений для ингибирования образования PrP Sc , основанный на работе ссылки 93.
CAS PubMed PubMed Central Статья Google Scholar
Supattapone, S.и другие. Разветвленные полиамины лечат клетки нейробластомы, инфицированные прионами. J. Virol. 75 , 3453–3461 (2001).
CAS PubMed PubMed Central Статья Google Scholar
Birkett, C. R. et al. Штаммы Scrapie сохраняют биологические фенотипы при размножении в клеточной линии в культуре. EMBO J. 20 , 3351–3358 (2001).
CAS PubMed PubMed Central Статья Google Scholar
Максон, Л., Wong, C., Herrmann, L.M, Caughey, B. & Baron, G.S. Твердофазный анализ для идентификации модуляторов взаимодействий прионных белков. Анал. Биохим. 323 , 54–64 (2003).
CAS PubMed Статья Google Scholar
Horiuchi, M., Baron, G. S., Xiong, L. W. и Caughey, B. Ингибирование взаимодействий и взаимных превращений изоформ прионного белка пептидными фрагментами из С-концевого сложенного домена. J. Biol. Chem. 276 , 15489–15497 (2001).
CAS PubMed Статья Google Scholar
Rhie, A. et al. Характеристика аптамеров 2′-фтор-РНК, которые преимущественно связываются с конформациями прионного белка, ассоциированными с заболеванием, и ингибируют конверсию. J. Biol. Chem. 278 , 39697–39705 (2003).
CAS PubMed PubMed Central Статья Google Scholar
Caughey, W.С., Раймонд, Л. Д., Хориучи, М., Коуги, Б. Ингибирование образования протеаз-устойчивых прионных белков порфиринами и фталоцианинами. Proc. Natl Acad. Sci. USA 95 , 12117–12122 (1998).
CAS PubMed Статья Google Scholar
Тальявини, Ф., Форлони, Г., Д’урси, П., Бугиани, М. и Салмона, М. Исследования пептидных фрагментов прионного белка. Adv. Protein Chem. 57 , 171–202 (2001).
CAS PubMed Статья Google Scholar
Zou, W. Q. & Cashman, N. R. Кислый pH и детергенты усиливают преобразование in vitro человеческого мозга PrP C в форму, подобную PrP Sc . J. Biol. Chem. 277 , 43942–43947 (2002).
CAS PubMed Статья Google Scholar
Supattapone, S.Конверсия прионного белка in vitro . J. Mol. Med. (2004).
Soto, C. et al. Реверсия конформационных изменений прионного белка синтетическими пептидами-разрушителями β-складок. Ланцет 355 , 192–197 (2000). Первая демонстрация пептида, который может способствовать разворачиванию PrP Sc .
CAS PubMed Статья Google Scholar
Тальявини, Ф.и другие. Эффективность антрациклина против экспериментальной прионной болезни у сирийских хомяков. Наука 276 , 1119–1122 (1998).
Артикул Google Scholar
Forloni, G. et al. Тетрациклины влияют на инфекционность прионов. Proc. Natl Acad. Sci. USA 99 , 10849–10854 (2002).
CAS PubMed Статья Google Scholar
Шакед, Г.М., Энгельштейн, Р., Авраам, И., Кахана, Э. и Габизон, Р. Диметилсульфоксид задерживает накопление PrP SC и симптомы заболевания у инфицированных прионами хомяков. Brain Res. 983 , 137–143 (2003).
CAS PubMed Статья Google Scholar
Ehlers, B. & Diringer, H. Декстран сульфат 500 задерживает и предотвращает скрепи у мышей за счет нарушения репликации агентов в селезенке. Дж.Gen. Virol. 65 , 1325–1330 (1984).
CAS PubMed Статья Google Scholar
Кимберлин Р. Х. и Уокер С. А. Подавление инфекции скрепи у мышей гетерополианионом 23, сульфатом декстрана и некоторыми другими полианионами. Антимикробный. Агенты Chemother. 30 , 409–413 (1986).
CAS PubMed PubMed Central Статья Google Scholar
Фаркуар, К.F. & Dickinson, A. G. Продление инкубационного периода скрепи путем инъекции декстрансульфата 500 в течение месяца до или после заражения. J. Gen. Virol. 67 , 463–473 (1986).
CAS PubMed Статья Google Scholar
Priola, S. A., Raines, A. & Caughey, W. S. Соединения, предотвращающие скрепи с порфирином и фталоцианином. Наука 287 , 1503–1506 (2000). Основываясь на ссылке 100, это первая демонстрация того, что циклические тетрапирролы могут существенно продлить инкубационный период грызунов, зараженных скрепи.
CAS PubMed Статья Google Scholar
Murakami-Kubo, I. et al. Производные хинолина являются терапевтическими кандидатами для лечения трансмиссивных губчатых энцефалопатий. J. Virol. 78 , 1281–1288 (2004).
CAS PubMed PubMed Central Статья Google Scholar
Баррет, А.и другие. Оценка хинакринового лечения прионных заболеваний. J. Virol. 77 , 8462–8469 (2003).
CAS PubMed PubMed Central Статья Google Scholar
Рэйс, Р., Олдстон, М. и Чезебро, Б. Вхождение против блокады инфекции мозга после перорального или внутрибрюшинного введения скрепи: роль экспрессии прионного белка в периферических нервах и селезенке. J. Virol. 74 , 828–833 (2000).
CAS PubMed PubMed Central Статья Google Scholar
Fischer, M. et al. Прионный белок (PrP) с амино-проксимальными делециями восстанавливает восприимчивость мышей с нокаутом PrP к скрепи. EMBO J. 15 , 1255–1264 (1996).
CAS PubMed PubMed Central Статья Google Scholar
Берингу, В., Аджу, К.T., Lamoury, F., Maignien, T., Deslys, JP, Race, R. & Dormont, D. Противоположные эффекты декстрансульфата 500, полиенового антибиотика MS-8209 и конго красного на накопление устойчивых к протеазам изоформа PrP в селезенке мышей, интраперитонеально инокулированных агентом скрепи. J. Virol. 74 , 5432–5440 (2000).
CAS PubMed PubMed Central Статья Google Scholar
Корт, К., May, B. C., Cohen, F. E. и Prusiner, S. B. Производные акридина и фенотиазина в качестве фармакотерапевтических средств при прионной болезни. Proc. Natl Acad. Sci. USA 98 , 9836–9841 (2001).
CAS PubMed Статья Google Scholar
Bate, C., Salmona, M., Diomede, L. & Williams, A. Сквалестатин излечивает инфицированные прионами нейроны и защищает от нейротоксичности прионов. J. Biol. Chem. (в печати).
Дирингер, Х. и Элерс, Б. Химиопрофилактика скрепи у мышей. J. Gen. Virol. 72 , 457–460 (1991).
CAS PubMed Статья Google Scholar
Caughey, B. & Raymond, G. J. Ингибирование сульфатированным полианионом накопления PrP, связанного со скрепи, в культивируемых клетках. J. Virol. 67 , 643–650 (1993).
CAS PubMed PubMed Central Google Scholar
Габизон, р., Мейнер, З., Халими, М. и Бенсассон, С. А. Гепарин-подобные молекулы по-разному связываются с прионными белками и изменяют их внутриклеточную метаболическую судьбу. J. Cell. Physiol. 157 , 319–325 (1993).
CAS PubMed Статья Google Scholar
Wong, C. et al. Сульфатированные гликаны и повышенная температура стимулируют зависимое от PrP Sc бесклеточное образование протеазо-устойчивого прионного белка. EMBO J. 20 , 377–386 (2001).
CAS PubMed PubMed Central Статья Google Scholar
Бен-Закен, О. и др. Клеточный гепарансульфат участвует в метаболизме прионов. J. Biol. Chem. 278 , 40041–40049 (2003).
CAS PubMed Статья Google Scholar
Дело, Н.Р., Лукассен, Р. В. и Супаттапон, С. Молекулы РНК стимулируют конверсию прионного белка. Nature 425 , 717–720 (2003).
CAS Статья PubMed Google Scholar
Caughey, B. & Kocisko, D. A. Прионные болезни: соучастник нуклеиновой кислоты? Nature 425 , 673–674 (2003).
CAS PubMed Статья Google Scholar
Caughey, B.& Race, R.E. Сильное ингибирование накопления PrP, связанного со скрепи, конго красным. J. Neurochem. 59 , 768–771 (1992). Первая идентификация ингибитора PrP Sc в живых клетках, демонстрация того, что даже сверхъестественно устойчивые прионные инфекции могут быть уязвимы для химиотерапии.
CAS PubMed Статья Google Scholar
Ingrosso, L., Ladogana, A. & Pocchiari, M. Congo red продлевает инкубационный период у хомяков, инфицированных скрепи. J. Virol. 69 , 506–508 (1995).
CAS PubMed PubMed Central Google Scholar
Caughey, B., Brown, K., Raymond, G.J., Katzenstien, G.E. & Thresher, W. Связывание протеазочувствительной формы PrP (прионный белок) с сульфатированным гликозаминогликаном и конго красным. J. Virol. 68 , 2135–2141 (1994).
CAS PubMed PubMed Central Google Scholar
Caspi, S. et al. Антиприонная активность Конго красного. Предполагаемый механизм. J. Biol. Chem. 273 , 3484–3489 (1998).
CAS PubMed Статья Google Scholar
Demaimay, R. et al. Структурные аспекты конго красного как ингибитора образования протеазорезистентных прионных белков. J. Neurochem. 71 , 2534–2541 (1998).
CAS PubMed Статья Google Scholar
Demaimay, R., Chesebro, B. & Caughey, B. Ингибирование образования протеазо-устойчивого прионного белка трипановым синим, сириусовым красным и другими аналогами конго красного. Arch. Virol. [Suppl] 16 , 277–283 (2000).
Google Scholar
Поли, Г.и другие. Оценка in vitro антиприонной активности вновь синтезированных производных конго красного. Arzneimittelforschung. 53 , 875–888 (2003).
CAS PubMed Google Scholar
Gilch, S. et al. Внутриклеточное изменение маршрута прионного белка предотвращает распространение PrP (Sc) и задерживает начало прионного заболевания. EMBO J. 20 , 3957–3966 (2001).
CAS PubMed PubMed Central Статья Google Scholar
Caughey, B., и другие. Подавление накопления устойчивых к протеазам прионных белков in vitro куркумином. J. Virol. 77 , 5499–5502 (2003).
CAS PubMed PubMed Central Статья Google Scholar
Приола, С. А., Рейнс, А. и Коуги, В. Профилактические и терапевтические эффекты тетрасульфоната фталоцианина у мышей, инфицированных скрепи. J. Infect. Дис. 188 , 699–705 (2003).
CAS PubMed Статья Google Scholar
Pocchiari, M., Schmittinger, S. & Masullo, C. Амфотерицин B задерживает инкубационный период скрепи у хомяков с внутримозговыми прививками. J. Gen. Virol. 68 , 219–223 (1987).
CAS PubMed Статья Google Scholar
Дормонт Д. Подходы к профилактике и лечению. руб. Med. Бык. 66 , 281–292 (2003).
CAS Статья PubMed Google Scholar
Mange, A. et al. Амфотерицин B ингибирует образование изоформы прионного белка скрепи в инфицированных культурах. J. Virol. 74 , 3135–3140 (2000).
CAS PubMed PubMed Central Статья Google Scholar
Марелла, М., Lehmann, S., Grassi, J. & Chabry, J. Filipin предотвращает накопление патологического прионного белка за счет снижения эндоцитоза и индукции клеточного высвобождения PrP. J. Biol. Chem. 277 , 25457–25464 (2002).
CAS PubMed PubMed Central Статья Google Scholar
Adjou, K. T. et al. MS-8209, аналог амфотерицина B, задерживает появление спонгиоз, астроглиоз и накопление PrPres в мозге хомяков, инфицированных скрепи. J. Comp. Патол. 122 , 3–8 (2000).
CAS PubMed Статья Google Scholar
Doh-ura, K., Iwaki, T. и Caughey, B. Лизосомотропные агенты и ингибиторы цистеиновых протеаз подавляют накопление прионного белка, связанного со скрепи. J. Virol. 74 , 4894–4897 (2000). Первая демонстрация ингибирующей эффективности хинакрина, противомалярийного препарата, который в настоящее время проходит испытания на людях.
CAS PubMed PubMed Central Статья Google Scholar
Sigurdsson, E. M. et al. Хелатирование меди задерживает начало прионной болезни. J. Biol. Chem. 278 , 46199–46202 (2003).
CAS PubMed Статья Google Scholar
Скотт М. Р., Колер Р., Фостер Д. и Прусинер С. Б. Экспрессия химерного прионного белка в культивируемых клетках и трансгенных мышах. Protein Sci. 1 , 986–997 (1992).
CAS PubMed PubMed Central Статья Google Scholar
Priola, S.A., Caughey, B., Race, R.E. & Chesebro, B. Гетерологичные молекулы PrP препятствуют накоплению протеазо-резистентного PrP в клетках нейробластомы мыши, инфицированных скрепи. J. Virol. 68 , 4873–4878 (1994).
CAS PubMed PubMed Central Google Scholar
Хориучи, М., Priola, S. A., Chabry, J. и Caughey, B. Взаимодействия между гетерологичными формами прионного белка: связывание, ингибирование конверсии и видовые барьеры. Proc. Natl Acad. Sci. USA 97 , 5836–5841 (2000).
CAS PubMed Статья Google Scholar
Goldmann, W., Hunter, N., Smith, G., Foster, J. & Hope, J. Генотип PrP и эффекты агента при скрейпи: изменение аллельного взаимодействия с различными изолятами агента у овец, a естественный хозяин скрепи. J. Gen. Virol. 75 , 989–995 (1994).
CAS PubMed PubMed Central Статья Google Scholar
Палмер М. С., Драйден А. Дж., Хьюз Дж. Т. и Коллиндж Дж. Гомозиготный генотип прионного белка предрасполагает к спорадической болезни Крейтцфельда – Якоба. Nature 352 , 340–342 (1991).
CAS PubMed Статья Google Scholar
Прусинер, С.B. et al. Трансгенетические исследования предполагают взаимодействия между гомологичными изоформами PrP в репликации прионов скрепи. Cell 63 , 673–686 (1990). Эта статья вместе с несколькими другими (ссылки 98 и 143–150) устанавливает обоснование терапевтических подходов, основанных на экспрессии мешающих молекул PrP или фрагментов PrP в организме хозяина.
CAS PubMed Статья Google Scholar
Чабри, Дж., Caughey, B. & Chesebro, B. Специфическое ингибирование in vitro образования протеазо-устойчивого прионного белка синтетическими пептидами. J. Biol. Chem. 273 , 13203–13207 (1998).
CAS PubMed Статья Google Scholar
Chabry, J. et al. Независимое от вида ингибирование образования аномального прионного белка (PrP) пептидом, содержащим консервативную последовательность PrP. J. Virol. 73 , 6245–6250 (1999).
CAS PubMed PubMed Central Google Scholar
Браун П. Лекарственная терапия человека и экспериментальная трансмиссивная губчатая энцефалопатия. Неврология 58 , 1720–1725 (2002).
CAS PubMed Статья Google Scholar
Doh-ura, K. et al. Лечение трансмиссивной губчатой энцефалопатии внутрижелудочковой инфузией лекарственного средства на животных моделях. J. Virol. 78 , 4999–5006 (2004). Демонстрация того, что прямое введение ингибиторов PrP Sc в желудочки мозга может усиливать положительные эффекты лекарств в конце инкубационного периода, подход, который в настоящее время тестируется на пациентах с БКЯ.
CAS PubMed PubMed Central Статья Google Scholar
Кобаяши, Ю., Хирата, К., Танака, Х. и Ямада, Т. [Введение хинакрина пациенту с болезнью Крейтцфельдта-Якоба, которому был проведен трансплантат трупной твердой мозговой оболочки — оценка ЭЭГ]. Риншо Синкэйгаку 43 , 403–408 (2003).
PubMed Google Scholar
Nakajima, M. et al. Результаты применения хинакрина пациентам с болезнью Крейтцфельдта – Якоба. Демент. Гериатр. Cogn Disord. 17 , 158–163 (2004).
CAS PubMed Статья Google Scholar
Otto, M. et al. Эффективность флупиртина на когнитивные функции у пациентов с CJD: двойное слепое исследование. Неврология 62 , 714–718 (2004). Демонстрация положительного воздействия препарата на пациентов с CJD.
CAS PubMed Статья Google Scholar
Тейлор Д.М. Инактивация возбудителей трансмиссивной дегенеративной энцефалопатии: обзор. Вет. J. 159 , 10–17 (2000).
CAS PubMed Статья Google Scholar
Коциско, Д. А., Морри, Дж. Д., Рэйс, Р., Чен, Дж. И Коуги, Б. Оценка новых ингибиторов PrP-res в культуре клеток против инфекции скрепи у мышей. J. Gen. Virol. 85 , 2479–2484 (2004).
CAS PubMed Статья Google Scholar
Дауде, Н., Marella, M. и Chabry, J. Специфическое ингибирование патологического накопления прионного белка небольшими интерферирующими РНК. J. Cell Sci. 116 , 2775–2779 (2003). Эта статья вместе со ссылкой 84 предоставляет доказательства того, что активное снижение экспрессии PrP C может быть разумным терапевтическим подходом.
CAS PubMed Статья Google Scholar
Прусинер, С.Лекция Б. Шаттака — нейродегенеративные заболевания и прионы. N. Engl. J. Med. 344 , 1516–1526 (2001).
CAS PubMed Статья Google Scholar
Caughey, B. & Lansbury, P. T. Протофибриллы, поры, фибриллы и нейродегенерация: отделение ответственных белковых агрегатов от невинных прохожих. Annu. Rev. Neurosci. 26 , 267–298 (2003).
CAS PubMed Статья PubMed Central Google Scholar
Кимберлин, Р.H. & Walker, C.A. Противовирусное соединение HPA-23 может предотвратить скрепи при введении во время инфекции. Arch. Virol. 78 , 9–18 (1983). Эта и более ранние статьи этой группы являются первой, демонстрирующей профилактическую активность полианионных молекул против скрепи.
CAS PubMed Статья Google Scholar
Ласмезас, К.


 A new variant of Creutzfeldt-Jacob Disease in the UK. Lancet 1996; 347:921-5.
A new variant of Creutzfeldt-Jacob Disease in the UK. Lancet 1996; 347:921-5. W. Human prion diseases. J Neural Transm 1996; 47:231-46.
W. Human prion diseases. J Neural Transm 1996; 47:231-46.
 In: Fields B.N., et al., editors. Fields Virology. Philadelphia: Lippincott Raven Publishers; 1996. p.2851-900.
In: Fields B.N., et al., editors. Fields Virology. Philadelphia: Lippincott Raven Publishers; 1996. p.2851-900.