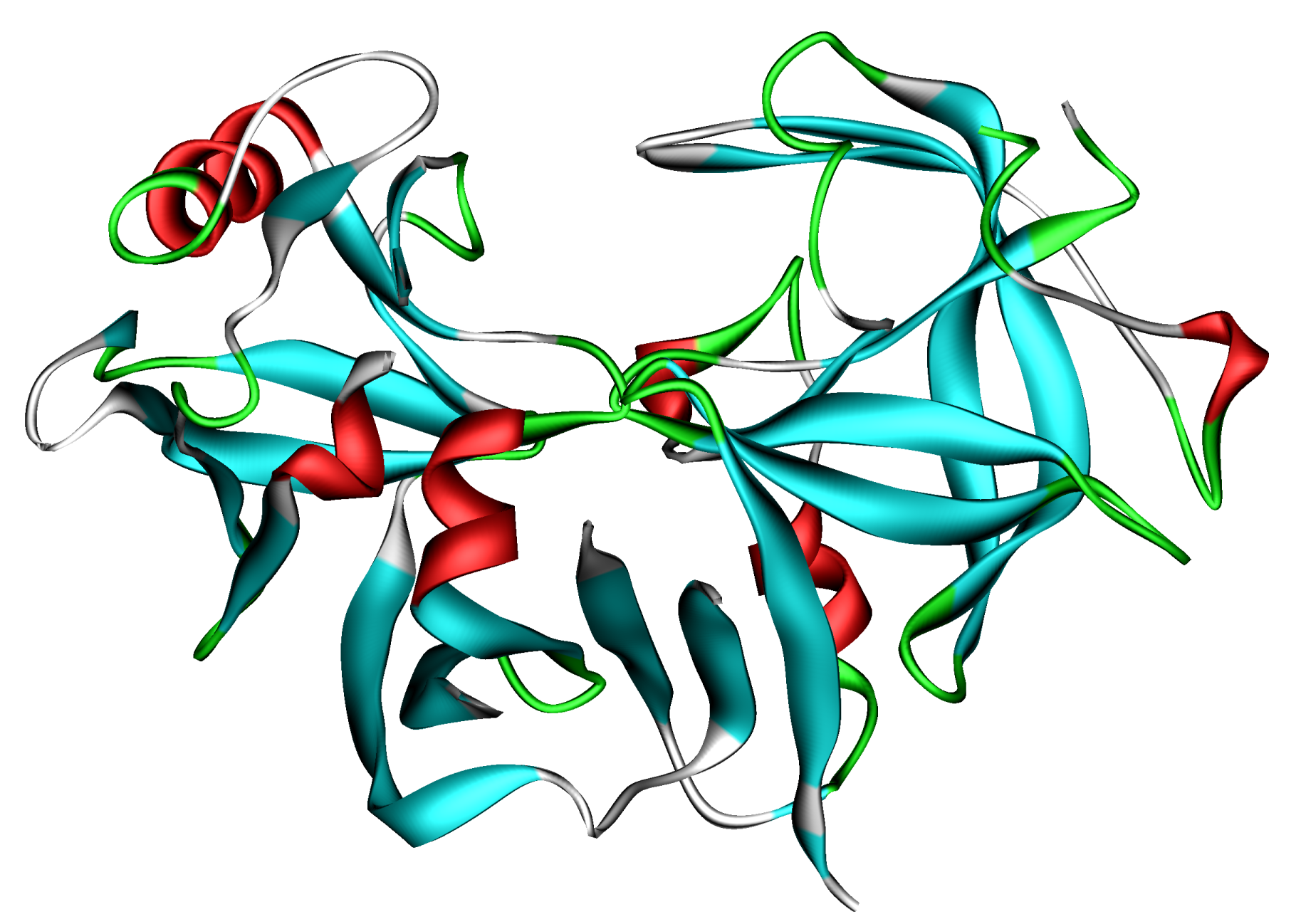
Ученые НГУ спроектировали фермент для производства нового сыра
Лаборатория структурной биоинформатики и молекулярного моделирования НГУ совместно с ГНЦ ВБ «Вектор» и Алтайским госуниверситетом спроектировали вариант модифицированного химозина, который в ближайшее время будет проверяться в НИИ Сыроделия (Барнаул).
Химозин (он же реннин) — это фермент, который вырабатывается в желудках млекопитающих, и используется в приготовлении сыра. В зависимости от свойств используемого химозина получаются разные сорта сыра, так что с помощью нового фермента можно будет производить новый продукт.
Вариант модифицированного химозина спроектирован методом компьютерного моделирования, пояснила заведующий лабораторией структурной информатики и молекулярного моделирования НГУ Анастасия Бакулина.
Целью совместного проекта НГУ, «Вектора» и АлтГУ является получение молокосвертывающего фермента химозина с пониженной температурной стабильностью. Химозин — фермент, под действием которого происходит частичный гидролиз основного белка молока — каппа-казеина с образованием казеина; молоко при этом створаживается.
В данный момент производство рекомбинантного химозина в России отсутствует. На базе студенческого конструкторского бюро УМНИК (входят студенты и выпускники НГУ и АлтГУ) планируется создание продуцентов химозина с улучшенными свойствами, чтобы затем наладить их производство. Стоит задача на просто скопировать чужие разработки, а сделать свою версию фермента, которая будет по каким-то параметрам превосходить мировые аналоги.
Эту работу начали в Алтайском государственном университете. На первом этапе участниками СКБ УМНИК был экспериментально получен рекомбинантный химозин коровы, показано, что он функционирует, этим заинтересовались местные производители сыра. Они и предложили сделать модификации для изменения термостабильности химозина. Эта задача интересна и с научной точки зрения, и с практической. Лаборатория в НГУ — это лаборатория компьютерной биологии, у нас нет возможности проводить эксперименты самостоятельно, мы постоянно сотрудничаем с биологами.
С другой стороны, специалистов по структурной биоинформатике сейчас мало, и в лабораториях, которые занимаются белковой инженерией, не всегда есть возможность найти сотрудника нужной квалификации, поэтому они обращаются к нам, — говорит Анастасия Бакулина.
Можно сказать, что работа с химозином — это часть большого проекта по «импортозамещению» ферментов, причем ученые планируют не просто повтор того, что делают за рубежом, а изготовление ферментов с новыми интересными свойствами. Иногда требуется увеличенная термостабильность, иногда уменьшенная, или измененная специфичность, или нужно, чтобы фермент эффективно работал при другом значении pH.
Предполагается, что с помощью биоинформатического анализа нам удастся найти варианты аминокислотных последовательностей химозинов теленка с пониженной термостабильностью. После этого варианты будут проверяться экспериментально. Исходный вариант химозина уже получен, нужно будет внести туда выбранные аминокислотные замены и проверить активность полученных вариантов, — резюмировал заведующий лабораторией иммунохимии ГНЦ ВБ «Вектор» и преподаватель АлтГУ Дмитрий Щербаков.
Лаборатория структурной биоинформатики и молекулярного моделирования НГУ создана при поддержке программы повышения конкурентоспособности российских вузов — Проекта «5-100»
Проект получения рекомбинантного химозина со сниженной термостабильностью недавно был поддержан фондом РФФИ.
Сычужный фермент химозин — Справочник химика 21
Препарат сычужного фермента получается путем экстракции высушенных желудков молодых телят. В желудке взрослых животных, а также человека сычужный фермент (химозин) отсутствует и свертывание молока осуществляется пепсином (см. стр. 310). [c.54]Для получения галалита часто применяют сычужный казеин, т. е. казеин, осажденный сычужным ферментом — химозином. [c.231]
В. Н. Окунев. Роль сычужного фермента (химозина) при ассимиляционных процессах организма. Док. дисс. СПб., 1895, 135 стр.
 278]
278]Очень сложное полимеризационное явление наблюдается для казеина, который содержит ряд отдельных компонентов, взаимодействующих друг с другом с образованием мицеллярных агрегатов [1003, 1004]. Частичный протеолиз одной из фракций казеина (х-казеина) сычужным ферментом (химозином), но-видимому, приводит к изменениям, аналогичным превращению фибриногена в фибриновый мономер. Модифицированный к-казеин в присутствии ионов Са » » может инициировать полимеризацию белка, приводящую к образованию нерастворимого сгустка. [c.339]
Многие традиционные технологии пищевой промышленности основаны на изменении структуры белков, что позволяет получать продукты разной текстуры. Наиболее известными примерами являются клейковина, а также казенны. Так, при хлебопечении замешивание теста из муки с водой и солью изменяет структуру клейковины и вызывает образование упругой и растяжимой белковой сети, в которую заключены крахмальные зерна. От реологических характеристик этой белковой сети зависят важнейшие свойства теста, а также конечное качество хлеба.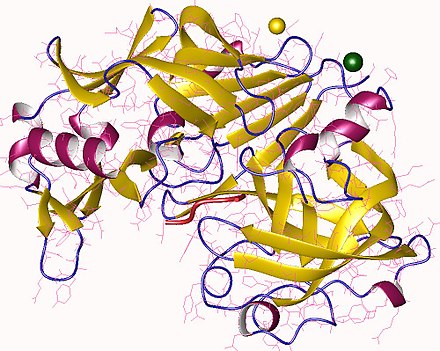
Из молока казеин получают действием или кислоты, или сычужно фермента— химозина. В первом случае происходит снятие заря/ с казеиновой частицы. Причина коагуляции во втором случае ь установлена окончательно. Есть мнения, что в данном случае наст нает дезагрегация казеиновой мицеллы согласиться с этим оче трудно, так как если дезагрегация и имеет место в первой стади) f то в следующий момент наступает обратное явление, обнаруживаемс невооруженным глазом казеин в разбавленных растворах молок начинает скопляться, образуя хлопья.
Сычужный казеин является лучшим видом белкового сырья для производства галалита. Золи сычужного казеина отличаются наибольшей вязкостью, а гель — наибольшей пластичностью. Цвет сычз лского казеина — белый. Указанные свойства сычужного казеина позволяют получать из него прочный и красивый галалит, способный окрашиваться в самые разнообразные и нежные тона. Он получается коагуляцией казеина сычужным ферментом — химозином. В заводских условиях сычужный фермент получается путем экстракции высушенных и измельченных телячьих желудков, четвертое отделение которых называтся сычугом. [c.459]
Теперь мы знаем, что при обмене веществ кровь играет важнейшую роль транспортного средства.
В молоке казеин находится в форме растворимой Са-солн. Казеин можно высадить из молока подкислением раствора или обработкой сычужным ферментом (химозином) телячьего желудка.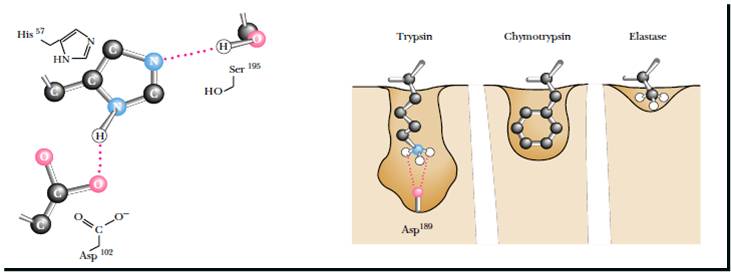 В результате обработки последним способом а-казеин превращается в параказеин [26], при этом аминокислотный состав не изменяется. Но а-казеин про-теолитически отщепляет сравнительно большие пептиды [27], образующие нерастворимую Са-соль, благодаря чему и выпадает так называемый параказеин.
В результате обработки последним способом а-казеин превращается в параказеин [26], при этом аминокислотный состав не изменяется. Но а-казеин про-теолитически отщепляет сравнительно большие пептиды [27], образующие нерастворимую Са-соль, благодаря чему и выпадает так называемый параказеин.
Сычужный фермент
СЫЧУЖНЫЙ ФЕРМЕНТ CARLINA 1650
В настоящее время на рынке представлен большой выбор отечественных и зарубежных молокосвёртывающих препаратов, и сыроделам зачастую сложно разобраться в их многообразии и качестве.
Известно, однако, что наилучшим МФП для сыроделия со всех точек зрения является очищенный от балластных веществ до максимального содержания химозина сычужный фермент, получаемый из сычужков телят-молокопоек.
Для российского рынка из всего ассортимента ферментов кампании был выбран такой ферментный препарат с содержанием химозина 90%.
Мы посчитали, что наилучшим способом подтвердить качество нашего ферментного препарата, его пригодность для производства сыра (а не биохимические свойства) – можно в условиях российского предприятия на российском сырье. С этой целью в условиях Угличского сыродельного завода была проведена серия из 200 промышленных варок сыра «Российский». Задачей было сравнить влияние состава ферментного препарата (а именно соотношения химозин/пепсин) на выход сыра. Для сравнения брали 3 коммерческих МФП с заявленным производителями соотношением химозин/пепсин соответственно 90/10, 70/30 и 20/80%. Измеряли также расход ферментного препарата.
В результате мы видим, что у МФП 70/30 существенно ниже выход сыра, в сравнении с другими образцами, а наилучшие выход расход продемонстрирован именно МФП с соотношением химозин/пепсин 90/10.
Таким образом, если сравнивать два препарата с одинаковым выходом сыра то при производстве 1000 т сыра экономия за счёт более низкого расхода фермента составит 40 кг препарата), то наилучшим из испытанных с точки зрения состава, выхода сыра и расхода, является молокосвёртывающий ферментный препарат с соотношением химозин/пепсин 90/10%.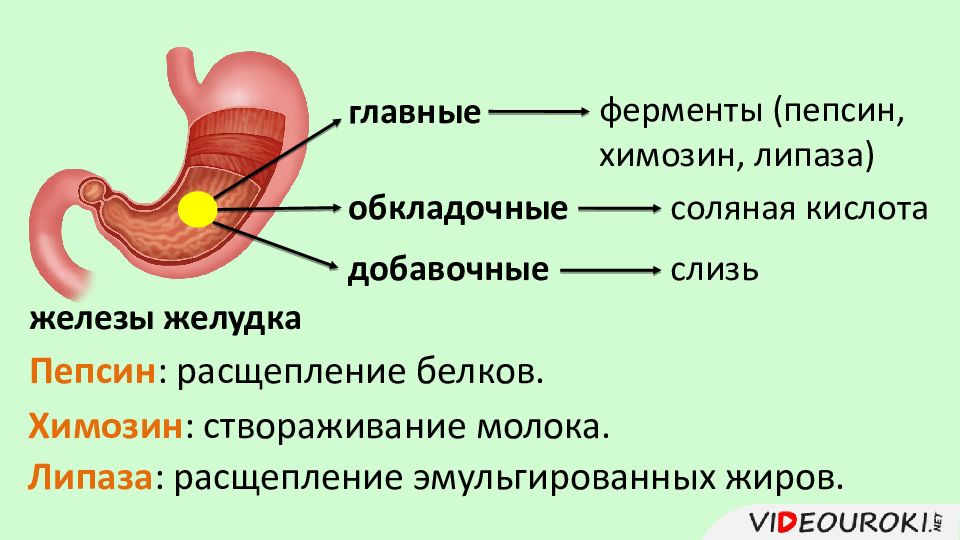
Подробно об условиях этого эксперимента вы сможете узнать в одном из ближайших номеров журнала Сыроделие и маслоделие.
РЕКОМЕНДАЦИИ ПО ИСПОЛЬЗОВАНИЮ СЫЧУЖНОГО
ФЕРМЕНТА CARLINA 1650
МФП (молокосвёртывающий ферментный препарат) в молочную смесь вносят после наполнения сыродельной ванны, внесения закваски (её активизации в случае сухих концентратов), хлористого кальция и т.д.
Первое что необходимо помнить — количество МФП (молокосвёртывающего ферментного препарата) необходимого для свёртывания молока, должно быть минимальным, но обеспечивать
получение сгустка в заданное время (от 25 до 35 минут). Дозировка, которую мы даём (0,9-1,5 г / 100 л молока) имеет довольно большой разброс.
Это обусловлено тем, что сычужный фермент работает в системе фермент-молоко. В то время как фермент обладает постоянными свойствами, свойства молока-сырья, особенно в России разнятся в зависимости от региона, сезона года и т. п.
п.
1. Поэтому в первую очередь мы рекомендуем определить точную дозу фермента, необходимую для свёртывания 100 л молока с помощью кружки ВНИИМС. Эта методика известна всем мастерам — сыроделам и описана в Сборнике Технологических Инструкций, Приложение 2.
На всякий случай привожу здесь её описание:
«На лабораторных весах берут навеску 2,5 г молокосвёртывающего препарата, которую переносят в мерный цилиндр вместимостью 100 см3, растворяют в пастеризованной и охлаждённой до 35оС нехлорированной воде, доливая её до деления 100см3. Раствор препарата перемешивают до полного растворения.
Кружку ВНИИМС наполняют до краёв подогретой до температуры свёртывания молочной смесью из ванны после того как внесены закваска, хлористый кальций и др. компоненты в соответствии с технологической инструкцией для данного вида сыра.
Наполненную Кружку устанавливают в горизонтальном положении и таким образом, чтобы молоко вытекало через ниппель в ванну.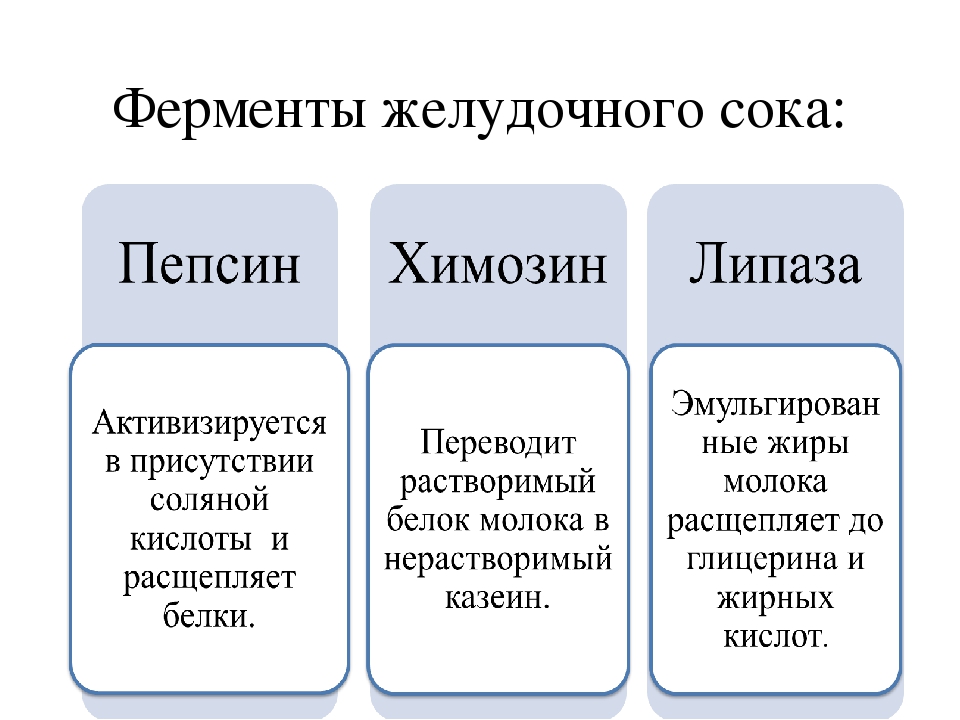 Когда уровень молока в приборе достигнет нулевой (самой верхней) отметки, быстро, при энергичном перемешивании шпателем, вносят 10см3 приготовленного раствора молокосвёртывающего ферментного препарата. Если для отмеривания используют пипетку, то раствор препарата выливают через широкую его часть.
Когда уровень молока в приборе достигнет нулевой (самой верхней) отметки, быстро, при энергичном перемешивании шпателем, вносят 10см3 приготовленного раствора молокосвёртывающего ферментного препарата. Если для отмеривания используют пипетку, то раствор препарата выливают через широкую его часть.
Отметка на шкале прибора ВНИИМС, соответствующая уровню образовавшегося сгустка, показывает количество МФП в граммах, которое надо внести на каждые 100 кг молока, чтобы оно свернулось за 30 минут.»
2. Зная количество МФП, необходимое для свёртывания, навешиваем количество МФП, рассчитанное на объём сыродельной ванны. МФП вносят в молоко в виде раствора, приготовленного непосредственно перед внесением. Необходимое количество МФП растворяют в пастеризованной и охлаждённой до 32-36º С , нехлорированной воде (в соотношении 1:9) и равномерно вливаем в ванну, равномерно по всей площади ванны.
3. После внесения молоко перемешивают в течение 5-7 минут и затем оставляют в покое до образования сгустка.
4. В каждой банке фермента мерная ложечка на 2,5 гр фермента.
Коагулянт (молокосвертывающий фермент) | Ингредиенты для сыроделия
Коагулянт (молокосвертывающий фермент)
Коагулянтом называют фермент, преобразующий жидкое молоко в желеобразный сырный сгусток (твердые белки и жиры, содержащиеся в молоке). Чаще используется название «сычужный фермент», но это лишь определенный тип фермента, хотя и самый часто используемый. В сыроделии применяются молокосвертывающие ферменты следующих типов:1. Сычужный фермент (сычуг) животного происхождения — экстракт сычуга телят (химозин) . Этот фермент добывают из желудков телят, и он является наиболее традиционным в сыроделии и используется повсеместно, с давних времен. Химозин, полученный из телят, лучше всего подходит для производства мягких и твердых сычужных сыров и его использование предусмотрено ГОСТом.
2. Также сычужный фермент выделяют из желудков других животных (чаще — коров), получая пепсин.
3. Искуственно выращенный рекомбинированный вегетарианский химозин, по составу и свойствам аналогичный телячьему сычужному ферменту.
4. Микробиальный реннин (пепсин) получают из различных водорослей, грибов.Пепсин рекомендуется использовать только при изготовлении сыров с коротким сроком созревания (не более 2 месяцев), в остальных случаях лучше всего подойдет химозин, поскольку он вместе с закваской в период созревания участвует в формировании вкуса и консистенции сыра.
При добавлении коагулянта в молоко руководствуйтесь правилами, указанными в инструкции препарата. Предварительно растворите фермент в небольшом количестве воды комнатной температуры. Будьте аккуратнее с дозировкой: излишнее количество сычужного фермента может дать горечь в сыре. См. расчет количества необходимого коагулянта.Последнее обновление — 01.11.2015 [19:37]
Как вегетарианцу выбрать сыр | Статьи о продуктах ВкусВилл: Самара
Переход на вегетарианство не так сложен, как может показаться на первый взгляд — магазины изобилуют растительными заменителями мяса с большим количеством необходимого белка: даже во «ВкусВилл» можно найти такие котлеты. Однако многие люди, ступившие на путь этичного питания, не подозревают о том, что камнем преткновения станет… сыр.
Однако многие люди, ступившие на путь этичного питания, не подозревают о том, что камнем преткновения станет… сыр.
В отличие от веганов, полностью исключивших из рациона продукты животного происхождения, вегетарианцы не отказывают себе в кисломолочных блюдах. Почему же с сыром могут возникнуть сложности? Дело в том, что зачастую этот продукт имеет в составе сычужный животный фермент. Особенно часто он встречается в твёрдых сырах, твороге и других творожных продуктах. Добывается этот фермент из желудков телят, достигших месячного возраста.
Безусловно, животный сычуг содержится не во всём сыре, поэтому вегетарианец при желании всегда может полакомиться этим продуктом: многие производители давно начали заменять животный компонент на микробиальный или микробиологический фермент. Казалось бы, всё просто — нужно лишь прийти в магазин и выбрать товар с подходящим составом. Однако на практике такой поход требует времени на скрупулёзное изучение этикеток: названия коагулянтов широкому кругу потребителя неизвестны.
В ассортимент сыров «ВкусВилл», конечно, включены продукты, которые подойдут вегетарианцам. Здесь можно найти и твёрдый, и мягкий, и копчёный сыр, и, конечно, нежную моцареллу и тофу.
Наши вегетарианские сыры
Чтобы вам всегда было удобно выбирать сыр из множества наименований, мы подготовили две шпаргалки. Первая содержит неживотные ферменты — такой продукт вегетарианцу смело можно брать. Вторая — с наименованиями компонентов животного происхождения, которых следует избегать, если вы решили питаться этично.
- Milase (Милаза) — получен при ферментации не генетически модифицированных грибов
- Chymogen — получен методом генной инженерии
- Fromase (Фромаза) — получен посредством ферментации плесневого гриба
- Maxilact (Максилакт) — получен из особых штаммов молочных грибов
- Suparen (Супарен) — получен из грибов Cryphonectria (Endothia) parasitica
- Meito Microbial Rennet (микробиальный ренин) — получен путём ферментации и дальнейшей сушки растительного пищевого гриба
- CHY-MAX (ферментативно произведённый химозин, ФПХ) — получен из грибов Aspergillus niger
- Maxiren — получен ферментацией молочных дрожжей
- 100% Химозин — химозин, полученный при ферментации специального плесневого гриба (не путать с обычным химозином)
Зачастую в составе вегетарианских сыров указывается не наименование фермента, а лишь его происхождение. Примеры таких надписей на упаковках: микробиальный (микробиологический) сычужный фермент, сычужный фермент (ферментный препарат) микробиального (неживотного) происхождения.
Примеры таких надписей на упаковках: микробиальный (микробиологический) сычужный фермент, сычужный фермент (ферментный препарат) микробиального (неживотного) происхождения.
Отдельно стоит упомянуть не коагулянт, а консервант — лизоцим (Е1105). Он изготавливается из белка куриных яиц (подходит для вегетарианцев, но не для веганов). На упаковках сыров часто указывают, что в составе есть компонент животного происхождения — лизоцим. Но пусть слово «животного» вас не смущает. Такой сыр можно брать.
Наиболее распространённый вариант обозначения невегетарианского компонента — сычужный фермент животного происхождения. Существует также сладкомолочный сыр. В нашем ассортименте такого продукта нет, но его можно найти в других магазинах. Так называются сыры, всегда изготавливаемые с использованием животного фермента. Увидели такую надпись на лицевой стороне упаковки — обратную можно уже не изучать.
Сычужный фермент (жидкий фермент — химозин), цена 490 грн
Максирен – высококачественный сычужный фермент (100% химозин), является молочносвертывающим веществом, разработанный с использованием последних технологий для удовлетворения потребности современного сыропроизводства.
Химозин – основной фермент для свертывания молока, производится из специальных молочных дрожжей Kluyveromyces Lactis.
Максирен и натуральный сычужный фермент обладают одинаковой чувствительностью к температуре воздействия.
Активация максирена в сыворотке может быть достигнута посредством пастеризации при t 72 С, рН сыворотки не ниже 6,0.
Идентичен телячьему химозину. Великолепная чувствительность к температурному воздействию 100% активность свертывания, увеличивающая выход продукции на 5-7%.
Обладает протеолитической активностью.
Рекомендуемая дозировка Максирен 1800 гранулированный 0,7-0,9 г. на 100 л. молока.
Рекомендуемая дозировка Максирен 600 жидкий 2,5-2,7 мл. на 100 л. молока.
Использование:
Перед добавлением Максирена убедитесь в том, что молоко доведено до необходимой сычужной температуры, внесен хлорид кальция и сырный краситель в-каротин или аннатто, и что они гомогенноперемешаны по целому объему емкости.
Уровень внесения Максирена будет меньшим, чем для эквивалентной активности телячьего сычуга. Аккуратно отмерьте Максирен , разбавьте в 10-ти кратном объеме прохладной питьевой нейтральной воды, и внесите сразу в емкость с молоком.
Использование жесткой щелочной воды понизит активность сычужных ферментов. По возможности используйте дистиллированную воду для раствора фермента. Не растворяйте сычуг в посудине, которая использовалась для щелочного сырного красителя или для моющих средств.
Тщательно перемешивайте молоко до того, как убедитесь, что сычуг равномерно распределен в молоке – время будет отличаться в зависимости от формы емкости, но приблизительно составит 4 минуты. Сырная масса должна быть готова для нарезания приблизительно через 25-45 минут.
Максирен изготавливается из молочных дрожжей Saccharomyces (Kluveromyces) lactis, которые были изолированы от микрофлоры Кефира. Максирен это высочайшего качества коагулянт с высокой степенью чистоты, консистенция качественной и стабильной ферментативной активности. Это обеспечивает максимальное свертывание молока и выхода сыра, а также подходит для всех видов сыра.
Это обеспечивает максимальное свертывание молока и выхода сыра, а также подходит для всех видов сыра.
Разработка процессов гранулирования ферментных препаратов
Авторы:
Макаренков Д.А. / Волков П.А. / Назаров В.И.
Год:
2014
Издательство:
Российский химический журнал
Язык:
Русский
Дата публикации:
УДК 66.099.2
Разработка процессов гранулирования ферментных препаратов
Д.А. Макаренков, П.А. Волков, В.И. Назаров
ДМИТРИЙ АНАТОЛЬЕВИЧ МАКАРЕНКОВ – кандидат технических наук, доцент, заведующий лабораторией перспективных исследований Федерального государственного унитарного предприятия «Государственный ордена Трудового Красного Знамени научно-исследовательский институт химических реактивов и особо чистых химических веществ» (ФГУП «ИРЕА»). Область научных интересов: процессы и аппараты химических технологий. E-mail: [email protected]; тел. (495) 963- 75-76. факс. (495) 963-70-71
Область научных интересов: процессы и аппараты химических технологий. E-mail: [email protected]; тел. (495) 963- 75-76. факс. (495) 963-70-71
ПАВЕЛ АЛЕКСАНДРОВИЧ ВОЛКОВ – младший научный сотрудник, заместитель руководителя Центра коллективного пользования «Исследовательский научно-аналитический центр ФГУП «ИРЕА»». Область научных интересов: aтомно-эмиссионная спектроскопия с индуктивно-связанной плазмой. E-mail: [email protected]; тел. (495) 963-70-70, факс. 963-70-71
ВЯЧЕСЛАВ ИВАНОВИЧ НАЗАРОВ – кандидат технических наук, доцент, преподаватель кафедры Юнеско «Техника экологически чистых производств» Московского государственного машиностроительного университета.
Область научных интересов: процессы и аппараты химических технологий. E-mail: nazarov_vi41/@mail.ru; тел (499) 267-12-07
107076, г. Москва, ул. Богородский вал, д. 3, ФГУП «ИРЕА »
107023, Москва, ул. Большая Семеновская, д.![]() 38, Московский государственный машиностроительный университет.
38, Московский государственный машиностроительный университет.
Введение
Ферментные препараты являются широко распространенными продуктами, применяемые в различных отраслях. В животноводстве ферментные препараты применяются для усвоения кормов, в пищевой промышленности широко распространены молокосвертывающие ферментные препараты (МФП). В основном они выпускаются в порошкообразном виде. Их высокая дисперсность yxyдшaет условия труда и экологическую обстановку на рабочих местах и является причиной потерь порошка на различных стадиях его производства и транспортировки. Пылевидные ферментные препараты гигpocкoпичны, налипают на поверхность бункеров и транспортирующих устройств, слеживаются при хранении.
Переход на гранулированные МФП позволит интенсифицировать технологический процесс, улучшить санитарные условия труда и снизить потери продукта [1, 4].
В настоящее время распространены МФП как растительного происхождения, так и получаемые методом микробиологического синтеза [2]. В группу МФП входят молокосвёртывающие препараты, получаемые из сычугов молодняка (желудков телят, ягнят). Часто этим термином называют препараты из желудков взрослых животных (пепсин), из железистых желудков цыплят (куриный пепсин) и микробиальных продуцентов.
В группу МФП входят молокосвёртывающие препараты, получаемые из сычугов молодняка (желудков телят, ягнят). Часто этим термином называют препараты из желудков взрослых животных (пепсин), из железистых желудков цыплят (куриный пепсин) и микробиальных продуцентов.
В сычужный фермент входят два ферментных компонента – химозин и говяжий пенсин. При получении сыров происходят процессы коагуляции основного его белка – казеина – и образование молочного геля. За ферментативное свертывание казеина «ответственна» только одна пептидная связь в белковой молекуле (при наличии сотен других). Разрыв белковой молекулы по этой ключевой связи и приводит к свёртыванию молока. Химозин является тем ферментом, который по своей природе (секретируется сычугом телёнка для обеспечения свёртывания молока) обеспечивает разрыв данной связи, при этом мало затрагивая другие. Пепсин, наоборот, в силу своей природной направленности (обеспечение распада белков) затрагивает широкий спектр пептидных связей в казеине. Качество сычужного фермента определяется соотношением химозина к пепсину. Чем оно выше, тем более качествен сычужный фермент.
Качество сычужного фермента определяется соотношением химозина к пепсину. Чем оно выше, тем более качествен сычужный фермент.
На качество фермента влияет также нерастворимый остаток. При высоком его содержании во время свёртывания молока нерастворившиеся частички, на которые адсорбируются пепсин и другие ферменты, захватываются мололочным сгустком и создаётся опасность получения сыра с горьким вкусом.
Обсемененность фермента не должна превышать нормативных показателей для данного препарата.
Активность сычужного порошка зависит от общего содержания в нём химозина н пепсина, а также свойств молочной смеси, подготовленной для свертывания. В России выпускаются препараты активностью 100000 усл. ед. на 1 гр. Это означает, что 1 мл 1%-ного водного раствора фермента свёртывает 100 мл стандартизированного молока за 7,5 мин.
Полный текст статьи представлен в журнале «Российский химический журнал». 2014. Т. 58. № 1. С. 49-56.
Химозин (реннин) и коагуляция молока
Химозин (реннин) и коагуляция молока
«Блаженны сыроделы» Монти Пайтон
Химозин, известный также как ренин, представляет собой протеолитический фермент, родственный пепсину, который синтезируется главными клетками желудка некоторых животных. Его роль в пищеварении заключается в свертывании или свертывании молока в желудке, что имеет большое значение для очень молодых животных. Если бы молоко не свертывалось, оно бы быстро прошло через желудок и упустило бы возможность для начального переваривания его белков.
Химозин эффективно превращает жидкое молоко в полутвердое, такое как творог, что позволяет дольше удерживать его в желудке. Секреция химозина максимальна в течение первых нескольких дней после рождения, а затем снижается, фактически замещаясь секрецией пепсина в качестве основной желудочной протеазы. Химозин секретируется в неонатальном желудке жвачных животных (крупный рогатый скот, козы, верблюды), свиней, кошек и крыс. Животные, в том числе люди, шимпанзе и лошади, имеют инактивирующие мутации в гене химозина и не секретируют фермент.
Животные, в том числе люди, шимпанзе и лошади, имеют инактивирующие мутации в гене химозина и не секретируют фермент.
Химозин секретируется в виде неактивного профермента, называемого прохимозин, который, как и пепсин, активируется при воздействии кислоты. Химозин также похож на пепсин в том, что он наиболее активен в кислой среде, что имеет смысл, учитывая его миссию.
Чтобы понять, как химозин свертывает молоко, нужно кое-что знать о молочных белках. Большая часть молочного белка представляет собой казеин, и существует четыре основных типа молекул казеина: альфа-s1, альфа-s2, бета и каппа.Альфа- и бета-казеины представляют собой гидрофобные белки, которые легко осаждаются кальцием: нормальная концентрация кальция в молоке значительно превышает концентрацию, необходимую для осаждения этих белков. Однако каппа-казеин представляет собой совершенно другую молекулу — он не может осаждаться кальцием. Когда казеины секретируются, они самоассоциируются в агрегаты, называемые мицеллами, в которых альфа- и бета-казеины удерживаются от осаждения за счет их взаимодействия с каппа-казеином. В сущности, каппа-казеин в норме удерживает большую часть молочного белка в растворимом состоянии и предотвращает его спонтанную коагуляцию.
В сущности, каппа-казеин в норме удерживает большую часть молочного белка в растворимом состоянии и предотвращает его спонтанную коагуляцию.
Введите химозин. Химозин протеолитически разрезает и инактивирует каппа-казеин, превращая его в пара-каппа-казеин и более мелкий белок, называемый макропептидом. Пара-каппа-казеин не обладает способностью стабилизировать мицеллярную структуру, и нерастворимые в кальции казеины осаждаются, образуя творог.
Помимо своей физиологической роли, химозин также является очень важным промышленным ферментом, поскольку он широко используется в сыроделии. В былые времена для этой цели из высушенных телячьих желудков извлекали химозин, но производство сыра расширилось за пределы доступных телячьих желудков (помните, что они должны быть из молодых телят).Оказывается, многие протеазы способны коагулировать молоко, превращая казеин в параказеин, и легко доступны альтернативы химозину. «Сычуг» — это название любого ферментативного препарата, который свертывает молоко.
Отправить комментарии по адресу [email protected]
Химозин — обзор | ScienceDirect Topics
Сычужные ферменты животных
Химозин представляет собой желудочный фермент, который секретируется в виде зимогена в слизистой оболочке сычуга новорожденных и подростков жвачных животных.Традиционный способ вызвать сычужную коагуляцию молока заключался в том, чтобы влить в чанное молоко ферментсодержащие экстракты, полученные путем замачивания срезов высушенного желудка в сыворотке на ночь. Сушеные телячьи или бараньи тельца, которые почти исключительно используются в кустарном производстве сыра или сыре AOC, по-прежнему доступны у некоторых коммерческих поставщиков. Для производства традиционной феты в Греции, например, высушенные ягненки или козленки измельчаются в подсоленной воде, экстрагируются в течение нескольких часов, и в результате получается раствор с силой свертывания примерно 10 IMCU (или международными единицами свертывания молока). ) на миллилитр, затем можно использовать в течение 1 недели (Moschopoulou et al., 2006 г.). Поскольку условия производства ремесленных препаратов сычужного фермента сильно различаются, необходимо также учитывать связанную с ними неферментную фракцию экстракта (Rolet-Repecaud et al., 2013). В настоящее время для промышленного производства сычужного фермента телячьи велюры поставляются преимущественно из Новой Зеландии или Канады производителям сычужного фермента по всему миру, где замороженные велюры измельчаются, а зимоген экстрагируется водой и активируется путем снижения pH. Наконец, экстракты нейтрализуют, осветляют, очищают и концентрируют мембранной фильтрацией, а полученный препарат сычужного фермента продают либо в виде жидкого экстракта, либо в виде лиофилизированного порошка.Было показано, что современные вспомогательные средства для экстракции, такие как обработка ультразвуком, повышают активность и выход химозина в экстрактах (Ким и Зайас, 1991; Чжан и Ван, 2007), но подробностей, касающихся процедур промышленного производства, мало.
) на миллилитр, затем можно использовать в течение 1 недели (Moschopoulou et al., 2006 г.). Поскольку условия производства ремесленных препаратов сычужного фермента сильно различаются, необходимо также учитывать связанную с ними неферментную фракцию экстракта (Rolet-Repecaud et al., 2013). В настоящее время для промышленного производства сычужного фермента телячьи велюры поставляются преимущественно из Новой Зеландии или Канады производителям сычужного фермента по всему миру, где замороженные велюры измельчаются, а зимоген экстрагируется водой и активируется путем снижения pH. Наконец, экстракты нейтрализуют, осветляют, очищают и концентрируют мембранной фильтрацией, а полученный препарат сычужного фермента продают либо в виде жидкого экстракта, либо в виде лиофилизированного порошка.Было показано, что современные вспомогательные средства для экстракции, такие как обработка ультразвуком, повышают активность и выход химозина в экстрактах (Ким и Зайас, 1991; Чжан и Ван, 2007), но подробностей, касающихся процедур промышленного производства, мало.
Помимо химозина сычужные ферменты животных содержат пепсин, другую аспарагиновую протеиназу, в количестве, которое зависит от рациона животного и возраста на момент убоя. В то время как химозин отщепляет казеино-макропептид от κ-казеина преимущественно по пептидной связи Phe 105 -Met 106 , пепсин гораздо менее специфичен и гидролизует пептидные связи с остатками Leu, Phe, Tyr или Val (Agudelo et al., 2004 г.). Коммерческие препараты сычужного фермента обычно доступны с содержанием химозина от 50% до 97% (например, www.bioren.at).
Химозин теленка экспрессируется в трех генетических вариантах. Химозин А (молекулярная масса 35,71 кДа) и химозин В (молекулярная масса 35,65 кДа) отличаются только аминокислотой в положении 254, которая представляет собой аспарагин или глицин, соответственно (Kumar et al., 2010). Химозин А обладает более высокой ферментативной активностью, но подвергается автокаталитической деградации. Третья аллельная форма, химозин C, была выделена Rampilli et al. из продукта деградации химозина A.(2005), и было показано, что он проявляет более высокую активность свертывания молока. Однако редкость гена ответственна за низкое содержание химозина С в коммерческом сычужном ферменте.
из продукта деградации химозина A.(2005), и было показано, что он проявляет более высокую активность свертывания молока. Однако редкость гена ответственна за низкое содержание химозина С в коммерческом сычужном ферменте.
Что касается других жвачных животных, то сычуг, имеющий технологическое значение, получают из ягненка, козленка и буйвола. Химозин ягненка имеет такой же размер (приблизительно 36 кДа; Baudys et al., 1988), аналогичную чувствительность к кальцию и pH, но более низкую зависимость от температуры, чем химозин теленка (Rogelj et al., 2001). Кид-химозин с аналогичной молекулярной массой имеет максимальную свертывающую активность при рН 5.5, и считается термически стабильным до 55°C (Kumar et al., 2006). Что касается химозина буйвола, Malak et al. (1996) определили молекулярную массу 35,6 кДа и сообщили, что часть аминокислотной последовательности идентична последовательности химозина теленка. Для этого фермента самое высокое отношение свертывающей активности к протеолитической активности было обнаружено при 30°C (Mohanty et al. , 2003).
, 2003).
Особой формой животного сычужного фермента является паста из баранины, которая используется в некоторых средиземноморских странах для производства сыров AOC, таких как пекорино романо, фиоре сардо, ронкаль или идиасабаль (Addis et al., 2005; Феррандини и др., 2012 г.; Муккетти и др., 2009 г.). Паста из баранины традиционно производится из наполненных молоком желудков свежезабитых ягнят; затем эти желудки измельчают, сушат, солят и созревают (Addis et al., 2008). На ферментативную активность паштетов из баранины влияют, например, условия забоя или температура созревания. Паштет из баранины содержит большое количество преджелудочных и желудочных эстераз, которые способствуют липолизу и образованию свободных жирных кислот с интенсивным вкусом во время созревания сыра (Addis et al., 2005; Вирто и др., 2003). Было продемонстрировано, что пробиотические бактерии, добавляемые либо в рацион ягнят-сосунов, либо непосредственно при производстве паштета из баранины, дополнительно усиливали ферментативную активность препарата сычужного фермента (Santillo and Albenzio, 2008; Santillo et al. , 2009, 2012). Недавно Сантильо и соавт. (2014) предложили использовать инкапсулированные пробиотики в пасте из баранины для производства пробиотического овечьего сыра, где бактерии активны в течение 120 дней созревания из-за их медленного высвобождения.При изготовлении сычужной пасты в кустарных условиях, как это делается в некоторых регионах для производства автохтонных сортов сыра, необходимо учитывать микробиологическую нагрузку препаратов. Часто сообщалось, что ферментативный состав сычужной пасты, на который влияют ее сырье и условия производства, в значительной степени определяют интенсивность протеолиза и, следовательно, развитие вкуса и текстуры таких сыров (Addis et al., 2005; Феррандини и соавт., 2011; Пиризи и др., 2007 г.; Вирто и др., 2003).
, 2009, 2012). Недавно Сантильо и соавт. (2014) предложили использовать инкапсулированные пробиотики в пасте из баранины для производства пробиотического овечьего сыра, где бактерии активны в течение 120 дней созревания из-за их медленного высвобождения.При изготовлении сычужной пасты в кустарных условиях, как это делается в некоторых регионах для производства автохтонных сортов сыра, необходимо учитывать микробиологическую нагрузку препаратов. Часто сообщалось, что ферментативный состав сычужной пасты, на который влияют ее сырье и условия производства, в значительной степени определяют интенсивность протеолиза и, следовательно, развитие вкуса и текстуры таких сыров (Addis et al., 2005; Феррандини и соавт., 2011; Пиризи и др., 2007 г.; Вирто и др., 2003).
Химозин | Подкаст | Мир химии
Бен Валслер
На этой неделе Брайан Клегг становится дрянным…
Брайан Клегг
Можно простить вас за то, что вы не знаете о существовании химозина, хотя его альтернативное название реннин может объяснить, почему этот фермент представляет особый интерес для энтузиастов сыра. Химозин играет важную роль в пищеварительной системе некоторых очень молодых млекопитающих, особенно жвачных животных, таких как коровы, свертывая молоко, чтобы дать ему больше шансов на переваривание.Молодняк человека не вырабатывает химозин, используя различные ферменты для атаки белков молока, но это не значит, что мы не находим его полезным. Действие в желудках жвачных точно такое же, как и при производстве творога, который в конечном итоге становится сыром.
Химозин играет важную роль в пищеварительной системе некоторых очень молодых млекопитающих, особенно жвачных животных, таких как коровы, свертывая молоко, чтобы дать ему больше шансов на переваривание.Молодняк человека не вырабатывает химозин, используя различные ферменты для атаки белков молока, но это не значит, что мы не находим его полезным. Действие в желудках жвачных точно такое же, как и при производстве творога, который в конечном итоге становится сыром.
В сложной структуре пищеварительной системы жвачных животных четвертый отдел называется сычугом — довольно скучно названным «от omasum», третий отдел получил свое название от латинского слова «рубец».Основная работа сычуга очень похожа на человеческий желудок: атаковать белки кислотой перед дальнейшей работой с ними в кишечнике, но он также выполняет роль секреции химозина, который является основным активным компонентом сычужного фермента, используемого для производства сыра. Строго говоря, сычуг выделяет предшественник под названием прохимозин, который активируется при контакте с желудочной кислотой. Химозин представляет собой сложное соединение, белок, образованный одной цепью из 323 аминокислот. Функционально это пептидаза, что означает, что она катализирует расщепление белков с образованием более мелких молекул.В частности, он измельчает белок каппа-казеин, разделяя гидрофобную и гидрофильную части. Именно объединение гидрофобных остатков запускает процесс свертывания, в результате чего образуется творог и сыворотка. Белая эмульсия молока превращается в более прозрачную жидкость (сыворотку) плюс ту часть, которая интересует сыроваров, — вязкие твердые сгустки творога.
Химозин представляет собой сложное соединение, белок, образованный одной цепью из 323 аминокислот. Функционально это пептидаза, что означает, что она катализирует расщепление белков с образованием более мелких молекул.В частности, он измельчает белок каппа-казеин, разделяя гидрофобную и гидрофильную части. Именно объединение гидрофобных остатков запускает процесс свертывания, в результате чего образуется творог и сыворотка. Белая эмульсия молока превращается в более прозрачную жидкость (сыворотку) плюс ту часть, которая интересует сыроваров, — вязкие твердые сгустки творога.
Можно свернуть молоко с помощью растительных ферментов, особенно экстрактов крапивы и чертополоха, хотя большинство сыроделов считают, что результат хуже, чем при использовании сычужного фермента.Этот подход популярен среди некоторых вегетарианцев, хотя большая часть сычужного фермента больше не производится из животных. Гены, продуцирующие химозин, были успешно добавлены к микробным организмам, которые затем весело производят сычужный фермент без необходимости убивать что-либо, кроме грибка или бактерии, что вряд ли вызовет угрызения совести даже у самого ярого вегетарианца. Технически средство для производства химозина — грибок или бактерия — генетически модифицировано, что делает его одним из самых успешных ГМ-продуктов в пищевой цепочке.Однако, поскольку хозяин убит и удален, остается только сычужный фермент, не содержащий ГМО, что делает продукт приемлемым в Европейском Союзе и других регионах, где запрещены ГМ-продукты.
Технически средство для производства химозина — грибок или бактерия — генетически модифицировано, что делает его одним из самых успешных ГМ-продуктов в пищевой цепочке.Однако, поскольку хозяин убит и удален, остается только сычужный фермент, не содержащий ГМО, что делает продукт приемлемым в Европейском Союзе и других регионах, где запрещены ГМ-продукты.
Механизм модификации грибкового или бактериального гена известен как рекомбинация. Начиная с ДНК теленка, ген, отвечающий за выработку химозина, амплифицируется с помощью ПЦР или полимеразной цепной реакции — стандартного метода молекулярной биологии для получения миллионов копий небольшого фрагмента ДНК, который используется, например, в дактилоскопии ДНК.Фрагмент, продуцирующий химозин, затем вводят в плазмиду, небольшую структуру ДНК, используемую, в частности, бактериями, но также и некоторыми грибами для переноса генов между организмами. Это приводит к тому, что ген, продуцирующий химозин, становится частью ДНК хозяина, что позволяет ему генерировать необходимый белок. После первоначальной настройки производство продолжается без использования каких-либо продуктов животного происхождения. Помимо изменения генетического состава хозяина, обычно происходит некоторая модификация самого гена, поскольку для этого потребуются несколько иные механизмы контроля.Однако сам химозин идентичен — модификации соединения нет.
После первоначальной настройки производство продолжается без использования каких-либо продуктов животного происхождения. Помимо изменения генетического состава хозяина, обычно происходит некоторая модификация самого гена, поскольку для этого потребуются несколько иные механизмы контроля.Однако сам химозин идентичен — модификации соединения нет.
Основная причина изменения источника химозина заключалась не в том, чтобы избегать продуктов животного происхождения, а в том, чтобы получить более стабильный результат. Сычужный фермент животного происхождения содержит гораздо больше примесей, а в смесь добавляется целый ряд белков, которые могут либо вызвать проблемы с партией сыра, либо снизить общий выход. Не помешает и то, что химозин из грибов или бактерий значительно дешевле.В Великобритании и США около 90 процентов сычужного фермента, используемого в производстве сыра, особенно в твердых сырах, таких как чеддер, в настоящее время представляет собой этот неживотный химозин, известный в торговле как «химозин, произведенный ферментацией» или FPC, предположительно потому, что ферментация звучит лучше, чем бактериальные или грибковые. Наиболее распространенными источниками являются оба гриба – черная плесень Aspergillus niger и дрожжи Kluyveromyces lactis .
Наиболее распространенными источниками являются оба гриба – черная плесень Aspergillus niger и дрожжи Kluyveromyces lactis .
Таким образом, без химозина целая индустрия, вероятно, никогда не была бы запущена.Хотя вполне возможно, что использовались бы растительные заменители, их применение ограничено, и они никогда не привели бы к масштабам производства сыра, которые мы наблюдаем сегодня. Хотя мы вряд ли когда-либо услышим, как Уоллес восклицает: «Раскалывает химозин, втулка!», его любимый Wensleydale не был бы таким без него.
Бен Валслер
Это был Брайан Клегг с химозином – ферментом, благодаря которому торговцы сыром продолжают свою деятельность. На следующей неделе Табита Уотсон чувствует себя по-королевски…
Табита Уотсон
Названная в переводе с латыни «королевская вода», эта летучая смесь превращается из бесцветной в огненно-желто-оранжевую в течение нескольких секунд после приготовления. Вдобавок к этому драматическому эффекту, он также сильно дымит.
Вдобавок к этому драматическому эффекту, он также сильно дымит.
Бен Валслер
Узнайте, как эта величественная смесь кислот помогает поддерживать чистоту пробирок ЯМР, но требует бережного обращения, в подкасте Chemistry in its element на следующей неделе. До тех пор свяжитесь с любыми соединениями, которые вы хотели бы охватить, — по электронной почте [email protected] или в Твиттере @chemistryworld. Спасибо за внимание, я Бен Валслер.
Функция молокосвертывающих ферментов бычьего и верблюжьего химозина, изученная методом флуоресцентного резонансного переноса энергии
.2015 май; 98 (5): 2853-60. doi: 10.3168/jds.2014-8672. Epub 2015 26 февраля.Принадлежности Расширять
Принадлежности
- 1 Химический факультет Копенгагенского университета, DK-2100 Копенгаген, Дания; Хр.
 Hansen a/s, Bøge allé 10-12, DK-2970 Hørsholm, Дания.
Hansen a/s, Bøge allé 10-12, DK-2970 Hørsholm, Дания. - 2 Хр. Hansen a/s, Bøge allé 10-12, DK-2970 Hørsholm, Дания.
- 3 BioZyme Inc., Apex 27523, Северная Каролина.
- 4 Химический факультет Копенгагенского университета, DK-2100 Копенгаген, Дания.
- 5 Хр. Hansen a/s, Bøge allé 10-12, DK-2970 Hørsholm, Дания.Электронный адрес: [email protected].
Элемент в буфере обмена
Джеспер Лангхольм Дженсен и соавт.
Дж. Молочная наука.
2015 май.
Молочная наука.
2015 май.
Показать варианты
Формат АннотацияPubMedPMID
.2015 май; 98 (5): 2853-60. doi: 10.3168/jds.2014-8672. Epub 2015 26 февраля.Принадлежности
- 1 Химический факультет Копенгагенского университета, DK-2100 Копенгаген, Дания; Хр.
 Hansen a/s, Bøge allé 10-12, DK-2970 Hørsholm, Дания.
Hansen a/s, Bøge allé 10-12, DK-2970 Hørsholm, Дания. - 2 Хр. Hansen a/s, Bøge allé 10-12, DK-2970 Hørsholm, Дания.
- 3 BioZyme Inc., Apex 27523, Северная Каролина.
- 4 Химический факультет Копенгагенского университета, DK-2100 Копенгаген, Дания.
- 5 Хр. Hansen a/s, Bøge allé 10-12, DK-2970 Hørsholm, Дания. Электронный адрес: [email protected].
Элемент в буфере обмена
Полнотекстовые ссылки Параметры отображения цитированияПоказать варианты
Формат АннотацияPubMedPMID
Абстрактный
Ферментативную коагуляцию коровьего молока можно разделить на 2 этапа: ферментативный этап, на котором расщепляется связь Phe105-Met106 коровьего κ-казеина молочного белка, и этап агрегации.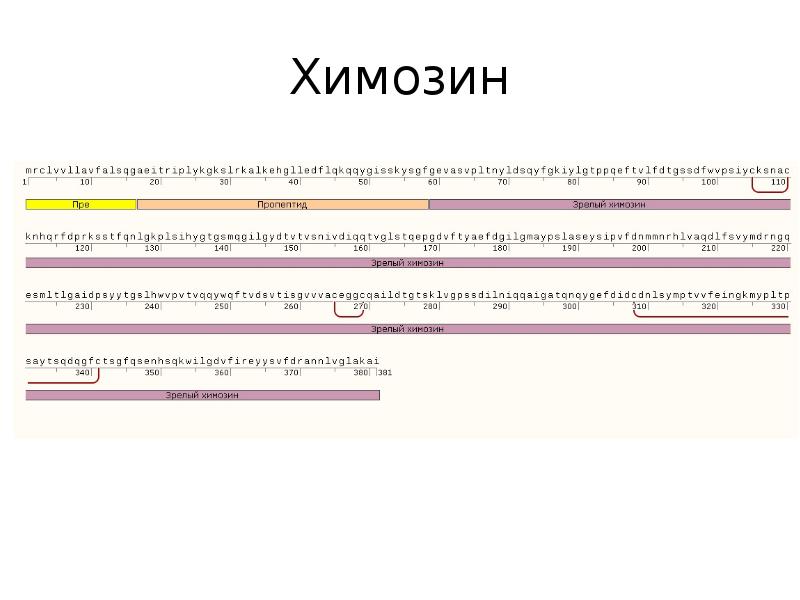 Аспарагиновые пептидазы бычьего и верблюжьего химозина (EC 3.4.23.4) обычно используются для катализа ферментативной стадии. Наиболее часто используемым методом изучения активности химозина является тест относительной активности свертывания молока, который измеряет конечную точку ферментативной стадии и стадии агрегации. Этот метод показал, что верблюжий химозин обладает в 2 раза более высокой молокосвертывающей активностью по отношению к коровьему молоку, чем бычий химозин. Для изучения ферментативной стадии, независимой от стадии агрегации, был разработан анализ переноса энергии флуоресцентного резонанса с использованием пептидного субстрата, полученного из последовательности 98-108 бычьего κ-казеина.Этот анализ и кинетику Михаэлиса-Ментен использовали для определения ферментативной активности верблюжьего и бычьего химозина в условиях, подобных свертыванию молока (рН 6,65, ионная сила 80 мМ). Полученные результаты показывают, что каталитическая эффективность верблюжьего химозина в 3 раза выше, чем бычьего химозина.
Аспарагиновые пептидазы бычьего и верблюжьего химозина (EC 3.4.23.4) обычно используются для катализа ферментативной стадии. Наиболее часто используемым методом изучения активности химозина является тест относительной активности свертывания молока, который измеряет конечную точку ферментативной стадии и стадии агрегации. Этот метод показал, что верблюжий химозин обладает в 2 раза более высокой молокосвертывающей активностью по отношению к коровьему молоку, чем бычий химозин. Для изучения ферментативной стадии, независимой от стадии агрегации, был разработан анализ переноса энергии флуоресцентного резонанса с использованием пептидного субстрата, полученного из последовательности 98-108 бычьего κ-казеина.Этот анализ и кинетику Михаэлиса-Ментен использовали для определения ферментативной активности верблюжьего и бычьего химозина в условиях, подобных свертыванию молока (рН 6,65, ионная сила 80 мМ). Полученные результаты показывают, что каталитическая эффективность верблюжьего химозина в 3 раза выше, чем бычьего химозина. Сродство к субстрату и каталитическая активность бычьего и верблюжьего химозина увеличиваются при более низком рН (6,00 и 5,50). Гликозилирование бычьего и верблюжьего химозина не влияет на связывание субстрата переноса энергии флуоресцентного резонанса, но двойное гликозилирование верблюжьего химозина, по-видимому, имеет несколько более высокую каталитическую эффективность.При характеристике ферментов разработанный анализ проще и быстрее использовать, чем традиционно используемый метод определения относительной молокосвертывающей активности.
Сродство к субстрату и каталитическая активность бычьего и верблюжьего химозина увеличиваются при более низком рН (6,00 и 5,50). Гликозилирование бычьего и верблюжьего химозина не влияет на связывание субстрата переноса энергии флуоресцентного резонанса, но двойное гликозилирование верблюжьего химозина, по-видимому, имеет несколько более высокую каталитическую эффективность.При характеристике ферментов разработанный анализ проще и быстрее использовать, чем традиционно используемый метод определения относительной молокосвертывающей активности.
Ключевые слова: Михаэлис-Ментен; коагулянт; анализ переноса энергии флуоресцентного резонанса; свертывание молока.
Авторское право © 2015 Американская ассоциация молочной науки.Опубликовано Elsevier Inc. Все права защищены.
Похожие статьи
- Верблюжий и бычий химозин: взаимосвязь между их структурой и сыродельными свойствами.
Лангхольм Йенсен Дж., Молгард А., Наварро Поульсен Дж. К., Харбо М. К., Симонсен Дж. Б., Лоренцен А. М., Йернё К., ван ден Бринк Дж. М., Квист К. Б., Ларсен С. Лангхольм Дженсен Дж. и соавт. Acta Crystallogr D Биол Кристаллогр.2013 май; 69 (часть 5): 901-13. дои: 10.1107/S0
- 4913003260. Epub 2013 19 апр. Acta Crystallogr D Биол Кристаллогр. 2013. PMID: 23633601 Бесплатная статья ЧВК.
- Характеристика рекомбинантного верблюжьего химозина показывает превосходные свойства коагуляции коровьего и верблюжьего молока.
Каппелер С.Р., ван ден Бринк Х.Дж., Рахбек-Нильсен Х., Фарах З., Пухан З., Хансен Э.
 Б., Йохансен Э.Каппелер С.Р. и соавт.
Biochem Biophys Res Commun. 2006 г., 7 апреля; 342(2):647-54. doi: 10.1016/j.bbrc.2006.02.014. Epub 2006, 13 февраля.
Biochem Biophys Res Commun. 2006.
PMID: 16488399
Б., Йохансен Э.Каппелер С.Р. и соавт.
Biochem Biophys Res Commun. 2006 г., 7 апреля; 342(2):647-54. doi: 10.1016/j.bbrc.2006.02.014. Epub 2006, 13 февраля.
Biochem Biophys Res Commun. 2006.
PMID: 16488399 - Сравнение гидролиза бычьего κ-казеина верблюжьим и бычьим химозином: исследование кинетики и специфичности.
Меллер К.К., Раттрей Ф.П., Соренсен Ю.С., Ардо Ю. Мёллер К.К. и др.J Agric Food Chem. 2012 30 мая; 60 (21): 5454-60. doi: 10.1021/jf300557d. Epub 2012 17 мая. J Agric Food Chem. 2012. PMID: 22563811
- Белковая инженерия молокосвертывающих аспарагиновых протеиназ.
Айкава Дж., Нишияма М., Беппу Т. Айкава Дж. и др. Scand J Clin Lab Invest Suppl. 1992;210:51-8. Scand J Clin Lab Invest Suppl.
 1992.
PMID: 1455180
Обзор.
1992.
PMID: 1455180
Обзор. - Вклад молокосвертывающих ферментов и плазмина в созревание сыра.
Фарки Нью-Йорк. Фарки Нью-Йорк. Adv Exp Med Biol. 1995;367:195-207. дои: 10.1007/978-1-4615-1913-3_11. Adv Exp Med Biol. 1995. PMID: 7572361 Обзор. Аннотация недоступна.
Цитируется
1 артикул- Конститутивная экспрессия прохимозина B Camelus bactrianus в Pichia pastoris .
Акишев З., Кирибаева А., Мусахметов А., Балтин К., Раманкулов Ю., Хасенов Б. Акишев З. и др. Гелион. 2021 28 мая; 7(5):e07137. doi: 10.1016/j.heliyon.2021.e07137. Электронная коллекция 2021 май. Гелион. 2021. PMID: 34113734 Бесплатная статья ЧВК.

Типы публикаций
- Поддержка исследований, за пределами США правительство
термины MeSH
- Резонансный перенос энергии флуоресценции / методы
- Флуоресцентный резонансный перенос энергии / ветеринария*
LinkOut — больше ресурсов
Полнотекстовые источники
Прочие литературные источники
Базы данных по молекулярной биологии
Укажите
КопироватьФормат: ААД АПА МДА НЛМ
Микробное производство рекомбинантного химозина
Введение
Процесс производства сыра. Свертывание (свертывание) производится на ранних стадиях производства. Казеин распадается на более мелкие фрагменты под действием химозина.
Свертывание (свертывание) производится на ранних стадиях производства. Казеин распадается на более мелкие фрагменты под действием химозина.Производство сыра требует использования белка из 323 аминокислот, называемого химозином (также известным как реннин). Химозин (36 кДа) представляет собой протеолитический фермент, который обычно получают из желудков телят. Роль этого фермента заключается в свертывании молока, что очень важно для переваривания молока у молодых животных. Первоначально химозин секретируется в виде неактивного прохимозина, а затем активируется при низком рН.Как только он становится активным, он расщепляет молочный белок k-казеин в определенной точке и вызывает свертывание, что является первым шагом в производстве сыра. При свертывании молока получается твердый продукт, называемый творогом. Затем творог перерабатывается для изготовления сыра[1,2].
Рост производства сыра в мире в сочетании с сокращением количества забитых телят стимулировал поиск альтернативных источников химозина.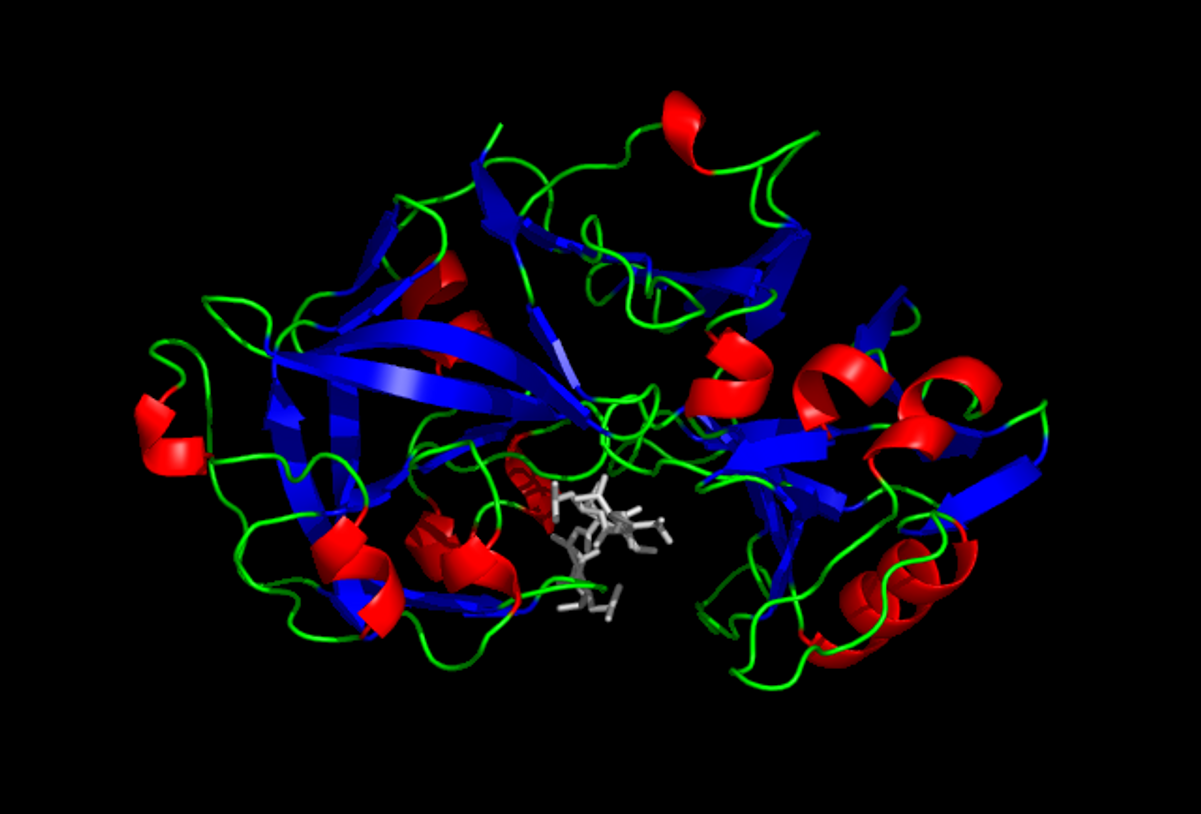 Одним из таких альтернативных источников является использование рекомбинантного химозина, продуцируемого микроорганизмами.Рекомбинантный химозин в основном продуцируется грибами, но также может быть получен с использованием бактерий.
Одним из таких альтернативных источников является использование рекомбинантного химозина, продуцируемого микроорганизмами.Рекомбинантный химозин в основном продуцируется грибами, но также может быть получен с использованием бактерий.
Механизм действия химозина
Молоко состоит из воды, жира, белка, фосфата, лактозы, лимонной кислоты и неорганических веществ, таких как фосфат кальция. Белковый компонент молока можно разделить на две группы: казеиновую фракцию (α s1 -казеин, α s2 -казеин, β-казеин и κ-казеин) и сывороточные белки (β-лактоглобулин, β-лактоальбумин). , иммуноглобулины и сывороточный альбумин).Казеиновые белки — это те, которые будут образовывать творог во время производства сыра, особенно κ-казеин [3].
Химозин, широко известный как ренин, является основным ферментом, коагулирующим молоко, который состоит из одной полипептидной цепи из 323 аминокислот с внутримолекулярными дисульфидными связями. Препараты сычужного фермента телят содержат две формы химозина, А и В. Единственная разница между химозинами А и В состоит в одной аминокислоте в полипептидной цепи; химозин А содержит остаток аспарагиновой кислоты в положении 286, тогда как химозин В содержит остаток глицина в том же положении [2].
Единственная разница между химозинами А и В состоит в одной аминокислоте в полипептидной цепи; химозин А содержит остаток аспарагиновой кислоты в положении 286, тогда как химозин В содержит остаток глицина в том же положении [2].
Как и другие кислые протеазы желудочного сока, химозин секретируется в виде неактивного предшественника, прохимозина. Предшественник стабилен при слабощелочном рН, тогда как активный фермент быстро денатурирует при значениях рН выше 7. Ниже рН 5 прохимозин превращается в химозин в результате ограниченного протеолиза, в ходе которого от N-конца отщепляется пептидный сегмент. Протеолитическая активность химозина имеет оптимальный рН около рН 3-5.
Молокосвертывающая активность химозина обусловлена протеолизом κ-казеина.κ-Казеин состоит из двух частей: одна гидрофобная, а другая гидрофильная. В молоке этот белок стабилизирует мицеллы казеина от агрегации. В процессе свертывания молока связь Phe-Met гидролизуется, высвобождается гидрофильная часть κ-казеина и происходит агрегация [3]. Химозин специфически распознает последовательность от His 98 до Lys 111 и расщепляет пептидную связь между Phe 105 и Met 106 в цепи κ-казеина [4].
Химозин специфически распознает последовательность от His 98 до Lys 111 и расщепляет пептидную связь между Phe 105 и Met 106 в цепи κ-казеина [4].
Производство рекомбинантного химозина
Рекомбинация — это процесс, при котором генетический материал разрушается, а затем присоединяется к новому генетическому материалу.В этом случае ген химозина коровы вынимают из генома и затем вводят в плазмиду. Затем плазмиду вводят в микроорганизм, который начинает продуцировать химозин путем транскрипции и трансляции гена из плазмиды.
Первым шагом в этом процессе является получение кусочка ткани из желудка теленка и выделение ДНК из клеток. После выделения ДНК необходимо амплифицировать ген химозина с помощью ПЦР, чтобы увеличить количество фрагментов гена по сравнению с другими последовательностями генома.Другой вариант — прямое выделение мРНК и превращение ее в кДНК с помощью фермента ретротранскриптазы; таким образом мы получили бы фрагмент ДНК без интронов, поскольку гены обнаруживаются у прокариотических микробов.
Вторым этапом является введение последовательности гена в плазмиды, которые затем вводятся в микробы-мишени. Ген часто вводят после последовательности промотора, которую мы можем контролировать, чтобы увеличить его экспрессию.
После введения гена в плазмиду и плазмиды в микроб он начнет производить химозин, и последним шагом будет его очистка.Наиболее распространенный способ сделать это — использовать очистительную колонку, в которой химозин будет прилипать к колонке из-за его сродства к матрице внутри колонки, в то время как другие белки не будут прилипать [2].
Важный факт, который следует учитывать при использовании рекомбинации генов одного вида в другой вид, — это специфические различия в использовании кодонов. Эта проблема обычно вызывает низкий уровень экспрессии белка, который мы хотим производить. Чтобы избежать этой проблемы, последовательность ДНК гена должна быть модифицирована и адаптирована к использованию кодонов видами, у которых будет продуцироваться химозин, это называется оптимизацией кодонов [5].
Еще одним важным этапом в производстве является секреция белка микробными клетками, последовательность химозина также может быть изменена для улучшения его секреции. Модификации часто представляют собой добавления секреторных контролирующих областей микроба, которые будут использоваться для производства гена. Одним из примеров таких стратегий улучшения продукции химозина является добавление в каркас гена глюкоамилазы в Aspergillus сразу после гена прохимозина. Глюкоамилаза представляет собой секретируемый белок, который секретируется даже с присоединенным к нему белком химозином.При таком слиянии генов достигается более высокая концентрация секретируемого прохимозина [6].
Некоторыми другими полезными инструментами для увеличения производства являются добавление к гену областей контроля транскрипции и трансляции видов-хозяев, которые могут быть не только специфическими промоторами (как упомянуто выше), но также специфическими терминаторами транскрипции [7].
Обычный способ контролировать производство (и увеличить его) — это добавить промотор, который индуцируется какой-либо молекулой. Когда мы добавим эту молекулу (индуктор) в питательную среду, микроб начнет транскрибировать наш ген и производить химозин.Одним из примеров индуктора, который используется при работе с Escherichia coli , является молекула IPTG, которая является аналогом лактозы и связывается с белком-репрезором в lac-опероне, тем самым индуцируя его. Использование промотора оперона lac перед геном химозина и IPTC в качестве индуктора увеличивает продукцию белка [8].
Когда мы добавим эту молекулу (индуктор) в питательную среду, микроб начнет транскрибировать наш ген и производить химозин.Одним из примеров индуктора, который используется при работе с Escherichia coli , является молекула IPTG, которая является аналогом лактозы и связывается с белком-репрезором в lac-опероне, тем самым индуцируя его. Использование промотора оперона lac перед геном химозина и IPTC в качестве индуктора увеличивает продукцию белка [8].
Микробы, используемые в производстве химозина
Наиболее распространенными микробами, используемыми для производства рекомбинантного химозина, являются грибы, но этот белок также может быть получен с использованием бактерий.Тремя наиболее часто используемыми микробами являются Aspergillus niger, Kluyveromices lactis и Escherichia coli . Эти три вида имеют очень хорошо известную генетику и метаболические пути, особенно Aspergillus niger и Escherichia coli , что делает их очень полезными для экспериментов по рекомбинации, таких как производство химозина.
Aspergillus — это название, используемое для рода плесеней, которые размножаются только бесполым путем. видов Aspergillus обычны и широко распространены. Они являются одной из наиболее успешных групп плесеней, играющих важную роль в природных экосистемах и экономике человека[9].
Aspergillus niger — один из наиболее распространенных видов этого рода[10]. Он встречается в самых разных средах, но особенно на растительности, разлагающемся органическом веществе и почве. У людей инфекция Aspergillus niger представляет собой проблему только для людей с ослабленной иммунной системой.Чаще всего он вызывает инфекции легких, но также может распространяться на другие органы и открытые раны[11].
A. niger впервые приобрел практическое значение в 1919 г., когда его способность производить лимонную кислоту была использована в промышленности. Глюконовая и фумаровая кислоты были получены с A.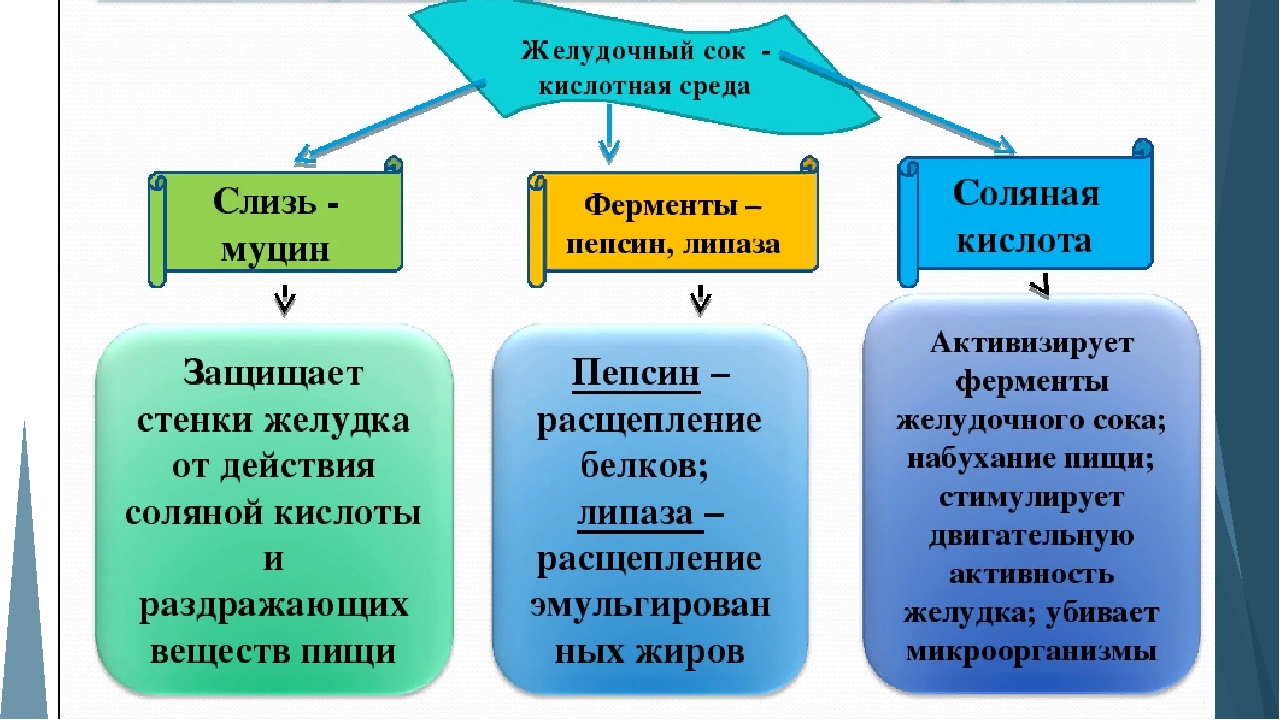 niger , хотя они имеют меньшее экономическое значение. Однако с 1960-х годов A. niger стал источником различных ферментов, которые хорошо зарекомендовали себя в качестве технических вспомогательных средств при переработке фруктов, выпечке, а также в крахмальной и пищевой промышленности.Генная технология успешно применялась для улучшения производственных процессов и использования A. niger в качестве системы экспрессии чужеродных белков [12]. Эта последняя часть является причиной использования этого микроба для производства химозина, A. niger используется во многих различных биотехнологических процессах, поэтому генетика прекрасно известна.
Другая причина использования A. niger заключается в том, что многие ферменты, продуцируемые A. niger , такие как лимонная кислота, амилазы, липазы, целлюлазы, ксиланазы и протеазы, считаются GRAS (обычно признанными безопасными) Соединенными Штатами Америки. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов[12], поэтому это не считается риском для здоровья человека.
niger , хотя они имеют меньшее экономическое значение. Однако с 1960-х годов A. niger стал источником различных ферментов, которые хорошо зарекомендовали себя в качестве технических вспомогательных средств при переработке фруктов, выпечке, а также в крахмальной и пищевой промышленности.Генная технология успешно применялась для улучшения производственных процессов и использования A. niger в качестве системы экспрессии чужеродных белков [12]. Эта последняя часть является причиной использования этого микроба для производства химозина, A. niger используется во многих различных биотехнологических процессах, поэтому генетика прекрасно известна.
Другая причина использования A. niger заключается в том, что многие ферменты, продуцируемые A. niger , такие как лимонная кислота, амилазы, липазы, целлюлазы, ксиланазы и протеазы, считаются GRAS (обычно признанными безопасными) Соединенными Штатами Америки. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов[12], поэтому это не считается риском для здоровья человека.
Наиболее часто используемым A. niger в производстве химозина является Aspergillus niger var awamori . Мутант со сверхэкспрессией глюкоамилазы, полученный из штамма NRRL 3112, был подвергнут мутагенезу и селекции для выделения двух ауксотрофных мутантов pyrG (дефицит оротидин-5′-монофосфатдекарбоксилазы; для роста требуется уридин) и argB (дефицит орнитинтранскарбамилазы; требуется аргинин для роста). Эти штаммы были скрещены, и из потомства был выделен двойной мутант pyrG argB, обозначенный как GC12.Цель этих модификаций состояла в том, чтобы обеспечить селектируемые маркеры для последующих генетических манипуляций.
На следующем этапе штамм GC12 был модифицирован путем замены его гена, кодирующего аспергиллопепсин А, внеклеточную аспарагиновую протеиназу, которая может расщеплять химозин и вызывать неприятный запах сыра, на ген argB A. nidulans. Для трансформации штамма GC12 использовали линейный фрагмент ДНК, содержащий 5′- и 3′-фланкирующие участки гена аспергиллопепсина А и гена argB A.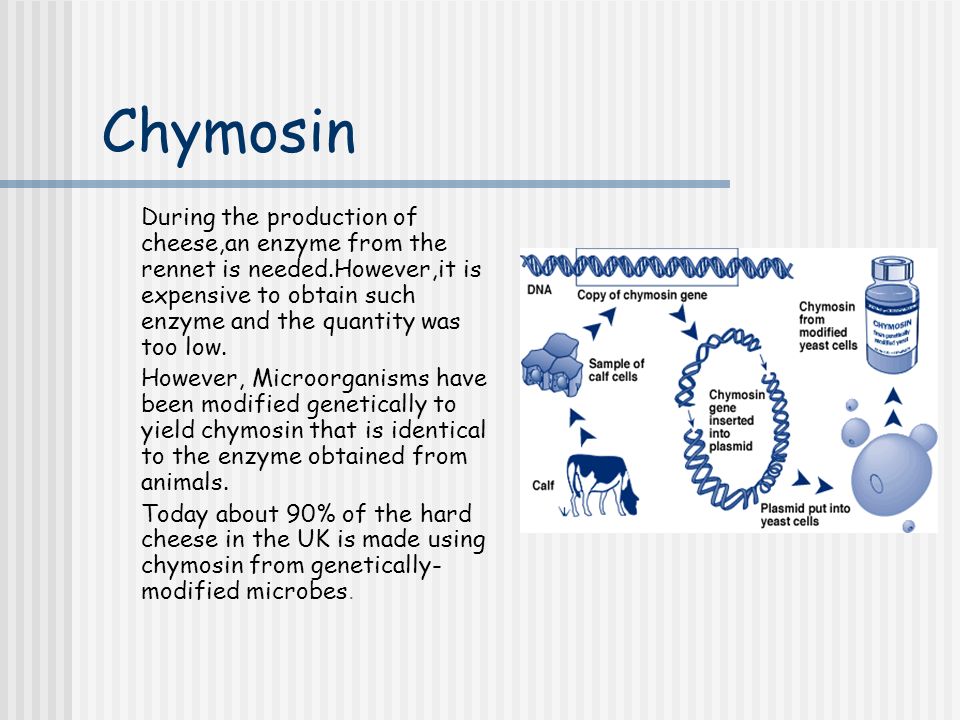 nidulans.Трансформанты отбирали по утрате ауксотрофии по аргинину. Вектор экспрессии, обозначенный как pGAMpR, был сконструирован на основе плазмиды pBR322. Вектор содержит промотор глюкоамилазы A. awamori и кодирующую глюкоамилазу область, слитые в рамке считывания с кДНК бычьего прохимозина, за которыми следует терминатор глюкоамилазы A. niger. Вектор также содержит ген pyr4 из Neurospora crassa, который может дополнять мутацию pyrG в штамме-хозяине и позволяет проводить отбор трансформантов, в которых утрачена потребность в уридине.Дефицитный по аспергиллопепсину штамм GCdeltaAP4 трансформировали вектором экспрессии.
Клетки выращивают в аэробных условиях при надлежащих условиях pH, температуры, состава питательных веществ и т. д. После того, как химозин достигает желаемого уровня в ферментационном бульоне, ферментацию останавливают и грибковые клетки отделяют от жидкости. Затем из бульона выделяют химозин. Для выделения бульон фильтруют с последующей хроматографической очисткой и концентрацией химозина[13].
nidulans.Трансформанты отбирали по утрате ауксотрофии по аргинину. Вектор экспрессии, обозначенный как pGAMpR, был сконструирован на основе плазмиды pBR322. Вектор содержит промотор глюкоамилазы A. awamori и кодирующую глюкоамилазу область, слитые в рамке считывания с кДНК бычьего прохимозина, за которыми следует терминатор глюкоамилазы A. niger. Вектор также содержит ген pyr4 из Neurospora crassa, который может дополнять мутацию pyrG в штамме-хозяине и позволяет проводить отбор трансформантов, в которых утрачена потребность в уридине.Дефицитный по аспергиллопепсину штамм GCdeltaAP4 трансформировали вектором экспрессии.
Клетки выращивают в аэробных условиях при надлежащих условиях pH, температуры, состава питательных веществ и т. д. После того, как химозин достигает желаемого уровня в ферментационном бульоне, ферментацию останавливают и грибковые клетки отделяют от жидкости. Затем из бульона выделяют химозин. Для выделения бульон фильтруют с последующей хроматографической очисткой и концентрацией химозина[13].
Kluyveromyces lactis — это аскомицетовые дрожжи (очень похожие на Saccharomyces cerevisiae ), которые обладают способностью ассимилировать лактозу и превращать ее в молочную кислоту. Фактически, они были выделены из молока и составляют преобладающую эукариотную группу при производстве сыра.
K. lactis используется для производства бета-галактозидазы, и его свойства ферментации хорошо изучены.Он обладает большинством черт, которые делают Saccharomyces cerevisiae лучшим модельным эукариотическим организмом (наличие хорошо зарекомендовавшей себя генетики, доступность быстрых и эффективных процедур трансформации и его эффективный механизм гомологичной рекомбинации), и также важно, что этот микроб используются и на других этапах цепочки производства сыра. Он также считается микробом GRAS [14,15].
Было обнаружено, что химозин может продуцироваться у этого хозяина при хорошем уровне секреции в среду. Ген химозина встраивают в хромосому K. lactis (обычно с помощью вектора экспрессии, полученного из плазмиды pUC18), и дрожжи выращивают путем периодической ферментации с подпиткой (подача питательного субстрата, ограничивающего рост, в культуру). После ферментации дрожжи убивают добавлением бензойной кислоты, а химозин выделяют фильтрованием [16,17].
Ген химозина встраивают в хромосому K. lactis (обычно с помощью вектора экспрессии, полученного из плазмиды pUC18), и дрожжи выращивают путем периодической ферментации с подпиткой (подача питательного субстрата, ограничивающего рост, в культуру). После ферментации дрожжи убивают добавлением бензойной кислоты, а химозин выделяют фильтрованием [16,17].
Обычно для введения гена прохимозина в K. lactis необходим промежуточный хозяин. кДНК препрохимозина клонируют в плазмиду pBR322 и амплифицируют в E.коли . ДНК, кодирующую прохимозин, продуцируемый E. coli , затем выделяют и используют для конструирования экспрессионного вектора на основе плазмиды pUC18, которую затем вводят в K. lactis [13].
Кишечная палочка Escherichia coli — это бактерия, которая является обычным обитателем толстой кишки человека. Он также живет в кишечнике многих других животных, как диких, так и домашних. Это грамотрицательные палочковидные гаммапротеобактерии. Это модельный организм для изучения бактерий.
Обычно Escherichia coli не вызывает заболевания, хотя некоторые штаммы часто вызывают диарею и являются наиболее частой причиной инфекций мочевыводящих путей.
Это модельный организм для изучения бактерий.
Обычно Escherichia coli не вызывает заболевания, хотя некоторые штаммы часто вызывают диарею и являются наиболее частой причиной инфекций мочевыводящих путей.
Escherichia coli — одна из наиболее тщательно изученных живых существ. Это любимый организм для генной инженерии, поскольку его генетика и метаболизм изучены лучше всего. Еще одно преимущество изучения Escherichia coli заключается в том, что ее можно очень легко и недорого выращивать в лабораторных условиях.Ферментативные свойства рекомбинантного химозина E. coli неотличимы от свойств нативного химозина теленка[18], что также важно, поскольку эффективность процесса производства сыра одинакова.
Проблема с E. coli , однако, заключается в том, что рекомбинантные белки часто синтезируются в виде внутриклеточных телец включения, а не секретируются, что значительно увеличивает стоимость процесса. После распада клеток тельца включения собирают центрифугированием. Еще одна проблема с E. coli заключается в том, что он обычно не считается безопасным для употребления человеком[2].
Еще одна проблема с E. coli заключается в том, что он обычно не считается безопасным для употребления человеком[2].
Одним из примеров продукции E. coli является штамм K12 JA198. Этот штамм подвергали нескольким генетическим манипуляциям для конструирования штамма-реципиента экспрессионной плазмиды, несущей ген прохимозина А. Экспрессионная плазмида была получена из широко используемого клонирующего вектора pBR322. кДНК, кодирующая бычий химозин А, была ранее клонирована и охарактеризована.Ген прохимозина был разделен на три участка, каждый из которых оканчивался уникальным сайтом узнавания рестрикционной эндонуклеазой. Все три субклонированных среза собирали вместе в правильном порядке для реконструкции гена прохимозина, который был вставлен в вектор pBR322.
Производственный штамм выращивают в водном растворе, содержащем углеводы, азот, минеральные соли и различные неорганические и органические соединения. Твердый прохимозин высвобождается из организма-продуцента путем разрушения клеток и сбора «телец включения» центрифугированием [13].
Заключение
Из-за уменьшения количества забитых телят и этической проблемы, которую вызывает убийство огромного количества животных, важно иметь альтернативный способ производства сыра, который не требует жертвоприношения ни одного животного. Кроме того, производство микроорганизмами рекомбинантного химозина предлагает простой способ увеличения производства химозина по сравнению с количеством, которое можно получить от молодых телят.
Важно учитывать, что могут потребоваться некоторые модификации в последовательности гена в зависимости от микроба, который будет использоваться для производства любого рекомбинантного белка из-за различий между видами в использовании кодонов.Принимая это во внимание, можно резко увеличить производство желаемого белка. Также важно изменить эту последовательность для достижения более высоких уровней производства, и именно на этом сосредоточены текущие исследования.
Ссылки
[1] JS Emtage, S Angal, MT Doel, TJ Harris, B Jenkins, G Lilley и PA Lowe. «Синтез телячьего прохимозина (прореннина) в Escherichia coli». Proc Natl Acad Sci U S A . 1983 г., июнь; 80 (12): 3671–3675.
«Синтез телячьего прохимозина (прореннина) в Escherichia coli». Proc Natl Acad Sci U S A . 1983 г., июнь; 80 (12): 3671–3675.
[2] С.А. Эль-Сохайми Эльсайед. Э., Хафез и М.А. Эль Саадани. «Клонирование и транскрипция in vitro гена химозина в E. coli». Открытый журнал нутрицевтиков . 2010, 3, 63-68.
[3] E. Gastaldi, N. Trial, C. Guillaume, E. Bourret, N. Gontard и JL Cuq. «Влияние контролируемого гидролиза κ-казеина на реологические свойства кислых молочных гелей». J Dairy Sci . 2003 март; 86 (3): 704-11.
[4] Б Фольтманн. «Прохимозин и химозин (прореннин и реннин)». Биохим J .1969 г., ноябрь; 115(3): 3П–4П.
[5] Хьюго Дж. Менцелла. «Сравнение двух стратегий оптимизации кодонов для увеличения производства рекомбинантного белка в Escherichia coli ». Факт о микробных клетках . 2011 г.; 10:15.
[6] Уорд М., Уилсон Л.Дж., Кодама К.Х., Рей М.В., Берка Р.М. «Улучшенное производство химозина в Aspergillus путем экспрессии в виде слияния глюкоамилазы и химозина». Биотехнология (Нью-Йорк) . 1990 г., май; 8(5):435-40.
Биотехнология (Нью-Йорк) . 1990 г., май; 8(5):435-40.
[7] Кардоса Р.Е., Гутьеррес С., Ортега Н., Колина А., Каскейро Х., Мартин Х.Ф.«Экспрессия синтетической копии гена бычьего химозина в Aspergillus awamori из конститутивных и рН-регулируемых промоторов и секреция с использованием двух разных последовательностей пре-про». Биотехнолог Биоэнг . 2003 г., 5 августа; 83 (3): 249–59.
[8] Zhang Y, Zhou Wei, Liu N, Yang K. «Экспрессия гена прохимозина теленка в Escherichia coli». Чин Дж Биотехнолог . 1991;7(3):169-75.
[9] Джоан В. Беннетт. «Обзор рода Aspergillus ».
[10] Масаюки Мачида и Кацуя Гом.« Aspergillus : Молекулярная биология и геномика». Национальный институт передовых промышленных наук и технологий . январь 2010 г.
[11] Aspergillus niger .
[12] Шустер, Э., Данн-Коулман, Н., Фрисвад, Дж., Ван Дейк, П. «О безопасности Aspergillus niger – обзор». Прикладная микробиология и биотехнология. 2002. Том 59. с. 426-435.
2002. Том 59. с. 426-435.
[13] ЦЕНТРАЛЬНОЕ ИССЛЕДОВАНИЕ PFIZER (1988). Международная подача по химозину. Представлено в ВОЗ компанией Pfizer, Inc., Гротон, Коннектикут, США.
[14] Rodicio R, Heinisch JJ. «Дрожжи млечного пути: генетика, физиология и биотехнология Kluyveromyces lactis ». Дрожжи . 2013 11 апр.
[15] Yuan W, Ke T, Du M, Chu X, Hu F, Hui F. «Синтез гена бычьего прохимозина и высокий уровень экспрессии в Kluyvermyces lactis». Шэн Ву Гонг Ченг Сюэ Бао . 2010 сен; 26 (9): 1281-6.
[16] Весоловски-Лувель, М., К.Д. Breunig и H. Fukuhara, Kluyveromyces lactis.В: К. Вольф, редактор. Нетрадиционные дрожжи в биотехнологии. Гейдельберг: Springer-Verlag, 1996: с. 139-201.
[17] Лашанс М.А. «Современное состояние систематики Kluyveromyces». FEMS Yeast Res . 2007 авг.; 7(5):642-5.
[18] Meisel H, Frister H. «Химическая характеристика казеинофосфопептида, выделенного из переваров казеиновой диеты in vivo». Biol ChemHoppe Seyler 1988; 369(12): 1275-9.
Biol ChemHoppe Seyler 1988; 369(12): 1275-9.
Под редакцией Энрике Родригеса, ученицы Норы Салливан, изучавшей BIOL187S (Микробная жизнь) научного факультета Кека колледжей Клермонта, весна 2013 г.
Химозин | Encyclopedia.com
oxford
просмотров обновлено 29 мая 2018 г. химозин Фермент в сычуге телят и желудке младенцев человека, который свертывает молоко путем осаждения казеина. Также известен как реннин. Биосинтетический химозин используется в сыроделии (растительный сычужный фермент). См. также сыр.A Dictionary of Food and Nutrition DAVID A. BENDER
oxford
просмотров обновлено 11 июня 2018 г. реннин Фермент протеаза, обнаруженный в четвертом желудке сычуга жвачных животных, который вызывает свертывание молока путем превращения растворимого белка казеиногена в нерастворимый казеин.Затем его атакует фермент пепсин.Зоологический словарь МАЙКЛ АЛЛАБИ
oxford
просмотров обновлено 11 июня 2018 г. реннин ( химозин ) Фермент, секретируемый клетками, выстилающими желудок, который отвечает за свертывание молока у млекопитающих. Он действует на растворимый молочный белок ( казеиноген ), который преобразуется в нерастворимую форму казеина. Это гарантирует, что молоко остается в желудке достаточно долго, чтобы на него воздействовали ферменты, расщепляющие белок.
реннин ( химозин ) Фермент, секретируемый клетками, выстилающими желудок, который отвечает за свертывание молока у млекопитающих. Он действует на растворимый молочный белок ( казеиноген ), который преобразуется в нерастворимую форму казеина. Это гарантирует, что молоко остается в желудке достаточно долго, чтобы на него воздействовали ферменты, расщепляющие белок.Биологический словарь
оксфорд
просмотров обновлено 08 июня 2018ren·nin / ˈrenin/ • н. фермент, выделяемый в желудок неотъемлемых млекопитающих, а также у некоторых низших животных и растений, вызывающий свертывание молока.
Оксфордский карманный словарь современного английского языка
oxford
просмотров обновлено 27 июня 2018 г. rennin ( ren -in) n. фермент, вырабатываемый в желудке, который свертывает молоко.Он превращает казеиноген (молочный белок) в нерастворимый казеин в присутствии ионов кальция. Это гарантирует, что молоко останется в желудке, подвергаясь воздействию ферментов, расщепляющих белок, как можно дольше.
Это гарантирует, что молоко останется в желудке, подвергаясь воздействию ферментов, расщепляющих белок, как можно дольше. Словарь по сестринскому делу
Оксфорд
просмотров обновлено 29 мая 2018Словарь по продуктам питания и питанию ДЭВИД А. БЕНДЕР
Химозин — wikidoc
Не путать с ренином, энзимом. артериальное кровяное давление.Химозин или реннин представляет собой протеазу, обнаруженную в сычужном ферменте. Это аспарагиновая эндопептидаза, принадлежащая к семейству MEROPS A1. Он вырабатывается новорожденными жвачными животными в слизистой оболочке сычуга, чтобы свернуть молоко, которое они проглатывают, что позволяет дольше оставаться в кишечнике и лучше всасываться. Широко используется в производстве сыра. Бычий химозин в настоящее время производится рекомбинантно в E. coli , Aspergillus niger var awamori и K. lactis в качестве альтернативного источника.
Возникновение
Химозин вырабатывается жвачными животными в слизистой оболочке сычуга. Химозин вырабатывается главными клетками желудка у молодых жвачных животных и некоторых других новорожденных животных [2] для свертывания проглатываемого ими молока, что позволяет ему дольше оставаться в кишечнике и лучше его всасывать. Его производят некоторые другие нежвачные виды, включая свиней, кошек и тюленей. [3]
Химозин вырабатывается главными клетками желудка у молодых жвачных животных и некоторых других новорожденных животных [2] для свертывания проглатываемого ими молока, что позволяет ему дольше оставаться в кишечнике и лучше его всасывать. Его производят некоторые другие нежвачные виды, включая свиней, кошек и тюленей. [3]
В одном исследовании сообщалось об обнаружении химозиноподобного фермента у некоторых младенцев, [4] , но другие не смогли воспроизвести это открытие. [5] У людей есть псевдоген химозина, который не генерирует белок, обнаруженный на хромосоме 1. [3] [6] У людей есть другие белки для переваривания молока, такие как пепсин и липаза. [7] :262
Ферментативная реакция
Химозин используется для обеспечения интенсивного осаждения и образования сгустка при производстве сыра. Нативным субстратом химозина является К-казеин, который специфически расщепляется по пептидной связи между аминокислотными остатками 105 и 106, фенилаланином и метионином. [8] Полученный продукт представляет собой фосфоказеинат кальция. [ необходима ссылка ] Когда специфическая связь между гидрофобными (пара-казеин) и гидрофильными (кислотный гликопептид) группами казеина разрывается, гидрофобные группы объединяются и образуют трехмерную сеть, которая захватывает водную фазу молока.
[8] Полученный продукт представляет собой фосфоказеинат кальция. [ необходима ссылка ] Когда специфическая связь между гидрофобными (пара-казеин) и гидрофильными (кислотный гликопептид) группами казеина разрывается, гидрофобные группы объединяются и образуют трехмерную сеть, которая захватывает водную фазу молока.
Зарядовые взаимодействия между гистидинами каппа-казеина и глутаматами и аспартатами химозина инициируют связывание фермента с субстратом. [8] Когда химозин не является связывающим субстратом, бета-шпилька, иногда называемая «лоскутом», может водородно связываться с активным центром, закрывая его и не допуская дальнейшего связывания субстрата. [1]
Примеры
Ниже перечислены ген Cym жвачных животных и соответствующий псевдоген человека:
Рекомбинантный химозин
Из-за несовершенства и дефицита микробных и животных сычужных ферментов производители искали замену. С развитием генной инженерии стало возможным извлекать гены, продуцирующие сычужный фермент, из желудка животных и вставлять их в определенные бактерии, грибы или дрожжи, чтобы заставить их производить химозин во время ферментации. [10] [11] Генетически модифицированный микроорганизм убивают после ферментации, а химозин выделяют из ферментационного бульона, поэтому химозин, полученный в результате ферментации (FPC), используемый производителями сыра, не содержит ГМ-компонента или ингредиента. [12] FPC содержит тот же химозин, что и животный источник, но производится более эффективным способом. Продукты FPC представлены на рынке с 1990 года и считаются идеальным ферментом для свертывания молока. [13]
С развитием генной инженерии стало возможным извлекать гены, продуцирующие сычужный фермент, из желудка животных и вставлять их в определенные бактерии, грибы или дрожжи, чтобы заставить их производить химозин во время ферментации. [10] [11] Генетически модифицированный микроорганизм убивают после ферментации, а химозин выделяют из ферментационного бульона, поэтому химозин, полученный в результате ферментации (FPC), используемый производителями сыра, не содержит ГМ-компонента или ингредиента. [12] FPC содержит тот же химозин, что и животный источник, но производится более эффективным способом. Продукты FPC представлены на рынке с 1990 года и считаются идеальным ферментом для свертывания молока. [13]
FPC был первым искусственно полученным ферментом, зарегистрированным и разрешенным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.В 1999 г. около 60 % твердого сыра в США производилось с использованием FPC [14] , и на его долю приходилось до 80 % мирового рынка сычужного фермента. [15]
[15]
К 2008 г. от 80% до 90% коммерческих сыров в США и Великобритании производились с использованием FPC. [12] Наиболее широко используемый ферментативный химозин производится либо с использованием грибка Aspergillus niger , либо с использованием Kluyveromyces lactis .
FPC содержит только химозин B, достигая высокой степени чистоты по сравнению с сычужным ферментом животного происхождения.FPC может дать производителю сыра несколько преимуществ по сравнению с животным или микробным сычужным ферментом, например, более высокий выход продукции, лучшую текстуру творога и меньшую горечь. [13]
Ссылки
- ↑ 1.0 1.1 PDB: 1CZI; Гровс М.Р., Дханарадж В., Бадассо М., Нуджент П., Питтс Дж. Э., Гувер Д. Д., Бланделл Т. Л. (октябрь 1998 г.). «Структура химозина в комплексе с ингибитором восстановленной связи с разрешением 2,3 А показывает, что бета-шпилечный лоскут активного центра перестроен по сравнению с нативной кристаллической структурой» (PDF) .
 Белок Eng . 11 (10): 833–40. doi: 10.1093/белок/11.10.833. PMID 9862200.
Белок Eng . 11 (10): 833–40. doi: 10.1093/белок/11.10.833. PMID 9862200. - ↑ Китамура Н., Танимото А., Хондо Э., Андрен А., Коттрелл Д.Ф., Сасаки М., Ямада Дж. (август 2001 г.). «Иммуногистохимическое исследование онтогенеза прохимозин- и пепсиноген-продуцирующих клеток в сычуге овец». Анат Хистол Эмбриол . 30 (4): 231–5. doi:10.1046/j.1439-0264.2001.00326.x. PMID 11534329.
- ↑ 3.0 3.1 Персонал, Интернет-база данных менделевского наследования у человека (OMIM). Последнее обновление: 21 февраля 1997 г. Псевдоген химозина; Прохимозин CYMP, включенный в состав OMIM
- ↑ Henschel, MJ; Ньюпорт, MJ; Пармар, В. (1987). «Желудочные протеазы у младенцев». Биология новорожденных . 52 (5): 268–272. ISSN 0006-3126. PMID 3118972.
- ↑ Сечи, Пал Бела; Харбо, Марианна (2013). «Глава 5: Химозин». В Роулингсе, Нил Д.; Салвесен, Гай. Справочник по протеолитическим ферментам .
 1 . стр. 37–42. doi: 10.1016/B978-0-12-382219-2.00005-3.
1 . стр. 37–42. doi: 10.1016/B978-0-12-382219-2.00005-3. - ↑ Фокс, П. Ф. Google книги. Сыр: химия, физика и микробиология: Том 1: Общие аспекты.
- ↑ Ян Р. Сандерсон, доктор медицины, и В. Аллан Уокер. Развитие желудочно-кишечного тракта pmph usa 1999. ISBN 155009081X
- ↑ 8.0 8.1 Джиллиленд Г.Л., Олива М.Т., Дилл Дж. (1991). «Функциональные последствия трехмерной структуры бычьего химозина». Доп. Эксп. Мед. Биол . 306 : 23–37. дои: 10.1007/978-1-4684-6012-4_3. PMID 1812710.
- ↑ PDB: 4CMS; Ньюман М., Сафро М., Фразао С., Хан Г., Зданов А., Тикл И.Дж., Бланделл Т.Л., Андреева Н. (октябрь 1991 г.). «Рентгеновский анализ аспарагиновых протеиназ. IV. Структура и уточнение при разрешении 2,2 A бычьего химозина». Дж. Мол. Биол . 221 (4): 1295–309. doi: 10.1016/0022-2836(91)90934-X. PMID 1942052.
- ↑ Emtage JS, Angal S, Doel MT, Harris TJ, Jenkins B, Lilley G, Lowe PA (июнь 1983 г.
 ).«Синтез телячьего прохимозина (прореннина) в Escherichia coli». Проц. Натл. акад. науч. США . 80 (12): 3671–5. doi:10.1073/pnas.80.12.3671. PMC 394112. PMID 6304731.
).«Синтез телячьего прохимозина (прореннина) в Escherichia coli». Проц. Натл. акад. науч. США . 80 (12): 3671–5. doi:10.1073/pnas.80.12.3671. PMC 394112. PMID 6304731. - ↑ Harris TJ, Lowe PA, Lyons A, Thomas PG, Eaton MA, Millican TA, Patel TP, Bose CC, Carey NH, Doel MT (апрель 1982 г.). «Молекулярное клонирование и нуклеотидная последовательность кДНК, кодирующая препрохимозин теленка». Рез. нуклеиновых кислот . 10 (7): 2177–87. дои: 10.1093/нар/10.7.2177. PMC 320601. PMID 6283469.
- ↑ 12.0 12.1 «Химозин». Компас ГМО. Архивировано из оригинала 26 марта 2015 г. Проверено 3 марта 2011 г. .
- ↑ 13.0 13.1 Закон BA (2010). Технология производства сыра . Великобритания: Уайли-Блэквелл. стр. 100–101. ISBN 978-1-4051-8298-0.
- ↑ «Пищевая биотехнология в США: наука, регулирование и проблемы». Государственный департамент США.


 С другой стороны, специалистов по структурной биоинформатике сейчас мало, и в лабораториях, которые занимаются белковой инженерией, не всегда есть возможность найти сотрудника нужной квалификации, поэтому они обращаются к нам, — говорит Анастасия Бакулина.
С другой стороны, специалистов по структурной биоинформатике сейчас мало, и в лабораториях, которые занимаются белковой инженерией, не всегда есть возможность найти сотрудника нужной квалификации, поэтому они обращаются к нам, — говорит Анастасия Бакулина.
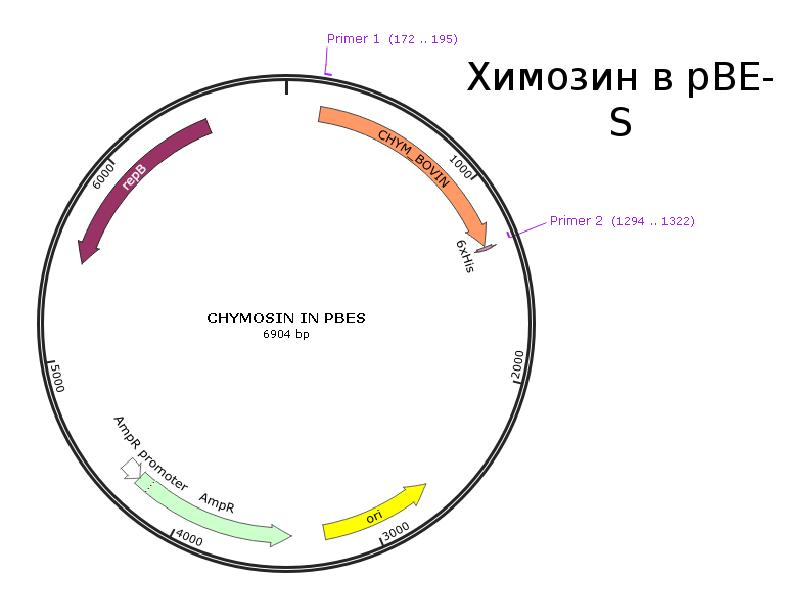 Hansen a/s, Bøge allé 10-12, DK-2970 Hørsholm, Дания.
Hansen a/s, Bøge allé 10-12, DK-2970 Hørsholm, Дания. Hansen a/s, Bøge allé 10-12, DK-2970 Hørsholm, Дания.
Hansen a/s, Bøge allé 10-12, DK-2970 Hørsholm, Дания. Б., Йохансен Э.Каппелер С.Р. и соавт.
Biochem Biophys Res Commun. 2006 г., 7 апреля; 342(2):647-54. doi: 10.1016/j.bbrc.2006.02.014. Epub 2006, 13 февраля.
Biochem Biophys Res Commun. 2006.
PMID: 16488399
Б., Йохансен Э.Каппелер С.Р. и соавт.
Biochem Biophys Res Commun. 2006 г., 7 апреля; 342(2):647-54. doi: 10.1016/j.bbrc.2006.02.014. Epub 2006, 13 февраля.
Biochem Biophys Res Commun. 2006.
PMID: 16488399 1992.
PMID: 1455180
Обзор.
1992.
PMID: 1455180
Обзор.
 Белок Eng . 11 (10): 833–40. doi: 10.1093/белок/11.10.833. PMID 9862200.
Белок Eng . 11 (10): 833–40. doi: 10.1093/белок/11.10.833. PMID 9862200.  1 . стр. 37–42. doi: 10.1016/B978-0-12-382219-2.00005-3.
1 . стр. 37–42. doi: 10.1016/B978-0-12-382219-2.00005-3.  ).«Синтез телячьего прохимозина (прореннина) в Escherichia coli». Проц. Натл. акад. науч. США . 80 (12): 3671–5. doi:10.1073/pnas.80.12.3671. PMC 394112. PMID 6304731.
).«Синтез телячьего прохимозина (прореннина) в Escherichia coli». Проц. Натл. акад. науч. США . 80 (12): 3671–5. doi:10.1073/pnas.80.12.3671. PMC 394112. PMID 6304731.