12 загадок и парадоксов боли
- Яна Литвинова
- Би-би-си, Лондон
Автор фото, Getty Images
Подпись к фото,Все мы знаем, что боль является объективной реальностью, но при этом ее восприятие глубоко субъективно. Боль может быть и симптомом, и болезнью, и душевной и физической. Насколько мы близки к пониманию, что же это такое?
Острая, тупая, внезапная, хроническая, ноющая, пульсирующая, ослепляющая… Это — далеко не полный перечень эпитетов, которые мы, не задумываясь, применяем, говоря об ощущении, которое испытывали и продолжаем испытывать мы все: о боли.
Она не обращает внимания на цвет кожи, разрез глаз, или социальный статус. Ей все равно, на каком уровне эволюции находится то или другое существо. Боль испытывают люди, собаки, кошки, дельфины, киты, птицы, лягушки и даже, как считают ученые, дождевые черви.
При этом, если ученые говорят, что механизм боли им более-менее понятен, то о том, что же она такое: сигнальная система неполадок, обязательная часть бытия, без которой невозможно понимание физического и душевного благосостояния, чисто физиологический процесс или же результат сложных химических процессов в головном мозге, ни медики, ни даже священнослужители к единому согласию не пришли.
Автор фото, Getty Images
Подпись к фото,Нам известно, как работает сигнальная система через нейроны в головной мозг и обратно, но многие вопросы по-прежнему остаются без ответа
К тому же есть группа людей, которые в силу генетической аномалии боли не испытывают вообще.
На самом деле им не надо завидовать, потому что они с легкостью могут пропустить начало какого-нибудь заболевания, и умереть, хотя и безболезненно, но совершенно напрасно.
Все наши знания о боли построены на парадоксах.
1. Наш мозг фиксирует сигналы боли, но сам ее не чувствует
Автор фото, Getty Images
Подпись к фото,Мозг фиксирует и обрабатывает болевые сигналы изо всех других частей организма, а сам боли не ощущает
Допустим, вы подвернули щиколотку, или обожгли палец. Нервные волокна немедленно посылают сигнал в ваш мозг, который расшифровывает испытываемое ощущение, как боль.
Нервные волокна немедленно посылают сигнал в ваш мозг, который расшифровывает испытываемое ощущение, как боль.
Недаром современная хирургия стала возможной только после открытия анестезии.
Однако, если в качестве объекта операции оказывается сам мозг, то ему обезболивающее ни к чему.
Нервные клетки головного мозга посылают сами себе такие же сигналы, как и при сломанной конечности, вот только центр обработки данных для них отсутствует.
Мозг, привыкший отвечать за весь организм, совершенно не понимает, когда больно должно быть ему самому.
В этом есть нечто жутковатое, но пациенты часто находятся в полном сознании во время операций на мозге, что позволяет хирургам понять, не слишком ли глубоко они залезли в главный процессор нашего тела.
2. Мы все чувствуем боль по-разному
Автор фото, DanielVilleneuve
Подпись к фото,Боль субъективна: для кого-то агония, а для кого-то небольшое неудобство.
Тот факт, что, после, допустим, естественных родов одна женщина говорит, что было немного дискомфортно, но ничего страшного, а другая уже в самом начале схваток требует обезболивания, вовсе не означает, что одна из них стоик, а другая — слабая размазня.
На то, как мы ощущаем боль, влияет множество факторов: какие химические реакции совершаются в это время в вашем мозге, идет ли где-то в вашем теле воспалительный процесс, а также насколько вы «помните» болевые ощущения, которые вы испытали раньше.
Как сказал однажды глава нью-йоркского центра спинальной хирургии Кеннет Хансрадж: «Кому-то можно сверлить берцовую кость без наркоза, а он вам спокойно скажет, мол, приятель, вытащи-ка ты эту штуку! А другой не вынесет даже прикосновения к коже тоненькой иголки».
3. От боли можно отвлечься
Автор фото, Portra
Подпись к фото,Боль можно обмануть: если начать трясти ушибленным пальцем, то становится легче
Наш мозг, конечно, является, самым сложным компьютером, когда-либо созданным природой, но при этом он немного туповат.
Дело в том, что ему сложно одновременно анализировать несколько ощущений.
Допустим, вас укусил комар и место укуса отчаянно чешется. Приложите к нему кубик льда, и неожиданно вы поймете, что холод вы-таки ощущаете, а вот зуд пропал.
Вот почему мы инстинктивно потираем ушибленное место или отчаянно трясем пальцем, который случайно прищемили дверью.
4. Рыжим приходится хуже
Автор фото, Getty Images
Подпись к фото,Рыжим приходится нелегко: огненный цвет волос сопровождается и нестандартным отношением к обезболивающим
В это трудно поверить, но в 2009 году в журнале Американской зубоврачебной ассоциации появилась статья, согласно которой рыжие очень не любят посещать дантистов.
Дело в том, что та же генетическая комбинация, которая награждает их огненным цветом волос, делает их и менее восприимчивыми к некоторым обезболивающим.
И иногда им требуется доза, которая в два раза превысит то, чего хватило бы какому-нибудь брюнету.
Возможно также, что их организм реагирует на анестезию не совсем тривиальным способом. Некоторые врачи, кстати, делают поправки на цвет волос пациента.
5. Секс спасает от боли
Автор фото, Getty Images
Подпись к фото,Занятия сексом могут уменьшить боль от мигрени… если у вас, конечно, хватит сил им заняться
Ну, объективно говоря, если у вас случился приступ мигрени, то секс в такой ситуации представляется делом несколько сомнительным.
Тем не менее, есть некоторые статистические данные, согласно которым 60% страдальцев от мигрени чувствовали себя гораздо лучше, если во время приступа занимались этим самым.
Сексуальное возбуждение вырабатывает в головном мозгу эндорфины, которые являются естественным обезболивающим.
Кстати, с больными мигренью все не так просто. Есть подозрение, что та же самая генная вариация, которая награждает страдальцев мигренью, одновременно существенно увеличивает и их либидо.
6. Разделились беспощадно мы на женщин и мужчин
Автор фото, Getty Images
Подпись к фото,Все мы все чувствуем одинаково, только мужчины считают, что надо терпеть
Вообще-то нет никаких научных доказательств того, что мужчины и женщины по-разному чувствуют боль.
Хотя врачи отмечают, что в целом женщины чаще готовы признать, что им больно.
Возможно, это связано с социальным стереотипом, который требует от «настоящих» мужчин терпеть, стиснув зубы.
7. Те, кто не чувствует боли
Автор фото, Getty Images
Подпись к фото,Тем, кто не чувствует боли, не так уж и хорошо: простое прикосновение к горячей плите может обернуться ожогом третьей степени
Это — очень редкая генетическая аномалия. Настолько редкая, что за всю историю медицины она встречалась всего несколько десятков раз.
Те, кому крупно не повезло с нею родиться, могут, например, почувствовать, является ли какой-нибудь предмет горячим или холодным, но боли не ощущают.
А это, кстати, совсем плохо. Например, случайное прикосновение к горячей плите может завершиться ожогом третьей степени, вместо небольшого волдыря, который бы возник, если бы они быстро сообразили, что к чему и отдернули руку.
По имеющейся статистике (которая, по вполне очевидным причинам, крайне невелика), средняя продолжительность жизни таких нечувствительных существенно ниже среднего показателя.
8. Самая распространенная боль
Автор фото, Getty Images
Подпись к фото,Самая распространенная боль в развитых странах — боль в нижней части спины
Это — боль в спине. Примерно 27% людей в развитых странах утверждают, что страдают от боли в нижней части спины.
Тогда как от постоянных головных болей, либо мигреней — всего 15%. Эксперты советуют не брезговать физическими упражнениями и не набирать излишнего веса.
Однако это — следствие наших эволюционных успехов. Двуногость вовсе не способствует здоровью позвоночника. Четвероногим, у которых вес распределяется гораздо более равномерно, боль в спине не грозит.
Двуногость вовсе не способствует здоровью позвоночника. Четвероногим, у которых вес распределяется гораздо более равномерно, боль в спине не грозит.
9. Что болело у королей и динозавров
Автор фото, Getty Images
Подпись к фото,И короли, и динозавры страдали от подагры. Здесь, правда, дракон, но, наверное он тираннозавру близкий родственник
Подагру, она же артрит, раньше называли болезнью королей, поскольку, она, якобы была следствием излишнего потребления жирной пищи и спиртного.
Понятно, что в далеком Средневековье это могли себе позволить только очень состоятельные люди. Теперь мы знаем, что боль при подагре возникает от образования внутри суставов острых кристаллов мочевой кислоты.
Исследование скелета верхней конечности самки тираннозавра (которую палеонтологи назвали Сью) показало, что этот конкретный хищник Юрского периода тоже страдал от подагры, причем в очень запущенной форме. Вероятно, что все последние годы своей жизни Сью страдала от хронической боли.
Вероятно, что все последние годы своей жизни Сью страдала от хронической боли.
10. Природа боли вовсе не однозначна
Автор фото, Getty Images
Подпись к фото,Иногда боль из симптома превращается в болезнь. Болит везде, а почему — непонятно
Боль является симптомом, который, однако, дает лишь общее представление о том, что что-то не в порядке, но не дает никакой конкретики.
А у больных, страдающих от центрального болевого синдрома, сама боль становится болезнью, а не ее симптомом.
Такие пациенты жалуются на боль во всем теле, причем ощущения варьируются от «иголок» до «сильного давления». В этом случае мозг является не просто регистратором и процессором болевых ощущений, но и их главным генератором.
11. Не надо недооценивать свой мозг
Автор фото, Getty Images
Подпись к фото,Не надо недооценивать свой мозг: он прекрасно знает на какие кнопки и в каких обстоятельствах следует нажимать
Мозг устроен так, что постоянно оценивает поступающие в него сигналы, решая, насколько серьезной является опасность и следует ли предпринимать немедленные меры.
Получив тревожный сигнал, мозг немедленно пытается ответить на главный вопрос: «А насколько это все действительно опасно?»
В оценке ситуации наш центральный процессор пользуется всей имеющейся у него в наличии информацией: от субъективной, исходящей из нашего прошлого опыта, до объективной, получаемой от всего комплекса физических и химических параметров организма.
А получив сигнал, он отправляет «указания» нервным окончаниям о том, как им себя вести. Канадский врач Пол Ингрэм описал происходящий процесс в следующем воображаемом диалоге:
Автор фото, Getty Images
Подпись к фото,Мозг командует нейронами как хочет, и тем приходится подчиняться
Нервы: Проблема! Проблема! Огромная! Большая! Красный сигнал тревоги! Включить немедленно!
Мозг: Ммммм, да? Ну ладно, принял к сведению. Но вот что, ребята, у меня тут есть база данных, пардон, она строго секретная, так что уж поверьте мне на слово: не так все это страшно. Расслабьтесь.
Расслабьтесь.
Нервы: Нет, нет, послушай, это все очень серьезно!
Мозг: Не-а, не верю.
Нервы: Послушай, может у нас, конечно, и нет доступа к этой «информации», о которой ты постоянно талдычишь, но что такое повреждение тканей нам прекрасно известно! И мы тут не в игрушки играем. Мы не заткнемся, пока ты не примешь меры!
Мозг (голосом гипнотизера): Вы уже не помните, в чем дело. Совершенно незачем посылать мне сигналы. Все абсолютно в порядке, дышите глубже…
Нервы: А, да… О чем это мы? Черт, вроде бы только что хотели о чем-то важном доложить… Ну, ладно, мы потом вернемся.
12. Самый главный начальник
Автор фото, Getty Images
Подпись к фото,Мозг сам решает, как регулировать кнопку боли в нашем организме, и почему иногда он останавливается на шести, а иногда — на десяти, мы до сих пор до конца не знаем
Мозг действительно может вертеть периферийными нервными окончаниями, как ему заблагорассудится.
Если ему что-то не понравится, он может затребовать больше информации. А может и приказать своим подчиненным не суетиться.
В последние годы появилось немало информации, согласно которой нервы на периферии могут реально меняться как физически, так и химически, возможно, следуя команде, поступающей из мозга.
Как отметил тот же Пол Ингрем: «Мозг не только может крутить кнопку, регулирующую звук, но запросто менять все оборудование, изменяя сам сигнал задолго до того, как он поступает в динамики».
Вывод
Окончательная природа боли, несмотря на то, что она является неотъемлемой частью существования всех живых существ, нам по-прежнему не известна.
Как делают наращивание костной ткани перед имплантацией – фото, отзывы, цены
Имплантация – «золотой стандарт» в замене отсутствующих зубов. Однако большинство пациентов – от 70 до 90% для верхней челюсти и до 50% — на нижней, нуждаются в наращивании кости перед . Искусственное увеличение объема ткани требуется тем пациентам, у кого зубы отсутствуют более 2-х месяцев. К сожалению, у большинства сроки гораздо больше, вплоть до 10 и более лет. В таких случаях на помощь приходят различные операции костной пластики.
Искусственное увеличение объема ткани требуется тем пациентам, у кого зубы отсутствуют более 2-х месяцев. К сожалению, у большинства сроки гораздо больше, вплоть до 10 и более лет. В таких случаях на помощь приходят различные операции костной пластики.
Наращивание костной ткани при имплантации зубов — в чем суть?
Ранее недостаточный объем кости был противопоказанием к имплантации. Сейчас, благодаря различным методикам, удается достичь нужного объема и , полностью функционирующие в течение всего срока службы.
Конечно, необходимость увеличения объема кости повышает стоимость имплантации. Эффект того стоит, ведь при наращивании тканей к собственной кости добавляют особые стимуляторы ее роста. Существуют несколько методик. Мы представили их в таблице:
| Разновидность | Увеличение альвеолярного отростка | Пересадка костного блока | Направленная регенерация кости | Синус лифтинг |
|---|---|---|---|---|
| Суть методики | Увеличение альвеолярного отростка Расширяют кость в продольном направлении, заполняя дефект специальным наполнителем. |
Пересадка костного блока Берут собственный материал пациента и подсаживают туда, где костная ткань истончилась. | Направленная регенерация кости Используют бычий или свиной материал, который фиксируется винтами к собственной кости. |
Синус лифтинг Приподнимают нижнюю стенку гайморовой пазухи, образовавшееся пространство заполняют специальным наполнителем. |
| Когда выполняют | Увеличение альвеолярного отростка Для восстановления нескольких зубов, при атрофии по всей длине челюсти. |
Пересадка костного блока Для восстановления одного или нескольких зубов, при значительной потере кости по высоте. |
Направленная регенерация кости Для восстановления одного или нескольких зубов, при средней и небольшой степени потери кости. | Синус лифтинг Для восстановления одного или нескольких зубов на верхней челюсти. |
| Можно ли проводить одновременно с установкой имплантов | Увеличение альвеолярного отростка Да |
Пересадка костного блока Нет |
Направленная регенерация кости Да |
Синус лифтинг Да |
Какие материалы используют для наращивания ткани кости?
- Собственные
- Донорские
- Животные – свиные или бычьи
Кроме того, используются специальные биосовместимые винты для фиксации, саморассасывающиеся мембраны, заменители десны и другие. Какой материал и методику выбрать, чтобы восстановить потерянную костную ткань и сделать ее доступной по цене, решает врач в ходе детального обследования. У нас есть возможность заказать любые материалы и расходники для любых, даже самых сложных случаев.
Какой материал и методику выбрать, чтобы восстановить потерянную костную ткань и сделать ее доступной по цене, решает врач в ходе детального обследования. У нас есть возможность заказать любые материалы и расходники для любых, даже самых сложных случаев.
Наращивание тканей — риски
Как и любая другая операция, эта сопровождается рисками воспаления, инфекции, кровотечения. При грамотном выборе методики и строгом соблюдении всех требований по ее выполнению риски сводятся к нулю. Легкий отек и незначительная болезненность в течение нескольких дней после вмешательства считаются нормой.
Кому доверить операцию по увеличению объема костной ткани? Тем, кто:
диагностика, восстановительное лечение в ЦКБ РАН, Москва
Ишиалгия (Sciatica) — боль в пояснице, распространяющаяся по заднее-наружной поверхности бедра на голень и стопу.
6 главных причин образования ишиалгии
Различные заболевания поясничного отдела позвоночника могут вызывать ишиалгию. Ишиалгия часто описывается как боль в ногах от средней до интенсивной. Она вызывается компрессией одного или нескольких из пяти пар нервных корешков в поясничном отделе позвоночника. Иногда доктора называют ишиалгию радикулопатией. Радикулопатия – это медицинский термин, используемый для описания боли, онемения, покалывания и слабости в руках или ногах, вызванной проблемами нервного корешка. Если проблема нерва имеется в шейном отделе, то это состояние называют шейной радикулопатией. Так как ишиалгия поражает поясничный отдел, то её также называют поясничной радикулопатией.
Ишиалгия часто описывается как боль в ногах от средней до интенсивной. Она вызывается компрессией одного или нескольких из пяти пар нервных корешков в поясничном отделе позвоночника. Иногда доктора называют ишиалгию радикулопатией. Радикулопатия – это медицинский термин, используемый для описания боли, онемения, покалывания и слабости в руках или ногах, вызванной проблемами нервного корешка. Если проблема нерва имеется в шейном отделе, то это состояние называют шейной радикулопатией. Так как ишиалгия поражает поясничный отдел, то её также называют поясничной радикулопатией.
Причины болей
5 пар нервных корешков в пояснично-крестцовом отделе объединяются с созданием седалищного нерва. Начинаясь с задней поверхности таза (крестца), седалищный нерв идет сзади под ягодицами и вниз через тазобедренный сустав в нижние конечности. Нервные корешки это не отдельные структуры, а часть общей нервной системы тела, способные передавать боль и ощущения в другие части тела.
Компрессия седалищного нерва
Некоторые виды заболеваний позвоночника могут вызвать компрессию спинального нерва и ишиалгию или поясничную радикулопатию. Ниже перечислены 6 наиболее распространенных из них:
- грыжа диска;
- стеноз поясничного отдела позвоночника;
- спондилолистез;
- травма;
- синдром грушевидной мышцы;
- опухоли позвоночника.
Протрузия или грыжа диска
Протрузией диска называют такое состояние, когда центральная гелеобразнаая часть диска (студенистое ядро) выпирает в сторону позвоночного канала, при этом не нарушена целостность наружной стенки диска (фиброзного кольца). Грыжа диска образуется в том случае, когда студенистое ядро выходит за пределы фиброзного кольца. При протрузии либо при грыже диска, выпирающая часть диска может сдавливать прилегающий нервный корешок и вызывать ишиалгию.
Стеноз поясничного отдела позвоночника
Стеноз позвоночного канала проявляется компрессией нерва и наиболее часто поражает людей зрелого возраста. Боль в нижних конечностях, похожая на ишиалгию, может быть результатом стеноза позвоночного канала поясничного отдела позвоночника. Боль обычно позиционная, проявляющаяся при изменении положения тела, вставании или хождении и облегчающаяся при сидении. Нервные корешки ответвляются от спинного мозга и выходят через фораминальное отверстие, ограниченное костями и связками. Нервные корешки выходят из этих отверстий и иннервируют другие части тела.
Спондилолистез
Спондилолистез наиболее часто поражает поясничный отдел позвоночника. При этом вышележащий позвонок смещается по отношению к нижележащему. Когда позвонок соскальзывает и смещается, происходит ущемление нервного корешка, что вызывает ишиалгические боли в ногах. Спондилолистез разделяют на врожденный и приобретенный (вследствие дегенеративных изменений, травмы, физической нагрузки или поднятии тяжестей.
Травма
Ишиалгия может быть результатом прямой компрессии нервного корешка, вызванной внешними силами на пояснично-крестцовый отдел позвоночника. Например, при дорожно-транспортной травме, падении и т.д. Это воздействие может повреждать нервы, когда фрагменты сломанной кости вызывают компрессию нервов.
Синдром грушевидной мышцы
Этот синдром назван по имени грушевидной мышцы и боль вызывается при раздражении этой мышцей седалищного нерва.
Опухоли позвоночника
Опухоли позвоночника характеризуются патологическим ростом тканей и делятся на доброкачественные и злокачественные. Встречаемость опухолей позвоночника довольно редкая. Однако при развитии опухоли поясничного отдела позвоночника имеется риск развития ишиалгии из-за компрессии нервного корешка.
Лечение ишиалгии
Для создания лечебного плана необходима диагностика, включающая неврологический осмотр, рентгеновский снимок и магнитно-резонансную томографию. В зависимости от причины ишиалгии имеется несколько вариантов лечения. Консервативная терапия включает изменение активности, физиотерапевтические процедуры, противовоспалительную терапию и различного вида блокады для снятия воспаления нервного корешка. Хирургическое лечение включает в себя удаление грыжи диска через маленький разрез (микродискэктомия), а при стенозе — проведение декомпрессивной операции с частичным либо полным удалением дуги позвонка (ламинэктомия).
Консервативная терапия включает изменение активности, физиотерапевтические процедуры, противовоспалительную терапию и различного вида блокады для снятия воспаления нервного корешка. Хирургическое лечение включает в себя удаление грыжи диска через маленький разрез (микродискэктомия), а при стенозе — проведение декомпрессивной операции с частичным либо полным удалением дуги позвонка (ламинэктомия).
Артроскопия коленного сустава. Разрыв ПКС
Анатомия
Коленный сустав – не только самый крупный в организме человека, но и самый сложный. Он образован тремя костями: бедренной костью сверху, большеберцовой костью снизу, а спереди от этих костей располагается надколенник (коленная чашечка). Как бедренная, так и большеберцовая кость имеют по два расширяющихся костных выступа – мыщелка: наружный и внутренний. Наружный мыщелок еще называют латеральным (от латинского слова lateralis – наружный), а внутренний – медиальным (от латинского слова medialis — внутренний). Основное движение коленного сустава – это сгибание, при этом надколенник ложится в специальную борозду между наружным и внутренним мыщелками бедренной кости.
Основное движение коленного сустава – это сгибание, при этом надколенник ложится в специальную борозду между наружным и внутренним мыщелками бедренной кости.
Контактирующие поверхности бедренной, большеберцовой костей и надколенника покрыты гладким хрящом, который облегчает скольжение.
Между бедренной и большеберцовой костью есть мениски – хрящевые прослойки полулунной формы, которые увеличивают стабильность сустава, повышая площадь контакта костей, работают как амортизаторы и выполняют некоторые другие важные функции.
Стабильность костей друг относительно друга обеспечивается за счет связок коленного сустава. К наиболее важным связкам коленного сустава относятся:
- Крестообразные связки, которые удерживают голень от смещения кпереди (передняя крестообразная связка) и кзади (задняя крестообразная связка).
- Большеберцовая коллатеральная связка (внутренняя боковая связка), которая удерживает голень от отклонения кнаружи.

- Малоберцовая коллатеральная связка (наружная боковая связка), которая удерживает голень от отклонения кнутри.
Передняя крестообразная связка находится в самом центре коленного сустава, сверху прикрепляется к наружному мыщелку бедренной кости, после чего идет вниз и немного кнаружи и прикрепляется к углублению на большеберцовой кости (переднее межмыщелковое поле), где часть ее волокон соединяются с менисками. Перпендикулярно передней крестообразной связке кзади от нее располагается задняя крестообразная связка, и если посмотреть на эти связки спереди, то можно увидеть, как они образуют крест, что и дало этим связкам такое название — крестообразные связки. Средняя длина передней крестообразной связки — 3 сантиметра, а ширина — 7-12 мм.
Передняя крестообразная связка, как и другие связки, в основном состоит из прочных коллагеновых волокон, которые практически не растягиваются. Эти волокна внутри связки закручены по спирали под углом в 110 градусов. Исходя из мест прикрепления связки и ее хода (сверху вниз, спереди назад и снаружи кнутри) становиться понятна ее роль: передняя крестообразная связка удерживает голень от смещения кпереди и кнутри.
Исходя из мест прикрепления связки и ее хода (сверху вниз, спереди назад и снаружи кнутри) становиться понятна ее роль: передняя крестообразная связка удерживает голень от смещения кпереди и кнутри.
Анатомия связок коленного сустава: ПКС — передняя крестообразная связка, ЗКС -задняя крестообразная связка
В составе передней крестообразной связки выделяют два пучка: передне-внутренний и задне-наружный. Такая двухпучковая структура передней крестообразной связки обеспечивает лучшую стабильность в коленном суставе при разных углах сгибания. Некоторые ученые даже выделяют третий — промежуточный пучок.
Передне-внутренний пучок в полтора раза длиннее задне-наружного (в среднем 37,7 мм против 20,7 мм) и шире (8,5 мм и 7,7 мм). При работе сустава эти два пучка находятся в сложном взаимодействии. При разогнутом колене они почти параллельны друг другу, если смотреть на них сбоку и перекрещиваются, если смотреть на них спереди. Если колено согнуть, то передне-внутренний пучок удлинняется, а задне-наружный — укорачивается.
Передняя крестообразная связка коленного сустава: двухпучковая структура. ПВ — передне-внутренний пучок (синяя линия), ЗН — задне-наружный (зеленая линия). Слева — вид сбоку, колено разогнуто; в центре — вид сбоку, колено согнуто; справа — вид спереди, колено разогнуто
Помимо того, что передняя крестообразная связка коленного сустава выполняет стабилизационную функцию (удерживает голень от смещения вперед и кнутри), в ней есть еще и нервные окончания, которые сигнализируют о том, в камо положении, согнутом или разогнутом находится коленный сустав.
Передняя крестообразная связка практически не имеет кровеносных сосудов.
Причины разрыва передней крестообразной связки и причины
Растяжения и повреждения передней крестообразной связки являются очень распространенной травмой. Например в США ежегодно диагностируется около 200 тысяч разрывов передней крестообразной связки, из них в 100 тысячах случаев выполняется операция по реконструкции (пластике) передней крестообразной связки. Среди всех других связок колена передняя крестообразная травмируется чаще всего, например, разрывы передней крестообразной связки происходят в 15-30 раз чаще, чем разрывы задней крестообразной связки. В спорте разрыв передней крестообразной связки у женщин происходит в 4-10 раз чаще, чем мужчины.
Среди всех других связок колена передняя крестообразная травмируется чаще всего, например, разрывы передней крестообразной связки происходят в 15-30 раз чаще, чем разрывы задней крестообразной связки. В спорте разрыв передней крестообразной связки у женщин происходит в 4-10 раз чаще, чем мужчины.
Исходя из функции, которую выполняет передняя крестообразная связка (удерживание голени от смещения вперед и кнутри), становится понятным и механиз травмы, при котором происходит растяжение или разрыв передней крестообразной связки. Как правило кручение на порной ноге, когда корпус с бедром вращается наружу, а голень со стопой остаются на месте.
Однако на самом деле механизм и причины разрыва передней крестообразной связки сложнее. Принципиально в качестве причин разрыва передней крестообразной связки можно выделить прямую травму (контактный механизм: удар по голени, бедру) и непрямую травму (неконтактный механизм: кручение на ноге при резком торможении, приземление после прыжка и т. д.).
д.).
Отклонение голени кнаружи и кручение бедра кнутри. Этот механизм разрыва передней крестообразной связки самый распространенный. Часто такой разрыв передней крестообразной связки происходит в гандболе, баскетболе, футболе и волейболе, когда при беге нужно резко развернуться или при приземлении после прыжка с разворотом корпуса кнутри от опорной ноги. При таком механизме травмы может произойти и разрыв внутреннего мениска. Если такое движение будет очень сильным, то возможен разрыв трех структур: передней крестообразной связки, внутреннего мениска и внутренней боковой связки. Такое повреждение коленного сустава еще называют «несчастливой триадой» или «взрывом коленного сустава». Это название прижилось по имени хирурга O’Donoghue, которые его впервые описал в 1950 году.
«Несчастливая триада»: при сильном отклонении голени кнаружи и вращении бедра кнутри возможен разрыв трех структур: передней крестообразной связки (1), внутреннего мениска (2) и внутренней боковой связки (3)
Отклонение голени кнутри и кручение бедра кнаружи. Этот механизм разрыва передней крестообразной связки коленного сустава противоположен предыдущему, при этом тоже возможен разрыв мениска, но наружного.
Этот механизм разрыва передней крестообразной связки коленного сустава противоположен предыдущему, при этом тоже возможен разрыв мениска, но наружного.
Фантом-стопа. Этот механизм разрыва возможен при падении с горных лыж. Например, при падении назад правая лыжа задирается вверх и только ее задний конец соприкасается со снегом. Как только лыжа входит в снег (край лыжи и олицетворяет «призрачную стопу»), она делает поворот и обусловливает внешнее вращение голени (пронация). Коленный сустав при этом согнут под прямым углом. Этот механизм может привести и к ихолировнному повреждению (полному или частичному разрыву) передней крестообразной связки без повреждения менисков и других структур (задне-латерального угла).
Механизм, обусловленный лыжным ботинком. Чаще всего разрывы передней крестообразной связки по этому механизму происходят у горнолыжников, которые носят более высокие и жесткие ботинки. Например, при падении назад верхняя часть ботинка передает нагрузку на верхнюю часть голени большеберцовой кости по типу «выдвижного ящика». Бедро кость смещается назад, а голень удерживается задним краем высокого ботинка. Передняя крестообразная связка натягивается и рвется. Фиксированный наклон вперед во всех современных лыжных ботинках способствует такому типу разрыва.
Бедро кость смещается назад, а голень удерживается задним краем высокого ботинка. Передняя крестообразная связка натягивается и рвется. Фиксированный наклон вперед во всех современных лыжных ботинках способствует такому типу разрыва.
Контактные механизмы. Разрыв передней крестообразной связки может произойти в результате прямого удара по колену, бедру или голени. При этом может произойти отклонение голени кнаружи, кнутри или кпереди. Разрыв передней крестообразной связки может произойти и в результате переразгибания колена (гиперэкстензии). Гиперэкстензия может быть вызвана как прямым ударом по колену спереди, так и ударом по нижней части голени. Кроме того разрыв передней крестообразной связки при сильном ударе ко верхней части голени сзади. Контактные механизмы травмы встречаются редко.
Факторы, которые способствуют разрыву передней крестообразной связки
Угол между бедром и голенью. Если смотреть на скелет спереди, то можно увидеть как бедро соединяется с голенью под углом, который называют углом квадрицепса или Q-углом. Размер угла Q определяется шириной таза. У женщин таз более широкий, чем у мужчин, поэтому у женщин и Q-угол больше, чем у мужчин. Большой угол Q приводит к тому, что при отклонении голени кнаружи нагрузка на переднюю крестообразную связку больше и поэтому она легче рвется.
Размер угла Q определяется шириной таза. У женщин таз более широкий, чем у мужчин, поэтому у женщин и Q-угол больше, чем у мужчин. Большой угол Q приводит к тому, что при отклонении голени кнаружи нагрузка на переднюю крестообразную связку больше и поэтому она легче рвется.
Q-угол у мужчин и женщин
Ширина межмыщелковой вырезки (Notch-вырезка). Передняя крестообразная связка находится в коленном суставе в межмыщелковой вырезке. У женщин она уже, чем у мужчин и при движениях в коленном суставе пространство вокруг передней крестообразной связки меньше, и она может даже тереться о край наружного мыщелка бедренной костичто способствует разрыву. При вращении голени с распрямлением в колене узкая межмыщелковая вырезка может зажать переднюю крестообразную связку и разорвать ее.
Межмыщелковая вырезка (обведена красным цветом) у женщин уже, чем у мужчин, что способствует разрыву передней крестообразной связки
Сила мышц бедра. Помимо связок важную роль в стабильности коленного сустава играют мышцы бедра, которые своими сухожилиями крепятся к большеберцовой кости голени. У женщин мышцы бедра слабее чем у мужчин, и поэтому в обеспечении стабильности коленного сустава большая нагрузка приходится на переднюю крестообразную связку.
Помимо связок важную роль в стабильности коленного сустава играют мышцы бедра, которые своими сухожилиями крепятся к большеберцовой кости голени. У женщин мышцы бедра слабее чем у мужчин, и поэтому в обеспечении стабильности коленного сустава большая нагрузка приходится на переднюю крестообразную связку.
Согласованность мышц бедра. Передние мышцы бедра (четырехглавая мышца бедра или квадрицепс) и задние мышцы бедра у женщин работают по другому, чем у мужчин. При согнутом колене женский квадрицепс сокращается сильнее, что выдвигает голень вперед, натягивая переднюю крестообразную связку. В тоже время задние мышцы бедра, которые препятствуют сдвиганию голени вперед, реагируют медленнее, чем у мужчин. Тем самым создаются предпосылки для разрыва передней крестообразной связки.
Гормональный профиль. Возможно, что разрыву передней крестообразной связки способствуют некоторые гормоны (эстроген и прогестерон). Некоторые ученые считают, что они уменьшают и прочность вех связок, не только передней крестообразной, и их эластичность. Эта эластичность (связки способны растягиваться на 4-5% от своей длины, не разрываясь при этом) вообще защищает от многих травм, позволяя поглотить больше энергии, прежде чем порвутся связки.
Эта эластичность (связки способны растягиваться на 4-5% от своей длины, не разрываясь при этом) вообще защищает от многих травм, позволяя поглотить больше энергии, прежде чем порвутся связки.
Все эти факторы в комплексе объясняют большую вероятность разрыва передней крестообразной связки у женщин, однако каждый из этих фактором может работать и у мужчин? например, у мужчин тоже бывает увеличенный Q-угол или узкая межмыщелковая вырезка.
Профилактика
В спорте разрывы передней крестообразной связки чаще встречаются у женщин, но в обычной жизни они встречаются одинаково часто как у мужчин, так и у женщин. Профилактика разрывов передней крестообразной связки касается, в основном, только спорта, и включает в себя обязательные разминки, укрепляющие и проприоцептивные тренировки, а также изменение техники бега, прыжков и рывковых движений. К сожалению, в настоящее время общепринятой программы профилактики травм передней крестообразной связки не существует.
Какие бывают повреждения передней крестообразной связки?
Как мы уже упоминали, передняя крестообразная связка до определенного предела может растягиваться (на 4-5% от своей длины). Если сила будет большей, то может произойти частичный разрыв связки (микроразрыв отдельных волокон), а если сила будет еще большей, то произойдет частичный разрыв, и, наконец, если сила будет еще увеличиваться, то произойдет полный разрыв передней крестообразной связки.
|
Классификация повреждений передней крестообразной свзки американской медицинской ассоциации спотивных травм (American Medical Association for Athletic Injuries) |
|
|
I степень: |
малые растяжения передней крестообразной связки (микроразрывы). |
|
II степень: |
умеренные растяжения связки (частичные разрывы). Имеют такие же признаки, что и малые растяжения, но эта травма склонна многократно повторяться, так как после частичного разрыва связка становится менее прочной и ее повторная травма может произойти гораздо легче |
|
III степень: |
полные разрывы. Выраженная боль, отек, ограничение движений, часто нарушение опороспособности, нестабильность коленного сустава. |
Однако на самом деле вариантов повреждений передней крестообразной связки больше. Например, как мы уже упоминали, у передней крестообразной связки есть два пучка. Бывают разрывы одного из пучков (передне-внутреннего или задне-наружного). При этом оторвавшийся пучок передней крестообразной связки может болтаться в коленном суставе и блокировать движения, давая картину, похожую на блок коленного сустава при разрыве мениска.
При этом оторвавшийся пучок передней крестообразной связки может болтаться в коленном суставе и блокировать движения, давая картину, похожую на блок коленного сустава при разрыве мениска.
Кроме того, возможен и так называемый перелом Сегонда. Иногда его называют отрывным переломом межмыщелкового возвышения.
Перелом Сегонда (отрыв передней крестообразной связки от места прикрепления к большеберцовой кости с костным блоком). На рентгенограмме справа показан не только перелом Сегонда в месте прикрепления передней крестообразной связки (синяя стрелка), но и в месте прикрепления наружной боковой связки (рыжая стрелка)
Кроме того, как мы мы уже отмечали, разрыв передней крестообразной связки может сочетаться с разрывами менисков и других связок коленного сустава (задней крестообразной, наружной боковой, внутренней боковой).
Симптомы разрыва передней крестообразной связки
Повреждению передней крестообразной связки обычно предшествует травма коленного сустава, сразу после которой возникает боль и сильный отек колена. При разрыве передней крестообразной связки часто слышно треск, однако это неспецифический признак, который бывает и при разрывах других связок коленного сустава. Кроме того, в момент травмы возможно ощущение «вывихивания» голени кпереди или вбок. В таких случаях нужно обратиться к врачу.
При разрыве передней крестообразной связки часто слышно треск, однако это неспецифический признак, который бывает и при разрывах других связок коленного сустава. Кроме того, в момент травмы возможно ощущение «вывихивания» голени кпереди или вбок. В таких случаях нужно обратиться к врачу.
Прежде всего врач-травматолог выяснит механизм травмы, который поможет заподозрить не только повреждение передней крестообразной связки, но и других структур (например, задней крестообразной связки, наружной и внутренней боковых коллатеральных связок).
При разрыве передней крестообразной связки в полость сустава попадает кровь — такое состояние называют гемартрозом. В первые несколько дней после травмы этот гемартроз и боль могут быть настолько выражены, что полноценное обследование сустава руками врача невозможно, а именно благодаря обследованию руками врача и может быть поставлен диагноз разрыва передней крестообразной связки. Такое обследование может быть выполнено позже, когда острая боль и гемартроз пройдут. Как правило к этому моменту и обнаруживается нестабильность коленного сустава или ощущение «провала» в нем. Это происходит ввиду того, что разованная передняя крестообразная связка не удерживает голень от смещения кпереди и кнутри (антеромедиальная или передне-внутренняя нестабильность голени в коленном суставе).
Как правило к этому моменту и обнаруживается нестабильность коленного сустава или ощущение «провала» в нем. Это происходит ввиду того, что разованная передняя крестообразная связка не удерживает голень от смещения кпереди и кнутри (антеромедиальная или передне-внутренняя нестабильность голени в коленном суставе).
Диагноз разрыва передней крестообразной связки
После того, как врач тщательно ознакомиться с механизмом травмы, он начнет тестировать Ваши коленные суставы. В первую очередь обследуют здоровое колено, чтобы ознакомить пациента с техникой осмотра, а так же для того, чтобы имелась возможность сравнить результаты тестов на здоровой и больной ноге. Для выявления передней нестабильности голени в коленном суставе существует ряд специальных тестов. Принцип этих тестов состоит в том, что врач-травматолог провоцирует голень смещаться кпереди, и, если передняя крестообразная связка разорвана и не выполняет своей функции, то голень будет поддаваться и смещаться. Существует три основных теста, которые определяют передне-внутреннюю нестабильность голени в коленном суставе: тест переднего выдвижного ящика, тест «pivot shift» и тест Лахмана (Lachman).
Существует три основных теста, которые определяют передне-внутреннюю нестабильность голени в коленном суставе: тест переднего выдвижного ящика, тест «pivot shift» и тест Лахмана (Lachman).
Тест переднего выдвижного ящика. Нога согнута в колене под прямым углом, врач тащит голень на себя, оценивая ее смещение в сравнении со здоровым коленом. Дополнительно тест выполняется с поворотом стопы внутрь и наружу
Если тест переднего выдвижного ящика дал сомнительные результаты, то для более точного измерения нестабильности голени в коленном суставе используется специальный прибор — артрометр, который позволяет оценить подвижность голени с точностью до миллиметра
Pivot shift тест или тест Jerk
Тест Лахмана (Lachman). Пробу проводят при согнутом под углом 20—30 градусов колене. Оценивают степень смещения голени вперед, а также ощущения в момент остановки. Недостаточность функции переднецй крестообразной связк4и или переднюю нестабильность голени разделяют на три степени, основываясь на сравнении со здоровой ногой. Первой степени соответствует увеличение смещения на 1—5 мм (т.е. подвижность голени больной ноги на 1-5 мм больше, чем на здоровой), второй — на 6—10 мм, третьей — более чем на 10 мм.
Первой степени соответствует увеличение смещения на 1—5 мм (т.е. подвижность голени больной ноги на 1-5 мм больше, чем на здоровой), второй — на 6—10 мм, третьей — более чем на 10 мм.
Как мы уже отмечали, в первые несколько дней после травмы боль в колене и гемартроз делают такое обследование невозможным, но, если сразу после травмы не упустить время, то есть провести осмотр до того, как разовьется отек и больной начнет инстинктивно сопротивляться манипуляциям врачато, то эти тесты воможны. Уменьшить боль и улучшить качество обследования можно, аспирировав (удалив шприцом) из сустава кровь.
При тщательном сборе анамнеза и внимательном осмотре, тестировании сустава разрыв передней крестообразной связки можно диагностировать без дополнительных методов исследования. Но, так как необходимо исключить и другие травмы (переломы мыщелков большеберцовой и мыщелков бедренной костей, переломы надколенника, перелом Сегонда, разрывы менисков, боковых связок и др.), врач использует и другие, инструментальные методы обследования (рентгенографию, магнитно-резонансную томографию, УЗИ).
Лучевая диагностика. Для исключения переломов выполняют рентгенографию коленного сустава в стандартных проекциях. Перелом Сегонда, упомянутый выше, представляет собой отрывной перелом участка мыщелка большеберцовой кости. Чаще этот перелом встречается у детей и подростков. Следующий по ценности метод для обнаружения сопутствующих травм — магнитно-резонансная томография. Точность ее для диагностики разрыва передней крестообразной связки составляет 95% или более, но обычно использование магнитно-резонансной томографии (МРТ) является подстраховкой, поскольку диагноз часто очевиден при обследовании руками. Более того, МРТ может быть даже вредным, поскольку исследование может показать «страшный» разрыв связки, а на самом деле он не будет давать нестабильности — и в такой ситуации врач и пациент могут склониться к ненужной операции. Среди ортопедов, травматологов, спортивных врачей есть даже специальное обозначение таких случаев — VOMIT, что является англоязычной аббревиатурой victim of modern imaging techniques (жертва современных изуализирующих методов обследования, к которым относится и МРТ).
В 80% случаев на магнитно-резонансных томограммах обнаруживают также поднадкостничные гематомы в области наружного мыщелка бедренной кости и наружной части большеберцовой кости.
Магнитно-резонансная томография коленного сустава. Слева — нормальная передняя крестообразная связка. На снимке она выглядит как равномерный темный тяж. Справа — разрыв передней крестообразной связки в ее верхней части. Связка на снимке не целая и светлая.
Лечение
Разрыв передней крестообразной связки совершенно не означает, что единственным возможным методом лечения такой травмы будет операция. Показанием к операции является не сам факт разрыва передней крестообразной связки, а развившаяся вследствие разрыва передне-внутренняя нестабильность голени в коленном суставе. Частичные разрывы передней крестообразной связки в большинстве случаев не приводят к нестабильности голени, поскольку оставшаяся часть связки может вполне успешно стабилизировать голень в коленном суставе. Полные разрывы также не всегда приводят к нестабильности. Например, оторвавшаяся передняя крестообразная связка может подпаяться к задней крестообразной связке и при неспротивных нагрузках в таком случае нестабильности не будет, и, соотеветственно, такое состояние не будет требовать операции. Стоит еще раз отметить, что передняя крестообразная связка хоь и главный стабилизатор, но не единственный (существуют и другие связки, мышцы, капсула сустава), и даже при полном разрыве оставшиеся неповрежденными структуры могут обеспечивать стабильность при определенном уровне физических нагрузок.
Полные разрывы также не всегда приводят к нестабильности. Например, оторвавшаяся передняя крестообразная связка может подпаяться к задней крестообразной связке и при неспротивных нагрузках в таком случае нестабильности не будет, и, соотеветственно, такое состояние не будет требовать операции. Стоит еще раз отметить, что передняя крестообразная связка хоь и главный стабилизатор, но не единственный (существуют и другие связки, мышцы, капсула сустава), и даже при полном разрыве оставшиеся неповрежденными структуры могут обеспечивать стабильность при определенном уровне физических нагрузок.
Прежде чем мы поговорим о лечении, стоит разделить повреждения и разрывы передней крестообразной связки по давности. Можно выделить свежие повреждения, когда после травмы колена прошло несколько дней, в колене имеется кровь (гемартроз) и еще ярко выражена боль. Несвежие случаи (до 3-5 недель), когда отек спадает, но связка еще не срослась (имеется ввиду возможность «подпаивания» передней крестообразной связки к задней или срастание частичного микроразрыва). И, наконец, спустя 3-5 недель после травмы можно выделить период, когда все нарушения функции сустава обусловлены только недостаточностью поврежденной передней крестообразной связки, а не болью или отеком острой травмы.
И, наконец, спустя 3-5 недель после травмы можно выделить период, когда все нарушения функции сустава обусловлены только недостаточностью поврежденной передней крестообразной связки, а не болью или отеком острой травмы.
В остром периоде, когда повреждение (растяжение, частичный или полный разрыв) передней крестообразной связки свежее, лечение направлено на снятие боли и отека (гемартроза) коленного сустава. Сразу после травмы не пытайтесь передвигаться без посторонней помощи, желательно вообще не наступать на травмированную ногу — ведь нагрузка может усугубить внутрисуставные повреждения. Сразу после травмы (и в первые 2-3 суток) нужно прикладывать холод, применять противовоспалительные препараты (обезбаливающие таблетки, капсулы). Важен покой для коленного сустава — который подразумевает ограничение и осевой нагрузки на ногу (нельзя наступать на ногу или можно наступать с частичной опорой), и амплитуды движений. Для ограничения амплиитуды движений может использоваться гипсовая лонгета, которая полностью исключит движения к коленном суставе, или ортез, который позволяет как полностью запрещать движения, так и ограничивать их в заданной амплитуде за счет специальных регулируемых шарниров.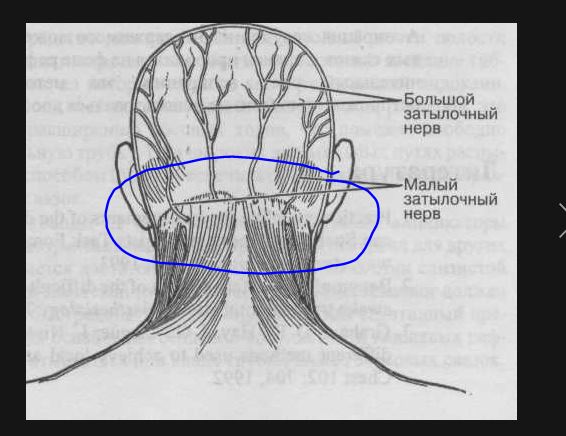 При наличии выраженного гемартроза необходимо отсасывать шприцом скапливающуюся в коленном суставе кровь — это позволит значительно снизить боль.
При наличии выраженного гемартроза необходимо отсасывать шприцом скапливающуюся в коленном суставе кровь — это позволит значительно снизить боль.
Ортез на коленный сустав
Во втором периоде (несвежий разрыв), который начинается после купирования острой боли в коленном суставе и гемартроза, начинают постепенно восстанавливать движения и приступают к тренировке мышц. Физические упражнения, которые укрепляют подколенные мышцы и четырехглавую мышцу бедра, помогут быстрее возвратить нормальную подвижность в суставе. Тренированные мышцы сами по себе могут стабилизировать коленный сустав, что очень важно при повреждении передней крестообразной связки. Если нет каких-либо других повреждений (связок, менисков), то упражнения выполняют с нарастающей амплитудой и интеснивностью, исключая только лишь те движения, которые провоцируют нестабильность. Для ограничения этих движений целесообразно все время использовать ортез для коленного сустава. Спустя 3-5 недель после травмы, после восстановления амплитуды движений и силы мышц, ортез снимают и еще больше увеличивают активность.
Широко распространенная практика полного обездвиживания коленного сустава гипсовой лонгетой на 5-6 недель неправильна, так как она может привести к стойкому ограничению движений в суставе (контрактуре), атрофии мышц. Конечно же, если повреждению передней крестообразной связки сопутствуют другие травмы структур колена (мениски, другие связки), то тактика лечения во втором периоде может быть другой, например, врач может обоснованно полностью запретить движения в коленном суставе или, наоборот, рекомендовать безотлагательную операцию.
В третьем периоде сустав оценивают с «чистого листа». Грубо говоря, если на нужном уровне физической активности нет признаков нестабильности, то консервативное лечение можно считать успешным. Если при нужном уровне физической активности имеются признаки нестабильности (боль, непослушность колена, выскальзывание, подкашивание и т.д.), то переднюю крестообразную связку можно признать несостоятельной и выходом в такой ситуации может быть операция. Однако важно понимать, что уровень физической активности после прекращения второго периода, когда проводилась иммобилизация, т.е. полное или частичное обездвиживание ортезом, восстанавливается не сразу, а за несколько недель. При этом важно продолжать тренировать передние и задние мышцы бедра, которые могут компенсировать разорванную переднюю крестообразную связку. Если после всего этого сохраняется нестабильность коленного сустава при нужных физических нагрузках, то ставится диагноз хронической передне-медиальной нестабильности, которая лечится только операцией.
Однако важно понимать, что уровень физической активности после прекращения второго периода, когда проводилась иммобилизация, т.е. полное или частичное обездвиживание ортезом, восстанавливается не сразу, а за несколько недель. При этом важно продолжать тренировать передние и задние мышцы бедра, которые могут компенсировать разорванную переднюю крестообразную связку. Если после всего этого сохраняется нестабильность коленного сустава при нужных физических нагрузках, то ставится диагноз хронической передне-медиальной нестабильности, которая лечится только операцией.
Консервативное, т.е. безоперационное лечение изолированных повреждений передней крестообразной связки рекомендуется или может быть эффективным в случаях, когда:
- при частичных разрыв без признаков нестабильности в остром периоде
- при полных разрывах без признаков нестабильности в повседневной жизни у спортсменов, которые более не планируют возвращаться в спорт
- при низких физических запросах (малоподвижный образ жизни).

- у детей и подростков с незакрытыми зонами роста кости
- у пожилых людей (разрывы связки у детей и у пожилых встречаются редко — около 5% случаев от числа всех разрывов)
Консервативное лечение травм передней крестообразной связки обычно не дает хороших результатов у людей, возвращающихся к интенсивным спортивным занятиям. Боль, отек и нестабильность периодически возникают у 56—89% спортсменов с разрывами передней крестообразной связки после консервативного лечения. Важно отметить, что нестабильность увеличивает риск последующих травм внутрисуставных структур (менисков, других связок). Кроме того, в нестабильном коленном суставе сильнее изнашивается хрящ, что приводит к развитию артроза коленного сустава. Без операции вероятность возвращения в профессиональный спорт после полных разрывов передней крестообразной связки составляет не более 20%.
У профессиональных спортсменов операция по восстановлению передней крестообразной связки может быть выполнена и сразу после травмы, т. е. без этапа консервативного лечения. Кроме того, безотлагательная операция может быть целесообразной и в том случае, если разрыву передней крестообразной связки сопутствует и повреждение других внутрисуставных структур. Например, при сопутствующем разрыве мениска его оторванный и болтающийся лоскут может блокировать движения в коленном суставе и, соответственно, полноценное консервативное движение в таком случае не возможно в принципе.
е. без этапа консервативного лечения. Кроме того, безотлагательная операция может быть целесообразной и в том случае, если разрыву передней крестообразной связки сопутствует и повреждение других внутрисуставных структур. Например, при сопутствующем разрыве мениска его оторванный и болтающийся лоскут может блокировать движения в коленном суставе и, соответственно, полноценное консервативное движение в таком случае не возможно в принципе.
Хирургическое лечение. Операцию делают в том случае, если после консервативного лечения стабильность сустава не соответствует требованиям физической активности. Стоит отметить, что операция дает наилучшие результаты на фоне хороших движений в коленном суставе и сильных мышц, что еще раз подчеркивает важность консервативного этапа лечения. В среднем операции по восстановлению передней крестообразной связки у неспортсменов делают через 6 месяцев после разрыва, но это не значит, что позже операцию делать не нужно. Бывает, что ее делают и через 5-7 лет после травмы. В принципе операция может быть выполнена на любом сроке после травмы, за исключением тех случаев, когда в коленном суставе на фоне разрыва передней крестообразной связки и последовавшей за ним нестабильности коленного сустава развился выраженный артроз.
В принципе операция может быть выполнена на любом сроке после травмы, за исключением тех случаев, когда в коленном суставе на фоне разрыва передней крестообразной связки и последовавшей за ним нестабильности коленного сустава развился выраженный артроз.
Идеальный кандидат на операцию — это молодой подвижный человек с объективными (т.е. обнаруживаемыми врачом) и субъективными (ощущаемыми пациентом) признаками нестабильности, желающий заниматься спортом, где необходимы частые рывковые движения и прыжки. Напротив, для больных постарше, с имеющимся дегенеративными изменениями в суставе, не участвующих в соревнованиях и без жалоб на нестабильность сустава больше подходят консервативное лечение, лечебная физкультура.
Сшить разорвавшуюся переднюю крестообразную связку невозможно — для ее восстановления используются трансплантаты, т.е. другие сухожилия (аутотрансплантат из связки надколенника, аутотрансплантат из подколенных сухожилий, аллотрансплантаты) или синтетические протеы. Исключение, пожалуй, только одно — перелом Сегонда (отрыв межмыщелкового возвышения). В таком случае оторвавшийся вместе со связкой костный блок можно фиксировать на свое место.
Исключение, пожалуй, только одно — перелом Сегонда (отрыв межмыщелкового возвышения). В таком случае оторвавшийся вместе со связкой костный блок можно фиксировать на свое место.
Схема операции при переломе Сегонда
Еще при первых попытках хирургического восстановления передней крестообразной связки было замечено, что простое сшивание не дает хороших результатов, да это часто и невозможно технически. Начались поиски оптимального способа реконструкции с помощью различных материалов: от искусственных до ауто- и аллотрансплантатов. Аутотрансплантаты — это связки или сухожилия, которые берутся у самого пациента из другого места (связка надколенника, сухожилия хамстринг-мышц и др.). Аллотрасплантаты — специально обработанные связки или сухожилия других людей.
Операцию по восстановлению передней крестообразной связки называют «пластикой передней крестообразной связки» или «стабилизацией коленного сустава». Суть операции заключается в том, что разорвавшуюся связку убирают, а вместо нее ставят заменитель. Сейчас такие операции выполняются малотравматично благодаря артроскопии. Суть артроскопических операций заключается в том, что их выполняют без разрезов, а через маленькие проколы длинной по 1-2 сантиметра. Через один из проколов в сустав вводят артроскоп (оптическую часть видеокамеры), что позволяет осматривать коленный сустав изнутри. Во время операции хирург смотрит на монитор и видит все, что происходит в данный момент в суставе, с большим увеличением – от 40 до 60 раз. Через другой прокол вводят минниатюрные инструменты, которыми и выполняют операцию. Артроскопия позволяет выполнять тончайшие манипуляции на коленном суставе с минимальным повреждением окружающих структур и самого сустава (например, сшивание или удаление части менисков, пересадка хряща, реконструкция связок). Во время операции хирург смотрит на монитор и видит все, что происходит в данный момент в суставе, с большим увеличением – от 40 до 60 раз. Использование современных инструментов и высокочувствительной оптики позволяет выполнять тончайшие манипуляции на коленном суставе с минимальным повреждением окружающих структур и самого сустава (например, сшивание или удаление части менисков, пересадка хряща, реконструкция связок) – и все это через 2–3 небольших разреза.
Сейчас такие операции выполняются малотравматично благодаря артроскопии. Суть артроскопических операций заключается в том, что их выполняют без разрезов, а через маленькие проколы длинной по 1-2 сантиметра. Через один из проколов в сустав вводят артроскоп (оптическую часть видеокамеры), что позволяет осматривать коленный сустав изнутри. Во время операции хирург смотрит на монитор и видит все, что происходит в данный момент в суставе, с большим увеличением – от 40 до 60 раз. Через другой прокол вводят минниатюрные инструменты, которыми и выполняют операцию. Артроскопия позволяет выполнять тончайшие манипуляции на коленном суставе с минимальным повреждением окружающих структур и самого сустава (например, сшивание или удаление части менисков, пересадка хряща, реконструкция связок). Во время операции хирург смотрит на монитор и видит все, что происходит в данный момент в суставе, с большим увеличением – от 40 до 60 раз. Использование современных инструментов и высокочувствительной оптики позволяет выполнять тончайшие манипуляции на коленном суставе с минимальным повреждением окружающих структур и самого сустава (например, сшивание или удаление части менисков, пересадка хряща, реконструкция связок) – и все это через 2–3 небольших разреза.
Артроскопия коленного сустава
Восстановленная передняя крестообразная связка в идеале должна по прочности, расположению и функции соответствовать неповрежденной. Проблема прочности решается за счет адекватного выбора материала для пластики, и первостепенным становится расположение трансплантата. Обычно его проводят через каналы в большеберцовой и бедренной костях таким образом, чтобы позиция трансплантата максимально точно соотвтетствовала нормальной связке.
Для успешной реконструкции необходимо подобрать правильную степень натяжения трансплантата и прочно фиксировать его. Натяжение трансплантата определяет его функциональность: слабо натянутый трансплантат не обеспечивает стабильности коленного сустава, туго натянутый — может порваться или ограничить амплитуду движений в коленном суставе.
Реконструкция связкой надколенника. Эта связка соединяет надколенник с большеберцовой костью. Аутотрансплантат отсекают от большеберцовой кости и надколенника с костными фрагментами, таким образом получается связка с костными блоками на концах. В большеберцовой и бедренной костях просверливаются каналы, выходящие в полость коленного сустава. Внутренние отверстия этих каналов в суставе находятся в тех же самых местах, где находились места прикрепления передней крестообразной связки. Трансплантат связки проводится в полость сустава через канал большеберцовой кости. Концы трансплантата протеза фиксируются в костных каналах при помощи специальных металлических или биополимерных рассасывающихся винтов. Титановый винт очень прочный, но он не рассасывается, что при возможных последующих операциях будет создавать технические трудности. В целом у молодых пациентов мы считаем более предпочтительными рассасывающиеся винты. Иногда такой трансплантат называют BTB-трансплантатом от английской аббревиатуры BTB: bone-tendon-bone (кость-сухожилие-кость). Именно эти костные блоки трансплантата фиксируются в каналах бедренной и большеберцовой кости винтами. Такая фиксация имеет важное преимущество: костный блок трансплантата быстрее срастается со стенками канала — за 2—3 недели, что значительно меньше срока прочного прирастания сухожилия к кости, что требуется, например, у трансплантата из подколенных сухожилий.
В большеберцовой и бедренной костях просверливаются каналы, выходящие в полость коленного сустава. Внутренние отверстия этих каналов в суставе находятся в тех же самых местах, где находились места прикрепления передней крестообразной связки. Трансплантат связки проводится в полость сустава через канал большеберцовой кости. Концы трансплантата протеза фиксируются в костных каналах при помощи специальных металлических или биополимерных рассасывающихся винтов. Титановый винт очень прочный, но он не рассасывается, что при возможных последующих операциях будет создавать технические трудности. В целом у молодых пациентов мы считаем более предпочтительными рассасывающиеся винты. Иногда такой трансплантат называют BTB-трансплантатом от английской аббревиатуры BTB: bone-tendon-bone (кость-сухожилие-кость). Именно эти костные блоки трансплантата фиксируются в каналах бедренной и большеберцовой кости винтами. Такая фиксация имеет важное преимущество: костный блок трансплантата быстрее срастается со стенками канала — за 2—3 недели, что значительно меньше срока прочного прирастания сухожилия к кости, что требуется, например, у трансплантата из подколенных сухожилий. Края разрезанной связки надколенника, откуда был взят трансплантат, зашиваются.
Края разрезанной связки надколенника, откуда был взят трансплантат, зашиваются.
Схема операции пластики передней крестообразной связки трансплантаом из связки надколенника (BTB-трансплантат)
Принцип фиксации костного блока трансплантата титановым или рассасывающимся винтом
Рентгенограмма после операции стабилизации коленного сустава BTB-трансплантатом. Костные блоки фикированы титановыми винтами, которые хорошо видны на рентгенограмме. Рассасывающиеся винты рентгенпрозрачны и поэтому не видны.
Артроскопическая стабилизация коленного сустава: пластика передней крестообразной связки BTB — трансплантатом (из связки надколенника с костными блоками надколенника и бугристости большеберцовой кости)
Аутотрансплантат из подколенных сухожилий. Иногда этот трансплантат называют еще хамстринг-трансплантатом. В качестве материала для пересадки используется сухожилие полусухожильной мышцы бедра, которое забтирают специальным инструментом (стриппером) через разрез длинной 3-4 сантиметра.
В качестве материала для пересадки используется сухожилие полусухожильной мышцы бедра, которое забтирают специальным инструментом (стриппером) через разрез длинной 3-4 сантиметра.
После забора сухожилия полусухожильной мышцы его складывают пополам, прошивают и, точно также как и при описанном выше BTB-трансплантате, просверливают каналы в бедренной и большеберцовой костях, через которые проводят новую связку, натягивают и фиксируют ее. Иногда для пластики забирают не одно сухожилие, а два (из полусухожильной, нежной или полуперепончатой мышц). Вариантов фиксации такого трансплантата больше, чем BTB — скобы, пуговицы, пины, винты и т.д.
Варианты фиксации бедренной части трансплантата: A — EndoButton, Б — винт Mulch В — TransFix, Г — RigidFix, Д — рассасывающийся винт, Е — EZLoc.
Варианты фиксации большеберцовой части трансплантата: A — накладка AO с винтами, Б — WasherLoc, В — накладка с шипами и винт, Г — скобы, Д — нитями к винту (Suture-post fixation), Е — рассасывающийся винт, Ж — IntraFix, З — система GTS (гильза и распирающий винт).
Послеоперационные рентгенограммы (слева — проекция спереди, справа — боковая проекция): аутотрансплантат не виден, так как он состоит из мягкой сухожильной ткани. Фиксация бедренной части трансплантата системой эндобаттон (Еndobutton фирмы
Smith & Nephew, США), а большеберцовая часть фиксирована скобой.
Среди травматологов до сих пор не существует единого мнения о том, какой аутотрансплантат лучше. Реконструкция аутотрансплантатом из связки надколенника травматичнее и восстановление после такой операции протекает сложнее из-за травмирования данной связки. Но зато считается, что такая операция надежнее, костные блоки трансплантата быстрее срастаются со стенками каналов, сколено более стабильно, лучше выдерживает нагрузки. Хотя если хирург хорошо освоил технику выполнения операции по реконструкции из подколенных сухожилий, получаются сравнимые результаты. При второй методике операции (из сухожилия полусухожильной мышцы) получается меньше разрезов и в будущем будет практически незаметно, что была операция на колене. При первой методике (из связки надколенника) об операции будет напоминать 5-сантиметровый рубец на месте разреза, через который забирали часть связки надколенника. Но и он часто малозаметен.
При первой методике (из связки надколенника) об операции будет напоминать 5-сантиметровый рубец на месте разреза, через который забирали часть связки надколенника. Но и он часто малозаметен.
Аллотрансплантаты — это ткани, полученные от донора. После смерти человека передняя крестообразная связка или другая связка забирается и отсылается в банк тканей. Там она проверяется на все инфекции, стерилизуется и замораживается. Когда необходима операция врач отправляет запрос в банк тканей и получает нужный аллотрансплантат. Источником аллотрансплантата могут быть связка надколенника, подколенные сухожилия или ахиллово сухожилие. Преимущество этого метода заключается в том, что хирургу не приходится вырезать трансплантат из организма пациента, нарушая его нормальные связки или сухожилия. Такая операция длится меньше, т.к. не тратится время на выделение трансплантата. У аллотрансплантатов существует риск неприживления. В нашей стране такие операции практически не выполняются.
Для лучшего восстановления двухпучковой структуры передней крестообразной связки существуют и методики двухпучковой реконструкции, когда устанавливаются два трансплантата или один, состоящий из двух ручков.
Осложнения
Вероятность успеха при реконструкции передней крестообразной связки очень высока, тем не менее осложнения все же возможны. Одно из наиболее частых — ограничение подвижности коленного сустава (контрактура). Для профилактики сустав полностью разгибают сразу после операции и поддерживают в разогнутом состоянии. Как можно раньше начинают упражнения, увеличивающие амплитуду движений, стараясь достигнуть 90° сгибания за неделю. Кроме того, важно сохранить подвижность надколенника, чтобы по возможности уменьшить рубцевание связок, соединяющих его с бедренной костью. Другое возможное осложнение — боль в переднем отделе коленного сустава (пателло-феморальный артроз), которая возможна после забора BTB-трансплантата. Также после забора BTB-трансплантата бывают редкие переломы надколенника или разрывы его связки, откуда забирался трансплантат.
Кроме того операция может быть неуспешной -трансплантат может порваться или от может вырваться из костных каналов. В таком случае приходится делать еще одну операцию, ревизионную. Для предотвращения этого осложнения важно тщательно выбирать места проведения костных каналов и жестко фиксировать трансплантат, а сам пациент должен четко соблюдать все рекомендации в послеоперационном периоде, во время реабилитации. В литературе описаны единичные случаи компартмент синдрома после пластики передней крестообразной связки.
Прогноз
Цель операции по пластике восстановления передней крестообразной связки — как можно быстрее вернуть больного к желаемому уровню физической активности и избежать осложнений, к которым в первую очередь относится артроз. Совершенствование хирургической техники и методов реабилитации привело к тому, что более 90% больных продолжают заниматься спортом и полностью удовлетворены результатами лечения. Средний срок реабилитации составляет 4—6 месяцев, но некоторые профессиональные спортсмены с успехом приступают к соревнованиям и через 3 мес. Критерии допуска к спортивным занятиям могут отличаться, но всегда ориентируются в той или иной мере на результаты функциональных проб, ощущения больного и данные осмотра. Наиболее общепринятые критерии следующие: восстановление амплитуды движений, увеличение смещаемости голени по данным гониометрии не более чем на 2—3 мм по сравнению со здоровой ногой, сила четырехглавой мышцы не менее 85% от нормы, восстановление силы задней группы мышц бедра, все функциональные показатели составляют не менее 85% нормы.
Критерии допуска к спортивным занятиям могут отличаться, но всегда ориентируются в той или иной мере на результаты функциональных проб, ощущения больного и данные осмотра. Наиболее общепринятые критерии следующие: восстановление амплитуды движений, увеличение смещаемости голени по данным гониометрии не более чем на 2—3 мм по сравнению со здоровой ногой, сила четырехглавой мышцы не менее 85% от нормы, восстановление силы задней группы мышц бедра, все функциональные показатели составляют не менее 85% нормы.
В костях человека обнаружены кровеносные сосуды неизвестного ранее типа
Источник: https://nauka.vesti.ru/
Международная команда учёных сообщила об открытии, которое перепишет учебники по анатомии. В костях человека найдены кровеносные сосуды совершенно нового для науки типа.
По словам исследователей, обнаруженные сети мелких сосудов, похожие на крошечные тоннели, проходят от поверхности костей в их внутренние полости. Судя по всему, благодаря им кровь и иммунные клетки, вырабатываемые в костном мозге, могут быстро и эффективно распространяться по всему телу.
«Это действительно неожиданно – найти новую центральную анатомическую структуру, которая не была описана ни в одном учебнике в 21 веке», – признаётся ведущий автор новой работы молекулярный иммунолог Маттиас Гунцер (Matthias Gunzer) из Университета Дуйсбург-Эссен.
Изначально его команда обнаружила кровеносные сосуды в костях мышей. Исследователи изучали клетки крови, помеченные флуоресцентным красителем, и заметили, что они проходят через структуры, которые, как считалось, были твёрдыми.
Не найдя в медицинской литературе ничего, что могло бы объяснить это явление, Гунцер решил применить иной подход. Он вместе с коллегами использовал вещество под названием этилциннамат, которое делает кости прозрачными.
Затем специалисты применили комбинацию нескольких методик, в том числе световой флуоресцентной микроскопии и рентгеновской микроскопии. Они заметили внутри костей, составляющих голень мыши, несколько сотен крошечных кровеносных сосудов, проходящих через кортикальный (твёрдый внешний) слой.
Обнаруженные сосуды были названы транскортикальными.
Оказалось, что мышиная большеберцовая кость, которая по размерам меньше спички, может содержать более тысячи таких маленьких сосудов. Что удивительно, через их сеть проходит более 80% артериальной крови и около 59% венозной крови.
На следующем этапе команда решила проверить наличие транскортикальных сосудов в костях человека. «Подопытным» выступил сам Маттиас Гунцер. В результате оказалось, что кости людей также пронизаны сетью из сосудов нового типа. Конечно, у человека они более широкие по сравнению с мышиными.
В дальнейших работах специалисты намерены подробнее исследовать транскортикальные сосуды и определить их функции. Ожидается, что благодаря этому открытию можно будет лучше изучить процессы повреждения тканей и миграции клеток, а также природу некоторых заболеваний костей, воспалительных болезней и нарушений в работе иммунной системы.
К слову, новые данные помогают объяснить, почему некоторые переломы костей могут сильно кровоточить, а лекарства, которые вводят непосредственно в кости, быстро распространяются по телу пациента.
Исследователи полагают, что существуют и другие виды кровеносных сосудов, проходящих сквозь костные структуры. Транскортикальные сосуды, по всей вероятности, составляют лишь малую часть «системы костного кровообращения».
Более подробно об этой работе рассказывается в статье, опубликованной в журнале Nature Metabolism.
Кстати, ранее авторы проекта «Вести.Наука» (nauka.vesti.ru) сообщали об открытии скелетных стволовых клеток человека.
Костная пластика при имплантации зубов в стоматологии Николь
Согласно рекомендациям стоматологов центра «Николь», проводить имплантацию нового зуба на месте недавно удаленного необходимо как можно скорее. Если это невозможно, то специалисты утверждают, что следует провести операцию костной пластики. Причиной этому служит быстрое изменение челюстной кости.
Происходит быстрое истончение ткани, поэтому уже через несколько недель прочность костной ткани, а также ее объем уменьшается.Отсутствие привычной нагрузки не позволит установить зубной имплантат должным образом. Данный процесс стоматологи именуют как дистрофия костной ткани.
Таким образом, при установке имплантата на ненадежно зафиксированную основу не удастся получить долговечный результат. От дефекта костной ткани легко и элементарно можно избавиться, прибегнув к костной пластике (остеопластике).
Показания к остеопластике
Недостаточный объем костно-челюстной ткани в результате удаления зуба путем хирургического вмешательства. При проведении операции стоматолог сможет добавить необходимое количество костной ткани пациенту, в будущем эта процедура обеспечит успешную имплантацию зуба.
Парадонтит. Данное заболевание из-за его воспалительных процессов наносит ущерб кости, в результате образуются дефекты тканей.
Имплантация в области переднего отдела челюсти. При проведении данного рода операции существует немалый риск задеть нервные окончания, которые располагаются в непосредственной близости с деснами. Костная пластика является единственным способом проведения операций, при которых отсутствует контакт неравными окончаниями, находящимися в переднем челюстном отделе.
Костная пластика является единственным способом проведения операций, при которых отсутствует контакт неравными окончаниями, находящимися в переднем челюстном отделе.
Травма челюстей. При необходимости восстановления нормальной функциональности жевательного аппарата, а также придания прежнего здорового вида челюстей.
Просто укажите свои имя и телефон.
Мы свяжемся с Вами буквально в течение нескольких минут!
Противопоказания к костной пластике
- Воспалительные процессы в ротовой полости;
- Слабая иммунная система;
- Онкология;
- Клинический синдром;
- Беременность или лактация;
- Психические отклонения;
-
Нарушение функций клеток крови.

Виды костной пластики
Всего различают три вида костной пластики, хирургом выбирается одна из остеопластик, исходя из личных особенностей пациента.
Пересадка аутогенного трансплантата. При данной операции происходит забор донорского участка, который позже используется для его трансплантации. Если материалом служит костный порошок, то его перемешивают с плазмой крови. Полученное вещество располагается на участок трансплантации. Зачастую используют барьерную мембрану, служащую дополнительным фиксатором.
Расщепление челюстной кости. Один из самых простых способов используется для увеличения объемов костной ткани при помощи распила или расщепления альвеолярного гребня кости до необходимой ширины.
Направленная регенерация костной ткани. Особенность данного метода заключается в использовании синтетических материалов для избавления от всяческих дефектов и увеличение необходимого объема кости.
Центр Позвоночника
Повреждение спинного мозга – это поражение в результате травмы или болезни любой части спинного мозга или нервов позвоночного канала. Эти травмы часто вызывают ухудшение или утрату двигательной или сенсорной функций.
Многие ученые не оставляют мысли о том, что повреждение спинного мозга когда-нибудь будут полностью обратимы. Поэтому по всему миру ведутся исследования в этой области. В тоже время лечение и реабилитационные программы, существующие сегодня, позволяют многим пациентам вновь стать активным членом общества.
Способность контролировать конечности тела после травмы спинного мозга зависит от двух факторов: место повреждения (часть спинного мозга) и степень тяжести травмы. Если спинной мозг поврежден серьезно, разрушены проводящие пути, которые связывают воедино несколько частей спинного мозга, тогда последствия спинальной травмы оказываются катастрофическими.
Тяжесть травмы подразделяют на:
Полное повреждение
Такая травма приводят к потере чувствительности и двигательных функций всех органов и частей тела, находящихся ниже уровня повреждения.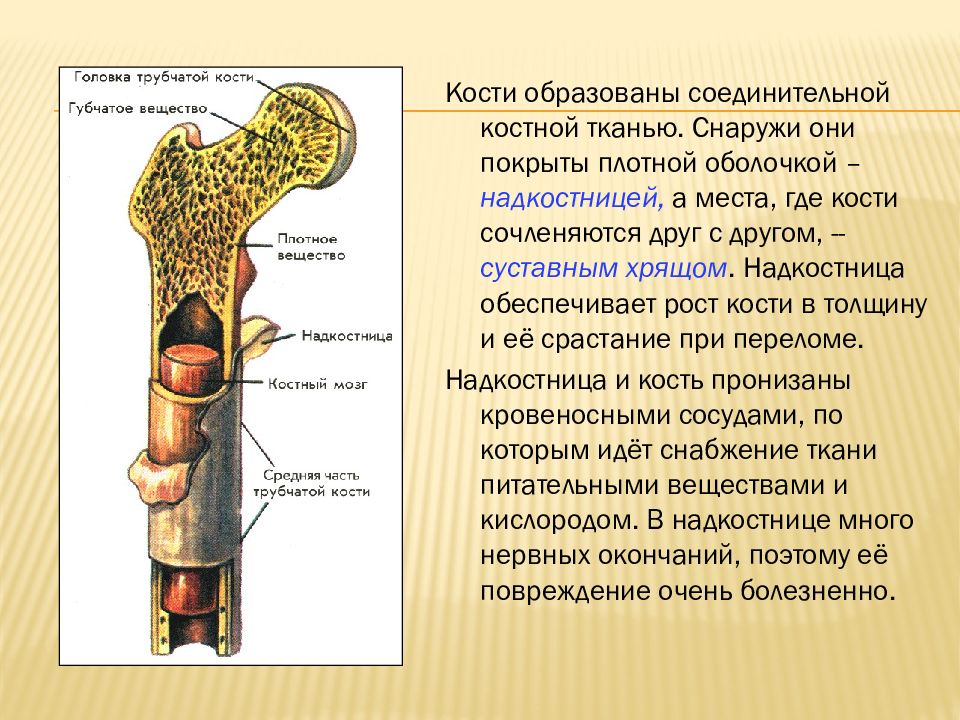
Неполное повреждение
При неполной травме спинного мозга расположенные ниже места поражения органы и конечности сохраняют частичную двигательную активность.
Также травмы спинного мозга могут привести к тетраплегии (она же квадриплегия) — нарушение или потеря функций рук, туловища, ног и функций тазовых органов.
Параплегия – это полный паралич или паралич, затрагивающий часть туловища, ноги и малый таз.
- Лечащий врач проведет ряд тестов, чтобы определить неврологический уровень поражения и тяжесть травмы.
- Признаки и симптомы повреждения спинного мозга (могут проявиться как несколькими или одним из списка):
- потеря двигательных функций,
- потеря чувствительности, в том числе способность ощущать тепло, холод или прикосновение.
- потеря контроля над работой кишечника и мочевого пузыря
- повышенный мышечный тонус или неконтролируемые спазмы
- сексуальная дисфункция и бесплодие
- болевые ощущения или покалывания, вызванные повреждением нервных волокон спинного мозга
- затрудненное дыхания, кашель.

Первые признаки травмы спинного мозга:
- Сильные боли в спине или давление в области шеи и головы
- Слабость, нарушение координации или паралич в любой части тела
- Онемение, покалывание или потеря чувствительности в кистях, пальцах, ступнях или пальцах ног
- Потеря контроля работы кишечника или мочевого пузыря
- Трудности при ходьбе и в поддержании баланса
- Проблемы с респираторной функцией
Когда необходимо обратиться к врачу
Любой, кто получил серьезную травму головы или шеи должен срочно обратиться за медицинской помощью. Врачи проведут оценку и возможного повреждения спинного мозга. При любом подозрении на травму спинного мозга доктора должны провести все надлежащие медицинские процедуры, пока не будет доказано обратное, это важно, потому что:
- Серьезная травма позвоночника не всегда бывает очевидна сразу. Если ее не распознать вовремя, это может привести к более серьезным последствиям.

- Онемение или паралич также могут проявиться не сразу, без своевременной диагностики ситуацию могут ухудшить продолжительное внутреннее кровотечение и отек в или вокруг спинного мозга.
- Время, прошедшее после травмы и оказания медицинской помощи, напрямую влияет на возможные осложнения и последующую реабилитацию пациента.
Как себя вести с человеком, который только что получи травму:
- Звоните 1719 или в службу скорой помощи ближайшего госпиталя.
- Положите полотенца с обеих сторон головы и шеи, чтобы закрепить их в неподвижном состоянии и ожидайте скорую помощь.
- Окажите первую помощь пострадавшему: предпримите меры для остановки кровотечения и обеспечьте комфорт пострадавшему на сколько это возможно, но, не смещая шею или голову.
Поражение спинного мозга возможно в результате повреждения позвонков, связок или дисков позвоночника. Травматическое повреждение спинного мозга может быть связано с внезапным ударом позвоночника, что приводит к перелому, смещению или сдавлению позвонков. Травму спинного мозга также можно получить также в результате выстрела или ножевого ранения. Осложнения обычно происходят в течение нескольких дней или недель после травмы из-за кровотечения, отека, воспаления и скопления жидкости внутри и вокруг спинного мозга.
Травму спинного мозга также можно получить также в результате выстрела или ножевого ранения. Осложнения обычно происходят в течение нескольких дней или недель после травмы из-за кровотечения, отека, воспаления и скопления жидкости внутри и вокруг спинного мозга.
Нетравматическое повреждение спинного мозга также возможно из-за ряда болезней: артрита, рака, воспаления, инфекции или дисковой дегенерации позвоночника.
Ваш мозг и центральная нервная система
Центральная нервная система состоит из головного и спинного мозга. Спинной мозг, состоящий из мягких тканей в окружении костей (позвонков) проходит вниз от основания головного мозга, состоит из нервных клеток и их отростков и заканчивается немного выше талии. Ниже этой области проходит пучок нервных окончаний под названием «конский хвост».
Нервные отростки спинного мозга отвечают за сообщение между мозгом и телом. Моторные нейроны передают сигналы от мозга, чтобы контролировать движение мышц. Сенсорные участки несут сигналы от частей тела к мозгу для передачи информации о жаре, холоде, давлении, боли и позиции конечностей.
Повреждение нервных волокон
Независимо от причины повреждения спинного мозга, пострадать могут и нервные волокна, проходящие через поврежденную область. Это приводит к ухудшению работы мышц и нервов, расположенных ниже места травмы. Повреждение грудной или поясничной области может сказаться на функционировании мышц туловища, ног и работе внутренних органов (контроль мочевого пузыря и кишечника, сексуальную функцию). А травмы шеи могут повлиять на движения рук и даже возможность дышать.
Распространенные причины повреждения спинного мозга
Наиболее распространенными причинами повреждения спинного мозга в Соединенных Штатах:
Дорожно-транспортные происшествия. ДТП с участием автомобилей и мотоциклов — основная причина травмирования спинного мозга, более 40 % ежегодно.
Падения. Травмы спинного мозга лиц пожилого возраста (после 65 лет), как правило, связаны с падением. В целом, статистика отводит этой причине ¼ часть всех случаев.
Акты насилия. 15 % случаев повреждений спинного мозга наносятся в результате насильственных действий (в т.ч. огнестрельных и ножевых ранений). Данные Национального института неврологических расстройств и инсульта.
15 % случаев повреждений спинного мозга наносятся в результате насильственных действий (в т.ч. огнестрельных и ножевых ранений). Данные Национального института неврологических расстройств и инсульта.
Спортивные травмы. Профессиональный спорт несет в себе немало опасностей, как и активных отдых, к примеру, дайвинг на мелководье. 8 % повреждений спины попадают под эту статью.
Алкоголь. Каждая четвертая травма, так или иначе, связана с употреблением алкоголя.
Болезни. Рак, артрит, остеопороз и воспаление спинного мозга может также могут стать причиной поражения этого органа.
Не смотря на то, что получение подобных травм, как правило, происходит по воле несчастного случая, были выявлены ряд факторов, предрасполагающих к риску, такие как:
Гендерный. Статистически пострадавших мужчин в разы больше. В США насчитывается лишь 20% женщин с подобными и повреждениями.
Возраст. Как правило, травмы получают в самом активном возрасте — от 16 до 30 лет. Главной причиной получения травм в этом возрасте остаются происшествия на дороге.
Любовь к риску и экстриму. Что логично, но главное, что в первую очередь травмы получают спортсмены и любители при нарушении техник безопасности.
Болезни костей и суставов. В случае хронического артрита или остеопороза даже небольшая травма спины может оказаться фатальной для пациента.
После травм спинного мозга пациенты сталкиваются с большим числом неприятных последствий, способных в корне изменить их жизни. При получении такого серьезного увечья, на помощь пациенту приходит команда специалистов, включая нейрохирургов, неврологов и врачей реабилитационного центра.
Специалисты Центра реабилитации предложат ряд методов контроля процессов жизнедеятельности (работы мочевого пузыря и кишечника). Разработают специальную диету для улучшения функций органов, что поможет избежать в будущем образований камней в почках, инфекций мочевыводящих путей и почек, ожирения, сахарного диабета и пр. Под контролем опытных физиотерапевтов будет разработана программа физических упражнений для улучшения мышечного тонуса пациента. Вы получите подробные рекомендации об уходе за кожей во избежание пролежней, поддержании работы сердечно-сосудистой и респираторных систем. Специалисты в области урологии и лечения бесплодия также могут быть задействованы в случае необходимости. Врачи научат бороться с болью и депрессией. Мы в состоянии предложить комплексный подход для полной стабилизации состояния пациента.
Вы получите подробные рекомендации об уходе за кожей во избежание пролежней, поддержании работы сердечно-сосудистой и респираторных систем. Специалисты в области урологии и лечения бесплодия также могут быть задействованы в случае необходимости. Врачи научат бороться с болью и депрессией. Мы в состоянии предложить комплексный подход для полной стабилизации состояния пациента.
Медицинские исследования:
Рентгенография. Именно с нее целесообразно начинать исследование. Снимки дают общую картину ситуации, позволяют оценить деформацию позвоночника, обнаружить переломы, вывихи тел и отростков позвонков, уточнить уровень повреждения.
Компьютерная томография (КТ). КТ более дает более подробную информацию о поврежденном участке. При сканировании врач получает ряд изображений поперечного сечения и обеспечивает подробное изучение стенок позвоночного канала, его оболочек и нервных корешков.
Магнитно-резонансная томография (МРТ). МРТ дает возможность получить изображение спинного мозга на всем протяжении в разных проекциях. И будет очень полезным при выявлении грыжи дисков, сгустков крови и другие масс, способных сжимать спинной мозг.
И будет очень полезным при выявлении грыжи дисков, сгустков крови и другие масс, способных сжимать спинной мозг.
Через несколько дней после травмы, когда спадет опухлость, врач может провести неврологическое обследование для определения степени тяжести травмы. Оно включает в себя проверку мышечной силы и сенсорной чувствительности.
К сожалению, поражение спинного мозга не может быть полностью излечимо. Но постоянно ведущиеся исследователи дают врачам все больше новых средств и методик для лечения пациентов, которые смогут способствовать регенерации нервных клеток и улучшению функции нервов. В тоже время не нужно забывать о работе, которая ведется в области поддержания активной жизни пациентов после травмы, расширения возможностей и улучшения качества жизни людей с ограниченными способностями.
Оказание скорой медицинской помощи
Оказание своевременной первой медицинской помощи имеет решающее значение для минимизации последствий после любой травмы головы или шеи. Так и лечение травмы спинного мозга часто начинается уже на месте происшествия.
Так и лечение травмы спинного мозга часто начинается уже на месте происшествия.
Команда неотложной медицинской помощи по прибытию должна провести иммобилизацию позвоночника , как мягко и быстро , насколько это возможно с использованием жесткого шейного воротника и специальных носилок для транспортировки пострадавшего в больницу.
При получении травмы спинного мозга пациента доставляют в отделение интенсивной терапии. Пациент также может быть доставлен в региональный центр лечения травм позвоночника, где всегда дежурит команда нейрохирургов, хирургов-ортопедов, психологов, медсестер, терапевтов и социальных работников.
Медикаменты. «Метилпреднизолон» ( Medrol ) применяется в случае получения острой травмы спинного мозга. При лечении «Метилпреднизолоном» в течение первых восьми часов после получении травмы, есть шанс получить умеренный улучшение состояния пациента. Данный препарат уменьшает повреждения нервных клеток и снимает воспаления тканей вокруг места травмы. Однако, это не лекарство от самой травмы спинного мозга.
Иммобилизация. Стабилизация поврежденного позвоночника при транспортировке крайне важна. Для этого в арсенале бригады находятся специальные приспособления для удержания позвоночника и шеи в неподвижном состоянии.
Хирургическое вмешательство. Зачастую врачи вынуждены прибегать к операциям, чтобы удалить фрагменты костей, посторонних предметов, грыжи дисков или закрепить переломом позвонков. Операция также может потребоваться для стабилизации позвоночника, чтобы предотвратить боль или деформацию кости в будущем.
Период госпитализации
После стабилизации больного и проведения первоочередного лечения персонал начинает работу по предотвращению осложнений и сопутствующих проблем. Это может быть ухудшение физического состояния пациента, мышечная контрактура, пролежни, нарушение работы кишечника и мочевого пузыря, респираторные инфекции и кровяные сгустки.
Длительность пребывания в стационаре зависит от тяжести травмы и темпов выздоровления. После выписки пациента направляют в отделение реабилитации.
Реабилитация. Работа с пациентом может начаться на ранних стадиях восстановления. В команде специалистов могут быть задействованы физиотерапевты, специалисты по трудотерапии, специально обученные медсестры, психолог, социальный работник, диетолог и курирующий врач.
На начальных этапах реабилитации врачи как правило работают над сохранением и укреплением функции мышц, задействуя мелкую моторику и обучая адаптивным методам поведения в повседневных делах. Пациенты получают консультации в вопросах последствий травм и предотвращения осложнений. Вам будут даны рекомендации о том, как можно улучшить качество жизни в сложившихся условиях. Пациентов обучают новым навыкам, в т ч использовать специальное оборудование и технологии, которые дают возможность не зависеть от посторонней помощи. Овладев ими, Вы сможете найти для себя возможно новое хобби, участвовать в социальных и спортивных мероприятиях, вернуться в школу или на рабочее место.
Медикаментозное лечение. Пациенту могут быть прописаны медикаменты для контроля последствий травмы спинного мозга. К ним относятся лекарства для контроля боли и мышечных спазмов, а также медикаменты для улучшения контроля работы мочевого пузыря, кишечника и половой функции.
К ним относятся лекарства для контроля боли и мышечных спазмов, а также медикаменты для улучшения контроля работы мочевого пузыря, кишечника и половой функции.
Новые технологии. На сегодняшний день для людей с ограниченными возможностями были придуманы современные средства передвижения, обеспечивающие полную мобильность пациентов. К примеру, современные облегченные кресла-коляски на электрическом приводе. Одни из последних моделей позволяют пациенту самостоятельно подниматься по лестнице и поднимать сидящего до любой необходимой высоты.
Прогнозы и восстановление
Ваш врач не сможет спрогнозировать выздоровление только поступившего пациента. В случае восстановления, если его возможно достичь, потребуется от 1й недели до шести месяцев после травмы. Для другой группы пациентов небольшие улучшения придут после года работы над собой или большего количество времени.
В случае паралича и последующей инвалидности необходимо найти в себе силы, чтобы принять ситуацию и начать другую жизнь, адаптация к которой будет нелегкой и пугающей. Травма спинного мозга повлияет на все аспекты жизни, будь то повседневные дела, работа или отношения.
Травма спинного мозга повлияет на все аспекты жизни, будь то повседневные дела, работа или отношения.
Восстановление после такого события требует времени, но только Вам выбирать будете ли Вы счастливы в сложившей ситуации, а не травме. Много людей прошли через это и смогли найти в себе силы начать новую полноценную жизнь. Одно из главных составляющих успеха – это качественная медицинская помощь и поддержка близких.
Доктор Д. Р. Джонсон, Центр биологии человека Анатомы говорят как о костях, так и о костях. Первый является
тип соединительной ткани, состоящий из клеток, взвешенных в матрице:
коллагеновая матрица в костях просто сильно пропитана
с минералами. Вы узнаете о костных клетках в другом месте, но
вот фотография слепка одного, просто чтобы доказать, что они существуют
.Этот остеоцит имеет характерные длинные отростки, идущие
через кость, связывая ее как с другими клетками, так и
с сосудами и нервами. Определение формы Форма и структура костей определяются многими факторами,
генетические, метаболические и механические. Генетическая детерминация первичных
форма может быть продемонстрирована с помощью органной культуры костных зачатков,
которые впоследствии превращаются в узнаваемые кости, т.е.е. грубо
законченная форма во всех основных аспектах. Тонкая настройка осуществляется мышечным
действие. Мышцы активны внутриутробно, хотя это трудно
изолировать их действие на данном этапе. Однако после рождения
и вплоть до подросткового возраста существует корреляция между активностью
и рост. это видно наоборот, если мы посмотрим на людей, которые
прикованы к постели или имеют паралич (например, полиомиелит). Функция
Происхождение кости снова в двух основных формах. Некоторые кости (в широком
терминах почти все, кроме верхней части черепа) преформируется
в хрящах — замещающая или эндохондральная кость.Подробности будут
приходите на лекции по гистологии. В черепе и один или два других
местами, однако, кости формируются непосредственно в перепончатой соединительной ткани
— перепончатая кость. Классификация костей Скелет состоит из множества костей, пропорции которых изменяются. между человеком и его близкими родственниками, но легко узнаваемы.Самый простой способ классифицировать кости — по форме. Длинные кости Типично для конечностей, хорошее место для начала.
Они состоят из центральной, обычно полой, трубчатой области,
диафиз, соединенный со специализированными концами (эпифизами) соединительной
область (метафиз). Сначала посмотрите на вал. трубчатый, немного
как труба велосипедной рамы. Галилей был первым, кто написал разумно
об этом, отметив, что полая трубка прочнее, вес для
вес, чем цельный стержень, и что размеры должны быть соотнесены
массе тела, а не площади: так кости слона
должны быть пропорционально шире, чем у мужчины.В некоторых
кости мы можем видеть приспособления к определенным силам. Например
кости крыльев грифов и других крупных птиц имеют усиление
это делает их очень похожими на мосты: это отрезвляющая мысль, что
первый гриф появился на несколько миллионов раньше первого балочного моста
лет. Короткие кости Короткие кости находятся в запястьях и лодыжках, запястьях и тарсалы соответственно.У них нет вала, так как они не увеличиваются резко увеличиваются в размерах в одном измерении во время роста и имеют тенденцию иметь кубовидную форму. Они скорее похожи на мальтийцев в строительстве, с губчатой костью в центре и твердой наружной оболочкой из компактная кость. Плоские кости Плоские кости, такие как кости черепа или лопатки, представляют собой бутерброды. губчатой кости между двумя слоями компактной кости. Обычно они изогнутые, поэтому мы можем обращаться к внутреннему и внешнему столу с помощью diploe между ними.Эти диплоэ, особенно в черепе, могут стать пневматизированы, то есть заполнены воздухом. Кольцо лицевых пазух вокруг нос может заразиться, что приведет к синуситу. Неправильные кости Любые кости, которые не соответствуют этим произвольным категориям (кости лица, позвонков) называют неправильными. Сесамовидный Сесамовидные кости интересны тем, что встречаются в сухожилиях, особенно там, где сухожилие поворачивает за угол и, таким образом, обнажается к трению.Мы еще встретимся с ними, когда будем говорить о мышцы. Маркировка поверхности кости. Мы часто можем получить подсказки о том, что происходит вокруг кости. с его поверхности. В таких местах, как суставные поверхности, кость быть покрыты гладким суставным хрящом. Это падает в препарирование, но оставляет лежащую под ним кость гладкой. Кость постоянно растет или видоизменяется, и это происходит на поверхность. При большом увеличении мы можем увидеть в высушенной кости что было до смерти.На этом фото дырка для кровеносного сосуда, отверстие. Примерно половина его диаметра коллагеновая кость шероховатая, другая половина гладкая. Грубо резорбирует кость, поедается крупными остеокластами, которые оставляют ямки и гладкие отложения, кость формируется. Этот указывает на то, что отверстие перемещалось по мере роста кости. В других областях также наблюдаются отложения и резорбция: наращивать и выдалбливать соответственно. На макроскопическом масштабе эти эффекты можно рассматривать как точки привязки к кости — связок, сухожилий или волокнистых прикреплений мышц.Все эти структуры передают силы и требуют хорошо организованной узел. Любая часть этой структуры, которая отложила кальций появится как кусок кости. Внутри кости мы часто видим ряды трабекулы или толстые нити коллагена, проходящие волокна Шарпея через полость костного мозга, чтобы вставить в кортикальную кость напротив. Кровеносные сосуды и нервы также имеют каналы. Различные шишки для крепления вещей имеют разные названия по форме, обычно производной от мертвого языка.Там их много, но самые распространенные:
Вернуться к примечаниям к курсу биологии человека Эта страница поддерживается Стивом Пакстон |
Физиология боли в костях.Как много мы знаем на самом деле?
Фронт Физиол. 2016; 7: 157.
Кафедра анатомии и неврологии Мельбурнского университета, Мельбурн, Виктория, Австралия
Под редакцией: Ника Спенсера, Университет Флиндерс, Австралия
Рецензирование: Майкл Карр, Исследователь респираторных препаратов, GlaxoSmithKline, США; TinaMarie Lieu, Университет Монаш, Австралия
Эта статья была отправлена в Autonomic Neuroscience, раздел журнала Frontiers in Physiology
Поступила в редакцию 15 февраля 2016 г.; Принято 11 апреля 2016 г.
Это статья с открытым доступом, распространяемая на условиях лицензии Creative Commons Attribution License (CC BY). Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора(ов) или лицензиара оригинала и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья была процитирована другими статьями в PMC.Abstract
Боль связана с большинством костных патологий. Клинические и экспериментальные наблюдения позволяют предположить, что боль в костях может быть следствием вредной стимуляции надкостницы или костного мозга. Известно, что сенсорные нейроны иннервируют надкостницу и полость костного мозга, и большинство из них имеют морфологию и молекулярный фенотип, соответствующие роли в ноцицепции. Однако мало что известно о физиологии этих нейронов, и поэтому информация о механизмах, которые вызывают и поддерживают боль в костях, отсутствует.Надкостнице уделялось больше внимания по сравнению с костным мозгом, что отражает более легкий доступ к надкостнице для экспериментальной оценки. С помощью используемых электрофизиологических препаратов исследователи смогли изолированно регистрировать отдельные периостальные единицы, и имеется много доступной информации о том, как они реагируют на различные раздражители, в том числе вредные. Напротив, препараты, используемые для изучения чувствительных нейронов, иннервирующих костный мозг, были ограничены регистрацией многоэлементной активности целых нервов, и, хотя они четко сообщают об ответах на вредную стимуляцию, невозможно определить ответы отдельных чувствительных нейронов, иннервирующих костный мозг. костный мозг.Имеются лишь ограниченные доказательства того, что периферические сенсорные нейроны, иннервирующие кость, могут быть сенсибилизированы или что они могут быть активированы несколькими типами стимулов, и в настоящее время это существует только частично для периостальных единиц. Очевидно, что в центральной нервной системе нейроны задних рогов спинного мозга могут активироваться вредными стимулами, воздействующими на кость. Некоторые из них могут быть сенсибилизированы при патологических состояниях и могут частично способствовать вторичной или отраженной боли, связанной с костной патологией. Активность, связанная со стимуляцией сенсорных нервов, иннервирующих кость, также была обнаружена в нейронах спинопарабрахиального пути и соматосенсорной коры, которые известны своей ролью в кодировании информации о боли.Хотя они дают некоторые подсказки относительно того, как информация о боли в костях централизованно кодируется, их необходимо расширить, чтобы углубить наше понимание других задействованных центральных областей. Еще многое предстоит узнать о физиологии периферических сенсорных нейронов, иннервирующих кость, и их центральных отростков.
Ключевые слова: боль в костях, боль, ноцицепция, кость, электрофизиология, надкостница, костный мозг как информация о вредной стимуляции, закодированная этими нейронами, передается через центральную нервную систему в кору головного мозга, вызывая болезненные ощущения.Мы начнем с обобщения некоторых ключевых концепций, касающихся качества и лечения боли в костях, а также того, что мы знаем о морфологии и молекулярном фенотипе костных афферентных нейронов, а затем подробно изучим физиологию костных афферентных нейронов и их проекции через ЦНС.
Боль в костях: клинические и экспериментальные наблюдения
Боль, связанная с костной патологией, включая синдромы отека костного мозга, остеомиелит, остеоартрит, переломы и рак кости, является тяжелым бременем (как с точки зрения качества жизни, так и с точки зрения стоимости) для отдельных лиц и системы здравоохранения во всем мире.Ожидается, что это бремя будет увеличиваться с достижениями современной медицины, увеличивающими ожидаемую продолжительность жизни, поскольку многие состояния, вызывающие боль в костях, неизлечимы и развиваются в более позднем возрасте. Распространенность многих из этих состояний высока, например, остеоартрит поражает почти 10 % мужчин и 18 % женщин старше 60 лет (всемирная оценка), а остеопороз поражает до 30 % женщин в постменопаузе на севере США (Woulf и Пфлегер, 2003). Метастатическая боль в костях является наиболее распространенным болевым синдромом у онкологических больных, и до 50% пациентов сообщают, что существующие методы лечения плохо справляются с болью (Mantyh and Hunt, 2004).Управление болью в костях с помощью традиционной анальгезии основано на предположении, что механизмы, опосредующие боль в костях, аналогичны механизмам, опосредующим боль в других тканевых системах, и поэтому могут быть нацелены на аналогичные методы лечения. Опиоиды и нестероидные противовоспалительные препараты (НПВП) обычно используются для лечения боли от легкой до сильной, но терапевтическое применение при болях в костях ограничено нежелательными побочными эффектами, включая седативный эффект, угнетение дыхания, толерантность к длительному применению, риск привыкания, желудочно-кишечные расстройства. эффектов и почечной токсичности.Все это происходит при длительном использовании того вида, который необходим для лечения постоянной боли при трудноизлечимых состояниях, таких как остеоартрит, остеопороз и рак костей. Использование НПВП и опиоидных анальгетиков при лечении болей в костях еще более осложняется из-за значительного нежелательного воздействия на ремоделирование/заживление кости (Bove et al., 2009; Pountos et al., 2012; Chrastil et al., 2013), что усложняет лечение. скрытая патология. Другие средства, подавляющие активность остеокластов (например, остеопротегерин) или уменьшающие воспалительные процессы (например, остеопротегерин).g., блокирующие функцию антитела к фактору роста нервов) вызывают значительную анальгезию на животных моделях рака кости и боли при переломах (Honore et al., 2000a; Halvorson et al., 2005; Sevcik et al., 2005; Jimenez-Andrade et al. и др., 2007; Кеулер и др., 2007). Они в первую очередь оказывают воздействие на периферию и нацелены на причины болей в костях. Однако они могут иметь значительные побочные эффекты, связанные с ремоделированием и/или разрушением кости, что ограничивает их терапевтический потенциал (Holmes, 2012; Seidel et al., 2013). Существует очевидная потребность в поиске альтернативных стратегий лечения боли в костях, не связанных с использованием НПВП или опиоидов и нацеленных более конкретно на нервные или воспалительные механизмы, вызывающие и/или поддерживающие боль.
Происхождение боли, связанной с костными тканями, является спорным вопросом. В ранних исследованиях отмечалось, что прямая болезненная механическая стимуляция надкостницы вызывала болезненные ощущения у людей (Inman and Saunders, 1944), и в более поздней литературе подчеркивается преобладающее мнение, что боль от кости обычно не ощущается, если не затронута надкостница. Мах и др., 2002). Боль от надкостницы часто описывается как острая и хорошо локализованная, и возникает, например, при переломах, достаточно значительных, чтобы воздействовать на надкостницу (Santy and Mackintosh, 2001). Однако введение раздражающих веществ в костномозговую полость также очень болезненно, как и пункционная аспирация костного мозга, и эта боль отличается от боли, связанной с разрывом надкостницы (Niv et al., 2003). Кроме того, пациенты часто ощущают боль в костях при патологиях, ограниченных главным образом костным мозгом и не имеющих явного периостального поражения (напр.g., синдром внутрикостного нагрубания) (Lemperg and Arnoldi, 1978; Arnoldi, 1990). В этих случаях боль часто описывается исключительно как тупая, диффузная и трудно локализуемая. Боль, вызванная раком костей, относится к этой последней категории и обычно состоит из фоновой боли, которая описывается как постоянная и тупая и усиливается со временем (Honore and Mantyh, 2000; Haegerstam, 2001). Кроме того, пациенты с раком кости часто жалуются на другую, более интенсивную боль при движении или нагрузке (прорывная боль) (Portenoy et al., 1999). Таким образом, оказывается, что как надкостница, так и полость костного мозга должны быть иннервированы первичными афферентными нейронами, способными трансдуцировать и передавать ноцицептивную информацию. Эти костные афферентные нейроны обеспечивают центральную нервную систему информацией, которая вызывает первичную боль, возникающую в костях.
Костная патология также может вызывать чувствительность к обычно безвредной стимуляции (аллодиния) и/или повышенную чувствительность к вредной стимуляции (гипералгезия) кожи вокруг пораженной кости/костей или даже кожи на отдаленных участках.Это часто описывается как вторичная или отраженная боль и, вероятно, отражает сенсибилизацию кожных афферентных нейронов и/или их центральных проекций (Ren and Dubner, 1999a). Сенсибилизация включает повышенную возбудимость (снижение порога возбуждения для активации и/или увеличение частоты разрядки потенциала действия) периферических и центральных сенсорных нейронов. Многие экспериментальные исследования, сообщающие о болевом поведении на животных моделях костной патологии, используют платформы для тестирования поведения, которые оценивают болевые, температурные или механические чувствительности в основном (или исключительно) на коже вокруг пораженной кости (Cain et al., 2001; Урч и др., 2003 г.; Янагисава и др., 2010 г.; Uhelski et al., 2013), и поэтому, вероятно, будут отслеживать механизмы, связанные со вторичной или отраженной болью, а не с первичной болью, связанной с прямой стимуляцией ноцицепторов в костях.
Морфология и молекулярный фенотип сенсорных нейронов, иннервирующих кость
Во многих исследованиях сообщалось о существовании первичных афферентных нейронов, иннервирующих кость, и стало ясно, что большинство этих сенсорных нейронов имеют морфологию и молекулярный фенотип, соответствующие роль в ноцицепции (рис. ).Здесь мы обобщаем литературу, которая способствовала этому пониманию, прежде чем подробно обсуждать физиологию сенсорных нейронов, иннервирующих кость. Более подробный обзор современной литературы по морфологии и молекулярному фенотипу сенсорных нейронов, иннервирующих кость, можно найти в следующих обзорах: Mach et al. (2002), Хименес-Андраде и др. (2010), Мантых (2014).
Морфология и молекулярный фенотип сенсорных нейронов, иннервирующих кости .Сома DRG первичных афферентных нейронов, иннервирующих костный мозг и надкостницу, в основном представляет собой миелинизированные и немиелинизированные нейроны малого диаметра со свободными окончаниями волокон, хотя в надкостнице все же существуют более крупные нейроны с инкапсулированными окончаниями. Они экспрессируют различные комбинации маркеров, характерных для ноцицептивных нейронов, включая пептид, родственный гену кальцитонина (CGRP), вещество P (SP) и киназу рецептора тирозина A (TrkA), и/или связывают изолектин B4 (IB4). Связывание IB4 не наблюдалось в окончаниях периферических нервов (представлено пунктирной линией).
Самые ранние исследования иннервации кости задокументировали примеры рассеченных или окрашенных серебром нервных волокон в кости и надкостнице, но мало внимания уделялось их функции (De Castro, 1925; Hurrell, 1937; Takase and Nomura, 1957; Miller and Kasahara). , 1963; Cooper et al., 1966; Sakada and Maeda, 1967а; Calvo, 1968; Thurston, 1982). Поскольку многие из этих волокон находились в тесном контакте с кровеносными сосудами внутри кости, некоторые авторы предположили связь с функцией сосудов, но не дали дальнейших комментариев.Это несколько удивительно, поскольку повреждение кости и ассоциированной ткани явно связано с болью, что позволяет предположить, что по крайней мере некоторые из описанных волокон в кости должны быть ноцицепторами. Использование иммуногистохимических маркеров различных нейропептидов в более поздних сообщениях показало, что нервные волокна, иннервирующие минерализованную кость, костный мозг и надкостницу, имеют как сенсорное, так и вегетативное происхождение (Duncan and Shim, 1977; Gronblad et al., 1984; Hohmann et al., 1986; Bjurholm et al., 1988; Хилл и Эльде, 1988, 1991; Мах и др., 2002). Волокна сенсорного происхождения обычно описывались как имеющие свободные окончания небольшого диаметра, хотя некоторые более крупные волокна со специализированными инкапсулированными окончаниями были обнаружены в надкостнице нижней челюсти кошек (Sakada and Maeda, 1967a; Sakada and Aida, 1971b), длинных костях человека. надкостница (Ralston et al., 1960) и гаверсовы каналы в кортикальной кости собак (Cooper et al., 1966). Недавно разработанный метод избирательной маркировки периферических сенсорных нейронов может быть полезен для подтверждения сенсорного, а не симпатического происхождения этих нервных окончаний в костях (Kyloh and Spencer, 2014; Spencer et al., 2014).
Ноцицепторы обычно определяются как тонкие миелинизированные или немиелинизированные первичные афферентные нейроны небольшого диаметра и могут быть идентифицированы по наличию специфических молекулярных маркеров, экспрессируемых на их соме [в ганглиях задних корешков (DRG)] или их периферических нервных окончаниях. Сома DRG первичных афферентных нейронов, иннервирующих костномозговую полость, трабекулярную кость и надкостницу, представляет собой почти исключительно миелинизированные и немиелинизированные нейроны малого диаметра, которые экспрессируют различные комбинации маркеров, характерных для ноцицептивных нейронов, включая пептид, родственный гену кальцитонина (CGRP), вещество P (SP) и киназа рецептора тирозина A (TrkA) и/или связывают изолектин B4 (IB4) (Gajda et al., 2004; Иванушич, 2009 г.; Асо и др., 2014). Важно отметить, что эти исследования идентифицировали субпопуляции сенсорных нейронов, иннервирующих кость, на основе различных комбинаций этих маркеров у крыс. Например, ясно, что до половины являются пептидергическими (CGRP+) (Ivanusic, 2009; Aso et al., 2014), а многие непептидергическими (связывание CGRP или IB4) (Ivanusic, 2009; Aso et al., 2014). ), и что примерно две трети, вероятно, будут чувствительными к фактору роста нервов (TrkA+), в то время как другие не будут (TrkA-) (Aso et al., 2014). Похоже, что эти молекулярные фенотипы сохраняются в окончаниях периферических нервов в костях (Mach et al., 2002; Jimenez-Andrade et al., 2010; Castaneda-Corral et al., 2011), хотя связывание IB4 при этом не наблюдалось. расположение (по крайней мере, у мышей; Mach et al., 2002). Хотя могут существовать некоторые тонкие межвидовые различия, ясно, что морфология и молекулярный фенотип сенсорных нейронов, которые иннервируют ткани кости, согласуются с их ролью в ноцицепции, и что эти особенности могут быть использованы для идентификации множественных субпопуляций костных афферентных нейронов. нейроны (рис. ).Отражается ли эта молекулярная гетерогенность на физиологии костных афферентных нейронов, еще предстоит определить. В оставшейся части этого обзора мы рассмотрим то, что известно о физиологии костных афферентных нейронов.
Физиология периферических костных афферентных нейронов
Среда, в которой существуют сенсорные нервные окончания в костях, сильно отличается от окружающей среды в тканях других типов. Надкостница выстилает очень твердый кортикальный слой кости, поэтому чувствительные нервные окончания в надкостнице легко сдавливаются относительно низкопороговыми механическими раздражителями по сравнению с окончаниями в более податливой ткани, такой как кожа.Костный мозг окружен неподатливой минерализованной костью и содержит большие популяции клеток-предшественников и зрелых воспалительных клеток (и других типов клеток), которые вместе создают различные стимулирующие условия в полости костного мозга по сравнению с другими тканями. Таким образом, важно учитывать, как первичные афферентные нейроны в каждом из этих различных костных компартментов реагируют на вредные стимулы и чем это отличается от других типов тканей. Здесь мы подробно обсуждаем то, что известно о физиологии периферически расположенных первичных афферентных нейронов, иннервирующих либо надкостницу, либо костный мозг.
Надкостница
В литературе гораздо большее внимание уделяется периостальной афферентной иннервации, чем полости костного мозга. Это, несомненно, отражает более легкий доступ к надкостнице для экспериментальной оценки, чем к костному мозгу.
Наиболее подробная серия электрофизиологических исследований периостальной иннервации была проведена Сакада с коллегами (Сакада, Маеда, 1967а,б; Сакада, Аида, 1971а,б; Сакада, Оное, 1971; Сакада, Тагучи, 1971; Сакада и др.). Мияке, 1972; Сакада и Немото, 1972; Сакада, 1974; Сакада и Яно, 1978).Они сделали сотни записей с мелких нервов в препарате in vitro с цельным препаратом надкостницы нижней челюсти кошки, описывая реакции как на вредную, так и на безвредную стимуляцию их сенсорных нервных окончаний. Поскольку рецептивные поля надкостничных афферентов в препарате были достаточно дискретными, исследователи смогли активировать и изолировать отдельные единицы с помощью механических стимулов, воздействующих на надкостницу. Гистология показала, что нижнечелюстная надкостница кошки была иннервирована окончаниями свободных волокон малого диаметра и некоторыми более крупными окончаниями, инкапсулированными тельцами Гольджи-Маццони (Sakada and Maeda, 1967a; Sakada and Aida, 1971b).Окончания свободных волокон были распределены по всему препарату, тогда как тельца Гольджи-Маццони можно было обнаружить только по средней линии перед ментальным отверстием. Таким образом, авторы смогли предпочтительно активировать и изучить окончания свободных волокон, применяя стимулы к надкостнице позади ментального отверстия. Они сообщили, что большинство аксонов со свободными окончаниями волокон имели малый диаметр, что соответствовало ноцицептивной функции, и систематически исследовали ответные свойства периостальных окончаний свободных волокон малого диаметра в надкостнице нижней челюсти (см. ниже).Они также описали поведение инкапсулированных телец Гольджи-Маццони, обнаруженных впереди ментального отверстия.
Чжао и Леви описали препарат, в котором они использовали электроды из вольфрамовой проволоки для регистрации активности нейронов тройничного ганглия с рецептивными полями на надкостнице свода черепа крысы (Чжао и Леви, 2014). Этот метод позволяет хорошо изолировать одиночные единицы, и все их данные относятся к ответам одиночных единиц на периостальную стимуляцию. Всего было сообщено о 115 отдельных единицах, что делает выборку значительной выборкой, на основе которой можно делать выводы.Они не комментировали морфологию или размер периостальных окончаний, но тщательно исследовали их физиологию преимущественно, но не исключительно, в контексте роли в ноцицепции (см. ниже).
Mahns и коллеги использовали препарат in vivo для исследования нейронов, иннервирующих надкостницу плечевой кости кошки (Mahns et al., 2004, 2006). Гистология показала, что небольшой нерв, из которого были сделаны записи в этом препарате, содержал только миелинизированные и немиелинизированные аксоны небольшого диаметра (Ivanusic et al., 2006). Они были способны выборочно активировать отдельные афферентные волокна, которые демонстрировали очерченные и точечные рецептивные поля. Однако только 15 отдельных волокон были изучены с точки зрения характеристик рецептивного поля и/или вибромеханической чувствительности и реактивности.
Скорость проведения
Скорость проведения тесно связана с размером аксона и может использоваться для классификации первичных афферентных нейронов по ряду функциональных категорий. Афференты с миелинизированными (Aδ) или немиелинизированными (C) аксонами малого диаметра и низкой скоростью проведения связаны преимущественно с ноцицептивной функцией (Dixon, 1963; Burgess and Perl, 1973; Lawson and Waddell, 1991; Djouhri and Lawson, 2004; Strassman et al. др., 2004). Нейроны С-волокна имеют аксоны наименьшего диаметра (0,6–1,2 мкм у крыс; 1–2 мкм у кошек) и самые низкие скорости проведения (<2 м/с у крыс; <10 м/с у кошек). Их проводящие свойства и реакции как на тепловые, так и на химические раздражители привели к идее, что они являются важными медиаторами медленной жгучей боли в большинстве тканевых систем. Нейроны миелинизированных волокон Aδ имеют более крупные аксоны (1,2–4 мкм у крыс; 2–5 мкм у кошек) и более высокие скорости проведения (2–12 м/с у крыс; 10–30 м/с у кошек). Из-за их более быстрой проводимости они считаются медиаторами быстрой боли.Нейроны Aβ также миелинизированы и имеют аксоны самого большого диаметра (> 4 мкм у крыс;> 5 мкм у кошек) и самые высокие скорости проведения (> 12 м / с у крыс;> 30 м / с у кошек). Нейроны с аксонами большого диаметра, высокой скоростью проведения и инкапсулированными окончаниями обычно связаны с безвредной (например, тактильной или кинестетической) чувствительностью.
Сакада и его коллеги сообщили, что аксоны, иннервирующие окончания свободных волокон надкостницы в надкостнице нижней челюсти кошек, имели скорость проведения в диапазоне волокон Aδ и С (2–18 м/с) (Sakada and Maeda, 1967b; Sakada and Taguchi, 1971). предполагая роль в ноцицепции.Аксоны с инкапсулированными окончаниями Гольджи-Маццони имели более высокую скорость проведения (>30 м/с) (Sakada and Maeda, 1967b; Sakada and Aida, 1971a), что указывает на их роль преимущественно в низкопороговой механо-чувствительности, а не в ноцицепции. Zhao and Levy (2014) сообщили об аналогичном распределении скорости проведения по диапазонам волокон Aβ, Aδ и C в надкостнице свода черепа крысы, подтверждая представление о том, что периостальные афференты играют роль как в ноцицепции, так и в низкопороговой механочувствительности.Напротив, Ivanusic и его коллеги сообщили о гистологических данных о том, что нерв, идущий к кошачьей плечевой кости, содержит только миелинизированные и немиелинизированные аксоны небольшого диаметра (Ivanusic et al., 2006), а скорости проводимости при электрической стимуляции надкостницы были ограничены диапазоном, соответствующим Aδ и классификация волокон С (<30 м/с) (Mahns et al., 2006). Однако была представлена скорость проведения только четырех периостальных афферентных волокон, поэтому размер их выборки ограничен. Возможно, при отборе проб более широкой области надкостницы кошачьей плечевой кости могут быть обнаружены единицы с более высокими скоростями проведения.В качестве альтернативы может быть, что единицы с более высокими скоростями проведения и более крупными аксонами чаще встречаются в черепе (Sakada and Taguchi, 1971; Zhao and Levy, 2014) по сравнению с аппендикулярным скелетом (Mahns et al., 2006). Тем не менее, результаты всех исследователей показывают, что подавляющее большинство периостальных афферентов имеют скорость проведения, соответствующую роли в ноцицепции, и, вероятно, способствуют возникновению острой, быстрой (Aδ) или медленной жгучей (C) боли. Об этих типах боли действительно сообщалось у людей, подвергшихся периостальной стимуляции (Inman and Saunders, 1944), и в ряде исследований на животных предполагалось, что они вносят свой вклад в профиль боли (Martin et al., 2007).
Свойства механической реакции
Все вышеперечисленные исследователи сообщили, что периостальные афферентные единицы являются механически чувствительными. Сакада и его коллеги зарегистрировали многие сотни механически чувствительных единиц в своей серии работ, посвященных надкостнице нижней челюсти кошек, но эти исследования не выявили относительную долю механически чувствительных афферентных волокон, поскольку они изучали только те, которые можно было идентифицировать с механическими раздражителями. Напротив, почти все единицы (113/115), которые могли быть активированы электрической стимуляцией надкостницы свода черепа, были механически чувствительны (Zhao and Levy, 2014), что позволяет предположить, что подавляющее большинство периостальных афферентов механически чувствительны в этом препарате.Точно так же все 15 сенсорных нейронов, идентифицированных при электрической стимуляции надкостницы плечевой кости кошки, могут быть активированы механическими стимулами (Mahns et al., 2006).
Порог активации является важным свойством физиологии сенсорных нейронов, которое сообщает, насколько легко стимул передается на периферии. Порог активации механически чувствительных первичных афферентных нейронов полезен для определения их функциональной классификации. Например, большинство механически чувствительных единиц с низким порогом играют роль в безобидной чувствительности, в то время как единицы с высоким порогом обычно играют роль в ноцицепции.Периферические сенсорные нейроны также могут по-разному адаптироваться к применению постоянного механического раздражителя. Для быстро адаптирующихся нейронов частота разрядов очень быстро снижается, а реакция на механический раздражитель является преходящей, так что импульсы возникают только в начале или после окончания механической стимуляции. Это обеспечивает четкую временную локализацию механических раздражителей и характерно для низкопороговых механосенсорных нейронов. Тельца Пачини являются примером быстро адаптирующихся механорецепторов.Для медленно адаптирующихся нейронов снижение частоты разряда занимает гораздо больше времени, так что нейрон продолжает возбуждаться в течение всего времени действия стимула. Большинство ноцицепторов классически определяются как имеющие медленно адаптирующуюся реакцию на вредную механическую стимуляцию, что означает, что после активации ноцицептор останется активированным и предоставит ЦНС информацию о продолжительности раздражителя.
Сакада и коллеги сообщили, что как большие, инкапсулированные окончания Гольджи-Маццони, так и окончания свободных волокон позади ментального отверстия могут быть классифицированы в соответствии с их адаптационными реакциями.Окончания Гольджи-Маццони были исключительно быстро адаптирующимися, низкопороговыми единицами, которые хорошо реагировали на вибрацию и родственны тельцам Пачини или другим афферентам, которые опосредуют безвредную тактильную или кинестетическую чувствительность (Sakada and Maeda, 1967b; Sakada and Aida, 1971a). Напротив, свободные окончания волокон, с которых они записывали, либо быстро, либо медленно адаптировались, и каждое из них имело разные свойства ответа. Паттерны импульсов к стимуляции давлением медленно адаптирующихся окончаний свободных волокон сильно различались, однако в большинстве из них наблюдалось резкое увеличение активности во время динамической фазы стимула давления, за которым следовал период устойчивой активности, характеризующийся постепенным увеличением интервала между импульсами. как рецептор, адаптированный к поддерживаемому раздражителю (Sakada, Taguchi, 1971; Sakada, Miyake, 1972).С увеличением интенсивности механической стимуляции у этих медленно адаптирующихся свободных окончаний волокон увеличивалась частота разрядов, по крайней мере, в динамической фазе их ответа (Sakada, Taguchi, 1971; Sakada, Miyake, 1972). Большинство из этих медленно адаптирующихся окончаний свободных волокон имели аксоны со скоростями проводимости в диапазоне нейронов Aδ (2-18 м/с) и имели относительно высокие механические пороги (Sakada and Taguchi, 1971), что указывает на роль в ноцицепции. Эти результаты согласуются с выводами Zhao и Levy, которые сообщили, что 82% механочувствительных афферентов в надкостнице свода черепа медленно адаптировались и большинство, но не все, имели скорость проведения в диапазоне волокон Aδ и C.Примечательно, что как Сакада и его коллеги, так и Чжао и Леви сообщили о некоторых медленно адаптирующихся окончаниях свободных волокон, которые реагировали на безвредное растяжение двубрюшной мышцы и/или проводились в диапазоне Aβ, предполагая, что некоторые из них могут быть безвредными механорецепторами, а не ноцицепторами, но они были относительно немного в их приготовлениях.
В исследованиях Sakada и коллег быстро адаптирующиеся окончания свободных волокон были идентифицированы по их ответу на вибрационные стимулы (Sakada and Onoe, 1971; Sakada and Taguchi, 1971).Порог активации измеряли как минимальное напряжение, приложенное к соленоиду механического стимулятора, которое требовалось, чтобы вызвать паттерн возбуждения 1:1 (один импульс на цикл вибрации) с частотой 10 циклов в секунду (Гц). Калибровка по реальной силе не была представлена, поэтому было невозможно сравнить механические пороги с другими исследованиями, но они смогли провести различие между относительно высоким и низким порогом быстрой адаптации свободных окончаний волокон в своих собственных исследованиях. Быстро адаптирующиеся окончания свободных волокон могут следовать частотам вибрации значительно выше 300 циклов в секунду (Sakada and Onoe, 1971).Примерно половина быстро адаптирующихся окончаний свободных волокон в надкостнице имели низкие пороги и реагировали на растяжение двубрюшной мышцы, которое не считалось вредным, поскольку не вызывало болевого рефлекса или рефлекса открывания челюсти (Sakada and Taguchi, 1971). Это свидетельствует о том, что они являются низкопороговыми механорецепторами. Другая половина имела относительно высокие пороги и считалась ноцицепторами (Sakada and Taguchi, 1971). Все 15 механически чувствительных волокон, описанных Mahns, Ivanusic et al.(2006) продемонстрировали быстро адаптирующиеся свойства, так как ступенчатое вдавливание надкостницы с помощью ручных зондов или механических стимулов с сервоуправлением вызывало ответы только в сочетании с динамическими компонентами стимула. Многие из них могут быть активированы с очень низким усилием (всего 0,5 мН) и проведены в диапазоне волокон Aδ и C. Они, вероятно, похожи на быстро адаптирующиеся окончания свободных волокон, определяемые как низкопороговые механорецепторы, о которых сообщают Сакада и его коллеги.
Рецептивное поле отдельного нейрона определяет область ткани, над которой адекватный стимул может вызвать активность, и, следовательно, влияет на способность сенсорного нейрона обнаруживать местоположение стимула и различать несколько стимулов. Рецептивные поля механически чувствительных единиц могут различаться по размеру для разных типов единиц и в разных тканевых системах. Сакада и Тагучи (1971) определили размер рецептивного поля 434 одиночных единиц, иннервирующих надкостницу нижней челюсти.Большинство единиц могут быть активированы в нескольких дискретных рецептивных участках на большой площади надкостницы, обычно от 2 до 20 мм 2 . Незначительная разница в размере рецептивного поля у единиц, которые реагировали на растяжение двубрюшных мышц, и у тех, которые не реагировали, могла иметь очень умеренную тенденцию медленно адаптирующихся единиц иметь несколько большие рецептивные поля, чем быстро адаптирующиеся единицы. В случае надкостницы кошачьей плечевой кости каждая единица имела рецептивное поле, состоящее из одного участка и обычно имело приблизительно овальную форму, которая колебалась от 2 до 4 мм 2 (Mahns et al., 2006). В этом последнем исследовании отдельные периостальные афферентные единицы обычно можно было избирательно активировать с помощью тонких стимульных зондов, что свидетельствует об ограниченном перекрытии терминальных рецептивных полей отдельных волокон в надкостнице.
Наконец, также возможно, что надкостницу иннервируют другие волокна с меньшей или нулевой механической чувствительностью, потому что в областях, которые казались нечувствительными к прямому механическому зондированию, можно было выборочно активировать отдельные волокна путем применения фокальных электрических стимулов (Mahns et al. др., 2006). Они имели скорости проводимости в диапазоне C и Aδ. Они могут реагировать на изменения температуры или химические раздражители вместо механической стимуляции, или они могут быть подобны молчащим ноцицепторам, обнаруженным в других тканевых системах, которые обычно нечувствительны к механической стимуляции в нормальных условиях, но становятся механически чувствительными после воспаления (Grigg et al. ., 1986; Шайбл и Шмидт, 1988; Шайбл, 1996).
Химическая чувствительность и медиаторы воспаления
Химическая чувствительность и сенсибилизация медиаторами воспаления типичны для полимодальных ноцицепторов, особенно тех, которые классифицируются как С-волокна.Только в одном исследовании была проверена химическая чувствительность периостальных афферентных нейронов (Zhao and Levy, 2014). В этом исследовании были сделаны записи сенсорных нейронов, которые иннервируют надкостницу свода черепа, до и во время применения известных болеутоляющих веществ, включая хлорид калия (50–500 мМ), капсаицин (10 мкМ) и протоны (низкий рН). Хлорид калия вызывает дозозависимое увеличение текущей активности периостальных афферентных единиц волокон Aδ и C, но капсаицин и низкий рН редко изменяют текущую активность, а когда это происходит, реакция была слабой.Однако чувствительность периостальных афферентных единиц к механическим раздражителям была отчетливо изменена после применения медиаторов воспаления. Местное применение смеси гистамина, серотонина, брадикинина и PGE2 приводило к увеличению текущей активности почти в одной трети механически чувствительных единиц Aδ и половине единиц C-волокон, а также к увеличению механической чувствительности почти половины волокон Aδ. единиц и всех протестированных единиц волокна C. Механическая сенсибилизация была длительной (часто более 30 минут) и была связана с периорбитальной тактильной гиперчувствительностью, обычно связанной с первичными приступами головной боли.Таким образом, может происходить сенсибилизация периостальных афферентных нейронов, что, вероятно, способствует изменению обработки боли при патологии. В дополнение к доказательствам того, что периостальные афференты могут быть сенсибилизированы, эти данные также подчеркивают, что некоторые периостальные афференты могут активироваться несколькими стимулами и, следовательно, могут считаться полимодальными. Идея о том, что периостальные афферентные единицы являются полимодальными, не исследовалась ни в одном из других исследований периостальной иннервации, описанных выше.
Реакция на изменения температуры
Сакада и Немото (1972) зафиксировали как множественные, так и одиночные реакции на динамические изменения температуры надкостницы.Это было сделано путем регистрации периостальных нервов при охлаждении раствора в ванне с 32 до 27°C и последующем нагревании до 31°C. В записях при 32°С спонтанной активности не было. Количество единиц, активных в многоединичных записях, увеличивалось по мере применения охлаждения, что свидетельствует о постепенном рекрутировании чувствительных к температуре надкостничных единиц. Частота разрядов записей всего нерва также увеличивалась при охлаждении, что указывает на то, что, по крайней мере, некоторые из этих множественных единиц могут кодировать интенсивность или скорость изменения температуры.Интересно, что единицы, которые реагировали на холод, замолчали, когда температура была изменена на температуру, которая нагревается, а не охлаждается, что позволяет предположить, что они ощущают изменения температуры, а не абсолютную температуру. Это похоже на холодовые рецепторы роговицы (Carr et al., 2003). По мере того, как потепление продолжалось, разные единицы начали реагировать на стимул потепления, и они также были способны кодировать интенсивность или скорость изменения стимула потепления. Таким образом, некоторые периостальные афференты реагируют на безвредное охлаждение, а некоторые — на безвредное согревание.Sakada и Nemoto (1972) дополнительно исследовали температурную чувствительность 93 механически чувствительных надкостничных единиц, выделенных из записей всего нерва, применяя температурные изменения к дискретным рецептивным точкам отдельных единиц на надкостнице. Их реакцию на охлаждение оценивали как минимум до 17°C (иногда даже до 0°C) и на нагревание максимум до 45–50°C, диапазоны которых включают температуры, считающиеся вредными. 20 из 93 из них вообще не реагировали на изменения температуры, даже когда эти изменения были экстремальными.24/93 реагировало на похолодание, но не на потепление, а 19/93 реагировало на потепление, но не на похолодание. 30/93 реагировали как на охлаждение, так и на нагрев. Те, что относятся к последним трем категориям, были протестированы только до точки, где был достигнут порог активации либо для охлаждения, либо для нагревания, и поэтому не совсем ясно, все ли они реагировали на вредный диапазон температур, хотя для многих порог активации произошло при вредных температурах. Следует, однако, отметить, что некоторые механически чувствительные ноцицепторы Aδ в коже имеют очень высокий порог к теплу (средний порог выше 53°C), но могут стать более чувствительными к тепловой стимуляции после сенсибилизации (ноцицепторы Aδ типа I; Treede et al. др., 1995), и поэтому температуры, использованные в исследовании Сакады и Немото, возможно, были недостаточными для активации некоторых единиц, которые, по их словам, обладали чисто механической чувствительностью.
В совокупности эти данные свидетельствуют о том, что многие окончания периостальных свободных волокон реагируют на безвредные и вредные термические раздражители. Однако маловероятно, что физиологические изменения температуры вокруг кости достаточно велики, чтобы активировать эти волокна (Sakada and Nemoto, 1972). Также маловероятно, что они активируются непосредственно патологическими изменениями, так как даже нагревание, вызванное воспалением in vivo (Segale, 1919), не вызвало бы достаточного изменения температуры, чтобы активировать эти рецепторы.Конечно, возможно, что, хотя воспаление не вызывает изменений температуры, которые могли бы непосредственно активировать периостальные волокна, оно может изменять их чувствительность к тепловым раздражителям, так что они становятся более чувствительными к изменениям температуры. Действительно, известно, что воспаление повышает термическую чувствительность первичных афферентных нейронов во многих других тканевых системах (Cervero and Laird, 1999; Ren and Dubner, 1999b). Таким образом, активация периостальных афферентов температурой может быть возможна при крайне аномальных или патологических состояниях.
Резюме/выводы
На рисунке обобщены наши знания о физиологии сенсорных нейронов, иннервирующих надкостницу. Надкостница иннервируется как быстропроводящими единицами большого диаметра с инкапсулированными окончаниями, которые, вероятно, обеспечивают информацию о безвредной чувствительности, так и более медленными проводящими единицами малого диаметра со свободными окончаниями волокон, типичными для ноцицепторов. Активация последнего, вероятно, вызывает боль, возникающую при патологии надкостницы.Их свойства реакции, включая скорость проведения и реакцию на химические раздражители, предполагают роль как в быстрой, острой боли в костях, так и в медленной жгучей боли в костях. Однако есть данные, что некоторые свободные окончания волокон в надкостнице активируются при относительно низких порогах. В коже низкопороговая механическая стимуляция небольшого диаметра, миелиновая (Burgess и Perl, 1967; Burgess et al., 1968; Koltzenburg et al., 1997) и немиелинизированная (Vallbo et al., 1993, 1999; Olausson et al., 2002) волокна производят ощущения, которые были описаны как безболезненные. Вопрос о том, играют ли низкопороговые окончания свободных волокон роль в безвредном механосенсорном восприятии в костях, требует дальнейшего изучения (Rowe et al., 2005), но это кажется маловероятным, поскольку трудно представить себе какой-либо стимул, который можно было бы применить к кости, если бы он не учитывался. болезненный. Альтернативой является то, что они могут быть легко активированы низкопороговой механической стимуляцией надкостницы из-за ее тесной связи с нижележащей твердой костной поверхностью и, следовательно, могут способствовать периостальному восприятию боли.Имеются также доказательства того, что нейроны большого диаметра в других тканевых системах могут способствовать обработке боли (Djouhri and Lawson, 2004). Таким образом, возможно, что инкапсулированные окончания большого диаметра, о которых сообщалось, действительно играют некоторую, пока еще не идентифицированную роль, которая также играет роль в боли в костях.
Реактивные свойства окончаний свободных волокон надкостницы . Отдельные периостальные единицы реагируют на механические, химические и термические раздражители. Механически чувствительные единицы можно классифицировать в соответствии с их порогом и профилем адаптации.Хлорид калия дозозависимо активирует большинство периостальных единиц, но капсаицин и низкий рН активируют их лишь изредка. Некоторые периостальные единицы реагируют на охлаждение и нагрев, другие на охлаждение, но не на нагрев, некоторые на нагрев, но не на охлаждение, а некоторые ни на что.
Костный мозг
Брюссова и Лебеденко (1930; цит. по Furusawa, 1970) изучали реакцию собак при введении физиологического раствора под давлением в полость костного мозга. Наблюдая за артериальным давлением и дыханием, они заметили, что во время инъекции животные испытывали сильное болезненное поведение.Это предполагало, что в полости костного мозга должны быть чувствительные нервы, которые реагируют на повышенное давление. Однако только в двух опубликованных работах изучалась физиология сенсорных нейронов, иннервирующих полость костного мозга (Furusawa, 1970; Seike, 1976). В этих исследованиях проводилась запись целого нерва из ветвей большеберцового нерва, в то время как к полости костного мозга применялись механические, термические или химические раздражители. В этих исследованиях не предпринималось попыток исследовать активность отдельных единиц.На основании гистологических данных исследователи предположили, что записи были исключительно из единиц волокон Aδ и C. Однако скорость проведения не была подтверждена ни в одном из исследований.
Свойства механической реакции
Механические стимулы доставлялись в полость костного мозга путем повышения нормального внутрикостного давления путем введения изотонического раствора в костномозговую полость кости. Нормальное внутрикостное давление и степень повышенного давления контролировали с помощью манометра, присоединенного к системе.У собаки нормальное внутрикостное давление в костномозговой полости большеберцовой кости находилось в пределах 30–50 мм рт. ст., а повышение внутрикостного давления в ~3–5 раз (до 100–130 мм рт. единиц в записи целого нерва (Seike, 1976). Подобные пороги активации для целостной нервной деятельности ранее были описаны Furusawa (1970). Это очень высокие пороги, которые вряд ли могут возникнуть в нормальных физиологических условиях. Однако повышение внутрикостного давления (примерно в 3–5 раз выше нормального внутрикостного давления) наблюдается при патологических состояниях, таких как синдромы внутрикостного нагрубания крови (Lemperg and Arnoldi, 1978; Arnoldi et al., 1980). В этих случаях повышение давления связано с болью, которую можно облегчить с помощью фенестрации, предполагая, что повышенное давление в полости костного мозга вызывает боль.
В исследовании Seike (1976) частота разрядов увеличивалась сразу после начала стимуляции давлением, что свидетельствует о коротком латентном ответе на механические раздражители. Скорость разряда обычно имела тенденцию увеличиваться по мере увеличения давления, и когда применялось стабильное линейное изменение давления, ответ постепенно уменьшался, поскольку рецепторы, по-видимому, медленно адаптировались.Однако следует отметить, что в этих исследованиях не выделялись единичные единицы, поэтому неясно, в какой степени этот адаптационный профиль действительно верен для отдельных сенсорных нейронов, иннервирующих полость костного мозга.
Химическая чувствительность
Только в одном исследовании изучалась реакция сенсорных рецепторов костного мозга на химические вещества (Seike, 1976). Интрамедуллярное введение известных болеутоляющих веществ (хлорид калия, ацетилхолин, гистамин, серотонин и брадикинин) в полость костного мозга приводило к увеличению текущей активности всего нерва в течение нескольких минут после инъекции в концентрациях, сравнимых с теми, которые сообщались для активации мышечных ноцицепторов. Фок и Менс, 1976).Хотя сообщалось, что увеличение текущей активности и латентный ответ в значительной степени зависят от концентрации, используемой для каждого вещества, степень этих изменений количественно не оценивалась.
Термическая чувствительность
Seike (1976) попытался зарегистрировать активность всего нерва в ответ на изменения температуры в полости костного мозга после снижения кровотока, вызванного перевязкой бедренной артерии или применением сосудосуживающих средств. В более ранних работах сообщалось, что эти манипуляции вызывают снижение температуры костномозговой полости (Yamada, Yoshino, 1977).Частота разрядов в записи всего нерва увеличивалась в течение 5 минут после лигатуры, а затем постепенно снижалась до контрольного уровня в течение следующих 15 минут. Несмотря на небольшое снижение температуры через 5 минут, изменение температуры в последующие 15 минут, по-видимому, плохо коррелировало с частотой разрядов. Внутрикостное введение адреналина и норадреналина (вазоконстрикторы) также увеличивало скорость разряда целого нерва. Оба вещества вызывали более значительное понижение температуры в полости костного мозга и большее изменение скорости разряда всего нерва, чем при перевязке бедренной артерии.Как и в случае с перевязкой бедренной артерии, связь между изменением температуры и скоростью разряда после начального периода активации не была ясна. Хотя кажется правдоподобным, что температурные изменения способствуют повышению активности всего нерва, гипоксия также может способствовать реакции. Артериальная окклюзия приводит к тяжелой гипоксии и увеличению воспалительных и/или других химических медиаторов (Paterson et al., 1988). Действительно, было показано, что некоторые медиаторы воспаления изменяют активность всего нерва при воздействии непосредственно на костный мозг (см. выше).Таким образом, изменение температуры в этом исследовании, возможно, не было тем стимулом, который фактически вызывал изменение активности всего нерва, о котором сообщил Seike (1976).
Резюме/выводы
На рисунке обобщены наши знания о физиологии сенсорных нейронов, иннервирующих костный мозг. В отличие от надкостницы мало что известно об активности афферентных нейронов в полости костного мозга. Хотя сообщалось об активности всего нерва после механической, химической и, возможно, термической стимуляции полости костного мозга, реакция отдельных единиц не исследовалась.Таким образом, неясно, реагируют ли и как отдельные нейроны, иннервирующие полость костного мозга, на механические, химические или термические стимулы, или же они реагируют на множественные типы стимулов, как в случае с полимодальными ноцицепторами в других тканевых системах. Также неизвестно, могут ли они быть сенсибилизированы медиаторами воспаления или другими химическими раздражителями.
Активность всего нерва после механической, химической и термической стимуляции костного мозга . Активность всего нерва увеличивается в ответ на механическую стимуляцию за счет увеличения внутрикостного давления.Химическая стимуляция дозозависимо увеличивает активность всего нерва. Изменения температуры, вызванные снижением кровотока, по-видимому, влияют на активность всего нерва, но это может быть связано с другими факторами, связанными с нарушением кровоснабжения костного мозга (например, ишемией). Отдельные единицы не тестировались на реакцию на стимуляцию костного мозга.
Физиология центральных проводящих путей, кодирующих информацию о боли в костях
Спинной мозг
Лишь в нескольких исследованиях на животных была предпринята попытка задокументировать физиологию спинномозговых нейронов, участвующих в ноцицепции костей.Большинство из них основывались на исследованиях зависимой от активности экспрессии Fos. Fos представляет собой белок, который продуцируется в ядре клеток после экспрессии гена c-fos немедленного начала (Coggeshall, 2005), и известно, что вредные стимулы индуцируют экспрессию c-fos в нейронах, несущих этот ген. Таким образом, присутствие белка Fos, который может быть помечен иммуногистохимически, может быть использовано для определения местоположения нейронов, физиологически активированных вредными стимулами. Острая болезненная механическая стимуляция кости, применяемая путем сверления кости и повышения внутрикостного давления большеберцовой кости, вызывает увеличение экспрессии Fos в ипсилатеральном поверхностном, но не глубоком дорсальном роге спинного мозга (Ivanusic, 2008; Williams and Ivanusic, 2008). .Тот же паттерн активности наблюдался в исследованиях экспрессии Fos после острой болевой стимуляции кожной ткани (Dai et al., 2001; Jinks et al., 2002) и подразумевает, что спинальные механизмы, которые опосредуют острую боль кожного и костного происхождения, имеют общие некоторые общие черты. Данные указывают на то, что поверхностные задние рога спинного мозга представляют интерес в исследованиях острой боли в костях, но неизвестно, отличается ли этот паттерн экспрессии Fos при воспалительном стимуле.Действительно, когда воспалительные агенты воздействуют на другие тканевые системы (такие как кожа), картина смещается таким образом, что наиболее активными становятся глубокие задние рога (Coggeshall, 2005). В животных моделях боли, вызванной раком костей, и боли при переломах скелета, экспрессия Fos увеличена как в глубоких, так и в поверхностных задних рогах, и существует значительная положительная корреляция между экспрессией Fos и разрушением кости (Schwei et al. , 1999; Хименес-Андраде и др., 2007). Интересно, что увеличение Fos наблюдалось в поверхностных дорсальных рогах в этих исследованиях только после того, как обычно безвредные стимулы доставлялись к бедренной кости путем легкой механической стимуляции (пальпация).У нормальных животных для индукции экспрессии c-Fos в поверхностных дорсальных нейронах требуется болезненная кожная стимуляция (Hunt et al., 1987; Abbadie and Besson, 1993; Abbadie et al., 1994; Honore et al., 1995; Doyle and Хант, 1999). Это говорит о том, что сенсибилизация спинномозговых нейронов происходит при боли, вызванной раком кости, и боли при переломах.
Восходящие пути
Williams и Ivanusic (2008) использовали экспрессию Fos в сочетании с ретроградным отслеживанием для идентификации восходящих мишеней нейронов задних рогов, активируемых вредной механической стимуляцией, осуществляемой при сверлении кости.Они сообщили о вовлечении спинопарабрахиального пути, но не спиноталамического тракта или постсинаптического дорсального столба в этой модели острой костной ноцицепции. Этот паттерн активации отличается от наблюдаемого после острой болезненной механической стимуляции кожных и висцеральных тканей (Palecek et al., 2003). Нейроны спинопарабрахиальной проекции происходят преимущественно из пластинки I спинного рога спинного мозга и проецируются в основном в контралатеральное латеральное парабрахиальное ядро (Kitamura et al., 1993; Гаурио и Бернар, 2002 г.; Альмарестани и др., 2007). Латеральное парабрахиальное ядро связано с несколькими областями мозга, участвующими в аффективно-мотивационных аспектах ноцицептивной обработки и гомеостатическими реакциями на ноцицептивные стимулы, включая миндалевидное тело, ядро солитарного тракта, вентролатеральный продолговатый мозг, околоводопроводное серое вещество, медиальный таламус и гипоталамус (Bianchi). и др., 1998; Альмарестани и др., 2007). Это усиливает связь, соответствующую сильному аффективному компоненту боли в костях.Хотя Уильямс и Иванусик не представили доказательств участия ни спиноталамического тракта, ни постсинаптических путей дорсального столба в ноцицепции кости, они не могли исключить возможность того, что эти пути могут быть вовлечены в модели животных, характеризующихся воспалительным или хроническим раком. индуцированная боль. Как отмечалось выше, модели такого типа характеризуются большей экспрессией Fos в клетках глубокого дорсального рога и, следовательно, с большей вероятностью проецируются через спиноталамический тракт или постсинаптические пути дорсального столба, поскольку большинство клеток этих путей происходит из глубокий задний рог поясничного отдела спинного мозга крысы.
Кора
Понимание физиологии корковых нейронов, активируемых вредными раздражителями, важно, поскольку кора играет решающую роль в восприятии боли. Только одно исследование показало активность коры, связанную со стимуляцией костных афферентных нейронов (Ivanusic et al., 2009). Они показали, что сенсорная информация от кости достигает дискриминационных областей соматосенсорной коры путем электрической стимуляции нерва плечевой кости кошки и регистрации вызванных потенциалов на поверхности первичной (SI) и вторичной (SII) соматосенсорной коры.Важно отметить, что нерв, идущий к кошачьей плечевой кости, содержит только миелинизированные и немиелинизированные нервные волокна малого диаметра, распределение по размерам (Ivanusic et al., 2006) и скорость проведения (Mahns et al., 2006) которых соответствуют волокнам Aδ и C. классификации и, следовательно, роль в ноцицепции. Корковые ответы, вызванные стимуляцией Aδ в других типах тканей, имеют относительно короткую латентность (в пределах 50 мс) и, как полагают, отражают механизмы, связанные с быстрой, острой болью, в то время как корковые ответы, вызванные стимуляцией С-волокон, имеют более длительный латентный период (50–300 мс). ) и, как полагают, отражают механизмы, связанные с медленной жгучей болью (Bromm and Treede, 1984; Willis, 1985).Интересно, что латентный период (6–11 мс) до начала корковых ответов SI и SII при стимуляции нерва плечевой кости кошки согласуется с активацией волокон Aδ в периферическом нерве и может отражать механизм быстрого, резкого, и четко локализованная боль в костях, которая обычно ощущается при периостальной стимуляции или при прорывной боли, связанной с раком кости. Увеличивая интенсивность электрической стимуляции, авторы смогли продемонстрировать более сильную корковую активацию, подразумевая, что нейроны в SI и SII способны кодировать интенсивность стимулов, воздействующих на кость.Они предположили, что небольшие стрессовые переломы вряд ли вызовут сильную боль, поскольку интенсивность кортикальной активности может быть недостаточной, в то время как большие переломы или метастазы, скорее всего, вызовут сильную боль. Этот механизм кодирования интенсивности вредных раздражителей хорошо задокументирован в исследованиях кожной системы на животных (Kenshalo et al., 1988, 2000; Chudler et al., 1990), а результаты исследований функциональной визуализации показывают, что он также вероятно применимо к людям (Porro et al., 1998; Когхилл и др., 1999). Однако исследователям не удалось обнаружить длительные латентные корковые реакции (50–300 мс), которые соответствовали бы активации С-волокон в нерве, ведущем к кошачьей плечевой кости. Хотя они предоставили доказательства того, что это может быть связано с торможением корковой реактивности после первоначального ответа Aδ, они не могли исключить возможность того, что проекции С-волокон на SI и SII слишком распространены, чтобы генерировать фокальные вызванные потенциалы того типа, который они могли бы регистрировать. , или что С-волокно, входящее от нерва в кошачью плечевую кость, вообще не достигает SI и SII.Также возможно, что вход С-волокна вместо этого проецируется на другие области коры, такие как островок, или подкорковые области, включая миндалину, ядро солитарного тракта, вентролатеральный мозг, периакведуктальный серый цвет, таламус и гипоталамус, которые, как сообщается, иметь важное значение в аффективных, эмоциональных аспектах боли.
Патофизиологические изменения в животных моделях боли в костях
Ряд животных моделей патологии костей был разработан и используется для изучения патофизиологических и нейрохимических изменений как в периферических, так и в центральных нейронах, которые способствуют боли в костях.Наиболее распространенной используемой моделью является модель боли, вызванной раком кости, которая обычно включает инокуляцию бедренной или большеберцовой кости грызунов опухолевыми клетками (Schwei et al., 1999; Medhurst et al., 2002), но модели боли, вызванной переломом кости также распространены (Freeman et al., 2008; Minville et al., 2008).
Некоторые провоспалительные цитокины (IL-1β, TNFα, IL-6 и TGFβ) и медиаторы воспаления (CGRP) повышаются в DRG в ответ на рак костей и переломы (Kon et al., 2001; Cho et al. ., 2002; Канг и др., 2005 г.; Рандл и др., 2006; Баамонде и др., 2007 г.; Гейс и др., 2010; Фанг и др., 2015 г.; Хансен и др., 2016). У животных с болью, вызванной раком костей, также повышена экспрессия DRG нескольких мембранных рецепторов/каналов (TRPV1, P2X3, ASIC1a/1b, Nav 1.8 и Nav 1.9), которые, как известно, участвуют в передаче ноцицептивных стимулов и/ или в возбудимости ноцицепторов (Nagae et al., 2007; Niiyama et al., 2007; Han et al., 2012; Qiu et al., 2012; Liu et al., 2013; Ли и др., 2014). Введение селективных антагонистов или антисмысловых олигодезоксинуклеотидов против некоторых из этих каналов/рецепторов ослабляет болевые ощущения у животных с болью при раке кости, еще больше усиливая роль этих молекул при боли в костях (Ghilardi et al., 2005; Gonzalez-Rodriguez et al. , 2009; Каан и др., 2010; Мяо и др., 2010). В других тканевых системах медиаторы воспаления сенсибилизируют периферические ноцицепторы, и, вероятно, участвуют изменения в мембранных рецепторах/каналах (Kidd and Urban, 2001).Однако нет доказательств того, что какой-либо из этих медиаторов воспаления непосредственно активирует или повышает чувствительность костных ноцицепторов или что изменения в экспрессии различных ионных каналов и рецепторов изменяют физиологию или функцию костных афферентных нейронов. Кроме того, изменения, наблюдаемые в DRG, не были локализованы в сенсорных нейронах, иннервирующих кость; экспрессию белка анализировали с использованием Вестерн-блоттинга целых лизатов DRG или количественно определяли с помощью иммуногистохимии, выполненной без ретроградного мечения, чтобы подтвердить, что нейроны DRG иннервируют кость.Таким образом, прямых доказательств роли ионных каналов, рецепторов и медиаторов воспаления в модулировании активности периферических костных афферентных нейронов и в регуляции боли при костной патологии до сих пор нет.
Некоторые прямые доказательства сенсибилизации периферических ноцицепторов при боли, вызванной раком кости, были предоставлены Cain (Cain et al., 2001) и Uhelski (Uhelski et al., 2013). Они сообщили о повышении спонтанной активности и снижении теплового (но не механического) порога в регистрируемых на периферии афферентных волокнах С у животных, у которых развилась поведенческая чувствительность в ответ на инъекцию опухолевых клеток в пяточную кость и вокруг нее, но не у контрольных животных.Однако в обоих этих исследованиях опухолевые клетки не были четко ограничены костью, а зарегистрированные С-волокна были кожными афферентными, поэтому сенсибилизация происходила не с костными афферентными нейронами, а скорее с кожными афферентными нейронами, иннервирующими окружающую кожу. Эти исследования более важны для понимания вторичной или отраженной боли, связанной с костной патологией, чем боли, воспринимаемой при стимуляции самой кости.
В ряде исследований также сообщалось об изменениях в центральной нервной системе, вызванных патологией костей.Повышенная экспрессия спинального SP, CGRP и других медиаторов воспаления (TNF, IL-1, IL-6, CCL2 и фактора роста нервов) наблюдается в спинном мозге крыс с болью, вызванной переломами и раком кости (Zhao и др., 2013; Ши и др., 2015). Рак кости вызывает гипертрофию астроцитов в спинном мозге и повышение экспрессии прогипералгетического пептида динорфина и c-Fos в нейронах второго порядка глубоких дорсальных рогов (Schwei et al., 1999; Honore et al., 2000b; Shen). и другие., 2014). Рак кости также вызывает изменения свойств физиологического ответа нейронов второго порядка в задних рогах спинного мозга. В поверхностных дорсальных рогах животных с раком кости наблюдается усиление спинальной синаптической передачи, более высокая доля клеток с широким динамическим диапазоном и увеличенные размеры рецептивного поля в клетках с широким динамическим диапазоном (Urch et al., 2003; Donovan-Rodriguez et al. ., 2004; Янагисава и др., 2010). Вместе эти изменения приводят к более возбудимому спинному мозгу. Они типичны для центральной сенсибилизации и могут лежать в основе развития хронической боли в костях.
Заключительные выводы
Во многих исследованиях сообщалось о существовании сенсорных нейронов, иннервирующих надкостницу и полость костного мозга, и стало ясно, что большинство из них имеют морфологию и молекулярный фенотип, соответствующие роли в ноцицепции. Однако о физиологии этих нейронов известно очень мало. Надкостнице уделялось больше внимания по сравнению с костным мозгом, что отражает более легкий доступ к надкостнице для экспериментальной оценки, чем к полости костного мозга.Электрофизиологические записи сенсорных нейронов как в надкостнице, так и в костном мозге подтвердили, что они оба содержат ноцицепторы, которые, вероятно, обеспечивают ЦНС информацией о боли в костях. Надкостница (но не костный мозг) также иннервируется нейронами, обладающими свойствами, предполагающими, что они могут быть рецепторами растяжения или придавать безвредную чувствительность, хотя неясно, имеет ли последнее отношение к стимулам, воздействующим на кость. Имеются лишь ограниченные доказательства того, что афферентные нейроны периферических костей могут быть сенсибилизированы или что они могут быть активированы несколькими типами стимулов, и в настоящее время это существует только частично для периостальных единиц.Очевидно, что в центральной нервной системе нейроны задних рогов спинного мозга могут активироваться вредными стимулами, воздействующими на кость. Некоторые из них могут быть сенсибилизированы при патологических состояниях и могут способствовать вторичной гипералгезии или отраженной боли, связанной с костной патологией. Существует лишь несколько исследований восходящих путей и задействованных корковых территорий. Хотя они дают некоторые подсказки относительно того, как информация о боли в костях централизованно кодируется, их необходимо расширить, чтобы углубить наше понимание других задействованных центральных областей.Нам предстоит еще многое узнать о физиологии костных афферентных нейронов и их центральных проекций, прежде чем мы приблизимся к пониманию того, как мы думаем о боли в костях и справляемся с ней.
Вклад авторов
SN и JI внесли свой интеллектуальный вклад в разработку этого обзора, включая составление проекта и редактирование рукописи. Оба одобрили окончательную версию для публикации.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
- Аббади С., Бессон Дж. М. (1993). Экспрессия C-fos в поясничном отделе спинного мозга крыс после периферической стимуляции у крыс с артритом, индуцированным адъювантом, и у нормальных крыс. Мозг Res.
607, 195–204. 10.1016/0006-8993(93)
-O [PubMed] [CrossRef] [Google Scholar]
- Аббади К., Оноре П., Бессон Дж. М. (1994). Интенсивная холодовая вредная стимуляция задней лапы крыс индуцирует экспрессию c-fos в нейронах поясничного отдела спинного мозга. неврология 59, 457–468. 10.1016/0306-4522(94)-2 [PubMed] [CrossRef] [Google Scholar]
- Almarestani L., Уотерс С.М., Краузе Дж.Е., Беннетт Г.Дж., Рибейро-Да-Сильва А. (2007). Морфологическая характеристика нейронов пластинки I задних рогов спинного мозга, проецирующихся на парабрахиальное ядро крысы. Дж. Комп. Нейрол. 504, 287–297. 10.1002/cne.21410 [PubMed] [CrossRef] [Google Scholar]
- Arnoldi CC (1990). Внутрикостные нагрубание-болевые синдромы. Патомеханизм боли, Bone Circulation and Bone Necrosis, eds Arlet J., Mazières B. (Berlin; Heidelberg: Springer;), 253–259. 10.1007/978-3-642-73644-5_52 [CrossRef] [Google Scholar]
- Арнольди С.К., Джурхуус Дж. К., Хеерфордт Дж., Карле А. (1980). Внутрикостная флебография, измерение внутрикостного давления и 99m ТС-полифосфатсцинтиграфия у больных с различными болезненными состояниями в тазобедренном и коленном суставах. Акта Ортоп. Сканд. 51, 19–28. 10.3109/174536780089
- [PubMed] [CrossRef] [Google Scholar]
- Асо К., Икеучи М., Изуми М., Сугимура Н., Като Т., Усида Т. и др. . (2014). Ноцицептивный фенотип нейронов ганглиев задних корешков, иннервирующих субхондральную кость в коленных суставах крыс.Евро. Дж. Пейн 18, 174–181. 10.1002/j.1532-2149.2013.00360.x [PubMed] [CrossRef] [Google Scholar]
- Баамонде А., Курто-Рейес В., Хуарес Л., Меана А., Идальго А., Менендес Л. (2007 г. ). Антигипералгезические эффекты, вызванные антагонистом рецептора IL-1 анакинрой, и повышение уровня IL-1бета у воспаленных мышей и мышей с остеосаркомой. Жизнь наук. 81, 673–682. 10.1016/j.lfs.2007.07.003 [PubMed] [CrossRef] [Google Scholar]
- Бьянки Р., Корсетти Г., Роделла Л., Тредичи Г., Джоя М. (1998).Супраспинальные соединения и паттерны окончания парабрахиального комплекса, определенные методом отслеживания биоцитинового антероградного тракта у крысы. Дж. Анат. 193 (часть 3), 417–430. 10.1046/j.1469-7580.1998.19330417.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бьюрхольм А., Крейкбергс А., Бродин Э., Шульцберг М. (1988). Вещество P- и CGRP-иммунореактивные нервы в кости. пептиды 9, 165–171. 10.1016/0196-9781(88)-X [PubMed] [CrossRef] [Google Scholar]
- Bove S.E., Flatters S.J., Inglis J.J., Mantyh P.W. (2009). Новые достижения в лечении скелетно-мышечной боли. Мозг Res. преп. 60, 187–201. 10.1016/j.brainresrev.2008.12.012 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Брюсова С. С., Лебеденко В. В. (1930). Zur Schmerzleitungsfähigkeit der Gefäße. Z. Gesamte Exp. Мед. 69, 29–40. 10.1007/BF02622549 [CrossRef] [Google Scholar]
- Bromm B., Treede RD (1984). Разряды нервных волокон, церебральные потенциалы и ощущения, вызванные стимуляцией лазером CO2.Гум. Нейробиол. 3, 33–40. [PubMed] [Google Scholar]
- Burgess PR, Perl ER (1967). Миелиновые афферентные волокна специфически реагируют на вредное раздражение кожи. Дж. Физиол. (Лонд). 190, 541–562. 10.1113/jphysiol.1967.sp008227 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Burgess PR, Perl ER (1973). Кожные механорецепторы и ноцицепторы, в Handbook of Sensory Physiology, Vol. II, изд. Игго А. (Нью-Йорк, штат Нью-Йорк: Springer-Verlag;), 29–78. [Google Scholar]
- Берджесс П.Р., Пети Д., Уоррен Р. М. (1968). Типы рецепторов волосистой кожи кошек снабжены миелинизированными волокнами. Дж. Нейрофизиол. 31, 833–848. [PubMed] [Google Scholar]
- Каин Д. М., Вачник П. В., Эйкмайер Л., Бейтц А., Уилкокс Г. Л., Симона Д. А. (2001). Функциональные взаимодействия между опухолью и периферическим нервом в модели онкологической боли у мышей. Боль Мед. 2, 15–23. 10.1046/j.1526-4637.2001.002001015.x [PubMed] [CrossRef] [Google Scholar]
- Calvo W. (1968). Иннервация костного мозга лабораторных животных.Являюсь. Дж. Анат. 123, 315–328. 10.1002/aja.1001230206 [PubMed] [CrossRef] [Google Scholar]
- Карр Р. В., Пианова С., Фернандес Дж., Фэллон Дж. Б., Бельмонте К., Брок Дж. А. (2003). Влияние нагревания и охлаждения на импульсы нервных окончаний, регистрируемые холодочувствительными рецепторами роговицы морской свинки. J. Gen. Physiol. 121, 427–439. 10.1085/jgp.200308814 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Castaneda-Corral G., Jimenez-Andrade J.M., Bloom A.P., Taylor R.N., Mantyh W.Г., Качмарска М.Дж. и соавт. . (2011). Большинство миелинизированных и немиелинизированных чувствительных нервных волокон, иннервирующих кость, экспрессируют киназу рецептора тропомиозина А. Неврология 178, 196–207. 10.1016/j.neuroscience.2011.01.039 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Серверо Ф., Лэрд Дж. М. (1999). Висцеральная боль. Ланцет 353, 2145–2148. 10.1016/S0140-6736(99)01306-9 [PubMed] [CrossRef] [Google Scholar]
- Чо Т.Дж., Герстенфельд Л.С., Эйнхорн Т.А. (2002). Дифференциальная временная экспрессия членов суперсемейства трансформирующих факторов роста бета во время заживления переломов у мышей.Дж. Боун Шахтер. Рез. 17, 513–520. 10.1359/jbmr.2002.17.3.513 [PubMed] [CrossRef] [Google Scholar]
- Chrastil J., Sampson C., Jones K.B., Higgins T.F. (2013). Послеоперационное введение опиоидов ингибирует заживление костей на животных моделях. клин. Ортоп. Относ. Рез. 471, 4076–4081. 10.1007/s11999-013-3232-z [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Чудлер Э. Х., Антон Ф., Дубнер Р., Кеншало Д. Р., мл. (1990). Ответы ноцицептивных нейронов SI у обезьян и болевые ощущения у людей, вызванные вредной тепловой стимуляцией: влияние межстимульного интервала.Дж. Нейрофизиол. 63, 559–569. [PubMed] [Google Scholar]
- Coggeshall RE (2005). Fos, ноцицепция и задний рог. Прог Нейробиол 77, 299–352. 10.1016/j.pneurobio.2005.11.002 [PubMed] [CrossRef] [Google Scholar]
- Когхилл Р. К., Санг С. Н., Майсог Дж. М., Ядарола М. Дж. (1999). Обработка интенсивности боли в человеческом мозгу: двусторонний распределенный механизм. Дж. Нейрофизиол. 82, 1934–1943. [PubMed] [Google Scholar]
- Купер Р. Р., Милграм Дж. В., Робинсон Р.А. (1966). Морфология остеона. Электронно-микроскопическое исследование. J. Хирургия суставов костей. Являюсь. 48, 1239–1271. [PubMed] [Google Scholar]
- Дай Ю., Ивата К., Кондо Э., Моримото Т., Ногучи К. (2001). Избирательное увеличение экспрессии Fos в нейронах спинного мозга после постепенной термической стимуляции у крыс с экспериментальной мононевропатией. Боль 90, 287–296. 10.1016/S0304-3959(00)00411-5 [PubMed] [CrossRef] [Google Scholar]
- Де Кастро Ф. (1925). Техника для окрашивания системы нервов, которая лучше всего подходит для кожи.Траб. лаборатория биол. ун-т Мадрид 23, 427–447. [Google Scholar]
- Диксон А. Д. (1963). Ультраструктура нервных волокон в тройничном узле крысы. Дж. Ультраструктур. Рез. 8, 107–121. 10.1016/S0022-5320(63)80023-4 [PubMed] [CrossRef] [Google Scholar]
- Джухри Л., Лоусон С. Н. (2004). Ноцицептивные первичные афферентные нейроны A-волокна: обзор частоты и свойств по отношению к другим афферентным нейронам A-волокна у млекопитающих. Мозг Res. Мозг Res. преп. 46, 131–145. 10.1016/j.brainresrev.2004.07.015 [PubMed] [CrossRef] [Google Scholar]
- Донован-Родригес Т., Дикенсон А. Х., Урч С. Е. (2004). Реакции нейронов поверхностных дорсальных рогов и появление поведенческой гипералгезии в крысиной модели боли в костях, вызванной раком. Неврологи. лат. 360, 29–32. 10.1016/j.neulet.2004.01.048 [PubMed] [CrossRef] [Google Scholar]
- Doyle CA, Hunt SP (1999). Нейроны, экспрессирующие рецептор вещества P (нейрокинин-1), в пластинке I спинного мозга кодируют интенсивность вредной стимуляции: исследование c-Fos на крысах.неврология 89, 17–28. 10.1016/S0306-4522(98)00276-0 [PubMed] [CrossRef] [Google Scholar]
- Дункан С. П., Шим С. С. (1977). Ж. Эдуард Самсон Адрес: вегетативная иннервация кости. Экспериментальное исследование внутрикостного адренергического сосудистого нерва у кролика. J. Хирургия суставов костей. бр. 59, 323–330. [PubMed] [Google Scholar]
- Fang D., Kong L.Y., Cai J., Li S., Liu X.D., Han J.S., et al. . (2015). Опосредованная интерлейкином-6 функциональная активация рецепторов TRPV1 в нейронах ганглиев задних корешков посредством активации сигнального пути JAK/PI3K: роль в развитии боли при раке кости на модели крыс.Боль 156, 1124–1144. 10.1097/j.pain.0000000000000158 [PubMed] [CrossRef] [Google Scholar]
- Фок С., Менсе С. (1976). Возбуждающие эффекты 5-гидрокситриптамина, гистамина и ионов калия на афферентные единицы мышечной группы IV: сравнение с брадикинином. Мозг Res.
105, 459–469. 10.1016/0006-8993(76)
-X [PubMed] [CrossRef] [Google Scholar]
- Freeman K.T., Koewler N.J., Jimenez-Andrade J.M., Buus R.J., Herrera M.B., Martin C.D., et al. . (2008). Модель боли при переломе у крысы: адаптация модели закрытого перелома бедренной кости для изучения скелетной боли.Анестезиология 108, 473–483. 10.1097/ALN.0b013e3181649351 [PubMed] [CrossRef] [Google Scholar]
- Furusawa S. (1970). Нейрофизиологическое исследование чувствительности костного мозга. Ниппон Сейкейгека Гаккай Засси 44, 365–370. [PubMed] [Google Scholar]
- Гайда М., Литвин Дж. А., Адриансен Д., Тиммерманс Дж. П., Чихоцкий Т. (2004). Сегментарное распределение и морфометрические особенности первичных сенсорных нейронов, проецирующихся на надкостницу большеберцовой кости у крыс. Фолиа гистохим. Цитобиол.42, 95–99. 10.5603/4656 [PubMed] [CrossRef] [Google Scholar]
- Gauriau C., Bernard JF (2002). Пути боли и парабрахиальные цепи у крысы. Эксп. Физиол. 87, 251–258. 10.1113/eph8702357 [PubMed] [CrossRef] [Google Scholar]
- Geis C., Graulich M., Wissmann A., Hagenacker T., Thomale J., Sommer C., et al. . (2010). Вызванное болевое поведение и активация спинальной глии зависят от рецептора фактора некроза опухоли 1 и 2 в мышиной модели боли при раке кости. неврология 169, 463–474.10.1016/j.neuroscience.2010.04.022 [PubMed] [CrossRef] [Google Scholar]
- Ghilardi J. R., Rohrich H., Lindsay T. H., Sevcik M. A., Schwei M. J., Kubota K., et al. . (2005). Селективная блокада рецептора капсаицина TRPV1 ослабляет боль при раке кости. Дж. Нейроски. 25, 3126–3131. 10.1523/JNEUROSCI.3815-04.2005 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Gonzalez-Rodriguez S., Pevida M., Roques BP, Fournie-Zaluski MC, Hidalgo A., Menendez L., и другие. . (2009).Участие энкефалинов в ингибировании термической гипералгезии, вызванной остеосаркомой, вызванной блокадой периферических P2X3-рецепторов. Неврологи. лат. 465, 285–289. 10.1016/j.neulet.2009.09.015 [PubMed] [CrossRef] [Google Scholar]
- Grigg P., Schaible HG, Schmidt RF (1986). Механическая чувствительность афферентов группы III и IV от заднего суставного нерва в норме и при воспалении кошачьего колена. Дж. Нейрофизиол. 55, 635–643. [PubMed] [Google Scholar]
- Гронблад М., Лиези П., Коркала О., Карахарью Э., Полак Дж. (1984). Иннервация надкостницы костей человека пептидергическими нервами. Анат. Рек. 209, 297–299. 10.1002/ar.10920
- [PubMed] [CrossRef] [Google Scholar]
- Haegerstam GA (2001). Патофизиология боли в костях: обзор. Акта Ортоп. Сканд. 72, 308–317. 10.1080/00016470152846682 [PubMed] [CrossRef] [Google Scholar]
- Halvorson K.G., Kubota K., Sevcik M.A., Lindsay T.H., Sotillo J.E., Ghilardi J.R., et al. . (2005). Блокирующие антитела к фактору роста нервов ослабляют скелетную боль, вызванную ростом клеток опухоли предстательной железы в костях.Рак Рез. 65, 9426–9435. 10.1158/0008-5472.CAN-05-0826 [PubMed] [CrossRef] [Google Scholar]
- Han Y., Li Y., Xiao X., Liu J., Meng X. L., Liu F. Y., et al. . (2012). Формальдегид активирует TRPV1 через сигнальные пути MAPK и PI3K в крысиной модели боли при раке костей. Неврологи. Бык. 28, 165–172. 10.1007/s12264-012-1211-0 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Hansen R.R., Vacca V., Pitcher T., Clark A.K., Malcangio M. (2016). Роль внеклеточного пептида, родственного гену кальцитонина, в механизмах боли в костях спинного мозга, вызванной раком.Боль 157, 666–676. 10.1097/j.pain.0000000000000416 [PubMed] [CrossRef] [Google Scholar]
- Hill E.L., Elde R. (1988). Связанные с геном кальцитонина пептид-иммунореактивные нервные волокна в надкостнице нижней челюсти крысы: свидетельство первичного афферентного происхождения. Неврологи. лат. 85, 172–178. 10.1016/0304-3940(88) -3 [PubMed] [CrossRef] [Google Scholar]
- Hill E.L., Elde R. (1991). Распределение CGRP-, VIP-, D бета H-, SP- и NPY-иммунореактивных нервов в надкостнице крысы.Сотовые Ткани Res. 264, 469–480. 10.1007/BF00319037 [PubMed] [CrossRef] [Google Scholar]
- Hohmann E.L., Elde R.P., Rysavy J.A., Einzig S., Gebhard R.L. (1986). Иннервация надкостницы и кости симпатическими вазоактивными интестинальными пептидсодержащими нервными волокнами. Наука 232, 868–871. 10.1126/science.3518059 [PubMed] [CrossRef] [Google Scholar]
- Холмс Д. (2012). Обезболивающие против NGF снова в ходу? Нац. Преподобный Друг Дисков. 11, 337–338. 10.1038/nrd3732 [PubMed] [CrossRef] [Google Scholar]
- Оноре П., Буритова Дж., Бессон Дж. М. (1995). Вызванная карагенином экспрессия c-Fos в поясничном отделе спинного мозга крыс: эффекты индометацина. Евро. Дж. Фармакол. 272, 249–259. 10.1016/0014-2999(94)00656-R [PubMed] [CrossRef] [Google Scholar]
- Оноре П., Люгер Н. М., Сабино М. А., Швей М. Дж., Роджерс С. Д., Мах Д. Б. и др. . (2000а). Остеопротегерин блокирует вызванное раком кости разрушение скелета, скелетную боль и связанную с болью нейрохимическую реорганизацию спинного мозга. Нац. Мед. 6, 521–528.10.1038/74999 [PubMed] [CrossRef] [Google Scholar]
- Оноре П., Мантых П. В. (2000). Боль при раке костей: от механизма к модели и терапии. Боль Мед. 1, 303–309. 10.1046/j.1526-4637.2000.00047.x [PubMed] [CrossRef] [Google Scholar]
- Оноре П., Роджерс С. Д., Швей М. Дж., Салак-Джонсон Дж. Л., Люгер Н. М., Сабино М. С. и др. . (2000б). Каждая мышиная модель воспалительной, невропатической и раковой боли генерирует уникальный набор нейрохимических изменений в спинном мозге и сенсорных нейронах.неврология 98, 585–598. 10.1016/S0306-4522(00)00110-X [PubMed] [CrossRef] [Google Scholar]
- Хант С. П., Пини А., Эван Г. (1987). Индукция c-fos-подобного белка в нейронах спинного мозга после сенсорной стимуляции. Природа 328, 632–634. 10.1038/328632a0 [PubMed] [CrossRef] [Google Scholar]
- Hurrell D. (1937). Иннервация кости. Дж. Анат. 72, 54–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Inman V., Saunders J. (1944). Отраженная боль от скелетных структур.Дж. Нерв. Мент. Дис. 99, 660–667. 10.1097/00005053-194405000-00023 [CrossRef] [Google Scholar]
- Ivanusic J. (2009). Размер, нейрохимия и сегментарное распределение сенсорных нейронов, иннервирующих большеберцовую кость крысы. Дж. Комп. Нейрол. 517, 276–283. 10.1002/cne.22160 [PubMed] [CrossRef] [Google Scholar]
- Ivanusic JJ (2008). Паттерн экспрессии Fos в спинном дорсальном роге после острой вредной механической стимуляции кости. Евро. Дж. Пейн 12, 895–899. 10.1016/j.ejpain.2007.12.017 [PubMed] [CrossRef] [Google Scholar]
- Иванушич Дж. Дж., Манс Д. А., Сахай В., Роу М. Дж. (2006). Отсутствие чувствительных волокон большого диаметра в нерве кошачьей плечевой кости. Дж. Анат. 208, 251–255. 10.1111/j.1469-7580.2006.00519.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Ivanusic JJ, Sahai V., Mahns DA (2009). Корковое представление сенсорных сигналов, исходящих от кости. Мозг Res. 1269, 47–53. 10.1016/j.brainres.2009.03.001 [PubMed] [CrossRef] [Google Scholar]
- Хименес-Андраде Дж.M., Mantyh W.G., Bloom A.P., Xu H., Ferng A.S., Dussor G., et al. . (2010). Фенотипически ограниченный набор первичных афферентных нервных волокон иннервирует кость по сравнению с кожей: терапевтическая возможность для лечения скелетной боли. Кость 46, 306–313. 10.1016/j.bone.2009.09.013 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Jimenez-Andrade JM, Martin C.D., Koewler N.J., Freeman K.T., Sullivan L.J., Halvorson K.G., et al. . (2007). Секвестрирующая терапия фактором роста нервов ослабляет незлокачественную скелетную боль после перелома.Боль 133, 183–196. 10.1016/j.pain.2007.06.016 [PubMed] [CrossRef] [Google Scholar]
- Джинкс С.Л., Саймонс С.Т., Десирье Дж.М., Карстенс М.И., Антонини Дж.Ф., Карстенс Э. (2002). Индукция C-fos в поверхностных спинных рогах крыс после нанесения на кожу вредных химических или механических раздражителей. Эксп. Мозг Res. 145, 261–269. 10.1007/s00221-002-1128-3 [PubMed] [CrossRef] [Google Scholar]
- Каан Т. К., Ип П. К., Патель С., Дэвис М., Маршан Ф., Кокейн Д. А. и др.. (2010). Системная блокада рецепторов P2X3 и P2X2/3 ослабляет болевые ощущения при раке костей у крыс. Головной мозг 133, 2549–2564. 10.1093/brain/awq194 [PubMed] [CrossRef] [Google Scholar]
- Кан Ю., Хе В., Талли С., Гупта Г. П., Серганова И., Чен С. Р. и др. . (2005). Метастазирование рака молочной железы в кости, опосредованное опухолевым супрессорным путем smad. проц. Натл. акад. науч. США. 102, 13909–13914. 10.1073/pnas.0506517102 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Kenshalo D.Р., младший, Чудлер Э. Х., Антон Ф., Дубнер Р. (1988). Ноцицептивные нейроны SI участвуют в процессе кодирования, с помощью которого обезьяны воспринимают интенсивность вредной тепловой стимуляции. Мозг Res. 454, 378–382. 10.1016/0006-8993(88) -4 [PubMed] [CrossRef] [Google Scholar]
- Кеншало Д. Р., Ивата К., Шолас М., Томас Д. А. (2000). Свойства реакции и организация ноцицептивных нейронов в области 1 первичной соматосенсорной коры обезьяны. Дж. Нейрофизиол. 84, 719–729. [PubMed] [Google Scholar]
- Кидд Б.Л., Урбан Л.А. (2001). Механизмы воспалительной боли. бр. Дж. Анаст. 87, 3–11. 10.1093/bja/87.1.3 [PubMed] [CrossRef] [Google Scholar]
- Китамура Т., Ямада Дж., Сато Х., Ямасита К. (1993). Клетки происхождения спинопарабрахиальных волокон у крыс: исследование с быстрым синим и WGA-HRP. Дж. Комп. Нейрол. 328, 449–461. 10.1002/cne.
- 0310 [PubMed] [CrossRef] [Google Scholar]
- Koewler N.J., Freeman K.T., Buus R.J., Herrera M.B., Jimenez-Andrade J.M., Ghilardi J.R., et al.. (2007). Влияние моноклонального антитела против фактора роста нервов на скелетную боль и заживление кости после перелома бедренной кости мыши C57BL/6J. Дж. Боун Шахтер. Рез. 22, 1732–1742 гг. 10.1359/jbmr.070711 [PubMed] [CrossRef] [Google Scholar]
- Koltzenburg M., Stucky C.L., Lewin G.R. (1997). Рецептивные свойства сенсорных нейронов мыши, иннервирующих волосистую кожу. Дж. Нейрофизиол. 78, 1841–1850 гг. [PubMed] [Google Scholar]
- Кон Т., Чо Т. Дж., Айзава Т., Ямадзаки М., Нух Н., Грейвс Д. и др. . (2001). Экспрессия остеопротегерина, активатора рецептора лиганда NF-kappaB (лиганд остеопротегерина) и родственных провоспалительных цитокинов при заживлении переломов. Дж. Боун Шахтер. Рез. 16, 1004–1014. 10.1359/jbmr.2001.16.6.1004 [PubMed] [CrossRef] [Google Scholar]
- Kyloh M., Spencer NJ (2014). Новый метод антеградной трассировки нейронов для выборочной маркировки афферентных нервных окончаний спинного мозга, которые кодируют вредные и безвредные стимулы во внутренних органах. Нейрогастроэнтерол.Мотиль. 26, 440–444. 10.1111/nmo.12266 [PubMed] [CrossRef] [Google Scholar]
- Lawson S.N., Waddell P.J. (1991). Сома нейрофиламент иммунореактивность связана с размером клеток и скоростью проводимости волокна в первичных сенсорных нейронах крысы. Дж. Физиол. (Лонд). 435, 41–63. 10.1113 / JPhysiol.1991.SP018497 [PMC Свободная статья] [PUBMED] [Crossref] [Google Scholar]
- Lemperg R. K., Арнольди С. С. (1978). Значение внутрикостного давления в норме и при патологии с особым упором на внутрикостное нагрубание-болевой синдром.клин. Ортоп. Относ. Рез. 136, 143–156. [PubMed] [Google Scholar]
- Li Y., Cai J., Han Y., Xiao X., Meng X.L., Su L. и др. . (2014). Улучшенная функция TRPV1 посредством повышающей регуляции инсулиноподобным фактором роста-1 в крысиной модели боли при раке кости. Евро. Дж. Пейн 18, 774–784. 10.1002/j.1532-2149.2013.00420.x [PubMed] [CrossRef] [Google Scholar]
- Liu M., Yang H., Fang D., Yang J.J., Cai J., Wan Y., et al. . (2013). Повышенная регуляция рецепторов P2X3 нейронным кальциевым сенсорным белком VILIP-1 в ганглиях задних корешков способствует боли при раке кости у крыс.Боль 154, 1551–1568. 10.1016/j.pain.2013.04.022 [PubMed] [CrossRef] [Google Scholar]
- Mach D.B., Rogers S.D., Sabino M.C., Luger N.M., Schwei M.J., Pomonis J.D., et al. . (2002). Происхождение скелетной боли: сенсорная и симпатическая иннервация бедренной кости мыши. неврология 113, 155–166. 10.1016/S0306-4522(02)00165-3 [PubMed] [CrossRef] [Google Scholar]
- Mahns D. A., Ivanusic J. J., Sahai V., Rowe M. J. (2006). Интактный препарат периферического нерва для мониторинга активности одиночных периостальных афферентных нервных волокон.Дж. Нейроски. Методы 156, 140–144. 10.1016/j.jneumeth.2006.02.019 [PubMed] [CrossRef] [Google Scholar]
- Mahns D., Sahai V., Ivanusic J., Tracey D., Rowe M. (2004). Препарат периферического нерва для изучения характеристик реакции отдельных чувствительных нервных волокон периостального происхождения. проц. Ауст. Здоровье Мед. Рез. Конг. Абстр. 1423, 304. [Google Scholar]
- Mantyh P. W. (2014). Нейробиология скелетной боли. Евро. Дж. Нейроски. 39, 508–519. 10.1111/ejn.12462 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Mantyh P.В., Хант С.П. (2004). Механизмы, которые вызывают и поддерживают боль при раке кости. Novartis обнаружила Symp. 260, 221–238; обсуждение 238–240, 277–229. 10.1002/0470867639.ch25 [PubMed] [CrossRef] [Google Scholar]
- Martin C.D., Jimenez-Andrade JM, Ghilardi JR, Mantyh P.W. (2007). Организация уникальной сетчатой сети сенсорных волокон CGRP+ в надкостнице мышей: значение для возникновения и поддержания боли при переломах костей. Неврологи. лат. 427, 148–152. 10.1016/j.neulet.2007.08.055 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Medhurst S.J., Walker K., Bowes M., Kidd B.L., Glatt M., Muller M., et al. . (2002). Крысиная модель боли при раке кости. Боль 96, 129–140. 10.1016/S0304-3959(01)00437-7 [PubMed] [CrossRef] [Google Scholar]
- Miao X.R., Gao X.F., Wu J.X., Lu Z.J., Huang Z.X., Li X.Q., et al. . (2010). Двустороннее подавление Nav1.8 в ганглиях задних корешков крыс с болью при раке костей, вызванной инокуляцией клеток опухоли молочной железы Walker 256.BMC Рак 10:216. 10.1186/1471-2407-10-216 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Миллер Р. М., Касахара М. (1963). Наблюдения за иннервацией длинных костей человека. Анат. Рек. 145, 13–23. 10.1002/ar.10
- 104 [CrossRef] [Google Scholar]
- Минвилл В., Лаффосс Дж. М., Фуркад О., Джиролами Дж. П., Тэк И. (2008). Мышиная модель боли при переломах. Анестезиология 108, 467–472. 10.1097/ALN.0b013e3181649333 [PubMed] [CrossRef] [Google Scholar]
- Нагае М., Хирага Т., Йонеда Т. (2007). Кислая микросреда, создаваемая остеокластами, вызывает боль в костях, связанную с колонизацией опухоли. Дж. Боун Шахтер. Метаб. 25, 99–104. 10.1007/s00774-006-0734-8 [PubMed] [CrossRef] [Google Scholar]
- Ниияма Ю., Кавамата Т., Ямамото Дж., Омотэ К., Намики А. (2007). Рак кости увеличивает транзиторный рецепторный потенциал экспрессии ваниллоидного подсемейства 1 в отдельных субпопуляциях нейронов ганглиев дорсальных корешков. неврология 148, 560–572. 10.1016/j.Неврология.2007.05.049 [PubMed] [CrossRef] [Google Scholar]
- Нив Д., Гофельд М., Девор М. (2003). Причины болей при дегенеративных заболеваниях костей и суставов: урок вертебропластики. Боль 105, 387–392. 10.1016/S0304-3959(03)00277-X [PubMed] [CrossRef] [Google Scholar]
- Olausson H., Lamarre Y., Backlund H., Morin C., Wallin B.G., Starck G., et al. . (2002). Немиелинизированные тактильные афференты сигнализируют о прикосновении и проецируются на островковую кору. Нац. Неврологи. 5, 900–904. 10.1038/nn896 [PubMed] [CrossRef] [Google Scholar]
- Palecek J., Палецкова В., Уиллис В. Д. (2003). Экспрессия Fos в спиноталамических и постсинаптических нейронах дорсального столба после вредных висцеральных и кожных раздражителей. Боль 104, 249–257. 10.1016/S0304-3959(03)00013-7 [PubMed] [CrossRef] [Google Scholar]
- Paterson D. J., Estavillo J. A., Nye PC (1988). Влияние гипоксии на концентрацию калия в плазме и возбуждение артериальных хеморецепторов у кошек. QJ Exp. Физиол. 73, 623–625. 10.1113/expphysiol.1988.sp003182 [PubMed] [CrossRef] [Google Scholar]
- Porro C.А., Четтоло В., Франческато М.П., Баральди П. (1998). Временное и интенсивное кодирование боли в коре головного мозга человека. Дж. Нейрофизиол. 80, 3312–3320. [PubMed] [Google Scholar]
- Портеной Р. К., Пейн Д., Якобсен П. (1999). Прорывная боль: характеристики и влияние на пациентов с онкологической болью. Боль 81, 129–134. 10.1016/S0304-3959(99)00006-8 [PubMed] [CrossRef] [Google Scholar]
- Поунтос И., Георгули Т., Калори Г. М., Джанноудис П. В. (2012). Влияют ли нестероидные противовоспалительные препараты на заживление костей? Критический анализ.Научный мировой журнал 2012:606404. 10.1100/2012/606404 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Qiu F., Jiang Y., Zhang H., Liu Y., Mi W. (2012). Повышенная экспрессия устойчивых к тетродотоксину натриевых каналов Nav1.8 и Nav1.9 в ганглиях задних корешков в крысиной модели боли при раке кости. Неврологи. лат. 512, 61–66. 10.1016/j.neulet.2012.01.069 [PubMed] [CrossRef] [Google Scholar]
- Ralston HJ, III, Miller MR, Kasahara M. (1960). Нервные окончания в фасциях, сухожилиях, связках, надкостнице и суставной синовиальной оболочке человека.Анат. Рек. 136, 137–147. 10.1002/ar.10
- 208 [PubMed] [CrossRef] [Google Scholar]
- Рен К., Дубнер Р. (1999a). Пластичность центральной нервной системы и постоянные боли. Дж. Орофак. Боль 13, 155–163; обсуждение 164–171. [PubMed] [Google Scholar]
- Рен К., Дубнер Р. (1999b). Воспалительные модели боли и гипералгезии. ИЛАР Дж. 40, 111–118. 10.1093/ilar.40.3.111 [PubMed] [CrossRef] [Google Scholar]
- Роу М. Дж., Трейси Д. Дж., Манс Д. А., Сахай В., Иванушич Дж. Дж. (2005).Механосенсорное восприятие: есть ли вклад костных рецепторов? клин. Эксп. Фармакол. Физиол. 32, 100–108. 10.1111/j.1440-1681.2005.04136.x [PubMed] [CrossRef] [Google Scholar]
- Rundle C.H., Wang H., Yu H., Chadwick R.B., Davis E.I., Wergedal J.E., et al. . (2006). Микроматричный анализ экспрессии генов на стадиях воспаления и формирования эндохондральной кости при восстановлении перелома бедренной кости у крыс. Кость 38, 521–529. 10.1016/j.bone.2005.09.015 [PubMed] [CrossRef] [Google Scholar]
- Сакада С.(1974). Механорецепторы в фасции, надкостнице и периодонтальной связке. Бык. Токио Мед. Вмятина. ун-т 21 (Прил.), 11–13. [PubMed] [Google Scholar]
- Сакада С., Аида Х. (1971a). Электрофизиологические исследования телец Гольджи-Маццони в надкостнице лицевых костей кошек. Бык. Токио Дент. Сб. 12, 255–272. [Google Scholar]
- Сакада С., Аида Х. (1971b). Локализация и форма телец Гольджи-Маццони в надкостнице лицевых костей кошки. Бык. Токио Дент. Сб.12, 235–253. [Google Scholar]
- Сакада С., Маэда К. (1967a). Особенности иннервации и нервных окончаний в надкостнице нижней челюсти кошек. Бык. Токио Дент. Сб. 8, 77–94. [PubMed] [Google Scholar]
- Сакада С., Маеда К. (1967b). Корреляция между гистологической структурой и реакцией на давление механорецепторов в надкостнице нижней челюсти кошки. Бык. Токио Дент. Сб. 8, 181–196. [Google Scholar]
- Сакада С., Мияке А. (1972). Реакция медленно адаптирующихся окончаний свободных волокон в надкостнице нижней челюсти кошки на вибрационную стимуляцию.Бык. Токио Дент. Сб. 13, 205–225. [PubMed] [Google Scholar]
- Сакада С., Немото Т. (1972). Реакция на тепловую стимуляцию быстро- и медленно адаптирующихся окончаний свободных волокон в надкостнице нижней челюсти кошки. Бык. Токио Дент. Сб. 13, 227–250. [PubMed] [Google Scholar]
- Сакада С., Оноэ Ю. (1971). Реакция быстроадаптирующихся окончаний свободных волокон в надкостнице нижней челюсти кошки на вибрационную стимуляцию. Бык. Токио Дент. Сб. 12, 199–221. [PubMed] [Google Scholar]
- Сакада С., Тагучи С. (1971). Электрофизиологические исследования окончаний свободных волокон надкостницы нижней челюсти кошки. Бык. Токио Дент. Сб. 12, 175–197. [PubMed] [Google Scholar]
- Сакада С., Яно Дж. (1978). Влияние гипертонических и гипотонических солевых растворов на нервные окончания в надкостнице позади подбородочного отверстия кошки. Бык. Токио Дент. Сб. 19, 103–118. [PubMed] [Google Scholar]
- Санти Дж., Макинтош К. (2001). Феноменологическое исследование боли после перелома диафиза бедренной кости.Дж. Клин. Нурс. 10, 521–527. 10.1046/j.1365-2702.2001.00506.x [PubMed] [CrossRef] [Google Scholar]
- Schaible HG (1996). Почему болит сустав при воспалении? бр. Дж. Ревматол. 35, 405–406. 10.1093/rheumatology/35.5.405 [PubMed] [CrossRef] [Google Scholar]
- Schaible HG, Schmidt R.F. (1988). Динамика изменения механочувствительности суставных афферентов при развивающемся экспериментальном артрите. Дж. Нейрофизиол. 60, 2180–2195. [PubMed] [Google Scholar]
- Schwei M.J., Honore P., Rogers S.D., Salak-Johnson J.L., Finke M.P., Ramnaraine M.L., et al. . (1999). Нейрохимическая и клеточная реорганизация спинного мозга в мышиной модели боли при раке кости. Дж. Нейроски. 19, 10886–10897. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Segale M. (1919). Температура остро воспаленных периферических тканей. Дж. Эксп. Мед. 29, 235–249. 10.1084/jem.29.3.235 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Seidel M. F., Wise B. L., Лейн Н.Е. (2013). Фактор роста нервов: последние сведения о науке и терапии. Остеоартроз. Картил. 21, 1223–1228. 10.1016/j.joca.2013.06.004 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Seike W. (1976). Электрофизиологические и гистологические исследования чувствительности нервных окончаний костного мозга. Йонаго Акта Мед. 20, 192–211. [PubMed] [Google Scholar]
- Севчик М. А., Гиларди Дж. Р., Петерс С. М., Линдси Т. Х., Халворсон К. Г., Джонас Б. М. и др. . (2005).Анти-ФРН-терапия значительно уменьшает боль при раке кости и сопровождающее ее увеличение маркеров периферической и центральной сенсибилизации. Боль 115, 128–141. 10.1016/j.pain.2005.02.022 [PubMed] [CrossRef] [Google Scholar]
- Shen W., Hu X.M., Liu Y.N., Han Y., Chen LP, Wang C.C., et al. . (2014). CXCL12 в астроцитах способствует боли при раке кости посредством CXCR4-опосредованной сенсибилизации нейронов и активации глии в спинном мозге крыс. J. Нейровоспаление 11, 75. 10.1186/1742-2094-11-75 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Shi X., Го Т. З., Вэй Т., Ли В. В., Кларк Д. Дж., Кингери В. С. (2015). Облегченная передача сигналов спинального нейропептида и повышенная экспрессия воспалительных медиаторов способствуют постпереломной ноцицептивной сенсибилизации. Боль 156, 1852–1863 гг. 10.1097/j.pain.0000000000000204 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Spencer N.J., Kyloh M., Duffield M. (2014). Идентификация различных типов окончаний спинномозговых афферентных нервов, которые кодируют вредные и безвредные стимулы в толстой кишке, с использованием новой техники антероградного отслеживания.ПЛОС ОДИН 9:e112466. 10.1371/journal.pone.0112466 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Strassman A.M., Weissner W., Williams M., Ali S., Levy D. (2004). Диаметры аксонов и интрадуральные траектории иннервации твердой мозговой оболочки у крыс. Дж. Комп. Нейрол. 473, 364–376. 10.1002/cne.20106 [PubMed] [CrossRef] [Google Scholar]
- Такасе Б., Номура С. (1957). Исследования иннервации костного мозга. Дж. Комп. Нейрол. 108, 421–443. 10.1002/cne. 0305 [PubMed] [CrossRef] [Google Scholar]
- Thurston T.Дж. (1982). Распределение нервов в длинных костях показано импрегнацией серебра. Дж. Анат. 134 (часть 4), 719–728. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Триде Р. Д., Мейер Р. А., Раджа С. Н., Кэмпбелл Дж. Н. (1995). Доказательства двух различных механизмов теплопередачи в ноцицептивных первичных афферентах, иннервирующих кожу обезьяны. Дж. Физиол. 483 (часть 3), 747–758. 10.1113/jphysiol.1995.sp020619 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Uhelski M.L., Cain D.М., Хардинг-Роуз К., Симона Д.А. (2013). Неселективный агонист каннабиноидных рецепторов WIN 55,212-2 ослабляет ответы ноцицепторов С-волокон в мышиной модели раковой боли. неврология 247, 84–94. 10.1016/j.neuroscience.2013.05.003 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Urch C.E., Donovan-Rodriguez T., Dickenson A.H. (2003). Изменения в нейронах задних рогов в крысиной модели боли в костях, вызванной раком. Боль 106, 347–356. 10.1016/j.pain.2003.08.002 [PubMed] [CrossRef] [Google Scholar]
- Валбо А.Б., Олауссон Х., Вессберг Дж. (1999). Немиелинизированные афференты составляют вторую систему, кодирующую тактильные раздражители волосистой кожи человека. Дж. Нейрофизиол. 81, 2753–2763. [PubMed] [Google Scholar]
- Валлбо А., Олауссон Х., Вессберг Дж., Норрселл У. (1993). Система немиелинизированных афферентов для безвредной механорецепции в коже человека. Мозг Res. 628, 301–304. 10.1016/0006-8993(93)
- -S [PubMed] [CrossRef] [Google Scholar]
- Williams MC, Ivanusic JJ (2008). Доказательства участия спинопарабрахиального пути, но не спиноталамического тракта или постсинаптического дорсального столба, в острой костной ноцицепции.Неврологи. лат. 443, 246–250. 10.1016/j.neulet.2008.07.076 [PubMed] [CrossRef] [Google Scholar]
- Willis WD, Jr. (1985). Система боли. Нейронная основа ноцицептивной передачи в нервной системе млекопитающих. Боль 8, 1–346. [PubMed] [Google Scholar]
- Вульф А. Д., Пфлегер Б. (2003). Бремя основных заболеваний опорно-двигательного аппарата. Бык. Всемирный орган здравоохранения.
81, 646–656. 10.1590/S0042-96862003000
7 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Yamada M., Йошино Ю. (1977). Механизмы возбуждения боли в коленном суставе при ишемии. Йонаго Акта Мед. 21, 1–10. [PubMed] [Google Scholar]
- Янагисава Ю., Фуруэ Х., Кавамата Т., Ута Д., Ямамото Дж., Фурусе С. и др. . (2010). Рак костей индуцирует уникальную центральную сенсибилизацию посредством синаптических изменений в широкой области спинного мозга. Мол. Боль 6:38. 10.1186/1744-8069-6-38 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Чжао Дж., Леви Д. (2014). Сенсорная иннервация надкостницы свода черепа является ноцицептивной и вносит вклад в поведение, подобное головной боли.Боль 155, 1392–1400. 10.1016/j.pain.2014.04.019 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Zhao J., Zhang H., Liu SB, Han P., Hu S., Li Q., et др. . (2013). Спинальный интерлейкин-33 и его рецептор ST2 вносят вклад в боль, вызванную раком кости у мышей. неврология 253, 172–182. 10.1016/j.neuroscience.2013.08.026 [PubMed] [CrossRef] [Google Scholar]
Физиология боли в костях. Как много мы знаем на самом деле?
Фронт Физиол. 2016; 7: 157.
Кафедра анатомии и неврологии Мельбурнского университета, Мельбурн, Виктория, Австралия
Под редакцией: Ника Спенсера, Университет Флиндерс, Австралия
Рецензирование: Майкл Карр, Исследователь респираторных препаратов, GlaxoSmithKline, США; TinaMarie Lieu, Университет Монаш, Австралия
Эта статья была отправлена в Autonomic Neuroscience, раздел журнала Frontiers in Physiology
Поступила в редакцию 15 февраля 2016 г.; Принято 11 апреля 2016 г.
Это статья с открытым доступом, распространяемая на условиях лицензии Creative Commons Attribution License (CC BY). Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора(ов) или лицензиара оригинала и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья была процитирована другими статьями в PMC.Abstract
Боль связана с большинством костных патологий. Клинические и экспериментальные наблюдения позволяют предположить, что боль в костях может быть следствием вредной стимуляции надкостницы или костного мозга. Известно, что сенсорные нейроны иннервируют надкостницу и полость костного мозга, и большинство из них имеют морфологию и молекулярный фенотип, соответствующие роли в ноцицепции. Однако мало что известно о физиологии этих нейронов, и поэтому информация о механизмах, которые вызывают и поддерживают боль в костях, отсутствует.Надкостнице уделялось больше внимания по сравнению с костным мозгом, что отражает более легкий доступ к надкостнице для экспериментальной оценки. С помощью используемых электрофизиологических препаратов исследователи смогли изолированно регистрировать отдельные периостальные единицы, и имеется много доступной информации о том, как они реагируют на различные раздражители, в том числе вредные. Напротив, препараты, используемые для изучения чувствительных нейронов, иннервирующих костный мозг, были ограничены регистрацией многоэлементной активности целых нервов, и, хотя они четко сообщают об ответах на вредную стимуляцию, невозможно определить ответы отдельных чувствительных нейронов, иннервирующих костный мозг. костный мозг.Имеются лишь ограниченные доказательства того, что периферические сенсорные нейроны, иннервирующие кость, могут быть сенсибилизированы или что они могут быть активированы несколькими типами стимулов, и в настоящее время это существует только частично для периостальных единиц. Очевидно, что в центральной нервной системе нейроны задних рогов спинного мозга могут активироваться вредными стимулами, воздействующими на кость. Некоторые из них могут быть сенсибилизированы при патологических состояниях и могут частично способствовать вторичной или отраженной боли, связанной с костной патологией. Активность, связанная со стимуляцией сенсорных нервов, иннервирующих кость, также была обнаружена в нейронах спинопарабрахиального пути и соматосенсорной коры, которые известны своей ролью в кодировании информации о боли.Хотя они дают некоторые подсказки относительно того, как информация о боли в костях централизованно кодируется, их необходимо расширить, чтобы углубить наше понимание других задействованных центральных областей. Еще многое предстоит узнать о физиологии периферических сенсорных нейронов, иннервирующих кость, и их центральных отростков.
Ключевые слова: боль в костях, боль, ноцицепция, кость, электрофизиология, надкостница, костный мозг как информация о вредной стимуляции, закодированная этими нейронами, передается через центральную нервную систему в кору головного мозга, вызывая болезненные ощущения.Мы начнем с обобщения некоторых ключевых концепций, касающихся качества и лечения боли в костях, а также того, что мы знаем о морфологии и молекулярном фенотипе костных афферентных нейронов, а затем подробно изучим физиологию костных афферентных нейронов и их проекции через ЦНС.
Боль в костях: клинические и экспериментальные наблюдения
Боль, связанная с костной патологией, включая синдромы отека костного мозга, остеомиелит, остеоартрит, переломы и рак кости, является тяжелым бременем (как с точки зрения качества жизни, так и с точки зрения стоимости) для отдельных лиц и системы здравоохранения во всем мире.Ожидается, что это бремя будет увеличиваться с достижениями современной медицины, увеличивающими ожидаемую продолжительность жизни, поскольку многие состояния, вызывающие боль в костях, неизлечимы и развиваются в более позднем возрасте. Распространенность многих из этих состояний высока, например, остеоартрит поражает почти 10 % мужчин и 18 % женщин старше 60 лет (всемирная оценка), а остеопороз поражает до 30 % женщин в постменопаузе на севере США (Woulf и Пфлегер, 2003). Метастатическая боль в костях является наиболее распространенным болевым синдромом у онкологических больных, и до 50% пациентов сообщают, что существующие методы лечения плохо справляются с болью (Mantyh and Hunt, 2004).Управление болью в костях с помощью традиционной анальгезии основано на предположении, что механизмы, опосредующие боль в костях, аналогичны механизмам, опосредующим боль в других тканевых системах, и поэтому могут быть нацелены на аналогичные методы лечения. Опиоиды и нестероидные противовоспалительные препараты (НПВП) обычно используются для лечения боли от легкой до сильной, но терапевтическое применение при болях в костях ограничено нежелательными побочными эффектами, включая седативный эффект, угнетение дыхания, толерантность к длительному применению, риск привыкания, желудочно-кишечные расстройства. эффектов и почечной токсичности.Все это происходит при длительном использовании того вида, который необходим для лечения постоянной боли при трудноизлечимых состояниях, таких как остеоартрит, остеопороз и рак костей. Использование НПВП и опиоидных анальгетиков при лечении болей в костях еще более осложняется из-за значительного нежелательного воздействия на ремоделирование/заживление кости (Bove et al., 2009; Pountos et al., 2012; Chrastil et al., 2013), что усложняет лечение. скрытая патология. Другие средства, подавляющие активность остеокластов (например, остеопротегерин) или уменьшающие воспалительные процессы (например, остеопротегерин).g., блокирующие функцию антитела к фактору роста нервов) вызывают значительную анальгезию на животных моделях рака кости и боли при переломах (Honore et al., 2000a; Halvorson et al., 2005; Sevcik et al., 2005; Jimenez-Andrade et al. и др., 2007; Кеулер и др., 2007). Они в первую очередь оказывают воздействие на периферию и нацелены на причины болей в костях. Однако они могут иметь значительные побочные эффекты, связанные с ремоделированием и/или разрушением кости, что ограничивает их терапевтический потенциал (Holmes, 2012; Seidel et al., 2013). Существует очевидная потребность в поиске альтернативных стратегий лечения боли в костях, не связанных с использованием НПВП или опиоидов и нацеленных более конкретно на нервные или воспалительные механизмы, вызывающие и/или поддерживающие боль.
Происхождение боли, связанной с костными тканями, является спорным вопросом. В ранних исследованиях отмечалось, что прямая болезненная механическая стимуляция надкостницы вызывала болезненные ощущения у людей (Inman and Saunders, 1944), и в более поздней литературе подчеркивается преобладающее мнение, что боль от кости обычно не ощущается, если не затронута надкостница. Мах и др., 2002). Боль от надкостницы часто описывается как острая и хорошо локализованная, и возникает, например, при переломах, достаточно значительных, чтобы воздействовать на надкостницу (Santy and Mackintosh, 2001). Однако введение раздражающих веществ в костномозговую полость также очень болезненно, как и пункционная аспирация костного мозга, и эта боль отличается от боли, связанной с разрывом надкостницы (Niv et al., 2003). Кроме того, пациенты часто ощущают боль в костях при патологиях, ограниченных главным образом костным мозгом и не имеющих явного периостального поражения (напр.g., синдром внутрикостного нагрубания) (Lemperg and Arnoldi, 1978; Arnoldi, 1990). В этих случаях боль часто описывается исключительно как тупая, диффузная и трудно локализуемая. Боль, вызванная раком костей, относится к этой последней категории и обычно состоит из фоновой боли, которая описывается как постоянная и тупая и усиливается со временем (Honore and Mantyh, 2000; Haegerstam, 2001). Кроме того, пациенты с раком кости часто жалуются на другую, более интенсивную боль при движении или нагрузке (прорывная боль) (Portenoy et al., 1999). Таким образом, оказывается, что как надкостница, так и полость костного мозга должны быть иннервированы первичными афферентными нейронами, способными трансдуцировать и передавать ноцицептивную информацию. Эти костные афферентные нейроны обеспечивают центральную нервную систему информацией, которая вызывает первичную боль, возникающую в костях.
Костная патология также может вызывать чувствительность к обычно безвредной стимуляции (аллодиния) и/или повышенную чувствительность к вредной стимуляции (гипералгезия) кожи вокруг пораженной кости/костей или даже кожи на отдаленных участках.Это часто описывается как вторичная или отраженная боль и, вероятно, отражает сенсибилизацию кожных афферентных нейронов и/или их центральных проекций (Ren and Dubner, 1999a). Сенсибилизация включает повышенную возбудимость (снижение порога возбуждения для активации и/или увеличение частоты разрядки потенциала действия) периферических и центральных сенсорных нейронов. Многие экспериментальные исследования, сообщающие о болевом поведении на животных моделях костной патологии, используют платформы для тестирования поведения, которые оценивают болевые, температурные или механические чувствительности в основном (или исключительно) на коже вокруг пораженной кости (Cain et al., 2001; Урч и др., 2003 г.; Янагисава и др., 2010 г.; Uhelski et al., 2013), и поэтому, вероятно, будут отслеживать механизмы, связанные со вторичной или отраженной болью, а не с первичной болью, связанной с прямой стимуляцией ноцицепторов в костях.
Морфология и молекулярный фенотип сенсорных нейронов, иннервирующих кость
Во многих исследованиях сообщалось о существовании первичных афферентных нейронов, иннервирующих кость, и стало ясно, что большинство этих сенсорных нейронов имеют морфологию и молекулярный фенотип, соответствующие роль в ноцицепции (рис. ).Здесь мы обобщаем литературу, которая способствовала этому пониманию, прежде чем подробно обсуждать физиологию сенсорных нейронов, иннервирующих кость. Более подробный обзор современной литературы по морфологии и молекулярному фенотипу сенсорных нейронов, иннервирующих кость, можно найти в следующих обзорах: Mach et al. (2002), Хименес-Андраде и др. (2010), Мантых (2014).
Морфология и молекулярный фенотип сенсорных нейронов, иннервирующих кости .Сома DRG первичных афферентных нейронов, иннервирующих костный мозг и надкостницу, в основном представляет собой миелинизированные и немиелинизированные нейроны малого диаметра со свободными окончаниями волокон, хотя в надкостнице все же существуют более крупные нейроны с инкапсулированными окончаниями. Они экспрессируют различные комбинации маркеров, характерных для ноцицептивных нейронов, включая пептид, родственный гену кальцитонина (CGRP), вещество P (SP) и киназу рецептора тирозина A (TrkA), и/или связывают изолектин B4 (IB4). Связывание IB4 не наблюдалось в окончаниях периферических нервов (представлено пунктирной линией).
Самые ранние исследования иннервации кости задокументировали примеры рассеченных или окрашенных серебром нервных волокон в кости и надкостнице, но мало внимания уделялось их функции (De Castro, 1925; Hurrell, 1937; Takase and Nomura, 1957; Miller and Kasahara). , 1963; Cooper et al., 1966; Sakada and Maeda, 1967а; Calvo, 1968; Thurston, 1982). Поскольку многие из этих волокон находились в тесном контакте с кровеносными сосудами внутри кости, некоторые авторы предположили связь с функцией сосудов, но не дали дальнейших комментариев.Это несколько удивительно, поскольку повреждение кости и ассоциированной ткани явно связано с болью, что позволяет предположить, что по крайней мере некоторые из описанных волокон в кости должны быть ноцицепторами. Использование иммуногистохимических маркеров различных нейропептидов в более поздних сообщениях показало, что нервные волокна, иннервирующие минерализованную кость, костный мозг и надкостницу, имеют как сенсорное, так и вегетативное происхождение (Duncan and Shim, 1977; Gronblad et al., 1984; Hohmann et al., 1986; Bjurholm et al., 1988; Хилл и Эльде, 1988, 1991; Мах и др., 2002). Волокна сенсорного происхождения обычно описывались как имеющие свободные окончания небольшого диаметра, хотя некоторые более крупные волокна со специализированными инкапсулированными окончаниями были обнаружены в надкостнице нижней челюсти кошек (Sakada and Maeda, 1967a; Sakada and Aida, 1971b), длинных костях человека. надкостница (Ralston et al., 1960) и гаверсовы каналы в кортикальной кости собак (Cooper et al., 1966). Недавно разработанный метод избирательной маркировки периферических сенсорных нейронов может быть полезен для подтверждения сенсорного, а не симпатического происхождения этих нервных окончаний в костях (Kyloh and Spencer, 2014; Spencer et al., 2014).
Ноцицепторы обычно определяются как тонкие миелинизированные или немиелинизированные первичные афферентные нейроны небольшого диаметра и могут быть идентифицированы по наличию специфических молекулярных маркеров, экспрессируемых на их соме [в ганглиях задних корешков (DRG)] или их периферических нервных окончаниях. Сома DRG первичных афферентных нейронов, иннервирующих костномозговую полость, трабекулярную кость и надкостницу, представляет собой почти исключительно миелинизированные и немиелинизированные нейроны малого диаметра, которые экспрессируют различные комбинации маркеров, характерных для ноцицептивных нейронов, включая пептид, родственный гену кальцитонина (CGRP), вещество P (SP) и киназа рецептора тирозина A (TrkA) и/или связывают изолектин B4 (IB4) (Gajda et al., 2004; Иванушич, 2009 г.; Асо и др., 2014). Важно отметить, что эти исследования идентифицировали субпопуляции сенсорных нейронов, иннервирующих кость, на основе различных комбинаций этих маркеров у крыс. Например, ясно, что до половины являются пептидергическими (CGRP+) (Ivanusic, 2009; Aso et al., 2014), а многие непептидергическими (связывание CGRP или IB4) (Ivanusic, 2009; Aso et al., 2014). ), и что примерно две трети, вероятно, будут чувствительными к фактору роста нервов (TrkA+), в то время как другие не будут (TrkA-) (Aso et al., 2014). Похоже, что эти молекулярные фенотипы сохраняются в окончаниях периферических нервов в костях (Mach et al., 2002; Jimenez-Andrade et al., 2010; Castaneda-Corral et al., 2011), хотя связывание IB4 при этом не наблюдалось. расположение (по крайней мере, у мышей; Mach et al., 2002). Хотя могут существовать некоторые тонкие межвидовые различия, ясно, что морфология и молекулярный фенотип сенсорных нейронов, которые иннервируют ткани кости, согласуются с их ролью в ноцицепции, и что эти особенности могут быть использованы для идентификации множественных субпопуляций костных афферентных нейронов. нейроны (рис. ).Отражается ли эта молекулярная гетерогенность на физиологии костных афферентных нейронов, еще предстоит определить. В оставшейся части этого обзора мы рассмотрим то, что известно о физиологии костных афферентных нейронов.
Физиология периферических костных афферентных нейронов
Среда, в которой существуют сенсорные нервные окончания в костях, сильно отличается от окружающей среды в тканях других типов. Надкостница выстилает очень твердый кортикальный слой кости, поэтому чувствительные нервные окончания в надкостнице легко сдавливаются относительно низкопороговыми механическими раздражителями по сравнению с окончаниями в более податливой ткани, такой как кожа.Костный мозг окружен неподатливой минерализованной костью и содержит большие популяции клеток-предшественников и зрелых воспалительных клеток (и других типов клеток), которые вместе создают различные стимулирующие условия в полости костного мозга по сравнению с другими тканями. Таким образом, важно учитывать, как первичные афферентные нейроны в каждом из этих различных костных компартментов реагируют на вредные стимулы и чем это отличается от других типов тканей. Здесь мы подробно обсуждаем то, что известно о физиологии периферически расположенных первичных афферентных нейронов, иннервирующих либо надкостницу, либо костный мозг.
Надкостница
В литературе гораздо большее внимание уделяется периостальной афферентной иннервации, чем полости костного мозга. Это, несомненно, отражает более легкий доступ к надкостнице для экспериментальной оценки, чем к костному мозгу.
Наиболее подробная серия электрофизиологических исследований периостальной иннервации была проведена Сакада с коллегами (Сакада, Маеда, 1967а,б; Сакада, Аида, 1971а,б; Сакада, Оное, 1971; Сакада, Тагучи, 1971; Сакада и др.). Мияке, 1972; Сакада и Немото, 1972; Сакада, 1974; Сакада и Яно, 1978).Они сделали сотни записей с мелких нервов в препарате in vitro с цельным препаратом надкостницы нижней челюсти кошки, описывая реакции как на вредную, так и на безвредную стимуляцию их сенсорных нервных окончаний. Поскольку рецептивные поля надкостничных афферентов в препарате были достаточно дискретными, исследователи смогли активировать и изолировать отдельные единицы с помощью механических стимулов, воздействующих на надкостницу. Гистология показала, что нижнечелюстная надкостница кошки была иннервирована окончаниями свободных волокон малого диаметра и некоторыми более крупными окончаниями, инкапсулированными тельцами Гольджи-Маццони (Sakada and Maeda, 1967a; Sakada and Aida, 1971b).Окончания свободных волокон были распределены по всему препарату, тогда как тельца Гольджи-Маццони можно было обнаружить только по средней линии перед ментальным отверстием. Таким образом, авторы смогли предпочтительно активировать и изучить окончания свободных волокон, применяя стимулы к надкостнице позади ментального отверстия. Они сообщили, что большинство аксонов со свободными окончаниями волокон имели малый диаметр, что соответствовало ноцицептивной функции, и систематически исследовали ответные свойства периостальных окончаний свободных волокон малого диаметра в надкостнице нижней челюсти (см. ниже).Они также описали поведение инкапсулированных телец Гольджи-Маццони, обнаруженных впереди ментального отверстия.
Чжао и Леви описали препарат, в котором они использовали электроды из вольфрамовой проволоки для регистрации активности нейронов тройничного ганглия с рецептивными полями на надкостнице свода черепа крысы (Чжао и Леви, 2014). Этот метод позволяет хорошо изолировать одиночные единицы, и все их данные относятся к ответам одиночных единиц на периостальную стимуляцию. Всего было сообщено о 115 отдельных единицах, что делает выборку значительной выборкой, на основе которой можно делать выводы.Они не комментировали морфологию или размер периостальных окончаний, но тщательно исследовали их физиологию преимущественно, но не исключительно, в контексте роли в ноцицепции (см. ниже).
Mahns и коллеги использовали препарат in vivo для исследования нейронов, иннервирующих надкостницу плечевой кости кошки (Mahns et al., 2004, 2006). Гистология показала, что небольшой нерв, из которого были сделаны записи в этом препарате, содержал только миелинизированные и немиелинизированные аксоны небольшого диаметра (Ivanusic et al., 2006). Они были способны выборочно активировать отдельные афферентные волокна, которые демонстрировали очерченные и точечные рецептивные поля. Однако только 15 отдельных волокон были изучены с точки зрения характеристик рецептивного поля и/или вибромеханической чувствительности и реактивности.
Скорость проведения
Скорость проведения тесно связана с размером аксона и может использоваться для классификации первичных афферентных нейронов по ряду функциональных категорий. Афференты с миелинизированными (Aδ) или немиелинизированными (C) аксонами малого диаметра и низкой скоростью проведения связаны преимущественно с ноцицептивной функцией (Dixon, 1963; Burgess and Perl, 1973; Lawson and Waddell, 1991; Djouhri and Lawson, 2004; Strassman et al. др., 2004). Нейроны С-волокна имеют аксоны наименьшего диаметра (0,6–1,2 мкм у крыс; 1–2 мкм у кошек) и самые низкие скорости проведения (<2 м/с у крыс; <10 м/с у кошек). Их проводящие свойства и реакции как на тепловые, так и на химические раздражители привели к идее, что они являются важными медиаторами медленной жгучей боли в большинстве тканевых систем. Нейроны миелинизированных волокон Aδ имеют более крупные аксоны (1,2–4 мкм у крыс; 2–5 мкм у кошек) и более высокие скорости проведения (2–12 м/с у крыс; 10–30 м/с у кошек). Из-за их более быстрой проводимости они считаются медиаторами быстрой боли.Нейроны Aβ также миелинизированы и имеют аксоны самого большого диаметра (> 4 мкм у крыс;> 5 мкм у кошек) и самые высокие скорости проведения (> 12 м / с у крыс;> 30 м / с у кошек). Нейроны с аксонами большого диаметра, высокой скоростью проведения и инкапсулированными окончаниями обычно связаны с безвредной (например, тактильной или кинестетической) чувствительностью.
Сакада и его коллеги сообщили, что аксоны, иннервирующие окончания свободных волокон надкостницы в надкостнице нижней челюсти кошек, имели скорость проведения в диапазоне волокон Aδ и С (2–18 м/с) (Sakada and Maeda, 1967b; Sakada and Taguchi, 1971). предполагая роль в ноцицепции.Аксоны с инкапсулированными окончаниями Гольджи-Маццони имели более высокую скорость проведения (>30 м/с) (Sakada and Maeda, 1967b; Sakada and Aida, 1971a), что указывает на их роль преимущественно в низкопороговой механо-чувствительности, а не в ноцицепции. Zhao and Levy (2014) сообщили об аналогичном распределении скорости проведения по диапазонам волокон Aβ, Aδ и C в надкостнице свода черепа крысы, подтверждая представление о том, что периостальные афференты играют роль как в ноцицепции, так и в низкопороговой механочувствительности.Напротив, Ivanusic и его коллеги сообщили о гистологических данных о том, что нерв, идущий к кошачьей плечевой кости, содержит только миелинизированные и немиелинизированные аксоны небольшого диаметра (Ivanusic et al., 2006), а скорости проводимости при электрической стимуляции надкостницы были ограничены диапазоном, соответствующим Aδ и классификация волокон С (<30 м/с) (Mahns et al., 2006). Однако была представлена скорость проведения только четырех периостальных афферентных волокон, поэтому размер их выборки ограничен. Возможно, при отборе проб более широкой области надкостницы кошачьей плечевой кости могут быть обнаружены единицы с более высокими скоростями проведения.В качестве альтернативы может быть, что единицы с более высокими скоростями проведения и более крупными аксонами чаще встречаются в черепе (Sakada and Taguchi, 1971; Zhao and Levy, 2014) по сравнению с аппендикулярным скелетом (Mahns et al., 2006). Тем не менее, результаты всех исследователей показывают, что подавляющее большинство периостальных афферентов имеют скорость проведения, соответствующую роли в ноцицепции, и, вероятно, способствуют возникновению острой, быстрой (Aδ) или медленной жгучей (C) боли. Об этих типах боли действительно сообщалось у людей, подвергшихся периостальной стимуляции (Inman and Saunders, 1944), и в ряде исследований на животных предполагалось, что они вносят свой вклад в профиль боли (Martin et al., 2007).
Свойства механической реакции
Все вышеперечисленные исследователи сообщили, что периостальные афферентные единицы являются механически чувствительными. Сакада и его коллеги зарегистрировали многие сотни механически чувствительных единиц в своей серии работ, посвященных надкостнице нижней челюсти кошек, но эти исследования не выявили относительную долю механически чувствительных афферентных волокон, поскольку они изучали только те, которые можно было идентифицировать с механическими раздражителями. Напротив, почти все единицы (113/115), которые могли быть активированы электрической стимуляцией надкостницы свода черепа, были механически чувствительны (Zhao and Levy, 2014), что позволяет предположить, что подавляющее большинство периостальных афферентов механически чувствительны в этом препарате.Точно так же все 15 сенсорных нейронов, идентифицированных при электрической стимуляции надкостницы плечевой кости кошки, могут быть активированы механическими стимулами (Mahns et al., 2006).
Порог активации является важным свойством физиологии сенсорных нейронов, которое сообщает, насколько легко стимул передается на периферии. Порог активации механически чувствительных первичных афферентных нейронов полезен для определения их функциональной классификации. Например, большинство механически чувствительных единиц с низким порогом играют роль в безобидной чувствительности, в то время как единицы с высоким порогом обычно играют роль в ноцицепции.Периферические сенсорные нейроны также могут по-разному адаптироваться к применению постоянного механического раздражителя. Для быстро адаптирующихся нейронов частота разрядов очень быстро снижается, а реакция на механический раздражитель является преходящей, так что импульсы возникают только в начале или после окончания механической стимуляции. Это обеспечивает четкую временную локализацию механических раздражителей и характерно для низкопороговых механосенсорных нейронов. Тельца Пачини являются примером быстро адаптирующихся механорецепторов.Для медленно адаптирующихся нейронов снижение частоты разряда занимает гораздо больше времени, так что нейрон продолжает возбуждаться в течение всего времени действия стимула. Большинство ноцицепторов классически определяются как имеющие медленно адаптирующуюся реакцию на вредную механическую стимуляцию, что означает, что после активации ноцицептор останется активированным и предоставит ЦНС информацию о продолжительности раздражителя.
Сакада и коллеги сообщили, что как большие, инкапсулированные окончания Гольджи-Маццони, так и окончания свободных волокон позади ментального отверстия могут быть классифицированы в соответствии с их адаптационными реакциями.Окончания Гольджи-Маццони были исключительно быстро адаптирующимися, низкопороговыми единицами, которые хорошо реагировали на вибрацию и родственны тельцам Пачини или другим афферентам, которые опосредуют безвредную тактильную или кинестетическую чувствительность (Sakada and Maeda, 1967b; Sakada and Aida, 1971a). Напротив, свободные окончания волокон, с которых они записывали, либо быстро, либо медленно адаптировались, и каждое из них имело разные свойства ответа. Паттерны импульсов к стимуляции давлением медленно адаптирующихся окончаний свободных волокон сильно различались, однако в большинстве из них наблюдалось резкое увеличение активности во время динамической фазы стимула давления, за которым следовал период устойчивой активности, характеризующийся постепенным увеличением интервала между импульсами. как рецептор, адаптированный к поддерживаемому раздражителю (Sakada, Taguchi, 1971; Sakada, Miyake, 1972).С увеличением интенсивности механической стимуляции у этих медленно адаптирующихся свободных окончаний волокон увеличивалась частота разрядов, по крайней мере, в динамической фазе их ответа (Sakada, Taguchi, 1971; Sakada, Miyake, 1972). Большинство из этих медленно адаптирующихся окончаний свободных волокон имели аксоны со скоростями проводимости в диапазоне нейронов Aδ (2-18 м/с) и имели относительно высокие механические пороги (Sakada and Taguchi, 1971), что указывает на роль в ноцицепции. Эти результаты согласуются с выводами Zhao и Levy, которые сообщили, что 82% механочувствительных афферентов в надкостнице свода черепа медленно адаптировались и большинство, но не все, имели скорость проведения в диапазоне волокон Aδ и C.Примечательно, что как Сакада и его коллеги, так и Чжао и Леви сообщили о некоторых медленно адаптирующихся окончаниях свободных волокон, которые реагировали на безвредное растяжение двубрюшной мышцы и/или проводились в диапазоне Aβ, предполагая, что некоторые из них могут быть безвредными механорецепторами, а не ноцицепторами, но они были относительно немного в их приготовлениях.
В исследованиях Sakada и коллег быстро адаптирующиеся окончания свободных волокон были идентифицированы по их ответу на вибрационные стимулы (Sakada and Onoe, 1971; Sakada and Taguchi, 1971).Порог активации измеряли как минимальное напряжение, приложенное к соленоиду механического стимулятора, которое требовалось, чтобы вызвать паттерн возбуждения 1:1 (один импульс на цикл вибрации) с частотой 10 циклов в секунду (Гц). Калибровка по реальной силе не была представлена, поэтому было невозможно сравнить механические пороги с другими исследованиями, но они смогли провести различие между относительно высоким и низким порогом быстрой адаптации свободных окончаний волокон в своих собственных исследованиях. Быстро адаптирующиеся окончания свободных волокон могут следовать частотам вибрации значительно выше 300 циклов в секунду (Sakada and Onoe, 1971).Примерно половина быстро адаптирующихся окончаний свободных волокон в надкостнице имели низкие пороги и реагировали на растяжение двубрюшной мышцы, которое не считалось вредным, поскольку не вызывало болевого рефлекса или рефлекса открывания челюсти (Sakada and Taguchi, 1971). Это свидетельствует о том, что они являются низкопороговыми механорецепторами. Другая половина имела относительно высокие пороги и считалась ноцицепторами (Sakada and Taguchi, 1971). Все 15 механически чувствительных волокон, описанных Mahns, Ivanusic et al.(2006) продемонстрировали быстро адаптирующиеся свойства, так как ступенчатое вдавливание надкостницы с помощью ручных зондов или механических стимулов с сервоуправлением вызывало ответы только в сочетании с динамическими компонентами стимула. Многие из них могут быть активированы с очень низким усилием (всего 0,5 мН) и проведены в диапазоне волокон Aδ и C. Они, вероятно, похожи на быстро адаптирующиеся окончания свободных волокон, определяемые как низкопороговые механорецепторы, о которых сообщают Сакада и его коллеги.
Рецептивное поле отдельного нейрона определяет область ткани, над которой адекватный стимул может вызвать активность, и, следовательно, влияет на способность сенсорного нейрона обнаруживать местоположение стимула и различать несколько стимулов. Рецептивные поля механически чувствительных единиц могут различаться по размеру для разных типов единиц и в разных тканевых системах. Сакада и Тагучи (1971) определили размер рецептивного поля 434 одиночных единиц, иннервирующих надкостницу нижней челюсти.Большинство единиц могут быть активированы в нескольких дискретных рецептивных участках на большой площади надкостницы, обычно от 2 до 20 мм 2 . Незначительная разница в размере рецептивного поля у единиц, которые реагировали на растяжение двубрюшных мышц, и у тех, которые не реагировали, могла иметь очень умеренную тенденцию медленно адаптирующихся единиц иметь несколько большие рецептивные поля, чем быстро адаптирующиеся единицы. В случае надкостницы кошачьей плечевой кости каждая единица имела рецептивное поле, состоящее из одного участка и обычно имело приблизительно овальную форму, которая колебалась от 2 до 4 мм 2 (Mahns et al., 2006). В этом последнем исследовании отдельные периостальные афферентные единицы обычно можно было избирательно активировать с помощью тонких стимульных зондов, что свидетельствует об ограниченном перекрытии терминальных рецептивных полей отдельных волокон в надкостнице.
Наконец, также возможно, что надкостницу иннервируют другие волокна с меньшей или нулевой механической чувствительностью, потому что в областях, которые казались нечувствительными к прямому механическому зондированию, можно было выборочно активировать отдельные волокна путем применения фокальных электрических стимулов (Mahns et al. др., 2006). Они имели скорости проводимости в диапазоне C и Aδ. Они могут реагировать на изменения температуры или химические раздражители вместо механической стимуляции, или они могут быть подобны молчащим ноцицепторам, обнаруженным в других тканевых системах, которые обычно нечувствительны к механической стимуляции в нормальных условиях, но становятся механически чувствительными после воспаления (Grigg et al. ., 1986; Шайбл и Шмидт, 1988; Шайбл, 1996).
Химическая чувствительность и медиаторы воспаления
Химическая чувствительность и сенсибилизация медиаторами воспаления типичны для полимодальных ноцицепторов, особенно тех, которые классифицируются как С-волокна.Только в одном исследовании была проверена химическая чувствительность периостальных афферентных нейронов (Zhao and Levy, 2014). В этом исследовании были сделаны записи сенсорных нейронов, которые иннервируют надкостницу свода черепа, до и во время применения известных болеутоляющих веществ, включая хлорид калия (50–500 мМ), капсаицин (10 мкМ) и протоны (низкий рН). Хлорид калия вызывает дозозависимое увеличение текущей активности периостальных афферентных единиц волокон Aδ и C, но капсаицин и низкий рН редко изменяют текущую активность, а когда это происходит, реакция была слабой.Однако чувствительность периостальных афферентных единиц к механическим раздражителям была отчетливо изменена после применения медиаторов воспаления. Местное применение смеси гистамина, серотонина, брадикинина и PGE2 приводило к увеличению текущей активности почти в одной трети механически чувствительных единиц Aδ и половине единиц C-волокон, а также к увеличению механической чувствительности почти половины волокон Aδ. единиц и всех протестированных единиц волокна C. Механическая сенсибилизация была длительной (часто более 30 минут) и была связана с периорбитальной тактильной гиперчувствительностью, обычно связанной с первичными приступами головной боли.Таким образом, может происходить сенсибилизация периостальных афферентных нейронов, что, вероятно, способствует изменению обработки боли при патологии. В дополнение к доказательствам того, что периостальные афференты могут быть сенсибилизированы, эти данные также подчеркивают, что некоторые периостальные афференты могут активироваться несколькими стимулами и, следовательно, могут считаться полимодальными. Идея о том, что периостальные афферентные единицы являются полимодальными, не исследовалась ни в одном из других исследований периостальной иннервации, описанных выше.
Реакция на изменения температуры
Сакада и Немото (1972) зафиксировали как множественные, так и одиночные реакции на динамические изменения температуры надкостницы.Это было сделано путем регистрации периостальных нервов при охлаждении раствора в ванне с 32 до 27°C и последующем нагревании до 31°C. В записях при 32°С спонтанной активности не было. Количество единиц, активных в многоединичных записях, увеличивалось по мере применения охлаждения, что свидетельствует о постепенном рекрутировании чувствительных к температуре надкостничных единиц. Частота разрядов записей всего нерва также увеличивалась при охлаждении, что указывает на то, что, по крайней мере, некоторые из этих множественных единиц могут кодировать интенсивность или скорость изменения температуры.Интересно, что единицы, которые реагировали на холод, замолчали, когда температура была изменена на температуру, которая нагревается, а не охлаждается, что позволяет предположить, что они ощущают изменения температуры, а не абсолютную температуру. Это похоже на холодовые рецепторы роговицы (Carr et al., 2003). По мере того, как потепление продолжалось, разные единицы начали реагировать на стимул потепления, и они также были способны кодировать интенсивность или скорость изменения стимула потепления. Таким образом, некоторые периостальные афференты реагируют на безвредное охлаждение, а некоторые — на безвредное согревание.Sakada и Nemoto (1972) дополнительно исследовали температурную чувствительность 93 механически чувствительных надкостничных единиц, выделенных из записей всего нерва, применяя температурные изменения к дискретным рецептивным точкам отдельных единиц на надкостнице. Их реакцию на охлаждение оценивали как минимум до 17°C (иногда даже до 0°C) и на нагревание максимум до 45–50°C, диапазоны которых включают температуры, считающиеся вредными. 20 из 93 из них вообще не реагировали на изменения температуры, даже когда эти изменения были экстремальными.24/93 реагировало на похолодание, но не на потепление, а 19/93 реагировало на потепление, но не на похолодание. 30/93 реагировали как на охлаждение, так и на нагрев. Те, что относятся к последним трем категориям, были протестированы только до точки, где был достигнут порог активации либо для охлаждения, либо для нагревания, и поэтому не совсем ясно, все ли они реагировали на вредный диапазон температур, хотя для многих порог активации произошло при вредных температурах. Следует, однако, отметить, что некоторые механически чувствительные ноцицепторы Aδ в коже имеют очень высокий порог к теплу (средний порог выше 53°C), но могут стать более чувствительными к тепловой стимуляции после сенсибилизации (ноцицепторы Aδ типа I; Treede et al. др., 1995), и поэтому температуры, использованные в исследовании Сакады и Немото, возможно, были недостаточными для активации некоторых единиц, которые, по их словам, обладали чисто механической чувствительностью.
В совокупности эти данные свидетельствуют о том, что многие окончания периостальных свободных волокон реагируют на безвредные и вредные термические раздражители. Однако маловероятно, что физиологические изменения температуры вокруг кости достаточно велики, чтобы активировать эти волокна (Sakada and Nemoto, 1972). Также маловероятно, что они активируются непосредственно патологическими изменениями, так как даже нагревание, вызванное воспалением in vivo (Segale, 1919), не вызвало бы достаточного изменения температуры, чтобы активировать эти рецепторы.Конечно, возможно, что, хотя воспаление не вызывает изменений температуры, которые могли бы непосредственно активировать периостальные волокна, оно может изменять их чувствительность к тепловым раздражителям, так что они становятся более чувствительными к изменениям температуры. Действительно, известно, что воспаление повышает термическую чувствительность первичных афферентных нейронов во многих других тканевых системах (Cervero and Laird, 1999; Ren and Dubner, 1999b). Таким образом, активация периостальных афферентов температурой может быть возможна при крайне аномальных или патологических состояниях.
Резюме/выводы
На рисунке обобщены наши знания о физиологии сенсорных нейронов, иннервирующих надкостницу. Надкостница иннервируется как быстропроводящими единицами большого диаметра с инкапсулированными окончаниями, которые, вероятно, обеспечивают информацию о безвредной чувствительности, так и более медленными проводящими единицами малого диаметра со свободными окончаниями волокон, типичными для ноцицепторов. Активация последнего, вероятно, вызывает боль, возникающую при патологии надкостницы.Их свойства реакции, включая скорость проведения и реакцию на химические раздражители, предполагают роль как в быстрой, острой боли в костях, так и в медленной жгучей боли в костях. Однако есть данные, что некоторые свободные окончания волокон в надкостнице активируются при относительно низких порогах. В коже низкопороговая механическая стимуляция небольшого диаметра, миелиновая (Burgess и Perl, 1967; Burgess et al., 1968; Koltzenburg et al., 1997) и немиелинизированная (Vallbo et al., 1993, 1999; Olausson et al., 2002) волокна производят ощущения, которые были описаны как безболезненные. Вопрос о том, играют ли низкопороговые окончания свободных волокон роль в безвредном механосенсорном восприятии в костях, требует дальнейшего изучения (Rowe et al., 2005), но это кажется маловероятным, поскольку трудно представить себе какой-либо стимул, который можно было бы применить к кости, если бы он не учитывался. болезненный. Альтернативой является то, что они могут быть легко активированы низкопороговой механической стимуляцией надкостницы из-за ее тесной связи с нижележащей твердой костной поверхностью и, следовательно, могут способствовать периостальному восприятию боли.Имеются также доказательства того, что нейроны большого диаметра в других тканевых системах могут способствовать обработке боли (Djouhri and Lawson, 2004). Таким образом, возможно, что инкапсулированные окончания большого диаметра, о которых сообщалось, действительно играют некоторую, пока еще не идентифицированную роль, которая также играет роль в боли в костях.
Реактивные свойства окончаний свободных волокон надкостницы . Отдельные периостальные единицы реагируют на механические, химические и термические раздражители. Механически чувствительные единицы можно классифицировать в соответствии с их порогом и профилем адаптации.Хлорид калия дозозависимо активирует большинство периостальных единиц, но капсаицин и низкий рН активируют их лишь изредка. Некоторые периостальные единицы реагируют на охлаждение и нагрев, другие на охлаждение, но не на нагрев, некоторые на нагрев, но не на охлаждение, а некоторые ни на что.
Костный мозг
Брюссова и Лебеденко (1930; цит. по Furusawa, 1970) изучали реакцию собак при введении физиологического раствора под давлением в полость костного мозга. Наблюдая за артериальным давлением и дыханием, они заметили, что во время инъекции животные испытывали сильное болезненное поведение.Это предполагало, что в полости костного мозга должны быть чувствительные нервы, которые реагируют на повышенное давление. Однако только в двух опубликованных работах изучалась физиология сенсорных нейронов, иннервирующих полость костного мозга (Furusawa, 1970; Seike, 1976). В этих исследованиях проводилась запись целого нерва из ветвей большеберцового нерва, в то время как к полости костного мозга применялись механические, термические или химические раздражители. В этих исследованиях не предпринималось попыток исследовать активность отдельных единиц.На основании гистологических данных исследователи предположили, что записи были исключительно из единиц волокон Aδ и C. Однако скорость проведения не была подтверждена ни в одном из исследований.
Свойства механической реакции
Механические стимулы доставлялись в полость костного мозга путем повышения нормального внутрикостного давления путем введения изотонического раствора в костномозговую полость кости. Нормальное внутрикостное давление и степень повышенного давления контролировали с помощью манометра, присоединенного к системе.У собаки нормальное внутрикостное давление в костномозговой полости большеберцовой кости находилось в пределах 30–50 мм рт. ст., а повышение внутрикостного давления в ~3–5 раз (до 100–130 мм рт. единиц в записи целого нерва (Seike, 1976). Подобные пороги активации для целостной нервной деятельности ранее были описаны Furusawa (1970). Это очень высокие пороги, которые вряд ли могут возникнуть в нормальных физиологических условиях. Однако повышение внутрикостного давления (примерно в 3–5 раз выше нормального внутрикостного давления) наблюдается при патологических состояниях, таких как синдромы внутрикостного нагрубания крови (Lemperg and Arnoldi, 1978; Arnoldi et al., 1980). В этих случаях повышение давления связано с болью, которую можно облегчить с помощью фенестрации, предполагая, что повышенное давление в полости костного мозга вызывает боль.
В исследовании Seike (1976) частота разрядов увеличивалась сразу после начала стимуляции давлением, что свидетельствует о коротком латентном ответе на механические раздражители. Скорость разряда обычно имела тенденцию увеличиваться по мере увеличения давления, и когда применялось стабильное линейное изменение давления, ответ постепенно уменьшался, поскольку рецепторы, по-видимому, медленно адаптировались.Однако следует отметить, что в этих исследованиях не выделялись единичные единицы, поэтому неясно, в какой степени этот адаптационный профиль действительно верен для отдельных сенсорных нейронов, иннервирующих полость костного мозга.
Химическая чувствительность
Только в одном исследовании изучалась реакция сенсорных рецепторов костного мозга на химические вещества (Seike, 1976). Интрамедуллярное введение известных болеутоляющих веществ (хлорид калия, ацетилхолин, гистамин, серотонин и брадикинин) в полость костного мозга приводило к увеличению текущей активности всего нерва в течение нескольких минут после инъекции в концентрациях, сравнимых с теми, которые сообщались для активации мышечных ноцицепторов. Фок и Менс, 1976).Хотя сообщалось, что увеличение текущей активности и латентный ответ в значительной степени зависят от концентрации, используемой для каждого вещества, степень этих изменений количественно не оценивалась.
Термическая чувствительность
Seike (1976) попытался зарегистрировать активность всего нерва в ответ на изменения температуры в полости костного мозга после снижения кровотока, вызванного перевязкой бедренной артерии или применением сосудосуживающих средств. В более ранних работах сообщалось, что эти манипуляции вызывают снижение температуры костномозговой полости (Yamada, Yoshino, 1977).Частота разрядов в записи всего нерва увеличивалась в течение 5 минут после лигатуры, а затем постепенно снижалась до контрольного уровня в течение следующих 15 минут. Несмотря на небольшое снижение температуры через 5 минут, изменение температуры в последующие 15 минут, по-видимому, плохо коррелировало с частотой разрядов. Внутрикостное введение адреналина и норадреналина (вазоконстрикторы) также увеличивало скорость разряда целого нерва. Оба вещества вызывали более значительное понижение температуры в полости костного мозга и большее изменение скорости разряда всего нерва, чем при перевязке бедренной артерии.Как и в случае с перевязкой бедренной артерии, связь между изменением температуры и скоростью разряда после начального периода активации не была ясна. Хотя кажется правдоподобным, что температурные изменения способствуют повышению активности всего нерва, гипоксия также может способствовать реакции. Артериальная окклюзия приводит к тяжелой гипоксии и увеличению воспалительных и/или других химических медиаторов (Paterson et al., 1988). Действительно, было показано, что некоторые медиаторы воспаления изменяют активность всего нерва при воздействии непосредственно на костный мозг (см. выше).Таким образом, изменение температуры в этом исследовании, возможно, не было тем стимулом, который фактически вызывал изменение активности всего нерва, о котором сообщил Seike (1976).
Резюме/выводы
На рисунке обобщены наши знания о физиологии сенсорных нейронов, иннервирующих костный мозг. В отличие от надкостницы мало что известно об активности афферентных нейронов в полости костного мозга. Хотя сообщалось об активности всего нерва после механической, химической и, возможно, термической стимуляции полости костного мозга, реакция отдельных единиц не исследовалась.Таким образом, неясно, реагируют ли и как отдельные нейроны, иннервирующие полость костного мозга, на механические, химические или термические стимулы, или же они реагируют на множественные типы стимулов, как в случае с полимодальными ноцицепторами в других тканевых системах. Также неизвестно, могут ли они быть сенсибилизированы медиаторами воспаления или другими химическими раздражителями.
Активность всего нерва после механической, химической и термической стимуляции костного мозга . Активность всего нерва увеличивается в ответ на механическую стимуляцию за счет увеличения внутрикостного давления.Химическая стимуляция дозозависимо увеличивает активность всего нерва. Изменения температуры, вызванные снижением кровотока, по-видимому, влияют на активность всего нерва, но это может быть связано с другими факторами, связанными с нарушением кровоснабжения костного мозга (например, ишемией). Отдельные единицы не тестировались на реакцию на стимуляцию костного мозга.
Физиология центральных проводящих путей, кодирующих информацию о боли в костях
Спинной мозг
Лишь в нескольких исследованиях на животных была предпринята попытка задокументировать физиологию спинномозговых нейронов, участвующих в ноцицепции костей.Большинство из них основывались на исследованиях зависимой от активности экспрессии Fos. Fos представляет собой белок, который продуцируется в ядре клеток после экспрессии гена c-fos немедленного начала (Coggeshall, 2005), и известно, что вредные стимулы индуцируют экспрессию c-fos в нейронах, несущих этот ген. Таким образом, присутствие белка Fos, который может быть помечен иммуногистохимически, может быть использовано для определения местоположения нейронов, физиологически активированных вредными стимулами. Острая болезненная механическая стимуляция кости, применяемая путем сверления кости и повышения внутрикостного давления большеберцовой кости, вызывает увеличение экспрессии Fos в ипсилатеральном поверхностном, но не глубоком дорсальном роге спинного мозга (Ivanusic, 2008; Williams and Ivanusic, 2008). .Тот же паттерн активности наблюдался в исследованиях экспрессии Fos после острой болевой стимуляции кожной ткани (Dai et al., 2001; Jinks et al., 2002) и подразумевает, что спинальные механизмы, которые опосредуют острую боль кожного и костного происхождения, имеют общие некоторые общие черты. Данные указывают на то, что поверхностные задние рога спинного мозга представляют интерес в исследованиях острой боли в костях, но неизвестно, отличается ли этот паттерн экспрессии Fos при воспалительном стимуле.Действительно, когда воспалительные агенты воздействуют на другие тканевые системы (такие как кожа), картина смещается таким образом, что наиболее активными становятся глубокие задние рога (Coggeshall, 2005). В животных моделях боли, вызванной раком костей, и боли при переломах скелета, экспрессия Fos увеличена как в глубоких, так и в поверхностных задних рогах, и существует значительная положительная корреляция между экспрессией Fos и разрушением кости (Schwei et al. , 1999; Хименес-Андраде и др., 2007). Интересно, что увеличение Fos наблюдалось в поверхностных дорсальных рогах в этих исследованиях только после того, как обычно безвредные стимулы доставлялись к бедренной кости путем легкой механической стимуляции (пальпация).У нормальных животных для индукции экспрессии c-Fos в поверхностных дорсальных нейронах требуется болезненная кожная стимуляция (Hunt et al., 1987; Abbadie and Besson, 1993; Abbadie et al., 1994; Honore et al., 1995; Doyle and Хант, 1999). Это говорит о том, что сенсибилизация спинномозговых нейронов происходит при боли, вызванной раком кости, и боли при переломах.
Восходящие пути
Williams и Ivanusic (2008) использовали экспрессию Fos в сочетании с ретроградным отслеживанием для идентификации восходящих мишеней нейронов задних рогов, активируемых вредной механической стимуляцией, осуществляемой при сверлении кости.Они сообщили о вовлечении спинопарабрахиального пути, но не спиноталамического тракта или постсинаптического дорсального столба в этой модели острой костной ноцицепции. Этот паттерн активации отличается от наблюдаемого после острой болезненной механической стимуляции кожных и висцеральных тканей (Palecek et al., 2003). Нейроны спинопарабрахиальной проекции происходят преимущественно из пластинки I спинного рога спинного мозга и проецируются в основном в контралатеральное латеральное парабрахиальное ядро (Kitamura et al., 1993; Гаурио и Бернар, 2002 г.; Альмарестани и др., 2007). Латеральное парабрахиальное ядро связано с несколькими областями мозга, участвующими в аффективно-мотивационных аспектах ноцицептивной обработки и гомеостатическими реакциями на ноцицептивные стимулы, включая миндалевидное тело, ядро солитарного тракта, вентролатеральный продолговатый мозг, околоводопроводное серое вещество, медиальный таламус и гипоталамус (Bianchi). и др., 1998; Альмарестани и др., 2007). Это усиливает связь, соответствующую сильному аффективному компоненту боли в костях.Хотя Уильямс и Иванусик не представили доказательств участия ни спиноталамического тракта, ни постсинаптических путей дорсального столба в ноцицепции кости, они не могли исключить возможность того, что эти пути могут быть вовлечены в модели животных, характеризующихся воспалительным или хроническим раком. индуцированная боль. Как отмечалось выше, модели такого типа характеризуются большей экспрессией Fos в клетках глубокого дорсального рога и, следовательно, с большей вероятностью проецируются через спиноталамический тракт или постсинаптические пути дорсального столба, поскольку большинство клеток этих путей происходит из глубокий задний рог поясничного отдела спинного мозга крысы.
Кора
Понимание физиологии корковых нейронов, активируемых вредными раздражителями, важно, поскольку кора играет решающую роль в восприятии боли. Только одно исследование показало активность коры, связанную со стимуляцией костных афферентных нейронов (Ivanusic et al., 2009). Они показали, что сенсорная информация от кости достигает дискриминационных областей соматосенсорной коры путем электрической стимуляции нерва плечевой кости кошки и регистрации вызванных потенциалов на поверхности первичной (SI) и вторичной (SII) соматосенсорной коры.Важно отметить, что нерв, идущий к кошачьей плечевой кости, содержит только миелинизированные и немиелинизированные нервные волокна малого диаметра, распределение по размерам (Ivanusic et al., 2006) и скорость проведения (Mahns et al., 2006) которых соответствуют волокнам Aδ и C. классификации и, следовательно, роль в ноцицепции. Корковые ответы, вызванные стимуляцией Aδ в других типах тканей, имеют относительно короткую латентность (в пределах 50 мс) и, как полагают, отражают механизмы, связанные с быстрой, острой болью, в то время как корковые ответы, вызванные стимуляцией С-волокон, имеют более длительный латентный период (50–300 мс). ) и, как полагают, отражают механизмы, связанные с медленной жгучей болью (Bromm and Treede, 1984; Willis, 1985).Интересно, что латентный период (6–11 мс) до начала корковых ответов SI и SII при стимуляции нерва плечевой кости кошки согласуется с активацией волокон Aδ в периферическом нерве и может отражать механизм быстрого, резкого, и четко локализованная боль в костях, которая обычно ощущается при периостальной стимуляции или при прорывной боли, связанной с раком кости. Увеличивая интенсивность электрической стимуляции, авторы смогли продемонстрировать более сильную корковую активацию, подразумевая, что нейроны в SI и SII способны кодировать интенсивность стимулов, воздействующих на кость.Они предположили, что небольшие стрессовые переломы вряд ли вызовут сильную боль, поскольку интенсивность кортикальной активности может быть недостаточной, в то время как большие переломы или метастазы, скорее всего, вызовут сильную боль. Этот механизм кодирования интенсивности вредных раздражителей хорошо задокументирован в исследованиях кожной системы на животных (Kenshalo et al., 1988, 2000; Chudler et al., 1990), а результаты исследований функциональной визуализации показывают, что он также вероятно применимо к людям (Porro et al., 1998; Когхилл и др., 1999). Однако исследователям не удалось обнаружить длительные латентные корковые реакции (50–300 мс), которые соответствовали бы активации С-волокон в нерве, ведущем к кошачьей плечевой кости. Хотя они предоставили доказательства того, что это может быть связано с торможением корковой реактивности после первоначального ответа Aδ, они не могли исключить возможность того, что проекции С-волокон на SI и SII слишком распространены, чтобы генерировать фокальные вызванные потенциалы того типа, который они могли бы регистрировать. , или что С-волокно, входящее от нерва в кошачью плечевую кость, вообще не достигает SI и SII.Также возможно, что вход С-волокна вместо этого проецируется на другие области коры, такие как островок, или подкорковые области, включая миндалину, ядро солитарного тракта, вентролатеральный мозг, периакведуктальный серый цвет, таламус и гипоталамус, которые, как сообщается, иметь важное значение в аффективных, эмоциональных аспектах боли.
Патофизиологические изменения в животных моделях боли в костях
Ряд животных моделей патологии костей был разработан и используется для изучения патофизиологических и нейрохимических изменений как в периферических, так и в центральных нейронах, которые способствуют боли в костях.Наиболее распространенной используемой моделью является модель боли, вызванной раком кости, которая обычно включает инокуляцию бедренной или большеберцовой кости грызунов опухолевыми клетками (Schwei et al., 1999; Medhurst et al., 2002), но модели боли, вызванной переломом кости также распространены (Freeman et al., 2008; Minville et al., 2008).
Некоторые провоспалительные цитокины (IL-1β, TNFα, IL-6 и TGFβ) и медиаторы воспаления (CGRP) повышаются в DRG в ответ на рак костей и переломы (Kon et al., 2001; Cho et al. ., 2002; Канг и др., 2005 г.; Рандл и др., 2006; Баамонде и др., 2007 г.; Гейс и др., 2010; Фанг и др., 2015 г.; Хансен и др., 2016). У животных с болью, вызванной раком костей, также повышена экспрессия DRG нескольких мембранных рецепторов/каналов (TRPV1, P2X3, ASIC1a/1b, Nav 1.8 и Nav 1.9), которые, как известно, участвуют в передаче ноцицептивных стимулов и/ или в возбудимости ноцицепторов (Nagae et al., 2007; Niiyama et al., 2007; Han et al., 2012; Qiu et al., 2012; Liu et al., 2013; Ли и др., 2014). Введение селективных антагонистов или антисмысловых олигодезоксинуклеотидов против некоторых из этих каналов/рецепторов ослабляет болевые ощущения у животных с болью при раке кости, еще больше усиливая роль этих молекул при боли в костях (Ghilardi et al., 2005; Gonzalez-Rodriguez et al. , 2009; Каан и др., 2010; Мяо и др., 2010). В других тканевых системах медиаторы воспаления сенсибилизируют периферические ноцицепторы, и, вероятно, участвуют изменения в мембранных рецепторах/каналах (Kidd and Urban, 2001).Однако нет доказательств того, что какой-либо из этих медиаторов воспаления непосредственно активирует или повышает чувствительность костных ноцицепторов или что изменения в экспрессии различных ионных каналов и рецепторов изменяют физиологию или функцию костных афферентных нейронов. Кроме того, изменения, наблюдаемые в DRG, не были локализованы в сенсорных нейронах, иннервирующих кость; экспрессию белка анализировали с использованием Вестерн-блоттинга целых лизатов DRG или количественно определяли с помощью иммуногистохимии, выполненной без ретроградного мечения, чтобы подтвердить, что нейроны DRG иннервируют кость.Таким образом, прямых доказательств роли ионных каналов, рецепторов и медиаторов воспаления в модулировании активности периферических костных афферентных нейронов и в регуляции боли при костной патологии до сих пор нет.
Некоторые прямые доказательства сенсибилизации периферических ноцицепторов при боли, вызванной раком кости, были предоставлены Cain (Cain et al., 2001) и Uhelski (Uhelski et al., 2013). Они сообщили о повышении спонтанной активности и снижении теплового (но не механического) порога в регистрируемых на периферии афферентных волокнах С у животных, у которых развилась поведенческая чувствительность в ответ на инъекцию опухолевых клеток в пяточную кость и вокруг нее, но не у контрольных животных.Однако в обоих этих исследованиях опухолевые клетки не были четко ограничены костью, а зарегистрированные С-волокна были кожными афферентными, поэтому сенсибилизация происходила не с костными афферентными нейронами, а скорее с кожными афферентными нейронами, иннервирующими окружающую кожу. Эти исследования более важны для понимания вторичной или отраженной боли, связанной с костной патологией, чем боли, воспринимаемой при стимуляции самой кости.
В ряде исследований также сообщалось об изменениях в центральной нервной системе, вызванных патологией костей.Повышенная экспрессия спинального SP, CGRP и других медиаторов воспаления (TNF, IL-1, IL-6, CCL2 и фактора роста нервов) наблюдается в спинном мозге крыс с болью, вызванной переломами и раком кости (Zhao и др., 2013; Ши и др., 2015). Рак кости вызывает гипертрофию астроцитов в спинном мозге и повышение экспрессии прогипералгетического пептида динорфина и c-Fos в нейронах второго порядка глубоких дорсальных рогов (Schwei et al., 1999; Honore et al., 2000b; Shen). и другие., 2014). Рак кости также вызывает изменения свойств физиологического ответа нейронов второго порядка в задних рогах спинного мозга. В поверхностных дорсальных рогах животных с раком кости наблюдается усиление спинальной синаптической передачи, более высокая доля клеток с широким динамическим диапазоном и увеличенные размеры рецептивного поля в клетках с широким динамическим диапазоном (Urch et al., 2003; Donovan-Rodriguez et al. ., 2004; Янагисава и др., 2010). Вместе эти изменения приводят к более возбудимому спинному мозгу. Они типичны для центральной сенсибилизации и могут лежать в основе развития хронической боли в костях.
Заключительные выводы
Во многих исследованиях сообщалось о существовании сенсорных нейронов, иннервирующих надкостницу и полость костного мозга, и стало ясно, что большинство из них имеют морфологию и молекулярный фенотип, соответствующие роли в ноцицепции. Однако о физиологии этих нейронов известно очень мало. Надкостнице уделялось больше внимания по сравнению с костным мозгом, что отражает более легкий доступ к надкостнице для экспериментальной оценки, чем к полости костного мозга.Электрофизиологические записи сенсорных нейронов как в надкостнице, так и в костном мозге подтвердили, что они оба содержат ноцицепторы, которые, вероятно, обеспечивают ЦНС информацией о боли в костях. Надкостница (но не костный мозг) также иннервируется нейронами, обладающими свойствами, предполагающими, что они могут быть рецепторами растяжения или придавать безвредную чувствительность, хотя неясно, имеет ли последнее отношение к стимулам, воздействующим на кость. Имеются лишь ограниченные доказательства того, что афферентные нейроны периферических костей могут быть сенсибилизированы или что они могут быть активированы несколькими типами стимулов, и в настоящее время это существует только частично для периостальных единиц.Очевидно, что в центральной нервной системе нейроны задних рогов спинного мозга могут активироваться вредными стимулами, воздействующими на кость. Некоторые из них могут быть сенсибилизированы при патологических состояниях и могут способствовать вторичной гипералгезии или отраженной боли, связанной с костной патологией. Существует лишь несколько исследований восходящих путей и задействованных корковых территорий. Хотя они дают некоторые подсказки относительно того, как информация о боли в костях централизованно кодируется, их необходимо расширить, чтобы углубить наше понимание других задействованных центральных областей.Нам предстоит еще многое узнать о физиологии костных афферентных нейронов и их центральных проекций, прежде чем мы приблизимся к пониманию того, как мы думаем о боли в костях и справляемся с ней.
Вклад авторов
SN и JI внесли свой интеллектуальный вклад в разработку этого обзора, включая составление проекта и редактирование рукописи. Оба одобрили окончательную версию для публикации.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
- Аббади С., Бессон Дж. М. (1993). Экспрессия C-fos в поясничном отделе спинного мозга крыс после периферической стимуляции у крыс с артритом, индуцированным адъювантом, и у нормальных крыс. Мозг Res.
607, 195–204. 10.1016/0006-8993(93)
-O [PubMed] [CrossRef] [Google Scholar]
- Аббади К., Оноре П., Бессон Дж. М. (1994). Интенсивная холодовая вредная стимуляция задней лапы крыс индуцирует экспрессию c-fos в нейронах поясничного отдела спинного мозга. неврология 59, 457–468. 10.1016/0306-4522(94)-2 [PubMed] [CrossRef] [Google Scholar]
- Almarestani L., Уотерс С.М., Краузе Дж.Е., Беннетт Г.Дж., Рибейро-Да-Сильва А. (2007). Морфологическая характеристика нейронов пластинки I задних рогов спинного мозга, проецирующихся на парабрахиальное ядро крысы. Дж. Комп. Нейрол. 504, 287–297. 10.1002/cne.21410 [PubMed] [CrossRef] [Google Scholar]
- Arnoldi CC (1990). Внутрикостные нагрубание-болевые синдромы. Патомеханизм боли, Bone Circulation and Bone Necrosis, eds Arlet J., Mazières B. (Berlin; Heidelberg: Springer;), 253–259. 10.1007/978-3-642-73644-5_52 [CrossRef] [Google Scholar]
- Арнольди С.К., Джурхуус Дж. К., Хеерфордт Дж., Карле А. (1980). Внутрикостная флебография, измерение внутрикостного давления и 99m ТС-полифосфатсцинтиграфия у больных с различными болезненными состояниями в тазобедренном и коленном суставах. Акта Ортоп. Сканд. 51, 19–28. 10.3109/174536780089
- [PubMed] [CrossRef] [Google Scholar]
- Асо К., Икеучи М., Изуми М., Сугимура Н., Като Т., Усида Т. и др. . (2014). Ноцицептивный фенотип нейронов ганглиев задних корешков, иннервирующих субхондральную кость в коленных суставах крыс.Евро. Дж. Пейн 18, 174–181. 10.1002/j.1532-2149.2013.00360.x [PubMed] [CrossRef] [Google Scholar]
- Баамонде А., Курто-Рейес В., Хуарес Л., Меана А., Идальго А., Менендес Л. (2007 г. ). Антигипералгезические эффекты, вызванные антагонистом рецептора IL-1 анакинрой, и повышение уровня IL-1бета у воспаленных мышей и мышей с остеосаркомой. Жизнь наук. 81, 673–682. 10.1016/j.lfs.2007.07.003 [PubMed] [CrossRef] [Google Scholar]
- Бьянки Р., Корсетти Г., Роделла Л., Тредичи Г., Джоя М. (1998).Супраспинальные соединения и паттерны окончания парабрахиального комплекса, определенные методом отслеживания биоцитинового антероградного тракта у крысы. Дж. Анат. 193 (часть 3), 417–430. 10.1046/j.1469-7580.1998.19330417.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бьюрхольм А., Крейкбергс А., Бродин Э., Шульцберг М. (1988). Вещество P- и CGRP-иммунореактивные нервы в кости. пептиды 9, 165–171. 10.1016/0196-9781(88)-X [PubMed] [CrossRef] [Google Scholar]
- Bove S.E., Flatters S.J., Inglis J.J., Mantyh P.W. (2009). Новые достижения в лечении скелетно-мышечной боли. Мозг Res. преп. 60, 187–201. 10.1016/j.brainresrev.2008.12.012 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Брюсова С. С., Лебеденко В. В. (1930). Zur Schmerzleitungsfähigkeit der Gefäße. Z. Gesamte Exp. Мед. 69, 29–40. 10.1007/BF02622549 [CrossRef] [Google Scholar]
- Bromm B., Treede RD (1984). Разряды нервных волокон, церебральные потенциалы и ощущения, вызванные стимуляцией лазером CO2.Гум. Нейробиол. 3, 33–40. [PubMed] [Google Scholar]
- Burgess PR, Perl ER (1967). Миелиновые афферентные волокна специфически реагируют на вредное раздражение кожи. Дж. Физиол. (Лонд). 190, 541–562. 10.1113/jphysiol.1967.sp008227 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Burgess PR, Perl ER (1973). Кожные механорецепторы и ноцицепторы, в Handbook of Sensory Physiology, Vol. II, изд. Игго А. (Нью-Йорк, штат Нью-Йорк: Springer-Verlag;), 29–78. [Google Scholar]
- Берджесс П.Р., Пети Д., Уоррен Р. М. (1968). Типы рецепторов волосистой кожи кошек снабжены миелинизированными волокнами. Дж. Нейрофизиол. 31, 833–848. [PubMed] [Google Scholar]
- Каин Д. М., Вачник П. В., Эйкмайер Л., Бейтц А., Уилкокс Г. Л., Симона Д. А. (2001). Функциональные взаимодействия между опухолью и периферическим нервом в модели онкологической боли у мышей. Боль Мед. 2, 15–23. 10.1046/j.1526-4637.2001.002001015.x [PubMed] [CrossRef] [Google Scholar]
- Calvo W. (1968). Иннервация костного мозга лабораторных животных.Являюсь. Дж. Анат. 123, 315–328. 10.1002/aja.1001230206 [PubMed] [CrossRef] [Google Scholar]
- Карр Р. В., Пианова С., Фернандес Дж., Фэллон Дж. Б., Бельмонте К., Брок Дж. А. (2003). Влияние нагревания и охлаждения на импульсы нервных окончаний, регистрируемые холодочувствительными рецепторами роговицы морской свинки. J. Gen. Physiol. 121, 427–439. 10.1085/jgp.200308814 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Castaneda-Corral G., Jimenez-Andrade J.M., Bloom A.P., Taylor R.N., Mantyh W.Г., Качмарска М.Дж. и соавт. . (2011). Большинство миелинизированных и немиелинизированных чувствительных нервных волокон, иннервирующих кость, экспрессируют киназу рецептора тропомиозина А. Неврология 178, 196–207. 10.1016/j.neuroscience.2011.01.039 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Серверо Ф., Лэрд Дж. М. (1999). Висцеральная боль. Ланцет 353, 2145–2148. 10.1016/S0140-6736(99)01306-9 [PubMed] [CrossRef] [Google Scholar]
- Чо Т.Дж., Герстенфельд Л.С., Эйнхорн Т.А. (2002). Дифференциальная временная экспрессия членов суперсемейства трансформирующих факторов роста бета во время заживления переломов у мышей.Дж. Боун Шахтер. Рез. 17, 513–520. 10.1359/jbmr.2002.17.3.513 [PubMed] [CrossRef] [Google Scholar]
- Chrastil J., Sampson C., Jones K.B., Higgins T.F. (2013). Послеоперационное введение опиоидов ингибирует заживление костей на животных моделях. клин. Ортоп. Относ. Рез. 471, 4076–4081. 10.1007/s11999-013-3232-z [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Чудлер Э. Х., Антон Ф., Дубнер Р., Кеншало Д. Р., мл. (1990). Ответы ноцицептивных нейронов SI у обезьян и болевые ощущения у людей, вызванные вредной тепловой стимуляцией: влияние межстимульного интервала.Дж. Нейрофизиол. 63, 559–569. [PubMed] [Google Scholar]
- Coggeshall RE (2005). Fos, ноцицепция и задний рог. Прог Нейробиол 77, 299–352. 10.1016/j.pneurobio.2005.11.002 [PubMed] [CrossRef] [Google Scholar]
- Когхилл Р. К., Санг С. Н., Майсог Дж. М., Ядарола М. Дж. (1999). Обработка интенсивности боли в человеческом мозгу: двусторонний распределенный механизм. Дж. Нейрофизиол. 82, 1934–1943. [PubMed] [Google Scholar]
- Купер Р. Р., Милграм Дж. В., Робинсон Р.А. (1966). Морфология остеона. Электронно-микроскопическое исследование. J. Хирургия суставов костей. Являюсь. 48, 1239–1271. [PubMed] [Google Scholar]
- Дай Ю., Ивата К., Кондо Э., Моримото Т., Ногучи К. (2001). Избирательное увеличение экспрессии Fos в нейронах спинного мозга после постепенной термической стимуляции у крыс с экспериментальной мононевропатией. Боль 90, 287–296. 10.1016/S0304-3959(00)00411-5 [PubMed] [CrossRef] [Google Scholar]
- Де Кастро Ф. (1925). Техника для окрашивания системы нервов, которая лучше всего подходит для кожи.Траб. лаборатория биол. ун-т Мадрид 23, 427–447. [Google Scholar]
- Диксон А. Д. (1963). Ультраструктура нервных волокон в тройничном узле крысы. Дж. Ультраструктур. Рез. 8, 107–121. 10.1016/S0022-5320(63)80023-4 [PubMed] [CrossRef] [Google Scholar]
- Джухри Л., Лоусон С. Н. (2004). Ноцицептивные первичные афферентные нейроны A-волокна: обзор частоты и свойств по отношению к другим афферентным нейронам A-волокна у млекопитающих. Мозг Res. Мозг Res. преп. 46, 131–145. 10.1016/j.brainresrev.2004.07.015 [PubMed] [CrossRef] [Google Scholar]
- Донован-Родригес Т., Дикенсон А. Х., Урч С. Е. (2004). Реакции нейронов поверхностных дорсальных рогов и появление поведенческой гипералгезии в крысиной модели боли в костях, вызванной раком. Неврологи. лат. 360, 29–32. 10.1016/j.neulet.2004.01.048 [PubMed] [CrossRef] [Google Scholar]
- Doyle CA, Hunt SP (1999). Нейроны, экспрессирующие рецептор вещества P (нейрокинин-1), в пластинке I спинного мозга кодируют интенсивность вредной стимуляции: исследование c-Fos на крысах.неврология 89, 17–28. 10.1016/S0306-4522(98)00276-0 [PubMed] [CrossRef] [Google Scholar]
- Дункан С. П., Шим С. С. (1977). Ж. Эдуард Самсон Адрес: вегетативная иннервация кости. Экспериментальное исследование внутрикостного адренергического сосудистого нерва у кролика. J. Хирургия суставов костей. бр. 59, 323–330. [PubMed] [Google Scholar]
- Fang D., Kong L.Y., Cai J., Li S., Liu X.D., Han J.S., et al. . (2015). Опосредованная интерлейкином-6 функциональная активация рецепторов TRPV1 в нейронах ганглиев задних корешков посредством активации сигнального пути JAK/PI3K: роль в развитии боли при раке кости на модели крыс.Боль 156, 1124–1144. 10.1097/j.pain.0000000000000158 [PubMed] [CrossRef] [Google Scholar]
- Фок С., Менсе С. (1976). Возбуждающие эффекты 5-гидрокситриптамина, гистамина и ионов калия на афферентные единицы мышечной группы IV: сравнение с брадикинином. Мозг Res.
105, 459–469. 10.1016/0006-8993(76)
-X [PubMed] [CrossRef] [Google Scholar]
- Freeman K.T., Koewler N.J., Jimenez-Andrade J.M., Buus R.J., Herrera M.B., Martin C.D., et al. . (2008). Модель боли при переломе у крысы: адаптация модели закрытого перелома бедренной кости для изучения скелетной боли.Анестезиология 108, 473–483. 10.1097/ALN.0b013e3181649351 [PubMed] [CrossRef] [Google Scholar]
- Furusawa S. (1970). Нейрофизиологическое исследование чувствительности костного мозга. Ниппон Сейкейгека Гаккай Засси 44, 365–370. [PubMed] [Google Scholar]
- Гайда М., Литвин Дж. А., Адриансен Д., Тиммерманс Дж. П., Чихоцкий Т. (2004). Сегментарное распределение и морфометрические особенности первичных сенсорных нейронов, проецирующихся на надкостницу большеберцовой кости у крыс. Фолиа гистохим. Цитобиол.42, 95–99. 10.5603/4656 [PubMed] [CrossRef] [Google Scholar]
- Gauriau C., Bernard JF (2002). Пути боли и парабрахиальные цепи у крысы. Эксп. Физиол. 87, 251–258. 10.1113/eph8702357 [PubMed] [CrossRef] [Google Scholar]
- Geis C., Graulich M., Wissmann A., Hagenacker T., Thomale J., Sommer C., et al. . (2010). Вызванное болевое поведение и активация спинальной глии зависят от рецептора фактора некроза опухоли 1 и 2 в мышиной модели боли при раке кости. неврология 169, 463–474.10.1016/j.neuroscience.2010.04.022 [PubMed] [CrossRef] [Google Scholar]
- Ghilardi J. R., Rohrich H., Lindsay T. H., Sevcik M. A., Schwei M. J., Kubota K., et al. . (2005). Селективная блокада рецептора капсаицина TRPV1 ослабляет боль при раке кости. Дж. Нейроски. 25, 3126–3131. 10.1523/JNEUROSCI.3815-04.2005 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Gonzalez-Rodriguez S., Pevida M., Roques BP, Fournie-Zaluski MC, Hidalgo A., Menendez L., и другие. . (2009).Участие энкефалинов в ингибировании термической гипералгезии, вызванной остеосаркомой, вызванной блокадой периферических P2X3-рецепторов. Неврологи. лат. 465, 285–289. 10.1016/j.neulet.2009.09.015 [PubMed] [CrossRef] [Google Scholar]
- Grigg P., Schaible HG, Schmidt RF (1986). Механическая чувствительность афферентов группы III и IV от заднего суставного нерва в норме и при воспалении кошачьего колена. Дж. Нейрофизиол. 55, 635–643. [PubMed] [Google Scholar]
- Гронблад М., Лиези П., Коркала О., Карахарью Э., Полак Дж. (1984). Иннервация надкостницы костей человека пептидергическими нервами. Анат. Рек. 209, 297–299. 10.1002/ar.10920
- [PubMed] [CrossRef] [Google Scholar]
- Haegerstam GA (2001). Патофизиология боли в костях: обзор. Акта Ортоп. Сканд. 72, 308–317. 10.1080/00016470152846682 [PubMed] [CrossRef] [Google Scholar]
- Halvorson K.G., Kubota K., Sevcik M.A., Lindsay T.H., Sotillo J.E., Ghilardi J.R., et al. . (2005). Блокирующие антитела к фактору роста нервов ослабляют скелетную боль, вызванную ростом клеток опухоли предстательной железы в костях.Рак Рез. 65, 9426–9435. 10.1158/0008-5472.CAN-05-0826 [PubMed] [CrossRef] [Google Scholar]
- Han Y., Li Y., Xiao X., Liu J., Meng X. L., Liu F. Y., et al. . (2012). Формальдегид активирует TRPV1 через сигнальные пути MAPK и PI3K в крысиной модели боли при раке костей. Неврологи. Бык. 28, 165–172. 10.1007/s12264-012-1211-0 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Hansen R.R., Vacca V., Pitcher T., Clark A.K., Malcangio M. (2016). Роль внеклеточного пептида, родственного гену кальцитонина, в механизмах боли в костях спинного мозга, вызванной раком.Боль 157, 666–676. 10.1097/j.pain.0000000000000416 [PubMed] [CrossRef] [Google Scholar]
- Hill E.L., Elde R. (1988). Связанные с геном кальцитонина пептид-иммунореактивные нервные волокна в надкостнице нижней челюсти крысы: свидетельство первичного афферентного происхождения. Неврологи. лат. 85, 172–178. 10.1016/0304-3940(88) -3 [PubMed] [CrossRef] [Google Scholar]
- Hill E.L., Elde R. (1991). Распределение CGRP-, VIP-, D бета H-, SP- и NPY-иммунореактивных нервов в надкостнице крысы.Сотовые Ткани Res. 264, 469–480. 10.1007/BF00319037 [PubMed] [CrossRef] [Google Scholar]
- Hohmann E.L., Elde R.P., Rysavy J.A., Einzig S., Gebhard R.L. (1986). Иннервация надкостницы и кости симпатическими вазоактивными интестинальными пептидсодержащими нервными волокнами. Наука 232, 868–871. 10.1126/science.3518059 [PubMed] [CrossRef] [Google Scholar]
- Холмс Д. (2012). Обезболивающие против NGF снова в ходу? Нац. Преподобный Друг Дисков. 11, 337–338. 10.1038/nrd3732 [PubMed] [CrossRef] [Google Scholar]
- Оноре П., Буритова Дж., Бессон Дж. М. (1995). Вызванная карагенином экспрессия c-Fos в поясничном отделе спинного мозга крыс: эффекты индометацина. Евро. Дж. Фармакол. 272, 249–259. 10.1016/0014-2999(94)00656-R [PubMed] [CrossRef] [Google Scholar]
- Оноре П., Люгер Н. М., Сабино М. А., Швей М. Дж., Роджерс С. Д., Мах Д. Б. и др. . (2000а). Остеопротегерин блокирует вызванное раком кости разрушение скелета, скелетную боль и связанную с болью нейрохимическую реорганизацию спинного мозга. Нац. Мед. 6, 521–528.10.1038/74999 [PubMed] [CrossRef] [Google Scholar]
- Оноре П., Мантых П. В. (2000). Боль при раке костей: от механизма к модели и терапии. Боль Мед. 1, 303–309. 10.1046/j.1526-4637.2000.00047.x [PubMed] [CrossRef] [Google Scholar]
- Оноре П., Роджерс С. Д., Швей М. Дж., Салак-Джонсон Дж. Л., Люгер Н. М., Сабино М. С. и др. . (2000б). Каждая мышиная модель воспалительной, невропатической и раковой боли генерирует уникальный набор нейрохимических изменений в спинном мозге и сенсорных нейронах.неврология 98, 585–598. 10.1016/S0306-4522(00)00110-X [PubMed] [CrossRef] [Google Scholar]
- Хант С. П., Пини А., Эван Г. (1987). Индукция c-fos-подобного белка в нейронах спинного мозга после сенсорной стимуляции. Природа 328, 632–634. 10.1038/328632a0 [PubMed] [CrossRef] [Google Scholar]
- Hurrell D. (1937). Иннервация кости. Дж. Анат. 72, 54–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Inman V., Saunders J. (1944). Отраженная боль от скелетных структур.Дж. Нерв. Мент. Дис. 99, 660–667. 10.1097/00005053-194405000-00023 [CrossRef] [Google Scholar]
- Ivanusic J. (2009). Размер, нейрохимия и сегментарное распределение сенсорных нейронов, иннервирующих большеберцовую кость крысы. Дж. Комп. Нейрол. 517, 276–283. 10.1002/cne.22160 [PubMed] [CrossRef] [Google Scholar]
- Ivanusic JJ (2008). Паттерн экспрессии Fos в спинном дорсальном роге после острой вредной механической стимуляции кости. Евро. Дж. Пейн 12, 895–899. 10.1016/j.ejpain.2007.12.017 [PubMed] [CrossRef] [Google Scholar]
- Иванушич Дж. Дж., Манс Д. А., Сахай В., Роу М. Дж. (2006). Отсутствие чувствительных волокон большого диаметра в нерве кошачьей плечевой кости. Дж. Анат. 208, 251–255. 10.1111/j.1469-7580.2006.00519.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Ivanusic JJ, Sahai V., Mahns DA (2009). Корковое представление сенсорных сигналов, исходящих от кости. Мозг Res. 1269, 47–53. 10.1016/j.brainres.2009.03.001 [PubMed] [CrossRef] [Google Scholar]
- Хименес-Андраде Дж.M., Mantyh W.G., Bloom A.P., Xu H., Ferng A.S., Dussor G., et al. . (2010). Фенотипически ограниченный набор первичных афферентных нервных волокон иннервирует кость по сравнению с кожей: терапевтическая возможность для лечения скелетной боли. Кость 46, 306–313. 10.1016/j.bone.2009.09.013 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Jimenez-Andrade JM, Martin C.D., Koewler N.J., Freeman K.T., Sullivan L.J., Halvorson K.G., et al. . (2007). Секвестрирующая терапия фактором роста нервов ослабляет незлокачественную скелетную боль после перелома.Боль 133, 183–196. 10.1016/j.pain.2007.06.016 [PubMed] [CrossRef] [Google Scholar]
- Джинкс С.Л., Саймонс С.Т., Десирье Дж.М., Карстенс М.И., Антонини Дж.Ф., Карстенс Э. (2002). Индукция C-fos в поверхностных спинных рогах крыс после нанесения на кожу вредных химических или механических раздражителей. Эксп. Мозг Res. 145, 261–269. 10.1007/s00221-002-1128-3 [PubMed] [CrossRef] [Google Scholar]
- Каан Т. К., Ип П. К., Патель С., Дэвис М., Маршан Ф., Кокейн Д. А. и др.. (2010). Системная блокада рецепторов P2X3 и P2X2/3 ослабляет болевые ощущения при раке костей у крыс. Головной мозг 133, 2549–2564. 10.1093/brain/awq194 [PubMed] [CrossRef] [Google Scholar]
- Кан Ю., Хе В., Талли С., Гупта Г. П., Серганова И., Чен С. Р. и др. . (2005). Метастазирование рака молочной железы в кости, опосредованное опухолевым супрессорным путем smad. проц. Натл. акад. науч. США. 102, 13909–13914. 10.1073/pnas.0506517102 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Kenshalo D.Р., младший, Чудлер Э. Х., Антон Ф., Дубнер Р. (1988). Ноцицептивные нейроны SI участвуют в процессе кодирования, с помощью которого обезьяны воспринимают интенсивность вредной тепловой стимуляции. Мозг Res. 454, 378–382. 10.1016/0006-8993(88) -4 [PubMed] [CrossRef] [Google Scholar]
- Кеншало Д. Р., Ивата К., Шолас М., Томас Д. А. (2000). Свойства реакции и организация ноцицептивных нейронов в области 1 первичной соматосенсорной коры обезьяны. Дж. Нейрофизиол. 84, 719–729. [PubMed] [Google Scholar]
- Кидд Б.Л., Урбан Л.А. (2001). Механизмы воспалительной боли. бр. Дж. Анаст. 87, 3–11. 10.1093/bja/87.1.3 [PubMed] [CrossRef] [Google Scholar]
- Китамура Т., Ямада Дж., Сато Х., Ямасита К. (1993). Клетки происхождения спинопарабрахиальных волокон у крыс: исследование с быстрым синим и WGA-HRP. Дж. Комп. Нейрол. 328, 449–461. 10.1002/cne.
- 0310 [PubMed] [CrossRef] [Google Scholar]
- Koewler N.J., Freeman K.T., Buus R.J., Herrera M.B., Jimenez-Andrade J.M., Ghilardi J.R., et al.. (2007). Влияние моноклонального антитела против фактора роста нервов на скелетную боль и заживление кости после перелома бедренной кости мыши C57BL/6J. Дж. Боун Шахтер. Рез. 22, 1732–1742 гг. 10.1359/jbmr.070711 [PubMed] [CrossRef] [Google Scholar]
- Koltzenburg M., Stucky C.L., Lewin G.R. (1997). Рецептивные свойства сенсорных нейронов мыши, иннервирующих волосистую кожу. Дж. Нейрофизиол. 78, 1841–1850 гг. [PubMed] [Google Scholar]
- Кон Т., Чо Т. Дж., Айзава Т., Ямадзаки М., Нух Н., Грейвс Д. и др. . (2001). Экспрессия остеопротегерина, активатора рецептора лиганда NF-kappaB (лиганд остеопротегерина) и родственных провоспалительных цитокинов при заживлении переломов. Дж. Боун Шахтер. Рез. 16, 1004–1014. 10.1359/jbmr.2001.16.6.1004 [PubMed] [CrossRef] [Google Scholar]
- Kyloh M., Spencer NJ (2014). Новый метод антеградной трассировки нейронов для выборочной маркировки афферентных нервных окончаний спинного мозга, которые кодируют вредные и безвредные стимулы во внутренних органах. Нейрогастроэнтерол.Мотиль. 26, 440–444. 10.1111/nmo.12266 [PubMed] [CrossRef] [Google Scholar]
- Lawson S.N., Waddell P.J. (1991). Иммунореактивность нейрофиламентов сомы связана с размером клеток и скоростью проводимости волокон в первичных сенсорных нейронах крыс. Дж. Физиол. (Лонд). 435, 41–63. 10.1113/jphysiol.1991.sp018497 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Lemperg R.K., Arnoldi C.C. (1978). Значение внутрикостного давления в норме и при патологии с особым упором на внутрикостное нагрубание-болевой синдром.клин. Ортоп. Относ. Рез. 136, 143–156. [PubMed] [Google Scholar]
- Li Y., Cai J., Han Y., Xiao X., Meng X.L., Su L. и др. . (2014). Улучшенная функция TRPV1 посредством повышающей регуляции инсулиноподобным фактором роста-1 в крысиной модели боли при раке кости. Евро. Дж. Пейн 18, 774–784. 10.1002/j.1532-2149.2013.00420.x [PubMed] [CrossRef] [Google Scholar]
- Liu M., Yang H., Fang D., Yang J.J., Cai J., Wan Y., et al. . (2013). Повышенная регуляция рецепторов P2X3 нейронным кальциевым сенсорным белком VILIP-1 в ганглиях задних корешков способствует боли при раке кости у крыс.Боль 154, 1551–1568. 10.1016/j.pain.2013.04.022 [PubMed] [CrossRef] [Google Scholar]
- Mach D.B., Rogers S.D., Sabino M.C., Luger N.M., Schwei M.J., Pomonis J.D., et al. . (2002). Происхождение скелетной боли: сенсорная и симпатическая иннервация бедренной кости мыши. неврология 113, 155–166. 10.1016/S0306-4522(02)00165-3 [PubMed] [CrossRef] [Google Scholar]
- Mahns D. A., Ivanusic J. J., Sahai V., Rowe M. J. (2006). Интактный препарат периферического нерва для мониторинга активности одиночных периостальных афферентных нервных волокон.Дж. Нейроски. Методы 156, 140–144. 10.1016/j.jneumeth.2006.02.019 [PubMed] [CrossRef] [Google Scholar]
- Mahns D., Sahai V., Ivanusic J., Tracey D., Rowe M. (2004). Препарат периферического нерва для изучения характеристик реакции отдельных чувствительных нервных волокон периостального происхождения. проц. Ауст. Здоровье Мед. Рез. Конг. Абстр. 1423, 304. [Google Scholar]
- Mantyh P. W. (2014). Нейробиология скелетной боли. Евро. Дж. Нейроски. 39, 508–519. 10.1111/ejn.12462 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Mantyh P.В., Хант С.П. (2004). Механизмы, которые вызывают и поддерживают боль при раке кости. Novartis обнаружила Symp. 260, 221–238; обсуждение 238–240, 277–229. 10.1002/0470867639.ch25 [PubMed] [CrossRef] [Google Scholar]
- Martin C.D., Jimenez-Andrade JM, Ghilardi JR, Mantyh P.W. (2007). Организация уникальной сетчатой сети сенсорных волокон CGRP+ в надкостнице мышей: значение для возникновения и поддержания боли при переломах костей. Неврологи. лат. 427, 148–152. 10.1016/j.neulet.2007.08.055 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Medhurst S.J., Walker K., Bowes M., Kidd B.L., Glatt M., Muller M., et al. . (2002). Крысиная модель боли при раке кости. Боль 96, 129–140. 10.1016/S0304-3959(01)00437-7 [PubMed] [CrossRef] [Google Scholar]
- Miao X.R., Gao X.F., Wu J.X., Lu Z.J., Huang Z.X., Li X.Q., et al. . (2010). Двустороннее подавление Nav1.8 в ганглиях задних корешков крыс с болью при раке костей, вызванной инокуляцией клеток опухоли молочной железы Walker 256.BMC Рак 10:216. 10.1186/1471-2407-10-216 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Миллер Р. М., Касахара М. (1963). Наблюдения за иннервацией длинных костей человека. Анат. Рек. 145, 13–23. 10.1002/ar.10
- 104 [CrossRef] [Google Scholar]
- Минвилл В., Лаффосс Дж. М., Фуркад О., Джиролами Дж. П., Тэк И. (2008). Мышиная модель боли при переломах. Анестезиология 108, 467–472. 10.1097/ALN.0b013e3181649333 [PubMed] [CrossRef] [Google Scholar]
- Нагае М., Хирага Т., Йонеда Т. (2007). Кислая микросреда, создаваемая остеокластами, вызывает боль в костях, связанную с колонизацией опухоли. Дж. Боун Шахтер. Метаб. 25, 99–104. 10.1007/s00774-006-0734-8 [PubMed] [CrossRef] [Google Scholar]
- Ниияма Ю., Кавамата Т., Ямамото Дж., Омотэ К., Намики А. (2007). Рак кости увеличивает транзиторный рецепторный потенциал экспрессии ваниллоидного подсемейства 1 в отдельных субпопуляциях нейронов ганглиев дорсальных корешков. неврология 148, 560–572. 10.1016/j.Неврология.2007.05.049 [PubMed] [CrossRef] [Google Scholar]
- Нив Д., Гофельд М., Девор М. (2003). Причины болей при дегенеративных заболеваниях костей и суставов: урок вертебропластики. Боль 105, 387–392. 10.1016/S0304-3959(03)00277-X [PubMed] [CrossRef] [Google Scholar]
- Olausson H., Lamarre Y., Backlund H., Morin C., Wallin B.G., Starck G., et al. . (2002). Немиелинизированные тактильные афференты сигнализируют о прикосновении и проецируются на островковую кору. Нац. Неврологи. 5, 900–904. 10.1038/nn896 [PubMed] [CrossRef] [Google Scholar]
- Palecek J., Палецкова В., Уиллис В. Д. (2003). Экспрессия Fos в спиноталамических и постсинаптических нейронах дорсального столба после вредных висцеральных и кожных раздражителей. Боль 104, 249–257. 10.1016/S0304-3959(03)00013-7 [PubMed] [CrossRef] [Google Scholar]
- Paterson D. J., Estavillo J. A., Nye PC (1988). Влияние гипоксии на концентрацию калия в плазме и возбуждение артериальных хеморецепторов у кошек. QJ Exp. Физиол. 73, 623–625. 10.1113/expphysiol.1988.sp003182 [PubMed] [CrossRef] [Google Scholar]
- Porro C.А., Четтоло В., Франческато М.П., Баральди П. (1998). Временное и интенсивное кодирование боли в коре головного мозга человека. Дж. Нейрофизиол. 80, 3312–3320. [PubMed] [Google Scholar]
- Портеной Р. К., Пейн Д., Якобсен П. (1999). Прорывная боль: характеристики и влияние на пациентов с онкологической болью. Боль 81, 129–134. 10.1016/S0304-3959(99)00006-8 [PubMed] [CrossRef] [Google Scholar]
- Поунтос И., Георгули Т., Калори Г. М., Джанноудис П. В. (2012). Влияют ли нестероидные противовоспалительные препараты на заживление костей? Критический анализ.Научный мировой журнал 2012:606404. 10.1100/2012/606404 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Qiu F., Jiang Y., Zhang H., Liu Y., Mi W. (2012). Повышенная экспрессия устойчивых к тетродотоксину натриевых каналов Nav1.8 и Nav1.9 в ганглиях задних корешков в крысиной модели боли при раке кости. Неврологи. лат. 512, 61–66. 10.1016/j.neulet.2012.01.069 [PubMed] [CrossRef] [Google Scholar]
- Ralston HJ, III, Miller MR, Kasahara M. (1960). Нервные окончания в фасциях, сухожилиях, связках, надкостнице и суставной синовиальной оболочке человека.Анат. Рек. 136, 137–147. 10.1002/ar.10
- 208 [PubMed] [CrossRef] [Google Scholar]
- Рен К., Дубнер Р. (1999a). Пластичность центральной нервной системы и постоянные боли. Дж. Орофак. Боль 13, 155–163; обсуждение 164–171. [PubMed] [Google Scholar]
- Рен К., Дубнер Р. (1999b). Воспалительные модели боли и гипералгезии. ИЛАР Дж. 40, 111–118. 10.1093/ilar.40.3.111 [PubMed] [CrossRef] [Google Scholar]
- Роу М. Дж., Трейси Д. Дж., Манс Д. А., Сахай В., Иванушич Дж. Дж. (2005).Механосенсорное восприятие: есть ли вклад костных рецепторов? клин. Эксп. Фармакол. Физиол. 32, 100–108. 10.1111/j.1440-1681.2005.04136.x [PubMed] [CrossRef] [Google Scholar]
- Rundle C.H., Wang H., Yu H., Chadwick R.B., Davis E.I., Wergedal J.E., et al. . (2006). Микроматричный анализ экспрессии генов на стадиях воспаления и формирования эндохондральной кости при восстановлении перелома бедренной кости у крыс. Кость 38, 521–529. 10.1016/j.bone.2005.09.015 [PubMed] [CrossRef] [Google Scholar]
- Сакада С.(1974). Механорецепторы в фасции, надкостнице и периодонтальной связке. Бык. Токио Мед. Вмятина. ун-т 21 (Прил.), 11–13. [PubMed] [Google Scholar]
- Сакада С., Аида Х. (1971a). Электрофизиологические исследования телец Гольджи-Маццони в надкостнице лицевых костей кошек. Бык. Токио Дент. Сб. 12, 255–272. [Google Scholar]
- Сакада С., Аида Х. (1971b). Локализация и форма телец Гольджи-Маццони в надкостнице лицевых костей кошки. Бык. Токио Дент. Сб.12, 235–253. [Google Scholar]
- Сакада С., Маэда К. (1967a). Особенности иннервации и нервных окончаний в надкостнице нижней челюсти кошек. Бык. Токио Дент. Сб. 8, 77–94. [PubMed] [Google Scholar]
- Сакада С., Маеда К. (1967b). Корреляция между гистологической структурой и реакцией на давление механорецепторов в надкостнице нижней челюсти кошки. Бык. Токио Дент. Сб. 8, 181–196. [Google Scholar]
- Сакада С., Мияке А. (1972). Реакция медленно адаптирующихся окончаний свободных волокон в надкостнице нижней челюсти кошки на вибрационную стимуляцию.Бык. Токио Дент. Сб. 13, 205–225. [PubMed] [Google Scholar]
- Сакада С., Немото Т. (1972). Реакция на тепловую стимуляцию быстро- и медленно адаптирующихся окончаний свободных волокон в надкостнице нижней челюсти кошки. Бык. Токио Дент. Сб. 13, 227–250. [PubMed] [Google Scholar]
- Сакада С., Оноэ Ю. (1971). Реакция быстроадаптирующихся окончаний свободных волокон в надкостнице нижней челюсти кошки на вибрационную стимуляцию. Бык. Токио Дент. Сб. 12, 199–221. [PubMed] [Google Scholar]
- Сакада С., Тагучи С. (1971). Электрофизиологические исследования окончаний свободных волокон надкостницы нижней челюсти кошки. Бык. Токио Дент. Сб. 12, 175–197. [PubMed] [Google Scholar]
- Сакада С., Яно Дж. (1978). Влияние гипертонических и гипотонических солевых растворов на нервные окончания в надкостнице позади подбородочного отверстия кошки. Бык. Токио Дент. Сб. 19, 103–118. [PubMed] [Google Scholar]
- Санти Дж., Макинтош К. (2001). Феноменологическое исследование боли после перелома диафиза бедренной кости.Дж. Клин. Нурс. 10, 521–527. 10.1046/j.1365-2702.2001.00506.x [PubMed] [CrossRef] [Google Scholar]
- Schaible HG (1996). Почему болит сустав при воспалении? бр. Дж. Ревматол. 35, 405–406. 10.1093/rheumatology/35.5.405 [PubMed] [CrossRef] [Google Scholar]
- Schaible HG, Schmidt R.F. (1988). Динамика изменения механочувствительности суставных афферентов при развивающемся экспериментальном артрите. Дж. Нейрофизиол. 60, 2180–2195. [PubMed] [Google Scholar]
- Schwei M.J., Honore P., Rogers S.D., Salak-Johnson J.L., Finke M.P., Ramnaraine M.L., et al. . (1999). Нейрохимическая и клеточная реорганизация спинного мозга в мышиной модели боли при раке кости. Дж. Нейроски. 19, 10886–10897. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Segale M. (1919). Температура остро воспаленных периферических тканей. Дж. Эксп. Мед. 29, 235–249. 10.1084/jem.29.3.235 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Seidel M. F., Wise B. L., Лейн Н.Е. (2013). Фактор роста нервов: последние сведения о науке и терапии. Остеоартроз. Картил. 21, 1223–1228. 10.1016/j.joca.2013.06.004 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Seike W. (1976). Электрофизиологические и гистологические исследования чувствительности нервных окончаний костного мозга. Йонаго Акта Мед. 20, 192–211. [PubMed] [Google Scholar]
- Севчик М. А., Гиларди Дж. Р., Петерс С. М., Линдси Т. Х., Халворсон К. Г., Джонас Б. М. и др. . (2005).Анти-ФРН-терапия значительно уменьшает боль при раке кости и сопровождающее ее увеличение маркеров периферической и центральной сенсибилизации. Боль 115, 128–141. 10.1016/j.pain.2005.02.022 [PubMed] [CrossRef] [Google Scholar]
- Shen W., Hu X.M., Liu Y.N., Han Y., Chen LP, Wang C.C., et al. . (2014). CXCL12 в астроцитах способствует боли при раке кости посредством CXCR4-опосредованной сенсибилизации нейронов и активации глии в спинном мозге крыс. J. Нейровоспаление 11, 75. 10.1186/1742-2094-11-75 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Shi X., Го Т. З., Вэй Т., Ли В. В., Кларк Д. Дж., Кингери В. С. (2015). Облегченная передача сигналов спинального нейропептида и повышенная экспрессия воспалительных медиаторов способствуют постпереломной ноцицептивной сенсибилизации. Боль 156, 1852–1863 гг. 10.1097/j.pain.0000000000000204 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Spencer N.J., Kyloh M., Duffield M. (2014). Идентификация различных типов окончаний спинномозговых афферентных нервов, которые кодируют вредные и безвредные стимулы в толстой кишке, с использованием новой техники антероградного отслеживания.ПЛОС ОДИН 9:e112466. 10.1371/journal.pone.0112466 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Strassman A.M., Weissner W., Williams M., Ali S., Levy D. (2004). Диаметры аксонов и интрадуральные траектории иннервации твердой мозговой оболочки у крыс. Дж. Комп. Нейрол. 473, 364–376. 10.1002/cne.20106 [PubMed] [CrossRef] [Google Scholar]
- Такасе Б., Номура С. (1957). Исследования иннервации костного мозга. Дж. Комп. Нейрол. 108, 421–443. 10.1002/cne. 0305 [PubMed] [CrossRef] [Google Scholar]
- Thurston T.Дж. (1982). Распределение нервов в длинных костях показано импрегнацией серебра. Дж. Анат. 134 (часть 4), 719–728. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Триде Р. Д., Мейер Р. А., Раджа С. Н., Кэмпбелл Дж. Н. (1995). Доказательства двух различных механизмов теплопередачи в ноцицептивных первичных афферентах, иннервирующих кожу обезьяны. Дж. Физиол. 483 (часть 3), 747–758. 10.1113/jphysiol.1995.sp020619 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Uhelski M.L., Cain D.М., Хардинг-Роуз К., Симона Д.А. (2013). Неселективный агонист каннабиноидных рецепторов WIN 55,212-2 ослабляет ответы ноцицепторов С-волокон в мышиной модели раковой боли. неврология 247, 84–94. 10.1016/j.neuroscience.2013.05.003 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Urch C.E., Donovan-Rodriguez T., Dickenson A.H. (2003). Изменения в нейронах задних рогов в крысиной модели боли в костях, вызванной раком. Боль 106, 347–356. 10.1016/j.pain.2003.08.002 [PubMed] [CrossRef] [Google Scholar]
- Валбо А.Б., Олауссон Х., Вессберг Дж. (1999). Немиелинизированные афференты составляют вторую систему, кодирующую тактильные раздражители волосистой кожи человека. Дж. Нейрофизиол. 81, 2753–2763. [PubMed] [Google Scholar]
- Валлбо А., Олауссон Х., Вессберг Дж., Норрселл У. (1993). Система немиелинизированных афферентов для безвредной механорецепции в коже человека. Мозг Res. 628, 301–304. 10.1016/0006-8993(93)
- -S [PubMed] [CrossRef] [Google Scholar]
- Williams MC, Ivanusic JJ (2008). Доказательства участия спинопарабрахиального пути, но не спиноталамического тракта или постсинаптического дорсального столба, в острой костной ноцицепции.Неврологи. лат. 443, 246–250. 10.1016/j.neulet.2008.07.076 [PubMed] [CrossRef] [Google Scholar]
- Willis WD, Jr. (1985). Система боли. Нейронная основа ноцицептивной передачи в нервной системе млекопитающих. Боль 8, 1–346. [PubMed] [Google Scholar]
- Вульф А. Д., Пфлегер Б. (2003). Бремя основных заболеваний опорно-двигательного аппарата. Бык. Всемирный орган здравоохранения.
81, 646–656. 10.1590/S0042-96862003000
7 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Yamada M., Йошино Ю. (1977). Механизмы возбуждения боли в коленном суставе при ишемии. Йонаго Акта Мед. 21, 1–10. [PubMed] [Google Scholar]
- Янагисава Ю., Фуруэ Х., Кавамата Т., Ута Д., Ямамото Дж., Фурусе С. и др. . (2010). Рак костей индуцирует уникальную центральную сенсибилизацию посредством синаптических изменений в широкой области спинного мозга. Мол. Боль 6:38. 10.1186/1744-8069-6-38 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Чжао Дж., Леви Д. (2014). Сенсорная иннервация надкостницы свода черепа является ноцицептивной и вносит вклад в поведение, подобное головной боли.Боль 155, 1392–1400. 10.1016/j.pain.2014.04.019 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Zhao J., Zhang H., Liu SB, Han P., Hu S., Li Q., et др. . (2013). Спинальный интерлейкин-33 и его рецептор ST2 вносят вклад в боль, вызванную раком кости у мышей. неврология 253, 172–182. 10.1016/j.neuroscience.2013.08.026 [PubMed] [CrossRef] [Google Scholar]
Физиология боли в костях. Как много мы знаем на самом деле?
Фронт Физиол. 2016; 7: 157.
Кафедра анатомии и неврологии Мельбурнского университета, Мельбурн, Виктория, Австралия
Под редакцией: Ника Спенсера, Университет Флиндерс, Австралия
Рецензирование: Майкл Карр, Исследователь респираторных препаратов, GlaxoSmithKline, США; TinaMarie Lieu, Университет Монаш, Австралия
Эта статья была отправлена в Autonomic Neuroscience, раздел журнала Frontiers in Physiology
Поступила в редакцию 15 февраля 2016 г.; Принято 11 апреля 2016 г.
Это статья с открытым доступом, распространяемая на условиях лицензии Creative Commons Attribution License (CC BY). Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора(ов) или лицензиара оригинала и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья была процитирована другими статьями в PMC.Abstract
Боль связана с большинством костных патологий. Клинические и экспериментальные наблюдения позволяют предположить, что боль в костях может быть следствием вредной стимуляции надкостницы или костного мозга. Известно, что сенсорные нейроны иннервируют надкостницу и полость костного мозга, и большинство из них имеют морфологию и молекулярный фенотип, соответствующие роли в ноцицепции. Однако мало что известно о физиологии этих нейронов, и поэтому информация о механизмах, которые вызывают и поддерживают боль в костях, отсутствует.Надкостнице уделялось больше внимания по сравнению с костным мозгом, что отражает более легкий доступ к надкостнице для экспериментальной оценки. С помощью используемых электрофизиологических препаратов исследователи смогли изолированно регистрировать отдельные периостальные единицы, и имеется много доступной информации о том, как они реагируют на различные раздражители, в том числе вредные. Напротив, препараты, используемые для изучения чувствительных нейронов, иннервирующих костный мозг, были ограничены регистрацией многоэлементной активности целых нервов, и, хотя они четко сообщают об ответах на вредную стимуляцию, невозможно определить ответы отдельных чувствительных нейронов, иннервирующих костный мозг. костный мозг.Имеются лишь ограниченные доказательства того, что периферические сенсорные нейроны, иннервирующие кость, могут быть сенсибилизированы или что они могут быть активированы несколькими типами стимулов, и в настоящее время это существует только частично для периостальных единиц. Очевидно, что в центральной нервной системе нейроны задних рогов спинного мозга могут активироваться вредными стимулами, воздействующими на кость. Некоторые из них могут быть сенсибилизированы при патологических состояниях и могут частично способствовать вторичной или отраженной боли, связанной с костной патологией. Активность, связанная со стимуляцией сенсорных нервов, иннервирующих кость, также была обнаружена в нейронах спинопарабрахиального пути и соматосенсорной коры, которые известны своей ролью в кодировании информации о боли.Хотя они дают некоторые подсказки относительно того, как информация о боли в костях централизованно кодируется, их необходимо расширить, чтобы углубить наше понимание других задействованных центральных областей. Еще многое предстоит узнать о физиологии периферических сенсорных нейронов, иннервирующих кость, и их центральных отростков.
Ключевые слова: боль в костях, боль, ноцицепция, кость, электрофизиология, надкостница, костный мозг как информация о вредной стимуляции, закодированная этими нейронами, передается через центральную нервную систему в кору головного мозга, вызывая болезненные ощущения.Мы начнем с обобщения некоторых ключевых концепций, касающихся качества и лечения боли в костях, а также того, что мы знаем о морфологии и молекулярном фенотипе костных афферентных нейронов, а затем подробно изучим физиологию костных афферентных нейронов и их проекции через ЦНС.
Боль в костях: клинические и экспериментальные наблюдения
Боль, связанная с костной патологией, включая синдромы отека костного мозга, остеомиелит, остеоартрит, переломы и рак кости, является тяжелым бременем (как с точки зрения качества жизни, так и с точки зрения стоимости) для отдельных лиц и системы здравоохранения во всем мире.Ожидается, что это бремя будет увеличиваться с достижениями современной медицины, увеличивающими ожидаемую продолжительность жизни, поскольку многие состояния, вызывающие боль в костях, неизлечимы и развиваются в более позднем возрасте. Распространенность многих из этих состояний высока, например, остеоартрит поражает почти 10 % мужчин и 18 % женщин старше 60 лет (всемирная оценка), а остеопороз поражает до 30 % женщин в постменопаузе на севере США (Woulf и Пфлегер, 2003). Метастатическая боль в костях является наиболее распространенным болевым синдромом у онкологических больных, и до 50% пациентов сообщают, что существующие методы лечения плохо справляются с болью (Mantyh and Hunt, 2004).Управление болью в костях с помощью традиционной анальгезии основано на предположении, что механизмы, опосредующие боль в костях, аналогичны механизмам, опосредующим боль в других тканевых системах, и поэтому могут быть нацелены на аналогичные методы лечения. Опиоиды и нестероидные противовоспалительные препараты (НПВП) обычно используются для лечения боли от легкой до сильной, но терапевтическое применение при болях в костях ограничено нежелательными побочными эффектами, включая седативный эффект, угнетение дыхания, толерантность к длительному применению, риск привыкания, желудочно-кишечные расстройства. эффектов и почечной токсичности.Все это происходит при длительном использовании того вида, который необходим для лечения постоянной боли при трудноизлечимых состояниях, таких как остеоартрит, остеопороз и рак костей. Использование НПВП и опиоидных анальгетиков при лечении болей в костях еще более осложняется из-за значительного нежелательного воздействия на ремоделирование/заживление кости (Bove et al., 2009; Pountos et al., 2012; Chrastil et al., 2013), что усложняет лечение. скрытая патология. Другие средства, подавляющие активность остеокластов (например, остеопротегерин) или уменьшающие воспалительные процессы (например, остеопротегерин).g., блокирующие функцию антитела к фактору роста нервов) вызывают значительную анальгезию на животных моделях рака кости и боли при переломах (Honore et al., 2000a; Halvorson et al., 2005; Sevcik et al., 2005; Jimenez-Andrade et al. и др., 2007; Кеулер и др., 2007). Они в первую очередь оказывают воздействие на периферию и нацелены на причины болей в костях. Однако они могут иметь значительные побочные эффекты, связанные с ремоделированием и/или разрушением кости, что ограничивает их терапевтический потенциал (Holmes, 2012; Seidel et al., 2013). Существует очевидная потребность в поиске альтернативных стратегий лечения боли в костях, не связанных с использованием НПВП или опиоидов и нацеленных более конкретно на нервные или воспалительные механизмы, вызывающие и/или поддерживающие боль.
Происхождение боли, связанной с костными тканями, является спорным вопросом. В ранних исследованиях отмечалось, что прямая болезненная механическая стимуляция надкостницы вызывала болезненные ощущения у людей (Inman and Saunders, 1944), и в более поздней литературе подчеркивается преобладающее мнение, что боль от кости обычно не ощущается, если не затронута надкостница. Мах и др., 2002). Боль от надкостницы часто описывается как острая и хорошо локализованная, и возникает, например, при переломах, достаточно значительных, чтобы воздействовать на надкостницу (Santy and Mackintosh, 2001). Однако введение раздражающих веществ в костномозговую полость также очень болезненно, как и пункционная аспирация костного мозга, и эта боль отличается от боли, связанной с разрывом надкостницы (Niv et al., 2003). Кроме того, пациенты часто ощущают боль в костях при патологиях, ограниченных главным образом костным мозгом и не имеющих явного периостального поражения (напр.g., синдром внутрикостного нагрубания) (Lemperg and Arnoldi, 1978; Arnoldi, 1990). В этих случаях боль часто описывается исключительно как тупая, диффузная и трудно локализуемая. Боль, вызванная раком костей, относится к этой последней категории и обычно состоит из фоновой боли, которая описывается как постоянная и тупая и усиливается со временем (Honore and Mantyh, 2000; Haegerstam, 2001). Кроме того, пациенты с раком кости часто жалуются на другую, более интенсивную боль при движении или нагрузке (прорывная боль) (Portenoy et al., 1999). Таким образом, оказывается, что как надкостница, так и полость костного мозга должны быть иннервированы первичными афферентными нейронами, способными трансдуцировать и передавать ноцицептивную информацию. Эти костные афферентные нейроны обеспечивают центральную нервную систему информацией, которая вызывает первичную боль, возникающую в костях.
Костная патология также может вызывать чувствительность к обычно безвредной стимуляции (аллодиния) и/или повышенную чувствительность к вредной стимуляции (гипералгезия) кожи вокруг пораженной кости/костей или даже кожи на отдаленных участках.Это часто описывается как вторичная или отраженная боль и, вероятно, отражает сенсибилизацию кожных афферентных нейронов и/или их центральных проекций (Ren and Dubner, 1999a). Сенсибилизация включает повышенную возбудимость (снижение порога возбуждения для активации и/или увеличение частоты разрядки потенциала действия) периферических и центральных сенсорных нейронов. Многие экспериментальные исследования, сообщающие о болевом поведении на животных моделях костной патологии, используют платформы для тестирования поведения, которые оценивают болевые, температурные или механические чувствительности в основном (или исключительно) на коже вокруг пораженной кости (Cain et al., 2001; Урч и др., 2003 г.; Янагисава и др., 2010 г.; Uhelski et al., 2013), и поэтому, вероятно, будут отслеживать механизмы, связанные со вторичной или отраженной болью, а не с первичной болью, связанной с прямой стимуляцией ноцицепторов в костях.
Морфология и молекулярный фенотип сенсорных нейронов, иннервирующих кость
Во многих исследованиях сообщалось о существовании первичных афферентных нейронов, иннервирующих кость, и стало ясно, что большинство этих сенсорных нейронов имеют морфологию и молекулярный фенотип, соответствующие роль в ноцицепции (рис. ).Здесь мы обобщаем литературу, которая способствовала этому пониманию, прежде чем подробно обсуждать физиологию сенсорных нейронов, иннервирующих кость. Более подробный обзор современной литературы по морфологии и молекулярному фенотипу сенсорных нейронов, иннервирующих кость, можно найти в следующих обзорах: Mach et al. (2002), Хименес-Андраде и др. (2010), Мантых (2014).
Морфология и молекулярный фенотип сенсорных нейронов, иннервирующих кости .Сома DRG первичных афферентных нейронов, иннервирующих костный мозг и надкостницу, в основном представляет собой миелинизированные и немиелинизированные нейроны малого диаметра со свободными окончаниями волокон, хотя в надкостнице все же существуют более крупные нейроны с инкапсулированными окончаниями. Они экспрессируют различные комбинации маркеров, характерных для ноцицептивных нейронов, включая пептид, родственный гену кальцитонина (CGRP), вещество P (SP) и киназу рецептора тирозина A (TrkA), и/или связывают изолектин B4 (IB4). Связывание IB4 не наблюдалось в окончаниях периферических нервов (представлено пунктирной линией).
Самые ранние исследования иннервации кости задокументировали примеры рассеченных или окрашенных серебром нервных волокон в кости и надкостнице, но мало внимания уделялось их функции (De Castro, 1925; Hurrell, 1937; Takase and Nomura, 1957; Miller and Kasahara). , 1963; Cooper et al., 1966; Sakada and Maeda, 1967а; Calvo, 1968; Thurston, 1982). Поскольку многие из этих волокон находились в тесном контакте с кровеносными сосудами внутри кости, некоторые авторы предположили связь с функцией сосудов, но не дали дальнейших комментариев.Это несколько удивительно, поскольку повреждение кости и ассоциированной ткани явно связано с болью, что позволяет предположить, что по крайней мере некоторые из описанных волокон в кости должны быть ноцицепторами. Использование иммуногистохимических маркеров различных нейропептидов в более поздних сообщениях показало, что нервные волокна, иннервирующие минерализованную кость, костный мозг и надкостницу, имеют как сенсорное, так и вегетативное происхождение (Duncan and Shim, 1977; Gronblad et al., 1984; Hohmann et al., 1986; Bjurholm et al., 1988; Хилл и Эльде, 1988, 1991; Мах и др., 2002). Волокна сенсорного происхождения обычно описывались как имеющие свободные окончания небольшого диаметра, хотя некоторые более крупные волокна со специализированными инкапсулированными окончаниями были обнаружены в надкостнице нижней челюсти кошек (Sakada and Maeda, 1967a; Sakada and Aida, 1971b), длинных костях человека. надкостница (Ralston et al., 1960) и гаверсовы каналы в кортикальной кости собак (Cooper et al., 1966). Недавно разработанный метод избирательной маркировки периферических сенсорных нейронов может быть полезен для подтверждения сенсорного, а не симпатического происхождения этих нервных окончаний в костях (Kyloh and Spencer, 2014; Spencer et al., 2014).
Ноцицепторы обычно определяются как тонкие миелинизированные или немиелинизированные первичные афферентные нейроны небольшого диаметра и могут быть идентифицированы по наличию специфических молекулярных маркеров, экспрессируемых на их соме [в ганглиях задних корешков (DRG)] или их периферических нервных окончаниях. Сома DRG первичных афферентных нейронов, иннервирующих костномозговую полость, трабекулярную кость и надкостницу, представляет собой почти исключительно миелинизированные и немиелинизированные нейроны малого диаметра, которые экспрессируют различные комбинации маркеров, характерных для ноцицептивных нейронов, включая пептид, родственный гену кальцитонина (CGRP), вещество P (SP) и киназа рецептора тирозина A (TrkA) и/или связывают изолектин B4 (IB4) (Gajda et al., 2004; Иванушич, 2009 г.; Асо и др., 2014). Важно отметить, что эти исследования идентифицировали субпопуляции сенсорных нейронов, иннервирующих кость, на основе различных комбинаций этих маркеров у крыс. Например, ясно, что до половины являются пептидергическими (CGRP+) (Ivanusic, 2009; Aso et al., 2014), а многие непептидергическими (связывание CGRP или IB4) (Ivanusic, 2009; Aso et al., 2014). ), и что примерно две трети, вероятно, будут чувствительными к фактору роста нервов (TrkA+), в то время как другие не будут (TrkA-) (Aso et al., 2014). Похоже, что эти молекулярные фенотипы сохраняются в окончаниях периферических нервов в костях (Mach et al., 2002; Jimenez-Andrade et al., 2010; Castaneda-Corral et al., 2011), хотя связывание IB4 при этом не наблюдалось. расположение (по крайней мере, у мышей; Mach et al., 2002). Хотя могут существовать некоторые тонкие межвидовые различия, ясно, что морфология и молекулярный фенотип сенсорных нейронов, которые иннервируют ткани кости, согласуются с их ролью в ноцицепции, и что эти особенности могут быть использованы для идентификации множественных субпопуляций костных афферентных нейронов. нейроны (рис. ).Отражается ли эта молекулярная гетерогенность на физиологии костных афферентных нейронов, еще предстоит определить. В оставшейся части этого обзора мы рассмотрим то, что известно о физиологии костных афферентных нейронов.
Физиология периферических костных афферентных нейронов
Среда, в которой существуют сенсорные нервные окончания в костях, сильно отличается от окружающей среды в тканях других типов. Надкостница выстилает очень твердый кортикальный слой кости, поэтому чувствительные нервные окончания в надкостнице легко сдавливаются относительно низкопороговыми механическими раздражителями по сравнению с окончаниями в более податливой ткани, такой как кожа.Костный мозг окружен неподатливой минерализованной костью и содержит большие популяции клеток-предшественников и зрелых воспалительных клеток (и других типов клеток), которые вместе создают различные стимулирующие условия в полости костного мозга по сравнению с другими тканями. Таким образом, важно учитывать, как первичные афферентные нейроны в каждом из этих различных костных компартментов реагируют на вредные стимулы и чем это отличается от других типов тканей. Здесь мы подробно обсуждаем то, что известно о физиологии периферически расположенных первичных афферентных нейронов, иннервирующих либо надкостницу, либо костный мозг.
Надкостница
В литературе гораздо большее внимание уделяется периостальной афферентной иннервации, чем полости костного мозга. Это, несомненно, отражает более легкий доступ к надкостнице для экспериментальной оценки, чем к костному мозгу.
Наиболее подробная серия электрофизиологических исследований периостальной иннервации была проведена Сакада с коллегами (Сакада, Маеда, 1967а,б; Сакада, Аида, 1971а,б; Сакада, Оное, 1971; Сакада, Тагучи, 1971; Сакада и др.). Мияке, 1972; Сакада и Немото, 1972; Сакада, 1974; Сакада и Яно, 1978).Они сделали сотни записей с мелких нервов в препарате in vitro с цельным препаратом надкостницы нижней челюсти кошки, описывая реакции как на вредную, так и на безвредную стимуляцию их сенсорных нервных окончаний. Поскольку рецептивные поля надкостничных афферентов в препарате были достаточно дискретными, исследователи смогли активировать и изолировать отдельные единицы с помощью механических стимулов, воздействующих на надкостницу. Гистология показала, что нижнечелюстная надкостница кошки была иннервирована окончаниями свободных волокон малого диаметра и некоторыми более крупными окончаниями, инкапсулированными тельцами Гольджи-Маццони (Sakada and Maeda, 1967a; Sakada and Aida, 1971b).Окончания свободных волокон были распределены по всему препарату, тогда как тельца Гольджи-Маццони можно было обнаружить только по средней линии перед ментальным отверстием. Таким образом, авторы смогли предпочтительно активировать и изучить окончания свободных волокон, применяя стимулы к надкостнице позади ментального отверстия. Они сообщили, что большинство аксонов со свободными окончаниями волокон имели малый диаметр, что соответствовало ноцицептивной функции, и систематически исследовали ответные свойства периостальных окончаний свободных волокон малого диаметра в надкостнице нижней челюсти (см. ниже).Они также описали поведение инкапсулированных телец Гольджи-Маццони, обнаруженных впереди ментального отверстия.
Чжао и Леви описали препарат, в котором они использовали электроды из вольфрамовой проволоки для регистрации активности нейронов тройничного ганглия с рецептивными полями на надкостнице свода черепа крысы (Чжао и Леви, 2014). Этот метод позволяет хорошо изолировать одиночные единицы, и все их данные относятся к ответам одиночных единиц на периостальную стимуляцию. Всего было сообщено о 115 отдельных единицах, что делает выборку значительной выборкой, на основе которой можно делать выводы.Они не комментировали морфологию или размер периостальных окончаний, но тщательно исследовали их физиологию преимущественно, но не исключительно, в контексте роли в ноцицепции (см. ниже).
Mahns и коллеги использовали препарат in vivo для исследования нейронов, иннервирующих надкостницу плечевой кости кошки (Mahns et al., 2004, 2006). Гистология показала, что небольшой нерв, из которого были сделаны записи в этом препарате, содержал только миелинизированные и немиелинизированные аксоны небольшого диаметра (Ivanusic et al., 2006). Они были способны выборочно активировать отдельные афферентные волокна, которые демонстрировали очерченные и точечные рецептивные поля. Однако только 15 отдельных волокон были изучены с точки зрения характеристик рецептивного поля и/или вибромеханической чувствительности и реактивности.
Скорость проведения
Скорость проведения тесно связана с размером аксона и может использоваться для классификации первичных афферентных нейронов по ряду функциональных категорий. Афференты с миелинизированными (Aδ) или немиелинизированными (C) аксонами малого диаметра и низкой скоростью проведения связаны преимущественно с ноцицептивной функцией (Dixon, 1963; Burgess and Perl, 1973; Lawson and Waddell, 1991; Djouhri and Lawson, 2004; Strassman et al. др., 2004). Нейроны С-волокна имеют аксоны наименьшего диаметра (0,6–1,2 мкм у крыс; 1–2 мкм у кошек) и самые низкие скорости проведения (<2 м/с у крыс; <10 м/с у кошек). Их проводящие свойства и реакции как на тепловые, так и на химические раздражители привели к идее, что они являются важными медиаторами медленной жгучей боли в большинстве тканевых систем. Нейроны миелинизированных волокон Aδ имеют более крупные аксоны (1,2–4 мкм у крыс; 2–5 мкм у кошек) и более высокие скорости проведения (2–12 м/с у крыс; 10–30 м/с у кошек). Из-за их более быстрой проводимости они считаются медиаторами быстрой боли.Нейроны Aβ также миелинизированы и имеют аксоны самого большого диаметра (> 4 мкм у крыс;> 5 мкм у кошек) и самые высокие скорости проведения (> 12 м / с у крыс;> 30 м / с у кошек). Нейроны с аксонами большого диаметра, высокой скоростью проведения и инкапсулированными окончаниями обычно связаны с безвредной (например, тактильной или кинестетической) чувствительностью.
Сакада и его коллеги сообщили, что аксоны, иннервирующие окончания свободных волокон надкостницы в надкостнице нижней челюсти кошек, имели скорость проведения в диапазоне волокон Aδ и С (2–18 м/с) (Sakada and Maeda, 1967b; Sakada and Taguchi, 1971). предполагая роль в ноцицепции.Аксоны с инкапсулированными окончаниями Гольджи-Маццони имели более высокую скорость проведения (>30 м/с) (Sakada and Maeda, 1967b; Sakada and Aida, 1971a), что указывает на их роль преимущественно в низкопороговой механо-чувствительности, а не в ноцицепции. Zhao and Levy (2014) сообщили об аналогичном распределении скорости проведения по диапазонам волокон Aβ, Aδ и C в надкостнице свода черепа крысы, подтверждая представление о том, что периостальные афференты играют роль как в ноцицепции, так и в низкопороговой механочувствительности.Напротив, Ivanusic и его коллеги сообщили о гистологических данных о том, что нерв, идущий к кошачьей плечевой кости, содержит только миелинизированные и немиелинизированные аксоны небольшого диаметра (Ivanusic et al., 2006), а скорости проводимости при электрической стимуляции надкостницы были ограничены диапазоном, соответствующим Aδ и классификация волокон С (<30 м/с) (Mahns et al., 2006). Однако была представлена скорость проведения только четырех периостальных афферентных волокон, поэтому размер их выборки ограничен. Возможно, при отборе проб более широкой области надкостницы кошачьей плечевой кости могут быть обнаружены единицы с более высокими скоростями проведения.В качестве альтернативы может быть, что единицы с более высокими скоростями проведения и более крупными аксонами чаще встречаются в черепе (Sakada and Taguchi, 1971; Zhao and Levy, 2014) по сравнению с аппендикулярным скелетом (Mahns et al., 2006). Тем не менее, результаты всех исследователей показывают, что подавляющее большинство периостальных афферентов имеют скорость проведения, соответствующую роли в ноцицепции, и, вероятно, способствуют возникновению острой, быстрой (Aδ) или медленной жгучей (C) боли. Об этих типах боли действительно сообщалось у людей, подвергшихся периостальной стимуляции (Inman and Saunders, 1944), и в ряде исследований на животных предполагалось, что они вносят свой вклад в профиль боли (Martin et al., 2007).
Свойства механической реакции
Все вышеперечисленные исследователи сообщили, что периостальные афферентные единицы являются механически чувствительными. Сакада и его коллеги зарегистрировали многие сотни механически чувствительных единиц в своей серии работ, посвященных надкостнице нижней челюсти кошек, но эти исследования не выявили относительную долю механически чувствительных афферентных волокон, поскольку они изучали только те, которые можно было идентифицировать с механическими раздражителями. Напротив, почти все единицы (113/115), которые могли быть активированы электрической стимуляцией надкостницы свода черепа, были механически чувствительны (Zhao and Levy, 2014), что позволяет предположить, что подавляющее большинство периостальных афферентов механически чувствительны в этом препарате.Точно так же все 15 сенсорных нейронов, идентифицированных при электрической стимуляции надкостницы плечевой кости кошки, могут быть активированы механическими стимулами (Mahns et al., 2006).
Порог активации является важным свойством физиологии сенсорных нейронов, которое сообщает, насколько легко стимул передается на периферии. Порог активации механически чувствительных первичных афферентных нейронов полезен для определения их функциональной классификации. Например, большинство механически чувствительных единиц с низким порогом играют роль в безобидной чувствительности, в то время как единицы с высоким порогом обычно играют роль в ноцицепции.Периферические сенсорные нейроны также могут по-разному адаптироваться к применению постоянного механического раздражителя. Для быстро адаптирующихся нейронов частота разрядов очень быстро снижается, а реакция на механический раздражитель является преходящей, так что импульсы возникают только в начале или после окончания механической стимуляции. Это обеспечивает четкую временную локализацию механических раздражителей и характерно для низкопороговых механосенсорных нейронов. Тельца Пачини являются примером быстро адаптирующихся механорецепторов.Для медленно адаптирующихся нейронов снижение частоты разряда занимает гораздо больше времени, так что нейрон продолжает возбуждаться в течение всего времени действия стимула. Большинство ноцицепторов классически определяются как имеющие медленно адаптирующуюся реакцию на вредную механическую стимуляцию, что означает, что после активации ноцицептор останется активированным и предоставит ЦНС информацию о продолжительности раздражителя.
Сакада и коллеги сообщили, что как большие, инкапсулированные окончания Гольджи-Маццони, так и окончания свободных волокон позади ментального отверстия могут быть классифицированы в соответствии с их адаптационными реакциями.Окончания Гольджи-Маццони были исключительно быстро адаптирующимися, низкопороговыми единицами, которые хорошо реагировали на вибрацию и родственны тельцам Пачини или другим афферентам, которые опосредуют безвредную тактильную или кинестетическую чувствительность (Sakada and Maeda, 1967b; Sakada and Aida, 1971a). Напротив, свободные окончания волокон, с которых они записывали, либо быстро, либо медленно адаптировались, и каждое из них имело разные свойства ответа. Паттерны импульсов к стимуляции давлением медленно адаптирующихся окончаний свободных волокон сильно различались, однако в большинстве из них наблюдалось резкое увеличение активности во время динамической фазы стимула давления, за которым следовал период устойчивой активности, характеризующийся постепенным увеличением интервала между импульсами. как рецептор, адаптированный к поддерживаемому раздражителю (Sakada, Taguchi, 1971; Sakada, Miyake, 1972).С увеличением интенсивности механической стимуляции у этих медленно адаптирующихся свободных окончаний волокон увеличивалась частота разрядов, по крайней мере, в динамической фазе их ответа (Sakada, Taguchi, 1971; Sakada, Miyake, 1972). Большинство из этих медленно адаптирующихся окончаний свободных волокон имели аксоны со скоростями проводимости в диапазоне нейронов Aδ (2-18 м/с) и имели относительно высокие механические пороги (Sakada and Taguchi, 1971), что указывает на роль в ноцицепции. Эти результаты согласуются с выводами Zhao и Levy, которые сообщили, что 82% механочувствительных афферентов в надкостнице свода черепа медленно адаптировались и большинство, но не все, имели скорость проведения в диапазоне волокон Aδ и C.Примечательно, что как Сакада и его коллеги, так и Чжао и Леви сообщили о некоторых медленно адаптирующихся окончаниях свободных волокон, которые реагировали на безвредное растяжение двубрюшной мышцы и/или проводились в диапазоне Aβ, предполагая, что некоторые из них могут быть безвредными механорецепторами, а не ноцицепторами, но они были относительно немного в их приготовлениях.
В исследованиях Sakada и коллег быстро адаптирующиеся окончания свободных волокон были идентифицированы по их ответу на вибрационные стимулы (Sakada and Onoe, 1971; Sakada and Taguchi, 1971).Порог активации измеряли как минимальное напряжение, приложенное к соленоиду механического стимулятора, которое требовалось, чтобы вызвать паттерн возбуждения 1:1 (один импульс на цикл вибрации) с частотой 10 циклов в секунду (Гц). Калибровка по реальной силе не была представлена, поэтому было невозможно сравнить механические пороги с другими исследованиями, но они смогли провести различие между относительно высоким и низким порогом быстрой адаптации свободных окончаний волокон в своих собственных исследованиях. Быстро адаптирующиеся окончания свободных волокон могут следовать частотам вибрации значительно выше 300 циклов в секунду (Sakada and Onoe, 1971).Примерно половина быстро адаптирующихся окончаний свободных волокон в надкостнице имели низкие пороги и реагировали на растяжение двубрюшной мышцы, которое не считалось вредным, поскольку не вызывало болевого рефлекса или рефлекса открывания челюсти (Sakada and Taguchi, 1971). Это свидетельствует о том, что они являются низкопороговыми механорецепторами. Другая половина имела относительно высокие пороги и считалась ноцицепторами (Sakada and Taguchi, 1971). Все 15 механически чувствительных волокон, описанных Mahns, Ivanusic et al.(2006) продемонстрировали быстро адаптирующиеся свойства, так как ступенчатое вдавливание надкостницы с помощью ручных зондов или механических стимулов с сервоуправлением вызывало ответы только в сочетании с динамическими компонентами стимула. Многие из них могут быть активированы с очень низким усилием (всего 0,5 мН) и проведены в диапазоне волокон Aδ и C. Они, вероятно, похожи на быстро адаптирующиеся окончания свободных волокон, определяемые как низкопороговые механорецепторы, о которых сообщают Сакада и его коллеги.
Рецептивное поле отдельного нейрона определяет область ткани, над которой адекватный стимул может вызвать активность, и, следовательно, влияет на способность сенсорного нейрона обнаруживать местоположение стимула и различать несколько стимулов. Рецептивные поля механически чувствительных единиц могут различаться по размеру для разных типов единиц и в разных тканевых системах. Сакада и Тагучи (1971) определили размер рецептивного поля 434 одиночных единиц, иннервирующих надкостницу нижней челюсти.Большинство единиц могут быть активированы в нескольких дискретных рецептивных участках на большой площади надкостницы, обычно от 2 до 20 мм 2 . Незначительная разница в размере рецептивного поля у единиц, которые реагировали на растяжение двубрюшных мышц, и у тех, которые не реагировали, могла иметь очень умеренную тенденцию медленно адаптирующихся единиц иметь несколько большие рецептивные поля, чем быстро адаптирующиеся единицы. В случае надкостницы кошачьей плечевой кости каждая единица имела рецептивное поле, состоящее из одного участка и обычно имело приблизительно овальную форму, которая колебалась от 2 до 4 мм 2 (Mahns et al., 2006). В этом последнем исследовании отдельные периостальные афферентные единицы обычно можно было избирательно активировать с помощью тонких стимульных зондов, что свидетельствует об ограниченном перекрытии терминальных рецептивных полей отдельных волокон в надкостнице.
Наконец, также возможно, что надкостницу иннервируют другие волокна с меньшей или нулевой механической чувствительностью, потому что в областях, которые казались нечувствительными к прямому механическому зондированию, можно было выборочно активировать отдельные волокна путем применения фокальных электрических стимулов (Mahns et al. др., 2006). Они имели скорости проводимости в диапазоне C и Aδ. Они могут реагировать на изменения температуры или химические раздражители вместо механической стимуляции, или они могут быть подобны молчащим ноцицепторам, обнаруженным в других тканевых системах, которые обычно нечувствительны к механической стимуляции в нормальных условиях, но становятся механически чувствительными после воспаления (Grigg et al. ., 1986; Шайбл и Шмидт, 1988; Шайбл, 1996).
Химическая чувствительность и медиаторы воспаления
Химическая чувствительность и сенсибилизация медиаторами воспаления типичны для полимодальных ноцицепторов, особенно тех, которые классифицируются как С-волокна.Только в одном исследовании была проверена химическая чувствительность периостальных афферентных нейронов (Zhao and Levy, 2014). В этом исследовании были сделаны записи сенсорных нейронов, которые иннервируют надкостницу свода черепа, до и во время применения известных болеутоляющих веществ, включая хлорид калия (50–500 мМ), капсаицин (10 мкМ) и протоны (низкий рН). Хлорид калия вызывает дозозависимое увеличение текущей активности периостальных афферентных единиц волокон Aδ и C, но капсаицин и низкий рН редко изменяют текущую активность, а когда это происходит, реакция была слабой.Однако чувствительность периостальных афферентных единиц к механическим раздражителям была отчетливо изменена после применения медиаторов воспаления. Местное применение смеси гистамина, серотонина, брадикинина и PGE2 приводило к увеличению текущей активности почти в одной трети механически чувствительных единиц Aδ и половине единиц C-волокон, а также к увеличению механической чувствительности почти половины волокон Aδ. единиц и всех протестированных единиц волокна C. Механическая сенсибилизация была длительной (часто более 30 минут) и была связана с периорбитальной тактильной гиперчувствительностью, обычно связанной с первичными приступами головной боли.Таким образом, может происходить сенсибилизация периостальных афферентных нейронов, что, вероятно, способствует изменению обработки боли при патологии. В дополнение к доказательствам того, что периостальные афференты могут быть сенсибилизированы, эти данные также подчеркивают, что некоторые периостальные афференты могут активироваться несколькими стимулами и, следовательно, могут считаться полимодальными. Идея о том, что периостальные афферентные единицы являются полимодальными, не исследовалась ни в одном из других исследований периостальной иннервации, описанных выше.
Реакция на изменения температуры
Сакада и Немото (1972) зафиксировали как множественные, так и одиночные реакции на динамические изменения температуры надкостницы.Это было сделано путем регистрации периостальных нервов при охлаждении раствора в ванне с 32 до 27°C и последующем нагревании до 31°C. В записях при 32°С спонтанной активности не было. Количество единиц, активных в многоединичных записях, увеличивалось по мере применения охлаждения, что свидетельствует о постепенном рекрутировании чувствительных к температуре надкостничных единиц. Частота разрядов записей всего нерва также увеличивалась при охлаждении, что указывает на то, что, по крайней мере, некоторые из этих множественных единиц могут кодировать интенсивность или скорость изменения температуры.Интересно, что единицы, которые реагировали на холод, замолчали, когда температура была изменена на температуру, которая нагревается, а не охлаждается, что позволяет предположить, что они ощущают изменения температуры, а не абсолютную температуру. Это похоже на холодовые рецепторы роговицы (Carr et al., 2003). По мере того, как потепление продолжалось, разные единицы начали реагировать на стимул потепления, и они также были способны кодировать интенсивность или скорость изменения стимула потепления. Таким образом, некоторые периостальные афференты реагируют на безвредное охлаждение, а некоторые — на безвредное согревание.Sakada и Nemoto (1972) дополнительно исследовали температурную чувствительность 93 механически чувствительных надкостничных единиц, выделенных из записей всего нерва, применяя температурные изменения к дискретным рецептивным точкам отдельных единиц на надкостнице. Их реакцию на охлаждение оценивали как минимум до 17°C (иногда даже до 0°C) и на нагревание максимум до 45–50°C, диапазоны которых включают температуры, считающиеся вредными. 20 из 93 из них вообще не реагировали на изменения температуры, даже когда эти изменения были экстремальными.24/93 реагировало на похолодание, но не на потепление, а 19/93 реагировало на потепление, но не на похолодание. 30/93 реагировали как на охлаждение, так и на нагрев. Те, что относятся к последним трем категориям, были протестированы только до точки, где был достигнут порог активации либо для охлаждения, либо для нагревания, и поэтому не совсем ясно, все ли они реагировали на вредный диапазон температур, хотя для многих порог активации произошло при вредных температурах. Следует, однако, отметить, что некоторые механически чувствительные ноцицепторы Aδ в коже имеют очень высокий порог к теплу (средний порог выше 53°C), но могут стать более чувствительными к тепловой стимуляции после сенсибилизации (ноцицепторы Aδ типа I; Treede et al. др., 1995), и поэтому температуры, использованные в исследовании Сакады и Немото, возможно, были недостаточными для активации некоторых единиц, которые, по их словам, обладали чисто механической чувствительностью.
В совокупности эти данные свидетельствуют о том, что многие окончания периостальных свободных волокон реагируют на безвредные и вредные термические раздражители. Однако маловероятно, что физиологические изменения температуры вокруг кости достаточно велики, чтобы активировать эти волокна (Sakada and Nemoto, 1972). Также маловероятно, что они активируются непосредственно патологическими изменениями, так как даже нагревание, вызванное воспалением in vivo (Segale, 1919), не вызвало бы достаточного изменения температуры, чтобы активировать эти рецепторы.Конечно, возможно, что, хотя воспаление не вызывает изменений температуры, которые могли бы непосредственно активировать периостальные волокна, оно может изменять их чувствительность к тепловым раздражителям, так что они становятся более чувствительными к изменениям температуры. Действительно, известно, что воспаление повышает термическую чувствительность первичных афферентных нейронов во многих других тканевых системах (Cervero and Laird, 1999; Ren and Dubner, 1999b). Таким образом, активация периостальных афферентов температурой может быть возможна при крайне аномальных или патологических состояниях.
Резюме/выводы
На рисунке обобщены наши знания о физиологии сенсорных нейронов, иннервирующих надкостницу. Надкостница иннервируется как быстропроводящими единицами большого диаметра с инкапсулированными окончаниями, которые, вероятно, обеспечивают информацию о безвредной чувствительности, так и более медленными проводящими единицами малого диаметра со свободными окончаниями волокон, типичными для ноцицепторов. Активация последнего, вероятно, вызывает боль, возникающую при патологии надкостницы.Их свойства реакции, включая скорость проведения и реакцию на химические раздражители, предполагают роль как в быстрой, острой боли в костях, так и в медленной жгучей боли в костях. Однако есть данные, что некоторые свободные окончания волокон в надкостнице активируются при относительно низких порогах. В коже низкопороговая механическая стимуляция небольшого диаметра, миелиновая (Burgess и Perl, 1967; Burgess et al., 1968; Koltzenburg et al., 1997) и немиелинизированная (Vallbo et al., 1993, 1999; Olausson et al., 2002) волокна производят ощущения, которые были описаны как безболезненные. Вопрос о том, играют ли низкопороговые окончания свободных волокон роль в безвредном механосенсорном восприятии в костях, требует дальнейшего изучения (Rowe et al., 2005), но это кажется маловероятным, поскольку трудно представить себе какой-либо стимул, который можно было бы применить к кости, если бы он не учитывался. болезненный. Альтернативой является то, что они могут быть легко активированы низкопороговой механической стимуляцией надкостницы из-за ее тесной связи с нижележащей твердой костной поверхностью и, следовательно, могут способствовать периостальному восприятию боли.Имеются также доказательства того, что нейроны большого диаметра в других тканевых системах могут способствовать обработке боли (Djouhri and Lawson, 2004). Таким образом, возможно, что инкапсулированные окончания большого диаметра, о которых сообщалось, действительно играют некоторую, пока еще не идентифицированную роль, которая также играет роль в боли в костях.
Реактивные свойства окончаний свободных волокон надкостницы . Отдельные периостальные единицы реагируют на механические, химические и термические раздражители. Механически чувствительные единицы можно классифицировать в соответствии с их порогом и профилем адаптации.Хлорид калия дозозависимо активирует большинство периостальных единиц, но капсаицин и низкий рН активируют их лишь изредка. Некоторые периостальные единицы реагируют на охлаждение и нагрев, другие на охлаждение, но не на нагрев, некоторые на нагрев, но не на охлаждение, а некоторые ни на что.
Костный мозг
Брюссова и Лебеденко (1930; цит. по Furusawa, 1970) изучали реакцию собак при введении физиологического раствора под давлением в полость костного мозга. Наблюдая за артериальным давлением и дыханием, они заметили, что во время инъекции животные испытывали сильное болезненное поведение.Это предполагало, что в полости костного мозга должны быть чувствительные нервы, которые реагируют на повышенное давление. Однако только в двух опубликованных работах изучалась физиология сенсорных нейронов, иннервирующих полость костного мозга (Furusawa, 1970; Seike, 1976). В этих исследованиях проводилась запись целого нерва из ветвей большеберцового нерва, в то время как к полости костного мозга применялись механические, термические или химические раздражители. В этих исследованиях не предпринималось попыток исследовать активность отдельных единиц.На основании гистологических данных исследователи предположили, что записи были исключительно из единиц волокон Aδ и C. Однако скорость проведения не была подтверждена ни в одном из исследований.
Свойства механической реакции
Механические стимулы доставлялись в полость костного мозга путем повышения нормального внутрикостного давления путем введения изотонического раствора в костномозговую полость кости. Нормальное внутрикостное давление и степень повышенного давления контролировали с помощью манометра, присоединенного к системе.У собаки нормальное внутрикостное давление в костномозговой полости большеберцовой кости находилось в пределах 30–50 мм рт. ст., а повышение внутрикостного давления в ~3–5 раз (до 100–130 мм рт. единиц в записи целого нерва (Seike, 1976). Подобные пороги активации для целостной нервной деятельности ранее были описаны Furusawa (1970). Это очень высокие пороги, которые вряд ли могут возникнуть в нормальных физиологических условиях. Однако повышение внутрикостного давления (примерно в 3–5 раз выше нормального внутрикостного давления) наблюдается при патологических состояниях, таких как синдромы внутрикостного нагрубания крови (Lemperg and Arnoldi, 1978; Arnoldi et al., 1980). В этих случаях повышение давления связано с болью, которую можно облегчить с помощью фенестрации, предполагая, что повышенное давление в полости костного мозга вызывает боль.
В исследовании Seike (1976) частота разрядов увеличивалась сразу после начала стимуляции давлением, что свидетельствует о коротком латентном ответе на механические раздражители. Скорость разряда обычно имела тенденцию увеличиваться по мере увеличения давления, и когда применялось стабильное линейное изменение давления, ответ постепенно уменьшался, поскольку рецепторы, по-видимому, медленно адаптировались.Однако следует отметить, что в этих исследованиях не выделялись единичные единицы, поэтому неясно, в какой степени этот адаптационный профиль действительно верен для отдельных сенсорных нейронов, иннервирующих полость костного мозга.
Химическая чувствительность
Только в одном исследовании изучалась реакция сенсорных рецепторов костного мозга на химические вещества (Seike, 1976). Интрамедуллярное введение известных болеутоляющих веществ (хлорид калия, ацетилхолин, гистамин, серотонин и брадикинин) в полость костного мозга приводило к увеличению текущей активности всего нерва в течение нескольких минут после инъекции в концентрациях, сравнимых с теми, которые сообщались для активации мышечных ноцицепторов. Фок и Менс, 1976).Хотя сообщалось, что увеличение текущей активности и латентный ответ в значительной степени зависят от концентрации, используемой для каждого вещества, степень этих изменений количественно не оценивалась.
Термическая чувствительность
Seike (1976) попытался зарегистрировать активность всего нерва в ответ на изменения температуры в полости костного мозга после снижения кровотока, вызванного перевязкой бедренной артерии или применением сосудосуживающих средств. В более ранних работах сообщалось, что эти манипуляции вызывают снижение температуры костномозговой полости (Yamada, Yoshino, 1977).Частота разрядов в записи всего нерва увеличивалась в течение 5 минут после лигатуры, а затем постепенно снижалась до контрольного уровня в течение следующих 15 минут. Несмотря на небольшое снижение температуры через 5 минут, изменение температуры в последующие 15 минут, по-видимому, плохо коррелировало с частотой разрядов. Внутрикостное введение адреналина и норадреналина (вазоконстрикторы) также увеличивало скорость разряда целого нерва. Оба вещества вызывали более значительное понижение температуры в полости костного мозга и большее изменение скорости разряда всего нерва, чем при перевязке бедренной артерии.Как и в случае с перевязкой бедренной артерии, связь между изменением температуры и скоростью разряда после начального периода активации не была ясна. Хотя кажется правдоподобным, что температурные изменения способствуют повышению активности всего нерва, гипоксия также может способствовать реакции. Артериальная окклюзия приводит к тяжелой гипоксии и увеличению воспалительных и/или других химических медиаторов (Paterson et al., 1988). Действительно, было показано, что некоторые медиаторы воспаления изменяют активность всего нерва при воздействии непосредственно на костный мозг (см. выше).Таким образом, изменение температуры в этом исследовании, возможно, не было тем стимулом, который фактически вызывал изменение активности всего нерва, о котором сообщил Seike (1976).
Резюме/выводы
На рисунке обобщены наши знания о физиологии сенсорных нейронов, иннервирующих костный мозг. В отличие от надкостницы мало что известно об активности афферентных нейронов в полости костного мозга. Хотя сообщалось об активности всего нерва после механической, химической и, возможно, термической стимуляции полости костного мозга, реакция отдельных единиц не исследовалась.Таким образом, неясно, реагируют ли и как отдельные нейроны, иннервирующие полость костного мозга, на механические, химические или термические стимулы, или же они реагируют на множественные типы стимулов, как в случае с полимодальными ноцицепторами в других тканевых системах. Также неизвестно, могут ли они быть сенсибилизированы медиаторами воспаления или другими химическими раздражителями.
Активность всего нерва после механической, химической и термической стимуляции костного мозга . Активность всего нерва увеличивается в ответ на механическую стимуляцию за счет увеличения внутрикостного давления.Химическая стимуляция дозозависимо увеличивает активность всего нерва. Изменения температуры, вызванные снижением кровотока, по-видимому, влияют на активность всего нерва, но это может быть связано с другими факторами, связанными с нарушением кровоснабжения костного мозга (например, ишемией). Отдельные единицы не тестировались на реакцию на стимуляцию костного мозга.
Физиология центральных проводящих путей, кодирующих информацию о боли в костях
Спинной мозг
Лишь в нескольких исследованиях на животных была предпринята попытка задокументировать физиологию спинномозговых нейронов, участвующих в ноцицепции костей.Большинство из них основывались на исследованиях зависимой от активности экспрессии Fos. Fos представляет собой белок, который продуцируется в ядре клеток после экспрессии гена c-fos немедленного начала (Coggeshall, 2005), и известно, что вредные стимулы индуцируют экспрессию c-fos в нейронах, несущих этот ген. Таким образом, присутствие белка Fos, который может быть помечен иммуногистохимически, может быть использовано для определения местоположения нейронов, физиологически активированных вредными стимулами. Острая болезненная механическая стимуляция кости, применяемая путем сверления кости и повышения внутрикостного давления большеберцовой кости, вызывает увеличение экспрессии Fos в ипсилатеральном поверхностном, но не глубоком дорсальном роге спинного мозга (Ivanusic, 2008; Williams and Ivanusic, 2008). .Тот же паттерн активности наблюдался в исследованиях экспрессии Fos после острой болевой стимуляции кожной ткани (Dai et al., 2001; Jinks et al., 2002) и подразумевает, что спинальные механизмы, которые опосредуют острую боль кожного и костного происхождения, имеют общие некоторые общие черты. Данные указывают на то, что поверхностные задние рога спинного мозга представляют интерес в исследованиях острой боли в костях, но неизвестно, отличается ли этот паттерн экспрессии Fos при воспалительном стимуле.Действительно, когда воспалительные агенты воздействуют на другие тканевые системы (такие как кожа), картина смещается таким образом, что наиболее активными становятся глубокие задние рога (Coggeshall, 2005). В животных моделях боли, вызванной раком костей, и боли при переломах скелета, экспрессия Fos увеличена как в глубоких, так и в поверхностных задних рогах, и существует значительная положительная корреляция между экспрессией Fos и разрушением кости (Schwei et al. , 1999; Хименес-Андраде и др., 2007). Интересно, что увеличение Fos наблюдалось в поверхностных дорсальных рогах в этих исследованиях только после того, как обычно безвредные стимулы доставлялись к бедренной кости путем легкой механической стимуляции (пальпация).У нормальных животных для индукции экспрессии c-Fos в поверхностных дорсальных нейронах требуется болезненная кожная стимуляция (Hunt et al., 1987; Abbadie and Besson, 1993; Abbadie et al., 1994; Honore et al., 1995; Doyle and Хант, 1999). Это говорит о том, что сенсибилизация спинномозговых нейронов происходит при боли, вызванной раком кости, и боли при переломах.
Восходящие пути
Williams и Ivanusic (2008) использовали экспрессию Fos в сочетании с ретроградным отслеживанием для идентификации восходящих мишеней нейронов задних рогов, активируемых вредной механической стимуляцией, осуществляемой при сверлении кости.Они сообщили о вовлечении спинопарабрахиального пути, но не спиноталамического тракта или постсинаптического дорсального столба в этой модели острой костной ноцицепции. Этот паттерн активации отличается от наблюдаемого после острой болезненной механической стимуляции кожных и висцеральных тканей (Palecek et al., 2003). Нейроны спинопарабрахиальной проекции происходят преимущественно из пластинки I спинного рога спинного мозга и проецируются в основном в контралатеральное латеральное парабрахиальное ядро (Kitamura et al., 1993; Гаурио и Бернар, 2002 г.; Альмарестани и др., 2007). Латеральное парабрахиальное ядро связано с несколькими областями мозга, участвующими в аффективно-мотивационных аспектах ноцицептивной обработки и гомеостатическими реакциями на ноцицептивные стимулы, включая миндалевидное тело, ядро солитарного тракта, вентролатеральный продолговатый мозг, околоводопроводное серое вещество, медиальный таламус и гипоталамус (Bianchi). и др., 1998; Альмарестани и др., 2007). Это усиливает связь, соответствующую сильному аффективному компоненту боли в костях.Хотя Уильямс и Иванусик не представили доказательств участия ни спиноталамического тракта, ни постсинаптических путей дорсального столба в ноцицепции кости, они не могли исключить возможность того, что эти пути могут быть вовлечены в модели животных, характеризующихся воспалительным или хроническим раком. индуцированная боль. Как отмечалось выше, модели такого типа характеризуются большей экспрессией Fos в клетках глубокого дорсального рога и, следовательно, с большей вероятностью проецируются через спиноталамический тракт или постсинаптические пути дорсального столба, поскольку большинство клеток этих путей происходит из глубокий задний рог поясничного отдела спинного мозга крысы.
Кора
Понимание физиологии корковых нейронов, активируемых вредными раздражителями, важно, поскольку кора играет решающую роль в восприятии боли. Только одно исследование показало активность коры, связанную со стимуляцией костных афферентных нейронов (Ivanusic et al., 2009). Они показали, что сенсорная информация от кости достигает дискриминационных областей соматосенсорной коры путем электрической стимуляции нерва плечевой кости кошки и регистрации вызванных потенциалов на поверхности первичной (SI) и вторичной (SII) соматосенсорной коры.Важно отметить, что нерв, идущий к кошачьей плечевой кости, содержит только миелинизированные и немиелинизированные нервные волокна малого диаметра, распределение по размерам (Ivanusic et al., 2006) и скорость проведения (Mahns et al., 2006) которых соответствуют волокнам Aδ и C. классификации и, следовательно, роль в ноцицепции. Корковые ответы, вызванные стимуляцией Aδ в других типах тканей, имеют относительно короткую латентность (в пределах 50 мс) и, как полагают, отражают механизмы, связанные с быстрой, острой болью, в то время как корковые ответы, вызванные стимуляцией С-волокон, имеют более длительный латентный период (50–300 мс). ) и, как полагают, отражают механизмы, связанные с медленной жгучей болью (Bromm and Treede, 1984; Willis, 1985).Интересно, что латентный период (6–11 мс) до начала корковых ответов SI и SII при стимуляции нерва плечевой кости кошки согласуется с активацией волокон Aδ в периферическом нерве и может отражать механизм быстрого, резкого, и четко локализованная боль в костях, которая обычно ощущается при периостальной стимуляции или при прорывной боли, связанной с раком кости. Увеличивая интенсивность электрической стимуляции, авторы смогли продемонстрировать более сильную корковую активацию, подразумевая, что нейроны в SI и SII способны кодировать интенсивность стимулов, воздействующих на кость.Они предположили, что небольшие стрессовые переломы вряд ли вызовут сильную боль, поскольку интенсивность кортикальной активности может быть недостаточной, в то время как большие переломы или метастазы, скорее всего, вызовут сильную боль. Этот механизм кодирования интенсивности вредных раздражителей хорошо задокументирован в исследованиях кожной системы на животных (Kenshalo et al., 1988, 2000; Chudler et al., 1990), а результаты исследований функциональной визуализации показывают, что он также вероятно применимо к людям (Porro et al., 1998; Когхилл и др., 1999). Однако исследователям не удалось обнаружить длительные латентные корковые реакции (50–300 мс), которые соответствовали бы активации С-волокон в нерве, ведущем к кошачьей плечевой кости. Хотя они предоставили доказательства того, что это может быть связано с торможением корковой реактивности после первоначального ответа Aδ, они не могли исключить возможность того, что проекции С-волокон на SI и SII слишком распространены, чтобы генерировать фокальные вызванные потенциалы того типа, который они могли бы регистрировать. , или что С-волокно, входящее от нерва в кошачью плечевую кость, вообще не достигает SI и SII.Также возможно, что вход С-волокна вместо этого проецируется на другие области коры, такие как островок, или подкорковые области, включая миндалину, ядро солитарного тракта, вентролатеральный мозг, периакведуктальный серый цвет, таламус и гипоталамус, которые, как сообщается, иметь важное значение в аффективных, эмоциональных аспектах боли.
Патофизиологические изменения в животных моделях боли в костях
Ряд животных моделей патологии костей был разработан и используется для изучения патофизиологических и нейрохимических изменений как в периферических, так и в центральных нейронах, которые способствуют боли в костях.Наиболее распространенной используемой моделью является модель боли, вызванной раком кости, которая обычно включает инокуляцию бедренной или большеберцовой кости грызунов опухолевыми клетками (Schwei et al., 1999; Medhurst et al., 2002), но модели боли, вызванной переломом кости также распространены (Freeman et al., 2008; Minville et al., 2008).
Некоторые провоспалительные цитокины (IL-1β, TNFα, IL-6 и TGFβ) и медиаторы воспаления (CGRP) повышаются в DRG в ответ на рак костей и переломы (Kon et al., 2001; Cho et al. ., 2002; Канг и др., 2005 г.; Рандл и др., 2006; Баамонде и др., 2007 г.; Гейс и др., 2010; Фанг и др., 2015 г.; Хансен и др., 2016). У животных с болью, вызванной раком костей, также повышена экспрессия DRG нескольких мембранных рецепторов/каналов (TRPV1, P2X3, ASIC1a/1b, Nav 1.8 и Nav 1.9), которые, как известно, участвуют в передаче ноцицептивных стимулов и/ или в возбудимости ноцицепторов (Nagae et al., 2007; Niiyama et al., 2007; Han et al., 2012; Qiu et al., 2012; Liu et al., 2013; Ли и др., 2014). Введение селективных антагонистов или антисмысловых олигодезоксинуклеотидов против некоторых из этих каналов/рецепторов ослабляет болевые ощущения у животных с болью при раке кости, еще больше усиливая роль этих молекул при боли в костях (Ghilardi et al., 2005; Gonzalez-Rodriguez et al. , 2009; Каан и др., 2010; Мяо и др., 2010). В других тканевых системах медиаторы воспаления сенсибилизируют периферические ноцицепторы, и, вероятно, участвуют изменения в мембранных рецепторах/каналах (Kidd and Urban, 2001).Однако нет доказательств того, что какой-либо из этих медиаторов воспаления непосредственно активирует или повышает чувствительность костных ноцицепторов или что изменения в экспрессии различных ионных каналов и рецепторов изменяют физиологию или функцию костных афферентных нейронов. Кроме того, изменения, наблюдаемые в DRG, не были локализованы в сенсорных нейронах, иннервирующих кость; экспрессию белка анализировали с использованием Вестерн-блоттинга целых лизатов DRG или количественно определяли с помощью иммуногистохимии, выполненной без ретроградного мечения, чтобы подтвердить, что нейроны DRG иннервируют кость.Таким образом, прямых доказательств роли ионных каналов, рецепторов и медиаторов воспаления в модулировании активности периферических костных афферентных нейронов и в регуляции боли при костной патологии до сих пор нет.
Некоторые прямые доказательства сенсибилизации периферических ноцицепторов при боли, вызванной раком кости, были предоставлены Cain (Cain et al., 2001) и Uhelski (Uhelski et al., 2013). Они сообщили о повышении спонтанной активности и снижении теплового (но не механического) порога в регистрируемых на периферии афферентных волокнах С у животных, у которых развилась поведенческая чувствительность в ответ на инъекцию опухолевых клеток в пяточную кость и вокруг нее, но не у контрольных животных.Однако в обоих этих исследованиях опухолевые клетки не были четко ограничены костью, а зарегистрированные С-волокна были кожными афферентными, поэтому сенсибилизация происходила не с костными афферентными нейронами, а скорее с кожными афферентными нейронами, иннервирующими окружающую кожу. Эти исследования более важны для понимания вторичной или отраженной боли, связанной с костной патологией, чем боли, воспринимаемой при стимуляции самой кости.
В ряде исследований также сообщалось об изменениях в центральной нервной системе, вызванных патологией костей.Повышенная экспрессия спинального SP, CGRP и других медиаторов воспаления (TNF, IL-1, IL-6, CCL2 и фактора роста нервов) наблюдается в спинном мозге крыс с болью, вызванной переломами и раком кости (Zhao и др., 2013; Ши и др., 2015). Рак кости вызывает гипертрофию астроцитов в спинном мозге и повышение экспрессии прогипералгетического пептида динорфина и c-Fos в нейронах второго порядка глубоких дорсальных рогов (Schwei et al., 1999; Honore et al., 2000b; Shen). и другие., 2014). Рак кости также вызывает изменения свойств физиологического ответа нейронов второго порядка в задних рогах спинного мозга. В поверхностных дорсальных рогах животных с раком кости наблюдается усиление спинальной синаптической передачи, более высокая доля клеток с широким динамическим диапазоном и увеличенные размеры рецептивного поля в клетках с широким динамическим диапазоном (Urch et al., 2003; Donovan-Rodriguez et al. ., 2004; Янагисава и др., 2010). Вместе эти изменения приводят к более возбудимому спинному мозгу. Они типичны для центральной сенсибилизации и могут лежать в основе развития хронической боли в костях.
Заключительные выводы
Во многих исследованиях сообщалось о существовании сенсорных нейронов, иннервирующих надкостницу и полость костного мозга, и стало ясно, что большинство из них имеют морфологию и молекулярный фенотип, соответствующие роли в ноцицепции. Однако о физиологии этих нейронов известно очень мало. Надкостнице уделялось больше внимания по сравнению с костным мозгом, что отражает более легкий доступ к надкостнице для экспериментальной оценки, чем к полости костного мозга.Электрофизиологические записи сенсорных нейронов как в надкостнице, так и в костном мозге подтвердили, что они оба содержат ноцицепторы, которые, вероятно, обеспечивают ЦНС информацией о боли в костях. Надкостница (но не костный мозг) также иннервируется нейронами, обладающими свойствами, предполагающими, что они могут быть рецепторами растяжения или придавать безвредную чувствительность, хотя неясно, имеет ли последнее отношение к стимулам, воздействующим на кость. Имеются лишь ограниченные доказательства того, что афферентные нейроны периферических костей могут быть сенсибилизированы или что они могут быть активированы несколькими типами стимулов, и в настоящее время это существует только частично для периостальных единиц.Очевидно, что в центральной нервной системе нейроны задних рогов спинного мозга могут активироваться вредными стимулами, воздействующими на кость. Некоторые из них могут быть сенсибилизированы при патологических состояниях и могут способствовать вторичной гипералгезии или отраженной боли, связанной с костной патологией. Существует лишь несколько исследований восходящих путей и задействованных корковых территорий. Хотя они дают некоторые подсказки относительно того, как информация о боли в костях централизованно кодируется, их необходимо расширить, чтобы углубить наше понимание других задействованных центральных областей.Нам предстоит еще многое узнать о физиологии костных афферентных нейронов и их центральных проекций, прежде чем мы приблизимся к пониманию того, как мы думаем о боли в костях и справляемся с ней.
Вклад авторов
SN и JI внесли свой интеллектуальный вклад в разработку этого обзора, включая составление проекта и редактирование рукописи. Оба одобрили окончательную версию для публикации.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
- Аббади С., Бессон Дж. М. (1993). Экспрессия C-fos в поясничном отделе спинного мозга крыс после периферической стимуляции у крыс с артритом, индуцированным адъювантом, и у нормальных крыс. Мозг Res.
607, 195–204. 10.1016/0006-8993(93)
-O [PubMed] [CrossRef] [Google Scholar]
- Аббади К., Оноре П., Бессон Дж. М. (1994). Интенсивная холодовая вредная стимуляция задней лапы крыс индуцирует экспрессию c-fos в нейронах поясничного отдела спинного мозга. неврология 59, 457–468. 10.1016/0306-4522(94)-2 [PubMed] [CrossRef] [Google Scholar]
- Almarestani L., Уотерс С.М., Краузе Дж.Е., Беннетт Г.Дж., Рибейро-Да-Сильва А. (2007). Морфологическая характеристика нейронов пластинки I задних рогов спинного мозга, проецирующихся на парабрахиальное ядро крысы. Дж. Комп. Нейрол. 504, 287–297. 10.1002/cne.21410 [PubMed] [CrossRef] [Google Scholar]
- Arnoldi CC (1990). Внутрикостные нагрубание-болевые синдромы. Патомеханизм боли, Bone Circulation and Bone Necrosis, eds Arlet J., Mazières B. (Berlin; Heidelberg: Springer;), 253–259. 10.1007/978-3-642-73644-5_52 [CrossRef] [Google Scholar]
- Арнольди С.К., Джурхуус Дж. К., Хеерфордт Дж., Карле А. (1980). Внутрикостная флебография, измерение внутрикостного давления и 99m ТС-полифосфатсцинтиграфия у больных с различными болезненными состояниями в тазобедренном и коленном суставах. Акта Ортоп. Сканд. 51, 19–28. 10.3109/174536780089
- [PubMed] [CrossRef] [Google Scholar]
- Асо К., Икеучи М., Изуми М., Сугимура Н., Като Т., Усида Т. и др. . (2014). Ноцицептивный фенотип нейронов ганглиев задних корешков, иннервирующих субхондральную кость в коленных суставах крыс.Евро. Дж. Пейн 18, 174–181. 10.1002/j.1532-2149.2013.00360.x [PubMed] [CrossRef] [Google Scholar]
- Баамонде А., Курто-Рейес В., Хуарес Л., Меана А., Идальго А., Менендес Л. (2007 г. ). Антигипералгезические эффекты, вызванные антагонистом рецептора IL-1 анакинрой, и повышение уровня IL-1бета у воспаленных мышей и мышей с остеосаркомой. Жизнь наук. 81, 673–682. 10.1016/j.lfs.2007.07.003 [PubMed] [CrossRef] [Google Scholar]
- Бьянки Р., Корсетти Г., Роделла Л., Тредичи Г., Джоя М. (1998).Супраспинальные соединения и паттерны окончания парабрахиального комплекса, определенные методом отслеживания биоцитинового антероградного тракта у крысы. Дж. Анат. 193 (часть 3), 417–430. 10.1046/j.1469-7580.1998.19330417.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бьюрхольм А., Крейкбергс А., Бродин Э., Шульцберг М. (1988). Вещество P- и CGRP-иммунореактивные нервы в кости. пептиды 9, 165–171. 10.1016/0196-9781(88)-X [PubMed] [CrossRef] [Google Scholar]
- Bove S.E., Flatters S.J., Inglis J.J., Mantyh P.W. (2009). Новые достижения в лечении скелетно-мышечной боли. Мозг Res. преп. 60, 187–201. 10.1016/j.brainresrev.2008.12.012 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Брюсова С. С., Лебеденко В. В. (1930). Zur Schmerzleitungsfähigkeit der Gefäße. Z. Gesamte Exp. Мед. 69, 29–40. 10.1007/BF02622549 [CrossRef] [Google Scholar]
- Bromm B., Treede RD (1984). Разряды нервных волокон, церебральные потенциалы и ощущения, вызванные стимуляцией лазером CO2.Гум. Нейробиол. 3, 33–40. [PubMed] [Google Scholar]
- Burgess PR, Perl ER (1967). Миелиновые афферентные волокна специфически реагируют на вредное раздражение кожи. Дж. Физиол. (Лонд). 190, 541–562. 10.1113/jphysiol.1967.sp008227 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Burgess PR, Perl ER (1973). Кожные механорецепторы и ноцицепторы, в Handbook of Sensory Physiology, Vol. II, изд. Игго А. (Нью-Йорк, штат Нью-Йорк: Springer-Verlag;), 29–78. [Google Scholar]
- Берджесс П.Р., Пети Д., Уоррен Р. М. (1968). Типы рецепторов волосистой кожи кошек снабжены миелинизированными волокнами. Дж. Нейрофизиол. 31, 833–848. [PubMed] [Google Scholar]
- Каин Д. М., Вачник П. В., Эйкмайер Л., Бейтц А., Уилкокс Г. Л., Симона Д. А. (2001). Функциональные взаимодействия между опухолью и периферическим нервом в модели онкологической боли у мышей. Боль Мед. 2, 15–23. 10.1046/j.1526-4637.2001.002001015.x [PubMed] [CrossRef] [Google Scholar]
- Calvo W. (1968). Иннервация костного мозга лабораторных животных.Являюсь. Дж. Анат. 123, 315–328. 10.1002/aja.1001230206 [PubMed] [CrossRef] [Google Scholar]
- Карр Р. В., Пианова С., Фернандес Дж., Фэллон Дж. Б., Бельмонте К., Брок Дж. А. (2003). Влияние нагревания и охлаждения на импульсы нервных окончаний, регистрируемые холодочувствительными рецепторами роговицы морской свинки. J. Gen. Physiol. 121, 427–439. 10.1085/jgp.200308814 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Castaneda-Corral G., Jimenez-Andrade J.M., Bloom A.P., Taylor R.N., Mantyh W.Г., Качмарска М.Дж. и соавт. . (2011). Большинство миелинизированных и немиелинизированных чувствительных нервных волокон, иннервирующих кость, экспрессируют киназу рецептора тропомиозина А. Неврология 178, 196–207. 10.1016/j.neuroscience.2011.01.039 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Серверо Ф., Лэрд Дж. М. (1999). Висцеральная боль. Ланцет 353, 2145–2148. 10.1016/S0140-6736(99)01306-9 [PubMed] [CrossRef] [Google Scholar]
- Чо Т.Дж., Герстенфельд Л.С., Эйнхорн Т.А. (2002). Дифференциальная временная экспрессия членов суперсемейства трансформирующих факторов роста бета во время заживления переломов у мышей.Дж. Боун Шахтер. Рез. 17, 513–520. 10.1359/jbmr.2002.17.3.513 [PubMed] [CrossRef] [Google Scholar]
- Chrastil J., Sampson C., Jones K.B., Higgins T.F. (2013). Послеоперационное введение опиоидов ингибирует заживление костей на животных моделях. клин. Ортоп. Относ. Рез. 471, 4076–4081. 10.1007/s11999-013-3232-z [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Чудлер Э. Х., Антон Ф., Дубнер Р., Кеншало Д. Р., мл. (1990). Ответы ноцицептивных нейронов SI у обезьян и болевые ощущения у людей, вызванные вредной тепловой стимуляцией: влияние межстимульного интервала.Дж. Нейрофизиол. 63, 559–569. [PubMed] [Google Scholar]
- Coggeshall RE (2005). Fos, ноцицепция и задний рог. Прог Нейробиол 77, 299–352. 10.1016/j.pneurobio.2005.11.002 [PubMed] [CrossRef] [Google Scholar]
- Когхилл Р. К., Санг С. Н., Майсог Дж. М., Ядарола М. Дж. (1999). Обработка интенсивности боли в человеческом мозгу: двусторонний распределенный механизм. Дж. Нейрофизиол. 82, 1934–1943. [PubMed] [Google Scholar]
- Купер Р. Р., Милграм Дж. В., Робинсон Р.А. (1966). Морфология остеона. Электронно-микроскопическое исследование. J. Хирургия суставов костей. Являюсь. 48, 1239–1271. [PubMed] [Google Scholar]
- Дай Ю., Ивата К., Кондо Э., Моримото Т., Ногучи К. (2001). Избирательное увеличение экспрессии Fos в нейронах спинного мозга после постепенной термической стимуляции у крыс с экспериментальной мононевропатией. Боль 90, 287–296. 10.1016/S0304-3959(00)00411-5 [PubMed] [CrossRef] [Google Scholar]
- Де Кастро Ф. (1925). Техника для окрашивания системы нервов, которая лучше всего подходит для кожи.Траб. лаборатория биол. ун-т Мадрид 23, 427–447. [Google Scholar]
- Диксон А. Д. (1963). Ультраструктура нервных волокон в тройничном узле крысы. Дж. Ультраструктур. Рез. 8, 107–121. 10.1016/S0022-5320(63)80023-4 [PubMed] [CrossRef] [Google Scholar]
- Джухри Л., Лоусон С. Н. (2004). Ноцицептивные первичные афферентные нейроны A-волокна: обзор частоты и свойств по отношению к другим афферентным нейронам A-волокна у млекопитающих. Мозг Res. Мозг Res. преп. 46, 131–145. 10.1016/j.brainresrev.2004.07.015 [PubMed] [CrossRef] [Google Scholar]
- Донован-Родригес Т., Дикенсон А. Х., Урч С. Е. (2004). Реакции нейронов поверхностных дорсальных рогов и появление поведенческой гипералгезии в крысиной модели боли в костях, вызванной раком. Неврологи. лат. 360, 29–32. 10.1016/j.neulet.2004.01.048 [PubMed] [CrossRef] [Google Scholar]
- Doyle CA, Hunt SP (1999). Нейроны, экспрессирующие рецептор вещества P (нейрокинин-1), в пластинке I спинного мозга кодируют интенсивность вредной стимуляции: исследование c-Fos на крысах.неврология 89, 17–28. 10.1016/S0306-4522(98)00276-0 [PubMed] [CrossRef] [Google Scholar]
- Дункан С. П., Шим С. С. (1977). Ж. Эдуард Самсон Адрес: вегетативная иннервация кости. Экспериментальное исследование внутрикостного адренергического сосудистого нерва у кролика. J. Хирургия суставов костей. бр. 59, 323–330. [PubMed] [Google Scholar]
- Fang D., Kong L.Y., Cai J., Li S., Liu X.D., Han J.S., et al. . (2015). Опосредованная интерлейкином-6 функциональная активация рецепторов TRPV1 в нейронах ганглиев задних корешков посредством активации сигнального пути JAK/PI3K: роль в развитии боли при раке кости на модели крыс.Боль 156, 1124–1144. 10.1097/j.pain.0000000000000158 [PubMed] [CrossRef] [Google Scholar]
- Фок С., Менсе С. (1976). Возбуждающие эффекты 5-гидрокситриптамина, гистамина и ионов калия на афферентные единицы мышечной группы IV: сравнение с брадикинином. Мозг Res.
105, 459–469. 10.1016/0006-8993(76)
-X [PubMed] [CrossRef] [Google Scholar]
- Freeman K.T., Koewler N.J., Jimenez-Andrade J.M., Buus R.J., Herrera M.B., Martin C.D., et al. . (2008). Модель боли при переломе у крысы: адаптация модели закрытого перелома бедренной кости для изучения скелетной боли.Анестезиология 108, 473–483. 10.1097/ALN.0b013e3181649351 [PubMed] [CrossRef] [Google Scholar]
- Furusawa S. (1970). Нейрофизиологическое исследование чувствительности костного мозга. Ниппон Сейкейгека Гаккай Засси 44, 365–370. [PubMed] [Google Scholar]
- Гайда М., Литвин Дж. А., Адриансен Д., Тиммерманс Дж. П., Чихоцкий Т. (2004). Сегментарное распределение и морфометрические особенности первичных сенсорных нейронов, проецирующихся на надкостницу большеберцовой кости у крыс. Фолиа гистохим. Цитобиол.42, 95–99. 10.5603/4656 [PubMed] [CrossRef] [Google Scholar]
- Gauriau C., Bernard JF (2002). Пути боли и парабрахиальные цепи у крысы. Эксп. Физиол. 87, 251–258. 10.1113/eph8702357 [PubMed] [CrossRef] [Google Scholar]
- Geis C., Graulich M., Wissmann A., Hagenacker T., Thomale J., Sommer C., et al. . (2010). Вызванное болевое поведение и активация спинальной глии зависят от рецептора фактора некроза опухоли 1 и 2 в мышиной модели боли при раке кости. неврология 169, 463–474.10.1016/j.neuroscience.2010.04.022 [PubMed] [CrossRef] [Google Scholar]
- Ghilardi J. R., Rohrich H., Lindsay T. H., Sevcik M. A., Schwei M. J., Kubota K., et al. . (2005). Селективная блокада рецептора капсаицина TRPV1 ослабляет боль при раке кости. Дж. Нейроски. 25, 3126–3131. 10.1523/JNEUROSCI.3815-04.2005 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Gonzalez-Rodriguez S., Pevida M., Roques BP, Fournie-Zaluski MC, Hidalgo A., Menendez L., и другие. . (2009).Участие энкефалинов в ингибировании термической гипералгезии, вызванной остеосаркомой, вызванной блокадой периферических P2X3-рецепторов. Неврологи. лат. 465, 285–289. 10.1016/j.neulet.2009.09.015 [PubMed] [CrossRef] [Google Scholar]
- Grigg P., Schaible HG, Schmidt RF (1986). Механическая чувствительность афферентов группы III и IV от заднего суставного нерва в норме и при воспалении кошачьего колена. Дж. Нейрофизиол. 55, 635–643. [PubMed] [Google Scholar]
- Гронблад М., Лиези П., Коркала О., Карахарью Э., Полак Дж. (1984). Иннервация надкостницы костей человека пептидергическими нервами. Анат. Рек. 209, 297–299. 10.1002/ar.10920
- [PubMed] [CrossRef] [Google Scholar]
- Haegerstam GA (2001). Патофизиология боли в костях: обзор. Акта Ортоп. Сканд. 72, 308–317. 10.1080/00016470152846682 [PubMed] [CrossRef] [Google Scholar]
- Halvorson K.G., Kubota K., Sevcik M.A., Lindsay T.H., Sotillo J.E., Ghilardi J.R., et al. . (2005). Блокирующие антитела к фактору роста нервов ослабляют скелетную боль, вызванную ростом клеток опухоли предстательной железы в костях.Рак Рез. 65, 9426–9435. 10.1158/0008-5472.CAN-05-0826 [PubMed] [CrossRef] [Google Scholar]
- Han Y., Li Y., Xiao X., Liu J., Meng X. L., Liu F. Y., et al. . (2012). Формальдегид активирует TRPV1 через сигнальные пути MAPK и PI3K в крысиной модели боли при раке костей. Неврологи. Бык. 28, 165–172. 10.1007/s12264-012-1211-0 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Hansen R.R., Vacca V., Pitcher T., Clark A.K., Malcangio M. (2016). Роль внеклеточного пептида, родственного гену кальцитонина, в механизмах боли в костях спинного мозга, вызванной раком.Боль 157, 666–676. 10.1097/j.pain.0000000000000416 [PubMed] [CrossRef] [Google Scholar]
- Hill E.L., Elde R. (1988). Связанные с геном кальцитонина пептид-иммунореактивные нервные волокна в надкостнице нижней челюсти крысы: свидетельство первичного афферентного происхождения. Неврологи. лат. 85, 172–178. 10.1016/0304-3940(88) -3 [PubMed] [CrossRef] [Google Scholar]
- Hill E.L., Elde R. (1991). Распределение CGRP-, VIP-, D бета H-, SP- и NPY-иммунореактивных нервов в надкостнице крысы.Сотовые Ткани Res. 264, 469–480. 10.1007/BF00319037 [PubMed] [CrossRef] [Google Scholar]
- Hohmann E.L., Elde R.P., Rysavy J.A., Einzig S., Gebhard R.L. (1986). Иннервация надкостницы и кости симпатическими вазоактивными интестинальными пептидсодержащими нервными волокнами. Наука 232, 868–871. 10.1126/science.3518059 [PubMed] [CrossRef] [Google Scholar]
- Холмс Д. (2012). Обезболивающие против NGF снова в ходу? Нац. Преподобный Друг Дисков. 11, 337–338. 10.1038/nrd3732 [PubMed] [CrossRef] [Google Scholar]
- Оноре П., Буритова Дж., Бессон Дж. М. (1995). Вызванная карагенином экспрессия c-Fos в поясничном отделе спинного мозга крыс: эффекты индометацина. Евро. Дж. Фармакол. 272, 249–259. 10.1016/0014-2999(94)00656-R [PubMed] [CrossRef] [Google Scholar]
- Оноре П., Люгер Н. М., Сабино М. А., Швей М. Дж., Роджерс С. Д., Мах Д. Б. и др. . (2000а). Остеопротегерин блокирует вызванное раком кости разрушение скелета, скелетную боль и связанную с болью нейрохимическую реорганизацию спинного мозга. Нац. Мед. 6, 521–528.10.1038/74999 [PubMed] [CrossRef] [Google Scholar]
- Оноре П., Мантых П. В. (2000). Боль при раке костей: от механизма к модели и терапии. Боль Мед. 1, 303–309. 10.1046/j.1526-4637.2000.00047.x [PubMed] [CrossRef] [Google Scholar]
- Оноре П., Роджерс С. Д., Швей М. Дж., Салак-Джонсон Дж. Л., Люгер Н. М., Сабино М. С. и др. . (2000б). Каждая мышиная модель воспалительной, невропатической и раковой боли генерирует уникальный набор нейрохимических изменений в спинном мозге и сенсорных нейронах.неврология 98, 585–598. 10.1016/S0306-4522(00)00110-X [PubMed] [CrossRef] [Google Scholar]
- Хант С. П., Пини А., Эван Г. (1987). Индукция c-fos-подобного белка в нейронах спинного мозга после сенсорной стимуляции. Природа 328, 632–634. 10.1038/328632a0 [PubMed] [CrossRef] [Google Scholar]
- Hurrell D. (1937). Иннервация кости. Дж. Анат. 72, 54–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Inman V., Saunders J. (1944). Отраженная боль от скелетных структур.Дж. Нерв. Мент. Дис. 99, 660–667. 10.1097/00005053-194405000-00023 [CrossRef] [Google Scholar]
- Ivanusic J. (2009). Размер, нейрохимия и сегментарное распределение сенсорных нейронов, иннервирующих большеберцовую кость крысы. Дж. Комп. Нейрол. 517, 276–283. 10.1002/cne.22160 [PubMed] [CrossRef] [Google Scholar]
- Ivanusic JJ (2008). Паттерн экспрессии Fos в спинном дорсальном роге после острой вредной механической стимуляции кости. Евро. Дж. Пейн 12, 895–899. 10.1016/j.ejpain.2007.12.017 [PubMed] [CrossRef] [Google Scholar]
- Иванушич Дж. Дж., Манс Д. А., Сахай В., Роу М. Дж. (2006). Отсутствие чувствительных волокон большого диаметра в нерве кошачьей плечевой кости. Дж. Анат. 208, 251–255. 10.1111/j.1469-7580.2006.00519.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Ivanusic JJ, Sahai V., Mahns DA (2009). Корковое представление сенсорных сигналов, исходящих от кости. Мозг Res. 1269, 47–53. 10.1016/j.brainres.2009.03.001 [PubMed] [CrossRef] [Google Scholar]
- Хименес-Андраде Дж.M., Mantyh W.G., Bloom A.P., Xu H., Ferng A.S., Dussor G., et al. . (2010). Фенотипически ограниченный набор первичных афферентных нервных волокон иннервирует кость по сравнению с кожей: терапевтическая возможность для лечения скелетной боли. Кость 46, 306–313. 10.1016/j.bone.2009.09.013 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Jimenez-Andrade JM, Martin C.D., Koewler N.J., Freeman K.T., Sullivan L.J., Halvorson K.G., et al. . (2007). Секвестрирующая терапия фактором роста нервов ослабляет незлокачественную скелетную боль после перелома.Боль 133, 183–196. 10.1016/j.pain.2007.06.016 [PubMed] [CrossRef] [Google Scholar]
- Джинкс С.Л., Саймонс С.Т., Десирье Дж.М., Карстенс М.И., Антонини Дж.Ф., Карстенс Э. (2002). Индукция C-fos в поверхностных спинных рогах крыс после нанесения на кожу вредных химических или механических раздражителей. Эксп. Мозг Res. 145, 261–269. 10.1007/s00221-002-1128-3 [PubMed] [CrossRef] [Google Scholar]
- Каан Т. К., Ип П. К., Патель С., Дэвис М., Маршан Ф., Кокейн Д. А. и др.. (2010). Системная блокада рецепторов P2X3 и P2X2/3 ослабляет болевые ощущения при раке костей у крыс. Головной мозг 133, 2549–2564. 10.1093/brain/awq194 [PubMed] [CrossRef] [Google Scholar]
- Кан Ю., Хе В., Талли С., Гупта Г. П., Серганова И., Чен С. Р. и др. . (2005). Метастазирование рака молочной железы в кости, опосредованное опухолевым супрессорным путем smad. проц. Натл. акад. науч. США. 102, 13909–13914. 10.1073/pnas.0506517102 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Kenshalo D.Р., младший, Чудлер Э. Х., Антон Ф., Дубнер Р. (1988). Ноцицептивные нейроны SI участвуют в процессе кодирования, с помощью которого обезьяны воспринимают интенсивность вредной тепловой стимуляции. Мозг Res. 454, 378–382. 10.1016/0006-8993(88) -4 [PubMed] [CrossRef] [Google Scholar]
- Кеншало Д. Р., Ивата К., Шолас М., Томас Д. А. (2000). Свойства реакции и организация ноцицептивных нейронов в области 1 первичной соматосенсорной коры обезьяны. Дж. Нейрофизиол. 84, 719–729. [PubMed] [Google Scholar]
- Кидд Б.Л., Урбан Л.А. (2001). Механизмы воспалительной боли. бр. Дж. Анаст. 87, 3–11. 10.1093/bja/87.1.3 [PubMed] [CrossRef] [Google Scholar]
- Китамура Т., Ямада Дж., Сато Х., Ямасита К. (1993). Клетки происхождения спинопарабрахиальных волокон у крыс: исследование с быстрым синим и WGA-HRP. Дж. Комп. Нейрол. 328, 449–461. 10.1002/cne.
- 0310 [PubMed] [CrossRef] [Google Scholar]
- Koewler N.J., Freeman K.T., Buus R.J., Herrera M.B., Jimenez-Andrade J.M., Ghilardi J.R., et al.. (2007). Влияние моноклонального антитела против фактора роста нервов на скелетную боль и заживление кости после перелома бедренной кости мыши C57BL/6J. Дж. Боун Шахтер. Рез. 22, 1732–1742 гг. 10.1359/jbmr.070711 [PubMed] [CrossRef] [Google Scholar]
- Koltzenburg M., Stucky C.L., Lewin G.R. (1997). Рецептивные свойства сенсорных нейронов мыши, иннервирующих волосистую кожу. Дж. Нейрофизиол. 78, 1841–1850 гг. [PubMed] [Google Scholar]
- Кон Т., Чо Т. Дж., Айзава Т., Ямадзаки М., Нух Н., Грейвс Д. и др. . (2001). Экспрессия остеопротегерина, активатора рецептора лиганда NF-kappaB (лиганд остеопротегерина) и родственных провоспалительных цитокинов при заживлении переломов. Дж. Боун Шахтер. Рез. 16, 1004–1014. 10.1359/jbmr.2001.16.6.1004 [PubMed] [CrossRef] [Google Scholar]
- Kyloh M., Spencer NJ (2014). Новый метод антеградной трассировки нейронов для выборочной маркировки афферентных нервных окончаний спинного мозга, которые кодируют вредные и безвредные стимулы во внутренних органах. Нейрогастроэнтерол.Мотиль. 26, 440–444. 10.1111/nmo.12266 [PubMed] [CrossRef] [Google Scholar]
- Lawson S.N., Waddell P.J. (1991). Иммунореактивность нейрофиламентов сомы связана с размером клеток и скоростью проводимости волокон в первичных сенсорных нейронах крыс. Дж. Физиол. (Лонд). 435, 41–63. 10.1113/jphysiol.1991.sp018497 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Lemperg R.K., Arnoldi C.C. (1978). Значение внутрикостного давления в норме и при патологии с особым упором на внутрикостное нагрубание-болевой синдром.клин. Ортоп. Относ. Рез. 136, 143–156. [PubMed] [Google Scholar]
- Li Y., Cai J., Han Y., Xiao X., Meng X.L., Su L. и др. . (2014). Улучшенная функция TRPV1 посредством повышающей регуляции инсулиноподобным фактором роста-1 в крысиной модели боли при раке кости. Евро. Дж. Пейн 18, 774–784. 10.1002/j.1532-2149.2013.00420.x [PubMed] [CrossRef] [Google Scholar]
- Liu M., Yang H., Fang D., Yang J.J., Cai J., Wan Y., et al. . (2013). Повышенная регуляция рецепторов P2X3 нейронным кальциевым сенсорным белком VILIP-1 в ганглиях задних корешков способствует боли при раке кости у крыс.Боль 154, 1551–1568. 10.1016/j.pain.2013.04.022 [PubMed] [CrossRef] [Google Scholar]
- Mach D.B., Rogers S.D., Sabino M.C., Luger N.M., Schwei M.J., Pomonis J.D., et al. . (2002). Происхождение скелетной боли: сенсорная и симпатическая иннервация бедренной кости мыши. неврология 113, 155–166. 10.1016/S0306-4522(02)00165-3 [PubMed] [CrossRef] [Google Scholar]
- Mahns D. A., Ivanusic J. J., Sahai V., Rowe M. J. (2006). Интактный препарат периферического нерва для мониторинга активности одиночных периостальных афферентных нервных волокон.Дж. Нейроски. Методы 156, 140–144. 10.1016/j.jneumeth.2006.02.019 [PubMed] [CrossRef] [Google Scholar]
- Mahns D., Sahai V., Ivanusic J., Tracey D., Rowe M. (2004). Препарат периферического нерва для изучения характеристик реакции отдельных чувствительных нервных волокон периостального происхождения. проц. Ауст. Здоровье Мед. Рез. Конг. Абстр. 1423, 304. [Google Scholar]
- Mantyh P. W. (2014). Нейробиология скелетной боли. Евро. Дж. Нейроски. 39, 508–519. 10.1111/ejn.12462 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Mantyh P.В., Хант С.П. (2004). Механизмы, которые вызывают и поддерживают боль при раке кости. Novartis обнаружила Symp. 260, 221–238; обсуждение 238–240, 277–229. 10.1002/0470867639.ch25 [PubMed] [CrossRef] [Google Scholar]
- Martin C.D., Jimenez-Andrade JM, Ghilardi JR, Mantyh P.W. (2007). Организация уникальной сетчатой сети сенсорных волокон CGRP+ в надкостнице мышей: значение для возникновения и поддержания боли при переломах костей. Неврологи. лат. 427, 148–152. 10.1016/j.neulet.2007.08.055 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Medhurst S.J., Walker K., Bowes M., Kidd B.L., Glatt M., Muller M., et al. . (2002). Крысиная модель боли при раке кости. Боль 96, 129–140. 10.1016/S0304-3959(01)00437-7 [PubMed] [CrossRef] [Google Scholar]
- Miao X.R., Gao X.F., Wu J.X., Lu Z.J., Huang Z.X., Li X.Q., et al. . (2010). Двустороннее подавление Nav1.8 в ганглиях задних корешков крыс с болью при раке костей, вызванной инокуляцией клеток опухоли молочной железы Walker 256.BMC Рак 10:216. 10.1186/1471-2407-10-216 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Миллер Р. М., Касахара М. (1963). Наблюдения за иннервацией длинных костей человека. Анат. Рек. 145, 13–23. 10.1002/ar.10
- 104 [CrossRef] [Google Scholar]
- Минвилл В., Лаффосс Дж. М., Фуркад О., Джиролами Дж. П., Тэк И. (2008). Мышиная модель боли при переломах. Анестезиология 108, 467–472. 10.1097/ALN.0b013e3181649333 [PubMed] [CrossRef] [Google Scholar]
- Нагае М., Хирага Т., Йонеда Т. (2007). Кислая микросреда, создаваемая остеокластами, вызывает боль в костях, связанную с колонизацией опухоли. Дж. Боун Шахтер. Метаб. 25, 99–104. 10.1007/s00774-006-0734-8 [PubMed] [CrossRef] [Google Scholar]
- Ниияма Ю., Кавамата Т., Ямамото Дж., Омотэ К., Намики А. (2007). Рак кости увеличивает транзиторный рецепторный потенциал экспрессии ваниллоидного подсемейства 1 в отдельных субпопуляциях нейронов ганглиев дорсальных корешков. неврология 148, 560–572. 10.1016/j.Неврология.2007.05.049 [PubMed] [CrossRef] [Google Scholar]
- Нив Д., Гофельд М., Девор М. (2003). Причины болей при дегенеративных заболеваниях костей и суставов: урок вертебропластики. Боль 105, 387–392. 10.1016/S0304-3959(03)00277-X [PubMed] [CrossRef] [Google Scholar]
- Olausson H., Lamarre Y., Backlund H., Morin C., Wallin B.G., Starck G., et al. . (2002). Немиелинизированные тактильные афференты сигнализируют о прикосновении и проецируются на островковую кору. Нац. Неврологи. 5, 900–904. 10.1038/nn896 [PubMed] [CrossRef] [Google Scholar]
- Palecek J., Палецкова В., Уиллис В. Д. (2003). Экспрессия Fos в спиноталамических и постсинаптических нейронах дорсального столба после вредных висцеральных и кожных раздражителей. Боль 104, 249–257. 10.1016/S0304-3959(03)00013-7 [PubMed] [CrossRef] [Google Scholar]
- Paterson D. J., Estavillo J. A., Nye PC (1988). Влияние гипоксии на концентрацию калия в плазме и возбуждение артериальных хеморецепторов у кошек. QJ Exp. Физиол. 73, 623–625. 10.1113/expphysiol.1988.sp003182 [PubMed] [CrossRef] [Google Scholar]
- Porro C.А., Четтоло В., Франческато М.П., Баральди П. (1998). Временное и интенсивное кодирование боли в коре головного мозга человека. Дж. Нейрофизиол. 80, 3312–3320. [PubMed] [Google Scholar]
- Портеной Р. К., Пейн Д., Якобсен П. (1999). Прорывная боль: характеристики и влияние на пациентов с онкологической болью. Боль 81, 129–134. 10.1016/S0304-3959(99)00006-8 [PubMed] [CrossRef] [Google Scholar]
- Поунтос И., Георгули Т., Калори Г. М., Джанноудис П. В. (2012). Влияют ли нестероидные противовоспалительные препараты на заживление костей? Критический анализ.Научный мировой журнал 2012:606404. 10.1100/2012/606404 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Qiu F., Jiang Y., Zhang H., Liu Y., Mi W. (2012). Повышенная экспрессия устойчивых к тетродотоксину натриевых каналов Nav1.8 и Nav1.9 в ганглиях задних корешков в крысиной модели боли при раке кости. Неврологи. лат. 512, 61–66. 10.1016/j.neulet.2012.01.069 [PubMed] [CrossRef] [Google Scholar]
- Ralston HJ, III, Miller MR, Kasahara M. (1960). Нервные окончания в фасциях, сухожилиях, связках, надкостнице и суставной синовиальной оболочке человека.Анат. Рек. 136, 137–147. 10.1002/ar.10
- 208 [PubMed] [CrossRef] [Google Scholar]
- Рен К., Дубнер Р. (1999a). Пластичность центральной нервной системы и постоянные боли. Дж. Орофак. Боль 13, 155–163; обсуждение 164–171. [PubMed] [Google Scholar]
- Рен К., Дубнер Р. (1999b). Воспалительные модели боли и гипералгезии. ИЛАР Дж. 40, 111–118. 10.1093/ilar.40.3.111 [PubMed] [CrossRef] [Google Scholar]
- Роу М. Дж., Трейси Д. Дж., Манс Д. А., Сахай В., Иванушич Дж. Дж. (2005).Механосенсорное восприятие: есть ли вклад костных рецепторов? клин. Эксп. Фармакол. Физиол. 32, 100–108. 10.1111/j.1440-1681.2005.04136.x [PubMed] [CrossRef] [Google Scholar]
- Rundle C.H., Wang H., Yu H., Chadwick R.B., Davis E.I., Wergedal J.E., et al. . (2006). Микроматричный анализ экспрессии генов на стадиях воспаления и формирования эндохондральной кости при восстановлении перелома бедренной кости у крыс. Кость 38, 521–529. 10.1016/j.bone.2005.09.015 [PubMed] [CrossRef] [Google Scholar]
- Сакада С.(1974). Механорецепторы в фасции, надкостнице и периодонтальной связке. Бык. Токио Мед. Вмятина. ун-т 21 (Прил.), 11–13. [PubMed] [Google Scholar]
- Сакада С., Аида Х. (1971a). Электрофизиологические исследования телец Гольджи-Маццони в надкостнице лицевых костей кошек. Бык. Токио Дент. Сб. 12, 255–272. [Google Scholar]
- Сакада С., Аида Х. (1971b). Локализация и форма телец Гольджи-Маццони в надкостнице лицевых костей кошки. Бык. Токио Дент. Сб.12, 235–253. [Google Scholar]
- Сакада С., Маэда К. (1967a). Особенности иннервации и нервных окончаний в надкостнице нижней челюсти кошек. Бык. Токио Дент. Сб. 8, 77–94. [PubMed] [Google Scholar]
- Сакада С., Маеда К. (1967b). Корреляция между гистологической структурой и реакцией на давление механорецепторов в надкостнице нижней челюсти кошки. Бык. Токио Дент. Сб. 8, 181–196. [Google Scholar]
- Сакада С., Мияке А. (1972). Реакция медленно адаптирующихся окончаний свободных волокон в надкостнице нижней челюсти кошки на вибрационную стимуляцию.Бык. Токио Дент. Сб. 13, 205–225. [PubMed] [Google Scholar]
- Сакада С., Немото Т. (1972). Реакция на тепловую стимуляцию быстро- и медленно адаптирующихся окончаний свободных волокон в надкостнице нижней челюсти кошки. Бык. Токио Дент. Сб. 13, 227–250. [PubMed] [Google Scholar]
- Сакада С., Оноэ Ю. (1971). Реакция быстроадаптирующихся окончаний свободных волокон в надкостнице нижней челюсти кошки на вибрационную стимуляцию. Бык. Токио Дент. Сб. 12, 199–221. [PubMed] [Google Scholar]
- Сакада С., Тагучи С. (1971). Электрофизиологические исследования окончаний свободных волокон надкостницы нижней челюсти кошки. Бык. Токио Дент. Сб. 12, 175–197. [PubMed] [Google Scholar]
- Сакада С., Яно Дж. (1978). Влияние гипертонических и гипотонических солевых растворов на нервные окончания в надкостнице позади подбородочного отверстия кошки. Бык. Токио Дент. Сб. 19, 103–118. [PubMed] [Google Scholar]
- Санти Дж., Макинтош К. (2001). Феноменологическое исследование боли после перелома диафиза бедренной кости.Дж. Клин. Нурс. 10, 521–527. 10.1046/j.1365-2702.2001.00506.x [PubMed] [CrossRef] [Google Scholar]
- Schaible HG (1996). Почему болит сустав при воспалении? бр. Дж. Ревматол. 35, 405–406. 10.1093/rheumatology/35.5.405 [PubMed] [CrossRef] [Google Scholar]
- Schaible HG, Schmidt R.F. (1988). Динамика изменения механочувствительности суставных афферентов при развивающемся экспериментальном артрите. Дж. Нейрофизиол. 60, 2180–2195. [PubMed] [Google Scholar]
- Schwei M.J., Honore P., Rogers S.D., Salak-Johnson J.L., Finke M.P., Ramnaraine M.L., et al. . (1999). Нейрохимическая и клеточная реорганизация спинного мозга в мышиной модели боли при раке кости. Дж. Нейроски. 19, 10886–10897. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Segale M. (1919). Температура остро воспаленных периферических тканей. Дж. Эксп. Мед. 29, 235–249. 10.1084/jem.29.3.235 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Seidel M. F., Wise B. L., Лейн Н.Е. (2013). Фактор роста нервов: последние сведения о науке и терапии. Остеоартроз. Картил. 21, 1223–1228. 10.1016/j.joca.2013.06.004 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Seike W. (1976). Электрофизиологические и гистологические исследования чувствительности нервных окончаний костного мозга. Йонаго Акта Мед. 20, 192–211. [PubMed] [Google Scholar]
- Севчик М. А., Гиларди Дж. Р., Петерс С. М., Линдси Т. Х., Халворсон К. Г., Джонас Б. М. и др. . (2005).Анти-ФРН-терапия значительно уменьшает боль при раке кости и сопровождающее ее увеличение маркеров периферической и центральной сенсибилизации. Боль 115, 128–141. 10.1016/j.pain.2005.02.022 [PubMed] [CrossRef] [Google Scholar]
- Shen W., Hu X.M., Liu Y.N., Han Y., Chen LP, Wang C.C., et al. . (2014). CXCL12 в астроцитах способствует боли при раке кости посредством CXCR4-опосредованной сенсибилизации нейронов и активации глии в спинном мозге крыс. J. Нейровоспаление 11, 75. 10.1186/1742-2094-11-75 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Shi X., Го Т. З., Вэй Т., Ли В. В., Кларк Д. Дж., Кингери В. С. (2015). Облегченная передача сигналов спинального нейропептида и повышенная экспрессия воспалительных медиаторов способствуют постпереломной ноцицептивной сенсибилизации. Боль 156, 1852–1863 гг. 10.1097/j.pain.0000000000000204 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Spencer N.J., Kyloh M., Duffield M. (2014). Идентификация различных типов окончаний спинномозговых афферентных нервов, которые кодируют вредные и безвредные стимулы в толстой кишке, с использованием новой техники антероградного отслеживания.ПЛОС ОДИН 9:e112466. 10.1371/journal.pone.0112466 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Strassman A.M., Weissner W., Williams M., Ali S., Levy D. (2004). Диаметры аксонов и интрадуральные траектории иннервации твердой мозговой оболочки у крыс. Дж. Комп. Нейрол. 473, 364–376. 10.1002/cne.20106 [PubMed] [CrossRef] [Google Scholar]
- Такасе Б., Номура С. (1957). Исследования иннервации костного мозга. Дж. Комп. Нейрол. 108, 421–443. 10.1002/cne. 0305 [PubMed] [CrossRef] [Google Scholar]
- Thurston T.Дж. (1982). Распределение нервов в длинных костях показано импрегнацией серебра. Дж. Анат. 134 (часть 4), 719–728. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Триде Р. Д., Мейер Р. А., Раджа С. Н., Кэмпбелл Дж. Н. (1995). Доказательства двух различных механизмов теплопередачи в ноцицептивных первичных афферентах, иннервирующих кожу обезьяны. Дж. Физиол. 483 (часть 3), 747–758. 10.1113/jphysiol.1995.sp020619 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Uhelski M.L., Cain D.М., Хардинг-Роуз К., Симона Д.А. (2013). Неселективный агонист каннабиноидных рецепторов WIN 55,212-2 ослабляет ответы ноцицепторов С-волокон в мышиной модели раковой боли. неврология 247, 84–94. 10.1016/j.neuroscience.2013.05.003 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Urch C.E., Donovan-Rodriguez T., Dickenson A.H. (2003). Изменения в нейронах задних рогов в крысиной модели боли в костях, вызванной раком. Боль 106, 347–356. 10.1016/j.pain.2003.08.002 [PubMed] [CrossRef] [Google Scholar]
- Валбо А.Б., Олауссон Х., Вессберг Дж. (1999). Немиелинизированные афференты составляют вторую систему, кодирующую тактильные раздражители волосистой кожи человека. Дж. Нейрофизиол. 81, 2753–2763. [PubMed] [Google Scholar]
- Валлбо А., Олауссон Х., Вессберг Дж., Норрселл У. (1993). Система немиелинизированных афферентов для безвредной механорецепции в коже человека. Мозг Res. 628, 301–304. 10.1016/0006-8993(93)
- -S [PubMed] [CrossRef] [Google Scholar]
- Williams MC, Ivanusic JJ (2008). Доказательства участия спинопарабрахиального пути, но не спиноталамического тракта или постсинаптического дорсального столба, в острой костной ноцицепции.Неврологи. лат. 443, 246–250. 10.1016/j.neulet.2008.07.076 [PubMed] [CrossRef] [Google Scholar]
- Willis WD, Jr. (1985). Система боли. Нейронная основа ноцицептивной передачи в нервной системе млекопитающих. Боль 8, 1–346. [PubMed] [Google Scholar]
- Вульф А. Д., Пфлегер Б. (2003). Бремя основных заболеваний опорно-двигательного аппарата. Бык. Всемирный орган здравоохранения.
81, 646–656. 10.1590/S0042-96862003000
7 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Yamada M., Йошино Ю. (1977). Механизмы возбуждения боли в коленном суставе при ишемии. Йонаго Акта Мед. 21, 1–10. [PubMed] [Google Scholar]
- Янагисава Ю., Фуруэ Х., Кавамата Т., Ута Д., Ямамото Дж., Фурусе С. и др. . (2010). Рак костей индуцирует уникальную центральную сенсибилизацию посредством синаптических изменений в широкой области спинного мозга. Мол. Боль 6:38. 10.1186/1744-8069-6-38 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Чжао Дж., Леви Д. (2014). Сенсорная иннервация надкостницы свода черепа является ноцицептивной и вносит вклад в поведение, подобное головной боли.Боль 155, 1392–1400. 10.1016/j.pain.2014.04.019 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Zhao J., Zhang H., Liu SB, Han P., Hu S., Li Q., et др. . (2013). Спинальный интерлейкин-33 и его рецептор ST2 вносят вклад в боль, вызванную раком кости у мышей. неврология 253, 172–182. 10.1016/j.neuroscience.2013.08.026 [PubMed] [CrossRef] [Google Scholar]
Роль периферических нервных волокон и их нейротрансмиттеров в физиологии и патофизиологии хрящей и костей | Исследования и терапия артрита
- 1.
Перкинс Р., Скирвинг А.П.: Образование костной мозоли и скорость заживления переломов бедренной кости у пациентов с травмами головы. J Bone Joint Surg Br. 1987, 69: 521-524.
КАС пабмед Google Scholar
- 2.
Dauty M, Perrouin Verbe B, Maugars Y, Dubois C, Mathe JF: Минеральная плотность кости над и под очагами поражения у пациентов с травмой спинного мозга. Кость. 2000, 27: 305-309. 10.1016/S8756-3282(00)00326-4.
КАС Статья пабмед Google Scholar
- 3.
Пул К.Е., Рив Дж., Уорбертон Э.А. Падения, переломы и остеопороз после инсульта: пора подумать о защите?. Гладить. 2002, 33: 1432-1436. 10.1161/01.СТР.0000014510.48897.7Д.
Артикул пабмед Google Scholar
- 4.
Джонс К.Б., Моллано А.В., Моркуэнде Дж.А., Купер Р.Р., Зальцман К.Л.: Кости и мозг: обзор нервных, гормональных и скелетно-мышечных связей. Айова Ортоп Дж. 2004, 24: 123-132.
Центральный пабмед пабмед Google Scholar
- 5.
Garcia-Castellano JM, Diaz-Herrera P, Morcuende JA: Является ли кость тканью-мишенью для нервной системы? Новые достижения в понимании их взаимодействия. Айова Ортоп Дж. 2000, 20: 49-58.
Центральный пабмед КАС пабмед Google Scholar
- 6.
Хукканен М., Конттинен Ю.Т., Рис Р.Г., Сантавирта С., Теренги Г., Полак Дж.М.: Распределение нервных окончаний и сенсорных нейропептидов в синовиальной оболочке крысы, мениске и кости. Int J Tissue React.1992, 14: 1-10.
КАС пабмед Google Scholar
- 7.
Madsen JE, Hukkanen M, Aune AK, Basran I, Moller JF, Polak JM, Nordsletten L: Заживление переломов и иннервация костной мозоли после резекции периферических нервов у крыс. Clin Orthop Relat Res 1998, :230-240.,
- 8.
Gajda M, Adriaensen D, Cichocki T: Развитие иннервации длинных костей: экспрессия ассоциированного с ростом белка 43.Фолиа Гистохим Цитобиол. 2000, 38: 103-110.
КАС пабмед Google Scholar
- 9.
Dirmeier M, Capellino S, Schubert T, Angele P, Anders S, Straub RH: более низкая плотность синовиальных нервных волокон, положительных на пептид, связанный с геном кальцитонина, по сравнению с субстанцией P при ревматоидном артрите, но не при остеоартрите. Ревматология (Оксфорд). 2008, 47: 36-40. 10.1093/ревматология/кем301.
КАС Статья Google Scholar
- 10.
Salo PT, Seeratten RA, Erwin WM, Bray RC: Доказательства невропатического вклада в развитие спонтанного остеоартроза коленного сустава на мышиной модели. Акта Ортоп Сканд. 2002, 73: 77-84. 10.1080/000164702317281459.
Артикул пабмед Google Scholar
- 11.
Offley SC, Guo TZ, Wei T, Clark JD, Vogel H, Lindsey DP, Jacobs CR, Yao W, Lane NE, Kingery WS: сенсорные нейроны, чувствительные к капсаицину, способствуют поддержанию целостности трабекулярной кости.Джей Боун Шахтер Рез. 2005, 20: 257-267. 10.1359/JBMR.041108.
Артикул пабмед Google Scholar
- 12.
Reid IR: Влияние бета-блокаторов на риск переломов. J Musculoskelet Нейрональное взаимодействие. 2008, 8: 105-110.
КАС пабмед Google Scholar
- 13.
Zhang Y, Lu L, Furlonger C, Wu GE, Paige CJ: Гемокинин представляет собой гемопоэтический специфический тахикинин, который регулирует B-лимфопоэз.Нат Иммунол. 2000, 1: 392-397. 10.1038/80826.
КАС Статья пабмед Google Scholar
- 14.
Maggi CA: Тахикининовые рецепторы млекопитающих. Генерал Фармакол. 1995, 26: 911-944. 10.1016/0306-3623(94)00292-У.
КАС Статья пабмед Google Scholar
- 15.
-3.Hartung HP, Toyka KV: Активация макрофагов веществом P: индукция окислительного взрыва и высвобождение тромбоксана.Евр Дж Фармакол. 1983, 89: 301-305. 10.1016/0014-2999(83)
КАС Статья пабмед Google Scholar
- 16.
Розенфельд М.Г., Мермод Дж.Дж., Амара С.Г., Суонсон Л.В., Савченко П.Е., Ривьер Дж., Вейл В.В., Эванс Р.М.: Производство нового нейропептида, кодируемого геном кальцитонина, посредством тканеспецифического процессинга РНК. Природа. 1983, 304: 129-135. 10.1038/304129а0.
КАС Статья пабмед Google Scholar
- 17.
Poyner DR, Sexton PM, Marshall I, Smith DM, Quirion R, Born W, Muff R, Fischer JA, Foord SM: Международный союз фармакологов. XXXII. Пептиды млекопитающих, связанные с геном кальцитонина, адреномедуллин, амилин и рецепторы кальцитонина. Pharmacol Rev. 2002, 54: 233-246. 10.1124/пр.54.2.233.
КАС Статья пабмед Google Scholar
- 18.
Молинов П.Б.: Свойства, распределение и регуляция подтипов альфа- и бета-адренорецепторов.Наркотики. 1984, 28: 1-15. 10.2165/00003495-198400282-00002.
КАС Статья пабмед Google Scholar
- 19.
Lerner UH, Persson E: Остеотропные эффекты нейропептидов, родственного гену кальцитонина пептида, субстанции P и вазоактивного кишечного пептида. J Musculoskelet Нейрональное взаимодействие. 2008, 8: 154-165.
КАС пабмед Google Scholar
- 20.
Пул А.Р., Кодзима Т., Ясуда Т., Мвале Ф., Кобаяши М., Лаверти С. Состав и структура суставного хряща: шаблон для восстановления тканей.Clin Orthop Relat Relat Res. 2001, 391 Приложение: S26-S33. 10.1097/00003086-200110001-00004.
Артикул пабмед Google Scholar
- 21.
Schwab W, Funk RH: Схема иннервации различных хрящевых тканей у крыс. Акта Анат (Базель). 1998, 163: 184-190. 10.1159/000046497.
КАС Статья Google Scholar
- 22.
Edoff K, Grenegard M, Hildebrand C: Ретроградное отслеживание и иммуногистохимия нейропептидов сенсорных нейронов, проецирующихся на хрящевой дистальный эпифиз бедренной кости молодых крыс.Сотовые Ткани Res. 2000, 299: 193-200. 10.1007/s004410050017.
КАС Статья пабмед Google Scholar
- 23.
Hara-Irie F, Amizuka N, Ozawa H: Иммуногистохимическая и ультраструктурная локализация CGRP-позитивных нервных волокон в эпифизарных трабекулах, обращенных к зоне роста бедренных костей крыс. Кость. 1996, 18: 29-39. 10.1016/8756-3282(95)00425-4.
КАС Статья пабмед Google Scholar
- 24.
Олива Ф., Тарантино У., Маффулли Н.: Иммуногистохимическая локализация пептида, связанного с геном кальцитонина, и вещества Р в коленном хряще крысы при рождении. Физиол рез. 2005, 54: 549-556.
КАС пабмед Google Scholar
- 25.
Edoff K, Hildebrand C: Эффекты нейропептидов на хондроциты крысы и перихондриальные клетки in vitro. Нейропептиды. 2003, 37: 316-318. 10.1016/j.npep.2003.09.001.
КАС Статья пабмед Google Scholar
- 26.
Jikko A, Murakami H, Yan W, Nakashima K, Ohya Y, Satakeda H, Noshiro M, Kawamoto T, Nakamura S, Okada Y, Suzuki F, Kato Y: Влияние циклического аденозин-3′,5′-монофосфата на хондроциты терминальная дифференцировка и кальцификация хрящевого матрикса. Эндокринология. 1996, 137: 122-128.
КАС пабмед Google Scholar
- 27.
Maestroni GJ: Нейрогормоны и катехоламины как функциональные компоненты микроокружения костного мозга.Энн Н.Ю. Академия наук. 2000, 917: 29-37. 10.1111/j.1749-6632.2000.tb05370.x.
КАС Статья пабмед Google Scholar
- 28.
Pongratz G, Straub RH: Роль периферических нервных волокон в остром и хроническом воспалении при артрите. Нат Рев Ревматол. 2013, 9: 117-126. 10.1038/нреум.2012.181.
КАС Статья пабмед Google Scholar
- 29.
Goldring MB, Goldring SR: Остеоартрит.J Cell Physiol. 2007, 213: 626-634. 10.1002/jcp.21258.
КАС Статья пабмед Google Scholar
- 30.
Suri S, Gill SE, Massena dC, Wilson D, McWilliams DF, Walsh DA: нейроваскулярная инвазия в костно-хрящевое соединение и остеофиты при остеоартрите. Энн Реум Дис. 2007, 66: 1423-1428. 10.1136/ард.2006.063354.
Центральный пабмед Статья пабмед Google Scholar
- 31.
Wojtys EM, Beaman DN, Glover RA, Janda D: Иннервация коленного сустава человека волокнами вещества P. Артроскопия. 1990, 6: 254-263. 10.1016/0749-8063(90)
-Н.
КАС Статья пабмед Google Scholar
- 32.
Neame RL, Carr AJ, Muir K, Doherty M: Распространенность хондрокальциноза коленного сустава в Великобритании: доказательства того, что корреляция с остеоартритом осуществляется через общую связь с остеофитами. Энн Реум Дис. 2003, 62: 513-518.10.1136/ард.62.6.513.
Центральный пабмед КАС Статья пабмед Google Scholar
- 33.
Schaible HG: Механизмы хронической боли при остеоартрите. Curr Rheumatol Rep. 2012, 14: 549-556. 10.1007/s11926-012-0279-х.
КАС Статья пабмед Google Scholar
- 34.
Lehner B, Koeck FX, Capellino S, Schubert TE, Hofbauer R, Straub RH: Преобладание чувствительных нервных волокон по сравнению с симпатическими нервными волокнами и повышенная клеточность в поднадколенниковом жировом слое у пациентов с болью в переднем колене после первичной артропластики.J Ортоп Res. 2008, 26: 342-350. 10.1002/jor.20498.
Артикул пабмед Google Scholar
- 35.
Miller LE, Justen HP, Scholmerich J, Straub RH: Потеря симпатических нервных волокон в синовиальной ткани у пациентов с ревматоидным артритом сопровождается повышенным высвобождением норадреналина из синовиальных макрофагов. FASEB J. 2000, 14: 2097-2107. 10.1096/fj.99-1082com.
КАС Статья пабмед Google Scholar
- 36.
Eitner A, Pester J, Nietzsche S, Hofmann GO, Schaible HG: Иннервация синовиальной оболочки суставов человека с остеоартритом по сравнению с нормальной синовиальной оболочкой крысы и овцы. Хрящевой остеоартрит. 2013, 21: 1383-1391. 10.1016/j.joca.2013.06.018.
КАС Статья пабмед Google Scholar
- 37.
Buma P, Verschuren C, Versleyen D, der KP V, Oestreicher AB: Связанный с геном кальцитонина пептид, субстанция P и иммунореактивность GAP-43/B-50 в нормальном и артрозированном коленном суставе мыши.Гистохимия. 1992, 98: 327-339. 10.1007/BF00270017.
КАС Статья пабмед Google Scholar
- 38.
Gomez C, Burt-Pichat B, Mallein-Gerin F, Merle B, Delmas PD, Skerry TM, Vico L, Malaval L, Chenu C: Экспрессия семафорина-3A и его рецепторов при эндохондральной оссификации: потенциал Роль в развитии скелета и иннервации. Дев Дин. 2005, 234: 393-403. 10.1002/dvdy.20512.
КАС Статья пабмед Google Scholar
- 39.
Толофари С.К., Ричардсон С.М., Фримонт А.Дж., Хойланд Дж.А.: Экспрессия семафорина 3А и его рецепторов в межпозвонковом диске человека: потенциальная роль в регуляции врастания нейронов в дегенеративном межпозвонковом диске. Артрит Res Ther. 2010, 12: R1-10.1186/ar2898.
Центральный пабмед Статья пабмед Google Scholar
- 40.
Okubo M, Kimura T, Fujita Y, Mochizuki S, Niki Y, Enomoto H, Suda Y, Toyama Y, Okada Y: Семафорин 3A экспрессируется в остеоартритном хряще человека и противодействует фактору роста эндотелия сосудов 165. миграция хондроцитов: значение для клонирования хондроцитов.Ревмирующий артрит. 2011, 63: 3000-3009. 10.1002/арт.30482.
КАС Статья пабмед Google Scholar
- 41.
Opolka A, Straub RH, Pasoldt A, Grifka J, Grässel S: Вещество P и норадреналин модулируют пролиферацию и апоптоз мышиных хондроцитов. Ревмирующий артрит. 2012, 64: 729-739. 10.1002/ст.33449.
КАС Статья пабмед Google Scholar
- 42.
Millward-Sadler SJ, Mackenzie A, Wright MO, Lee HS, Elliot K, Gerrard L, Fiskerstrand CE, Salter DM, Quinn JP: Экспрессия тахикинина в хрящах и функция механотрансдукции суставных хондроцитов человека. Ревмирующий артрит. 2003, 48: 146-156. 10.1002/ст.10711.
КАС Статья пабмед Google Scholar
- 43.
Karahan S, Kincaid SA, Baird AN, Kammermann JR: Распределение бета-эндорфина и субстанции P в плечевом суставе собаки до и после программы упражнений с низкой ударной нагрузкой.Анат Хистол Эмбриол. 2002, 31: 72-77. 10.1046/j.1439-0264.2002.00361.х.
КАС Статья пабмед Google Scholar
- 44.
Millward-Sadler SJ, Wright MO, Davies LW, Nuki G, Salter DM: Механотрансдукция с помощью интегринов и интерлейкина-4 приводит к изменению экспрессии генов аггрекана и матриксной металлопротеиназы 3 в нормальных, но не остеоартритных, суставных хондроцитах человека . Ревмирующий артрит. 2000, 43: 2091-2099. 10.1002/1529-0131(200009)43:9<2091::AID-ANR21>3.0.СО;2-С.
КАС Статья пабмед Google Scholar
- 45.
Howard MR, Millward-Sadler SJ, Vasilliou AS, Salter DM, Quinn JP: Механическая стимуляция индуцирует экспрессию гена препротахикинина в остеоартритных хондроцитах, что коррелирует с модуляцией фактора транскрипции нейрона, рестриктивного фактора молчания. Нейропептиды. 2008, 42: 681-686. 10.1016/j.npep.2008.09.004.
КАС Статья пабмед Google Scholar
- 46.
Inoue H, Shimoyama Y, Hirabayashi K, Kajigaya H, Yamamoto S, Oda H, Koshihara Y: Производство нейропептидного вещества P синовиальными фибробластами у пациентов с ревматоидным артритом и остеоартритом. Нейроски Летт. 2001, 303: 149-152. 10.1016/S0304-3940(01)01713-Х.
КАС Статья пабмед Google Scholar
- 47.
Im HJ, Li X, Muddasani P, Kim GH, Davis F, Rangan J, Forsyth CB, Ellman M, Thonar EJ: Основной фактор роста фибробластов ускоряет деградацию матрикса посредством нейроэндокринного пути во взрослом суставе человека. хондроциты.J Cell Physiol. 2008, 215: 452-463. 10.1002/jcp.21317.
Центральный пабмед КАС Статья пабмед Google Scholar
- 48.
Lotz M, Carson DA, Vaughan JH: Активация веществом P ревматоидных синовиоцитов: нервный путь в патогенезе артрита. Наука. 1987, 235: 893-895. 10.1126/научн.2433770.
КАС Статья пабмед Google Scholar
- 49.
Танабэ Т., Отани Х., Мисима К., Огава Р., Инагаки С. Механизмы производства оксирадикалов в стимулированных веществом Р ревматоидных синовиальных клетках. Ревматол Интерн. 1996, 16: 159-167. 10.1007/BF01419729.
КАС Статья пабмед Google Scholar
- 50.
Lotz M, Vaughan JH, Carson DA: Влияние нейропептидов на выработку воспалительных цитокинов моноцитами человека. Наука. 1988, 241: 1218-1221. 10.1126/научн.2457950.
КАС Статья пабмед Google Scholar
- 51.
Элефтериу Ф. Нейрональная сигнализация и регуляция ремоделирования костей. Cell Mol Life Sci. 2005, 62: 2339-2349. 10.1007/s00018-005-5175-3.
КАС Статья пабмед Google Scholar
- 52.
Schinke T, Liese S, Priemel M, Haberland M, Schilling AF, Catala-Lehnen P, Blicharski D, Rueger JM, Gagel RF, Emeson RB, Amling M: снижение костеобразования и остеопения у мышей, лишенных альфа пептид, родственный гену кальцитонина.Джей Боун Шахтер Рез. 2004, 19: 2049-2056. 10.1359/jbmr.040915.
КАС Статья пабмед Google Scholar
- 53.
Jiang W, Gao SG, Chen XG, Xu XC, Xu M, Luo W, Tu M, Zhang FJ, Zeng C, Lei GH: Экспрессия синовиальной жидкости и суставного хряща VIP в коленном суставе человека с остеоартритом: a новый показатель тяжести заболевания?. Клин Биохим. 2012, 45: 1607-1612. 10.1016/j.clinbiochem.2012.08.020.
КАС Статья пабмед Google Scholar
- 54.
Нииссало С., Хукканен М., Имаи С., Торнуолл Дж., Конттинен Ю.Т.: Нейропептиды при экспериментальном и дегенеративном артрите. Энн Н.Ю. Академия наук. 2002, 966: 384-399. 10.1111/j.1749-6632.2002.tb04239.x.
КАС Статья пабмед Google Scholar
- 55.
Delgado M, Abad C, Martinez C, Leceta J, Gomariz RP: Вазоактивный кишечный пептид предотвращает экспериментальный артрит, подавляя как аутоиммунные, так и воспалительные компоненты заболевания.Нат Мед. 2001, 7: 563-568. 10.1038/87887.
КАС Статья пабмед Google Scholar
- 56.
Lai LP, Mitchell J: Бета2-адренергические рецепторы, экспрессируемые на мышиных хондроцитах, стимулируют клеточный рост и ингибируют экспрессию индийского ежа и коллагена типа X. J Cell Biochem. 2008, 104: 545-553. 10.1002/jcb.21646.
КАС Статья пабмед Google Scholar
- 57.
Mitchell J, Lai LP, Peralta F, Xu Y, Sugamori K: бета2-адренорецепторы ингибируют экспрессию коллагена II типа в хондроцитах ростовой пластинки путем стимуляции фактора AP-1 Jun-B. Am J Physiol Endocrinol Metab. 2011, 300: Е633-Е639. 10.1152/ажпендо.00515.2010.
КАС Статья пабмед Google Scholar
- 58.
Takarada T, Hojo H, Iemata M, Sahara K, Kodama A, Nakamura N, Hinoi E, Yoneda Y: Влияние адреналина на хондрогенную дифференцировку посредством подавления трансактивации генов, опосредованной членами семейства Sox9.Кость. 2009, 45: 568-578. 10.1016/j.bone.2009.05.004.
КАС Статья пабмед Google Scholar
- 59.
Jenei-Lanzl Z, Grässel S, Pongratz G, Kees F, Miosge N, Angele P, Straub RH: Норэпинефрин ингибирует хондрогенез мезенхимальных стволовых клеток и хондрогенных клеток-предшественников и ускоряет хондрогенную гипертрофию. Ревмирующий артрит. 2014, 66: 2472-2481. 10.1002/арт.38695.
КАС Статья Google Scholar
- 60.
Li H, Fong C, Chen Y, Cai G, Yang M: Бета-адренергические сигналы регулируют адипогенез мезенхимальных стволовых клеток мыши через путь цАМФ/PKA. Мол Селл Эндокринол. 2010, 323: 201-207. 10.1016/j.mce.2010.03.021.
КАС Статья пабмед Google Scholar
- 61.
Bjurholm A, Kreicbergs A, Brodin E, Schultzberg M: Вещество P- и CGRP-иммунореактивные нервы в костях. Пептиды. 1988, 9: 165-171. 10.1016/0196-9781(88)
-Х.КАС Статья пабмед Google Scholar
- 62.
Hukkanen M, Konttinen YT, Santavirta S, Paavolainen P, Gu XH, Terenghi G, Polak JM: Быстрая пролиферация пептид-иммунореактивных нервов, связанных с геном кальцитонина, во время заживления перелома большеберцовой кости у крыс предполагает участие нейронов в росте кости и реконструкция. Неврология. 1993, 54: 969-979. 10.1016/0306-4522(93)-7.
КАС Статья пабмед Google Scholar
- 63.
Lerner UH: Нейропептидергическая регуляция резорбции и костеобразования. J Musculoskelet Нейрональное взаимодействие. 2002, 2: 440-447.
КАС пабмед Google Scholar
- 64.
Mach DB, Rogers SD, Sabino MC, Luger NM, Schwei MJ, Pomonis JD, Keyser CP, Clohisy DR, Adams DJ, O’Leary P, Mantyh PW: Происхождение скелетной боли: сенсорная и симпатическая иннервация бедренной кости мыши. Неврология. 2002, 113: 155-166. 10.1016/С0306-4522(02)00165-3.
КАС Статья пабмед Google Scholar
- 65.
Аро Х: Влияние повреждения нерва на заживление перелома. Образование каллуса изучали на крысах. Акта Ортоп Сканд. 1985, 56: 233-237. 10.3109/17453678508993002.
КАС Статья пабмед Google Scholar
- 66.
Nordsletten L, Madsen JE, Almaas R, Rootwelt T, Halse J, Konttinen YT, Hukkanen M, Santavirta S: Нейронная регуляция заживления переломов.Последствия резекции седалищного нерва в голени крысы. Акта Ортоп Сканд. 1994, 65: 299-304. 10.3109/17453679408995457.
КАС Статья пабмед Google Scholar
- 67.
Niedermair T, Kuhn V, Doraneh Gard F, Stange R, Wieskötter B, Beckmann J, Salmen P, Springorum HR, Straub RH, Zimmer A, Grifka J, Grässel S: Отсутствие вещества P и симпатического влияние нервной системы на структуру кости и дифференцировку хондроцитов во взрослой модели эндохондральной оссификации.Матрица биол. 2014, 38: 22-35. 10.1016/j.matbio.2014.06.007.
КАС Статья пабмед Google Scholar
- 68.
Li J, Kreicbergs A, Bergstrom J, Stark A, Ahmed M: Местная иннервация CGRP совпадает с формированием кости во время заживления и моделирования перелома: исследование на крысах с наклоном большеберцовой кости. J Ортоп Res. 2007, 25: 1204-1212. 10.1002/jor.20406.
Артикул пабмед Google Scholar
- 69.
Elefteriou F, Ahn JD, Takeda S, Starbuck M, Yang X, Liu X, Kondo H, Richards WG, Bannon TW, Noda M, Clement K, Vaisse C, Karsenty G: Регуляция лептином резорбции костей симпатической нервной системой и КОРЗИНА. Природа. 2005, 434: 514-520. 10.1038/природа03398.
КАС Статья пабмед Google Scholar
- 70.
Mukohyama H, Ransjo M, Taniguchi H, Ohyama T, Lerner UH: Ингибирующее действие вазоактивного интестинального пептида и полипептида, активирующего аденилатциклазу гипофиза, на образование остеокластов связано с активацией остеопротегерина и подавлением RANKL и RANK. .Biochem Biophys Res Commun. 2000, 271: 158-163. 10.1006/bbrc.2000.2599.
КАС Статья пабмед Google Scholar
- 71.
da Silva JA P, Carmo-Fonseca M: Пептидсодержащие нервы в синовиальной оболочке человека: иммуногистохимические данные о сниженной иннервации при ревматоидном артрите. J Ревматол. 1990, 17: 1592-1599.
Google Scholar
- 72.
Asmus SE, Parsons S, Landis SC: Изменения свойств передатчика симпатических нейронов, иннервирующих надкостницу.Дж. Нейроски. 2000, 20: 1495-1504.
КАС пабмед Google Scholar
- 73.
Ernsberger U: Роль передачи сигналов нейротрофинов в дифференцировке нейронов дорсальных корешковых ганглиев и симпатических ганглиев. Сотовые Ткани Res. 2009, 336: 349-384. 10.1007/с00441-009-0784-з.
КАС Статья пабмед Google Scholar
- 74.
Мано Т., Нисимура Н., Ивасэ С. Влияние симпатической нервной системы на метаболизм костей в условиях микрогравитации (обзор).Acta Physiologica Hungarica. 2010, 97: 354-361. 10.1556/АФизиол.97.2010.4.8.
КАС Статья пабмед Google Scholar
- 75.
Sherman BE, Chole RA: Механизм резорбции кости, вызванной симпатэктомией, в среднем ухе. Отоларингол Head Neck Surg. 1995, 113: 569-581.
КАС пабмед Google Scholar
- 76.
Nixon AJ, Cummings JF: Иммуногистохимическое исследование сенсорной иннервации нормальной субхондральной кости в пястно-фаланговом суставе лошадей с помощью вещества P.Am J Vet Res. 1994, 55: 28-33.
КАС пабмед Google Scholar
- 77.
Imai S, Tokunaga Y, Maeda T, Kikkawa M, Hukuda S: Пептид, связанный с геном кальцитонина, субстанция P и тирозингидроксилаза-иммунореактивная иннервация костного мозга крыс: иммуногистохимическое и ультраструктурное исследование возможных эфферентных и афферентные механизмы. J Ортоп Res. 1997, 15: 133-140. 10.1002/иор.1100150120.
КАС Статья пабмед Google Scholar
- 78.
Огино С., Сашо Т., Накагава К., Судзуки М., Ямагути С., Хигаси М., Такахаши К., Мория Х.: Обнаружение связанных с болью молекул в субхондральной кости остеоартритных коленей. Клин Ревматол. 2009, 28: 1395-1402. 10.1007/s10067-009-1258-0.
Артикул пабмед Google Scholar
- 79.
Fortier LA, Nixon AJ: Дистрибутивные изменения структуры ноцицептивных волокон вещества P в суставах с естественным остеоартритом. J Ревматол.1997, 24: 524-530.
КАС пабмед Google Scholar
- 80.
Liu D, Jiang LS, Dai LY: Вещество P и его рецепторы в костном метаболизме. Нейропептиды. 2007, 41: 271-283. 10.1016/j.npep.2007.05.003.
КАС Статья пабмед Google Scholar
- 81.
Lerner UH: Делеции генов, кодирующих кальцитонин/альфа-CGRP, амилин и кальцитониновые рецепторы, дали новое и неожиданное понимание функции рецепторов кальцитонина и рецепторов, подобных рецепторам кальцитонина, в костях.J Musculoskelet Нейрональное взаимодействие. 2006, 6: 87-95.
КАС пабмед Google Scholar
- 82.
Aitken SJ, Landao-Bassonga E, Ralston SH, Idris AI: Лиганды бета2-адренорецепторов регулируют дифференцировку остеокластов in vitro с помощью прямых и косвенных механизмов. Арх Биохим Биофиз. 2009, 482: 96-103. 10.1016/j.abb.2008.11.012.
КАС Статья пабмед Google Scholar
- 83.
Ma Y, Krueger JJ, Redmon SN, Uppuganti S, Nyman JS, Hahn MK, Elefteriou F: внеклеточный клиренс норадреналина транспортером норадреналина необходим для скелетного гомеостаза. Дж. Биол. Хим. 2013, 288: 30105-30113. 10.1074/jbc.M113.481309.
Центральный пабмед КАС Статья пабмед Google Scholar
- 84.
Cornish J, Callon KE, Bava U, Kamona SA, Cooper GJ, Reid IR: Влияние кальцитонина, амилина и пептида, родственного гену кальцитонина, на развитие остеокластов.Кость. 2001, 29: 162-168. 10.1016/S8756-3282(01)00494-Х.
КАС Статья пабмед Google Scholar
- 85.
Li J, Wang Y, Li Y, Sun J, Zhao G: Влияние комбинированной регуляции экспрессии гамма-рецептора, активируемого пролифератором пероксисом, и пептида, связанного с геном кальцитонина, на индуцированную алкоголем адипогенную дифференцировку мезенхимальные стволовые клетки костного мозга. Мол Селл Биохим. 2014, 392: 39-48. 10.1007/с11010-014-2016-4.
КАС Статья пабмед Google Scholar
- 86.
Гото Т., Накао К., Гунджигаке К.К., Кидо М.А., Кобаяши С., Танака Т.: Вещество Р стимулирует образование остеобластов крыс на поздней стадии через рецепторы нейрокинина-1. Нейропептиды. 2007, 41: 25-31. 10.1016/j.npep.2006.11.002.
КАС Статья пабмед Google Scholar
- 87.
Wang L, Zhao R, Shi X, Wei T, Halloran BP, Clark DJ, Jacobs CR, Kingery WS: Вещество P стимулирует остеогенную активность стромальных клеток костного мозга, дифференцировку остеокластов и резорбционную активность in vitro.Кость. 2009, 45: 309-320. 10.1016/j.bone.2009.04.203.
Центральный пабмед КАС Статья пабмед Google Scholar
- 88.
Адамус М.А., Дабровски З.Дж.: Влияние нейропептидного вещества Р на остеогенные клетки костного мозга крыс in vitro. Джей Селл Биохим. 2001, 81: 499-506. 10.1002/1097-4644(20010601)81:3<499::AID-JCB1063>3.0.CO;2-Y.
КАС Статья пабмед Google Scholar
- 89.
Kingery WS, Offley SC, Guo TZ, Davies MF, Clark JD, Jacobs CR: Антагонист рецептора вещества P (NK1) усиливает широко распространенные остеопоротические эффекты сечения седалищного нерва. Кость. 2003, 33: 927-936. 10.1016/j.bone.2003.07.003.
КАС Статья пабмед Google Scholar
- 90.
Дин В.Г., Чжан З.М., Чжан Ю.Х., Цзян С.Д., Цзян Л.С., Дай Л.И.: Изменения вещества Р во время заживления переломов у мышей после овариэктомии. Регул Пепт.2010, 159: 28-34. 10.1016/j.regpep.2009.11.004.
КАС Статья пабмед Google Scholar
- 91.
Yoo YM, Kwag JH, Kim KH, Kim CH: Влияние нейропептидов и механической нагрузки на резорбцию костных клеток in vitro. Int J Mol Sci. 2014, 15: 5874-5883. 10.3390/ijms15045874.
Центральный пабмед КАС Статья пабмед Google Scholar
- 92.
Persson E, Lerner UH: Нейропептид VIP усиливает выработку IL-6, индуцированную провоспалительными остеотропными цитокинами в остеобластах свода черепа и линии остеобластных клеток MC3T3-E1.Biochem Biophys Res Commun. 2005, 335: 705-711. 10.1016/j.bbrc.2005.07.135.
КАС Статья пабмед Google Scholar
- 93.
Kondo H, Guo J, Bringhurst FR: Циклический аденозинмонофосфат/протеинкиназа А опосредует регуляцию рецептора белка, связанного с паратиреоидным гормоном/паратиреоидным гормоном, остеокластогенеза и экспрессию RANKL и мРНК остеопротегерина стромальными клетками костного мозга. Джей Боун Шахтер Рез. 2002, 17: 1667-1679.10.1359/jbmr.2002.17.9.1667.
КАС Статья пабмед Google Scholar
- 94.
Persson E, Lerner UH: Нейропептид VIP регулирует экспрессию остеокластогенных факторов в остеобластах. Джей Селл Биохим. 2011, 112: 3732-3741. 10.1002/jcb.23304.
КАС Статья пабмед Google Scholar
- 95.
Yu XJ, Ren XH, Xu YH, Chen LM, Zhou CL, Li CY: Вазоактивный интестинальный пептид индуцирует выработку сосудистого эндотелиального фактора роста в кератиноцитах человека HaCaT посредством пути MAPK.Нейропептиды. 2010, 44: 407-411. 10.1016/j.npep.2010.05.002.
КАС Статья пабмед Google Scholar
- 96.
Mei G, Zou Z, Fu S, Xia L, Zhou J, Zhang Y, Tuo Y, Wang Z, Jin D: Substance P Активирует путь передачи сигнала Wnt и усиливает дифференцировку преостеобластных клеток MC3T3- клетки Е1. Int J Mol Sci. 2014, 15: 6224-6240. 10.3390/ijms15046224.
Центральный пабмед КАС Статья пабмед Google Scholar
- 97.
Mei G, Xia L, Zhou J, Zhang Y, Tuo Y, Fu S, Zou Z, Wang Z, Jin D: Нейропептид SP активирует путь передачи сигнала WNT и усиливает пролиферацию стромальных стволовых клеток костного мозга. Cell Biol Int. 2013, 37: 1225-1232.
КАС пабмед Google Scholar
- 98.
Mrak E, Guidobono F, Moro G, Fraschini G, Rubinacci A, Villa I: Пептид, родственный гену кальцитонина (CGRP), ингибирует апоптоз в остеобластах человека путем стабилизации бета-катенина.J Cell Physiol. 2010, 225: 701-708. 10.1002/jcp.22266.
КАС Статья пабмед Google Scholar
Неврология прикосновения и боли
iStock.com/vadimguzhva
Когда вы держите друга за руку, вы чувствуете тепло его кожи, мягкость или шероховатость его ладони и давление его пальцев. Осязание передает важную социальную информацию, помогая укрепить связи между людьми.Если ваш друг сжимает вашу руку так сильно, что это причиняет боль, прикосновение дает вам знать, что что-то не так или опасно через чувство боли.
Кортикальные карты и чувствительность к прикосновению
Ощущения начинаются с сигналов, генерируемых сенсорными рецепторами вашей кожи. Они проходят по сенсорным нервам, состоящим из пучков волокон, которые соединяются с нейронами спинного мозга. Затем сигналы поступают в таламус, который передает информацию в остальную часть мозга. Следующая остановка — соматосенсорная кора, где сигналы преобразуются в тактильное восприятие.
Соматосенсорная информация со всего тела распространяется на кору головного мозга, образуя топографическую карту, которая закручивается вокруг мозга, как наушники. Чувствительные области, такие как губы и кончики пальцев, стимулируют гораздо большие участки коры, чем менее чувствительные участки. Чувствительность региона зависит от количества рецепторов на единицу площади и расстояния между ними. В отличие от очень чувствительных губ и рук, рецепторов на спине немного и они расположены далеко друг от друга, поэтому она гораздо менее чувствительна.
Неврологи измеряют чувствительность, исследуя минимальное расстояние между двумя точками на коже, которые человек может идентифицировать как отдельные раздражители, а не одиночные раздражители.Восприятие лучше всего там, где двухбалльный порог самый низкий, в областях с наибольшей плотностью нервных окончаний, таких как пальцы и губы. Но вы можете различить два стимула на спине, только если они находятся на расстоянии нескольких сантиметров друг от друга.
Сигналы боли и зуда
Слишком сильно ударьтесь ногой о дверной косяк, и вы почувствуете неприятное ощущение: боль. В первую очередь предупреждающий сигнал, боль — это способ мозга сигнализировать о том, что с телом что-то не так. Как сенсорный, так и эмоциональный опыт, боль сигнализирует о повреждении тканей или возможности повреждения и делает этот опыт неприятным и расстраивающим.
После того, как палец ноги касается дверного косяка, на удар реагируют специальные сенсорные нейроны, ноцицепторы. Ноцицепторы настроены на раздражители, вызывающие повреждение тканей. Они реагируют на сильные раздражители, сообщая вам, когда что-то действительно опасно. Аккуратное прикосновение к дверному косяку не причинит вреда. Пни слишком сильно, и ты можешь сломать кость. Разные ноцицепторы чувствительны к разным болевым раздражителям, таким как термические (тепло или холод), механические (раны) и химические (токсины или яды).
Некоторые ноцицепторы реагируют только на химические раздражители, вызывающие зуд.Рецепторы гистамина активируются, когда раздражение кожи, укусы насекомых или аллергия вызывают высвобождение гистамина в организме. Рецепторы зуда имеют молекулярные каналы в своей клеточной мембране, которые открываются, когда они обнаруживают гистамин. Ученые определили другие рецепторы, специфичные для зуда, которые активируются при обнаружении других молекул, включая простагландины, нейропептиды и протеазы, которые организм высвобождает в ответ на боль и раздражители.
Травма вызывает выделение различных химических веществ в месте повреждения, вызывая воспаление.Этот воспалительный «суп» вызывает нервные импульсы, которые заставляют вас чувствовать боль, поэтому вы защитите травму. Простагландины делают рецепторы более чувствительными к боли, поэтому боль становится более интенсивной. Длительная травма может привести к изменениям в нервной системе, которые усиливают восприятие боли даже без болевых раздражителей. Эта невропатическая боль вызвана сверхчувствительной нервной системой, а не травмой. При диабетической невропатии длительное воздействие высокого уровня сахара в крови повреждает нервы в руках и ногах, посылая сигналы онемения, покалывания, жжения или ноющей боли.
Отправка и получение сообщений
Исследовать Таламус 3D МОЗГСообщения о боли и зуде поступают в спинной мозг по А-дельта- и С-нервным волокнам. Миелиновые волокна А-дельта изолируют нерв, поэтому электроны эффективно направляются и перемещаются быстрее, позволяя вам почувствовать немедленную, острую и легко идентифицируемую боль. Немиелинизированные С-волокна передают сообщения медленнее, и их нервные окончания распространяются на большую площадь. Они помогают вам почувствовать тупую боль, которую трудно определить. Из спинного мозга сигналы направляются в таламус, который передает сигналы в области коры головного мозга, преобразуя сообщения в сознательный опыт.Узнав об этом, вы можете решить быть более осторожным в следующий раз, когда подойдете к двери.
Лечение боли
Если вы и ваш друг ударились ногой об один и тот же дверной косяк, вы, вероятно, будете испытывать боль по-разному. Боль зависит как от силы раздражителя, так и от эмоционального состояния и обстановки, в которой происходит травма. Когда сообщения поступают в кору, мозг может обрабатывать их по-разному в зависимости от того, был ли у вас хороший день или вы только что расстались со своей девушкой.
Кора посылает болевые сообщения в околоводопроводное серое вещество, которое активирует пути, модулирующие боль. Пути посылают сообщения в сети, которые высвобождают эндорфины — натуральные опиоиды, которые действуют как морфин, болеутоляющее. Адреналин, вырабатываемый во время эмоционально стрессовых ситуаций, также служит болеутоляющим средством. Высвобождение этих химических веществ помогает регулировать и уменьшать боль, перехватывая сигналы, проходящие через спинной и ствол головного мозга.
Хотя эти мозговые цепи есть у всех, от того, насколько хорошо они работают и насколько они чувствительны, зависит, насколько сильную боль кто-то чувствует.Вот почему у некоторых людей развивается хроническая боль, которую не может облегчить регулярное лечение. Эндорфины воздействуют на несколько типов опиоидных рецепторов в головном и спинном мозге. Врачи могут вводить опиоидные препараты в спинной мозг до, во время и после операции, чтобы уменьшить боль. Ученые изучают способы электрической стимуляции спинного мозга для облегчения боли, избегая при этом вредных последствий длительного употребления опиоидов.
Ни одна область мозга не отвечает за восприятие боли и зуда. Эмоциональные и сенсорные компоненты создают мозаику активности, влияющую на то, как мы воспринимаем боль.Некоторые успешные методы лечения нацелены на эмоциональный компонент, такой как медитация, гипноз, когнитивно-поведенческая терапия и контролируемое употребление каннабиса. Пациенты с хронической болью все еще чувствуют боль, но она не так «болит». Томография мозга показывает, что каннабис подавляет активность только в нескольких болевых зонах, в основном в лимбической системе, эмоциональном центре мозга. Ученые еще не до конца понимают, как работают эти методы лечения.
Еще многое предстоит узнать о том, как мозг и тело обнаруживают и обрабатывают прикосновение и боль.История до сих пор показывает сложность и важность соматосенсорной системы.
Эта статья была адаптирована из 8-го -го -го издания Brain Facts Мариссы Фессенден.
Об авторе
Сандра Блюменрат
Сандра Х.Блуменрат, доктор наук, магистр наук, научный писатель, редактор и разработчик контента. В настоящее время она работает в Информационной ассоциации по наркотикам (DIA) в Вашингтоне, округ Колумбия, где занимается созданием научного и медицинского контента для различных аудиторий. Сандра живет в Силвер-Спринг, штат Мэриленд, со своим мужем, дочерью и аквариумом, полным рыбы.
Ссылки
Гарибян Л., Рейнгольд, К.Г., и Лернер, Э.А. (2013). Понимание патофизиологии зуда. Дерматологическая терапия , 26 (2), 84–91. doi: 10.1111/dth.12025
Ноцицепция — Физиопедия
Ноцицепция является подкатегорией соматосенсорных ощущений. Ноцицепция — это нейронные процессы кодирования и обработки вредных раздражителей. [1] Ноцицепция относится к сигналу, поступающему в центральную нервную систему в результате стимуляции специализированных сенсорных рецепторов в периферической нервной системе, называемых ноцицепторами. Ноцицепторы активируются потенциально вредными раздражителями, поскольку такая ноцицепция является физиологическим процессом, с помощью которого ткани тела защищаются от повреждений. Ноцицепция важна для «реакции борьбы или бегства» тела и защищает нас от вреда в окружающей среде.
Ноцицепторы могут быть активированы тремя типами стимулов в ткани-мишени: температурными (тепловыми), механическими (например, растяжение/деформация) и химическими (например, изменение рН в результате локального воспалительного процесса).Таким образом, вредный раздражитель можно отнести к одной из этих трех групп.
Термины ноцицепция и боль не должны использоваться как синонимы , поскольку одно может возникать без другого. [1] . Боль, возникающая при активации ноцицепторов, называется ноцицептивной болью. Ноцицептивную боль можно классифицировать в зависимости от ткани, в которой произошла активация ноцицептора: поверхностная соматическая (например, кожа), глубокая соматическая (например, связки/сухожилия/кости/мышцы) или висцеральная (внутренние органы).
Не каждый ноцицептор реагирует на каждый тип вредных раздражителей. К кажущемуся отсутствию ответа на повреждающий раздражитель может привести иное расположение рецепторов на мембране концевого терминаля (свободного нервного окончания) или недостаточная интенсивность раздражителя. [2] Обычно порог стимуляции ноцицептора ниже интенсивности повреждения ткани. Ноцицепторы обладают гетерогенными свойствами, реагируя на множественные модальности стимулов (полимодальные).Однако применение болевого стимула одной модальности может изменить свойства реакции ноцицептора на другие модальности. Кроме того, применение определенного стимула в течение заданного промежутка времени может вызывать долговременные изменения свойств ответа ноцицептора. [3] Травма и воспаление снижают порог и увеличивают величину ответа на данный раздражитель, явление, известное как периферическая сенсибилизация. Особый интерес представляют чувствительные к теплу, но механически нечувствительные немиелинизированные афференты, которые развивают механическую чувствительность только в условиях травмы.
Схематический рисунок ноцицептора, показывающий четыре области клетки.Предполагается, что
Ноцицепторы имеют морфологический вид свободных нервных окончаний. Термин «свободное нервное окончание» указывает на то, что в световом микроскопе невозможно распознать (корпускулярную) рецептивную структуру. В настоящее время нет четких ультраструктурных различий между неноцицептивными свободными нервными окончаниями (например, чувствительными механорецепторами и терморецепторами) и ноцицептивными. Функционально различные свободные нервные окончанияобладают различными наборами рецепторных молекул в своей аксональной мембране. Рецепторные молекулы, которые особенно важны для функции ноцицепторов мышц, представляют собой кислоточувствительные ионные каналы (ASIC), которые открываются при низком pH ткани, рецепторы P2X3, которые активируются путем связывания аденозинтрифосфата (АТФ), и рецепторы с временным рецепторным потенциалом подтипа 1. (TRPV1), который чувствителен к высоким температурам, капсаицину и низкому pH. Сообщалось, что нейропептидное вещество Р присутствует преимущественно в ноцицептивных афферентных волокнах.Хотя в нервной системе имеется множество нейротрансмиттеров, три наиболее часто участвующих в ноцицептивной передаче — это пептиды, пурины и возбуждающие аминокислоты (EAA). EAA, особенно глутамат, вызывают начальный возбуждающий ответ на постсинаптических нейронах второго порядка с последующим высвобождением пептидов, включая вещество P, вызывая более длительную деполяризацию и устойчивую ноцицептивную передачу.
Ноцицепторы присутствуют во многих тканях организма, но не были обнаружены в суставном хряще, висцеральной плевре, легочной паренхиме, перикарде, мозге и ткани пуповины.Типы ноцицепторов[править | править источник]
Описано несколько классов ноцицепторов. Некоторые ноцицепторы реагируют на вредный холод, вредное тепло и высокопороговые механические раздражители, а также на различные химические медиаторы. Ноцицепторы, хотя и полимодальные, могут быть дополнительно разделены на два основных класса на основе реакции на механические раздражители, что приводит к различию между механически чувствительными афферентами (MSA) и механически нечувствительными афферентами (MIA), определяемыми как афференты, которые имеют очень высокие механические пороги или не реагируют на механические раздражители.
Ноцицепторы можно классифицировать по скорости проведения их аксонов [3] или диаметру волокон, [4] это группы III и IV или Aδ и C соответственно.
Тип Aδ миелинизированные афференты среднего диаметра, которые опосредуют острую, хорошо локализованную, острую колющую боль, известную как афферентная группа III. Афферентные волокна Аδ имеют средний диаметр волокон 2-5 мм и скорость проведения 5-30 м/с. Ноцицепторы Aδ можно разделить на два типа (по-видимому, существует примерно 50% каждого типа).
- Тип I Aδ представляют собой механически чувствительные афференты (MSA), которые реагируют медленно адаптирующимся разрядом к сильному точечному давлению.Они также реагируют на тепловые и химические раздражители и имеют относительно высокие тепловые пороги (>50°С).
- Ноцицепторы типа II Aδ имеют более низкий тепловой порог, чем единицы типа I, но имеют очень высокие механические пороги (так называемые механически нечувствительные афференты — MIA). Активность этого афферента почти наверняка опосредует «первую» острую болевую реакцию на вредное тепло. О них сообщалось в коленном суставе, [5] внутренних органах [6] и роговице. [7]
Немиелинизированные афферентные волокна типа С , передающие плохо локализованную тупую, жгучую, так называемую «вторую» или медленную боль, известны как группа IV.Средний диаметр волокна составляет менее 2 мм, а скорость проводимости составляет 2 м/с или менее. Немиелинизированные С-волокна также гетерогенны. Афференты С-волокон можно разделить на два класса в зависимости от их реакции на механические раздражители. Подобно миелинизированным афферентным волокнам Aδ, большинство C-волокон являются полимодальными, то есть они включают популяцию, чувствительную как к механическим, так и к тепловым воздействиям (CMH). Реакция CMH также сильно зависит от истории стимула. Наблюдаются как усталость, так и сенсибилизация. [8] Снижение реакции на тепло наблюдается также после механических раздражений, воздействующих на рецептивное поле, или электрических раздражений, воздействующих на нервный ствол. [9] Это позволяет предположить, что утомление в ответ на данную модальность стимула может быть вызвано гетерологичной стимуляцией, то есть возбуждением стимулом другой модальности. Это преобладающий тип ноцицепторов С-волокон в коже млекопитающих. Механически нечувствительные С-волокна (C-MIA) либо не реагируют на механические раздражители, либо имеют очень высокий механический порог.Эти афференты реагируют на тепло и различные вредные химические стимулы (например, капсаицин, гистамин) и часто считаются хеморецепторами.
Подводя итог вышеизложенному, можно сказать, что немедленная, хорошо локализованная, жгучая боль опосредована миелинизированными нервными волокнами малого диаметра, тип Aδ. Волокна С опосредуют слабо локализованный анатомически тип боли, она носит ноющий и жгучий характер, наступает позже первоначального первого ощущения и оценить ее силу сложно.
Ноцицепторы реагируют на определенный диапазон температур и механические раздражители.Периферический конец аксона содержит инкапсулированные белки, называемые белками трансдукции (TRP), которые могут активироваться определенным стимулом. Мультигенное суперсемейство переходного рецепторного потенциала (TRP) кодирует интегральные мембранные белки, которые функционируют как ионные каналы. Семейство каналов TRP представляет интерес, поскольку несколько членов участвуют в передаче ноцицепторного сигнала.
Болезненные холодовые и вредные тепловые раздражители обнаруживаются ноцицепторами волокон Aδ и C. Семейство каналов TRP представляет собой группу молекул, приспособленных для обнаружения тепловых изменений.Весь диапазон температур, от ядовитого холода до ядовитого жара, по-видимому, передается активностью этих ионных каналов. TRPM8 и TRPV3/4 кодируют холод и тепло соответственно, TRPA1 передает вредный холод, а TRPV1/2 — вредное тепло. Некоторые из термочувствительных каналов TRP также реагируют на химические и механические раздражители. [10]
Например, TRPV1 необходим для передачи ноцицептивного воспалительного и гипотермического эффектов ваниллоидных соединений и способствует острой термической ноцицепции и термической гипералгезии после повреждения ткани.Ток TRPV1 потенцируется брадикинином и фактором роста нервов с помощью нескольких возможных механизмов, а также активируется протонами и капсаицином, «горячим» соединением в перце чили. [11] В отличие от гипералгезии после интенсивных вредных раздражителей, длительное воздействие капсаицина может привести к последующей десенсибилизации.
В то время как открытие термочувствительных каналов TRP значительно улучшило наше понимание механизмов передачи тепловых раздражителей, находки у животных с селективными генными делециями ясно указывают на то, что тепловые раздражители задействуют множественные и пока еще неизвестные механизмы передачи.Травма приводит к локальному высвобождению многочисленных химических веществ из ненейрональных клеток (например, фибробластов, тучных клеток, нейтрофилов, моноцитов и тромбоцитов), а также из чувствительных окончаний первичных афферентных волокон, которые опосредуют или облегчают воспалительный процесс. Медиаторы воспаления включают простагландины, лейкотриены, брадикинин, серотонин, гистамин, SP, тромбоксаны, фактор активации тромбоцитов, пурины, такие как аденозин и АТФ, протоны и свободные радикалы. Цитокины, такие как интерлейкины и фактор некроза опухоли, и нейротрофины, особенно NGF, также образуются во время воспаления.Стоит отметить, что большинство из этих химических веществ (в основном такие вещества, как брадикинин и простагландин E2), как правило, не активируют ноцицепторы напрямую, а скорее усиливают ощущение боли в ответ на естественные раздражители и другие эндогенные химические вещества за счет увеличения частоты действия. потенциальная стрельба. [3]
Мембранные химические рецепторы ноцицептивного нервного окончания.
Активация ноцицепторов не только передает афферентные сообщения в задние рога спинного мозга, но и инициирует процесс нейрогенного воспаления.Нейрогенное воспаление вызывает высвобождение нейротрансмиттеров, особенно субстанции Р и пептида, родственного гену кальцитонина (CGRP), что приводит к выраженной вазодилатации, а также утечке белков и жидкости из посткапиллярных венул в плазму. [3]Особый интерес представляют два химических вещества:
- Аденозинтрифосфат (АТФ)
АТФ является переносчиком энергии молекулой во всех клетках организма. Он высвобождается из всех тканей при травмах и других патологических изменениях, связанных с гибелью клеток.По этой причине АТФ считается общим сигнальным веществом при травмах тканей и боли. В микронейрографических исследованиях человека инъекция АТФ активировала 60% механочувствительных и механонечувствительных С-ноцицептивных волокон без повышения чувствительности этих волокон к механическим или тепловым раздражителям. АТФ активирует пуринергические рецепторы P2X3 в ноцицепторах, вызывая разряд. АТФ особенно важен при мышечной боли, потому что он присутствует в мышечных клетках в высокой концентрации.
- Изменение рН ткани протонами
Кислоточувствительные ионные каналы (ASIC) составляют семейство рецепторных молекул, которые чувствительны к падению рН и открываются при различных значениях рН.Канальные белки реагируют уже на слишком малые изменения рН. Это семейство рецепторов (например, ASIC1 и ASIC3) особенно важно при мышечной боли, поскольку почти все патологические изменения в мышцах сопровождаются падением рН ткани, например, изнурительные физические нагрузки, ишемия и воспаление.
Тела клеток ноцицепторов расположены в ганглиях задних корешков (DRG) на периферии и в ганглиях тройничного нерва на лице. Их аксоны проходят в периферическую нервную систему и оканчиваются ветвями, образующими рецептивные поля.
Свободные нервные окончания, оканчивающиеся в коже, являются механизмом передачи сигналов о местных механических, термических и химических изменениях. [3] Подавляющее большинство свободных нервных окончаний в коже называются полимодальными ноцицепторами, поскольку они содержат несколько рецепторов и, таким образом, реагируют на различные комбинации вышеупомянутых раздражителей. [3] Единицы высокопороговых механорецепторов Aδ типа I плотно распределены в волосистой и голой коже.
Рецепторные молекулы, которые особенно важны для функции ноцицепторов мышц, представляют собой кислоточувствительные ионные каналы (ASIC), которые открываются при низком рН ткани, рецепторы P2X3, которые активируются путем связывания аденозинтрифосфата (АТФ), и подтип рецепторов с временным рецепторным потенциалом 1 (TRPV1), который чувствителен к высоким температурам и низкому pH.
В скелетных мышцах свободные нервные окончания распределены довольно равномерно. Различий между проксимальным и дистальным отделами икроножно-камбаловидной мышцы крыс не обнаружено. Однако в том же исследовании плотность нервных волокон в брюшине пяточного сухожилия крысы оказалась в несколько раз выше, чем в GS мышце. Напротив, пучки коллагеновых волокон собственно ткани сухожилия почти не имели свободных нервных окончаний.Иннервация ахиллова сухожилия человека обеспечивается нервами от окружающих мышц и мелкими пучками от кожных нервов, но при этом вовлекаются все нервные окончания. [12] Свободные нервные окончания представлены внутри сухожилий, но преимущественно в околосухожильной клетчатке, являются рецепторами боли. Количество и расположение всех нервных волокон и нервных окончаний варьируется в зависимости от функции сухожилия, они больше представлены в более мелких сухожилиях, участвующих в тонких движениях.
Ноцицепторы в суставах расположены в пределах суставной капсулы, связок и проксимальных сухожилий, кости, надкостницы, суставной жировой ткани и вокруг кровеносных сосудов, но не в суставном хряще.Высокопороговые ноцицептивные афференты оканчиваются преимущественно в синовиальной оболочке и надкостнице и в норме реагируют только на движение сустава за пределы его рабочих возможностей. После повреждения сустава сочетание двух факторов изменяет механическую чувствительность суставных ноцицепторов. Во-первых, физические изменения (суставной выпот и отек тканей) изменяют силы покоя и движения, воздействующие на ткани сустава, и, во-вторых, медиаторы воспаления, высвобождаемые в поврежденной ткани, сенсибилизируют суставные ноцицептивные афференты, связываясь с рецепторами на нервных окончаниях.Многие ноцицепторы сустава реагируют на безобидные движения, но активируются все больше, когда движения превышают физиологический рабочий диапазон, в то время как другие ноцицепторы активны исключительно во время болезненных движений. [5] Третья группа так называемых безмолвных ноцицепторов обычно неактивна и реагирует только при патологических состояниях, таких как воспаление. [5]
Показано, что капсула поясничного дугоотростчатого сустава богато иннервирована ноцицепторами и проприоцептивными волокнами. [13] В нормальном состоянии ноцицепторы, такие как те, что видны в капсуле дугоотростчатых суставов, имеют высокий порог, и не ожидается, что они будут разряжаться, если только нагрузки не будут сверхфизиологическими. Однако при наличии патологического воспаления суставов химические медиаторы синовита могут повышать чувствительность этих ноцицепторов, и для стимуляции боли больше не требуется сверхфизиологический уровень стресса. Такие медиаторы воспаления (вещество Р, брадикинин, фосфолипаза А2) обнаружены в капсуле фасеточных суставов. [13]
Ноцицепторы в межпозвонковых дисках в норме ограничены внешней третью фиброзного кольца, могут быть субстратом дискогенной боли, когда они распространяются на большую площадь фиброзного кольца и проникают дальше в дегенерированный диск по ходу сосудистой сети и трещины. Эти волокна C и A δ, вероятно, ответственны за передачу болевых реакций. Задняя продольная связка и наружные слои фиброзного кольца межпозвонкового диска содержат большое количество ноцицептивных волокон.Нервные волокна и нервные окончания встречаются также в субхондральной кости дуговидных суставов. Они возникают в эрозионных каналах, простирающихся от субхондральной кости до суставного хряща.
Исследование человека, проведенное (Kiter et al., 2010) [14] , показало наличие как свободных, так и инкапсулированных нервных окончаний в подвздошно-поясничной связке человека. Исследование (Hirsch et al., 1963) [15] предполагает наличие тонких нервных волокон и сложных неинкапсулированных окончаний в надостных и внутриостистых связках.Висцеральные ноцицепторы не реагируют на порезы или ожоги, как их аналоги в периферических кожных тканях. Вместо этого они активируются в ответ на патологические изменения. Боль, вызывающая раздражение внутренних органов, включая растяжение брыжейки, воспаление, растяжение полых органов с мышечной стенкой, таких как желудочно-кишечный тракт, мочевыводящие пути, желчный пузырь, и сильные сокращения мышечных слоев, окружающих такие полые органы, химические раздражители или ишемию в таких органах, как сердце.Распределение этих волокон различается по органам. Высокопороговые рецепторы иннервируют исключительно органы, от которых боль является единственным сознательным ощущением (например, мочеточники, почки, легкие, сердце), но относительно немногочисленны в органах, которые обеспечивают безвредные и вредные ощущения (например, толстая кишка, желудок и мочевой пузырь). иннервируется преимущественно низкопороговыми рецепторами. Органы, такие как печень, легкие, почки и поджелудочная железа, имеют мало рецепторов, но боль от этих органов возникает в основном из-за активации рецепторов в капсулах этих органов.Ноцицептивная стимуляция внутренних органов приводит к диффузной боли, которую трудно локализовать. Афферентные ноцицептивные волокна во внутренних органах связаны с симпатическими и парасимпатическими нервами. Большинство внутренних органов иннервируются блуждающим нервом, но исследования не показывают ясно, способен ли этот нерв проводить ноцицептивную афферентную передачу. Однако некоторые исследования ясно демонстрируют, что афференты блуждающего нерва передают информацию о механических раздражителях высокой интенсивности в центральную нервную систему.Ряд исследований с участием людей или животных показал, что субъекты с поражением позвоночника могут сообщать о боли, вероятно, исходящей из области внутренних органов. [16]
- ↑ 1.0 1.1 Loeser JD, Treede RD. Киотский протокол базовой терминологии боли IASP. Боль. 2008 г.; 137(3): 473–477. doi:10.1016/j.pain.2008.04.025. PMID 18583048
- ↑ Басбаум А.И., Джесселл Т. Восприятие боли. В: Kandel ER, Schwartz J, Jessell T. Editors.Принципы нейробиологии. Нью-Йорк: Эпплтон и Ланге; 2000. стр. 472-491.
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 Мейер Р.А., Рингкамп М., Кэмпбелл Дж.Н., Раджа С.Н. Периферические механизмы кожной ноцицепции. В: McMahon SB, Koltzenburg M, редакторы. Уолл и «Учебник боли» Мелзака. Лондон: Эльзевир; 2006. стр. 3–34.
- ↑ Ллойд, ЦОД. Паттерны нейронов, контролирующие передачу ипсилатеральных рефлексов задних конечностей у кошек.J Нейрофизиол. 1943; 6: 293–315.
- ↑ 5.0 5.1 5.2 Schaible HG, Schmidt RF. Влияние экспериментального артрита на чувствительные свойства мелких суставных афферентных единиц. Журнал нейрофизиологии. 1985 год; 54:1109-1122
- ↑ Häbler HJ, Jänig W, Koltzenburg M. Новый тип немиелинизированного химиочувствительного ноцицептора в остро воспаленном мочевом пузыре. Агенты и действия. 1988;25:219-221
- ↑ Танелиан Д.Л. Холинергическая активация популяции афферентных нервов роговицы.Экспериментальное исследование мозга. 1991;86:414-420
- ↑ Ламотт Р.Х., Кэмпбелл Дж.Н. Сравнение ответов тепловых и ноцицептивных афферентов С-волокон у обезьяны с человеческими суждениями о термической боли. Журнал нейрофизиологии. 1978;41:509-528
- ↑ Триде Р.Д., Мейер Р.А., Раджа С.Н., Кэмпбелл Дж.Н. Доказательства двух различных механизмов теплопередачи в ноцицептивных первичных афферентах, иннервирующих кожу обезьяны. Журнал физиологии. 1995;483:747-758
- ↑ Шеперс Р.Дж., Рингкамп М.Терморецепторы и термочувствительные афференты. Нейронаука и биоповеденческие обзоры. 2010 г.; 34(2):177-184
- ↑ Катерина М.Дж., Шумахер М.А., Томинага М., Розен Т.А., Левин Дж.Д., Юлиус Д. Рецептор капсаицина: активируемый нагреванием ионный канал в болевом пути. Природа 1997; 389: 816–824
- ↑ Бьюр Д., Альфредсон Х., Форсгрен С. Паттерн иннервации ахиллова сухожилия человека: исследования нормального и тендинозного сухожилия с маркерами общей и сенсорной иннервации. Сотовые Ткани Res.2005 г.; 320:201-206
- ↑ 13.0 13.1 Эштон И.К., Эштон Б.А., Гибсон С.Дж., Полак Дж.М., Джафрей Д.К., Эйзенштейн С.М. Морфологическая основа болей в спине: наличие нервных волокон и нейропептидов в капсуле поясничного дугоотростчатого сустава, но не в желтой связке. J Ортоп Res. 1992;10(1):72-78
- ↑ Китер Э., Карабоюн Т., Туфан А.С., Акар К. Иммуногистохимическая демонстрация свободных нервных окончаний в подвздошно-поясничной связке.


 Характеризуются болью, умеренным ограничением движений в суставе, умеренным отеком коленного сустава, сохранением стабильности сустава
Характеризуются болью, умеренным ограничением движений в суставе, умеренным отеком коленного сустава, сохранением стабильности сустава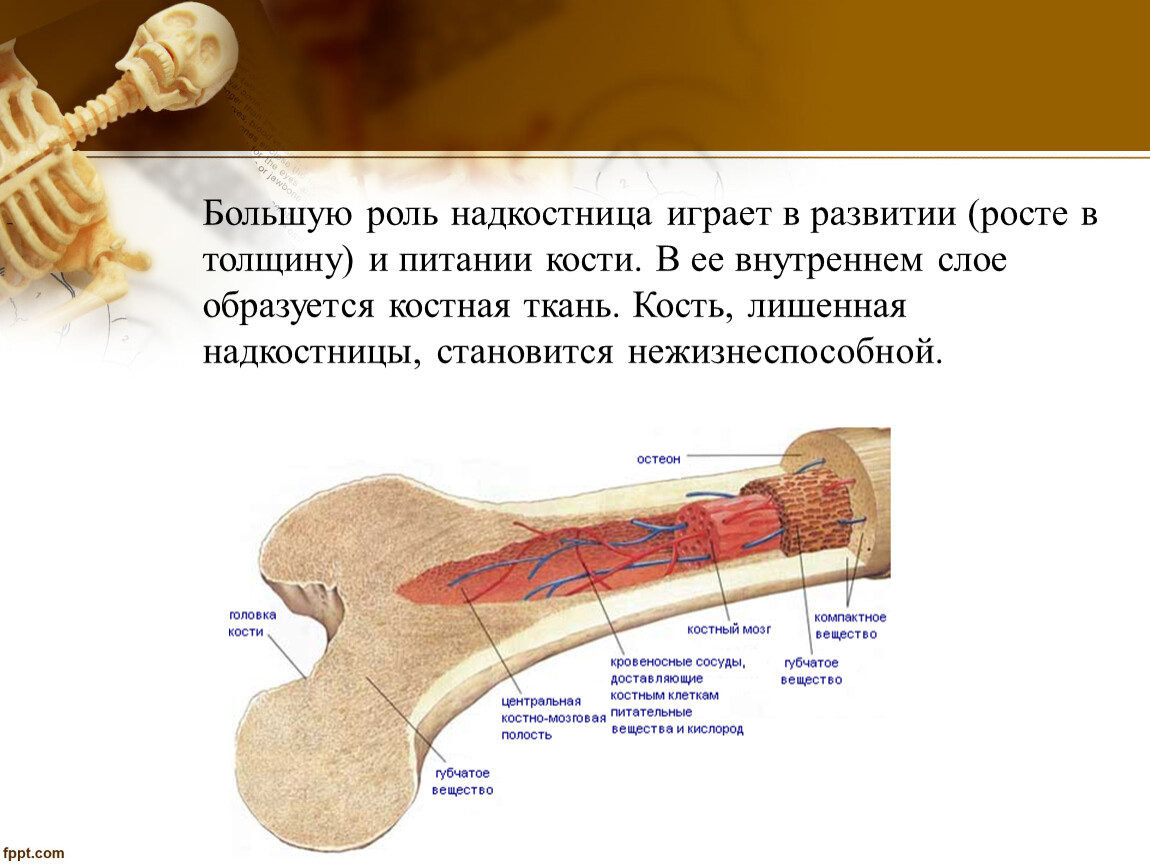
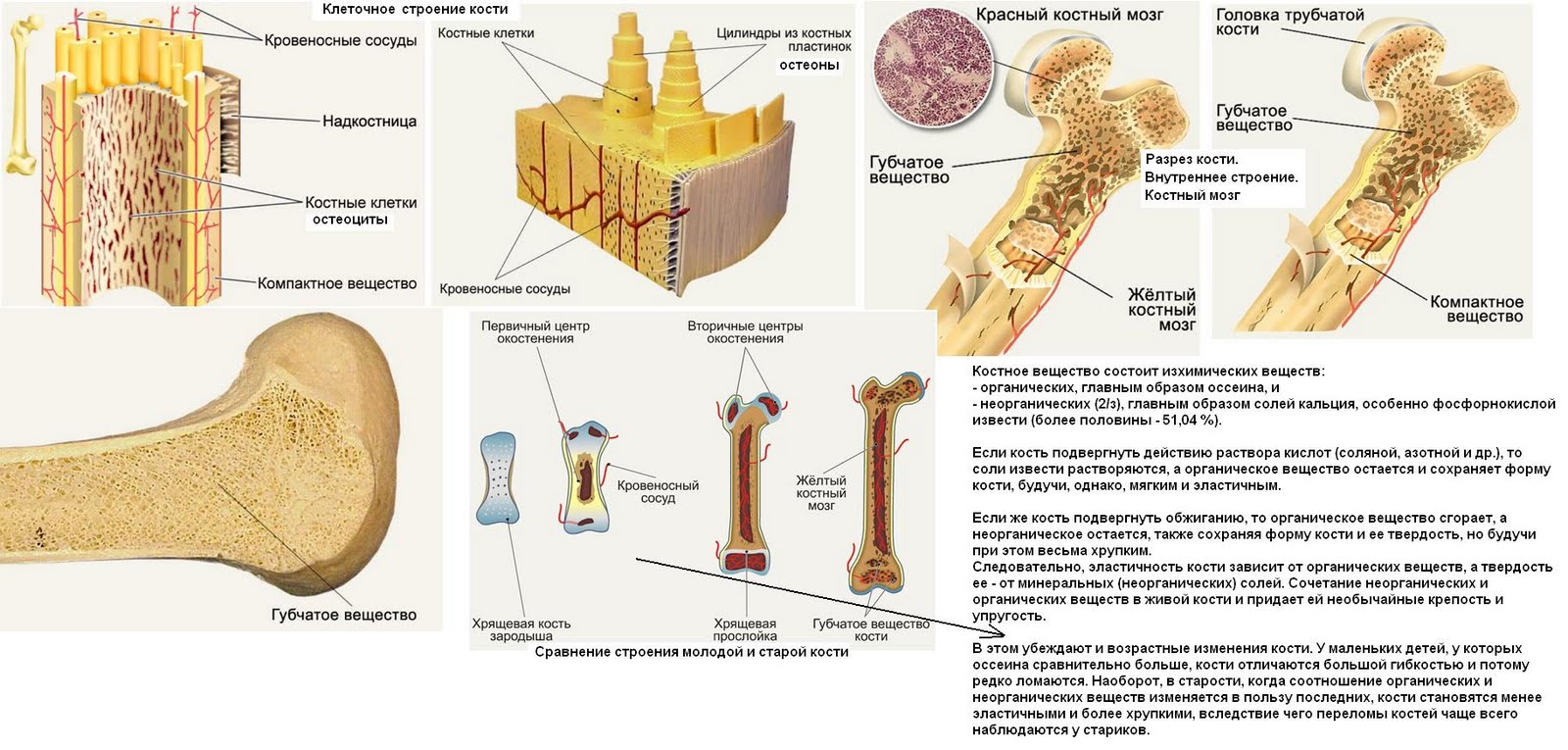 Отсутствие привычной нагрузки не позволит установить зубной имплантат должным образом. Данный процесс стоматологи именуют как дистрофия костной ткани.
Отсутствие привычной нагрузки не позволит установить зубной имплантат должным образом. Данный процесс стоматологи именуют как дистрофия костной ткани.


 Кости – это дискретные органы, состоящие
костной ткани, плюс несколько других вещей.
Кости – это дискретные органы, состоящие
костной ткани, плюс несколько других вещей. 
 Отсутствие достаточного количества витамина D может
привести к рахиту, а отсутствие кальция в рационе к слабости костей
склонны к разрушению.
Отсутствие достаточного количества витамина D может
привести к рахиту, а отсутствие кальция в рационе к слабости костей
склонны к разрушению.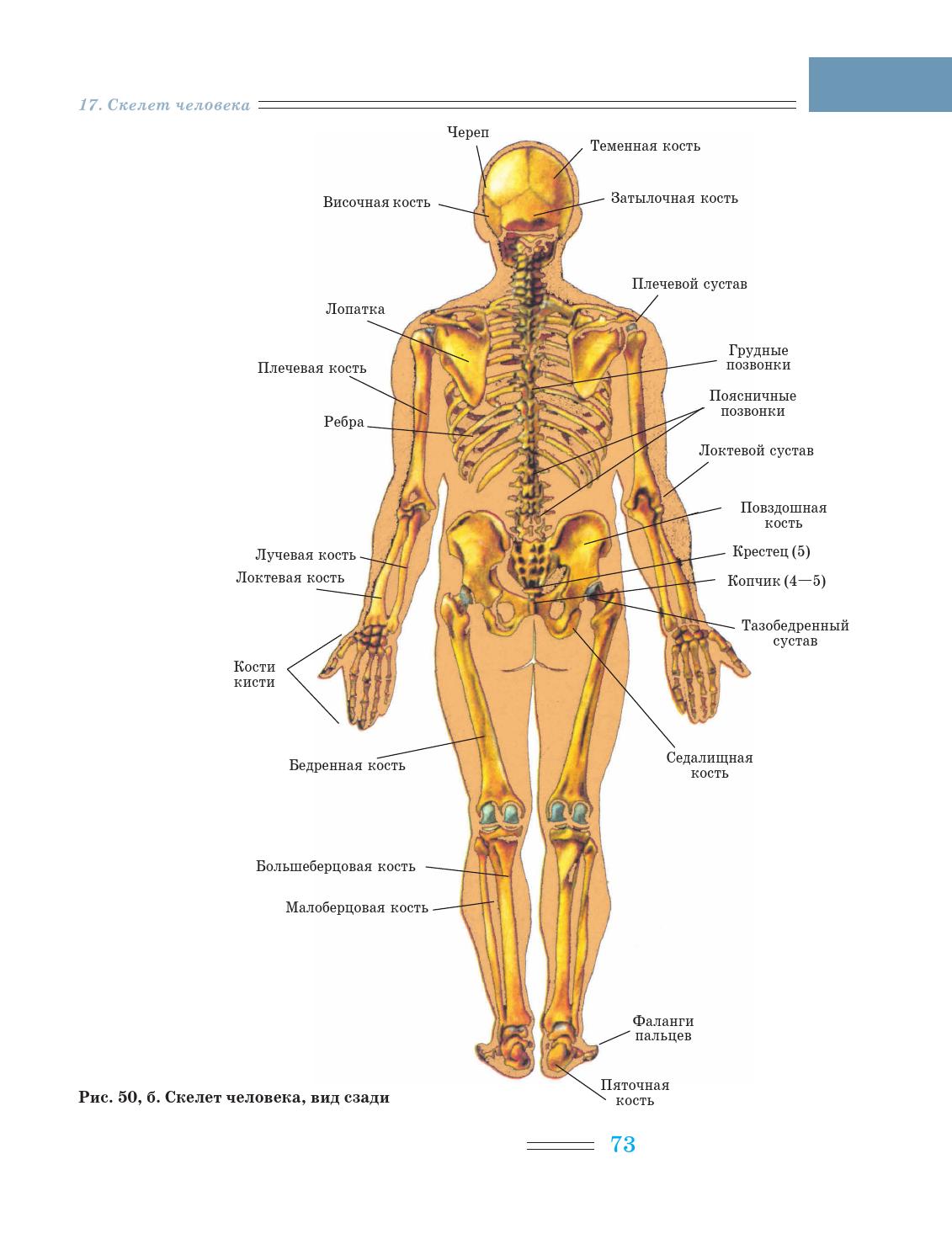 Значит, кость не может быть такой хорошей. На практике эти
превышаются почти непрерывными большими силами, оказываемыми
наши собственные мышцы. Для дыхательных движений нужны ребра. если бедро
кость или плечевая кость ломаются под действием силы мышц,
хоть и не в активном использовании, будет достаточно для перекрытия или иным образом
смещать обломанные концы и нам потребуется значительная сила, тяга,
уменьшить излом, т. е. не перекрывать долота, чтобы они
можно выстроиться. Сила, действующая на жевательные мышцы
достаточно для поддержания массы тела.
Значит, кость не может быть такой хорошей. На практике эти
превышаются почти непрерывными большими силами, оказываемыми
наши собственные мышцы. Для дыхательных движений нужны ребра. если бедро
кость или плечевая кость ломаются под действием силы мышц,
хоть и не в активном использовании, будет достаточно для перекрытия или иным образом
смещать обломанные концы и нам потребуется значительная сила, тяга,
уменьшить излом, т. е. не перекрывать долота, чтобы они
можно выстроиться. Сила, действующая на жевательные мышцы
достаточно для поддержания массы тела. Вхождение
кости в двух основных формах, компактной и губчатой. Оба могут быть
видел в позвонке нашей старушки. Этот раздел был создан как
это.Вокруг снаружи слой прочной, твердой, тяжелой компактной
кость. В середине находится разветвленная сеть губчатых или трабекулярных
кости, которые обычно, подобно железным опилкам, следуют силовым линиям.
Мозг располагается в соединительных полостях между этими пластинками.
или костяные стержни.
Вхождение
кости в двух основных формах, компактной и губчатой. Оба могут быть
видел в позвонке нашей старушки. Этот раздел был создан как
это.Вокруг снаружи слой прочной, твердой, тяжелой компактной
кость. В середине находится разветвленная сеть губчатых или трабекулярных
кости, которые обычно, подобно железным опилкам, следуют силовым линиям.
Мозг располагается в соединительных полостях между этими пластинками.
или костяные стержни. брахиоподы,
наутилоиды, трилобиты постепенно преобразовались. Позже появились первые позвоночные.
в их кожу были встроены костные чешуйки — те, что вокруг рта
попутно образуют примитивную основу зубов.В некоторых строках
эти чешуйки срослись, образуя костные панцири. Эти панцири
сохранились над нашими головами как своды черепов. Позже остальная часть
скелет, позвонки и т. д., которые были хрящевыми, также стали
костлявый. Это объясняет распространение и происхождение мембранных
и хрящевой кости. Сохранившиеся перепончатые кости, особенно
в головке и части ключицы (позднее изобретение, сделанное
из 2 сросшихся костей, одна перепончатая, другая хрящевая) биты
кожного щита.
брахиоподы,
наутилоиды, трилобиты постепенно преобразовались. Позже появились первые позвоночные.
в их кожу были встроены костные чешуйки — те, что вокруг рта
попутно образуют примитивную основу зубов.В некоторых строках
эти чешуйки срослись, образуя костные панцири. Эти панцири
сохранились над нашими головами как своды черепов. Позже остальная часть
скелет, позвонки и т. д., которые были хрящевыми, также стали
костлявый. Это объясняет распространение и происхождение мембранных
и хрящевой кости. Сохранившиеся перепончатые кости, особенно
в головке и части ключицы (позднее изобретение, сделанное
из 2 сросшихся костей, одна перепончатая, другая хрящевая) биты
кожного щита. центры, позже и часто периферийные.
центры, позже и часто периферийные. Диафиз состоит из слоев кости, расположенных как фанера.
для силы. Полость заполнена костным мозгом (красным и
активны у детей, желтые, жирные и неактивные у взрослых). То
стенки диафиза состоят из плотной твердой кости и наиболее толсты в
середина, где силы наибольшие.Если эти силы слишком велики
вал может сломаться. В молодых костях меньше кальция и они
податливый, поэтому ломается неравномерно и частично (зеленая палочка): старше
кости будут ломаться поперечно или по спирали в зависимости от силы
применяемый. Переломы обычно срастаются спонтанно, хотя
медленно в некоторых случаях, но сломанными поверхностями нужно манипулировать
в нужное место и, возможно, потребуется удерживать гипсом, булавками
или провода.
Диафиз состоит из слоев кости, расположенных как фанера.
для силы. Полость заполнена костным мозгом (красным и
активны у детей, желтые, жирные и неактивные у взрослых). То
стенки диафиза состоят из плотной твердой кости и наиболее толсты в
середина, где силы наибольшие.Если эти силы слишком велики
вал может сломаться. В молодых костях меньше кальция и они
податливый, поэтому ломается неравномерно и частично (зеленая палочка): старше
кости будут ломаться поперечно или по спирали в зависимости от силы
применяемый. Переломы обычно срастаются спонтанно, хотя
медленно в некоторых случаях, но сломанными поверхностями нужно манипулировать
в нужное место и, возможно, потребуется удерживать гипсом, булавками
или провода.  Эпифиз позволяет это сделать.
но выглядит сложно. Вернемся к длинной кости рыбы и
попытайтесь понять логику, лежащую в основе структуры. Рост
должно происходить как на конце вала (А), так и над поверхностью
сустава (б). Рыба достигает этого, заканчивая кость
с простой пробкой из хряща. Это работает до тех пор, пока кость не
выдерживать вес, когда большой гибкий хрящ становится смущающим.Первая модификация, увиденная у челоний (черепахи и черепахи)
заключается в том, что поверхность становится искривленной (полости костного мозга впервые видны
у земноводных). Новый радиально расположенный хрящ по-прежнему
прочный, но менее громоздкий. Следующая проблема, когда конца нет
более длинная полусфера: структура тогда менее прочна, и
постоянное изменение формы необходимо с ростом. Эти проблемы
можно преодолеть, создав вторичный центр окостенения,
уже упоминалось, — образуя еще один кусок крепкой кости в
эпифиз.Это популярно, встречается как минимум в семи группах.
наземных позвоночных. Мы видим вторичные центры на концах
большинство длинных костей, часто более одной на конец, если форма
сложный. В конечном итоге они сливаются с главным валом в процессе
называют закрытием эпифиза. Что укрепляет кости
но заканчивается возможность роста. Это полезно для судебно-медицинской экспертизы.
целях, но происходит не очень регулярно.
Эпифиз позволяет это сделать.
но выглядит сложно. Вернемся к длинной кости рыбы и
попытайтесь понять логику, лежащую в основе структуры. Рост
должно происходить как на конце вала (А), так и над поверхностью
сустава (б). Рыба достигает этого, заканчивая кость
с простой пробкой из хряща. Это работает до тех пор, пока кость не
выдерживать вес, когда большой гибкий хрящ становится смущающим.Первая модификация, увиденная у челоний (черепахи и черепахи)
заключается в том, что поверхность становится искривленной (полости костного мозга впервые видны
у земноводных). Новый радиально расположенный хрящ по-прежнему
прочный, но менее громоздкий. Следующая проблема, когда конца нет
более длинная полусфера: структура тогда менее прочна, и
постоянное изменение формы необходимо с ростом. Эти проблемы
можно преодолеть, создав вторичный центр окостенения,
уже упоминалось, — образуя еще один кусок крепкой кости в
эпифиз.Это популярно, встречается как минимум в семи группах.
наземных позвоночных. Мы видим вторичные центры на концах
большинство длинных костей, часто более одной на конец, если форма
сложный. В конечном итоге они сливаются с главным валом в процессе
называют закрытием эпифиза. Что укрепляет кости
но заканчивается возможность роста. Это полезно для судебно-медицинской экспертизы.
целях, но происходит не очень регулярно.