|
« Назад Каждый день в промышленности люди сталкиваются с таким понятием как стандартные условия, так же называемыми «нормальными». Под ними подразумевают определенные значения температуры и давления, а так же всех величин, которые от них зависят. Стандарты различных организаций и отраслей:
Калькулятор для перевода в стандартные условия: « Назад |
Нормальные условия (НУ).
 STP. NTP. SATP. Стандартная атмосфера и температура. Что это такое?
STP. NTP. SATP. Стандартная атмосфера и температура. Что это такое?Нормальные условия (НУ). STP. NTP. SATP. Стандартная атмосфера и температура. Что это такое?
1.1.1) Самые распространенные и уже устаревшие нормальные условия (НУ = STP = стандартная температура и давление) . Определены IUPAC — Международный союз чистой и прикладной химии. :
При этих НУ
- объем одного моля идеального газа = постоянная Авогадро составляет 22,413996 дм
- число молекул в 1 литре газа = 2,6867774х1022
- число молекул в 1 см3 газа = 2,6867774х1019
1.1.2) Сейчас нормальные условия (НУ= STP = стандартная температура и давление). Определены IUPAC — Международный союз чистой и прикладной химии. :
1.1.3) Сейчас нормальные условия (НУ= STP или NTP = стандартная (нормальная) температура и давление). Определены NIST — National Institute for Standards and Technology :
1. 2)
2)
- Давление: 101325 Па (760 мм рт.ст.)
- Температура: 298,15 ° K =25 ° С
2) ICAO — Международная организация гражданской авиации определяет некую «международную стандартную атмосферу на уровне моря», которую тоже, бывает, называют нормальными условиями:
- Давление: 101325 Па (760 мм рт.ст.)
- Температура: 288,15 ° K =15 ° С
- Влажность (абсолютная и относительная) = 0
3) Как минимум 50% ветеранов броуновского движения и сестер милосердия в РФ, из-за того, что газовики в России приводят, согласно ГОСТ 2939-63, объемы газов к «условиям для определения объема», считают, что НУ это:
- Давление: 101325 Па (760 мм рт.ст.)
- Температура: 293,15 ° K =20 ° С
- Влажность (абсолютная и относительная) = 0
Пользуйтесь этой информацией на здоровье, и помните, что не все так ясно, как кажется, но и сложного ничего при ближайшем рассмотрении нет.
Вывод: ссылка на НУ без указания величины не имеет смысла.
Объем, масса, плотность, удельный объем. Приведение к нормальным и стандартным условиям и пересчет
Приведение к нормальным и стандартным условиям
Единицей измерения объема газа является кубический метр (м³). Измеренный объем приводится к нормальным физическим условиям.
Нормальные физические условия: давление 101 325 Па, температура 273,16 К (0 °С).
Стандартные условия: давление 101 325 Па, температура 293,16 К (+20 °С).
В настоящее время эти обозначения выходят из употребления. Поэтому в дальнейшем следует указывать те условия, к которым относятся объемы и другие параметры газа. Если эти условия не указываются, то это значит, что параметры газа даны при 0 °С (273,16 °К) и 760 мм рт. ст. (1,033 кгс/см²). Иногда объем газа (особенно в иностранной литературе и нормах) при пользовании системой СИ приводится к 288,16 °К (+15 °С) и давлению 1 бар (105 Па).
Если известен объем газа при одних условиях, то пересчитать его в объемы при других условиях можно с помощью коэффициентов, приведенных следующей таблице.
Коэффициенты для пересчета объемов газа из одних условий в другие
| Температура и даление газа | 0 °С и 760 мм рт. ст. | 15 °С и 760 мм рт. ст. | 20 °С и 760 мм рт. ст. | 15 °С (288,16 °К) и 1 бар |
| 0 °С и 760 мм рт. ст. (норм. условия) | 1 | 1,055 | 1,073 | 1,069 |
| 15 °С и 760 мм рт. ст. (в зар. литературе) | 1 | 1,019 | 1,013 | |
| 20 °С и 760 мм рт. ст. (ст. условия) | 0,932 | 0,983 | 1 | 0,966 |
| 15 °С (288,16 °К) и 1 бар (СИ) | 0,936 | 0,987 | 1,003 | 1 |
Для приведения объемов газа к 0 °С (273,16 °К) и 760 мм рт.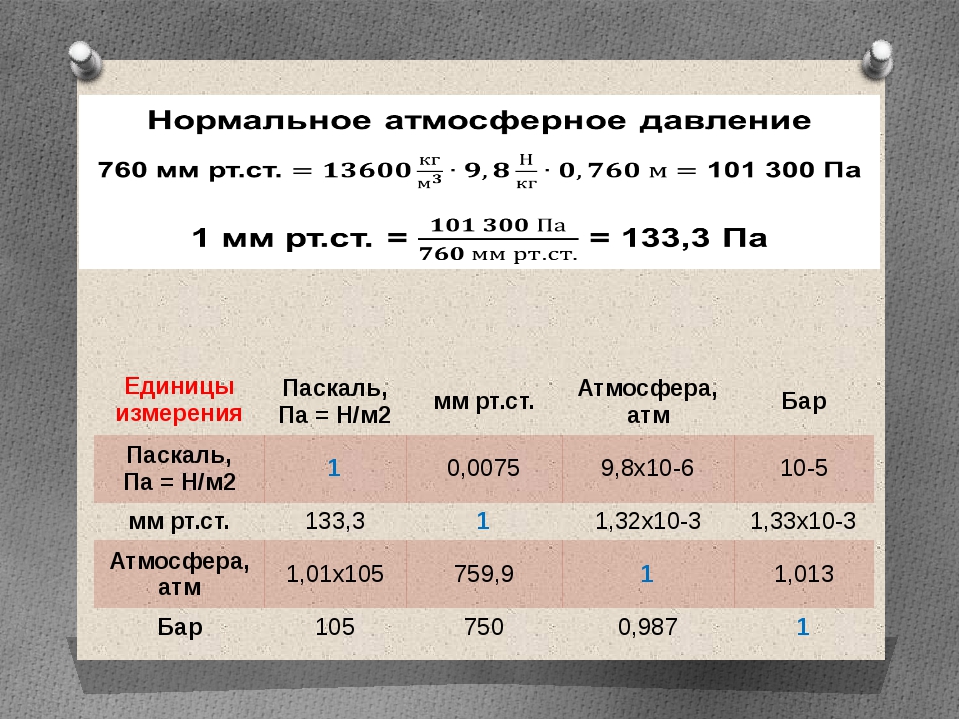 ст. (1,033 кгс/см²), а также к 20 °С (293,16 °К) и 760 мм рт. ст. (1,033 кгс/см²) могут быть применены следующие формулы:
ст. (1,033 кгс/см²), а также к 20 °С (293,16 °К) и 760 мм рт. ст. (1,033 кгс/см²) могут быть применены следующие формулы:
где V0 °С и 760 мм рт. ст.
V20° С и 760 мм рт. ст. — объем газа при 20 °С и 760 мм рт. ст., м³;
VP — объем газа в рабочих условиях, м³;
р — абсолютное давление газа в рабочих условиях, мм рт. ст.;
Т — абсолютная температура газа в рабочих условиях, °К.
Пересчет объемов газа, приведенных к 0 °С и 760 мм рт. ст., а также к 20 °С и 760 мм рт. ст., в объемы при других (рабочих) условиях можно производить по формулам:
Любой газ способен расширяться. Следовательно, знание объема, который занимает газ, недостаточно для определения его массы, так как в любом объеме, целиком заполненном газом, его масса может быть различной.
Масса — это мера вещества какого-либо тела (жидкости, газа) в состоянии покоя; скалярная величина, характеризующая инерционные и гравитационные свойства тела. Единицы массы в СИ — килограмм (кг).
Единицы массы в СИ — килограмм (кг).
Плотность, или масса единицы объема, обозначаемая буквой p, — это отношение массы тела m, кг, к его объему, V, м³:
p = m/V
или с учетом химической формулы газа:
p = M/VМ = M/22,4,
где M — молекулярная масса,
VМ — молярный объем.
Единица плотности в СИ — килограмм на кубический метр (кг/м³).
Зная состав газовой смеси и плотность ее компонентов, определяем по правилу смешения среднюю плотность смеси:
pсм = (p1V1 + p2V2 + … + pnVn)/100,
где p1, p2, …, pn — плотность компонентов газового топлива, кг/м³;
V1, V2, …, Vn — содержание компонента, об. %.
%.
Величину, обратную плотности, называют удельным, или массовым, объемом (ν) и измеряют в кубических метрах на килограмм (м³/кг).
Как правило, на практике, чтобы показать, на сколько 1 м³ газа легче или тяжелее 1 м³ воздуха, используют понятие относительная плотность d, которая представляет собой отношение плотности газа к плотности воздуха:
d = p/1,293
и
d = M/(22,4×1,293).
Нормальные и стандартные условия — это… Что такое Нормальные и стандартные условия?
Норма́льные усло́вия — стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях, при н. у., англ. Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом практической и прикладной химии) следующим образом
При нормальных условиях объём одного моля идеального газа составляет 22,413 996(39) дм³[2] (следствие из закона Авогадро), а количество молекул в 1 см³ составляет 2,6867774(47)×1019[3] (постоянная Лошмидта).
Стандартные условия (англ. Standard Ambient Temperature and Pressure, SATP):
- давление 1 Бар = 105 Па = 750,06 мм рт. ст.;
- температура 298,15 К = 25 °С.
При этих условиях константа диссоциации дистиллированной воды составляет 1,0×10−14.
Другие области
Авиация
Международная организация гражданской авиации (ICAO) определяет международную стандартную атмосферу (англ. International Standard Atmosphere, ISA) на уровне моря с температурой 15 °C, атмосферным давлением 101325 Па и относительной влажностью 0 %.
Она используется при расчётах движения летательных аппаратов.
Газовое хозяйство
Газовая отрасль Российской Федерации при расчётах с потребителями использует атмосферные условия по ГОСТ 2939—63:
Таким образом, масса кубометра газа по ГОСТ 2939—63 несколько меньше, чем при «химических» нормальных условиях.
Иногда путают нормальные условия со стандартными, полагая, что ГОСТ определяет нормальные условия, и делается вывод о неоднозначности термина «нормальные условия». На самом деле ГОСТ 2939—63 никак не определяет и не упоминает нормальные условия, поэтому «н.у.» определяются однозначно.
На самом деле ГОСТ 2939—63 никак не определяет и не упоминает нормальные условия, поэтому «н.у.» определяются однозначно.
См. также
Стандартные состояния
Примечания
Давление при нормальных условиях в паскалях – 1 па равен
Для того, чтобы узнать, сколько в паскале атмосфер, необходимо воспользоваться простым онлайн калькулятором. Введите в левое поле интересующее вас количество паскалей, которое вы хотите конвертировать. В поле справа вы увидите результат вычисления. Если необходимо перевести паскали или атмосферы в другие единицы измерения, просто кликните по соответствующей ссылке.
Что такое «паскаль»
Единица измерения из системы СИ – паскаль (Па, Pa), равен давлению при равномерном приложении силы в 1 ньютон к ровной поверхности площадью 1 кв.
м. В паскалях измеряют также механическое напряжение, модули упругости, модуль Юнга, предел текучести, предел пропорциональности, сопротивление разрыву и срезу, звуковое и осмотическое давление, летучесть. Названа единица в честь французского физика и математика Блеза Паскаля в 1961 году.
Названа единица в честь французского физика и математика Блеза Паскаля в 1961 году.
Что такое «атмосфера»
Внесистемная единица измерения давления, приблизительно соответствующая атмосферному давлению на уровне мирового океана.
Равноправно существуют две единицы – техническая атмосфера (ат, at) и нормальная, стандартная или физическая атмосфера (атм, atm). Одна техническая атмосфера – это равномерное перпендикулярное давление силы в 1 кгс на ровную поверхность площадью 1 см².
1 ат = 98 066,5 Па.
Как перевести давление в Паскали
Стандартная атмосфера – это давление ртутного столба высотой 760 мм при плотности ртути 13 595,04 кг/м³ и нулевой температуре. 1 атм = 101 325 Па = 1,033233 ат. В РФ используется только техническая атмосфера.
В прошлом для абсолютного и избыточного давления употребляли термины «ата» и «ати».
Избыточное давление – разница между абсолютным и атмосферным давлением, когда абсолютное больше атмосферного. Разница между атмосферным и абсолютным давлением, когда абсолютное давление ниже атмосферного, называется разрежением (вакуумом).
Атмосферное давление
Паска́ль (русское обозначение: Па, международное: Pa) — единица измерениядавления (механического напряжения) в Международной системе единиц (СИ)[1].
Паскаль равен давлению, вызываемому силой, равной одному ньютону, равномерно распределённой по нормальной к ней поверхности площадью один квадратный метр: 1 Па = 1 Н·м−2.
Атмосферное давление: перевод мегапаскалей (МПа) в атмосферы
С основными единицами СИ паскаль связан следующим образом: 1 Па = 1 кг·м−1·с−2.
В СИ паскаль также является единицей измерения механического напряжения, модулей упругости, модуля Юнга, объёмного модуля упругости, предела текучести, предела пропорциональности, сопротивления разрыву, сопротивления срезу, звукового давления, осмотического давления, летучести (фугитивности)[2].
В соответствии с общими правилами СИ, касающимися производных единиц, названных по имени учёных, наименование единицы паскаль пишется со строчной буквы, а её обозначение — с заглавной.
Такое написание обозначения сохраняется и в обозначениях других производных единиц, образованных с использованием паскаля. Например, обозначение единицы динамической вязкости записывается как Па·с.
Единица названа в честь французскогофизика и математикаБлеза Паскаля. Впервые наименование было введено во Франции декретом о единицах в 1961 году[2][3].
Десятичные кратные и дольные единицы образуют с помощью стандартных приставок СИ.
На практике применяют приближённые значения: 1 атм = 0,1 МПа и 1 МПа = 10 атм. 1 мм водяного столба примерно равен 10 Па, 1 мм ртутного столба равен приблизительно 133 Па.
Нормальное атмосферное давление принято считать равным 760 мм ртутного столба, или 101 325 Па (101 кПа).
Размерность единицы давления (Н/м²) совпадает с размерностью единицы плотности энергии (Дж/м³), но с точки зрения физики эти единицы не эквивалентны, так как описывают разные физические свойства.
В связи с этим некорректно использовать Паскали для измерения плотности энергии, а давление записывать как Дж/м³.
Сколько атмосферы в 1 бар?
Название единицы давления в баре происходит от греческого слова для веса. Производная этой единицы, миллибар, широко используется в метеорологии.
Бар относится к категории единиц, определяемых силами силы и площади. Есть две единицы с тем же именем, называемые линией. Одним из них является единица измерения давления, принятая в физической системе единиц CGS (сантиметр, грамм, другая). Этот блок определяется как 1 dyne / cm2, где 1 dyne — это единица силы, используемая в системе.
Кроме того, под 1 баром находится внесистемная система, метеорологическая единица, также называемая стандартной атмосферой. Соотношение между двумя полосами составляет 1 бар или 1 стандартная атмосфера составляет 106 дин / см2.
В дополнение к стандартной атмосфере, техническая (метрическая) атмосфера и физическая (нормальная) атмосфера используются на практике. Техническая или метрическая атмосфера используется в технической системе подразделений МКГСС. Он также обозначается как кгс / см2. Техническая атмосфера определяется как давление, создаваемое силой 1 кгс, направленное перпендикулярно и равномерно распределенное на плоскую поверхность 1 см2.
Он также обозначается как кгс / см2. Техническая атмосфера определяется как давление, создаваемое силой 1 кгс, направленное перпендикулярно и равномерно распределенное на плоскую поверхность 1 см2.
Соотношение стержня к технической атмосфере составляет 1 бар = 10197 кгс / см2.
Нормальная атмосфера — дополнительный системный блок, такое же давление на поверхности Земли. Он определяется как давление, контролируемое 760 мм ртути при 0 градусах Цельсия, нормальная плотность ртути и нормальное ускорение веса. Связь между полосой и нормальной или физической атмосферой — 1 бар = 0,98692 атм.
Часто быстрый и удобный расчет не требует высокой точности. Поэтому приведенные выше значения могут быть округлены в зависимости от того, какие ошибки вы готовы принять в измерениях.
Атмосферное нормальное и стандартное давление
Если ошибка составляет 0,5%, вы можете взять 1 бар, что равно 0,98 атм. или 1,02 кгс / см2. Если мы проигнорируем разницу между технической атмосферой и баром (стандартная атмосфера), то ошибка составляет 2%.
И, допустив ошибку 3%, мы можем принять во внимание физическую и стандартную атмосферу, которая эквивалентна друг другу.
По материалам сайта http://otvet.mail.ru
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
19202122232425
2627282930
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Как правильно рассчитать расход газа (азота, кислорода, воздуха) на производстве и что такое нормальные метры кубические?
Расход газа необходимо приводить к нормальным метрам кубическим.
Пример:
В опросном листе Клиент в поле «расход газа» указал 130 м3/ч, а в поле «давление газа» — 8 бар.
Для инженера, который будет заниматься подбором, к примеру, адсорбционной азотной станции, встанет вопрос: расход 130 метров кубических при нормальных условиях или при давлении 8 бар?
В первом случае инженер будет подбирать адсорбционную азотную станцию с производительностью 130 нм3/ч и рабочим давлением 8 бар, а во втором случае – будет производить перерасчет в нормальные метры кубические,
[Расход при нормальных условиях] = [Расход реальный] 130 м3/ч * [избыточное давление] 8 бар = 1040 нм3/ч
а потом производить подбор азотной станции с производительностью 1040 нм3/ч и рабочим давлением 8 бар.
Как Вы уже поняли, следствием такой ошибки может стать неправильно подобранная или, что хуже – приобретённая адсорбционная, мембранная или компрессорная станция. Поэтому очень важно помнить о различиях между расходом газа при нормальных условия и расходом газа при давлении.
Поэтому очень важно помнить о различиях между расходом газа при нормальных условия и расходом газа при давлении.
Нормальный метр кубический (нм3) – это метр кубический (м3) газа при нормальных условиях. Под нормальными условиями принимают давление, равное 101 325 Паскаль (или 760 мм. рт. ст.) и температуру 0℃.
Как рассчитать реальный расход газа на Вашем производстве и не допустить ошибок в подборе оборудования?
Расскажу на примере реальной истории (Клиент поставил задачу просчитать азотную станцию для отказа от использования баллонов на производстве).
Диалог с Клиентом:
…
Какой расход азота у Вас на производстве? – 2 ресивера в сутки;
Какой объем каждого ресивера? – по 10 кубов;
А давление в ресиверах? – по-разному, от 100 до 200 бар;
А есть более точная информация? – Давайте позже, нам работать надо.
…
Следует понимать, что по таким исходным данным невозможно правильно рассчитать производительность азотной станции. Более того, недобросовестные продавцы и вовсе могут этим пользоваться и навязывать неподходящее по производительности оборудование! Таких случаев не мало и о них мы обязательно будем рассказывать в следующих статьях.
Основные вопросы, которые остались без ответа, звучат так:
- Какое точное давление азота в ресиверах? (необходимо для расчета производительности в рабочую смену/сутки)
- Какое количество смен/часов в Вашем рабочем дне? (необходимо для просчета возможности использования азотной станции в нерабочее время).
- Закупка большого количества баллонов (более 100 шт. в сутки), затрата времени на манипуляции с подключением и отключением баллонов от системы подачи азота, раздутый штат грузчиков;
- Постоянные проверки и дорогое техническое обслуживание поднадзорных высокобарных ресиверов, объемом 10 м3.

Получив ответы на все необходимые вопросы, мы выяснили, что на производстве расходуется 2 ресивера азота в сутки, объемом 10 м3 каждый, с давлением газа 150 бар. В сутках 2 рабочих смены по 8 часов, то есть 16 рабочих часов в день.
Благодаря полученной информации мы можем рассчитать реальный расход азота на производстве Клиента:
Расчет:
2 ресивера х 10 м3 = 20 м3 х 150 бар = 3000 м3 / 16 часов = 187,5 нм3/ч.
Проанализировав эти данные, мы разработали техническое решение, позволяющее избавиться от необходимости закупки огромного количества дорогостоящего азота в баллонах, а также от использования поднадзорных ресиверов.
Нами была установлена адсорбционная азотная станция АВС-200А, производительностью 200 нм3/ч азота, с запасом на длину трубопроводов от азотной станции до точки потребления, исключающая просадки давления на магистрали. В составе станции были установлены воздушные и азотные ресиверы, не требующие регистрации в Ростехнадзоре (объем ресивера не более 0,9 м3, рабочее давление не более 10 бар).
В составе станции были установлены воздушные и азотные ресиверы, не требующие регистрации в Ростехнадзоре (объем ресивера не более 0,9 м3, рабочее давление не более 10 бар).
Работа азотной станции полностью автоматизирована и не требует круглосуточного мониторинга оператором. После наполнения азотных ресиверов до максимального давления 8 бар азотная станция АВС-200А переходит в режим ожидания. В тот момент, когда давление в ресивере азота опускается ниже 7 бар, станция автоматически выходит на рабочий режим и работает до тех пор, пока максимальное давление не будет достигнуто (уровень минимального и максимального давления для включения азотной станции настраивается на панели оператора).
Это были основные вопросы и ошибки, которые возникают при определении расхода газа (азота, кислорода или воздуха) на производстве, а также одно из технических решений, позволяющее модернизировать производство и существенно сэкономить Клиенту в долгосрочной перспективе.
О том, как правильно рассчитать расход в случае, если потребление газа плавает в течение всего дня (пиковые нагрузки и спады) и о том, какие варианты компенсаций плавающего расхода существуют – мы расскажем в следующих статьях.
Давление газа
10.2 Давление газа
Цель обучения
- Для описания и измерения давления газа.
На макроскопическом уровне полное физическое описание образца газа требует четырех величин: температуры (выражено в кельвинах), объема (выражено в литрах), количества (выражено в молях) и давления. (в атмосферах). Как мы объясняем в этом разделе и в разделе 10.3 «Взаимосвязь между давлением, температурой, объемом и количеством» эти переменные не независимы. Если нам известны значения любых , трех, из этих величин, мы можем вычислить четвертое и таким образом получить полное физическое описание газа. Температура, объем и количество обсуждались в предыдущих главах. Теперь обсудим давление и его единицы измерения.
Температура, объем и количество обсуждались в предыдущих главах. Теперь обсудим давление и его единицы измерения.
Единицы давления
Любой объект, будь то ваш компьютер, человек или образец газа, воздействует на любую поверхность, с которой он соприкасается.Например, воздух в воздушном шаре оказывает усилие на внутреннюю поверхность воздушного шара, а жидкость, впрыскиваемая в форму, оказывает силу на внутреннюю поверхность формы, точно так же, как стул прикладывает силу к полу из-за его масса и влияние силы тяжести. Если воздух в воздушном шаре нагревается, повышенная кинетическая энергия газа в конечном итоге приводит к разрыву воздушного шара из-за повышенного давления ( P ). Величина силы (F), приложенная к данной области (A) поверхности: P = F / A.газа, сила ( F ) на единицу площади ( A, ) поверхности:
Давление зависит от и силы, прилагаемой, и размера области, к которой приложена сила. Из уравнения 10.1 мы знаем, что приложение той же силы к меньшей площади создает более высокое давление. Например, когда мы используем шланг для мытья автомобиля, мы можем увеличить давление воды, уменьшив размер отверстия шланга большим пальцем.
Из уравнения 10.1 мы знаем, что приложение той же силы к меньшей площади создает более высокое давление. Например, когда мы используем шланг для мытья автомобиля, мы можем увеличить давление воды, уменьшив размер отверстия шланга большим пальцем.
Единицы давления являются производными от единиц измерения силы и площади.В английской системе единицы силы — фунты, а единицы площади — квадратные дюймы, поэтому мы часто видим, что давление выражается в фунтах на квадратный дюйм (фунт / дюйм 2 , или фунт / кв. Дюйм), особенно среди инженеров. Однако для научных измерений предпочтительны единицы СИ для силы. Единица СИ для давления, производная от единиц СИ для силы (ньютонов) и площади (квадратные метры), — это ньютон на квадратный метр (Н / м 2 ), который называется паскаль (Па). давление.Паскаль — это ньютоны на квадратный метр: Н / м2., По французскому математику Блезу Паскалю (1623–1662):
Уравнение 10.2
1 Па = 1 Н / м 2 Чтобы преобразовать фунты на квадратный дюйм в паскали, умножьте фунты на квадратный дюйм на 6894,757 [1 Па = 1 фунт на квадратный дюйм (6894,757)].
Блез Паскаль (1623–1662)
Помимо своих математических талантов (он изобрел современную теорию вероятностей), Паскаль проводил исследования в области физики, а также был писателем и религиозным философом.Его достижения включают изобретение первого шприца и первого цифрового калькулятора, а также разработку принципа передачи гидравлического давления, который сейчас используется в тормозных системах и гидравлических лифтах.
Пример 2
Предположим, что книга в мягкой обложке имеет массу 2,00 кг, длину 27,0 см, ширину 21,0 см и толщину 4,5 см. Какое давление она оказывает на поверхность, если оно составляет
- лежа?
- стоит на краю в книжном шкафу?
Дано: Масса и габариты объекта
Запрошено: давление
Стратегия:
A Вычислите силу, прилагаемую к книге, а затем вычислите площадь, которая соприкасается с поверхностью.
B Подставьте эти два значения в уравнение 10.1, чтобы найти давление, оказываемое на поверхность в каждой ориентации.
Решение:
Сила, прикладываемая книгой, и не зависит от ее ориентации. Вспомните из главы 5 «Энергетические изменения в химических реакциях», что сила, прилагаемая объектом, равна F = ma , где m — его масса, а a — его ускорение.В гравитационном поле Земли ускорение происходит за счет силы тяжести (9,8067 м / с 2 у поверхности Земли). Таким образом, в единицах СИ сила, прилагаемая книгой, равна
. F = мА = (2,00 кг) (9,8067 м / с 2 ) = 19,6 (кг · м) / с 2 = 19,6 НA Мы рассчитали силу как 19,6 Н.
P = 19,6 N 0,0567 м2 = 3,46 × 102 Па Когда книга лежит ровно, площадь составляет (0,270 м) (0.210 м) = 0,0567 м 2 . B Давление, оказываемое горизонтально лежащим текстом, составляет
Когда книга лежит ровно, площадь составляет (0,270 м) (0.210 м) = 0,0567 м 2 . B Давление, оказываемое горизонтально лежащим текстом, составляетA Если книга стоит на конце, сила остается прежней, но площадь уменьшается:
(21,0 см) (4,5 см) = (0,210 м) (0,045 м) = 9,5 × 10 −3 м 2B Давление книги в этом положении, таким образом, составляет
Р = 19.6 Н9,5 × 10−3 м2 = 2,1 × 103 ПаТаким образом, давление , оказываемое книгой, изменяется примерно в шесть раз в зависимости от ее ориентации, хотя сила , прилагаемая книгой, не изменяется.

Упражнение
Какое давление оказывает на пол школьник весом 60,0 кг
- при стоянии в лаборатории на плоской подошве в теннисных туфлях (площадь подошвы примерно 180 см. 2 )?
- , когда она ступает пяткой вперед на танцпол в туфлях на высоком каблуке (площадь пятки = 1.0 см 2 )?
Ответы:
- 3,27 × 10 4 Па (4,74 фунта / дюйм 2 )
- 5,9 × 10 6 Па (8,5 × 10 2 фунт / дюйм 2 )
Атмосферное давление
Наша атмосфера действует так же, как мы оказываем давление на поверхность под действием силы тяжести. Мы живем на дне океана газов, который становится все менее плотным с увеличением высоты. Примерно 99% массы атмосферы находится в пределах 30 км от поверхности Земли, а половина ее находится в пределах первых 5,5 км (рис. 10.3 «Атмосферное давление»). Каждая точка на поверхности Земли испытывает чистое давление, которое называется атмосферное давление . Давление, оказываемое атмосферой, является значительным: столб размером 1,0 м 2 , измеренный от уровня моря до верхних слоев атмосферы, имеет массу около 10 000 кг, что дает давление около 100 кПа:
Примерно 99% массы атмосферы находится в пределах 30 км от поверхности Земли, а половина ее находится в пределах первых 5,5 км (рис. 10.3 «Атмосферное давление»). Каждая точка на поверхности Земли испытывает чистое давление, которое называется атмосферное давление . Давление, оказываемое атмосферой, является значительным: столб размером 1,0 м 2 , измеренный от уровня моря до верхних слоев атмосферы, имеет массу около 10 000 кг, что дает давление около 100 кПа:
Уравнение 10.3
давление = (1,0 × 104 кг) (9,807 м / с2) 1,0 м2 = 0,98 × 105 Па = 98 кПаРисунок 10.3 Атмосферное давление
Каждый квадратный метр поверхности Земли поддерживает столб воздуха высотой более 200 км и весом около 10 000 кг на поверхности Земли, в результате чего давление на поверхности составляет 1,01 × 10 5 Н / м 2 . Это соответствует давлению 101 кПа = 760 мм рт. Ст. = 1 атм.
Ст. = 1 атм.
В английских единицах это около 14 фунтов / дюйм. 2 , но мы так привыкли жить под таким давлением, что даже не замечаем этого. Вместо этого мы замечаем изменения давления, например, когда наши уши щелкают в быстрых лифтах в небоскребах или в самолетах во время быстрых изменений высоты. Мы используем атмосферное давление разными способами. Мы можем использовать трубочку для питья, потому что при ее всасывании удаляется воздух и, таким образом, снижается давление внутри соломинки. Атмосферное давление, оказывающее давление на жидкость в стакане, затем заставляет жидкость подниматься по соломке.
Атмосферное давление можно измерить с помощью барометра. Устройство, используемое для измерения атмосферного давления. Устройство было изобретено в 1643 году одним из учеников Галилея, Евангелистой Торричелли (1608–1647). Барометр может быть изготовлен из длинной стеклянной трубки, закрытой с одного конца. Он наполнен ртутью и помещен вверх дном в емкость с ртутью, не допуская попадания воздуха в трубку. Часть ртути вытечет из трубки, но внутри остается относительно высокий столбик (Рисунок 10.4 «Ртутный барометр»). Почему не заканчивается ртуть? Гравитация, безусловно, оказывает на ртуть в трубке нисходящую силу, но ей противодействует давление атмосферы, давящее на поверхность ртути в чашке, что в итоге приводит к выталкиванию ртути вверх в трубку. Поскольку над ртутью внутри трубки в правильно заполненном барометре (он содержит вакуум ) нет воздуха над ртутью, на колонку нет давления. Таким образом, ртуть выходит из трубки до тех пор, пока давление самого ртутного столба точно не уравновесит давление атмосферы.При нормальных погодных условиях на уровне моря две силы уравновешиваются, когда верхняя часть ртутного столба находится примерно на 760 мм выше уровня ртути в чаше, как показано на Рисунке 10.4 «Ртутный барометр». Это значение зависит от метеорологических условий и высоты. В Денвере, штат Колорадо, например, на высоте около 1 мили или 1609 м (5280 футов) высота ртутного столба составляет 630 мм, а не 760 мм.
Часть ртути вытечет из трубки, но внутри остается относительно высокий столбик (Рисунок 10.4 «Ртутный барометр»). Почему не заканчивается ртуть? Гравитация, безусловно, оказывает на ртуть в трубке нисходящую силу, но ей противодействует давление атмосферы, давящее на поверхность ртути в чашке, что в итоге приводит к выталкиванию ртути вверх в трубку. Поскольку над ртутью внутри трубки в правильно заполненном барометре (он содержит вакуум ) нет воздуха над ртутью, на колонку нет давления. Таким образом, ртуть выходит из трубки до тех пор, пока давление самого ртутного столба точно не уравновесит давление атмосферы.При нормальных погодных условиях на уровне моря две силы уравновешиваются, когда верхняя часть ртутного столба находится примерно на 760 мм выше уровня ртути в чаше, как показано на Рисунке 10.4 «Ртутный барометр». Это значение зависит от метеорологических условий и высоты. В Денвере, штат Колорадо, например, на высоте около 1 мили или 1609 м (5280 футов) высота ртутного столба составляет 630 мм, а не 760 мм.
Рисунок 10.4 Ртутный барометр
Давление, оказываемое атмосферой на поверхность ртутного резервуара, поддерживает столб ртути в трубке высотой около 760 мм.Поскольку точка кипения ртути довольно высока (356,73 ° C), в пространстве над ртутным столбом очень мало паров ртути.
Ртутные барометры использовались для измерения атмосферного давления так долго, что у них есть собственная единица измерения давления: миллиметр ртутного столба (мм рт. Ст.). Единица давления, часто называемая торр., Часто называемая единицей давления торрА. Один торр равен 1 мм рт. Ст. После Торричелли. Стандартное атмосферное давление Атмосферное давление, необходимое для поддержания столба ртути высотой ровно 760 мм, который также называется 1 атмосферой (атм).атмосферное давление, необходимое для поддержания столба ртути высотой ровно 760 мм; это давление также обозначается как 1 атмосфера (атм). Также называется стандартным атмосферным давлением. Это атмосферное давление, необходимое для поддержания столба ртути высотой ровно 760 мм. Эти единицы также относятся к паскалям:
Это атмосферное давление, необходимое для поддержания столба ртути высотой ровно 760 мм. Эти единицы также относятся к паскалям:
Уравнение 10.4
1 атм = 760 мм рт. Ст. = 760 торр = 1,01325 × 10 5 Па = 101,325 кПаТаким образом, давление в 1 атм в точности равно 760 мм рт. Ст. И приблизительно равно 100 кПа.
Пример 3
Один из авторов несколько лет назад посетил национальный парк Роки-Маунтин. После вылета из аэропорта на уровне моря на востоке Соединенных Штатов он прибыл в Денвер (высота 5280 футов), арендовал машину и поехал на вершину шоссе за пределами Эстес-парка (высота 14000 футов). Он заметил, что на этой высоте, где атмосферное давление всего 454 мм рт. Преобразуйте это давление в
- атмосфер.
- килопаскалей.
Дано: Давление в миллиметрах ртутного столба
Запрошено: Давление в атмосферах и килопаскалях
Стратегия:
Используйте коэффициенты преобразования в уравнении 10. 4 для преобразования миллиметров ртутного столба в атмосферу и килопаскали.
4 для преобразования миллиметров ртутного столба в атмосферу и килопаскали.
Решение:
Из уравнения 10.4 имеем 1 атм = 760 мм рт. Ст. = 101,325 кПа. Таким образом, давление на высоте 14000 футов в атм составляет
. P = (454 мм рт. Ст.) (1 атм. 760 мм рт. Ст.) = 0,597 атм.Давление в кПа определяется по
. P = (0,597 атм) (101,325 кПа1 атм) = 60,5 кПаУпражнение
Mt. Эверест, расположенный на высоте 29 028 футов над уровнем моря, является самой высокой горой в мире. Нормальное атмосферное давление на этой высоте составляет около 0,308 атм.Преобразуйте это давление в
- миллиметров ртутного столба.
- килопаскалей.
Ответ: а. 234 мм рт. б. 31,2 кПа
б. 31,2 кПа
Манометры
Барометры измеряют атмосферное давление, а манометры — устройство, используемое для измерения давления проб газов, содержащихся в аппарате. измерить давление проб газов, содержащихся в аппарате. Ключевой особенностью манометра является U-образная трубка, содержащая ртуть (или иногда другую нелетучую жидкость).Манометр с закрытым концом схематично показан в части (а) на Рисунке 10.5 «Два типа манометров». Когда колба не содержит газа (т. Е. Когда ее внутренняя часть близка к вакууму), высота двух столбов ртути одинакова, потому что пространство над ртутью слева — это почти вакуум (он содержит только следы паров ртути. ). Если газ будет выпущен в колбу справа, он окажет давление на ртуть в правом столбце, и два столбца ртути больше не будут одинаковой высоты.Разница между высотами двух колонн равна давлению газа.
Рисунок 10.5 Два типа манометров
(a) В манометре с закрытым концом пространство над ртутным столбиком слева (эталонное плечо) по существу представляет собой вакуум ( P ≈ 0), а разница в высоте двух столбцов дает давление газа, содержащегося непосредственно в баллоне. (b) В манометре с открытым концом левое (эталонное) плечо открыто для атмосферы ( P ≈ 1 атм), а разница в высоте двух столбцов дает разность между атмосферным давлением и атмосферным давлением. давление газа в баллоне.
(b) В манометре с открытым концом левое (эталонное) плечо открыто для атмосферы ( P ≈ 1 атм), а разница в высоте двух столбцов дает разность между атмосферным давлением и атмосферным давлением. давление газа в баллоне.
Если трубка открыта для атмосферы, а не закрыта, как в манометре с открытым концом, показанном в части (b) на Рисунке 10.5 «Два типа манометров», то два столбца ртути имеют одинаковую высоту, только если газ в баллоне имеет давление, равное атмосферному давлению. Если давление газа в баллоне на выше , ртуть в открытой трубке будет вытесняться газом, давящим вниз на ртуть в другом плече U-образной трубки. Таким образом, давление газа в баллоне складывается из атмосферного давления (измеренного с помощью барометра) и разницы высот двух столбцов.Если газ в баллоне имеет давление на меньше, чем давление атмосферы, то высота ртути будет больше в руке, прикрепленной к баллоне. В этом случае давление газа в баллоне равно атмосферному давлению за вычетом разницы в высоте двух колонн.
Пример 4
Предположим, вы хотите построить манометр с закрытым концом для измерения давления газа в диапазоне 0,000–0,200 атм. Из-за токсичности ртути вы решаете использовать воду, а не ртуть.Какой высоты вам нужен столб воды? (При 25 ° C плотность воды 0,9970 г / см 3 ; плотность ртути 13,53 г / см 3 .)
Дано: Диапазон давления и плотности воды и ртути
Запрошено: высота колонны
Стратегия:
A Рассчитайте высоту столбика ртути, соответствующего 0.200 атм в миллиметрах ртутного столба. Это высота, необходимая для столбца, заполненного ртутью.
B Исходя из заданных плотностей, используйте пропорцию, чтобы вычислить высоту, необходимую для столбца, заполненного водой.
Решение:
A В миллиметрах ртутного столба давление газа 0,200 атм равно
P = (0,200 атм) (760 мм рт. Ст. 1 атм) = 152 мм рт. Ст.
Ст. 1 атм) = 152 мм рт. Ст.При использовании ртутного манометра вам потребуется ртутный столбик высотой не менее 152 мм.
B Поскольку вода менее плотная, чем ртуть, вам нужен столб воды на выше , чтобы достичь того же давления, что и данный столб ртути. Высота, необходимая для заполненного водой столба, соответствующего давлению 0,200 атм, пропорциональна отношению плотности ртути (dHg) к плотности воды (dh3O):
(heighth3O) (dh3O) = (heightHg) (dHg) heighth3O = (heightHg) (dHgdh3O) = (152 мм) (13,53 г / см30,9970 г / см3) = 2.06 × 103 мм h3O = 2,06 м h3OЭтот ответ имеет смысл: для достижения того же давления требуется более высокий столб менее плотной жидкости.
Упражнение
Предположим, вы хотите создать барометр для измерения атмосферного давления в среде, температура которой всегда превышает 30 ° C. Чтобы избежать использования ртути, вы решили использовать галлий, который плавится при 29,76 ° C; плотность жидкого галлия при 25 ° C составляет 6,114 г / см 3 . Какой высоты вам нужен столбик галлия, если P = 1.00 атм?
Какой высоты вам нужен столбик галлия, если P = 1.00 атм?
Ответ: 1,68 м
Ответ на пример 4 также сообщает нам максимальную глубину фермерского колодца, если для откачки воды будет использоваться простой всасывающий насос. Если столб воды высотой 2,06 м соответствует 0,200 атм, то 1,00 атм соответствует высоте столба
h3.06 м = 1.00 атм. 0.200 атм. h = 10.3 м Всасывающий насос — это просто более сложная версия соломинки: он создает вакуум над жидкостью и использует атмосферное давление, чтобы заставить жидкость подниматься по трубке.Если давление 1 атм соответствует столбу воды 10,3 м (33,8 фута), то при атмосферном давлении физически невозможно поднять воду в колодце выше этого значения. До тех пор, пока не были изобретены электрические насосы для механического выталкивания воды с больших глубин, этот фактор сильно ограничивал место проживания людей, поскольку добывать воду из колодцев глубиной более 33 футов было трудно.
Сводка
Четыре величины должны быть известны для полного физического описания образца газа: температура , объем , количество и давление . Давление — сила на единицу площади поверхности; единицей измерения давления в системе СИ является паскаль (Па) , определяемая как 1 ньютон на квадратный метр (Н / м 2 ). Давление, оказываемое объектом, пропорционально силе, которую он оказывает, и обратно пропорционально площади, на которую действует сила. Давление атмосферы Земли, называемое атмосферным давлением , составляет около 101 кПа или 14,7 фунта / дюйм. 2 на уровне моря. Атмосферное давление можно измерить с помощью барометра , закрытой перевернутой трубки, заполненной ртутью.Высота ртутного столба пропорциональна атмосферному давлению, которое часто выражается в единицах миллиметров ртутного столба (мм рт. Ст.) , также называемых торр . Стандартное атмосферное давление , давление, необходимое для поддержки столба ртути высотой 760 мм, является еще одной единицей давления: 1 атмосфера (атм) . Манометр — это прибор, используемый для измерения давления пробы газа.
Ст.) , также называемых торр . Стандартное атмосферное давление , давление, необходимое для поддержки столба ртути высотой 760 мм, является еще одной единицей давления: 1 атмосфера (атм) . Манометр — это прибор, используемый для измерения давления пробы газа.
Ключевые вынос
- Давление определяется как сила, действующая на единицу площади; его можно измерить с помощью барометра или манометра.
Концептуальные проблемы
Какие четыре величины должны быть известны, чтобы полностью описать образец газа? Какие единицы обычно используются для каждого количества?
Если приложенная сила постоянна, как изменяется давление, оказываемое объектом, по мере уменьшения площади, на которую действует сила? Как это соотношение применимо в реальном мире к простоте забивания маленького гвоздя по сравнению с большим гвоздем?
По мере увеличения силы на фиксированном участке давление увеличивается или уменьшается? Имея это в виду, ожидаете ли вы, что тяжелому человеку понадобятся снегоступы большего или меньшего размера, чем более легкому человеку? Объяснять.

Что мы подразумеваем под атмосферное давление ? Атмосферное давление на вершине горы. Ренье больше или меньше давления в Майами, Флорида? Почему?
Где самое высокое атмосферное давление — пещера в Гималаях, шахта в Южной Африке или пляжный домик во Флориде? У кого самый низкий?
Марс имеет среднее атмосферное давление 0.007 атм. Будет ли на Марсе легче или труднее пить жидкость из соломинки, чем на Земле? Поясните свой ответ.
Давление, оказываемое массой 1,0 кг на площадь 2,0 м 2 , больше или меньше давления, оказываемого массой 1,0 кг на площадь 1,0 м 2 ? Какая разница, если таковая имеется, между давлением атмосферы на поршень 1,0 м 2 и поршень 2.
 0 м 2 поршневой?
0 м 2 поршневой?Если бы вы использовали воду в барометре вместо ртути, в чем было бы основное отличие прибора?
Ответ
Поскольку давление определяется как сила на единицу площади ( P = F / A ), увеличение силы на данной площади увеличивает давление.Тяжелому человеку нужны снегоступы большего размера, чем более легкому. Распределение силы, действующей на более тяжелого человека под действием силы тяжести (то есть его веса), на большую площадь снижает давление, оказываемое на единицу площади, например квадратный дюйм, и снижает вероятность того, что он погрузится в снег.

Числовые задачи
Рассчитайте давление в атмосфере и килопаскалях в аквариуме, равное 2.0 футов в длину, 1,0 фута в ширину и 2,5 фута в высоту и содержит 25,0 галлонов воды в комнате с температурой 20 ° C; сам резервуар весит 15 фунтов (dh3O = 1,00 г / см 3 при 20 ° C). Если бы резервуар был 1 фут в длину, 1 фут в ширину и 5 футов в высоту, оказывал бы он такое же давление? Поясните свой ответ.

Рассчитайте давление в паскалях и в атмосферах, оказываемое пакетом молока весом 1.5 кг и имеет основание 7,0 × 7,0 см. Если бы коробка лежала на боку (высота = 25 см), оказывала бы она большее или меньшее давление? Объясните свои рассуждения.
Если атмосферное давление на уровне моря составляет 1,0 × 10 5 Па, какова масса воздуха в килограммах над 1,0 см. 2 участок вашей кожи, когда вы лежите на пляже? Если на вершине горы атмосферное давление составляет 8,2 × 10 4 Па, то какова масса воздуха в килограммах выше 4.0 см 2 лоскут кожи?
Заполните следующую таблицу:
атм кПа мм рт.  Ст.
Ст.торр 1.40 723 43,2 Единица давления в системе СИ — паскаль, равная 1 Н / м 2 .Покажите, как произведение массы объекта и ускорения свободного падения приводит к силе, которая при приложении к данной области приводит к давлению в правильных единицах СИ.
 Какая масса в килограммах, приложенная к площади 1,0 см 2 , требуется для создания давления
Какая масса в килограммах, приложенная к площади 1,0 см 2 , требуется для создания давления- 1,0 атм?
- 1,0 торр?
- 1 мм рт.
- 1 кПа?
Если вы сконструировали манометр для измерения давления газа в диапазоне 0.60–1,40 атм при использовании жидкостей, указанных в следующей таблице, какой высоты столбец вам понадобится для каждой жидкости? Плотность ртути 13,5 г / см 3 . На основании полученных результатов объясните, почему ртуть до сих пор используется в барометрах, несмотря на ее токсичность.
Плотность жидкости (20 ° C) Высота колонны (м) изопропанол 0.  785
785кокосовое масло 0,924 глицерин 1,259
Ответ
5.4 кПа или 5,3 × 10 −2 атм; 11 кПа, 1,1 × 10 −3 атм; та же сила, действующая на меньшую площадь, приводит к большему давлению.
6.
 6. Простые законы о газе
6. Простые законы о газеЦели обучения
- Узнайте, что означает термин газовые законы .
- Знайте разные единицы давления.
- Изучите и примените закон Бойля.
- Изучите и примените закон Чарльза.
- Изучите и примените закон Гей-Люссака.
Поведение газов можно смоделировать с помощью газовых законов. Закон Бойля связывает давление и объем газа при постоянной температуре и количестве. Закон Чарльза связывает объем и температуру газа при постоянном давлении и количестве.В газовых законах температура всегда должна выражаться в Кельвинах.
Единицы давления
Барометр измеряет давление газа по высоте столба ртути. Единицей измерения давления газа является миллиметр ртутного столба \ (\ left (\ text {mm} \: \ ce {Hg} \ right) \). Единица, эквивалентная \ (\ text {mm} \: \ ce {Hg} \), называется \ (\ text {torr} \) в честь изобретателя барометра Евангелисты Торричелли. паскаль \ (\ left (\ text {Pa} \ right) \) — стандартная единица измерения давления.Паскаль — это очень небольшая величина давления, поэтому наиболее полезной единицей измерения повседневного давления газа является килопаскаль \ (\ left (\ text {kPa} \ right) \). Килопаскаль равен 1000 паскалей. Другой часто используемой единицей давления является атмосфер \ (\ left (\ text {atm} \ right) \). Стандартное атмосферное давление называется \ (1 \: \ text {atm} \) давлением и равно \ (760 \: \ text {mm} \: \ ce {Hg} \) и \ (101.3 \: \ text {кПа} \). Атмосферное давление также часто указывается в фунтах на квадратный дюйм \ (\ left (\ text {psi} \ right) \).Атмосферное давление на уровне моря составляет \ (14.7 \: \ text {psi} \).
паскаль \ (\ left (\ text {Pa} \ right) \) — стандартная единица измерения давления.Паскаль — это очень небольшая величина давления, поэтому наиболее полезной единицей измерения повседневного давления газа является килопаскаль \ (\ left (\ text {kPa} \ right) \). Килопаскаль равен 1000 паскалей. Другой часто используемой единицей давления является атмосфер \ (\ left (\ text {atm} \ right) \). Стандартное атмосферное давление называется \ (1 \: \ text {atm} \) давлением и равно \ (760 \: \ text {mm} \: \ ce {Hg} \) и \ (101.3 \: \ text {кПа} \). Атмосферное давление также часто указывается в фунтах на квадратный дюйм \ (\ left (\ text {psi} \ right) \).Атмосферное давление на уровне моря составляет \ (14.7 \: \ text {psi} \).
\ [1 \: \ text {atm} = 760 \: \ text {mm} \: \ ce {Hg} = 760 \: \ text {torr} = 101,3 \: \ text {кПа} = 14,7 \: \ текст {psi} \]
Закон Бойля: давление и объем
Когда ученые семнадцатого века начали изучать физические свойства газов, они заметили некоторые простые отношения между некоторыми измеряемыми свойствами газа. Возьмем, к примеру, давление ( P ) и объем ( V ).Ученые отметили, что для данного количества газа (обычно выраженного в молях [ n ]), если температура ( T ) газа поддерживалась постоянной, давление и объем были связаны: другие снижаются. По мере того, как одно уменьшается, другое увеличивается. Мы говорим, что давление и объем обратно связаны .
Возьмем, к примеру, давление ( P ) и объем ( V ).Ученые отметили, что для данного количества газа (обычно выраженного в молях [ n ]), если температура ( T ) газа поддерживалась постоянной, давление и объем были связаны: другие снижаются. По мере того, как одно уменьшается, другое увеличивается. Мы говорим, что давление и объем обратно связаны .
Но это еще не все: давление и объем заданного количества газа при постоянной температуре численно связаны с .Если вы возьмете значение давления и умножите его на значение объема, произведение будет постоянным для данного количества газа при постоянной температуре:
\ [P × V = \ text {постоянная при постоянных n и T} \]
Если объем или давление изменяются, а количество и температура остаются неизменными, то другое свойство должно измениться так, чтобы произведение двух свойств по-прежнему равнялось той же константе. То есть, если исходные условия обозначены \ (P_1 \) и \ (V_1 \), а новые условия обозначены \ (P_2 \) и \ (V_2 \), мы имеем
\ [P_1V_1 = \ text {константа} = P_2V_2 \]
, где предполагается, что свойства перемножаются. Не считая средней части, получаем просто
Не считая средней части, получаем просто
\ [P_1V_1 = P_2V_2 \ text {при постоянных n и T} \]
Это уравнение является примером закона газа. Газовый закон — это простая математическая формула, которая позволяет моделировать или предсказывать поведение газа. Этот конкретный газовый закон называется закон Бойля в честь английского ученого Роберта Бойля, который впервые объявил о нем в 1662 году. На рисунке \ (\ PageIndex {1} \) показаны два представления того, как работает закон Бойля.
Рисунок \ (\ PageIndex {1} \) Закон Бойля.Поршень с определенным давлением и объемом (левый поршень) будет иметь половину объема, когда его давление в два раза больше (правый поршень). Можно также построить график зависимости P от V для данного количества газа при определенной температуре; такой график будет выглядеть как график справа.
Закон Бойля — это пример второго типа математических задач, которые мы видим в химии, — проблемы, основанной на математической формуле. Тактика работы с математическими формулами отличается от тактики работы с коэффициентами пересчета.Во-первых, большинство вопросов, на которые вам придется отвечать с помощью формул, представляют собой вопросы словесного типа, поэтому первый шаг — определить, какие величины известны, и присвоить их переменным. Во-вторых, в большинстве формул необходимо выполнить некоторые математические преобразования (например, алгебру), чтобы найти неизвестную переменную. Правило состоит в том, что для нахождения значения неизвестной переменной вы должны математически изолировать неизвестную переменную отдельно от себя и в числителе одной стороны уравнения. Наконец, единицы должны быть последовательными.Например, в законе Бойля есть две переменные давления; у них должен быть один и тот же блок. Также есть две переменные объема; у них также должен быть один и тот же блок. В большинстве случаев не имеет значения, что такое единица измерения , но единица измерения должна быть той же , что и , в обеих частях уравнения.
Тактика работы с математическими формулами отличается от тактики работы с коэффициентами пересчета.Во-первых, большинство вопросов, на которые вам придется отвечать с помощью формул, представляют собой вопросы словесного типа, поэтому первый шаг — определить, какие величины известны, и присвоить их переменным. Во-вторых, в большинстве формул необходимо выполнить некоторые математические преобразования (например, алгебру), чтобы найти неизвестную переменную. Правило состоит в том, что для нахождения значения неизвестной переменной вы должны математически изолировать неизвестную переменную отдельно от себя и в числителе одной стороны уравнения. Наконец, единицы должны быть последовательными.Например, в законе Бойля есть две переменные давления; у них должен быть один и тот же блок. Также есть две переменные объема; у них также должен быть один и тот же блок. В большинстве случаев не имеет значения, что такое единица измерения , но единица измерения должна быть той же , что и , в обеих частях уравнения.
Пример \ (\ PageIndex {1} \)
Образец газа имеет начальное давление 2,44 атм и начальный объем 4,01 л. Его давление изменяется до 1,93 атм. Какой будет новый объем, если температура и количество остаются постоянными?
Решение
Шаги для решения проблем | |
|---|---|
| Определите «данную» информацию и то, что проблема просит вас «найти».« | Дано: P 1 = 2,44 атм и В 1 = 4,01 л P 2 = 1,93 атм Найти: V 2 =? L |
Перечислите другие известные количества. | нет |
Спланируйте проблему. | Сначала измените уравнение алгебраически, чтобы найти \ (V_2 \). \ [V_2 = \ frac {P_1 \ times V_1} {P_2} \] |
Отменить единицы и рассчитать. | Теперь подставьте известные величины в уравнение и решите. \ [V_2 = \ frac {2.44 \: \ cancel {\ text {atm}} \ times 4.01 \: \ text {L}} {1.93 \: \ cancel {atm}} = 5.07 \: \ text {L} \] |
| Подумайте о своем результате. | Мы знаем, что давление и объем обратно пропорциональны; по мере того, как одно уменьшается, другое увеличивается. Давление снижается (с 2,44 атм до 1,93 атм), поэтому объем должен увеличиваться для компенсации, и он есть (с 4,01 л до 5,07 л). Итак, ответ имеет смысл на основе закона Бойля. Давление снижается (с 2,44 атм до 1,93 атм), поэтому объем должен увеличиваться для компенсации, и он есть (с 4,01 л до 5,07 л). Итак, ответ имеет смысл на основе закона Бойля. |
Упражнение \ (\ PageIndex {1} \)
Если P 1 = 334 торр, V 1 = 37.8 мл и P 2 = 102 торр, что такое V 2 ?
- Ответ
124 мл
Как уже упоминалось, вы можете использовать любые единицы для давления или объема, но оба давления должны быть выражены в одних и тех же единицах, и оба объема должны быть выражены в одних и тех же единицах.
Пример \ (\ PageIndex {2} \):
Образец газа имеет начальное давление 722 торр и начальный объем 88.8 мл. Его объем изменится до 0,663 л. Что такое новое давление?
Решение
Шаги для решения проблем | |
|---|---|
Определите «данную» информацию и то, что проблема просит вас «найти». | Дано: P 1 = 722 торр и V 1 = 88.8 мл В 2 = 0,633 л Найти: P 2 =? торр |
| Перечислите другие известные количества. | 1 л = 1000 мл, чтобы иметь те же единицы измерения объема. |
Спланируйте проблему. | 1. Выполните преобразование второй единицы объема с л в мл. 2. Переставьте уравнение алгебраически, чтобы найти \ (P_2 \). \ [P_2 = \ frac {P_1 \ times V_1} {V_2} \] |
Отменить единицы и рассчитать. | 1. 2. Подставьте известные величины в уравнение и решите. \ [P_2 = \ frac {722 \: \ text {torr} \ times 88.8 \: \ cancel {\ text {mL}}} {663 \: \ cancel {\ text {mL}}} = 96.7 \: \ text {torr} \] |
| Подумайте о своем результате. | Когда объем увеличивался, давление уменьшалось, что соответствует закону Бойля. |
Упражнение \ (\ PageIndex {2} \)
Если V 1 = 456 мл, P 1 = 308 торр и P 2 = 1,55 атм, что такое V 2 ?
- Ответ
119 мл
Закон Чарльза: температура и объем
Французский физик Жак Шарль (1746 — 1823) изучал влияние температуры на объем газа при постоянном давлении. Закон Чарльза гласит, что объем данной массы газа напрямую зависит от абсолютной температуры газа, когда давление поддерживается постоянным. Абсолютная температура — это температура, измеренная по шкале Кельвина. Необходимо использовать шкалу Кельвина, потому что ноль на шкале Кельвина соответствует полной остановке молекулярного движения.
Закон Чарльза гласит, что объем данной массы газа напрямую зависит от абсолютной температуры газа, когда давление поддерживается постоянным. Абсолютная температура — это температура, измеренная по шкале Кельвина. Необходимо использовать шкалу Кельвина, потому что ноль на шкале Кельвина соответствует полной остановке молекулярного движения.
Рисунок \ (\ PageIndex {2} \) По мере того, как контейнер с ограниченным газом нагревается, его молекулы увеличивают кинетическую энергию и выталкивают подвижный поршень наружу, что приводит к увеличению объема.
Математически прямая зависимость закона Чарльза может быть представлена следующим уравнением:
\ [\ frac {V} {T} = k \]
Как и в случае с законом Бойля, \ (k \) постоянно только для данной пробы газа. В таблице ниже приведены данные о температуре и объеме для заданного количества газа при постоянном давлении. Третий столбец является константой для этого конкретного набора данных и всегда равен объему, деленному на температуру Кельвина.
| Температура \ (\ left (\ text {K} \ right) \) | Объем \ (\ left (\ text {mL} \ right) \) | \ (\ frac {V} {T} = k \) \ (\ left (\ frac {\ text {mL}} {\ text {K}} \ right) \) |
|---|---|---|
| 50 | 20 | 0.40 |
| 100 | 40 | 0,40 |
| 150 | 60 | 0,40 |
| 200 | 80 | 0,40 |
| 300 | 120 | 0,40 |
| 500 | 200 | 0. 40 40 |
| 1000 | 400 | 0,40 |
Когда эти данные нанесены на график, результатом будет прямая линия, указывающая на прямую взаимосвязь, показанную на рисунке ниже.
Рисунок \ (\ PageIndex {3} \) Объем газа увеличивается с увеличением температуры Кельвина.
Обратите внимание, что линия идет точно к началу координат, а это означает, что, когда абсолютная температура газа приближается к нулю, его объем приближается к нулю.Однако, когда газ доводят до чрезвычайно низких температур, его молекулы в конечном итоге конденсируются в жидкое состояние, прежде чем достичь абсолютного нуля. Температура, при которой происходит это изменение в жидкое состояние, различна для разных газов.
Закон Чарльза также можно использовать для сравнения изменяющихся условий для газа. Теперь мы используем \ (V_1 \) и \ (T_1 \) для обозначения начального объема и температуры газа, а \ (V_2 \) и \ (T_2 \) обозначаем конечный объем и температуру. Математическая связь закона Чарльза становится:
\ [\ frac {V_1} {T_1} = \ frac {V_2} {T_2} \]
Это уравнение можно использовать для расчета любой из четырех величин, если известны другие три.\ text {o} \ text {C} \). Найдите новый объем воздушного шара.
Решение
Шаги для решения проблем | |
|---|---|
| Определите «данную» информацию и то, что проблема просит вас «найти». | Дано: \ (V_1 = 2. Найти: V 2 =? L |
| Перечислите другие известные количества. | Сначала температуры были переведены в градусы Кельвина. |
Спланируйте проблему. | Сначала измените уравнение алгебраически, чтобы найти \ (V_2 \). \ [V_2 = \ frac {V_1 \ times T_2} {T_1} \] |
Отменить единицы и рассчитать. | Теперь подставьте известные величины в уравнение и решите. \ [V_2 = \ frac {2.20 \: \ text {L} \ times 344 \: \ cancel {\ text {K}}} {295 \: \ cancel {\ text {K}}} = 2,57 \: \ текст {L} \] |
Подумайте о своем результате. | Объем увеличивается при повышении температуры. Результат состоит из трех значащих цифр. |
Упражнение \ (\ PageIndex {2} \)
Если V 1 = 3,77 L и T 1 = 255 K, что будет V 2 , если T 2 = 123 K?
- Ответ
1.82 л
Пример \ (\ PageIndex {3} \):
Проба газа имеет начальный объем 34,8 л и начальную температуру –67 ° C. Какой должна быть температура газа, чтобы его объем составлял 25,0 л?
Решение
Шаги для решения проблем | |
|---|---|
Определите «данную» информацию и то, что проблема просит вас «найти». « « | Дано: Дано: T 1 = -27 o C и V 1 = 34,8 л В 2 = 25,0 л Найти: T 2 =? K |
| Перечислите другие известные количества. | К = -27 o С + 273 |
Спланируйте проблему. | 1. Преобразуйте начальную температуру в градусы Кельвина 2. Переставьте уравнение алгебраически, чтобы найти \ (T_2 \). \ [T_2 = \ frac {V_2 \ times T_1} {V_1} \] |
Отменить единицы и рассчитать. | 1. −67 ° C + 273 = 206 K 2. Подставьте известные величины в уравнение и решите. \ [T_2 = \ frac {25.0 \: \ cancel {\ text {L}} \ times 206 \: \ text {K}} {34.8 \: \ cancel {\ text {L}}} = 148 \: \ текст {K} \] |
| Подумайте о своем результате. | Это также равно −125 ° C. При понижении температуры объем уменьшается, что и происходит в этом примере. |
Упражнение \ (\ PageIndex {3} \)
Если V 1 = 623 мл, T 1 = 255 ° C и V 2 = 277 мл, что такое T 2 ?
- Ответ
235 К, или -38 °
Закон Гей-Люссака: температура и давление
Когда температура пробы газа в жестком контейнере увеличивается, давление газа также увеличивается. Увеличение кинетической энергии приводит к тому, что молекулы газа ударяются о стенки контейнера с большей силой, что приводит к большему давлению. Французский химик Жозеф Гей-Люссак (1778–1850) обнаружил связь между давлением газа и его абсолютной температурой. Закон Гей-Люссака гласит, что давление данной массы газа напрямую зависит от абсолютной температуры газа, когда объем поддерживается постоянным. Закон Гей-Люссака очень похож на закон Чарльза, с той лишь разницей, что тип контейнера.В то время как контейнер в эксперименте по закону Чарльза является гибким, в эксперименте по закону Гей-Люссака он является жестким.
Увеличение кинетической энергии приводит к тому, что молекулы газа ударяются о стенки контейнера с большей силой, что приводит к большему давлению. Французский химик Жозеф Гей-Люссак (1778–1850) обнаружил связь между давлением газа и его абсолютной температурой. Закон Гей-Люссака гласит, что давление данной массы газа напрямую зависит от абсолютной температуры газа, когда объем поддерживается постоянным. Закон Гей-Люссака очень похож на закон Чарльза, с той лишь разницей, что тип контейнера.В то время как контейнер в эксперименте по закону Чарльза является гибким, в эксперименте по закону Гей-Люссака он является жестким.
Рисунок \ (\ PageIndex {4} \) Джозеф Гей-Люссак.
Математические выражения закона Гей-Люссака аналогичны формулам закона Чарльза:
\ [\ frac {P} {T} \: \: \: \ text {и} \: \: \: \ frac {P_1} {T_1} = \ frac {P_2} {T_2} \]
График зависимости давления от температуры также демонстрирует прямую зависимость. \ text {o} \ text {C} = 1118 \: \ text {K} \)
\ text {o} \ text {C} = 1118 \: \ text {K} \)
Найти: \ (P_2 =? \: \ Text {atm} \)
Сначала температуры были переведены в градусы Кельвина.
Спланируйте проблему
Сначала измените уравнение алгебраически, чтобы найти \ (P_2 \).
\ [P_2 = \ frac {P_1 \ times T_2} {T_1} \]
Рассчитать
Теперь подставьте известные величины в уравнение и решите.
\ [P_2 = \ frac {3.00 \: \ text {atm} \ times 1118 \: \ cancel {\ text {K}}} {298 \: \ cancel {\ text {K}}} = 11. 3 \: \ текст {atm} \]
3 \: \ текст {atm} \]
Молярный объем
К настоящему времени должно быть очевидно, что некоторые физические свойства газов сильно зависят от условий. Что нам нужно, так это набор стандартных условий, чтобы свойства газов можно было должным образом сравнивать друг с другом. Стандартная температура и давление (STP) определяется как давление 100 кПа (0,986 атм) и 273 К (0 ° C).Для простоты мы будем использовать стандартное давление 1 атм. Определение STP позволяет нам более точно сравнивать свойства газов, которые отличаются друг от друга.
Одно свойство, общее для газов, — это молярный объем. Молярный объем . — это объем 1 моля газа. В STP молярный объем газа можно легко определить с помощью закона идеального газа:
\ [(1 \, атм) V = (1 \, моль) (0,08205 \ frac {L. atm} {mol.K}) (273 \, K) \]
atm} {mol.K}) (273 \, K) \]
Отменяются все единицы, кроме L, единицы объема.Итак, В = 22,4 л
Обратите внимание, что мы не указали идентификацию газа; мы указали только, что давление составляет 1 атм, а температура — 273 К. Это дает очень полезное приближение: любой газ на STP имеет объем 22,4 л на моль газа ; то есть молярный объем при STP составляет 22,4 л / моль (рис. 6.6.1 Молярный объем). Этот молярный объем является полезным коэффициентом пересчета в задачах стехиометрии, если условия соответствуют стандартным нормам. Если условия не соответствуют стандартным, молярный объем 22.4 л / моль неприменимо. Однако, если условия не соответствуют STP, можно использовать закон комбинированного газа для расчета того, каким был бы объем газа, если бы он был на STP; тогда можно использовать молярный объем 22,4 л / моль.
Рисунок \ (\ PageIndex {5} \) Молярный объем. Моль газа на СТП занимает 22,4 л, объем куба со стороной 28,2 см.
Пример \ (\ PageIndex {5} \):
Сколько молей Ar присутствует в 38.7 л на СТП?
Решение
Мы можем использовать молярный объем, 22,4 л / моль, в качестве коэффициента преобразования, но нам нужно обратить дробь так, чтобы единицы L отменяли и вводили единицы моль. Это одностадийное преобразование:
\ [38.7 \, \ not {L} \ times \ frac {1 \, mol} {22.4 \ not {L}} = 1.73 \, mol \]
Упражнение \ (\ PageIndex {5} \)
Какой объем у 4,87 моль Kr на СТП?
Ответ
109 л
Примечание
Химия везде: дыхание
Дыхание (более правильное название дыхание ) — это процесс, с помощью которого мы втягиваем воздух в легкие, чтобы наши тела могли поглощать кислород из воздуха.Применим газовые законы к дыханию.
Начните с рассмотрения давления. Мы втягиваем воздух в легкие, потому что диафрагма, мышца под легкими, опускается вниз, чтобы снизить давление в легких, в результате чего внешний воздух устремляется внутрь, заполняя объем с более низким давлением. Мы выталкиваем воздух через диафрагму, давя на легкие, увеличивая давление внутри легких и вытесняя воздух под высоким давлением. В чем заключаются изменения давления? Четверть атмосферы? Десятая часть атмосферы? На самом деле, в нормальных условиях только разница давлений в 1-2 торр заставляет нас вдыхать и выдыхать.
Мы выталкиваем воздух через диафрагму, давя на легкие, увеличивая давление внутри легких и вытесняя воздух под высоким давлением. В чем заключаются изменения давления? Четверть атмосферы? Десятая часть атмосферы? На самом деле, в нормальных условиях только разница давлений в 1-2 торр заставляет нас вдыхать и выдыхать.
Рис. 6.6.2 Механика дыхания. Дыхание связано с разницей давления между внутренней частью легких и воздухом снаружи. Разница давлений составляет всего несколько торр.
Нормальное дыхание составляет около 0,50 л. Если температура в помещении составляет около 22 ° C, тогда температура воздуха составляет около 295 К. При нормальном давлении, равном 1,0 атм, сколько молей воздуха мы вдыхаем за каждый вдох? Закон идеального газа дает нам ответ:
\ [(1.0 \, атм) (0.50 \, L) = n (0,08205 \ frac {L.atm} {mol.K}) (295 \, K) \]
Решая количество молей, получаем
n = 0,021 моль воздуха В итоге получается около 0,6 г воздуха на вдох — немного, но достаточно, чтобы сохранить нам жизнь.
Сводка
- Поведение газов можно смоделировать с помощью газовых законов.
- Закон Бойля связывает давление и объем газа при постоянной температуре и количестве.
- Закон Чарльза связывает объем и температуру газа при постоянном давлении и количестве.
- Закон Гей-Люссака гласит, что давление данной массы газа напрямую зависит от абсолютной температуры газа, когда объем поддерживается постоянным.
- В газовых законах температура всегда должна выражаться в Кельвинах.
Авторы и авторство
Стандартные условияпо сравнению со стандартным состоянием
Стандартные условия, или STP, и стандартное состояние используются в научных расчетах, но они не всегда означают одно и то же.
Ключевые выводы: стандартные температура и давление (STP) по сравнению со стандартным государством
- Как стандартные условия, так и стандартные условия обычно используются для научных расчетов.

- STP означает стандартную температуру и давление. Оно составляет 273 К (0 градусов Цельсия) и давление 1 атм (или 105 Па).
- В определении стандартных государственных условий указано давление 1 атм, жидкость и газы должны быть чистыми, а растворы должны иметь концентрацию 1 М.Температура , а не , хотя в большинстве таблиц данные компилируются при 25 градусах Цельсия (298 К).
- STP используется для расчетов с газами, приближенными к идеальным.
- Стандартные условия используются для любых термодинамических расчетов.
- Значения, указанные для STP и стандартных условий, основаны на идеальных условиях, поэтому они могут незначительно отличаться от экспериментальных значений.
STP — это сокращение от Standard Temperature and Pressure, которое определяется как 273 K (0 градусов Цельсия) и давление 1 атм (или 10 5 Па).STP описывает стандартные условия и часто используется для измерения плотности и объема газа с использованием закона идеального газа. Здесь 1 моль идеального газа занимает 22,4 л. В старом определении для давления использовались атмосферы, а в современных расчетах — паскалях.
Здесь 1 моль идеального газа занимает 22,4 л. В старом определении для давления использовались атмосферы, а в современных расчетах — паскалях.
Для термодинамических расчетов используются стандартные условия состояния. Для стандартного состояния указано несколько условий:
- Стандартная государственная температура 25 градусов C (298 K). Обратите внимание, что температура не указана для стандартных государственных условий, но большинство таблиц составлено для этой температуры.
- Все газы под давлением 1 атм.
- Все жидкости и газы чистые.
- Все растворы имеют концентрацию 1М.
- Энергия образования элемента в нормальном состоянии определяется как ноль.
Расчеты стандартного состояния могут выполняться при другой температуре, чаще всего 273 К (0 градусов Цельсия), поэтому расчеты стандартного состояния могут выполняться в STP. Однако, если не указано иное, предполагается, что стандартное состояние относится к более высокой температуре.
по сравнению с STP
И STP, и стандартное состояние определяют давление газа 1 атмосферу. Однако стандартное состояние обычно не соответствует температуре STP. Стандартное состояние также включает несколько дополнительных ограничений.
STP, SATP и NTP
Хотя STP полезен для расчетов, он непрактичен для большинства лабораторных экспериментов, потому что они обычно не проводятся при 0 ° C. Можно использовать SATP, что означает стандартные температуру и давление окружающей среды.SATP находится при 25 градусах Цельсия (298,15 К) и 101 кПа (по существу 1 атмосфера, 0,997 атм).
Другой стандарт — NTP, что означает нормальную температуру и давление. Это определено для воздуха при температуре 20 ° C (293,15 K, 68 ° F) и давлении 1 атм.
Существует также ISA, или международная стандартная атмосфера, которая составляет 101,325 кПа, 15 градусов Цельсия и влажность 0 процентов, и Стандартная атмосфера ИКАО, которая представляет собой атмосферное давление 760 мм рт. ст. и температуру 5 градусов Цельсия (288,15 К или 59 градусов по Фаренгейту). ).
ст. и температуру 5 градусов Цельсия (288,15 К или 59 градусов по Фаренгейту). ).
Какой использовать?
Обычно вы используете тот стандарт, по которому вы можете найти данные, наиболее близкий к вашим реальным условиям или тот, который требуется для конкретной дисциплины. Помните, что стандарты близки к реальным значениям, но не совсем соответствуют реальным условиям.
Узнайте о STP в химии
STP в химии — это аббревиатура от Standard Temperature and Pressure . STP чаще всего используется при выполнении расчетов с газами, например с плотностью газа.Стандартная температура составляет 273 К (0 ° по Цельсию или 32 ° по Фаренгейту), а стандартное давление — 1 атм. Это точка замерзания чистой воды при атмосферном давлении на уровне моря. На STP один моль газа занимает 22,4 л объема (молярный объем).
Определение STP в химии
Обратите внимание, что Международный союз теоретической и прикладной химии (IUPAC) применяет более строгий стандарт STP: температура 273,15 K (0 ° C, 32 ° F) и абсолютное давление ровно 100000 Па (1 бар, 14,0 бар). 5 фунтов на квадратный дюйм, 0,98692 атм). Это изменение от их более раннего стандарта (измененного в 1982 г.) 0 ° C и 101,325 кПа (1 атм).
5 фунтов на квадратный дюйм, 0,98692 атм). Это изменение от их более раннего стандарта (измененного в 1982 г.) 0 ° C и 101,325 кПа (1 атм).
Ключевые выводы: STP или стандартные температура и давление
- STP — это сокращение от Standard Temperature and Pressure. Однако «стандарт» определяется разными группами по-разному. Значения
- STP чаще всего приводятся для газов, поскольку их характеристики резко меняются в зависимости от температуры и давления.
- Одно из распространенных определений STP — это температура 273 К (0 ° Цельсия или 32 ° Фаренгейта) и стандартное давление 1 атм.В этих условиях на один моль газа приходится 22,4 л.
- Поскольку стандарты различаются в зависимости от отрасли, рекомендуется указывать условия температуры и давления для измерений, а не просто говорить «STP».
Использование СТП
Стандартные стандартные условия важны для выражений расхода жидкости и объемов жидкостей и газов, которые сильно зависят от температуры и давления. STP обычно используется, когда к расчетам применяются стандартные условия .Стандартные государственные условия, которые включают стандартные температуру и давление, могут быть обозначены в расчетах по надстрочному кружку. Например, ΔS ° относится к изменению энтропии на STP.
STP обычно используется, когда к расчетам применяются стандартные условия .Стандартные государственные условия, которые включают стандартные температуру и давление, могут быть обозначены в расчетах по надстрочному кружку. Например, ΔS ° относится к изменению энтропии на STP.
Другие формы СТП
Поскольку лабораторные условия редко связаны с STP, общим стандартом является стандартная температура окружающей среды , и давление или SATP , то есть температура 298,15 K (25 ° C, 77 ° F) и абсолютное давление ровно 1 атм (101,325 Па). , 1.01325 бар).
International Standard Atmosphere или ISA и US Standard Atmosphere — это стандарты, используемые в области гидродинамики и аэронавтики для определения температуры, давления, плотности и скорости звука для диапазона высот в среднем диапазоне. широты. Эти два набора стандартов одинаковы на высоте до 65 000 футов над уровнем моря. В остальном они немного отличаются по диапазонам температур, используемых на разных высотах.Эти стандарты являются таблицами, поскольку единого «стандартного» значения не существует.
В остальном они немного отличаются по диапазонам температур, используемых на разных высотах.Эти стандарты являются таблицами, поскольку единого «стандартного» значения не существует.
Национальный институт стандартов и технологий (NIST) использует температуру 20 ° C (293,15 K, 68 ° F) и абсолютное давление 101,325 кПа (14,696 фунтов на квадратный дюйм, 1 атм) для STP. В ГОСТ 2939-63 используются стандартные условия: 20 ° C (293,15 K), 760 мм рт. Ст. (101325 Н / м2) и нулевая влажность. Международные стандартные метрические условия для природного газа: 288,15 К (15,00 ° C; 59,00 ° F) и 101,325 кПа.Международная организация по стандартизации (ISO) и Агентство по охране окружающей среды США (US EPA) также устанавливают свои собственные стандарты.
Правильное использование термина STP
Несмотря на то, что STP определен, вы можете видеть, что точное определение зависит от комитета, установившего стандарт! Следовательно, вместо того, чтобы ссылаться на измерения, выполненные в стандартных или стандартных условиях, всегда лучше явно указать эталонные условия температуры и давления. Это позволяет избежать путаницы. Кроме того, важно указать температуру и давление для молярного объема газа, а не указывать STP в качестве условий. При расчете молярного объема необходимо указать, использовалась ли в расчетах постоянная идеального газа R или удельная газовая постоянная R s . Две константы связаны между собой: R s = R / m, где m — молекулярная масса газа.
Это позволяет избежать путаницы. Кроме того, важно указать температуру и давление для молярного объема газа, а не указывать STP в качестве условий. При расчете молярного объема необходимо указать, использовалась ли в расчетах постоянная идеального газа R или удельная газовая постоянная R s . Две константы связаны между собой: R s = R / m, где m — молекулярная масса газа.
Хотя STP чаще всего применяется к газам, многие ученые пытаются проводить эксперименты от STP к SATP, чтобы упростить их воспроизведение без введения переменных.Хорошая лабораторная практика — всегда указывать температуру и давление или, по крайней мере, записывать их на случай, если они окажутся важными.
Источники
- Дуарон, Тед (2007). «20 ° C — Краткая история стандартной эталонной температуры для промышленных измерений размеров». Национальный институт стандартов и технологий. Журнал исследований Национального института стандартов и технологий .

- McNaught, A.D .; Уилкинсон, А.(1997). Сборник химической терминологии, Золотая книга (2-е изд.). Blackwell Science. ISBN 0-86542-684-8.
- Природный газ — Стандартные исходные условия (ISO 13443) (1996). Женева, Швейцария: Международная организация по стандартизации.
- Weast, Роберт К. (редактор) (1975). Справочник по физике и химии (56-е изд.). CRC Press. стр. F201 – F206. ISBN 0-87819-455-X.
Нормальные условия температуры и давления газа — статья энциклопедии
В химии, физике и машиностроении, а также в промышленности и торговле эталонные условия температуры и давления газа определяют плотность газа и документируют указанный объем газа.Стандартные условия должны быть указаны при выражении объема газа или объемного расхода, поскольку объемы газа меняются в зависимости от температуры и давления газа.
Имеющиеся данные о различных определениях так называемых стандартных условий ясно указывают на то, что не существует общепринятого определения стандартных стандартных условий температуры и давления (см. Таблицу 1 ниже). По этой причине простое указание объемов газа или объемных расходов газа при стандартных условиях или при STP (стандартные температура и давление) не имеет смысла, если конкретные исходные условия не указаны четко.По той же причине обозначения Нм 3 (нормальные кубические метры) и scf (стандартные кубические футы) также не имеют смысла, если четко не указаны конкретные исходные условия.
Таблицу 1 ниже). По этой причине простое указание объемов газа или объемных расходов газа при стандартных условиях или при STP (стандартные температура и давление) не имеет смысла, если конкретные исходные условия не указаны четко.По той же причине обозначения Нм 3 (нормальные кубические метры) и scf (стандартные кубические футы) также не имеют смысла, если четко не указаны конкретные исходные условия.
Прошлые и настоящие определения
В течение многих лет большинство инженеров, химиков, физиков и других ученых, использующих метрическую систему единиц, определяли стандартные эталонные условия температуры и давления для выражения объемов газа как 0 ° C (273.15 К) и 101,325 кПа (т. Е. 1 атмосфера абсолютного давления). В те же годы наиболее часто используемыми стандартными эталонными условиями для людей, использующих имперскую или обычную систему единиц США, были 60 ° F (520 ° R) и 14,696 фунтов на квадратный дюйм (т. Е. 1 атмосфера абсолютного давления), потому что они использовались почти повсеместно. нефтяной и газовой отраслями по всему миру.
Е. 1 атмосфера абсолютного давления), потому что они использовались почти повсеместно. нефтяной и газовой отраслями по всему миру.
Два приведенных выше определения больше не являются наиболее часто используемыми определениями в метрической, имперской или стандартной системе единиц США.Некоторые из множества различных определений, используемых в настоящее время, представлены в следующем разделе (см. Таблицу 1).
При указании объема или расхода газа в нормальных кубических метрах (Нм³) или стандартных кубических футов (scf) или в любых других обозначениях ( нм , Scf , STP и т. Д.), конкретные стандартные условия температуры и давления должны быть четко указаны. Невыполнение этого требования может привести к путанице, поскольку не существует общепринятого набора исходных условий.Например, как отмечалось выше, Международный союз теоретической и прикладной химии (IUPAC) теперь определяет стандартные стандартные условия как 0 ° C и 100 кПа (а не 0 ° C и 101,325 кПа). [1] [2] [3] В качестве другого примера, Организация стран-экспортеров нефти (ОПЕК) и большинство предприятий газовой промышленности Северной Америки приняли 60 ° F и 14,73 фунта на квадратный дюйм в качестве своих стандартные стандартные условия (вместо 60 ° F и 14,696 фунтов на квадратный дюйм) для выражения объемов и расходов природного газа. [4] [5] [6] Кроме того, газовые компании в некоторых других странах приняли 15 ° C (59 ° F) и 101,325 кПа (14,696 фунт / кв.дюйм) в качестве стандартных исходных условий для объема газа. [7] [8] [9]
[1] [2] [3] В качестве другого примера, Организация стран-экспортеров нефти (ОПЕК) и большинство предприятий газовой промышленности Северной Америки приняли 60 ° F и 14,73 фунта на квадратный дюйм в качестве своих стандартные стандартные условия (вместо 60 ° F и 14,696 фунтов на квадратный дюйм) для выражения объемов и расходов природного газа. [4] [5] [6] Кроме того, газовые компании в некоторых других странах приняли 15 ° C (59 ° F) и 101,325 кПа (14,696 фунт / кв.дюйм) в качестве стандартных исходных условий для объема газа. [7] [8] [9]
Во многих технических публикациях (книги, журналы, реклама поставщиков оборудования и статьи в Интернете) все еще указываются объемы или потоки газа в Нм³ или scf без указания эталонная температура и давление.Эта практика предполагает, что читатель поймет, какие исходные условия применимы. Такие предположения могут и будут приводить к путанице и ошибкам.
Используемые определения
В настоящее время используется множество различных определений стандартных эталонных условий. В таблице 1 представлены тринадцать таких вариантов определений стандартных состояний, а также немало других.
Для «SATP» (Стандартная температура и давление окружающей среды), используемого для представления химических термодинамических свойств, например, опубликованных Национальным бюро стандартов (см. Таблицу 1), давление стандартизировано как 1 бар (100 кПа), а температура обычно (но не всегда) указывается при 25 ° C.
Следует также отметить, что Международная организация по стандартизации (ISO), Агентство по охране окружающей среды США (EPA) и Национальный институт стандартов и технологий (NIST) имеют более одного определения стандартных эталонных условий в своих различных публикациях. . Также обратите внимание, что список фундаментальных физических констант NIST / CODATA включает значения как при стандартном давлении 100 кПа, так и при стандартном давлении 101,325 кПа для молярного объема идеального газа.
Из таблицы совершенно очевидно, что абсолютно необходимо четко указывать эталонные условия температуры и давления всякий раз, когда выражается объем газа или объемный расход газа.Не менее важно указать, выражается ли объем газа на сухой или влажной основе. Как отмечено в таблице 1, некоторые из текущих определений стандартных условий включают спецификацию относительной влажности в процентах (% RH).
| Температура | Абсолютное давление | Относительная влажность | Издательство или учреждение |
|---|---|---|---|
| ° С | кПа | % относительной влажности | |
| 0 | 100.000 | IUPAC (Текущее определение), [1] NIST / CODATA [10] | |
| 0 | 101,325 | IUPAC (прежнее определение), [1] NIST / CODATA, [10] NIST, [11] ISO 10780 [12] | |
| 15 | 101,325 | 0 [13] [14] | ISA, [13] ISO 13443, [14] EEA, [15] EGIA [4] |
| 20 | 101. 325 325 | Агентство по охране окружающей среды США, [16] NIST [17] | |
| 25 | 101,325 | Агентство по охране окружающей среды США [18] | |
| 25 | 100,000 | SATP [19] | |
| 20 | 100,000 | 0 | CAGI [20] |
| 15 | 100,000 | SPE [21] | |
| ° F | фунтов на квадратный дюйм | % относительной влажности | |
| 60 | 14.696 | SPE, [21] OSHA, [22] SCAQMD [23] | |
| 60 | 14,73 | EGIA, [4] OPEC, [5] EIA [6] | |
| 59 | 14,503 | 78 | Армейский стандарт Metro [24] |
| 59 | 14,696 | 60 | ISO 2314 и ISO 3977-2 [25] |
| ° F | дюйм рт. Ст. Ст. | % относительной влажности | |
| 70 | 29.92 | 0 | AMCA [26] |
Примечания:
- 101,325 кПа = 1 атм = 1,01325 бар = 760 мм рт. Ст. = 29,92 дюймов рт. Ст. ≈ 14,696 фунтов на кв. Дюйм
- 100,000 кПа = 1 бар ≈ 14,504 psi ≈ 750 торр (или мм рт. Ст.)
- 14,73 фунтов на кв. Дюйм ≈ 30 дюймов рт. Ст. ≈ 1,0156 бар ≈ 101,560 кПа
- Все давления являются абсолютными (не манометрическими)
- 59 ° F = 15 ° C, 60 ° F ≈ 15,6 ° C, 70 ° F ≈ 21,1 ° C
- сухой = 0 процентов относительной влажности = 0% относительной влажности
Полные названия организаций, перечисленных в таблице 1:
Молярный объем газа
Молярный объем газа — фундаментальная физическая константа. [10] Указание применимых эталонных условий температуры и давления при указании молярного объема газа так же важно, как и при выражении объема газа или объемной скорости потока. Указание молярного объема газа без указания стандартных условий температуры и давления не имеет смысла и может вызвать путаницу.
Указание молярного объема газа без указания стандартных условий температуры и давления не имеет смысла и может вызвать путаницу.
Молярные объемы газа могут быть рассчитаны с точностью, обычно достаточной при использовании закона идеального газа:
, который можно изменить как:
где (в метрических единицах СИ):
| п. | = абсолютное давление газа, Па |
|---|---|
| n | = количество моль, в моль |
| V м | = молярный объем газа, м 3 / моль |
| т | = абсолютная температура газа, К |
| R | = универсальная газовая постоянная, равная 8.314472 м 3 · Па · моль -1 · K -1 |
или где (в обычных единицах США):
п. | = абсолютное давление газа в фунтах на квадратный дюйм |
|---|---|
| n | = количество молей, фунт-моль |
| V м | = молярный объем газа, футы 3 / фунт-моль |
| т | = абсолютная температура газа в градусах Ренкина (° R) |
| R | = постоянная универсального закона газа 10.7316 футов 3 · psia · фунт-моль -l · ° R -1 |
Молярный объем любого идеального газа может быть рассчитан при различных стандартных условиях, как показано ниже:
- V м = 8,314472 × 273,15 / 101,325 = 22,414 м 3 / кмоль при 0 ° C и абсолютном давлении 101,325 кПа
- V м = 8,314472 × 273,15 / 100,000 = 22,711 м 3 / кмоль при 0 ° C и абсолютном давлении 100 кПа
- V 1 м = .
 7316 × 519,67 / 14,696 = 379,48 футов 3 / фунт-моль при 60 ° F и 14,696 фунт / кв.дюйм
7316 × 519,67 / 14,696 = 379,48 футов 3 / фунт-моль при 60 ° F и 14,696 фунт / кв.дюйм - V м = 10,7316 × 519,67 / 14,730 = 378,61 фута 3 / фунт-моль при 60 ° F и 14,73 фунт / кв. Дюйм они используют универсальную константу закона газа R , которая применяется к любому идеальному газу, или используют ли они константу закона особого газа R s , которая применяется только к определенному отдельному газу.Отношение между двумя константами: R s = R / M , где M — молекулярная масса газа.
Примечания:
Список литературы
- ↑ 1,0 1,1 1,2 Стандартное давление IUPAC Goldbook
- ↑ Стандартные условия газов IUPAC Goldbook
- ↑ Золотая книга STP IUPAC
- ↑ 4,0 4,1 4.2 «Закон об инспекции электроэнергии и газа», SOR / 86-131 (определяет набор стандартных условий для британских единиц и другой набор для метрических единиц). Копия канадского «Закона об инспекции электроэнергии и газа»
- ↑ 5,0 5,1 «Ежегодный статистический бюллетень», 2004 г., главный редактор: д-р Омар Ибрагим, Организация стран-экспортеров нефти, Вена, Австрия Статистический бюллетень ОПЕК
- ↑ 6.0 6.1 «Natural Gas Annual 2004», DOE / EIA-0131 (04), декабрь 2005 г., U.S. Министерство энергетики, Управление энергетической информации, Вашингтон, округ Колумбия, США Natural Gas Annual 2004
- ↑ Gassco (норвежский трубопровод, по которому газ идет в Европу)
- ↑ Nord Gas AG (трубопровод консорциума, поставляющий газ из России в Германию)
- ↑ Metrogas (газовая компания в Аргентине)
- ↑ 10,0 10,1 10,2 Фундаментальные физические константы, физико-химические константы (список данных CODATA в NIST)
- ↑ NIST (1989).Стандартная справочная база данных NIST 7. (База данных материалов по тормозящим способностям электронов и позитронов NIST)
- ↑ Международная организация по стандартизации (1994), ISO 10780: 1994: Выбросы из стационарных источников — Измерение скорости и объемного расхода газовых потоков в каналах Каталог стандартов ISO
- ↑ 13,0 13,1 Роберт К. Вист (редактор) (1975). Справочник по физике и химии , 56-е издание.CRC Press, стр. F201-F206. ISBN 0-87819-455-X.
- ↑ 14,0 14,1 «Природный газ — стандартные стандартные условия», ISO 13443, Международная организация по стандартизации, Женева, Швейцария, Каталог стандартов ISO
- ↑ «Добыча, первая обработка и загрузка жидких и газообразных ископаемых видов топлива», Руководство по инвентаризации выбросов B521, мероприятия 050201–050303, сентябрь 1999 г., Европейское агентство по окружающей среде, Копенгаген, Дания, Руководство по инвентаризации выбросов
- ↑ «Стандарты эффективности для новых источников», 40 CFR — Защита окружающей среды, Глава I, Часть 60, Раздел 60.2, Стандарты производительности новых источников 1990 г.
- ↑ «Расчет и неопределенность для стандарта расхода газа PVTt», Журнал исследований Национального института стандартов и технологий, Том 108, номер 1, 2003 г. NIST Journal
- ↑ «Национальные первичные и вторичные стандарты качества окружающего воздуха», 40 CFR — Охрана окружающей среды, глава I, часть 50, раздел 50.3, Национальные стандарты атмосферного воздуха 1998 г.
- ↑ «Таблица химических термодинамических свойств», Национальное бюро стандартов (NBS), журнал физических и химических справочных данных, 1982, Vol.11, Приложение 2. Таблицы химико-термодинамических свойств NBS.
- ↑ «Глоссарий», 2002, Институт сжатого воздуха и газа, Кливленд, Огайо, США Глоссарий
- ↑ 21,0 21,1 Метрическая система единиц СИ и метрический стандарт SPE (примечания к таблице 2.3, на странице 25 из 42 страниц PDF в формате PDF, определяют два различных набора исходных условий: один для стандартного кубического фута, а другой — для стандартного кубического фута. стандартный кубический метр)
- ↑ «Хранение сжиженных углеводородных газов и обращение с ними» и «Хранение и обращение с безводным аммиаком», 29 CFR — Трудовые отношения, Глава XVII — Управление по охране труда, Часть 1910, Раздел.1910.110 и 1910.111, 1993 Хранение / обращение с СНГ
- ↑ «Правило 102, Определение терминов (стандартные условия)», с поправками, внесенными в декабре 2004 г., Округ управления качеством воздуха Южного побережья, Лос-Анджелес, Калифорния, США Правило 102 SCAQMD
- ↑ Роберт Хайден, Тед Альмгрен, Кевин Томас и Уильям Макдональд. Руководство по перезарядке винтовки и пистолета (Раздел 3) , 5-е издание. Сьерра Пули. Внешняя баллистика
- ↑ «Газовые турбины — Закупки — Часть 2: Стандартные исходные условия и рейтинги», ISO 3977-2: 1997 и «Газовые турбины — Приемочные испытания», ISO 2314: 1989, издание 2, Международная организация по стандартизации, Женева, Швейцария ISO Каталог стандартов
- ↑ Стандарт 210 ANSI / AMCA, «Лабораторные методы тестирования вентиляторов для определения аэродинамических характеристик», как подразумевается на веб-сайте Greenheck, доступ 17 октября 2007 г.
Стандартные температура и давление (STP)
Гиперглоссарий MSDS: Стандартные температура и давление (STP)Определение
Стандартная температура и давление (STP) определяется как 0 градусов Цельсия и давление 1 атмосфера.
Не путайте STP с компанией STP Products, производителем присадок к маслам и топливу … если вы не читаете один из их паспортов безопасности!
Дополнительная информация
STP используется во многих термодинамических расчетах и таблицах. Некоторые свойства вещества, такие как плотность, вязкость, точка кипения и т. Д., Будут меняться в зависимости от изменений температуры или давления. Наличие одного общего набора условий («состояние») для табулирования этих значений делает возможным сравнение и упрощает вычисления.
Понятие материи в ее стандартном состоянии (также называемое «стандартные условия») тесно связано. «Стандартное состояние» не означает, что , а не , обычно подразумевает определенную температуру, но чаще всего используется 25 ° C (298 K):
Состояние вещества Стандартное состояние Газ Давление 1 атм Жидкость Чистая жидкость Твердый Раствор Элементы Самый стабильный аллотроп в STP, с G f 0 = 0 Многие химические расчеты проводятся для материалов, находящихся в их стандартном состоянии.Одним очень полезным правилом для газов, которое не обязательно требует стандартных условий состояния, является Закон идеального газа (уравнение 1).
(1) Где:
Используя закон идеального газа, можно определить значение любой одной из четырех переменных (P, V, n, T), если нам известны значения трех других (R — константа).
Например, 1000 грамм (1 килограмм = 2,2 фунта) этилена (с молярной массой 28 грамм / моль) будут занимать объем 800 литров в STP:
Если бы мы хотели рассчитать этот объем при другой, нестандартной температуре состояния, например, 100 ° C, мы бы просто заменили температуру 373 K (100 ° C = 373 K) в приведенном выше расчете.Закон идеального газа — это удобное уравнение очень для оценки свойств газа как в стандартных, так и в нестандартных условиях.
Соответствие паспорту безопасности
Буквы «STP» чаще всего встречаются в паспорте безопасности после физических свойств, таких как плотность, предел воспламеняемости или давление пара материала. Эти свойства указаны в разделе 9 (физические и химические свойства) SDS.
Помните: STP — 0 ° C, НЕ комнатная температура . Обычно свойства при STP по сравнению с комнатной температурой различаются менее чем на 10% для газов и еще меньше для жидкостей или твердых тел. Например, в расчете в предыдущем разделе объем будет 858 литров при 20 ° C, разница в 7%. А плотность воды составляет 0,99987 г / мл при 0 ° C по сравнению с 0,99823 г / мл при 20 ° C, разница 0,16%.
Однако иногда различия могут быть весьма значительными — диметиламин — это летучая жидкость с удельным весом 0,680 при стандартном давлении, но это газ с температурой кипения выше 7 ° C!
Дополнительная литература
См. Также : единицы массы, моль, единицы давления
Дополнительные определения от Google и OneLook.
Последнее обновление записи: суббота, 24 октября 2020 г. Несанкционированное копирование или размещение на других веб-сайтах категорически запрещено. Присылайте нам предложения, комментарии и пожелания о новых записях (если возможно, укажите URL-адрес) по электронной почте.
Заявление об ограничении ответственности : Информация, содержащаяся в данном документе, считается правдивой и точной, однако ILPI не дает никаких гарантий относительно правдивости любого заявления.Читатель использует любую информацию на этой странице на свой страх и риск. ILPI настоятельно рекомендует читателям проконсультироваться с соответствующими местными, государственными и федеральными агентствами по вопросам, обсуждаемым здесь.
Что такое барометрическое давление?
Нас регулярно спрашивают: «Что такое барометрическое давление?» Поэтому я решил написать короткое сообщение в блоге, чтобы ответить на этот вопрос.Обратите внимание, что барометрическое давление иногда также называют атмосферным давлением.
Вкратце, мы можем сказать следующее: Барометрическое давление — это давление на землю, которое создается весом воздуха над нами.
Это определение звучит довольно просто, но давайте все равно рассмотрим этот предмет глубже…
Что такое давление?
Для начала, что такое давление? Давление определяется как силы на площадь (p = F / A) , что означает, что давление — это определенная сила, действующая на площадь. Международная система СИ определяет базовую единицу давления как Паскаль, где 1 Паскаль равен 1 Ньютону на квадратный метр (Н / м2).
Думаем мы об этом или нет, но многие часто используемые единицы измерения давления указывают в своем названии силу и площадь. Например, psi — фунт-сила на квадратный дюйм или кгс / см 2 — килограмм-сила на квадратный сантиметр. Однако большинство единиц измерения давления не включают этот принцип прямо в свое название.
Чтобы узнать больше о давлении и различных используемых единицах давления, прочтите сообщение в блоге Единицы давления и преобразование единиц давления .
Абсолютное давлениеБарометрическое давление — это так называемое абсолютное давление типа . При измерении абсолютного давления измеренное давление сравнивается с идеальным (абсолютным) вакуумом, в котором не осталось молекул воздуха и, следовательно, нет давления.
Для сравнения, обычный манометр называется текущим барометрическим / атмосферным давлением.
Для получения более подробной информации о различных типах давления, пожалуйста, просмотрите сообщение в блоге Основы калибровки давления — Типы давления.
Барометрическое давление
Как уже упоминалось, барометрическое давление — это давление , вызванное весом воздуха над нами . Атмосфера Земли над нами содержит воздух, и хотя он относительно легкий, имея его в таком большом количестве, он начинает иметь некоторый вес, поскольку гравитация притягивает молекулы воздуха.
Когда я говорю «воздух», это означает воздух вокруг нас, состоящий примерно из 78% азота, 21% кислорода, 1% аргона и небольшого количества других газов.Чем выше мы поднимаемся, тем тоньше воздух, потому что в нем меньше молекул.Приблизительно 75% массы атмосферы находится на поверхности земли ниже высоты слоя толщиной около 11 км (6,8 миль, 36 000 футов). Граница, на которой атмосфера превращается в космическое пространство, обычно считается примерно на 100 км (62 мили) над поверхностью земли.
Мы можем проиллюстрировать столб воздуха над нами, притягиваемый силой тяжести, вызывающий атмосферное давление, с помощью рисунка ниже:
Номинальное барометрическое давление на Земле согласовано как 101.325 кПа абс. (1013,25 мбар абс. Или 14,696 фунт / кв. Дюйм абс.), Что означает, что на каждый квадратный сантиметр (14,7 фунт-сила на каждый квадратный дюйм) обычно приходится около 1,03 килограмм-силы из-за веса воздуха.
На практике барометрическое давление очень редко бывает точно таким же, как и номинальное, поскольку оно все время меняется и колеблется в разных местах.Атмосферное давление зависит от нескольких факторов, например от погодных условий и высоты .
Для погоды Пример: в дождливый день атмосферное давление ниже, чем в солнечный день.
Барометрическое давление также зависит от высоты . Чем выше вы находитесь, тем меньше атмосферное давление, что имеет смысл, потому что, когда вы поднимаетесь на большую высоту, над вами становится меньше воздуха. Воздух на больших высотах также содержит меньше молекул, что делает его легче, чем на более низкой высоте.На этих высотах сила тяжести также уменьшается. По этим причинам барометрическое давление меньше на больших высотах.
Фактически, вы можете использовать измеритель барометрического давления , чтобы измерить вашу высоту , именно так самолеты могут измерять свою высоту. Давление падает по мере того, как вы поднимаетесь вверх, оно все равно не падает точно линейно.
Когда вы поднимаетесь в космос, там нет давления, это идеальный вакуум без каких-либо молекул воздуха.
На рисунках ниже показано, как изменяется атмосферное давление при изменении высоты. Первый — кПа по сравнению с метрами, второй — с фунтами на квадратный дюйм по сравнению с футами:
Единицы измерения барометрического (атмосферного) давления
Есть несколько единиц давления, которые были созданы специально для измерения барометрического давления.
Одна из этих единиц — в стандартной атмосфере (атм), что равно 101325 Паскаля. Также существует единица под названием техническая атмосфера (атм.), Которая не совсем такая же, как атм (1 атм = 0.968 атм).
Торр также используется для измерения барометрического давления, первоначально равного миллиметру ртутного столба, но позже оно определяется как немного другое. Также используются некоторые единицы СИ, такие как гПа (гектопаскаль), кПа (килопаскаль) или мбар (миллибар).
Важно помнить, что мы всегда говорим об абсолютном давлении, когда говорим о атмосферном давлении.
Подробнее об единицах давления в записи блога Единицы давления и преобразование единиц давления .
Некоторые практические соображения
Мы можем легко почувствовать изменение атмосферного давления, когда путешествуем на самолете. Несмотря на то, что внутри самолета создается давление, оно все равно падает, когда самолет поднимается выше. Особенно чувствуется давление в ушах, когда самолет начинает приземляться и падает на меньшую высоту. Изменение происходит так быстро, что ваши уши не всегда успокаиваются достаточно быстро.
Возможно, вы заметили, что чашка для йогурта несколько опухает, когда вы находитесь в воздухе.Чашка набухает, потому что она была запечатана на земле при нормальном барометрическом давлении.



 Когда книга лежит ровно, площадь составляет (0,270 м) (0.210 м) = 0,0567 м 2 . B Давление, оказываемое горизонтально лежащим текстом, составляет
Когда книга лежит ровно, площадь составляет (0,270 м) (0.210 м) = 0,0567 м 2 . B Давление, оказываемое горизонтально лежащим текстом, составляет

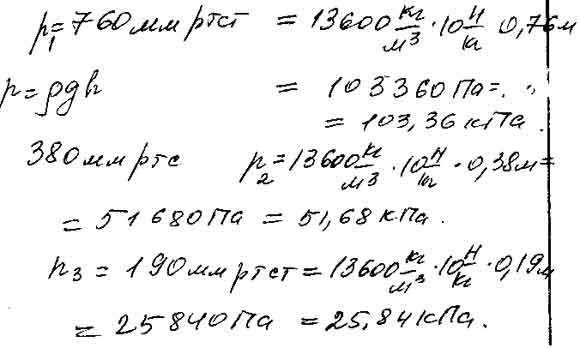 0 м 2 поршневой?
0 м 2 поршневой?

 Ст.
Ст. Какая масса в килограммах, приложенная к площади 1,0 см 2 , требуется для создания давления
Какая масса в килограммах, приложенная к площади 1,0 см 2 , требуется для создания давления 785
785 \ [0.663 \, \ cancel {L} \ times \ frac {1000 \, ml} {1 \, \ cancel {L}} = 663 \, ml \]
\ [0.663 \, \ cancel {L} \ times \ frac {1000 \, ml} {1 \, \ cancel {L}} = 663 \, ml \] \ text {o} \ text {C} = 344 \: \ text {K} \)
\ text {o} \ text {C} = 344 \: \ text {K} \)


 7316 × 519,67 / 14,696 = 379,48 футов 3 / фунт-моль при 60 ° F и 14,696 фунт / кв.дюйм
7316 × 519,67 / 14,696 = 379,48 футов 3 / фунт-моль при 60 ° F и 14,696 фунт / кв.дюйм