Периодическая таблица через 150 лет
Ю. Ц. Оганесян
По материалам доклада на Научной сессии Общего собрания членов РАН, посвященной закрытию Международного года Периодической таблицы 14 ноября 2019 г. В варианте статьи журнала «Вестник Российской академии наук» № 4 2020 г.
К началу 2019 г., провозглашенного ООН и ЮНЕСКО Международным годом Периодической таблицы химических элементов, 7-й период таблицы был уже заполнен новыми, самыми тяжелыми элементами. Согласно предсказаниям теории, изотопы сверхтяжелых элементов, обладающие повышенной стабильностью, образуют на карте нуклидов большую зону в виде острова с вершиной, расположенной вблизи «магических» чисел протонов Z=114 и нейтронов N=184. Новые элементы с атомными номерами от 114 до 118 были синтезированы в Лаборатории ядерных реакций им. Г.Н. Флёрова Объединённого института ядерных исследований (ОИЯИ) в Дубне в 2000–2012 гг. в реакциях слияния ядер мишени – тяжёлых изотопов актиноидов (Z = 94–98) – с бомбардирующими ионами кальция-48. Из полученных экспериментальных результатов следует, что могут существовать ядра/элементы с атомными номерами более 118 и массами более 300 а.е.м. Для исследования ядерной и электронной структур новых элементов, а также их химических свойств, равно как и синтеза элементов начала 8-го периода Периодической таблицы, в Дубне создан новый экспериментальный комплекс Фабрика сверхтяжелых элементов (Фабрика СТЭ), где уже состоялся пуск нового ускорителя DC-280 и в ближайшее время начнутся эксперименты. Вводная и заключительная части моего выступления на Научной сессии Общего собрания членов РАН относились к открытию периодического закона, опубликованного Д.И. Менделеевым 150 лет назад. Действие этого закона в свойствах тяжелейших элементов представляет и сегодня одну из актуальных и интересных задач естествознания.
Ключевые слова: Периодическая таблица Д. И. Менделеева, сверхтяжёлые элементы, “остров” стабильности, Фабрика сверхтяжёлых элементов, спонтанное деление.
И. Менделеева, сверхтяжёлые элементы, “остров” стабильности, Фабрика сверхтяжёлых элементов, спонтанное деление.
ПРОЛОГ
Предание гласит, что всё началось с письма, которое сэр Мартин Поляков, профессор Ноттингемского университета (Великобритания) и иностранный член РАН, направил 28 июля 2016 г. президенту Международного союза чистой и прикладной химии (ИЮПАК) члену-корреспонденту РАН Наталии Павловне Тарасовой:
«Уважаемая Наталия,
надеюсь, что Вы в порядке.
Как я понимаю, 2019 год станет 150-й годовщиной публикации Менделеевым Периодической таблицы. Было бы интересно знать, можно ли поднять вопрос о том, чтобы объявить 2019 год Международным годом Периодической таблицы. Чувствую, что это предложение может получить большую поддержку. Как Вы думаете?
С наилучшими пожеланиями,
Мартин Поляков»
Н.П. Тарасова поставила этот вопрос на заседании Исполнительного комитета ИЮПАК, который, как ей показалось, со здоровым скептицизмом поддержал идею Международного года Периодической таблицы и предложил России воплотить её в жизнь через ЮНЕСКО. Начиная с этого момента, вся деятельность по данному вопросу, проводимая Международным союзом чистой и прикладной химии в течение 18 месяцев, легла на плечи президента ИЮПАК и её коллег.
Российская академия наук и российские химики с большим воодушевлением взялись за дело: написали обращение Менделеевского съезда (2016) и Российского химического общества к мировой научной общественности, президент РАН академик В.Е. Фортов направил письмо министру иностранных дел России С.В. Лаврову, РАН обратилась в ИЮПАК, Н.П. Тарасова написала письмо Генеральному директору ЮНЕСКО и пр. К этому времени подошло другое событие, непосредственно связанное с Периодической таблицей химических элементов. После включения в 2012 г. в таблицу 114-го и 116-го элементов ИЮПАК принял название и утвердил символы ещё четырех химических элементов, в их числе двух самых тяжёлых.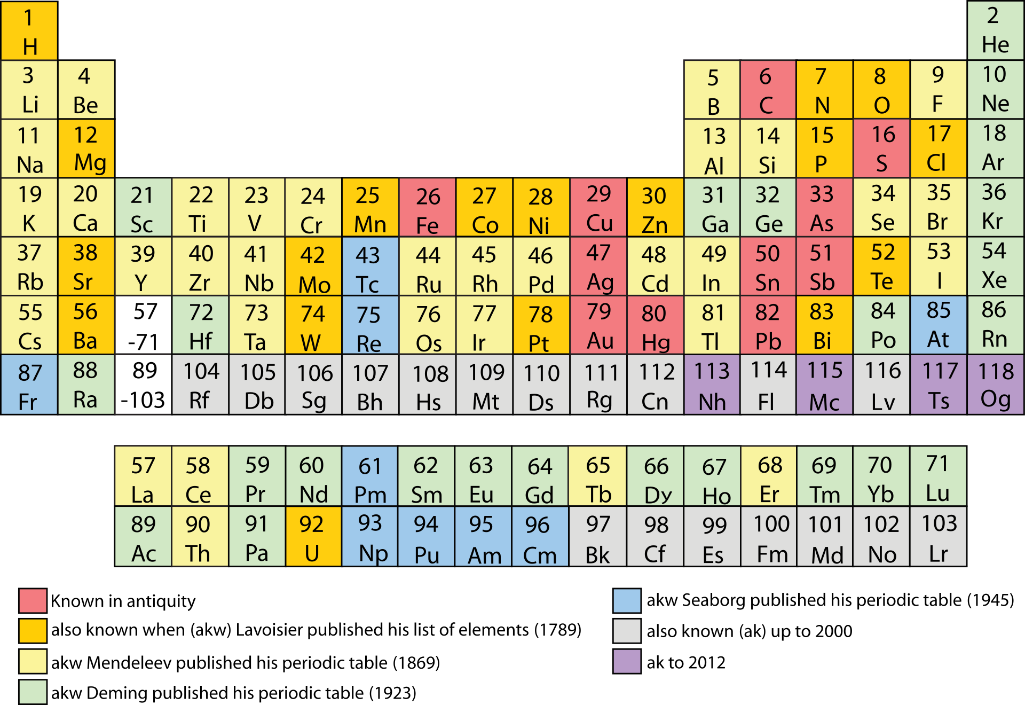
А 20 декабря 2017 г. с интересной и необычной формулировкой – “признавая важность глобального расширения знаний о том, как химия способствует устойчивому развитию в области энергетики, образования, сельского хозяйства и здоровья,” – Генеральная Ассамблея ООН, затем и ЮНЕСКО провозгласили 2019-й Международным годом Периодической таблицы химических элементов – IYPT-2019.
НОВЫЕ ОБИТАТЕЛИ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
В 1928 г. Георгий Антонович Гамов, наш соотечественник, выпускник Ленинградского государственного университета, уже известный к тому времени советский физик, предложил первую теоретическую модель атомного ядра в виде капли заряженной жидкости с плотностью, на 15 порядков превышающей плотность воды [1]. В новой науке, ядерной физике, этой работе суждено было сыграть большую роль. На основе капельной модели ядра Гамов создал теорию альфа-распада (1928) [2], Карл Фридрих фон Вайцзеккер предложил свою знаменитую формулу для расчёта энергии связи ядер (1935) [3], а Нильс Бор и Джон А. Уилер создали теорию ядерного деления (1939) [4]
Согласно Бору и Уилеру, тяжёлое ядро предохраняет от разделения на две части потенциальный барьер. Высота барьера деления ядра урана составляет 6 МэВ. Поэтому если в ядро внести энергию более чем 6 МэВ (например, энергию захвата ядром нейтрона), оно моментально разделится на две части. В этом процессе выделяется энергия около 200 МэВ, что используется в атомных электростанциях. Однако ядро урана может разделиться самопроизвольно (спонтанно) без вноса в ядро дополнительной энергии. Для этого, как было впервые измерено Г.Н. Флёровым и К.А. Петржаком (1940) [6], потребуется огромное время: 10
Поэтому если в ядро внести энергию более чем 6 МэВ (например, энергию захвата ядром нейтрона), оно моментально разделится на две части. В этом процессе выделяется энергия около 200 МэВ, что используется в атомных электростанциях. Однако ядро урана может разделиться самопроизвольно (спонтанно) без вноса в ядро дополнительной энергии. Для этого, как было впервые измерено Г.Н. Флёровым и К.А. Петржаком (1940) [6], потребуется огромное время: 10
Ещё 60 лет назад такое макроскопическое, и в этом смысле классическое, описание процесса деления не вызывало сомнений. Особенно после синтеза первых искусственных элементов тяжелее урана, прекрасно подтверждающих капельную теорию деления: от урана (Z = 92) до калифорния (Z = 98) период полураспада относительно спонтанного деления уменьшился в 10
Рис. 1. Периоды полураспада ядер с Z ≥ 96 относительно спонтанного деления. Черные кружки – экспериментальные значения для актиноидов и изотопов 104 элемента. Открытые кружки – один из вариантов предсказаний для ядер c Z ≥ 106 и N ≥ 150. С правой стороны: периоды спонтанного деления изотопов 114-го элемента, рассчитанные в макро – микроскопической модели ядра. |
Многие лаборатории мира буквально ринулись на поиски этих долгоживущих тяжеловесов. Но, к сожалению, все экстенсивные попытки найти их в природе, космических лучах и даже путём искусственного синтеза сверхтяжёлых элементов, предпринятые в течение 15 лет (1970–1985), не дали результатов. Оставляя пока вопрос о вероятности образования ядер с массой около 300 в процессах природного ядерного синтеза, отметим, что время жизни сверхтяжёлых долгожителей заметно меньше возраста Солнечной системы (4.5∙10
После 1985 г. мы кардинально изменили подход к синтезу сверхтяжёлых элементов. Для того чтобы добраться до “острова” и увидеть резкий подъём стабильности, предсказанный теорией, пришлось существенно усложнить эксперимент. Теперь вместо использования стабильных ядер в качестве материала мишени были выбраны тяжёлые изотопы трансурановых элементов (такие как плутоний-244 или кюрий-248), полученные в высокопоточном ядерном реакторе. Мишени из этих материалов подвергались бомбардировке ускоренными ионами кальция-48, исключительно редкого и дорогого изотопа природного кальция. Содержание кальция-48 в естественной смеси по отношению к основному изотопу кальцию-40 составляет всего 0.2%. Преимущества этой реакции прямо следуют из сравнения результатов экспериментов по синтезу 113-го элемента Nh, проведённого в RIKEN (Япония) и 114-го элемента Fl – в ОИЯИ (Дубна). Элемент Nh был синтезирован при слиянии ядер висмута-209 и цинка-70 [9]. Составная система после слияния двух атомных ядер содержит 113 протонов и 165 нейтронов. В этой реакции в течение девяти лет были получены три атома 113-го элемента. Элемент Fl (Z = 114), полученный в Дубне в реакции плутоний-244 + кальций-48, имел в составном ядре 114 протонов и 178 нейтронов [10] – на 13 нейтронов больше, чем в предыдущем случае. Эти 13 нейтронов, как следует из дальнейшего, и сыграли решающую роль.
Теперь вместо использования стабильных ядер в качестве материала мишени были выбраны тяжёлые изотопы трансурановых элементов (такие как плутоний-244 или кюрий-248), полученные в высокопоточном ядерном реакторе. Мишени из этих материалов подвергались бомбардировке ускоренными ионами кальция-48, исключительно редкого и дорогого изотопа природного кальция. Содержание кальция-48 в естественной смеси по отношению к основному изотопу кальцию-40 составляет всего 0.2%. Преимущества этой реакции прямо следуют из сравнения результатов экспериментов по синтезу 113-го элемента Nh, проведённого в RIKEN (Япония) и 114-го элемента Fl – в ОИЯИ (Дубна). Элемент Nh был синтезирован при слиянии ядер висмута-209 и цинка-70 [9]. Составная система после слияния двух атомных ядер содержит 113 протонов и 165 нейтронов. В этой реакции в течение девяти лет были получены три атома 113-го элемента. Элемент Fl (Z = 114), полученный в Дубне в реакции плутоний-244 + кальций-48, имел в составном ядре 114 протонов и 178 нейтронов [10] – на 13 нейтронов больше, чем в предыдущем случае. Эти 13 нейтронов, как следует из дальнейшего, и сыграли решающую роль.
Высадка на берег “острова” в северо-западной его части была действительно впечатляющей. Вероятность образования тяжёлого изотопа 114-го элемента оказалась примерно в 500 раз выше, чем 113-го элемента, полученного в RIKEN. Еще более сильное отличие наблюдалось в свойствах ядер, в частности, во временах жизни, измеряемых обычно периодами полураспада. Повышение числа нейтронов на 8 единиц в ядрах, синтезированных с ионами кальция-48, увеличило их период полураспада примерно в 100 тысяч раз! Оба фактора: рост вероятности образования и стабильности ядер демонстрируют сильный эффект “магической” структуры N = 184, даже несмотря на то, что синтезированный изотоп 114-го элемента содержит всего 175 нейтронов. После первых результатов по исследованию изотопов 114-го и 116-го элементов в реакциях с ионами кальция-48 (2000–2002) последующие эксперименты по синтезу других элементов с атомными номерами 115, 117 и 118 были проведены по той же методике с мишенями из америция-243, берклия-249 и калифорния-249 соответственно [11-13]. За 15 лет работы (около 100 тыс. часов облучения мишеней пучком ионов кальция-48) были синтезированы 52 новых изотопа [14] от 104-го до 118-го элементов (рис. 2, а). На карте нуклидов они простираются до ядер массой 294 а.е.м. (рис. 2, б). Это предельно тяжёлое ядро было получено в виде двух изобар: как чётно-чётный изотоп 118-го элемента с периодом полураспада около 0.5 миллисекунд и как нечётно-нечётный изотоп 117-го элемента с периодом полураспада около 50 миллисекунд. Оба периода полураспада в ядерном масштабе – огромные времена! Учитывая, что после образования нового ядра за время 10-14–10-13 секунды вокруг него выстраивается вся электронная система атома, то подобный вывод можно сделать и о существовании элементов. Из данных экспериментов следует, что мы не дошли до предела масс ядер. Определённо, ядра могут иметь массу более 300 а.е.м., а количество элементов может быть свыше 118.
За 15 лет работы (около 100 тыс. часов облучения мишеней пучком ионов кальция-48) были синтезированы 52 новых изотопа [14] от 104-го до 118-го элементов (рис. 2, а). На карте нуклидов они простираются до ядер массой 294 а.е.м. (рис. 2, б). Это предельно тяжёлое ядро было получено в виде двух изобар: как чётно-чётный изотоп 118-го элемента с периодом полураспада около 0.5 миллисекунд и как нечётно-нечётный изотоп 117-го элемента с периодом полураспада около 50 миллисекунд. Оба периода полураспада в ядерном масштабе – огромные времена! Учитывая, что после образования нового ядра за время 10-14–10-13 секунды вокруг него выстраивается вся электронная система атома, то подобный вывод можно сделать и о существовании элементов. Из данных экспериментов следует, что мы не дошли до предела масс ядер. Определённо, ядра могут иметь массу более 300 а.е.м., а количество элементов может быть свыше 118.
Рис. 2, а. Таблица Менделеева (площадь 150 м2). на фасаде химического факультета Университета в городе Мурсия (Испания, 2017). В красной рамке показаны элементы, полученные с пучком кальция-48. |
Рис. 2, б. Область конца карты нуклидов: показаны изотопы от свинца до элемента 118. Красными квадратами обозначены самые тяжелые ядра: с массой 252 а.е.м. (No, 1962) и 294 а.е.м. (Og, 2004), полученные впервые в Лаборатории ядерных реакций ОИЯИ. Желтым цветом показана область ядер, полученных в реакциях с использованием мишеней из свинца и висмута. Розовое поле – область ядер синтезированных в реакциях с пучком ионов кальция-48. Фон – карта потенциальной энергии ядер в зависимости от содержания протонов и нейтронов, полученная в расчетах макро-микроскопической модели. Цифры и цвет указывают амплитуду структурной поправки (в МэВ) к жидко-капельной энергии ядра.  |
Заключая краткий экскурс в мир сверхтяжёлых, можно отметить, что уйдя от висмута, последнего стабильного элемента, в область больших масс и зарядов, мы наблюдаем удивительную живучесть атомных ядер. В области предельных кулоновских сил дополнительные связи протонов и нейтронов структурного свойства создают в тяжёлом ядре барьер деления и делают тем самым возможным существование сверхтяжёлых элементов.
Эксперименты проводились в Дубне на ускорителе У400 Лаборатории ядерных реакций им. Г.Н. Флерова (ОИЯИ) в сотрудничестве с ВНИИЭФ (Саров, Россия), НИИАР (Димитровград, Россия), а также с Ливерморской и Ок-Риджской национальными лабораториями (США), взявшими на себя труд по наработке мишенного материала и участвовавшими в ряде экспериментов.
ТЯЖЕЛЕЙШИЕ АТОМЫ И ХИМИЯ СВЕРХТЯЖЁЛЫХ ЭЛЕМЕНТОВ
На фотографии (см. рис. 2, а) изображена самая большая (150 м2) Периодическая таблица химических элементов, встроенная в фасад химического факультета Университета г. Мурсия (Испания).** На ней красной рамкой выделены сверхтяжёлые элементы от 112-го до 118-го, полученные в реакциях с кальцием-48, когда в качестве материала мишени использовались тяжёлые изотопы от урана (Z = 92) до калифорния (Z = 98), соответственно***.
В белой рамке находятся дочерние нуклиды – продукты альфа-распада ядер из красной рамки. Они заполняют практически все оставшиеся клетки 7-го периода, вплоть до резерфордия (Z = 104). Дочерние ядра, берущие начало от нейтронно-избыточных материнских изотопов сверхтяжёлых элементов, тоже обогащены нейтронами, что значительно повышает их период полураспада и открывает широкие возможности для исследования химических свойств транс-актиноидов. Подобные исследования элементов, особенно конца 7-го периода, представляют большой интерес. Их химическое поведение может отличаться от более лёгких гомологов из-за релятивистского возрастания массы электронов с ростом заряда ядра. В более лёгких элементах релятивистский эффект проявляется в свойствах благородных металлов: золото – мягкий металл жёлтого цвета – не окисляется, ртуть тоже металл, но жидкий при комнатной температуре. Благородные металлы способны взаимодействовать друг с другом и создавать соединения типа ртуть/золото (амальгама ртути и золота). С увеличением атомного номера элемента и приближением скорости электронов к скорости света эффект будет быстро возрастать, вследствие чего химическое поведение сверхтяжёлых элементов, например, 112-го элемента (Cn), может отличаться от своего лёгкого гомолога – ртути (Hg). В первом эксперименте, проведённом в Дубне (2007), исследовалась именно эта пара гомологов [15]. Измерялась адсорбция Cn и Hg на поверхности золота (Au) при различной температуре на предмет наблюдения различия в образовании соединений [Au-Hg] и [Au-Cn]. Наблюдаемое смещение пика адсорбции в область более низких температур было первым прямым экспериментальным наблюдением релятивистского эффекта в транс-актиноидах. В целом, 112-ый элемент продемонстрировал свою принадлежность 12-й группе Таблицы Менделеева. Но из результатов этого эксперимента и проведенных недавно расчетов [16] были выявлены также отличия физико-химических свойств Cn и Hg, в частности, в температурах их фазовых переходов. Как известно, температура плавления ртути составляет -38.8 °С, температура кипения 353.7 °С, в то время как расчетные значения для Сn заметно отличаются: 10 °С и 67 °С, соответственно. При комнатной температуре, с учетом погрешности измерений, 112-ый элемент будет либо сильно летучей жидкостью, либо газообразным.
В более лёгких элементах релятивистский эффект проявляется в свойствах благородных металлов: золото – мягкий металл жёлтого цвета – не окисляется, ртуть тоже металл, но жидкий при комнатной температуре. Благородные металлы способны взаимодействовать друг с другом и создавать соединения типа ртуть/золото (амальгама ртути и золота). С увеличением атомного номера элемента и приближением скорости электронов к скорости света эффект будет быстро возрастать, вследствие чего химическое поведение сверхтяжёлых элементов, например, 112-го элемента (Cn), может отличаться от своего лёгкого гомолога – ртути (Hg). В первом эксперименте, проведённом в Дубне (2007), исследовалась именно эта пара гомологов [15]. Измерялась адсорбция Cn и Hg на поверхности золота (Au) при различной температуре на предмет наблюдения различия в образовании соединений [Au-Hg] и [Au-Cn]. Наблюдаемое смещение пика адсорбции в область более низких температур было первым прямым экспериментальным наблюдением релятивистского эффекта в транс-актиноидах. В целом, 112-ый элемент продемонстрировал свою принадлежность 12-й группе Таблицы Менделеева. Но из результатов этого эксперимента и проведенных недавно расчетов [16] были выявлены также отличия физико-химических свойств Cn и Hg, в частности, в температурах их фазовых переходов. Как известно, температура плавления ртути составляет -38.8 °С, температура кипения 353.7 °С, в то время как расчетные значения для Сn заметно отличаются: 10 °С и 67 °С, соответственно. При комнатной температуре, с учетом погрешности измерений, 112-ый элемент будет либо сильно летучей жидкостью, либо газообразным.
Но это первый звонок. Дальнейшее увеличение заряда ядра будет более ощутимым. Поэтому, спустя 100 лет после открытия Вильямом Рамзаем радона (1904) [17], последнего до 2004 года представителя семейства благородных газов 18 группы таблицы, мы задаемся сегодня вопросом: а будет ли 118-ый элемент благородным газом? Релятивистский эффект сильнее проявляется на ближайших к ядру электронах, скорость которых максимальна [18-20], что приводит к сжатию внутренних орбит (рис. 3, а). Для внешних электронов “релятивистское сжатие” приводит к экранированию положительного заряда ядра. В этой ситуации необходимо учитывать (пока в виде малых поправок) взаимодействие внешних электронов друг с другом, которое мало в природных элементах и которым пренебрегают в нерелятивистских расчётах. Нетрудно предвидеть, что роль этих поправок будет быстро возрастать с увеличением атомного номера в сверхтяжёлых элементах. Сам расчёт поправок – по сути, задача многих тел – требует огромных вычислительных мощностей. Большие надежды здесь связаны с квантовым компьютером. А пока доступными средствами в различном приближении отрабатываются методы расчёта на известных атомах, которые затем используются для предельно тяжёлых систем. Релятивистский расчёт элементов 18-й группы показывает, что пространственное распределение внешних электронов 118-го элемента [21] существенно размыто по сравнению с радоном и тем более с ксеноном (рис. 3, б). Подобная картина воспроизводится в расчётах В.М. Шабаева и его коллег [22], но указывается одновременно, что 118-й элемент на 94% будет благородным газом. Возможно, и не газом, а твёрдым телом при комнатной температуре [16,23].
3, а). Для внешних электронов “релятивистское сжатие” приводит к экранированию положительного заряда ядра. В этой ситуации необходимо учитывать (пока в виде малых поправок) взаимодействие внешних электронов друг с другом, которое мало в природных элементах и которым пренебрегают в нерелятивистских расчётах. Нетрудно предвидеть, что роль этих поправок будет быстро возрастать с увеличением атомного номера в сверхтяжёлых элементах. Сам расчёт поправок – по сути, задача многих тел – требует огромных вычислительных мощностей. Большие надежды здесь связаны с квантовым компьютером. А пока доступными средствами в различном приближении отрабатываются методы расчёта на известных атомах, которые затем используются для предельно тяжёлых систем. Релятивистский расчёт элементов 18-й группы показывает, что пространственное распределение внешних электронов 118-го элемента [21] существенно размыто по сравнению с радоном и тем более с ксеноном (рис. 3, б). Подобная картина воспроизводится в расчётах В.М. Шабаева и его коллег [22], но указывается одновременно, что 118-й элемент на 94% будет благородным газом. Возможно, и не газом, а твёрдым телом при комнатной температуре [16,23].
Рис. 3, а. Расчетная плотность электронов 118-го элемента (Og) в зависимости от радиуса (логарифмическая шкала) в двух вариантах расчета: в релятивистском (синяя кривая) и не релятивистском (красный пунктир) приближениях. Цифрами на графике указаны электронные оболочки (периоды). Видно сильное сжатие внутренних электронных оболочек, в то время как средний радиус внешних (валентных) электронов мало меняется |
Рис. 3, б. Пространственные распределения (функции локализации) электронов 118-го элемента (Og), полученные в работе [20]. Хорошо видно размытие внешних электронов в сравнении с его гомологами — радоном и ксеноном |
На примере 118-го элемента можно видеть, что в конце 7-го периода у элементов, именуемых сегодня сверхтяжёлыми, появляются отличные от лёгких гомологов признаки. Экспериментальные данные, к сожалению, весьма скудны прежде всего из-за малого количества сверхтяжёлых элементов и короткого времени их жизни. Одно из направлений будущих исследований нацелено на изучение атомной структуры и химических свойств уже синтезированных сверхтяжёлых элементов на новом оборудовании (см. далее).
Экспериментальные данные, к сожалению, весьма скудны прежде всего из-за малого количества сверхтяжёлых элементов и короткого времени их жизни. Одно из направлений будущих исследований нацелено на изучение атомной структуры и химических свойств уже синтезированных сверхтяжёлых элементов на новом оборудовании (см. далее).
Пока не видно принципиальных ограничений для синтеза 119-го и 120-го элементов – начала 8-го периода таблицы. Несмотря на то, что попытки их получения на старых установках в реакциях с ионами титана, хрома и даже железа, предпринятые в разных лабораториях, не увенчались успехом [24-26], это остаётся делом техники. Сложнее будет изучать их химические свойства из-за короткого периода полураспада, исчисляемого долями миллисекунды. Но здесь не ожидается сюрпризов. Большой скачок в химии будет иметь место при переходе от 118-го к 119-му элементу (от последней колонки таблицы к первой). По всей вероятности, 120-й элемент также в целом будет следовать своим лёгким гомологам второй колонки. Отклонения начнутся, скорее всего, после 121-го элемента с различными сценариями дальнейшего продолжения таблицы (рис. 4). Элемент 122 либо откроет новую серию так называемых супер-актиноидов [27], включающую ещё 33 элемента вплоть до 155-го, либо 122-й элемент и все последующие продолжат 8-й период. Но в этом случае групповое различие элементов начнёт быстро исчезать (размываться). Пока же остается только гадать, как будет выглядеть химия атомных гигантов за пределами периодического закона.
Рис. 4. Таблица Д.И. Менделеева с различными вариантами релятивистских расчетов. В синей рамке – сверхтяжёлые элементы, полученные в реакциях с пучком ионов кальция-48. |
ФАБРИКА СВЕРХТЯЖЁЛЫХ ЭЛЕМЕНТОВ
После открытия новых элементов, расположенных на “острове” стабильности, дальнейшее развитие исследований в этой области связано прежде всего с получением сверхтяжёлых нуклидов в значительно бóльших количествах. Спустя 10 лет после первых экспериментов по синтезу 114-го и 116-го элементов по результатам, полученным в опытах с пучком ионов кальция-48, а также в связи с общим прогрессом в смежных областях науки и техники стало ясно, что светимость экспериментов может быть существенно увеличена. Поэтому с 2012 г. мы сильно сократили экспериментальную программу на действующих установках и стали строить новую лабораторию – Фабрику cверхтяжёлых элементов, которая пока не имеет мировых аналогов. Она определяет и тем самым отражает технический уровень всех этапов работы по получению сверхтяжёлых элементов от создания мишеней из трансурановых элементов до доставки сверхтяжёлых нуклидов к экспериментальным физическим и химическим установкам. По достижению проектных параметров возможности Фабрики СТЭ будут превосходить современный уровень в 50–100 раз.
Спустя 10 лет после первых экспериментов по синтезу 114-го и 116-го элементов по результатам, полученным в опытах с пучком ионов кальция-48, а также в связи с общим прогрессом в смежных областях науки и техники стало ясно, что светимость экспериментов может быть существенно увеличена. Поэтому с 2012 г. мы сильно сократили экспериментальную программу на действующих установках и стали строить новую лабораторию – Фабрику cверхтяжёлых элементов, которая пока не имеет мировых аналогов. Она определяет и тем самым отражает технический уровень всех этапов работы по получению сверхтяжёлых элементов от создания мишеней из трансурановых элементов до доставки сверхтяжёлых нуклидов к экспериментальным физическим и химическим установкам. По достижению проектных параметров возможности Фабрики СТЭ будут превосходить современный уровень в 50–100 раз.
Новый комплекс с инфраструктурой для работы с высокорадиоактивными материалами расположен в отдельном строении (рис. 5, а). Там же находится новый сильноточный ускоритель тяжелых ионов – циклотрон DC-280 [28], пуск которого состоялся в марте 2019 года (рис. 5, б). Ускоритель доставляет пучки ионов в три экспериментальных зала, где размещаются сепарирующие каналы, химические и физические установки, а также другое экспериментальное оборудование. В настоящее время идет наладка нового сепаратора и подготовка первого эксперимента.
Рис. 5, а. Строение ускорительного комплекса «Фабрики СТЭ» |
Рис. 5, б. Ускоритель тяжелых ионов — циклотрон DC-280 |
ЭПИЛОГ
За прошедшие 80 лет после открытия нептуния и плутония (1940) – первых искусственных элементов – Периодическая таблица пополнилась ещё 24 рукотворными элементами. Пять самых тяжёлых из них заняли своё место в таблице в последние семь лет.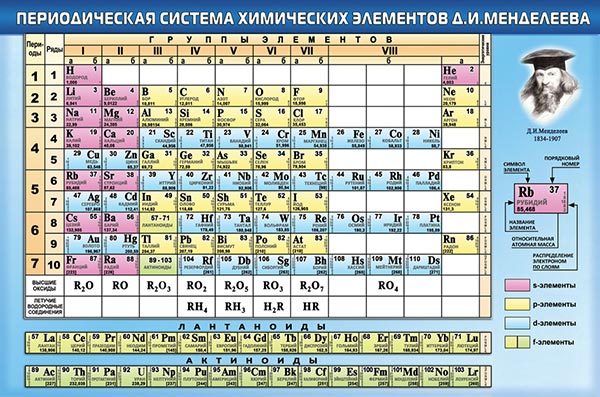 Искусственных элементов, как известно, в природе нет. А сверхтяжёлых элементов, скорее всего, не было и при зарождении Солнечной системы. Они получены в лабораториях в совершенно других условиях (реакциях), чем природные химические элементы. Однако все известные сегодня 118 элементов располагаются в единой таблице в строгом соответствии с периодическим законом, открытым Дмитрием Ивановичем Менделеевым 150 лет назад.
Искусственных элементов, как известно, в природе нет. А сверхтяжёлых элементов, скорее всего, не было и при зарождении Солнечной системы. Они получены в лабораториях в совершенно других условиях (реакциях), чем природные химические элементы. Однако все известные сегодня 118 элементов располагаются в единой таблице в строгом соответствии с периодическим законом, открытым Дмитрием Ивановичем Менделеевым 150 лет назад.
Между тем Международный год Периодической таблицы — IYPT2019, начавший своё шествие в ЮНЕСКО 29 января 2019 г., закончился в Токио (Япония) 5 декабря. Огромное количество статей в научных, научно-популярных и совсем не научных изданиях, удивительный всплеск очень интересных работ в области ядерной физики, химии, атомной физики, астрофизики, истории науки – все посвященные 150-летию открытия Периодической таблицы химических элементов. Год был встречен с невероятным энтузиазмом не только научным миром, но и широкой общественностью. Форумы, конференции, симпозиумы, лекции, собрания научных обществ, академий наук многих стран мира, везде по-разному, но всегда одухотворенно и очень интересно.
Что-то объединяет людей. Быть может, также великие открытия и любовь к науке.
* В то же время в нашей стране теорию ядерного деления независимо развивал Я.И. Френкель [5].
** С 2019 года самая большая периодическая Таблица элементов (660 м2) находится в Австралии в государственном университете Эдит Коуэн (ECU) в г. Перт.
*** К сожалению, калифорний – самый тяжёлый элемент, который может быть получен в ядерном реакторе в количестве, необходимом для изготовления мишени. Для синтеза 119 элемента и более тяжелых придется увеличивать массу и заряд бомбардирующих ионов.
Литература
1. Gamov G. Discussion оn the structure of atomic nuclei// Proc. of the Royal Society A. 1929. № 123. P. 386–387.
2. Gamov G. Zur Quantentheorie des Atomkernes // Zeitschrift fur Physik. 1928. V. 51. № ¾. P. 204–212.
3. Von Weizsäcker C.F. Zur Theorie der Kernmassen// Zeitschrift fur Physik. 1935. V. 96. P. 431.
4. Bohr N., Weeler J.A. The Mechanism of Nuclear Fission // Phys. Rev. 1939. V. 56. P. 426–450.
5. Френкель Я.И. Электрокапиллярная теория расщепления тяжёлых ядер медленными нейтронами // ЖЭТФ. 1939. № 6. С. 641–653.
6. Flerov , Petrjak . Spontaneous Fission of Uranium // Phys. Rev. 1940. V. 58. Р. 89.
7. Seaborg G.T., Loveland W.D. Transuranium Nuclei // Treatise on Heavy-Ion Science / Edited by D.A. Bromley. V. 4. P. 289. N.Y.: Plenum Press, 1985.
8. Polikanov S.M., Druin A.V., Karnaukhov V.A. et al. Spontaneous fission with an anomalously short period // Soviet Physics JETP-USSR. 1962. № 15(6). P.1016–1021.
9. Morita K., Morimoto K., Kaji D. et al. Experiment on the Synthesis of Element 113 in the Reaction 209Bi (70Zn,n)278113 // J. Phys. Soc. Jpn. 2004. V.73. P. 2593–2596.
10. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al., Synthesis of Superheavy Nuclei in the 48Ca+244Pu Reaction // Phys. Rev. Lett. 1999. V. 83. P. 3154–3157.
11. Oganessian Yu.Ts., Utyonkoy V.K., Lobanov Yu.V. et al. Experiments on the synthesis of element 115 in the reaction 243Am(48Ca,xn)291−x115 // Phys. Rev. C. 2004. V. 69. № 021601(R).
12. Oganessian Yu.Ts., Abdullin F.Sh., Bailey P.D. et al. Synthesis of a New Element with Atomic Number Z=117 // Phys. Rev. Lett. 2010. V. 104. № 142502.
13. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al. Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions // Phys. Rev. C. 2006. V. 74. № 044602.
Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions // Phys. Rev. C. 2006. V. 74. № 044602.
14. Oganessian Yu.Ts., Utyonkov V.K. Super-heavy element research // Rep. Prog. Phys. 2015. V. 78. № 036301.
15. Eichler R., Aksenov N.V., Belozerov A.V. et al. Chemical characterization of element 112 // Nature. 2007. V. 447. P. 72–75.
16. Mewes J.-M., Smits O. R., Kresse G. et al. Copernicium: A Relativistic Noble Liquid // Angew. Chem. Int. Ed.2019. V.58, P.17964 – 17968
17. Ramsay W., Soddy F. Further Experiments on the Production of Helium from Radium // Proceedings of the Royal Society of London (1854–1905). 1904. V. 73. P. 346–358.
18. Pershina V. Relativity in the electronic structure of the heaviest elements and its influence on periodicities in properties // Radiochimica Acta. 2019. V. 107. Р. 833–864.
19. Eliav E., Borschevsky A., Kaldor U. Electronic Structure at the Edge of the Periodic Table // Nuclear Physics News. 2019. V. 29. Р. 16–20.
20. Lackenby B.G.C., Dzuba V.A, Flambaum V.V. Atomic structure calculations of superheavy noble element oganesson (Z=118) // Phys.Rev. A. 2018. V. 98. P. 042512.
21. Jerabek P., Schuetrumpf B., Schwerdtfeger P., Nazarewicz W. Electron and Nucleon Localization Functions of Oganesson: Approaching the Thomas-Fermi Limit// Phys. Rev. Lett. 2018. V. 120. Р. 053001.
22. Shabaev V.M., Tupitsyn I.I., Kaygorodov M.Y., Kozhedub Y.S. Localisation of electron states of Oganesson atoms // The 4th International Symposium on Superheavy Elements (SHE2019). Hakone, Japan. Dec.1–5, 2019
23. Giuliani S. A., Matheson Z., Nazarewicz W. et al., Colloquium: Superheavy elements: Oganesson and beyond// Rev. Mod. Phys. 2019. V. 91. No. 1. P.01100.
Mod. Phys. 2019. V. 91. No. 1. P.01100.
24. Düllmann C.E. Superheavy Element Research at TASCA at GSI // Fission and Properties of Neutron-Rich Nuclei. 2013. V. 44. Р. 271–277.
25. Hofmann S., Heinz S., Mann R. et al. Review of even element super-heavy nuclei and search for element 120 // Eur. Phys. J. A. 2016. V. 52. Р. 180.
26. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al. Attempt to produce element 120 in the 244Pu+58Fe reaction // Phys. Rev. C. 2009. V. 79. Р. 024603.
27. Borschevsky A., Pershina V., Eliav E., Kaldor U. Ab initio predictions of atomic properties of element 120 and its lighter group-2 homologues // Phys. Rev. A. 2013. V. 87. P. 022502.
28. Gulbekian G.G., Dmitriev S.N., Itkis M.G. et al. Start-Up of the DC-280 Cyclotron, the Basic Facility of the Factory of Superheavy Elements of the Laboratory of Nuclear Reactions at the Joint Institute for Nuclear Research // Physics of Particles and Nuclei Letters. 2019. V. 16(6). Р. 866–875.
Два новых химических элемента получили «российские» имена – Hi-Tech – Коммерсантъ
Международный союз теоретической и прикладной химии (IUPAC) официально одобрил названия четырех новых элементов таблицы Менделеева — 113-го, 115-го, 117-го и 118-го: нихоний (Nh), московий (Mc), теннессин (Tn), оганессон (Og) соответственно. Первый элемент синтезировали японские ученые, остальные открыты группой российских и американских ученых.
«Следуя традиции, новые элементы названы по географическим названиям или именам ученых (также элементы могут быть названы в честь небесных тел.— “Ъ”)»,— отмечается в сообщении IUPAC. Процедура признания предложенных учеными названий для открытых ими элементов заняла около пяти месяцев. При этом IUPAC официально подтвердил открытие новых элементов (относящихся к седьмому периоду периодической системы) 30 декабря 2015 года.
115-й, 117-й и 118-й элементы были созданы группой ученых российского Объединенного института ядерных исследований (ОИЯИ) в Дубне, Ливерморской национальной лаборатории им. Э. Лоуренса (национальная лаборатория Министерства энергетики США, Ливермор, штат Калифорния) и Окриджской национальной лаборатории (национальная лаборатория Министерства энергетики США, Оук-Ридж, штат Теннесси). Элемент с атомным номером 115 назван московием в честь Московской области, а 118-й получил название оганессон по имени академика РАН научного руководителя лаборатории ядерных реакций ОИЯИ Юрия Оганесяна. 117-й элемент стал теннессином (от названия американского штата Теннесси).
113-й элемент синтезирован учеными японского института RIKEN и получил название нихоний (от «Nihon» — «Япония»). Отметим, что о создании 113-го элемента сообщала в 2014 году коллаборация российско-американских ученых, но Международный союз теоретической и прикладной химии не признал, что открытие элементов состоялось. При этом японские ученые предлагали назвать элемент японием, нисинанием (в честь физика Ёсио Нисины) или рикением (в честь института RIKEN), однако IUPAC рекомендовал нихоний.
Господин Оганесян сообщил “Ъ”, что работа над 115-м, 117-м и 118-м элементами шла более 15 лет: «Только в 1999 году мы увидели первый результат, а заявили об открытии в 2015 году». «Это сверхтяжелые элементы,— объяснил он.— Всегда предполагалось, что в природе таких тяжелых не должно быть, но в 1969 году появилась новая ядерная теория, которая допустила существование очень тяжелых и весьма стабильных элементов».
Говоря о современной процедуре появления названий элементов в таблице Менделеева, Юрий Оганесян объяснил, что она делится на несколько этапов: сначала создается комиссия экспертов (физиков и химиков), которые должны подтвердить факт открытия и определить, каким ученым принадлежит его приоритет, после этого они публикуют информацию об открытии, и в течение полугода это обсуждается в научных кругах. Далее факт открытия официально подтверждается. «Поскольку это касается химических элементов, то далее нужно определить название — этим занимается номенклатурная комиссия IUPAC, которая запрашивает авторов об их предложениях»,— рассказал господин Оганесян И отметил: «Не факт, что название еще одобрят», так как «оно должно одинаково произноситься на всех 130 языках мира, легко должны произноситься и названия химических соединений с этим элементом», а также «символ должен быть удобным». «Все это занимает время»,— подытожил господин Оганесян. Он напомнил, что подобную процедуру группа российско-американских ученых прошла в 2012 году, когда в таблице Менделеева появились синтезированные ими 114-й элемент флеровий (назван в честь основателя лаборатории ядерных реакций ОИЯИ Георгия Флерова) и 116-й элемент ливерморий (название дали «наши американские коллеги»).
Далее факт открытия официально подтверждается. «Поскольку это касается химических элементов, то далее нужно определить название — этим занимается номенклатурная комиссия IUPAC, которая запрашивает авторов об их предложениях»,— рассказал господин Оганесян И отметил: «Не факт, что название еще одобрят», так как «оно должно одинаково произноситься на всех 130 языках мира, легко должны произноситься и названия химических соединений с этим элементом», а также «символ должен быть удобным». «Все это занимает время»,— подытожил господин Оганесян. Он напомнил, что подобную процедуру группа российско-американских ученых прошла в 2012 году, когда в таблице Менделеева появились синтезированные ими 114-й элемент флеровий (назван в честь основателя лаборатории ядерных реакций ОИЯИ Георгия Флерова) и 116-й элемент ливерморий (название дали «наши американские коллеги»).
Валерия Мишина
: Технологии и медиа :: РБК
Химические элементы с атомными номерами 113, 115, 117 и 118 официально добавлены в периодическую таблицу. Открытие трех из них числится за совместной российско-американской коллаборацией, а 113-го элемента — за японцами
Президент Международного союза теоретической и прикладной химии (ИЮПАК) профессор Тацуми Кацуюки выступает на церемонии присвоения имен новым элементам таблицы Менделеева в Центральном доме ученых РАН в Москве, 24 октября 2012 года
Четыре новых химических элемента добавлены в периодическую таблицу, что завершило ее седьмой ряд. Элементы официально верифицированы Международным союзом теоретической и прикладной химии (ИЮПАК).
Элементы официально верифицированы Международным союзом теоретической и прикладной химии (ИЮПАК).
Это первое расширение периодической таблицы с 2011 года, когда были добавлены 114 и 116-й элементы. Впервые принятая периодизация химических элементов по атомному весу была разработана российским ученым Дмитрием Менделеевым в 1869 году.
ИЮПАК присудил честь открытия 115, 117 и 118-го элементов команде российских и американских исследователей из Объединенного института ядерных исследований в Дубне и Ливерморской национальной лаборатории в Калифорнии.
Открывателями 113-го элемента были признаны японские ученые из Института физико-химических исследований «Рикагаку Кенкусё» (Riken).
Первооткрыватели теперь получат право придумать элементам названия и двубуквенные обозначения. На это отводится пять месяцев, после чего названия и символы будут утверждены советом ИЮПАК.
В таблицу Менделеева внесли четыре новых химических элемента
(Видео: Телеканал РБК)
VideoВсе четыре новых элемента были искусственно синтезированы. Элементы тяжелее урана не встречаются в естественной среде. Искусственно созданные сверхтяжелые элементы из конца периодической таблицы обычно существуют лишь доли секунды, а потом распадаются на другие элементы.
Автор
Андрей Кузнецов
Российские ученые готовятся заполнить новую клетку таблицы Менделеева — Российская газета
На очереди еще один новый обитатель периодической системы Менделеева. Уже 119-й! Руководит работами академик Юрий Оганесян. Кстати, его имя носит 118-й элемент. По решению Международного союза чистой и прикладной химии он назван «оганесон». Российский ученый стал вторым (после Г. Сиборга), при жизни которого его именем был назван химический элемент.
Надо подчеркнуть, что в этом году среди кандидатов на Нобелевскую премию многие авторитетные ученые особо выделяли исследователей, которые совершили настоящий научный прорыв, существенно пополнив таблицу Менделеева сразу несколькими новыми элементами. Они считались наиболее вероятными претендентами еще и потому, что по решению ООН в этом году во всем мире отмечалось 150-летие таблицы Менделеева. Но Нобелевский комитет решил иначе…
Юрий Оганесян стал вторым ученым, при жизни которого его именем назван химический элемент
Напомним, что, когда наш великий ученый Дмитрий Иванович Менделеев обнародовал свой знаменитый Периодический закон, было известно лишь 63 элемента. В начале ХХ века был открыт последний из существующих в природе химических элементов. Правда, ряд ученых утверждали, что картина неполная, так как на заре Вселенной элементов было намного больше, но часть не дотянула до наших дней, поскольку период их полного распада меньше, чем возраст Земли.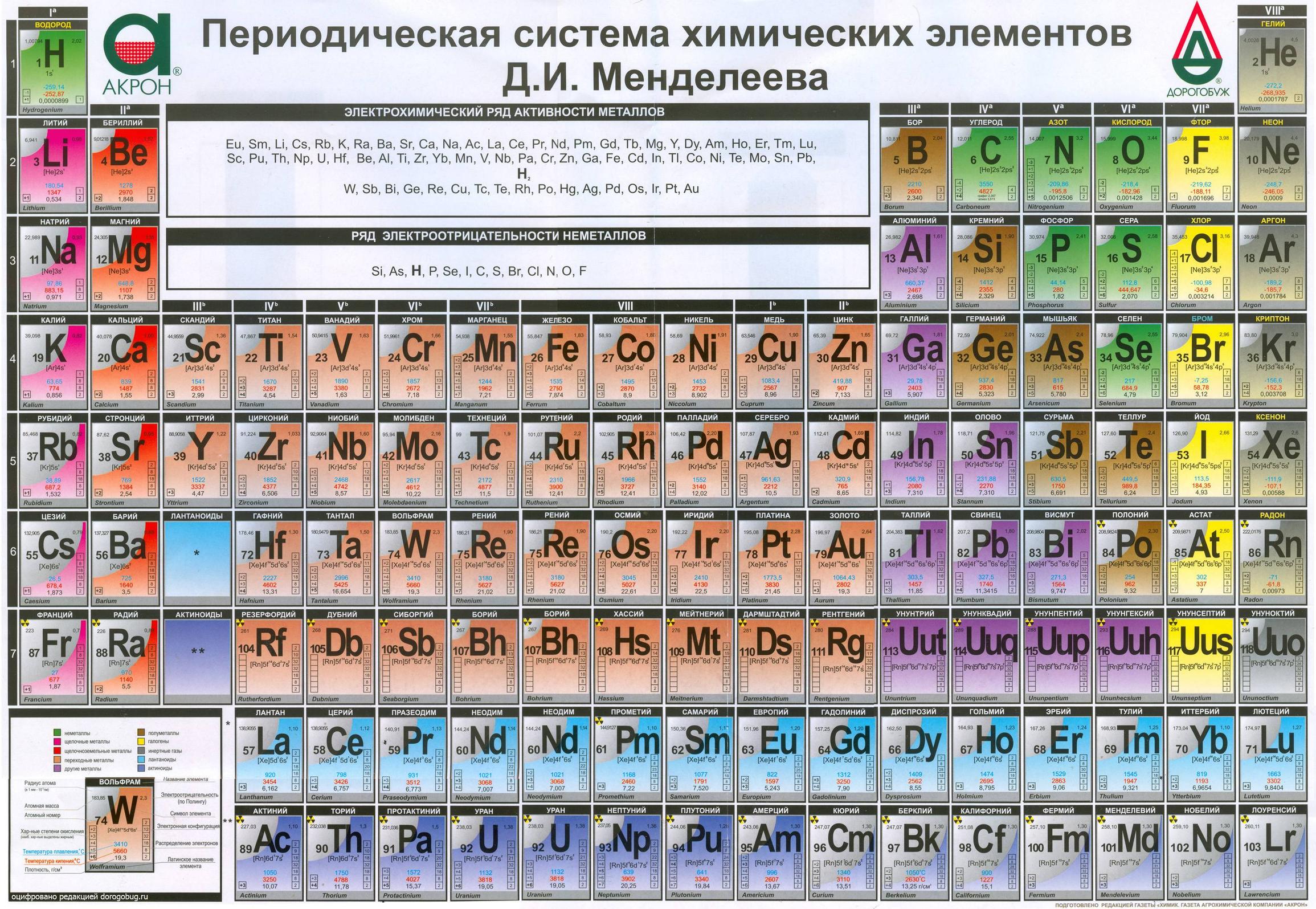 Но даже великий Нильс Бор считал невозможным существование элементов с порядковым номером больше 100. Дело в том, что более тяжелые элементы были крайне неустойчивы. Если переходить от элемента с порядковым номером 92 — урана — к элементу номер 102, нобелию, период полураспада их ядер стремительно уменьшается — от 4,5 миллиарда лет до считанных секунд. Поэтому физики полагали, что продвижение в сторону еще более тяжелых элементов приведет очень быстро к пределу их существования и фактически обозначит границу существования материального мира.
Но даже великий Нильс Бор считал невозможным существование элементов с порядковым номером больше 100. Дело в том, что более тяжелые элементы были крайне неустойчивы. Если переходить от элемента с порядковым номером 92 — урана — к элементу номер 102, нобелию, период полураспада их ядер стремительно уменьшается — от 4,5 миллиарда лет до считанных секунд. Поэтому физики полагали, что продвижение в сторону еще более тяжелых элементов приведет очень быстро к пределу их существования и фактически обозначит границу существования материального мира.
Но в конце 1960-х годов теоретики выдвинули гипотезу о возможном существовании сверхтяжелых элементов. Более того, по их расчетам, время жизни атомных ядер элементов с номерами 110-120 должно было существенно возрастать. Эти «долгожители» создают целую область гипотетических элементов, которую назвали «островом Стабильности» и которая значительно отодвигает ранее обозначенные пределы существования химических элементов. Эта идея захватила ведущие научные центры мира, но осуществить ее оказалось непросто.
В центре внимания всех экспериментов — атомное ядро, состоящее из протонов и нейтронов. Его требовалось «слепить» сверхтяжелым, но чтобы оно прожило как можно дольше, а не распалось уже при рождении. Способ создания таких тяжеловесов был очевиден: бомбардировать ядра тяжелых элементов тяжелыми ионами, которые содержат много нейтронов. А разгонять снаряды надо на мощных ускорителях, чтобы частицы могли преодолеть силы кулоновского отталкивания и слиться с ядрами мишени.
— С 1970-го по 1985 г. во всех ведущих лабораториях мирах, в том числе и у нас в Дубне, пытались получить сверхтяжелые элементы, но это никому не удалось, — рассказывает академик Оганесян. — В итоге сформировалось мнение, что такие попытки обречены на неудачу. Анализируя ситуацию, мы пришли к выводу, что все существующие методы синтеза сверхтяжелых ядер себя исчерпали и следует искать новые подходы к решению трудной задачи.
Такой метод учеными из Дубны был предложен и применен в Германии, в США, Франции, Японии. С его помощью были синтезированы новые элементы с атомными номерами 107, 108, 109, 110, 111 и 112.
С его помощью были синтезированы новые элементы с атомными номерами 107, 108, 109, 110, 111 и 112.
— Меня часто спрашивали: «Вот вы придумали новый метод синтеза. Почему сами его не используете?» — рассказывает Юрий Оганесян. — Дело в том, что он не ведет туда, где находится «остров Стабильности». В ядрах, полученных таким способом, большой дефицит нейтронов. Поэтому поняли, что надо усложнить схему эксперимента, где-то добыть недостающие нейтроны.
И тогда ученые Дубны решили использовать в мишени элементы, в которых содержится максимальный избыток нейтронов, например, самый тяжелый изотоп — плутоний-244, который может быть накоплен в реакторах с высоким потоком нейтронов. А снарядом стали тяжелые ионы кальция-48. В итоге этим методом мы за 15 лет получили шесть новых элементов таблицы Менделеева — 113-й, 114-й, 115-й, 116-й, 117-й, 118-й, — говорит академик Оганесян. — Время их жизни на порядки больше, чем соседей, скажем, 114-й сохраняется не миллисекунды, как 110-й, а десятки и даже сотни секунд.
По его мнению, пока наука только приблизилась к «острову Стабильности», находится у самого его подножия, а уже 120-й и следующие за ним окажутся очень устойчивыми, будут жить долгие годы, а может, и миллионы лет. Но чтобы добраться до таких долгожителей, надо искать новые методы.
Путешествие к «острову Стабильности» ученый намерен продолжить на первой в мире Фабрике сверхтяжелых элементов, которая недавно заработала в Дубне. Уже осенью этого года российские ученые вместе с зарубежными коллегами начнут эксперименты по получению нового 119-го элемента. В планах 120-й и 121-й. И подъем к вершине острова Стабильности.
Между тем
ЮНЕСКО учредило международную премию ЮНЕСКО-России им. Д.И. Менделеева за достижения в области фундаментальных наук. Первое вручение премии состоится уже в 2020 году. Эта награда «призвана подчеркнуть ведущую роль России в области фундаментальных наук». Размер премии составит 500 тыс. долларов и будет вручаться ежегодно двум отдельным лауреатам в размере 250 тыс.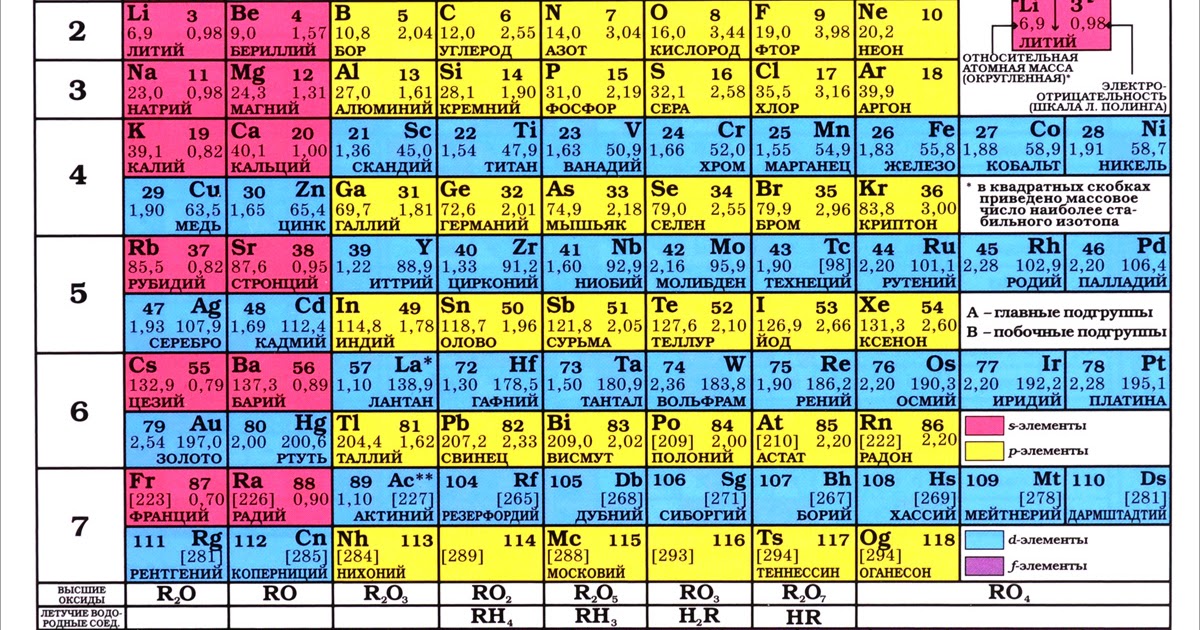 долларов каждому за прорывные открытия, выдающиеся инновации и активное содействие развитию фундаментальных наук. Это единственная и самая крупная премия в области фундаментальных наук в интересах устойчивого развития под эгидой ЮНЕСКО.
долларов каждому за прорывные открытия, выдающиеся инновации и активное содействие развитию фундаментальных наук. Это единственная и самая крупная премия в области фундаментальных наук в интересах устойчивого развития под эгидой ЮНЕСКО.
Впечатляющая наглядность. Заслуги Менделеева не меркнут
Со школьных лет Периодическую таблицу химических элементов Дмитрия
Менделеева мы помним как самое масштабное наглядное пособие – в кабинете
химии она занимала целую стену. Рядом в красивой раме – портрет ее
создателя.
Прошлый год был провозглашен Генеральной ассамблеей ООН Международным годом Периодической таблицы химических элементов (International Year of the Periodic Table of Chemical Elements – IYPT2019) – 150 лет назад великий русский ученый Д.И.Менделеев опубликовал ее первый вариант.
Проведение IYPT2019 поддержали более чем 80 национальных академий наук и исследовательских обществ. Открыли Международный год Периодической таблицы химических элементов 29 января 2019 года в Париже, в штаб-квартире ЮНЕСКО. В России Международный год взял старт 6 февраля на заседании в Президиуме РАН. Событие максимально приблизили к 8 февраля – дню рождения Дмитрия Ивановича и Дню российской науки.
Историки науки считают датой открытия Периодического закона 1 марта 1869 года, когда наш великий соотечественник Д.И.Менделеев завершил работу над исследованием «Опыт системы на основе элементов от их атомного веса и химического сходства». Этому событию предшествовали усилия многих выдающихся исследователей по всему миру, сделавших несколько попыток систематизации химических элементов.
Д.И.Менделеев опубликовал свой
первый вариант Периодической таблицы в 1869 году в статье «Соотношение
свойств с атомным весом элементов». Еще ранее – в феврале того же года –
научное извещение о сделанном открытии разослал ведущим химикам мира.
Таблица включала все известные в то время химические элементы (61) и
была построена так, что химические свойства объяснялись атомным весом. Он также поставил под сомнение атомный вес некоторых уже известных
элементов и предсказал, что есть определенные элементы, которые только
предстоит обнаружить.
Он также поставил под сомнение атомный вес некоторых уже известных
элементов и предсказал, что есть определенные элементы, которые только
предстоит обнаружить.
Недавно журнал New Yorker опубликовал статью Неймы Джахроми «Истории, скрытые в Периодической таблице», где отмечен известный факт о том, что «Менделеев точно предсказал существование тогда еще не открытых элементов, таких как галлий и германий, и предсказал их взаимодействие с другими элементами». В статье приводятся также слова Эрика Шерри из Калифорнийского университета (Лос-Анджелес), считавшего, что «русский химик был главным рассказчиком и по сравнению с Мейером и другими конкурентами более эффективным евангелистом для периодической системы».
Бытовала легенда, что идея системы химических элементов пришла к Менделееву во сне. Однако сам ученый, отвечая однажды на вопрос, как он открыл периодическую систему, сказал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сидел – и вдруг готово».
В начале 1940-х годов после открытия первых
искусственных элементов – нептуния и плутония – вопрос о пределах
существования элементов и свойствах распада ядер тяжелее урана вызвал
исключительный интерес фундаментальной науки к строению материи и
характеру ее превращений. Многие десятилетия подобные исследования
проводились и проводятся в крупных научных центрах Германии, США,
Японии, Франции и Лаборатории ядерных реакций имени Г.Н.Флерова
Объединенного института ядерных исследований, которая была организована в
1957 году и вскоре оснащена ускорителем тяжелых ионов У-300. Это
положило начало новому направлению в ядерной физике – физике тяжелых
ионов. Международные союзы чистой и прикладной физики (IUPAP) и химии
(IUPAC) признали приоритет Дубны в открытии 102-го и 105-го элементов,
совместные с Национальной лабораторией в (Беркли, США) открытия 103-го и
104-го и отметили большой вклад коллектива ОИЯИ в открытии 106-го и
108-го элементов. В 1997 году на Генеральной Ассамблее IUPAC 105-й
элемент был назван дубний.
К концу ХХ столетия ученым в Лаборатории ядерных реакций Дубны удалось продвинуться в синтезе сверхтяжелых элементов и понимании проблемы их стабильности. Благодаря достигнутой высокой эффективности ускорения тяжелых ионных пучков и значительному улучшению экспериментальных методов впервые в 2000-2012 годах были синтезированы самые тяжелые (сверхтяжелые) элементы с атомными номерами 113-118.
Для элемента 118 сотрудничающие команды первооткрывателей Объединенного института ядерных исследований (Россия) и Национальной лаборатории Лоуренса Ливермора (США) предложили название oganesson и символ Og. Факт, свидетельствующий о признании новаторской роли их руководителя профессора Юрия Оганесяна в исследовании трансактиноидных элементов. Его многочисленные достижения включают открытие сверхтяжелых элементов, значительные успехи в изучении физики сверхтяжелых ядер, в том числе получение экспериментальных данных о существовании предсказанного теорией «Острова стабильности» сверхтяжелых элементов. («Остров стабильности» – это группа тяжелых нуклидов, расположенных далеко от известной области ядер, время жизни которых дольше, чем у их более легких предшественников. Предполагается, что благодаря этой особенности они могут обладать высокой стабильностью и даже существовать в природе. Согласно теории, изотопы сверхтяжелых элементов, обладающие повышенной стабильностью, образуют на карте нуклидов большую зону в виде острова с вершиной, расположенной вблизи «ядра-долгожителя» с числом протонов Z=110 и нейтронов N=182. – Прим. ред.)
Элемент 118 завершает 7-ю строку Периодической таблицы. Закроет ли он Периодическую таблицу элементов?
«В последние годы ученые создали сверхтяжелые элементы, которые
угрожают разбить Периодическую таблицу, – пишет Н.Джахроми. – В 1998
году российские ученые создали новый элемент, который исчез спустя чуть
больше секунды. Главный русский охотник за стихиями Ю.Оганесян назвал
его в честь своего покойного наставника Г. Флерова. В 2016 году
Ю.Оганесян получил и свое имя на атоме. Его элемент, который в настоящее
время является последним в таблице Менделеева, был также короткой
вспышкой в исследовательском оборудовании. «Такие элементы, как флеровий
и оганесон (№114 и №118 соответственно), могут означать «конец химии,
какой мы ее знаем», – приводит автор статьи слова Кита Чапмена из
английского журнала Chemistry World. Первоначально предполагалось, что
таблица описывает строительные блоки природы. Но поскольку охотники за
элементами стали их создателями, смысл таблицы изменился. Теперь она
описывает, что возможно в дополнение к тому, что просто существует».
Флерова. В 2016 году
Ю.Оганесян получил и свое имя на атоме. Его элемент, который в настоящее
время является последним в таблице Менделеева, был также короткой
вспышкой в исследовательском оборудовании. «Такие элементы, как флеровий
и оганесон (№114 и №118 соответственно), могут означать «конец химии,
какой мы ее знаем», – приводит автор статьи слова Кита Чапмена из
английского журнала Chemistry World. Первоначально предполагалось, что
таблица описывает строительные блоки природы. Но поскольку охотники за
элементами стали их создателями, смысл таблицы изменился. Теперь она
описывает, что возможно в дополнение к тому, что просто существует».
Технеций, первый искусственный элемент, все еще используется в лечении рака во всем мире, отмечено в New Yorker. Теоретически более новые элементы могут быть аналогичным образом полезны: например, флеровий размером с горошину «мог бы обеспечить город энергией», если бы его удалось стабилизировать.
В рамках Международного года Периодической таблицы химических элементов в России проведены более пятисот научно-популярных и образовательных мероприятий, цель которых – привлечение внимания к науке и ее достижениям. На закрытии Международного года в МГУ Александр Сергеев, президент РАН, подчеркнул, что главным результатом стало пробужденное в юных умах здорового любопытства к тому, как много значат химические элементы в нашей жизни.
Оценить завершившийся Международный год Периодической таблицы химических элементов для газеты «Поиск» любезно согласился вице-президент РАН академик Алексей Хохлов:
– Проведено много мероприятий,
вызвавших очень большой интерес научного сообщества, причем как в
России, так и за рубежом. В том числе конференций по органической и
неорганической химии, по ряду других областей науки, связанных с
Периодической таблицей химических элементов, более чем в 80 странах
мира, в 295 городах. Имя российского ученого звучало на выставках нового
типа – интерактивных – и открытых уроках, на научных фестивалях и
других мероприятиях, проводимых по всему земному шару. Во многих странах
были организованы выставки, посвященные Периодической таблице,
отмечался вклад в ее создание Д.И.Менделеева. Среди наиболее ярких
событий Международного года – Всероссийский фестиваль NAUKA 0+,
Всероссийский съезд учителей химии, XXI Менделеевский съезд по общей и
прикладной химии, где приняли участие почти три тысячи исследователей из
40 стан планеты.
Во многих странах
были организованы выставки, посвященные Периодической таблице,
отмечался вклад в ее создание Д.И.Менделеева. Среди наиболее ярких
событий Международного года – Всероссийский фестиваль NAUKA 0+,
Всероссийский съезд учителей химии, XXI Менделеевский съезд по общей и
прикладной химии, где приняли участие почти три тысячи исследователей из
40 стан планеты.
Открытие Д.И.Менделеева, его значение для науки получили широкий резонанс, – подчеркнул вице-президент РАН.
Итог года весьма положительный: многие молодые люди заинтересовались химией и другими науками, связанными с периодической системой химических элементов Менделеева.
Алексей Ремович, президент РАН неоднократно высказывал надежду на то, что в 2019 году Периодическая таблица официально на международном уровне получит имя Дмитрия Менделеева. Не получила.
Не соглашусь с вами. То или иное открытие связывается с именем первооткрывателя не в силу изданного кем-то «декрета», этот факт закрепляется мнением научного сообщества. В результате всех мероприятий года стала очевидной ключевая роль Д.И.Менделеева в создании Периодической таблицы химических элементов. Не случайно его портрет помещен на эмблему Года таблицы, которую во многих странах так и зовут – Менделеевской. Главное, что роль Д.И.Менделеева, которая подчеркивалась и в отечественных публикациях на эту тему, и в зарубежных, стала более выпуклой, заметной для молодежи, прежде всего студентов, аспирантов, по всему миру. И в умах людей, интересующихся химией, Периодическая таблица, конечно, ассоциируется прежде всего с именем Д.Менделеева.
Как вы думаете, эту таблицу когда-нибудь заполнят или этот процесс бесконечен, как жизнь?
Есть
предсказание о существовании «острова стабильности» при более высоких
зарядах атомного ядра. Так что, по крайней мере, до тех пор, пока мы не
дойдем до этих значений, таблица Менделеева, думаю, будет расширяться.
Определенно будет расширяться, – продолжил тему академик Ю.Оганесян, научный руководитель Лаборатории ядерных реакций им. Г.Н.Флерова ОИЯИ.
Ядра могут иметь массу более 300, а количество элементов – более 118. На примере 118-го видно, что у элементов, именуемых сегодня сверхтяжелыми, уже появляются признаки, отличающие их от легких гомологов. Экспериментальные данные здесь, к сожалению, весьма скудны, прежде всего из-за малого их количества и краткого времени жизни. Одно из направлений будущих исследований – изучение атомной структуры и химических свойств уже синтезированных сверхтяжелых элементов. Сложнее организовать изучение их химических свойств даже на новом оборудовании из-за короткого периода полураспада, исчисляемого долями миллисекунды. Пока не видно и принципиальных ограничений для синтеза 119-го и 120-го элементов – начала 8-го периода таблицы. Несмотря на то что некоторые попытки их получения на старых установках совершались, например, в разных лабораториях в реакциях с ионами титана, хрома и даже железа, усилия не увенчались успехом. Но это – дело техники. Сложнее с изучением химических свойств будущих сверхтяжелых элементов, ведь их период полураспада исчисляется долями миллисекунды. Но и здесь особых сюрпризов не ожидается. Надо работать.
То есть выход за пределы 118-го элемента – дело будущего?
Возможно. Мы полагаем, что элемент 122 либо откроет новую, так называемую серию суперактиноидов, включающую еще 33 элемента вплоть до 155-го, либо 122-й элемент и все последующие продолжат 8-й период. Но в этом случае групповое различие элементов будет быстро исчезать или, как говорят ученые, размываться. Так что пока остается только гадать, как может выглядеть химия атомных гигантов за пределами Периодического закона.
Для новых открытий определенно требуется соответствующее оборудование.
Оно
теперь есть. С 2012 года мы сильно сократили экспериментальную
программу на действующих установках и начали строить новую лабораторию,
получившую название ФСЭ – «Фабрика сверхтяжелых элементов». Пока она не
имеет аналогов в мире и отражает технический уровень всех этапов работы
по получению сверхтяжелых элементов: от создания мишеней из
трансурановых элементов до доставки сверхтяжелых нуклидов к
экспериментальным физическим и химическим установкам. По выходу на
проектный уровень возможности ФСЭ превзойдут существующий уровень в
50-100 раз.
Пока она не
имеет аналогов в мире и отражает технический уровень всех этапов работы
по получению сверхтяжелых элементов: от создания мишеней из
трансурановых элементов до доставки сверхтяжелых нуклидов к
экспериментальным физическим и химическим установкам. По выходу на
проектный уровень возможности ФСЭ превзойдут существующий уровень в
50-100 раз.
Юрий Цолакович, за 80 лет после открытия нептуния и плутония – первых искусственных элементов – таблица пополнилась еще 24 названиями. Пять самых тяжелых элементов вписаны в нее за последние 7 лет. Запуск ФСЭ спровоцирует «ревизию» Периодического закона?
Вряд ли. В природе сверхтяжелых элементов пока не нашли, и, вероятнее всего, что самых тяжелых не было даже при зарождении Солнечной системы. Однако все 118 известных сегодня науке элементов располагаются в таблице строго соответственно Периодическому закону, сформулированному полтора века назад Д.И.Менделеевым. Лучше всего ответил на этот вопрос сам ученый. «Я думаю, что она (таблица) еще будет меняться, но совсем не уйдет, останется», – говорил он. Как в воду глядел.
Подготовил Андрей СУББОТИН
В ЮНЕСКО дан старт Международному году Периодической таблицы химических элементов
В торжественном мероприятии приняли участие министры науки и образования руководители международных организаций и научных обществ, в том числе министр науки и высшего образования России Михаил Котюков, президент РАН Александр Сергеев и гендиректор министерства высшего образования, науки и инноваций Франции Ален Беретц.
Но главными действующими лицами дня стали ученые – те, благодаря кому таблица Менделеева продолжает пополняться новыми элементами. Особый интерес вызвали выступления лауреата Нобелевской премии по химии 2016 года Бернарда Феринга и российского академика Юрия Оганесяна – ученого, чей вклад в науку велик настолько, что 118 элемент таблицы назван в его честь оганесоном.
Когда 1 марта 1869 года Менделеев закончил свой труд «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», было известно всего около 60 элементов. Сегодня в таблице — 118 элементов, из которых первые 94 встречаются в природе, а остальные 24 являются синтетическими.
Сегодня в таблице — 118 элементов, из которых первые 94 встречаются в природе, а остальные 24 являются синтетическими.
В поисках новых элементов были разработаны действенные квантовые прогностические методы, определены новые химические явления, проводятся исследования в космосе.
В программе Международного года — большое число мероприятий: симпозиумы, круглые столы, научно-практические конференции, которые проведут во многих странах мира.
О том, как год Периодической таблицы будут отмечать на родине ученого Службе новостей ООН рассказал Александр Мажуга, ректор Российского химико-технологического университета им. Д.И.Менделеева:
«В России открытие года пройдет 6 февраля в здании Российской академии наук. По всему году практически все учебные заведения формируют свою повестку празднования. А крупным мероприятием для всех химиков будет Менделеевский съезд, который пройдет с 9 по 13 сентября в Санкт-Петербурге, где будут представлены доклады ученых как из нашей страны, так и нобелевских лауреатов, которые приезжают для того, чтобы обменяться опытом и поделиться новыми разработками и обсудить науку».
Международный год Периодической таблицы химических элементов был провозглашен Генеральной Ассамблеей ООН. Его проведение координирует ЮНЕСКО совместно с целым рядом международных научных организаций.
«Крестины» 114-го и 116-го элементов таблицы Менделеева состоятся в Москве 24 октября
Торжественная церемония присвоения наименований 114-му и 116-му элементам таблицы Менделеева состоится в Москве 24 октября, сообщил РИА Новости Сергей Дмитриев, директор Лаборатории ядерных реакций имени Флерова, где они были получены.
Элементы с атомными номерами 114 и 116 были впервые синтезированы на циклотроне Лаборатории ядерных реакций имени Флерова в Объединенном институте ядерных исследований (ОИЯИ) в подмосковной Дубне.
Эти эксперименты проводила группа ученых ЛЯР ОИЯИ под руководством академика Юрия Оганесяна при участии американских коллег из Ливерморской национальной лаборатории.
Элемент под номером 114 был получен в 2000 году путем бомбардировки на ускорителе мишени из плутония-242 ядрами кальция-48, а 116-й элемент — в 2004 году в реакции кальция-48 и кюрия-245.
В мае 2012 года Международный союз теоретической и прикладной химии (ИЮПАК) принял предложения, внесенные первооткрывателями в декабре 2011 года и присвоил 114-му элементу наименование «флеровий», а 116-му — «ливерморий», закрепил за новыми элементами химическим обозначения Fl и Lv.
В среду, 24 октября, в Москве в Центральном Доме ученых РАН состоится официальная церемония «имянаречения».
Флеровий получил свое название в честь Лаборатории ядерных реакций имени Флерова ОИЯИ, являющейся признанным лидером в области синтеза сверхтяжелых элементов.
Георгий Флеров — советский физик-ядерщик, специалист в области деления ядер, синтеза новых химических элементов, новых видов радиоактивности. Участник создания советского ядерного оружия. В 1940 году совместно с Константином Петржаком открыл новый тип радиоактивных превращений — спонтанное деление ядер урана. Благодаря идеям Флерова в ОИЯИ был получен целый ряд химических элементов.
Ливерморий (Livermorium, Lv) предложено назвать в честь Ливерморской национальной лаборатории им. Лоуренса и места ее расположения, города Ливермор в штате Калифорния. Его ученые уже более 20 лет участвуют в экспериментах по синтезу новых элементов, проводимых в Дубне.
Новая совместная рабочая группа, учрежденная бюро ИЮПАК, начала работу по установлению приоритета в получении других пока безымянных сверхтяжелых элементов — 113-го, 115-го, 117-го и 118-го.
Официально признанные первооткрыватели получат право предлагать для них названия.
В июне нынешнего года ученые из Дубны подали заявку в ИЮПАК на признание 113, 115, 117 и 118 элементов — все они были впервые синтезированы в ОИЯИ.
Расшифровка: Химия в ее элементе: хром(Promo) Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Meera Senthilingam На этой неделе элемент, который придает блеск и ценность минералам благодаря красочным характеристикам его компонентов. Christopher Blanford В западном мире красочная история хрома начинается, что вполне уместно, в дальнем конце видимого спектра с красно-оранжевого минерала, который его первооткрыватель назвал «сибирский красный свинец» Геолог 18 века Иоганн Леманн. Хотя до создания периодической таблицы Менделеева к тому времени еще оставалось почти столетие, ученые всего мира быстро открывали новые элементы — 30% встречающихся в природе элементов были впервые изолированы между 1775 и 1825 годами.Именно в середине этой волны открытий, более чем через 35 лет после того, как был впервые обнаружен сибирский красный свинец, французский химик Луи Воклен показал, что этот минерал, теперь известный как крокоит, содержит ранее неизвестный химический элемент. Для выделения хрома Воклену потребовалось несколько шагов. Сначала он смешал раствор крокоита с карбонатом калия, чтобы осадить свинец. Затем он разложил лимонно-желтый промежуточный хромат в кислоте и, наконец, удалил связанный кислород путем нагревания с углеродом, оставив после себя элементарный хром. Название этого нового элемента обсуждалось среди его друзей, которые предложили «хром» от греческого слова «цвет» из-за окраски его соединений. Хотя он сначала возражал против этого названия, потому что сам металл не имел характерного цвета, мнение его друзей победило. Когда Воклен представил свой бледно-серый металл Французской академии наук, он прокомментировал хрупкость металла, устойчивость к кислотам и неспособность расплавиться. Он считал, что эти свойства делают его слишком трудным для работы и, таким образом, ограничивают его применение в качестве металла.Однако он предположил, что соединения хрома будут широко использоваться в качестве красивых ярко окрашенных пигментов. Из всех этих пигментов выделяется один из них. Я химик, который родился, вырос и получил образование на Среднем Западе Соединенных Штатов, поэтому знаковые желтые школьные автобусы в Северной Америке были знакомыми достопримечательностями. Желтый хром, также известный как «желтый школьный автобус», был принят в 1939 году для всех школьных автобусов США, чтобы обеспечить высокую контрастность и видимость в сумерки. Тем не менее, присутствие токсичного свинца и шестивалентного хрома, известных Эрин Брокович, привело к тому, что он был в значительной степени заменен семейством азокрасителей, известных как пигментные желтые, хотя хромовый желтый все еще используется в некоторых морских и промышленных применениях. Из всех природных образований хрома мне больше всего нравятся драгоценные камни, след элемента которых добавляет яркости. Как корунд, берилл и кризоберилл, эти оксиды металлов являются бесцветными и малоизвестными минералами. Но добавьте немного хрома, и они станут рубином, изумрудом и александритом. Химический инструмент теории кристаллического поля, который моделирует электронную структуру комплексов переходных металлов, обеспечивает удивительно точный способ описания и предсказания источника и изменчивости цвета в соединениях хрома.В рубине, который представляет собой оксид алюминия, в котором несколько частей на тысячу ионов алюминия заменены ионами хрома (III), атомы хрома окружены шестью атомами кислорода. Ион Cr3 + примерно на 26% больше, чем ион Al3 +, который он заменяет. Таким образом, когда к оксиду алюминия добавляется больше хрома, октаэдрическая среда вокруг хрома искажается, и две полосы поглощения смещаются в сторону красного цвета.В оксиде алюминия, в котором от 20 до 40% атомов алюминия заменены на хром, поглощенные и прошедшие цвета меняются местами, и мы видим этот комплекс как зеленый, превращая синтетический рубин в зеленый сапфир. Мой следующий драгоценный камень, изумруд, изготовлен из оксида кремния, алюминия и бериллия. Он имеет такую же замену иона хрома на ион алюминия и аналогичное искаженное октаэдрическое расположение кислорода вокруг хрома, придающее изумрудам их характерный зеленый цвет, как у зеленых сапфиров. Из драгоценных камней хрома александрит мне больше всего нравится. Его камни сильно плеохроичны. То есть они поглощают волны разной длины в зависимости от направления и поляризации падающего на них света. Итак, в зависимости от ориентации драгоценного камня цвет александрита варьируется от красно-оранжевого до желтого и изумрудно-зеленого. Его цвет также меняется в зависимости от того, рассматривается ли он при дневном свете или в теплых красных тонах свечей. При переходе от дневного света к свету свечи лучшие экземпляры меняют цвет с ярко-зеленого на огненно-красный.Мелкие драгоценные камни меняют цвет от тускло-зеленого до мутно-кроваво-красного. За пределами этой радуги соединений хрома хром помогает предотвратить особенно нежелательный цвет: коричневый ржавчина. В коррозионно-стойких или «нержавеющих» сталях не менее 11% массы составляет хром. Легированный хром реагирует с кислородом, образуя прозрачный наноскопический слой оксида, который создает барьер для дальнейшего проникновения кислорода и, таким образом, предотвращает появление румяных хлопьевидных продуктов окисления железа. Учитывая такое широкое использование комплексов хрома, неудивительно, что я скажу вам, что менее половины процента производимого хрома составляет хром в его элементарной форме.Так что в некоторой степени предсказание Воклена два столетия назад об ограниченной полезности элементарного хрома оказалось верным. С другой стороны, первая картина хрома (после драгоценных камней, конечно) — это когда он находится в своей металлической форме, например, для зеркальной коррозии и износостойких «хромированных» поверхностей шарикоподшипников и блестящих серебристых отделка деталей автомобиля. Meera Senthilingam Таким образом, он блестящий и красочный, а также устойчивый к коррозии и износу.Не думаю, что я бы сказал, что хром имеет ограниченное применение, не так ли? Это был Кристофер Бланфорд из Оксфордского университета со сложной и яркой химией хрома. На следующей неделе планетарный элемент. Брайан Клегг Мы настолько знакомы с ураном и плутонием, что легко не заметить, что они названы в честь седьмой и девятой планет солнечной системы. (По крайней мере, Плутон был девятой планетой, пока не лишился своего статуса в 2006 году.) Между этими планетами находится Нептун, а промежуток между двумя элементами оставляет место для их относительно невоспетого кузена, нептуния — элемента номер 93 в периодической шкале. Таблица.В июне 1940 года американские физики Эдвин Макмиллан и Филип Абельсон, работающие в Радиационной лаборатории Беркли, написали статью, описывающую реакцию урана, которая была обнаружена при бомбардировке его нейтронами с помощью циклотронного ускорителя частиц. Примечательно, что открыто опубликованная статья Беркли покажет первый шаг к преодолению одного из самых больших препятствий на пути создания атомной бомбы. Meera Senthilingam И Брайан Клегг расскажет, как это препятствие было преодолено в программе Chemistry in its Element на следующей неделе. (Промо) (Окончание промо) |
хром | Использование, свойства и факты
Хром (Cr) , химический элемент 6-й группы (VIb) периодической таблицы, твердый металл серо-стального цвета, который требует полировки и используется в сплавах для повышения прочности и коррозионной стойкости.Хром был открыт (1797) французским химиком Николя-Луи Вокленом и выделен как металл год спустя; он был назван в честь его разноцветных соединений. Зеленый цвет изумруда, змеевика, хромовой слюды и красный цвет рубина обусловлены небольшим количеством хрома. Название элемента хром (от греческого chrōmos , «цвет») означает ярко выраженную и разнообразную окраску соединений хрома.
хромСвойства хрома.
Британская энциклопедия, Inc.Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 24 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| атомный вес | 51,9961 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| точка плавления | 1890 ° C (3434 ° F)
Встречаемость, использование и свойства Хром — элемент, который присутствует в относительно большом количестве в земной коре; свободный металл никогда не встречается в природе. Для получения чистого хрома хромит сначала обрабатывают расплавленной щелочью и кислородом, превращая весь хром в хромат щелочного металла, а последний растворяют в воде и в конечном итоге осаждают в виде дихромата натрия, Na 2 Cr 2 O 7 . Затем дихромат восстанавливают углеродом до полуторного оксида хрома, Cr 2 O 3 , и этот оксид, в свою очередь, восстанавливают алюминием с получением металлического хрома. Хром добавляют к железу и никелю в форме феррохрома для получения сплавов, которые отличаются высокой стойкостью к коррозии и окислению.Используется в небольших количествах, сталь упрочняет хром. Нержавеющие стали — это сплавы хрома и железа, в которых содержание хрома колеблется от 10 до 26 процентов. Хромовые сплавы используются для производства таких продуктов, как маслопроводы, отделка автомобилей и столовые приборы. Хромит используется как огнеупор и как сырье для производства хромовых химикатов. Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас Металл белый, твердый, блестящий и хрупкий, чрезвычайно устойчив к обычным коррозионным реагентам; это сопротивление объясняет его широкое использование в качестве гальванического защитного покрытия.При повышенных температурах хром соединяется непосредственно с галогенами или с серой, кремнием, бором, азотом, углеродом или кислородом. (Для дополнительной обработки металлического хрома и его производства см. Природный хром состоит из смеси четырех стабильных изотопов: хрома-52 (83,76 процента), хрома-53 (9,55 процента), хрома-50. (4,31 процента) и хром-54 (2,38 процента). Металл парамагнитен (слабо притягивается к магниту). Он существует в двух формах: объемно-центрированной кубической (альфа) и гексагональной плотноупакованной (бета).При комнатной температуре хром медленно растворяется в соляной и разбавленной серной кислотах. Некоторые окислители образуют тонкий слой инертного оксида на металле, что делает его пассивным также для разбавленных минеральных кислот, таких как серная, азотная или холодная царская водка. При обычных температурах металл не реагирует на морскую воду, влажный или сухой воздух. Крупнейшие производители хрома включают ЮАР, Индию, Казахстан и Турцию. Основные соединенияНаиболее распространенные степени окисления хрома: +6, +3 и +2.Однако известно несколько стабильных соединений в состояниях +5, +4 и +1. В степени окисления +6 наиболее важными частицами, образованными хромом, являются хромат CrO 4 2- и дихромат Cr 2 O 7 2- ионы. Эти ионы составляют основу ряда промышленно важных солей. Среди них хромат натрия Na 2 CrO 4 и дихромат натрия Na 2 Cr 2 O 7 , которые используются при дублении кожи, при обработке поверхности металлов и в качестве катализаторов в различных промышленных предприятиях. процессы. Хром образует несколько коммерчески ценных кислородных соединений, наиболее важным из которых является оксид хрома, обычно называемый триоксидом хрома или хромовой кислотой, CrO 3 , в котором хром находится в степени окисления +6. Оранжево-красное кристаллическое вещество хромовая кислота постепенно разжижается при воздействии влажного воздуха. Обычно его получают обработкой дихромата натрия серной кислотой. Хромовая кислота используется в основном для хромирования, но также используется в качестве красителя в керамике. Другим важным кислородным соединением является оксид хрома, также известный как полуторный оксид хрома или оксид хрома, Cr 2 O 3 , в котором хром находится в степени окисления +3. Его получают прокаливанием бихромата натрия в присутствии углерода или серы. Оксид хрома представляет собой зеленый порошок и широко используется в качестве пигмента; его гидратная форма, известная как зеленый цвет Гинье, используется, когда требуется химическая и термостойкость. Эрик ГрегерсенУзнайте больше в этих связанных статьях Britannica:
Факты о хроме | Живая наукаИзвестный своим серебристым, блестящим внешним видом, хром используется для покрытия автомобилей, печей и других приборов, чтобы защитить их от коррозии и улучшить их внешний вид. высокая температура плавления Chromium и стабильная структура также делает его полезным в текстильной и огнеупорной промышленности.В сочетании с другими элементами хром дает яркие цвета и используется в качестве красителя, за что первоначально он получил свое название от греческого слова chroma , означающего «цвет». В природе встречается в соединениях земной коры. Однако потребление большого количества хрома в загрязненной питьевой воде или вдыхание паров нагретого элемента может вызвать язвы, рак и другие проблемы со здоровьем. Только факты
Открытие хром Французский химик Луи Николя Воклен впервые выделил хром из ярко-красного минерала под названием сибирский красный свинец, ныне известного как хромат свинца (PbCrO 4 ), в 1797 году. Источники хромаХром является 21-м наиболее распространенным элементом, обнаруженным в земной коре, но он не встречается в форме свободного металла.По словам Роберта Э. Кребса в своей книге «История и использование химических элементов нашей Земли: справочное руководство» (Greenwood Publishing Group, 2006), он в основном находится в хромитовой руде. Хромит добывается в Зимбабве, России, Новой Зеландии, Турции, Иране, Албании, Финляндии, на Филиппинах и на Мадагаскаре. По данным Эмсли, ежегодно производится около 20 000 тонн металлического хрома, и в Гренландии, Канаде и Соединенных Штатах до сих пор остается около миллиарда тонн неразработанных месторождений.По данным лаборатории Джефферсона, металлический хром затем получают путем нагревания хромитовой руды в присутствии алюминия или кремния. Свойства хромаХром является переходным металлом шестой группы Периодической таблицы элементов. В чистом виде хром — это серебристый, блестящий, твердый металл с высокой степенью полировки, идеально подходящий для гальваники. По данным Лос-Аламосской национальной лаборатории, наиболее важными соединениями хрома являются хроматы натрия и калия, бихроматы, а также хромовые квасцы калия и аммония.Соединения хрома токсичны, и с ними следует обращаться осторожно. Все соединения хрома ярко окрашены и используются в качестве пигментов — ярко-зеленого, желтого, красного и оранжевого. По данным Королевского химического общества (RSC), рубины имеют красный цвет из-за хрома, а стекло, обработанное хромом, имеет изумрудно-зеленый цвет. Используется для защиты и красоты Используя технику, называемую гальваникой, тонкий слой хрома может покрывать металлические и пластмассовые предметы, включая автомобильные детали и бытовую технику, чтобы придать им блестящий привлекательный вид. Нержавеющая сталь — это сплав железа и не менее 10,5 процента хрома. Он очень устойчив к коррозии. Он используется в кухонных столовых приборах, бытовой технике и посуде, такой как сковороды и сковороды из нержавеющей стали. По данным Эмсли, около 90 процентов кожи подвергается хромовому дублению.Во время этого процесса сульфат хрома используется для обработки кожи животных и превращения ее в кожу, стойкую к горячей воде, которая может вызвать разложение. Обжиговые печи и печи используют кирпичи из хромитовой руды, которая сохраняет прочность при высоких температурах. В текстильной промышленности ионы хрома используются для прилипания красителей к ткани. Высокая температура плавления, умеренное тепловое расширение и стабильность кристаллической структуры хрома делают его пригодным для этих целей. Опасно в избыткеХотя его конкретная роль для человека неясна, исследования показали, что хром является важным микроэлементом, который содержится в РНК и помогает организму использовать глюкозу.Хром больше всего сконцентрирован в плаценте, и его присутствие в организме уменьшается с возрастом. По данным RSC, безопасное количество составляет около 1 миллиграмма в день. Такие продукты, как пивные дрожжи, зародыши пшеницы и почки, богаты хромом. Однако в избытке он ядовит. В фильме 2000 года «Эрин Брокович» Джулия Робертс изображает активиста-эколога и клерка, который ведет дело против газовой и электрической компании за загрязнение питьевой воды хромом (VI), токсичным соединением, которое, как известно, вызывает рак. U.S. Управление по охране труда и здоровья (OSHA). Хотя Брокович выиграла дело в реальной жизни и в кино, ученые раскритиковали ее отсутствие доказательств того, что хром (VI), а не другие факторы, был причиной многочисленных проблем со здоровьем, включая рак, в сообществе Хинкли, Калифорния. По словам Эмсли, чрезмерное воздействие хрома также может вызвать хромовые язвы, особенно при работе с ним в течение нескольких месяцев при хромировании или дублении кожи. Хромированные язвы — это зудящие и сырые дыры на коже или желудке. При вдыхании пыли, содержащей хром, промышленные рабочие более подвержены язвам в носовой полости и раку легких. Кроме того, исследование 2017 года, опубликованное в Европейском журнале клинического питания, связывает высокий уровень хрома в моче с сердечно-сосудистыми заболеваниями и диабетом. Дополнительные ресурсы хром — База данных ElementsТаблица Менделеева -> хромхром Детали хром Символ: Cr хром Атомный номер: 24 хром Атомный вес: 51,996 Что такое хром? Хром (символ Cr, атомный номер 24) — первый элемент в группе 6 элементов. Остальные элементы в этой группе являются переходными.Это молибден (Mo), вольфрам (W) и сиборгий (Sg). Хром стально-серого цвета, твердый и с высокой температурой плавления. Без вкуса и запаха. Название этого элемента происходит от греческого слова «цветность», что на самом деле означает цвет. Это потому, что многие соединения этого элемента имеют яркие цвета. Китайцы использовали этот элемент для покрытия оружия еще два тысячелетия назад. В конце 18 века этот элемент был обнаружен в минерале крокоите, который использовался в качестве красителя.В последнее время хром также использовался для производства пигментов. Этот элемент — очень твердый металл и, следовательно, очень устойчив к ржавчине. Хром играет важную роль в разработке и производстве нержавеющей стали. Причина в том, что он делает сталь очень устойчивой к коррозии и обесцвечиванию при смешивании с ней. Хром относительно часто встречается в земной коре. При этом этот элемент не добывают в чистом виде, его добывают как хромит.Около 40 процентов хромитовых руд в мире находится в Южной Африке. Остальные месторождения находятся в таких странах, как Казахстан, Индия и Россия, а также на Филиппинах, в Зимбабве и Финляндии. Ученые подсчитали, что залежей хромита, которые еще не разрабатывались, намного больше, чем тех, которые были добыты. Запасы хрома оцениваются в один миллиард тонн, при этом в Гренландии обнаружены неразработанные месторождения. Отложения чистого хрома очень редки. В России есть один, богатый не только хромом, но и алмазами. Среди изотопов этого элемента 53Cr, 54Cr и 52Cr, последний из трех является наиболее распространенным. Период полураспада одного из радиоизотопов хрома чрезвычайно велик, самый стабильный изотоп, 50Cr, имеет период полураспада более 1,8 · 1017 лет. С другой стороны, радиоизотоп 51Cr имеет период полураспада менее 28 дней. Остальные радиоактивные изотопы имеют еще более короткий период полураспада — менее 24 часов. У некоторых даже период полураспада длится несколько секунд. Хром обычно используется в металлургии, красителях, гальванических покрытиях, для защиты древесины и дубления.Небольшие количества металла содержатся в быстрорежущих инструментальных сталях, сплавах на основе никеля, реактивных двигателях и газовых турбинах. Это наиболее часто используемое металлическое покрытие, поскольку оно чрезвычайно прочное. Применяется для хромирования (на колесах автомобилей и мотоциклов) и декоративных поверхностей. Распространенным пигментом, который, помимо прочего, используется для окраски школьных автобусов, является так называемый хромово-желтый. Этот цвет не ухудшается на фото и очень сильный. В прошлом он также использовался для немецкой почтовой службы. В дополнение к этим применениям, элемент используется в металлургии, придавая ему блеск и коррозионную стойкость. Вы можете перейти по ссылке на эту страницу , используя приведенный ниже код: хром — Периодическая таблица Периодическая таблица | банки © ElementsDatabase.com 2015 | Конфиденциальность | О нас | Контакты Периодическая таблица элементовПериодическая таблица элементовЭЛЕМЕНТЫ В ОДНОЙ КОЛОНКЕ (ГРУППЕ) ИМЕЮТ ПОДОБНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА Название каждого элемента (коричневым цветом) сопровождается его химическим символом (красным цветом), Z = атомный номер = количество протонов в ядре = количество электронов, вращающихся вокруг ядра;
[Подкаталог урана] [Подкаталог плутония] [ПОЛНЫЙ СПРАВОЧНИК] по почте С 27 марта 1996 г. было более 100 000 внешних посещений веб-сайта ЦКСР, плюс (сброс счетчика 3 июня 1998 г. в полночь) Хром: промышленное и повседневное использованиеЧто такое хром?Прежде чем мы начнем, давайте немного поговорим о хроме. Хром — это металл, который находится в группе 6 и периоде 4 периодической таблицы Менделеева. Атомный номер хрома 24, что означает, что в его ядре 24 протона. Обозначение хрома — Cr . Использование хромаХром — это универсальный металл, имеющий множество применений. Если вы водите более старую машину, возможно, бампер был хромированным.Вилка из нержавеющей стали, которой вы едите, содержит хром. Если вы рисуете, многие красители и пигменты содержат хром. Давайте узнаем больше об этих приложениях. ГальваникаХром может быть нанесен гальваническим способом на другой металл или даже пластик. Гальваника — это просто процесс, в котором электричество используется для осаждения небольшого слоя атомов на поверхности. Хромированный бампер — это металл, на который нанесено гальваническое покрытие хромом. Хромирование не только придает бамперу блестящий вид, но и увеличивает его долговечность, поскольку он очень устойчив к коррозии. Нержавеющая стальХром смешивается с другими металлами с образованием сплава под названием нержавеющая сталь . Сплав — это просто смесь металлов, обладающих улучшенными свойствами по сравнению с каждым из отдельных компонентов. Нержавеющая сталь устойчива к ржавчине и очень проста в уходе. Благодаря этим свойствам он используется в кухонной технике, а также в столовом серебре. ПигментыХром также входит в состав многих пигментов , используемых художниками для рисования.Хромат свинца (II), известный как хромово-желтый, дает ярко-желтый цвет, похожий на цвет школьного автобуса. Из-за токсичности свинца и того факта, что цвет со временем потемнел, желтый хром больше не используется в качестве пигмента. Хром находится в двух зеленых пигментах. Первый — это оксид хрома, известный как хромовый зеленый. Это дает очень темно-зеленый цвет. Второй известен как виридиан и представляет собой дигидрат оксида хрома.Винсент Ван Гог использовал виридиановый зеленый цвет, чтобы нарисовать Cafe Terrace at Night . Синтетические рубиныЕсли вы хотите сделать рубина , вам понадобится хром. Настоящие рубины — это кристаллы оксида алюминия с разбросанными по всей поверхности атомами хрома. Красный цвет на самом деле происходит от атомов хрома.Рубины можно создать в лаборатории путем смешивания оксида алюминия и хрома. Краткое содержание урокаХром — это металл с 24 протонами и символом элемента Cr . Он используется во многих промышленных приложениях, таких как:
WebElements Periodic Table »Хром» Свойства свободных атомовАтомы хрома имеют 24 электрона, а структура оболочки — 2.8.13.1. Электронная конфигурация основного состояния газообразного нейтрального хрома в основном состоянии — это [ Ar ]. 3д 5 . 4s 1 , а символ термина — это 7 S 3 . Схематическая электронная конфигурация хрома. Оболочечная структура Косселя хрома.Атомный спектрПредставление атомного спектра хрома. Энергии ионизации и сродство к электронуСродство к электрону хрома составляет 64,3 кДж моль ‑1 . Энергии ионизации хрома приведены ниже. Энергии ионизации хрома.Эффективные ядерные зарядыНиже приведены эффективные ядерные заряды «Клементи-Раймонди», Z eff . Перейдите по гиперссылкам для получения более подробной информации и графиков в различных форматах.
Список литературыЭти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
Энергии связи электрона
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Просматривая изображения соединений хрома в Википедии, можно увидеть весь спектр цветов: темно-красный оксид хрома (VI), оранжево-красный хромат свинца, ярко-желтый хромат натрия, блестящий хром-зеленый (это оксид хрома (III)), голубой хром. (II) хлорид и фиолетовый безводный хлорид хрома (III). Последнее из этих соединений проявляет удивительные свойства при гидратации. Его цвет меняется между бледно-зеленым, темно-зеленым и фиолетовым в зависимости от того, сколько из шести координационных центров иона хрома занято хлоридом, а не водой.
Просматривая изображения соединений хрома в Википедии, можно увидеть весь спектр цветов: темно-красный оксид хрома (VI), оранжево-красный хромат свинца, ярко-желтый хромат натрия, блестящий хром-зеленый (это оксид хрома (III)), голубой хром. (II) хлорид и фиолетовый безводный хлорид хрома (III). Последнее из этих соединений проявляет удивительные свойства при гидратации. Его цвет меняется между бледно-зеленым, темно-зеленым и фиолетовым в зависимости от того, сколько из шести координационных центров иона хрома занято хлоридом, а не водой. Это означает, что атомы хрома сильно поглощают свет в фиолетовой и желто-зеленой областях. Мы видим, что это в основном красный цвет с небольшим количеством синего, что в лучшем случае дает характерный цвет голубиной крови лучших рубинов.
Это означает, что атомы хрома сильно поглощают свет в фиолетовой и желто-зеленой областях. Мы видим, что это в основном красный цвет с небольшим количеством синего, что в лучшем случае дает характерный цвет голубиной крови лучших рубинов. А пока я Мира Сентилингам, и спасибо за внимание.
А пока я Мира Сентилингам, и спасибо за внимание. Большинство руд состоит из минерала хромита, идеальная формула которого — FeCr 2 O 4 . Он широко распространен в естественных отложениях, обычно загрязненных кислородом, магнием, алюминием и кремнеземом; содержание хрома в них колеблется от 42 до 56 процентов. Одно из основных применений хрома — это сплавы черных металлов, для которых чистый металл не требуется. Соответственно, хромит часто восстанавливают углеродом в печи, получая сплав феррохром, который содержит железо и хром в соотношении атомов приблизительно 1-2.
Большинство руд состоит из минерала хромита, идеальная формула которого — FeCr 2 O 4 . Он широко распространен в естественных отложениях, обычно загрязненных кислородом, магнием, алюминием и кремнеземом; содержание хрома в них колеблется от 42 до 56 процентов. Одно из основных применений хрома — это сплавы черных металлов, для которых чистый металл не требуется. Соответственно, хромит часто восстанавливают углеродом в печи, получая сплав феррохром, который содержит железо и хром в соотношении атомов приблизительно 1-2.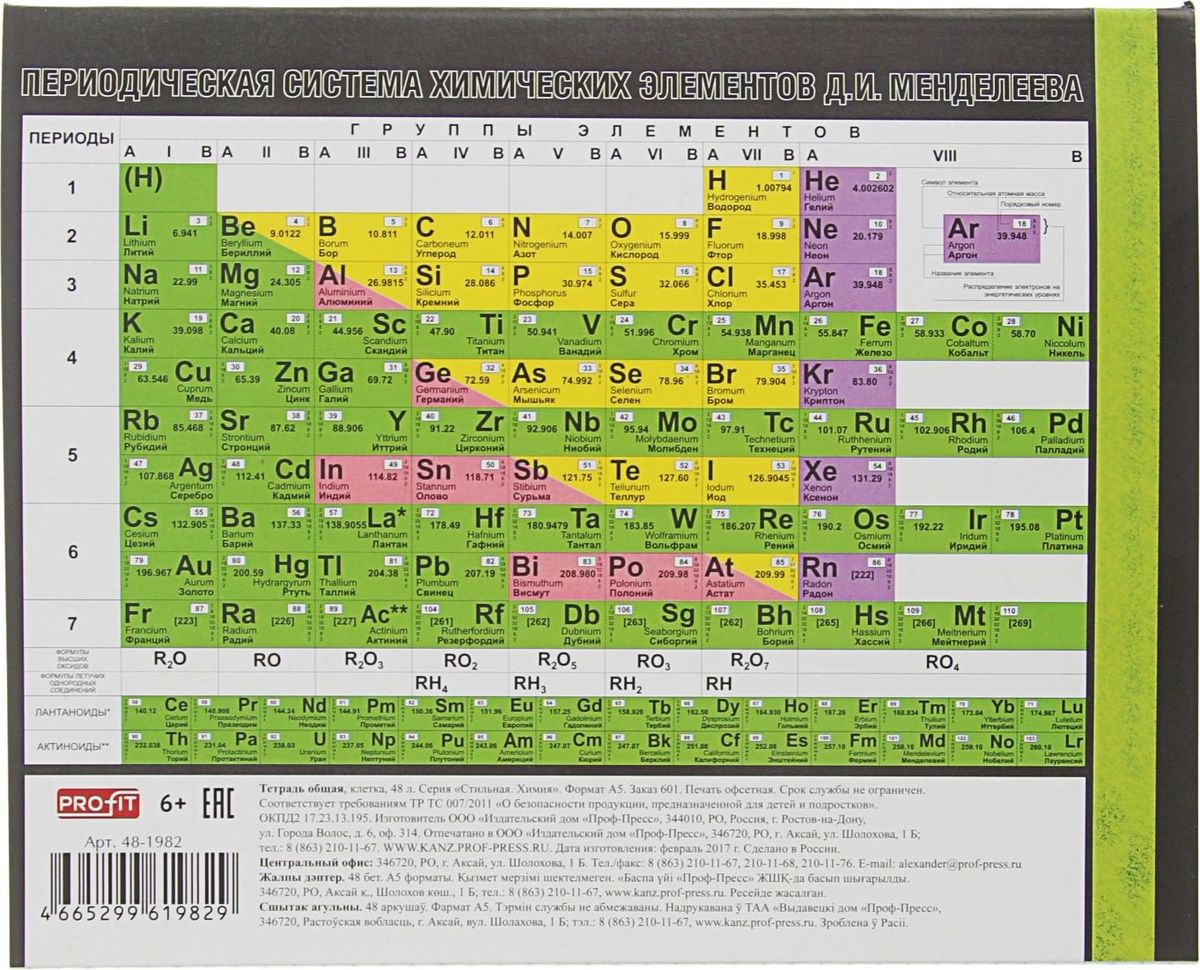 Обработка хрома .)
Обработка хрома .) Это мощный окислитель, который может бурно реагировать с некоторыми органическими материалами, но такие растворы часто используются путем контролируемого окисления в органическом синтезе.
Это мощный окислитель, который может бурно реагировать с некоторыми органическими материалами, но такие растворы часто используются путем контролируемого окисления в органическом синтезе. Вольфрам…
Вольфрам… По словам Джона Эмсли в своей книге «Строительные блоки природы: руководство по элементам» (Oxford University Press, 1999), Воклену потребовался год, прежде чем он смог осаждать свинец и получить чистый хром. Он смешал хром в различных растворах и был заинтригован множеством цветов, которые он производил, поэтому назвал элемент после греческого слова chroma , означающего «цвет».
По словам Джона Эмсли в своей книге «Строительные блоки природы: руководство по элементам» (Oxford University Press, 1999), Воклену потребовался год, прежде чем он смог осаждать свинец и получить чистый хром. Он смешал хром в различных растворах и был заинтригован множеством цветов, которые он производил, поэтому назвал элемент после греческого слова chroma , означающего «цвет». Например, автомобильные дизайнеры используют хромированные диски и диски, чтобы украсить свои автомобили. Хромирование используется не только для внешнего вида; По словам Кребса, поскольку хром образует на поверхности защитный оксидный слой, хромированные предметы сопротивляются коррозии.
Например, автомобильные дизайнеры используют хромированные диски и диски, чтобы украсить свои автомобили. Хромирование используется не только для внешнего вида; По словам Кребса, поскольку хром образует на поверхности защитный оксидный слой, хромированные предметы сопротивляются коррозии. Однако несколько исследований, проведенных за последние несколько лет, связали хром (VI) в водопроводной воде с раком, а EPA установило предел концентрации этого элемента в питьевой воде для защиты здоровья населения.
Однако несколько исследований, проведенных за последние несколько лет, связали хром (VI) в водопроводной воде с раком, а EPA установило предел концентрации этого элемента в питьевой воде для защиты здоровья населения. Еще одно популярное применение металла — хромирование.
Еще одно популярное применение металла — хромирование.