роль воды в природе и жизни человека
Четыре элемента природы, четыре стихии родили на Земле жизнь — это огонь, воздух, земля и вода. Причем вода появилась на нашей планете на несколько миллионов лет, чем та же почва или воздух.
Казалось бы, вода уже изучена человеком, но ученые до сих пор находят самые удивительные факты об этом природном элементе.
Вода стоит особняком в истории нашей планеты.
Нет природного тела, которое могло бы
сравниться с ней по влиянию на ход основных,
самых грандиозных, геологических процессов.
В.И. Вернадский
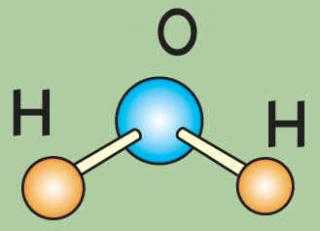
Вода — это самое распространенное неорганическое соединение на земле. И первое исключительное свойство воды в том, что она состоит из соединений атомов водорода и кислорода. Казалось бы, такое соединение, согласно химическим законам, должно быть газообразным. А вода — жидкая!
Так, например, всем известно, что вода существует в природе в трех состояниях: твердом, жидком и в виде пара. Но уже сейчас выделяют более 20 состояний воды, из которых только 14 — это вода в замерзшем состоянии.
Удивительно, но вода — единственное вещество на Земле, плотность которого в твердом состоянии меньше, чем в жидком. Именно поэтому лед не тонет, а водоемы не промерзают до самого дна. Разве что при экстремально холодных температурах.
Еще один факт: вода — универсальный растворитель. По количеству и качеству растворенных в воде элементов и минералов ученые выделяют приблизительно 1330 видов воды: минеральная и талая, дождевая и роса, ледниковая и артезианская…
Вода в природе

В природе вода играет важнейшую роль. При этом она оказывается задействованной в самых разных механизмах и жизненных циклах на земле. Вот лишь несколько фактов, которые наглядно демонстрируют ее значимость для нашей планеты:

- Значение круговорота воды в природе просто огромно. Именно этот процесс позволяет животным и растениям получать столь необходимую для их жизни и существования влагу.
- Моря и океаны, реки и озера — все водоемы играют важнейшую роль в создании климата той или иной местности. А высокая теплоемкость воды обеспечивает комфортный температурный режим на нашей планете.
- Вода играет одну из ключевых ролей в процессе фотосинтеза. Не будь воды, растения не могли бы перерабатывать углекислый газ в кислород, а значит — воздух был бы непригоден для дыхания.
Вода в жизни человека

Главный потребитель воды на Земле — это человек. Не случайно все мировые цивилизации формировались и развивались исключительно вблизи водоемов. Значение же воды в жизни человека просто огромное.
- Тело человека тоже состоит из воды. В теле новорожденного — до 75% воды, в теле пожилого человека — более 50%. При этом известно, что без воды человек не выживет. Так, когда у нас исчезает хотя бы 2% воды из организма, начинается мучительная жажда. При потере более 12% воды человеку уже не восстановится без помощи врачей. А потеряв 20% воды из организма, человек умирает.
- Вода является для человека исключительно важным источником питания. По статистике человек за месяц в норме потребляет 60 литров воды (2 литра в день).
- Именно вода доставляет к каждой клеточке нашего организма кислород и питательные вещества.
- Благодаря наличию воды наш организм может регулировать температуру тела.
- Вода также позволяет перерабатывать пищу в энергию, помогает клеткам усваивать питательные вещества. А еще вода выводит шлаки и отходы из нашего тела.
- Человек повсеместно использует воду для своих нужд: для питания, в сельском хозяйстве, для различного производства, для выработки электроэнергии. Неудивительно, что борьба за водные ресурсы идет нешуточная. Вот всего лишь несколько фактов:

Более 70% нашей планеты покрыто водой. Но при этом всего 3% всей воды можно отнести к питьевой. И доступ к этому ресурсу с каждым годом становится все труднее. Так, по данным РИА-новости за последние 50 лет на нашей планете произошло более 500 конфликтов, связанных с борьбой за водные ресурсы. Из них более 20 конфликтов переросли в вооруженные столкновения. Это всего лишь одна из цифр, ярко демонстрирующих то, насколько важна роль воды в жизни человека.
Загрязнение воды

Загрязнением воды называют процесс насыщения водоемов вредными веществами, отходами производства и бытовыми отходами, в результате которого вода теряет большую часть своих функций и становится непригодной для дальнейшего потребления.
Основные источники загрязнения:
- Нефтеперерабатывающие предприятия
- Тяжелые металлы
- Радиоактивные элементы
- Ядохимикаты
- Стоки городских канализаций и животноводческих ферм.
Ученые давно бьют тревогу, что мировой океан ежегодно получает свыше 13 млн. тонн отходов нефтепродуктов. При этом Тихий океан получает до 9 млн.тонн, а Атлантика — более 30 млн.тонн.
По данным Всемирной Организации Здравоохранения на нашей планете уже не осталось источников, в которых присутствовала бы чистая природная вода. Есть лишь водоемы, загрязненные менее остальных. И это грозит катастрофой нашей цивилизации, так как без воды человечество просто не выживет. А заменить ее нечем.
xn—-8sbiecm6bhdx8i.xn--p1ai
Значение воды в природе — MicroArticles
Строение и свойства воды
Вода — единственное вещество природы, которое в земных условиях существует в трех агрегатных состояниях — твердом, жидком, газообразном. Температуры кипения и плавления взяты за опорные точки температурной шкалы Цельсия. Это 0 °С — температура плавления льда, и 100 °С — температура кипения воды.
Плотность воды -1 г/см. Плотность льда — 0,92 г/см. Лед, плавая на воде, спасает водоемы от вымерзания в зимнее время. В 1793 году французский химик Антуан Лавуазье доказал, что вода это химическое соединение водорода с кислородом — оксид водорода.
Молекула воды имеет угловатую форму: атомы водорода по отношению кислороду образуют угол, равный 104,5˚. Поэтому молекула воды — диполь: та часть молекулы, где находится водород, заряжена положительно, а та часть, где находится кислород, — отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
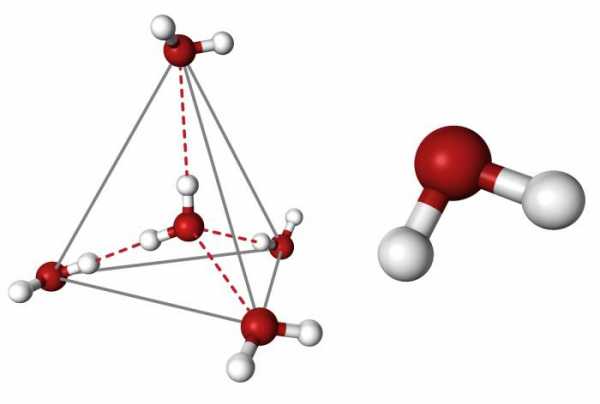
В жидкой воде наряду с обычными молекулами Н2О содержатся ассоциированные молекулы, т. е. соединенные в более сложные агрегаты , благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии ее физических свойств: максимальная плотность при 4˚ С, высокая температура кипения , аномально высокая теплоемкость . С повышением температуры водородные связи разрываются, и полный разрыв их наступает при переходе воды в пар.
Универсальная структура воды обеспечивает ей возможность переходить из одного агрегатного состояния в другое. Это осуществляется при таянии, испарении, кипении, конденсации, замерзании.
Свойства воды
Физические свойства:
Вода — прозрачная жидкость, не имеющая ни запаха, ни вкуса. Масса 1 мл чистой воды принята за одну единицу массы и называется граммом. Малая теплопроводность воды и большая теплоемкость объясняет ее использование в качестве теплоносителя. Из-за высокой теплоемкости она в зимнее время долго остывает, а летом медленно нагревается, являясь, таким образом, естественным регулятором температуры на земном шаре. Особые свойства воды, отличающие ее от других тел, называют аномалиями воды:
- При нагревание воды от 0°С до 4°С вода уменьшается в объеме, достигая максимальной плотности 1г/мл.
- Вода при замерзании расширяется, а не сжимается, как все другие тела, плотность ее при этом уменьшается./14,15/
- Температура замерзания воды с увеличением давления понижается, а не повышается, как следовало ожидать.
- Вследствие дипольного момента вода обладает большой растворяющей и диссоциирующей способностью, чем другие жидкости.
- Вода обладает самым большим поверхностным натяжением после ртути. Поверхностное натяжение и плотность определяют высоту, на которую может подняться жидкость в капиллярной системе при фильтрации через простые преграды.
Значение воды в природе
Вода — важнейший минерал на Земле, который нельзя заменить никаким другим веществом. Она составляет большую часть любых организмов, как растительных, так и животных, в частности, у человека на её долю приходится 60-80% массы тела. Вода является средой обитания многих организмов определяет климат и изменения погоды, способствует очищению атмосферы от вредных веществ, растворяет, выщелачивает горные породы и минералы и транспортирует их из одних мест в другие.
Вода насыщает атмосферу кислородом.
Вода — причина эволюции на Земле. Круговорот воды — это сложный процесс, состоящий из нескольких основных звеньев: испарения, переноса водяных паров воздушными потоками, выпадения осадков, поверхностного и подземного стока вода попадает в океан. Это не только важный момент возникновения жизни на планете, но и необходимое условие устойчивого функционирования биосферы.
Виды загрязнений вод
Водоём или водный источник связан с окружающей его внешней средой. На него оказывают влияние условия формирования поверхностного или наземного водного стока, разнообразные природные явления, индустрия, промышленное и коммунальное строительство, транспорт, хозяйственная и бытовая деятельность человека. Последствием этих влияний является привнесение в водную среду новых, несвойственных ей веществ — загрязнителей, ухудшающих качество воды. Загрязнения, поступающие в водную среду, классифицируют по-разному, в зависимости от подходов, критериев и задач. Так обычно выделяют химическое, физическое и биологическое загрязнения.
В нашей стране имеются специальные институты, систематически ведущие контроль за качеством воды. Разработаны комитетом стандартов нормы состава питьевой и промышленной воды.
Жесткость воды
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочно-земельных металлов, главным образом, кальция и магния. Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
www.microarticles.ru
Вода и ее свойства физические и химические. Структура воды :: SYL.ru
Самое важное, уникальное по свойствам и составу вещество нашей планеты — это, конечно, вода. Ведь именно благодаря ей на Земле жизнь есть, в то время как на других известных сегодня объектах Солнечной системы ее нет. Твердая, жидкая, в виде пара — она нужна и важна любая. Вода и ее свойства составляют предмет изучения целой научной дисциплины — гидрологии.
Количество воды на планете
Если рассматривать показатель количества данного оксида во всех агрегатных состояниях, то его на планете около 75% от общей массы. При этом следует учитывать связанную воду в органических соединениях, живых существах, минералах и прочих элементах.

Если учитывать только жидкое и твердое состояние воды, показатель падет до 70,8%. Рассмотрим, как распределяются эти проценты, где содержится рассматриваемое вещество.
- Соленой воды в океанах и морях, солончаковых озерах на Земле 360 млн км2.
- Пресная вода распределена неравномерно: ее в ледниках Гренландии, Арктики, Антарктиды заковано во льды 16,3 млн км2.
- В пресных реках, болотах и озерах сосредоточено 5,3 млн км2 оксида водорода.
- Подземные воды составляют 100 млн м3.
Именно поэтому космонавтам из далекого космического пространства видно Землю в форме шара голубого цвета с редкими вкраплениями суши. Вода и ее свойства, знание особенностей строения являются важными элементами науки. К тому же, в последнее время человечество начинает испытывать явную нехватку пресной воды. Может быть, такие знания помогут в решении данной проблемы.
Состав воды и строение молекулы
Если рассмотреть эти показатели, то сразу станут понятны и свойства, которые проявляет это удивительное вещество. Так, молекула воды состоит из двух атомов водорода и одного атома кислорода, поэтому имеет эмпирическую формулу Н2О. Кроме того, при построении самой молекулы большую роль играют электроны обоих элементов. Посмотрим, что собой представляют структура воды и ее свойства.
Очевидно, что каждая молекула ориентирована вокруг другой, и все вместе они формируют общую кристаллическую решетку. Интересно то, что оксид построен в форме тетраэдра — атом кислорода в центре, а две пары электронов его и два атома водорода вокруг асимметрично. Если провести через центры ядер атомов линии и соединить их, то получится именно тетраэдрическая геометрическая форма.
Угол между центром атома кислорода и ядрами водородов составляет 104,5 0С. Длина связи О-Н = 0,0957 нм. Наличие электронных пар кислорода, а также его большее в сравнении с водородами сродство к электрону обеспечивают формирование в молекуле отрицательно заряженного поля. В противовес ему ядра водородов образуют положительно заряженную часть соединения. Таким образом, выходит, что молекула воды — диполь. Это определяет то, какой может быть вода, и ее физические свойства также зависят от строения молекулы. Для живых существ эти особенности играют жизненно важную роль.
Основные физические свойства
К таковым принято относить кристаллическую решетку, температуры кипения и плавления, особенные индивидуальные характеристики. Все их и рассмотрим.
- Строение кристаллической решетки оксида водорода зависит от агрегатного состояния. Оно может быть твердым — лед, жидким — основная вода при обычных условиях, газообразным — пар при повышении температуры воды свыше 100 0С. Красивые узорные кристаллы формирует лед. Решетка в целом рыхлая, но соединение очень прочное, плотность низкая. Видеть ее можно на примере снежинок или морозных узоров на стеклах. У обычной воды решетка не имеет постоянной формы, она изменяется и переходит из одного состояния в другое.
- Молекула воды в космическом пространстве имеет правильную форму шара. Однако под действием земной силы тяжести она искажается и в жидком состоянии принимает форму сосуда.
- То, что по структуре оксид водорода — диполь, обуславливает следующие свойства: высокая теплопроводность и теплоемкость, которая прослеживается в быстром нагревании и долгом остывании вещества, способность ориентировать вокруг себя как ионы, так и отдельные электроны, соединения. Это делает воду универсальным растворителем (как полярным, так и нейтральным).
- Состав воды и строение молекулы объясняют способность этого соединения образовывать множественные водородные связи, в том числе с другими соединениями, имеющими неподеленные электронные пары (аммиак, спирт и прочие).
- Температура кипения жидкой воды — 1000С, кристаллизация наступает при +40С. Ниже этого показателя — лед. Если же увеличивать давление, то температура кипения воды резко возрастет. Так, при высоких атмосферах в ней можно растопить свинец, но она при этом даже не закипит (свыше 3000С).
- Свойства воды весьма значимы для живых существ. Например, одно из самых важных — поверхностное натяжение. Это формирование тончайшей защитной пленки на поверхности оксида водорода. Речь идет о воде в жидком состоянии. Эту пленку разорвать механическим воздействием очень сложно. Учеными установлено, что понадобится сила, равная весу в 100 тонн. Как ее заметить? Пленка очевидна, когда вода капает из крана медленно. Видно, что она словно в какой-то оболочке, которая растягивается до определенного предела и веса и отрывается в виде круглой капельки, слегка искаженной силой тяжести. Благодаря поверхностному натяжению многие предметы могут находиться на поверхности воды. Насекомые, имеющие особые приспособления, могут свободно передвигаться по ней.
- Вода и ее свойства аномальны и уникальны. По органолептическим показателям данное соединение — бесцветная жидкость без вкуса и запаха. То, что мы называем вкусом воды, — это растворенные в ней минералы и другие компоненты.
- Электропроводность оксида водорода в жидком состоянии зависит от того, сколько и каких солей в нем растворены. Дистиллированная вода, не содержащая никаких примесей, электрический ток не проводит.
Лед — это особое состояние воды. В структуре этого ее состояния молекулы связаны друг с другом водородными связями и формируют красивую кристаллическую решетку. Но она достаточно неустойчива и легко может расколоться, растаять, то есть деформироваться. Между молекулами сохраняется множество пустот, размеры которых превышают размеры самих частиц. Благодаря этому плотность льда меньше, чем жидкого оксида водорода.

Это имеет большое значение для рек, озер и прочих пресных водоемов. Ведь в зимний период вода в них не замерзает полностью, а лишь покрывается плотной коркой более легкого льда, всплывающего наверх. Если бы данное свойство не было характерно для твердого состояния оксида водорода, то водоемы промерзали бы насквозь. Жизнь под водой была бы невозможна.
Кроме того, твердое состояние воды имеет большое значение как источник огромного количества питьевых пресных запасов. Это ледники.
Особенным свойством воды можно назвать явление тройной точки. Это такое состояние, при котором лед, пар и жидкость могут существовать одновременно. Для этого требуются такие условия, как:
- высокое давление — 610 Па;
- температура 0,010С.
Показатель прозрачности воды варьируется в зависимости от посторонних примесей. Жидкость может быть полностью прозрачной, опалесцентной, мутной. Поглощаются волны желтого и красного цветов, глубоко проникают лучи фиолетовые.

Химические свойства
Вода и ее свойства — важный инструмент в понимании многих процессов жизнедеятельности. Поэтому они изучены очень хорошо. Так, гидрохимию интересуют вода и ее химические свойства. Среди них можно назвать следующие:
- Жесткость. Это такое свойство, которое объясняется наличием солей кальция и магния, их ионов в растворе. Подразделяется на постоянную (соли названных металлов: хлоридов, сульфатов, сульфитов, нитратов), временную (гидрокарбонаты), которая устраняется кипячением. В России воду перед использованием смягчают химическим путем для лучшего качества.
- Минерализация. Свойство, основанное на дипольном моменте оксида водорода. Благодаря его наличию молекулы способны присоединять к себе множество других веществ, ионов и удерживать их. Так формируются ассоциаты, клатраты и прочие объединения.
- Окислительно-восстановительные свойства. Как универсальный растворитель, катализатор, ассоциат, вода способна взаимодействовать с множеством простых и сложных соединений. С одними она выступает в роли окислителя, с другими — наоборот. Как восстановитель реагирует с галогенами, солями, некоторыми менее активными металлами, с многими органическими веществами. Последние превращения изучает органическая химия. Вода и ее свойства, в частности, химические, показывают, насколько она универсальна и уникальна. Как окислитель она вступает в реакции с активными металлами, некоторыми бинарными солями, многими органическими соединениями, углеродом, метаном. Вообще химические реакции с участием данного вещества нуждаются в подборе определенных условий. Именно от них и будет зависеть исход реакции.
- Биохимические свойства. Вода является неотъемлемой частью всех биохимических процессов организма, являясь растворителем, катализатором и средой.
- Взаимодействие с газами с образованием клатратов. Обычная жидкая вода может поглощать даже неактивные химически газы и располагать их внутри полостей между молекулами внутренней структуры. Такие соединения принято называть клатратами.
- Со многими металлами оксид водорода формирует кристаллогидраты, в которые он включен в неизменном виде. Например, медный купорос (CuSO4*5H2O), а также обычные гидраты (NaOH*H2O и другие).
- Для воды характерны реакции соединения, при которых происходит образование новых классов веществ (кислот, щелочей, оснований). Они не являются окислительно-восстановительными.
- Электролиз. Под действием электрического тока молекула разлагается на составные газы — водород и кислород. Один из способов получения их в лаборатории и промышленности.
С точки зрения теории Льюиса вода — это слабая кислота и слабое основание одновременно (амфолит). То есть можно сказать о некоей амфотерности в химических свойствах.

Вода и ее полезные свойства для живых существ
Сложно переоценить то значение, которое имеет оксид водорода для всего живого. Ведь вода и есть сам источник жизни. Известно, что без нее человек не смог бы прожить и недели. Вода, ее свойства и значение просто колоссальны.
- Это универсальный, то есть способный растворять и органические, и неорганические соединения, растворитель, действующий в живых системах. Именно поэтому вода — источник и среда для протекания всех каталитических биохимических преобразований, с формированием сложных жизненно важных комплексных соединений.
- Способность образовывать водородные связи делает данное вещество универсальным в выдерживании температур без изменения агрегатного состояния. Если бы это было не так, то при малейшем снижении градусов она превращалась бы в лед внутри живых существ, вызывая гибель клеток.
- Для человека вода — источник всех основных бытовых благ и нужд: приготовление пищи, стирка, уборка, принятие ванны, купание и плавание и прочее.
- Промышленные заводы (химические, текстильные, машиностроительные, пищевые, нефтеперерабатывающие и другие) не сумели бы осуществлять свою работу без участия оксида водорода.
- Издревле считалось, что вода — это источник здоровья. Она применялась и применяется сегодня как лечебное вещество.
- Растения используют ее как основной источник питания, за счет чего они продуцируют кислород — газ, благодаря которому существует жизнь на нашей планете.
Можно назвать еще десятки причин того, почему вода — это самое широко распространенное, важное и необходимое вещество для всех живых и искусственно созданных человеком объектов. Мы привели только самые очевидные, главные.

Гидрологический цикл воды
Иными словами, это ее круговорот в природе. Очень важный процесс, позволяющий постоянно пополнять исчезающие запасы воды. Как он происходит?
Основных участников трое: подземные (или грунтовые) воды, поверхностные воды и Мировой океан. Важна также и атмосфера, конденсирующая и выдающая осадки. Также активными участниками процесса являются растения (в основном деревья), способные поглощать огромное количество воды в сутки.
Итак, процесс происходит следующим образом. Грунтовые воды заполняют подземные капилляры и стекаются к поверхности и Мировому океану. Затем поверхностные воды поглощаются растениями и транспирируются в окружающую среду. Также происходит испарение с огромных площадей океанов, морей, рек, озер и прочих водоемов. Попав в атмосферу, вода что делает? Конденсируется и проливается обратно в виде осадков (дождь, снег, град).
Если бы не происходили эти процессы, то запасы воды, особенно пресной, давно бы уже закончились. Именно поэтому охране и нормальному гидрологическому циклу уделяется людьми большое внимание.
Понятие о тяжелой воде
В природе оксид водорода существует в виде смеси изотопологов. Это связано с тем, что водород формирует три вида изотопа: протий 1Н, дейтерий 2Н, тритий 3Н. Кислород, в свою очередь, также не отстает и образует три устойчивые формы: 16О, 17О, 18О. Именно благодаря этому существует не просто обычная протиевая вода состава Н2О (1Н и 16О), но еще и дейтериевая, и тритиевая.

При этом устойчива по структуре и форме именно дейтериевая (2Н), которая включается в состав практически всех природных вод, но в малом количестве. Именно ее называют тяжелой. Она несколько отличается от обычной или легкой по всем показателям.
Тяжелая вода и ее свойства характеризуются несколькими пунктами.
- Кристаллизуется при температуре 3,82 0С.
- Кипение наблюдается при 101,42 0С.
- Плотность составляет 1,1059 г/см3.
- Как растворитель в несколько раз хуже легкой воды.
- Имеет химическую формулу D2O.
При проведении опытов, показывающих влияние подобной воды на живые системы, было установлено, что жить в ней способны лишь некоторые виды бактерий. Для приспособления и акклиматизации колониям потребовалось время. Но, приспособившись, они полностью восстановили все жизненно важные функции (размножение, питание). Кроме того, стали очень устойчивы к воздействию радиоактивного излучения. Опыты на лягушках и рыбах положительного результата не дали.
Современные области применения дейтерия и образованной им тяжелой воды — атомная и ядерная энергетика. Получить в лабораторных условиях такую воду можно при помощи электролиза обычной — она образуется как побочный продукт. Сам дейтерий формируется при многократных перегонках водорода в специальных устройствах. Применение его основано на способности замедлять нейтронные синтезы и протонные реакции. Именно тяжелая вода и изотопы водорода — основа для создания ядерной и водородной бомбы.
Опыты на применении дейтериевой воды людьми в небольших количествах показали, что задерживается она недолго — полный вывод наблюдается через две недели. Употреблять ее в качестве источника влаги для жизни нельзя, однако техническое значение просто огромно.
Талая вода и ее применение
Свойства такой воды издревле были определены людьми как целебные. Давно было замечено, что при таянии снега животные стараются напиться водой из образовавшихся лужиц. Позже были тщательно исследованы ее структура и биологическое воздействие на организм человека.

Талая вода, ее признаки и свойства находятся посередине между обычной легкой и льдом. Изнутри она образована не просто молекулами, а набором кластеров, сформированных кристаллами и газом. То есть внутри пустот между структурными частями кристалла находятся водород и кислород. По общему виду строение талой воды сходно со строением льда — сохраняется структурность. Физические свойства такого оксида водорода незначительно меняются в сравнении с обычным. Однако биологическое воздействие на организм отличное.
При замораживании воды первой фракцией превращается в лед более тяжелая часть — это дейтериевые изотопы, соли и примеси. Поэтому эту сердцевину следует удалять. А вот остальная часть — чистая, структурированная и полезная вода. Каково воздействие на организм? Учеными Донецкого НИИ были названы следующие виды улучшений:
- Ускорение восстановительных процессов.
- Укрепление иммунитета.
- У детей после ингаляций такой водой происходит восстановление и излечение простудных заболеваний, проходит кашель, насморк и прочее.
- Улучшается дыхание, состояние гортани и слизистых оболочек.
- Общее самочувствие человека, активность повышаются.
Сегодня существует ряд сторонников лечения именно талой водой, которые пишут свои положительные отзывы. Однако есть ученые, в том числе медики, которые эти взгляды не поддерживают. Они считают, что вреда от такой воды не будет, но и пользы мало.
Энергетика
Почему свойства воды могут изменяться и восстанавливаться при переходе в разные агрегатные состояния? Ответ на этот вопрос следующий: у данного соединения существует своя информационная память, которая записывает все изменения и приводит к восстановлению структуры и свойств в нужное время. Биоэнергетическое поле, через которое проходит часть воды (та, что поступает из космоса), несет в себе мощный заряд энергии. Эту закономерность часто используют при лечении. Однако с медицинской точки зрения не каждая вода способна оказать благоприятный эффект, в том числе и информационный.
Структурированная вода — что это?
Это такая вода, которая имеет несколько иное строение молекул, расположение кристаллических решеток (такое, которое наблюдается у льда), но это все же жидкость (талая также относится к этому типу). В этом случае состав воды и ее свойства с научной точки зрения не отличаются от тех, что характерны для обычного оксида водорода. Поэтому структурированная вода не может иметь такого широкого лечебного эффекта, который ей приписывают эзотерики и сторонники нетрадиционной медицины.
www.syl.ru
Свойства воды
Содержание
Введение. 3
Физические свойства воды.5
Агрегатные состояния.7
Химические свойства воды.9
Виды воды.9
Мировые запасы воды.11
Заключение.20
Библиографический список:21
Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме), запаха и вкуса. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд на полюсах).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы). Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Почти 70% поверхности нашей планеты занято океанами и морями. Твёрдой водой – снегом и льдом – покрыто 20% суши. Из общего количества воды на Земле, равного 1 млрд. 386 млн. кубических километров, 1 млрд. 338 млн. кубических километров приходится на долю солёных вод Мирового океана, и только 35 млн. кубических километров приходится на долю пресных вод. Всего количества океанической воды хватило бы на то, чтобы покрыть ею земной шар слоем более 2,5 километров. На каждого жителя Земли приблизительно приходится 0,33 кубических километров морской воды и 0,008 кубических километров пресной воды. Но трудность в том, что подавляющая часть пресной воды на Земле находится в таком состоянии, которое делает её труднодоступной для человека. Почти 70% пресных вод заключено в ледниковых покровах полярных стран и в горных ледниках, 30% — в водоносных слоях под землёй, а в руслах всех рек содержатся одновременно всего лишь 0,006% пресных вод. Молекулы воды обнаружены в межзвёздном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников.
Состав воды (по массе): 11,19 % водорода и 88,81 % кислорода. Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0° С (1 г/см3). Плотность льда меньше плотности жидкой воды, поэтому лед всплывает на поверхность. Вода замерзает при 0° С и кипит при 100° С при давлении 101 325 Па. Она плохо проводит теплоту и очень плохо проводит электричество. Вода — хороший растворитель. Молекула воды имеет угловую форму атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды — диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, — отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
В жидкой воде наряду с обычными молекулами Н20 содержатся ассоциированные молекулы, т. е. соединенные в более сложные агрегаты (Н2О)x благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии ее физических свойств: максимальная плотность при 4° С, высокая температура кипения (в ряду Н20—Н2S — Н2Sе) аномально высокая теплоемкость [4,18 кДж/(г • К)]. С повышением температуры водородные связи разрываются, и полный разрыв наступает при переходе воды в пар.
Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения — кристаллогидраты.
Очевидно, соединения, связывающие воду, могут служить в качестве осушителей. Из других осушающих веществ можно указать Р205, СаО, ВаО, металлический Ма (они тоже химически взаимодействуют с водой), а также силикагель. К важным химическим свойствам воды относится ее способность вступать в реакции гидролитического разложения.
Вода обладает рядом необычных особенностей:
1. При таянии льда его плотность увеличивается (с 0,9 до 1 г/см³). Почти у всех остальных веществ при плавлении плотность уменьшается.
2. При нагревании от 0 °C до 4 °C (точнее, 3,98 °C) вода сжимается. Соответственно, при остывании — плотность падает. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4 °C, более холодная вода как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
3. Высокая температура и удельная теплота плавления (0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг [1]), по сравнению с соединениями водорода с похожим молекулярным весом.
4. Высокая теплоёмкость жидкой воды.
5. Высокая вязкость.
6. Высокое поверхностное натяжение.
7. Отрицательный электрический потенциал поверхности воды.
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода (протон) не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Определенную роль играет протонное обменное взаимодействие между молекулами и внутри молекул воды. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °С этот эффект становится слабее, чем тепловое расширение. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов HO− составляет 0,1 мкмоль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
1. По состоянию различают:
2. Твёрдое — лёд
3. Жидкое — вода
4. Газообразное — водяной пар

Рис.1 «Типы снежинок»
При атмосферном давлении вода замерзает (превращается в лёд) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C. При снижении давления температура плавления воды медленно растёт, а температура кипения — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Изотопные модификации воды.
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды:
1. Лёгкая вода (просто вода).
2. Тяжёлая вода (дейтериевая).
3. Сверхтяжёлая вода (тритиевая).
Вода является наиболее распространённым растворителем на Земле, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH-). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ ок. 16.
mirznanii.com
основа жизни. Свойства воды, ее значение в формировании жизни на Земле и потребность для человека
Вода – основа жизни на планете. Об этом с детства знает каждый человек, а в школьном возрасте может даже перечислить все основные свойства этого уникального вещества. Но все это не дает никакого представления о том, почему воду называют основой жизни на Земле. Несмотря на то что ее беспрестанно изучают, начиная с самых древних времен, вода может преподнести нам немало сюрпризов. Это вовсе не кажется странным, если учесть, что она входит в число самых распространенных во Вселенной веществ. К тому же не так давно было выяснено, что наша планета обязана своим образованием, чему бы вы думали? Конечно же, воде.
Поэтому древние философы превозносили ее превыше всех существующих жидкостей и посвящали ей целые поэмы. Да и сегодня это вещество интересует не только ученых, но и людей искусства. К примеру, документальный фильм «Жизнь: вода – основа жизни» (2012 года) произвел настоящий фурор в мире. Лента, снятая немецким кинорежиссером, повествует о том, насколько взаимосвязаны между собой все процессы, происходящие на планете, и о роли воды, представленной в фильме единым организмом.
Значение воды в жизни всего живого на Земле сложно переоценить, но вот многие люди его все же недооценивают. Достаточно посмотреть, как неразумно мы, люди, относимся к водным ресурсам, разбазаривая и загрязняя их повсеместно. В статье будет рассказано, почему воду называют основой жизни и как она влияет на жизнедеятельность всех организмов на планете, включая человека. Итак, знакомьтесь – Ее Величество Вода.
Краткая характеристика воды
Люди считают себя венцом творения природы и подчас забывают о том, что являются частью всего живого и взаимосвязаны с любыми процессами, происходящими на планете. Ученые утверждают, что это происходит из-за большого объема жидкости в нашем организме. Если рассматривать усредненные показатели, то можно уверенно говорить о том, что человек на 70, а то и 80 % состоит из чистой воды. В некоторых человеческих органах и тканях ее концентрация доходит до 90 %. В таком же количестве она содержится и в растениях, а также других организмах. Уже одно это подсказывает ответ на вопрос, почему воду называют основой жизни. Ведь природа отличается невероятной мудростью и, создав все живое, неспроста определила именно такой состав и соотношение жидкости относительно других веществ.
Не стоит забывать и о том, что вода содержится на нашей планете в огромном количестве, и это тоже является важным фактором, обеспечившим когда-то возникновение, а затем и сохранение жизни на Земле. Если взять наш земной шар и покрутить его со всех сторон, внимательно рассматривая, то обнаружится, что приблизительно 80 его процентов покрыто водой. При этом в расчет идут только океаны. А ведь на планете есть еще реки, озера, моря, ледники и подземные воды. Все они составляют гидросферу – одну из оболочек нашей Земли. Благодаря тому что она достаточно обширна, происходит бесконечный круговорот воды в природе, обеспечивающий регулярное взаимодействие этого вещества в разных своих формах существования.
Интересно, что, несмотря на обилие воды на земном шаре, большая ее часть является непригодной для питья. А потому не может обеспечить человеческие потребности в восполнении жидкости. Питьевой воды на планете не более трех процентов, причем всего лишь менее одной трети от этого числа находится в озерах и реках. Зная эту информацию, становится не по себе от того, насколько плачевной может стать судьба человечества при исчезновении этих и так незначительных запасов.
Вода – основа жизни на Земле. Этот факт сложно подвергнуть сомнению, тем более что она имеет массу уникальных свойств, которые не приводятся в школьных учебниках. О них ученые заговорили не так давно и до сих пор проводят массу исследований, выясняя все новые факты. Кроме этого, в любую школьную программу входит изучение химических и физических свойств воды, которые раскрывают некоторые ее особенности как вещества, чрезвычайно важного для обеспечения жизнедеятельности всех организмов на земном шаре.
Свойства воды
Проводя параллель между словами «вода» и «основа жизни», мы не можем не рассказать о свойствах этой уникальной во всех смыслах жидкости.
Интересно, что вода не имеет вкуса, запаха и цвета. Но в таком виде ее чрезвычайно сложно встретить в природе, ведь она по своей сути является растворителем и зачастую содержит в себе массу примесей, влияющих на ее органолептические показатели.
Не так давно ученые открыли еще одно свойство воды, о котором ранее могли только подозревать. Как оказалось, она способна проникать абсолютно во все тела на планете. Это вещество содержится даже в составе камней, что полностью раскрывает, почему вода – основа жизни.
Молекулы воды могут распадаться на ионы, также они образуют очень нестабильные и кратковременные водородные связи. Существуют они на протяжении доли секунд. Стоит помнить и о том, что в своем нормальном состоянии вода не может образовывать долговременные структуры, представляя собой однородную среду.
Физики утверждают, что вода – это единственное на планете вещество, которое в своем нормальном состоянии имеет текучую форму. К тому же она может быть представлена в разных состояниях: жидкое, газообразное и твердое. Ни одно вещество, известное ученым, больше не обладает подобными свойствами.
Вода способна вступать в химические реакции с другими веществами и может быть радиоактивной. Она обладает плотностью, теплопроводностью и электропроводностью. Эти свойства лучше всего проиллюстрируют следующие примеры.
Практически у всех веществ на планете в процессе перехода из жидкого состояния в твердое меняется и их плотность. Если бы вода вела себя точно так же, то в водоемах при снижении температуры до нуля градусов по Цельсию происходили бы следующие реакции:
- охлажденные верхние слои опускались бы на одно водоемов и выталкивали наверх более теплые;
- они, в свою очередь, вновь бы охлаждались, и так процесс шел бы до полного охлаждения всей массы воды;
- после этого водоем начал бы промерзать;
- слои льда вновь опускались бы на одно до полного замерзания всей воды;
- в итоге жизнь во многих морях и озерах на планете просто не смогла бы существовать.
Однако в реальности процессы протекают совсем иначе, ведь уже при четырех градусах выше нуля вода достигает своей наивысшей плотности, и процесс перемешивания слоев завершается. Промерзает только верхний слой водоема, что способствует развитию различных организмов в толще воды.
Важное значение вода в жизни играет посредством формирования климата. Это происходит за счет ее большой теплоемкости – она медленно нагревается и остывает. Именно этот факт является определяющим при установлении погоды в разных районах планеты.
Многие ученые утверждают, что вода – основа жизни, потому что без нее и перечисленных нами свойств ничто живое не смогло бы существовать на земном шаре.

Роль воды
Почему вода — основа жизни на Земле? Этим вопросом наши современники задаются не так уж и часто. Но если все же углубиться в его изучение, то выяснятся очень интересные подробности об этом кажущемся таким знакомым веществе.
Вода в природе и жизни человека играет незаменимую роль. Достаточно знать о том, что она активно участвует в формировании рельефа и его изменении на земном шаре. Интересно, что если полностью сгладить весь рельеф, то вода покроет всю планету слоем в три километра. Это кажется просто невероятным, но очень точно описывает одну из основных ролей, которые выполняет это вещество.
Кроме этого она является настоящим творцом климата, распределяет и аккумулирует энергию, а главное – представляет собой основу для всего живого на нашей планете. Ученые полагают, что основой зарождения жизни на любой из планет во Вселенной является одно правило: живой организм, включая все внутренние органы и структуры жизнеобеспечения, должен состоять из веществ, которые находятся в свободном доступе. Очень важно, чтобы их недостаток можно было восполнить. А значит, они должны быть:
- доступны;
- обеспечивать комфортное существование;
- в полной мере выполнять свои функции по обеспечению жизнедеятельности.
Все перечисленные факторы науке хорошо известны и изложены ею в виде многочисленных теорий о зарождении жизни. Исходя из обилия воды на нашей планете, именно она должна являться тем материалом, который соответствует всем вышеперечисленным пунктам и раскрывает суть, почему воду называют основой жизни на Земле.

Доступность
Выше было рассказано о том, что вода на земном шаре находится в избыточном количестве, поэтому в ее доступности сомневаться не приходится. В этом она может соперничать только с воздухом, образующим оболочку, называемую атмосферой.
Так как вода всегда находилась в легком доступе, то практически все живые организмы использовали ее достоинства в полной мере. Если внимательно изучить их строение, то станет понятно, что большинство организмов состоит из воды более чем наполовину. Существуют и такие, в которых ее до 90 %. Все эти факты выступают доказательством того, что именно вода была главным строительным материалом при зарождении жизни на планете. Да и сама жизнь впервые возникла в глубине океанов, и только распространившись там, вышла на сушу. Ученые считают, что разнообразие живых организмов в воде гораздо больше, чем на суше. До сегодняшнего дня воду можно считать основным строительным материалом, без которого жизнь погибает буквально за несколько дней.
Интересно, что доступностью воды обусловлена и одна из ее функций – нахождение в организмах в динамичном состоянии. Ученые называют это вещество своеобразным транспортом, который доставляет в организм минералы, витамины и микроэлементы, обеспечивающие его нормальное функционирование, а также выводит из него продукты жизнедеятельности, чтобы избежать интоксикации клеток. В процессе транспортировки вода не реагирует с веществами, что делает ее поистине уникальной. Ведь другие вещества при соприкосновении вступают в активную реакцию между собой и не могут выполнять роль транспорта для клеток. Для того чтобы этот процесс происходил бесперебойно, живые организмы должны постоянно пополнять запасы воды. Благодаря ее доступности сделать это довольно легко. Также следует добавить, что в природе не существует иного вещества, которое могло бы находиться в таком количестве на земном шаре.
Если вам все еще требуются доказательства того, что вода – основа жизни на Земле, то следующий раздел статьи будет однозначно интересен.
Создание комфортных условий для жизнедеятельности организма
Когда речь идет о комфортных условиях, то следует понимать, что имеются в виду факторы, при которых организм может функционировать в полной мере, так как это заложено природой. Подобные условия являются для организма нормальными, и именно в них вода находится в текучем состоянии. Это обеспечивает всему живому комфортное существование.
Ученые особо выделяют уникальность воды, когда обсуждают вопросы жизнедеятельности организма. Дело в том, что им не известно ни одного вещества, которое в своем нормальном состоянии имело бы жидкую форму и было бы готово к употреблению, а также отвечало запросам относительно ее количества.
Нельзя не упомянуть в данном разделе о нейтральности воды. Ни один живой организм, контактируя с этим веществом, не повредится. Оно имеет нейтральный уровень кислотности и не повреждает их оболочку. Внутри организма вода практически не вступает ни в какие химические реакции, однако обеспечивает подходящую среду для них. Для обеспечения комфортного существования организмов необходимо осуществление большого количества биохимических реакций. А они, как известно из школьных уроков, могут происходить в растворах и газах. Поэтому вода так необходима всему живому на планете. Попадая в любой организм, она дает ему возможность вести нормальную жизнедеятельность и становится средой для биохимических реакций.

Обеспечение жизнедеятельности организмов: подробности
Ни для кого не секрет, что живые организмы, особенно человек, представляют собой единую, но очень сложную систему. Внутри нее существует взаимосвязь между всеми органами, каждый из которых в отдельности нуждается в особых условиях для нормального функционирования. Для того чтобы биохимические процессы происходили правильно, к органам должен быть организован доступ всех необходимых веществ. После необходимо вывести из организма продукты его жизнедеятельности, а здесь понадобится особая система, дающая доступ ко всем органам и клеткам. И вот тут природа в полной мере использовала все свойства воды.
Только задумайтесь: доступ кислорода, без которого клетки не могут существовать, доставляется к ним водным раствором крови, а выводится наружу посредством мочи, лимфы и пота. Они, в свою очередь, являются тоже водой, в которой растворены продукты жизнедеятельности различных органов.
Все биохимические процессы в живых организмах могут протекать только при условии соблюдения температурного режима. Для человека верхней границей являются 37 °С, а низшим пределом – 36 °С. Любые отклонения от этой нормы вызывают сбои в работе внутренних органов, поэтому организм вынужден поддерживать нужную температуру постоянно. В этом ему помогает все та же вода, которая обладает высокой теплоемкостью. По данным ученых, она выше, чем у других веществ в 5-30 раз. Сравниться с ней не может ни одно вещество на планете.
Еще одна роль воды в жизни человека и животных заключается в ее защитных функциях для внутренних органов. И это еще раз подтверждает уникальность данного вещества. У людей и животных внутренние органы всегда находятся в подвешенном состоянии. Печень, сердце и легкие имеют немалую массу и являются довольно хрупкими. Так как живой организм находится в постоянном движении, то органы испытывают огромные перегрузки и очень легко могут повредиться. Однако природа оказалась очень мудрой и при создании жизни заполнила внутреннее пространство жидкостью. В ней все органы находятся в состоянии минимального веса и надежно защищены от внешнего воздействия.

Вода и человек
После всего вышеперечисленного наверняка можно убедиться в том, что вода – основа жизни всего существующего на нашей планете. Но даже уже приведенные данные не раскрывают той роли, которую выполняет это уникальное вещество для человека. А ведь люди нуждаются в воде не только для того, чтобы обеспечить себе хорошее самочувствие. Мы используем ее и в бытовых целях, порой расходуя в несоизмеримо больших количествах. Специалисты часто обсуждают нормы водопотребления, но обычный человек не всегда понимает, что подразумевается под данным термином. Обычно водопотребление выстраивается из двух составляющих:
- количества жидкости, требуемого организму для восполнения потерь;
- воды, необходимой для обеспечения комфортных бытовых условий.
Первый пункт будет рассмотрен в следующем разделе, а сейчас узнаем, каков расход воды на человека в сутки, определяемый санитарными службами тех или иных городов. Сразу стоит оговориться, что общемировых стандартов не существует. В каждой стране специальные контролирующие органы устанавливают правила водопотребления, исходя из того, сколько человек может потратить, ведя обычную жизнь. Ведь мы с трудом представляем себя сегодня без водопровода: из него мы берем воду для приготовления пищи, чашки чая, стирки или мытья посуды. А вечером многие предпочитают налить ароматную ванную и расслабиться после тяжелого трудового дня. Кажется, что эти повседневные манипуляции не наносят природе никакого вреда, однако экологи считают их губительными для гидросферы. Понять это можно, изучив нормы водопотребления. Они формируются, исходя из нескольких факторов:
- при проведенном водопроводе, но отсутствии ванны норма составляет от 125 до 160 литров в сутки на одного человека;
- если у вас есть в наличии и водопровод, и ванна, то расход воды на человека возрастает до 250 л;
- в домах, где ко всему вышеперечисленному можно добавить и наличие горячей воды, норма составляет уже 350 л;
- самое низкое водопотребление наблюдается у тех, кто пользуется колонками, – от 30 до 50 литров в сутки на человека.
Эти цифры являются весьма усредненными, но, исходя из них, специалисты определяют, что водозабор на душу населения составляет около 450 литров. Такое количество воды жители современных городов расходуют ежедневно. Но для каждого населенного пункта существуют свои нормы, которые могут отличаться от средних в ту или иную сторону. К примеру, Москва выделяется самым высоким уровнем водопотребления на душу населения – 700 литров, а в Париже эти параметры снижены до 160 литров. Среди европейских городов самыми бережливыми считаются жители Брюсселя. Они потребляют 85 литров в сутки на человека.
Экологи утверждают, что при таком отношении к воде вскоре мы можем столкнуться с серьезной проблемой – недостатком чистой воды. А это может привести к настоящему кризису. Поэтому нам ни в коем случае не стоит забывать о том, что вода – основа жизни на всей планете и без нее мы просто не сможем существовать.
Значение воды в процессах жизнедеятельности человека
Вода – это жизнь. Еще древние греки и римляне этой фразой пытались отразить уникальные свойства этого вещества, без которого невозможно представить себе существование человечества как вида. В любом школьном учебнике написано, что человек на 60-70 % состоит из воды, а значит, постоянно нуждается в ней для восполнения потерь. А они в среднем составляют до четырех литров.
Большинство людей понимают, что жидкость мы теряем в основном через почки и кожные покровы посредством работы потовых желез. Однако это не единственные пути потери воды. На самом деле мы теряем ее даже в процессе дыхания. Да-да. Один кубический метр выдыхаемого нами воздуха может содержать до девяти граммов воды. Из всего этого и складываются те самые четыре литра, которые человек должен обязательно пополнить. Но что будет, если живительная влага в организм не поступит?
Любой ученый может пояснить, что вода является основой жизни, так как при 20-процентной ее потере в организме произойдут необратимые изменения, выражающиеся нарушением работы большинства жизненно важных органов. Подобные процессы вполне могут привести к смерти. Если же недостаток воды исчисляется всего десятью процентами, то человек будет ощущать слабость и недомогание. Это происходит из-за того, что все процессы, связанные с водообменом в организме, регулирует центральная нервная система через пищевые центры и центры жажды. Как только в организме снижается уровень жидкости, мгновенно меняется состав крови, что приводит к возбуждению центральной нервной системы. Как следствие, человек начинает испытывать чувство жажды. В подобном состоянии можно находиться не более трех суток. За это время обезвоживание приводит к серьезным проблемам, и человек умирает. Для сравнения можно сказать, что без пищи люди могут прожить около месяца.

Сколько воды нужно человеку?
Нормы жидкости, необходимой для нормальной жизнедеятельности человека, зависят от многих факторов:
- от качества воды;
- наличия определенных заболеваний;
- климата и сезонных изменений погоды;
- классификации трудовой деятельности.
К примеру, горожанину, занимающемуся умственным трудом, в среднем требуется два литра чистой воды в сутки. В жаркое время года это количество может увеличиться до четырех литров. Люди, работающие физически, испытывают большую потребность в жидкости. В среднем мужчина, занятый на тяжелом производстве, должен выпивать до четырех литров воды. Летом данный показатель повышается до пяти-шести литров.
Не менее важна жидкость и для детей. Вода – источник жизни для младенцев, так как способствует быстрому налаживанию пищеварения и нормализует все процессы жизнедеятельности. Месячный малыш нуждается приблизительно в одном стакане чистой воды ежедневно. Ее недостаток губительно сказывается на его здоровье и может стать причиной серьезных проблем в будущем.

О качестве воды
Вода – основа жизни растений, людей, животных и других организмов, к сожалению, в современном мире не всегда может порадовать качеством. А ведь от этого напрямую зависит самочувствие человека. Чистая вода – источник здоровой жизни, долголетия и красоты. Но вот что именно нужно понимать под словосочетанием «чистая вода»?
В первую очередь специалисты советуют ориентироваться на органолептические свойства воды. Они характеризуются цветом, запахом, вкусом, наличием осадка, прозрачностью и другими подобными факторами. В идеале вода должна быть прозрачной, без вкуса и запаха, но встретить такую в городах невозможно. В любой воде, текущей из-под крана, находится масса примесей. Часть из них – это растворенные химические элементы из почвы, еще одна часть – примеси из водопроводных труб, также нельзя не упомянуть и об элементах, которые используются при очистке воды (во многих городах, к примеру, применяется хлор). Поэтому в разных районах так сильно отличается вкус воды и ее качество. Хотя в любом городе нашей страны она пригодна для питья.
Также нужно упомянуть и о загрязнениях, влияющих на качество воды. Они могут быть вызваны деятельностью человека и стать причиной настоящей эпидемии. Через воду человек может заразиться гепатитом, гриппом, сальмонеллой, кишечными вирусами и приобрести еще массу проблем. В странах, где за качеством воды следят не так пристально, несколько раз в год вспыхивают эпидемии, вызванные ее загрязнением. При подобных обстоятельствах люди гибнут тысячами, и исправить ситуацию довольно сложно.
Подводим итоги
В наши дни человечество еще не испытывает особых проблем с питьевой водой и водой в целом. Однако в некоторых местах на земном шаре о них уже знают не понаслышке, а значит, людям пора серьезно задуматься о том, как они относятся к воде, дарующей им возможность нормально существовать. Ведь именно об этом древние философы писали свои многочисленные сочинения. Вода – основа жизни. Стоит человечеству забыть эту аксиому, как оно потеряет все шансы на свое счастливое будущее.
fb.ru
13.2. Физико-химические свойства воды и их значение для природных процессов
Вода – простейшее химическое соединение водорода с кислородом. Химически чистая вода состоит из 11,19 % водорода и 88,81 % кислорода (по весу). Вода – самое распространенное и самое необыкновенное вещество на Земле благодаря своим аномальным свойствам. В земных условиях только вода находится в трех физических агрегатных состояниях: твердом (лед, снег), жидком (вода) и газообразном (пар). В парообразном состоянии (при температуре 100 °С) вода состоит главным образом из простых молекул, называемых гидролями (Н2О). В жидкой фазе вода представляет собой смесь гидролей (Н2О) двойных молекул – дигидролей (Н2О)2 и тройных молекул – тригидролей (Н2О)3. В твердой фазе (лед) в воде преобладают тригидроли (Н2О)3. Переход воды из одного состояния в другое происходит быстро и сопровождается или поглощением тепла (при испарении, таянии льда и снега) или выделением тепла (при конденсации и сублимации водяного пара, при замерзании воды), но на температуру самой воды (льда) это не влияет. При этом скачкообразно изменяются физические и химические свойства воды. Химически чистая вода при нормальном атмосферном давлении 760 мм (1013 гПа) кипит при 100 °С, замерзает при О°С (это и температура плавления льда), имеет наибольшую плотность при температуре +4 °С.
Теплоемкость. Вода – одно из самых теплоемких в природе тел. Удельной теплоемкостью вещества называется количество теплоты, необходимое для нагревания 1 кг вещества на 1 °С. Вследствие высокой теплоемкости воды океанов, морей и озер поглощают огромное количество тепла летом, являясь его мощными аккумуляторами. Зимой воды, охлаждаясь, отдают тепло в атмосферу. Этим объясняется большое умеряющее (летом охлаждающее, зимой отепляющее) влияние океанов и морей на климат прилегающих материков в умеренных и высоких широтах. В экваториально-тропических теплоэнергетических зонах вода нагревается весь год и тепло морскими течениями и воздушными потоками передается в умеренные и полярные широты. Это перераспределение тепла имеет огромное климатическое значение.
Для воды характерны высокие значения теплоты испарения (597 кал/г) и теплоты плавления (79,4 кал/г). Эти свойства очень важны для живых организмов. Высокая теплота испарения обеспечивает защиту их от перегрева, а большая теплота плавления – от переохлаждения.
Теплопроводность воды весьма незначительна. Поэтому нагревание воды в естественных водоемах происходит не столько путем молекулярной теплопроводности, сколько путем плотностной конвекции, перемешивания воды
вследствие течений и волнения. При отсутствии перемешивания воды в озерах наблюдается вертикальная термическая слоистость (стратификация).’Лед и особенно снег обладают еще меньшей теплопроводностью, чем вода. Поэтому лед, возникнув на поверхности водоема, предохраняет воду от дальнейшего охлаждения, а снег – почву от промерзания, бесснежие же губит озимые культуры.
Плотность воды зависит от температуры и солености. Наибольшая плотность химически чистой воды достигается при температуре +4°С, а выше и ниже +4°С плотность воды уменьшается – вода становится легче. Это удивительное аномальное свойство воды по сравнению с другими жидкостями, плотность которых при понижении температуры и затвердевании увеличивается, объясняется тем, что одиночные молекулы воды Н2О (моногид-роли) могут объединяться и образовывать сложные молекулы: дигидроли и тригидроли. Они более крупные по объему, но относительно рыхлые, ажурные по структуре и поэтому более легкие. При понижении температуры воды происходит, с одной стороны, нормальное уменьшение объема и уплотнение воды, вызванное охлаждением, как у всех жидкостей, а с другой – увеличение объема и соответственно уменьшение плотности воды из-за объединения молекул воды в более сложные, но более легкие. При охлаждении воды до +4°С преобладает первый процесс, при температуре +4°С оба процесса уравновешиваются, поэтому плотность наибольшая, при дальнейшем охлаждении воды ниже +4°С преобладает второй процесс. Плотностная аномалия воды имеет громадное значение для природных вод. Во-первых, при осеннем охлаждении пресных водоемов до +4°С более холодная и плотная вода с поверхности опускается и обогащает глубинные слои кислородом, как бы подготавливая водоем к зиме. Во-вторых, вследствие этой аномалии водоемы даже в условиях сурового климата не промерзают до дна, за исключением совсем мелких, поскольку при охлаждении воды ниже +4°С вплоть до О °С верхние слои воды становятся менее плотными, более легкими и удерживаются на поверхности. Так как молекулярная теплопроводность воды и льда невелика, верхние слои предохраняют от охлаждения ниже расположенные толщи воды; живые организмы тем самым уберегаются от гибели. Весной после таяния льда и нагревания воды в верхнем ее слое до +4°С она становится тяжелее, плотнее и опускается вниз, обогащая глубинные слои кислородом, что очень важно для жизни, так как после зимы запасы кислорода в водоемах истощаются. Но это опускание прекращается после достижения температуры +4°С, ибо при
последующем прогревании поверхностная вода становится легче. Таким образом, благодаря плотностной аномалии воды сохраняется жизнь в водоемах в условиях холодных и умеренных климатических поясов.
Своеобразным свойством воды является резкое увеличение ее объема при замерзании. Объем льда примерно на 10% больше по сравнению с первоначальным объемом воды. И наоборот, плавление льда сопровождается не расширением, а сжатием и уменьшением объема воды. Это аномальное свойство воды объясняется тем, что при понижении температуры воды и переходе ее через 0°С происходит быстрое превращение почти всех ее молекул в тригидроли, что сопровождается скачкообразным увеличением объема льда. Увеличиваясь в объеме, лед становится менее плотным (плотность льда при замерзании воды составляет 0,91 г/см3), а значит, более легким, чем вода, и всплывает. Будучи плохим проводником тепла, лед предохраняет глубокие слои воды от замерзания. Свойство воды увеличиваться в объеме при замерзании играет огромную роль при разрушении горных пород путем физического («морозного») выветривания, поскольку, замерзая в трещинах пород, лед давит на их стенки и разрывает породу на мелкие части. Изменение объема воды при замерзании и таянии льда создает в области многолетней мерзлоты особый рельеф: бугры пучения при замерзании воды и впадины при таянии льдистых грунтов и линз льда.
Подвижность – характерное свойство жидкой воды. Движение воды происходит под действием силы тяжести, различия плотностей, под влиянием ветра, вследствие притяжения Луной и Солнцем и др. Перемешивание воды способствует выравниванию ее температуры, солености, химического состава и т. д. Велика роль движущейся воды в перераспределении тепла в океанах путем морских течений. Благодаря поверхностным текучим водам размываются, перемещаются и отлагаются огромные массы горных пород.
Термическая устойчивость воды весьма высока. Водяной пар разлагается на водород и кислород только при температуре выше 1000°С в высоких слоях атмосферы.
Поверхностное натяжение. Вода среди жидкостей, кроме ртути, обладает самым большим поверхностным натяжением. Благодаря этому свойству вода поднимается по капиллярам в грунтах, движется вверх в растениях, обеспечивая соответственно почвообразование и питание растений. Без воды земледелие было бы невозможно.
Вода – прекрасный растворитель, поэтому все воды представляют собой газосолевые растворы различного химического состава и различной концентрации. Концентрация растворенных в воде веществ характеризуется соленостью, обозначается символом S и выражается в промилле (%о), т. е. в тысячных долях (граммах вещества на килограмм воды). Соленость пресной воды менее 1%о, остальные воды в той или иной степени соленые. Большая часть химических элементов находится в воде в виде гидратированных ионов, газы – в виде растворенных молекул. Растворимость газов в воде больше при низких температурах и повышенном давлении. Обнаружилось, что вода изменяет свою растворяющую способность под воздействием искусственно создаваемого магнитного поля. Растворяющая способность воды обусловливает химическое выщелачивание (выветривание) горных пород, обмен веществами между компонентами природы внутри географической оболочки, между сушей и океаном, между организмами и средой. Вообще минерализация воды до определенного предела – основа жизни. Химически чистая вода для жизни непригодна.
Многообразен не только химический и молекулярный, но и изотопный состав природных вод, так как кислород и водород имеют несколько изотопов. В природных условиях известны атомы водорода с атомным весом 1 (Н1 – протий), 2 (Н2=Д – дейтерий) и 3 (Н3=Т – тритий) и атомы кислорода с атомным весом 16(О16), 17(О17) и 18(О18). Из сочетания изотопов водорода Н, Д и Т и кислорода О16, О17 и О18 образуется девять видов воды. Природная вода – смесь всех этих
видов. Причем на долю обыкновенной воды Н2‘О16 приходится 99.7% на Земле. Все остальные виды воды, кроме обыкновенной, называются тяжелой водой. Наиболее существенно отличается от обыкновенной тяжелая вода Н22О16 (Д9О). Она имеет молекулярный вес 20, кипит при температуре 101,42°С, замерзает при температуре 0,8 °С, имеет максимальную плотность при 11,6 °С. Тяжелая вода нашла применение в атомной энергетике.
Способность к самоочищению – важное свойство воды. Оно осуществляется в процессе течения в реках, волнения в озерах и морях, фильтрации воды через грунт, в процессе испарения. Но при загрязнении выше определенных пределов эта способность нарушается.
Цвет воды. Вода имеет голубоватый оттенок, но в тонких слоях бесцветна. Оттенки цвета зависят от угла падения солнечных лучей, глубины проникновения света и от примесей.
Прозрачность воды определяется глубиной погружения белого диска диаметром 30 см. Прозрачность зависит от примесей. При большой прозрачности свет проникает на большую глубину, поддерживая необходимые условия для существования организмов.
Физические и химические свойства воды тесно взаимосвязаны. Особенно сильно изменяются свойства воды под влиянием температуры и давления. Удивительные свойства воды способствовали появлению и развитию жизни на Земле. Благодаря воде совершаются все процессы в географической оболочке.
studfiles.net
Свойства воды в природе
Вода — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71% поверхности Земли покрыто водой (океаны, моря, озера, реки, лёд на полюсах).
Свойства воды — это совокупность физических, химических, биохимических,
органолептических, физико-химических и других свойств воды.
Вода — оксид водорода — одно из наиболее распространенных и важных веществ.
Поверхность Земли, занятая водой, в 2,5 раза больше поверхности суши. Чистой
воды в природе нет, — она всегда содержит примеси. Получают чистую воду методом
перегонки. Перегнанная вода называется дистиллированной. Состав воды (по массе):
11,19 % водорода и 88,81 % кислорода.
Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0° С (1 г/см3). Плотность льда меньше плотности жидкой воды, поэтому лед всплывает на поверхность. Вода замерзает при 0° С и кипит при 100° С при давлении 101 325 Па. Она плохо проводит теплоту и очень плохо проводит электричество. Вода — хороший растворитель. Молекула воды имеет угловую форму атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды — диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, — отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
В жидкой воде наряду с обычными молекулами Н20 содержатся ассоциированные молекулы, т. е. соединенные в более сложные агрегаты (Н2О)x благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии ее физических свойств: максимальная плотность при 4° С, высокая температура кипения (в ряду Н20—Н2S — Н2Sе) аномально высокая теплоемкость [4,18 кДж/(г • К)]. С повышением температуры водородные связи разрываются, и полный разрыв наступает при переходе воды в пар.
Вода — весьма реакционноспособное вещество. При обычных условиях она
взаимодействует со многими основными и кислотными оксидами, а также со щелочными
и щелочно-земельными металлами. Вода образует многочисленные соединения —
кристаллогидраты.
Очевидно, соединения, связывающие воду, могут служить в качестве осушителей. Из
других осушающих веществ можно указать Р205, СаО, ВаО, металлический Ма (они
тоже химически взаимодействуют с водой), а также силикагель. К важным химическим
свойствам воды относится ее способность вступать в реакции гидролитического
разложения.
Вода, содержащая тяжелый водород, называется тяжелой водои (обозначается
формулой D2O).
Химические реакции с тяжелой водой протекают значительно медленнее, чем с
обычной водой. Поэтому она при длительном электролизе обычной воды накапливается
в электролизере.
Химические свойства воды обусловлены ее составом. Вода на 88,81% состоит из кислорода, и только на 11,19% – из водорода. Как мы упоминали выше, вода замерзает при нуле градусов Цельсия, а вот закипает – при ста. Дистиллированная вода имеет очень низкую концентрацию положительно заряженных ионов гидроксония НО и Н3О+ (всего 0,1 мкмоль/л), поэтому ее можно назвать отличным изолятором. Однако свойства воды в природе не были бы реализованы правильно, если бы она не была хорошим растворителем. Молекула воды очень мала по размеру. Когда в воду попадает другое вещество, его положительные ионы притягиваются атомами кислорода, составляющими молекулу воды, а отрицательные – атомами водорода. Вода как бы окружает со всех сторон растворенные в ней химические элементы. Поэтому, в воде почти всегда содержатся различные вещества, в частности, соли металлов, обеспечивающие проведение электрического тока.
Физические свойства воды «подарили» нам такие явления, как парниковый эффект и микроволновая печь. Около 60% парникового эффекта создает водяной пар, который отлично поглощает инфракрасные лучи. При этом показатель оптического преломления воды n=1,33. Кроме того, вода поглощает и микроволны, благодаря высокому дипольному моменту ее молекул. Эти свойства воды в природе и натолкнули ученых на мысли об изобретении микроволновой печи.
Неизмеримо велика роль воды в природе и жизни человека. Можно сказать, что все живое состоит из воды и органических веществ. Она — активнейший участник формирования физической и химической среды, климата и погоды. При этом она влияет и на экономику, промышленность, сельское хозяйство, транспорт и энергетику.

Вода. Фото: Graham Dean
Без пищи мы можем прожить несколько недель, а без воды — лишь 2-3 дня. Для обеспечения нормального существования человек должен вводить в организм воды примерно в 2 раза больше по весу, чем питательных веществ. Потеря организмом человека более 10% воды может привести к смерти. В среднем в организме растений и животных содержится более 50% воды, в теле медузы ее до 96%, в водорослях 95-99%, в спорах и семенах от 7 до 15%. В почве находится не менее 20% воды, в организме же человека вода составляет около 65%. Разные части человеческого организма содержат неодинаковое количество воды: стекловидное тело глаза состоит из воды на 99%, в крови ее содержится 83, в жировой ткани 29, в скелете 22 и даже в зубной эмали 0,2%. В течение всей своей жизни человек теряет воду из организма, и его биоэнергетический потенциал уменьшается. В шестинедельном человеческом эмбрионе содержание воды составляет до 97%, у новорождённого — 80%, у взрослого — 60-70%, а в организме пожилого человека — лишь 50-60%.
Вода абсолютна необходима для всех ключевых систем жизнеобеспечения человека.
Вода и содержащиеся в ней вещества становятся средой питания и поставляют живым
организмам необходимые для жизни микроэлементы. Она содержится в крови (79%) и
способствует переносом по кровеносной системе в растворённом состоянии тысяч
необходимых веществ и элементов (геохимический состав воды близок к составу
крови животных и человека.).
В лимфе, которая осуществляет обмен веществ между кровью и тканями живого
организма вода составляет 98%.
Вода сильнее других жидкостей проявляет свойства универсального растворителя.
Через определённое время она может растворить почти любое твёрдое вещество.
Такая всеобъемлющая роль воды обусловлена её уникальными свойствами.
В последнее время усилия исследователей сосредоточены на форсированном изучении процессов, протекающих на границе раздела фаз. Оказалось, что вода в граничных слоях обладает многими интересными свойствами, которые не проявляются в объемной фазе. Эта информация крайне необходима для решения ряда важных практических задач. Примером может служить создание принципиально новой элементной базы микроэлектроники, где дальнейшая .миниатюризация схем будет основана на принципе самоорганизации макромолекул на водной поверхности. Развитая поверхность также характерна для биологических систем, что обусловлено важностью поверхностных явлений для их функционирования. Практически всегда существенное влияние на характер процессов, происходящих в приповерхностной области, оказывает присутствие воды. В свою очередь под влиянием поверхности кардинально изменяются свойства самой воды, и воду у границы необходимо рассматривать как принципиально новый физический объект исследования. Весьма вероятно, что изучение молекулярно-статистических свойств воды вблизи поверхности, которое, по существу, только начинается, даст возможность эффективно управлять многими физическими и химическими процессами.
В последнее время возрос интерес к исследованиям свойств воды на микроскопическом уровне. Так, для понимания многих вопросов физики поверхностных явлений необходимо знать свойства воды на границе раздела фаз. Отсутствие строгих представлений о структуре воды, об организации воды на молекулярном уровне приводит к тому, что при изучении свойств водных растворов как в объемной фазе, так и в капиллярных системах вода часто рассматривается как бесструктурная среда. Однако известно, что свойства воды в граничных слоях могут заметно отличаться от объемных. Поэтому, рассматривая воду как бесструктурную жидкость, мы теряем уникальную информацию о свойствах граничных слоев, которые, как оказывается, во многом определяют природу процессов, протекающих в тонких порах. Например, ионная селективность ацетатцеллюлозных мембран объясняется особой молекулярной организацией воды в порах, которая, в частности, нашла свое отражение в концепции «нерастворяющего объема». Дальнейшее развитие теории, учитывающей специфику межмолекулярных взаимодействий, лежащих в основе селективного мембранного транспорта, будет способствовать более полному пониманию мембранного опреснения растворов. Это позволит дать обоснованные рекомендации для улучшения эффективности технологических процессов опреснения воды. Отсюда вытекают важность и необходимость исследований свойств жидкости в пограничных слоях, в частности вблизи поверхности твердого тела.
biofile.ru
