История создания и развития
Как всё начиналось?
Многие известные именитые химики на рубеже XIX-XX веков уже давно заметили, что физические и химические свойства многих химических элементов очень похожи друг на друга. Так например Калий, Литий и Натрий — все являются активными металлами, которые при взаимодействии с водой образают активные гидроксиды этих металлов; Хлор, Фтор, Бром в своих соединениях с водородом проявляли одинаковую валентность равную I и все эти соединения являются сильными кислотами. Из этой похожести давно напрашивался вывод, что все известные химические элементы можно объединить в группы, причём так чтобы у элементов каждой группы был определённый набор физико-химических характеристик. Однако часто такие группы были неверно составлены из разных элементов различными учёными и долгое время многими игнорировалась одна из главных характеристик элементов — это их атомная масса. Игнорировалась она потому, что была и есть разная у различных элементов, а значит её не могли использовать в качестве параметра для объединения в группы. Исключение составил лишь франзуский химик Александр Эмиль Шанкуртуа, он попытался расположить все элементы в трёхмерной модели по винтовой линии, но его работа не была признана научным сообществом, а модель получилась громоздкая и неудобная.
В отличие от многих учёных, Д.И. Менделеев взял атомную массу (в те времена ещё «Атомный вес») как ключевой параметр при классификации элементов. В своём варианте Дмитрий Иванович расположил элементы по возрастанию их атомных весов и вот тут обозначилась закономерность, что через определённые промежутки элементов их свойства периодически повторяются. Правда пришлось сделать и исключения: некоторые элементы были поменяны местами и не соответствовали возрастанию атомных масс (например, теллур и йод), но зато соответствовали свойствам элементов. Дальнейшее развитие атомно-молекулярного учения оправдало такие подвижки и показало справедливость этой расстановки. Подробнее об этом вы можете прочесть в статье «В чём открытие Менделеева»
Первый вариант таблицы был опубликован учёным в статье «Соотношение свойств с атомным весом элементов» в 1869 и вариант этот был далек от идеала и совсем не похож на современный.
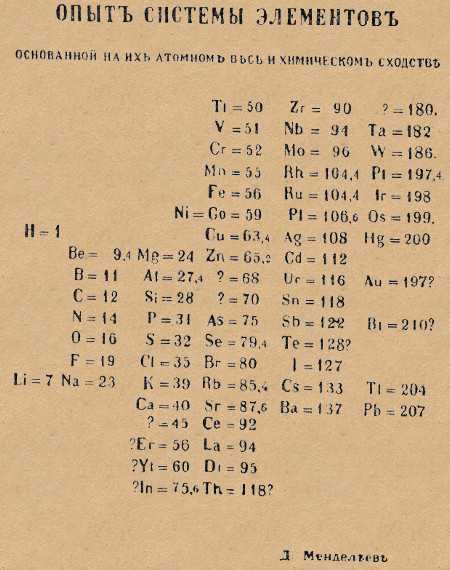
Как мы можем видеть, расположение элементов в этом варианте совсем не такое, какое мы видим в совремнном виде. Во первых, группы и периоды поменяны местами: группы по горизонтали, периоды по вертикали, а во-вторых, самих групп в нём как-то многовато — девятнадцать, вместо принятых на сегодня восемнадцати.
Однако, спустя всего год, в 1870-м Менделеев сформировал новый вариант таблицы, который уже более узнаваем нами: подобные элементы выстроены по вертикали, образуя группы, а 6 периодов расположены по горизонтали. Особенно примечательно то, что и в первом и во втором варианте таблицы виднеются существенные достижения, коих не было у его предшественников: в таблице заботливо оставлены места под элементы которые, по мнению Менделеева, ещё предстояло открыть. Соответствующие вакантные места обозначены им знаком вопроса и вы можете видеть их на рисунке выше. В дальнейшем были действительно открыты соответствующие элементы: Галий, Германий, Скандий. Таким образом Дмитрий Иванович не только систематезировал элементы в группы и периоды, но и предсказал открытие новых, ещё не известных, элементов.
В дальнейшем, после разрешения многих актуальных загадок химии того времени — открытие новых элементов, выделение группы благородных газов совместно с участием Уильяма Рамзая, установления того факта, что Дидимий вовсе не является самостоятельным элементом, а является смесью двух других, — были опубликованы всё новые и новые варианты таблицы, подчас имеющих даже вовсе и не табличный вид. Но не будем приводить здесь их все, а приведём лишь конечный вариант, сформировавшийся ещё при жизни великого учёного.
Переход от атомных весов к заряду ядра.
К сожалению, Дмитрий Иванович не дожил до планетарной теории строения атома и не видел триумф опытов Резерфорда, хотя именно с его открытиями начинается новая эпоха в развитии периодического закона и всей периодической системы. Напомню что из опытов, проводимых Эрнестом Резерфордом, следовало, что атомы элементов состоят из положительно-заряженного атомного ядра и обращающихся вокруг ядра отрицательно-заряженных электронов. После определения зарядов атомных ядер всех, известных на тот момент, элементов, выяснилось, что в периодической системе они располагаются в соответствии с зарядом ядра. А периодический закон приобрёл новый смысл, теперь он стал звучать так:
«Свойства химических элементов, а также формы и свойства, образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов»
Теперь стало понятно, почему некоторые более лёгкие элементы были поставлены Менделеевым позади их более тяжёлых предшественников, — всё дело в том, что так они стоят по порядку зарядов их ядра. Например, теллур тяжелее йода, однако стоит в таблице раньше него, ибо заряд ядра его атома и количество электронов равняется 52, а у йода — 53. Можете посмотреть на таблицу и убедиться в этом сами.
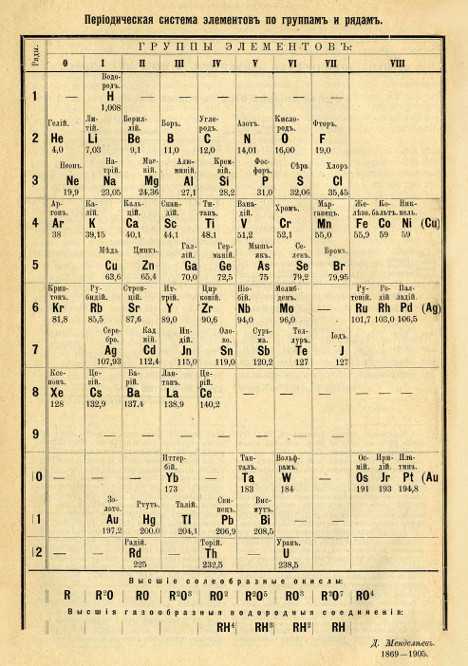
После открытия строения атома и атомного ядра, периодическая система претерпевала ещё несколько изменений, пока, наконец, не достигла вида, уже знакомого нам со школы, короткопериодного варианта таблицы Менделеева.
 В этой таблице нам знакомо уже всё: 7 периодов, 10 рядов, побочные и главные подгруппы. Также со временем открытия новых элементов и наполнения ими таблицы, пришлось вынести в отдельные ряды элементы подобные Актинию и Лантану, все они соответственно были названы Актиноидами и Лантаноидами. Эта версия системы просуществовала очень долго — в мировом научном сообществе практически до конца 80х, начала 90х, а в нашей стране и того дольше — до 10х годов нынешнего столетия.
В этой таблице нам знакомо уже всё: 7 периодов, 10 рядов, побочные и главные подгруппы. Также со временем открытия новых элементов и наполнения ими таблицы, пришлось вынести в отдельные ряды элементы подобные Актинию и Лантану, все они соответственно были названы Актиноидами и Лантаноидами. Эта версия системы просуществовала очень долго — в мировом научном сообществе практически до конца 80х, начала 90х, а в нашей стране и того дольше — до 10х годов нынешнего столетия.
Современный вариант таблицы Менделеева.
Однако, тот вариант, которые многие из нас проходили в школе на деле оказывается весьма запутанным, а путаница выражается в разделении подгрупп на главные и побочные и запоминание логики отображения свойств элементов становится достаточно сложным. Конечно, несмотря на это, многие по нему учились, становились докторами химических наук, но всё же в современности ему на смену пришёл новый вариант — длиннопериодный. Отмечу, что именно этот вариант является одобренным IUPAC (международным союзом теоретической и прикладной химии). Давайте взглянем на него.
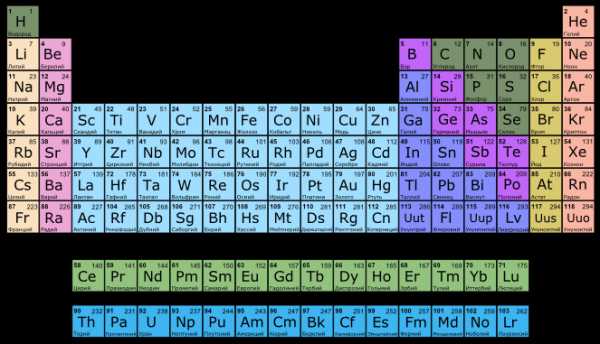
На смену восьми группам пришли восемнадцать, среди которых нет уже никакого разделения на главные и побочные, а все группы продиктованы расположением электронов в атомной оболочке. Заодно избавились и от двухрядных и однорядных периодов, теперь все периоды содержат только один ряд. Чем же удобен такой вариант? Теперь периодичность свойств элементов просматривается более наглядно. Номер группы, по сути, обозначает количество электронов во внешнем уровне, в связи с чем все главные подгруппы старого варианта расположились в первой, второй и с тринадцатой по восемнадцатую группу, а все «бывшие побочные» группы разместились в середине таблицы. Тем самым теперь из таблицы хорошо видно, что если это первая группа — то это щелочные металлы и никаких вам меди или серебра, и видно, что все транзитные металлы хорошо демонстрируют схожесть их свойств в связи с заполнением d-подуровня, в меньшей степени влияющим на внешние свойства, также как и лантаноиды и актиноиды проявляют подобные свойства по причине разного лишь f-подуровня. Таким образом, вся таблица разбита на следующие блоки: s-блок, на котором заполняются s-электроны, d-блок, p-блок и f-блок, с заполнением d, p, и f-электронов соответственно.
К сожалению, в нашей стране этот вариант включился в школьные учебники лишь в последние 2-3 года, да и то не во все. И очень напрасно. С чем это связано? Ну во-первых, с застойными временами в лихие 90-е, когда в стране не было вообще никакого развития, не говоря уж о сфере образования, а именно в 90е годы мировое химическое сообщество перешло на этот вариант. Во-вторых, с лёгкой инертностью и тяжестью восприятия всего нового, ведь нашим преподавателям привычен именно старый, короткопериодный вариант таблицы, несмотря на то, что при изучении химии он гораздо сложнее и менее удобен.
Расширенный вариант периодической системы.
Но время не стоит на месте, наука и технологии тоже. Уже открыт 118 элемент периодической системы, а значит скоро придётся открывать следующий, восьмой, период таблицы. Кроме того, появится новый энергетический подуровень: g-подуровень. Элементы его составляющие придётся вынести вниз таблицы, подобно лантаноидам или актиноидам, либо расширить эту таблицу ещё в два раза, так что она перестанет помещаться на лист формата A4. Здесь я приведу лишь ссылку на википедию (см. Расширенная периодическая система) и не буду лишний раз повторять описание этого варианта. Кому станет интересно — сможет пройти по ссылке и ознакомиться.
В этом варианте ни f-элементы (лантаноиды и актиноиды) ни g-элементы («элементы будущего» с №№ 121-128) не вынесены отдельно, а делают таблицу шире на 32 клетки. Также элемент Гелий помещён во вторую группу, так как он входит в s-блок.
В целом, же вряд ли будущие химики будут пользоваться этим вариантом, скорее всего на смену таблице Менделеева придёт одна из альтернатив, которые уже выдвигаются смелыми учёными: система Бенфея, «Химическая галактика» Стьюарта или иной вариант. Но это будет уже только после достижения второго острова стабильности химических элементов и, скорее всего, нужно будет больше для наглядности в ядерной физике, чем в химии, ну а нам пока хватит старой доброй периодической системы Дмитрия Ивановича.
xn—-7sbbaecnhbaa5b5ahdr7gqd.xn--p1ai
Мой блог: Таблицы по химии
Периодическая система химических элементов Д.И. МенделееваЭлектроотрицательность химических элементов по Л. Полингу
Электронные формулы атомов химических элементов
Названия и состав минералов
Степени окисления химических элементов
Растворимость некоторых веществ в воде и их молекулярные или формульные массы
Ряд электроотрицательности неметаллов
Количественные величины в химии
Окраска индикаторов в различных средах
Распознавание органических веществ

Качественные реакции на катионы

Качественные реакции на анионы
novostixim.blogspot.com
Как научиться читать таблицу химических элементов Д.И. Менделеева ? железо в таблице менделеева ? Естественные науки
В XIX веке считалось, что атомная масса является главной характеристикой элемента, поэтому для классификации веществ использовали именно ее. Сейчас атомы определяют и идентифицируют по величине заряда их ядра (числу протонов и порядковому номеру в таблице Менделеева). Впрочем, атомная масса элементов за некоторыми исключениями (например, атомная масса калия меньше атомной массы аргона) увеличивается соразмерно их заряду ядра.При увеличении атомной массы наблюдается периодическое изменение свойств элементов и их соединений. Это металличность и неметалличность атомов, атомный радиус и объем, потенциал ионизации, сродство к электрону, электроотрицательность, степени окисления, физические свойства соединений (температуры кипения, плавления, плотность), их основность, амфотерность или кислотность.
Сколько элементов в современной таблице Менделеева
Таблица Менделеева графически выражает открытый им периодический закон. В современной периодической системе содержится 112 химических элементов (последние – Мейтнерий, Дармштадтий, Рентгений и Коперниций). По последним данным, открыты и следующие 8 элементов (до 120 включительно), но не все из них получили свои названия, и эти элементы пока еще мало в каких печатных изданиях присутствуют.
Каждый элемент занимает определенную клетку в периодической системе и имеет свой порядковый номер, соответствующий заряду ядра его атома.
Как построена периодическая система
Структура периодической системы представлена семью периодами, десятью рядами и восемью группами. Каждый период начинается щелочным металлом и заканчивается благородным газом. Исключения составляют первый период, начинающийся водородом, и седьмой незавершенный период.
Периоды делятся на малые и большие. Малые периоды (первый, второй, третий) состоят из одного горизонтального ряда, большие (четвертый, пятый, шестой) – из двух горизонтальных рядов. Верхние ряды в больших периодах называются четными, нижние – нечетными.
В шестом периоде таблицы после лантана (порядковый номер 57) находятся 14 элементов, похожих по свойствам на лантан, – лантаноидов. Они вынесены в нижнюю часть таблицы отдельной строкой. То же самое относится и к актиноидам, расположенным после актиния (с номером 89) и во многом повторяющим его свойства.
Четные ряды больших периодов (4, 6, 8, 10) заполнены только металлами.
Элементы в группах проявляют одинаковую высшую валентность в оксидах и других соединениях, и эта валентность соответствует номеру группы. Главные подгруппы вмещают в себя элементы малых и больших периодов, побочные – только больших. Сверху вниз металлические свойства усиливаются, неметаллические – ослабевают. Все атомы побочных подгрупп – металлы.
www.kakprosto.ru
Таблица Менделеева | Глубинная информация
Подлинная Таблица Менделеева

Глава из статьи: В.Г. Родионов. Место и роль мирового эфира в истинной таблице Д.И. Менделеева
6. Argumentum ad rem
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная ф а л ь ш и в к а .
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник «Основы химии», VIII издание). И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации диссертации в журнале ЖРФМ Русского Физического Общества.
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева — сын друга и соратника Д. И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, Меншуткин действовал не в одиночку, — он лишь выполнял заказ. Ведь, новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д. И. Менделеева был фальсифицирован.
Главное искажение Таблицы — перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент «Х» (по Менделееву — «Ньютоний»),- т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент «Х» есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.

Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
«… Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую … Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими … Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород. Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через «y». Ему, очевидно, будут принадлежать коренные свойства аргоновых газов … «Короний», плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром. Этот элемент «у», однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу «х», который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его «Ньютонием» — в честь бессмертного Ньютона … Задачу тяготения и задачи всей энергетики (!!! — В.Родионов) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом» («Попытка химического понимания мирового эфира». 1905 г., стр. 27).

«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!! — В.Родионов) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года …» («Основы химии». VIII изд., 1906 г., стр. 613 и след.)
Скачать статью В.Г. Родионов
полная версия.
Предлагаем посмотреть другие интересные Научные статьи.
Вашему вниманию представлен доклад русского учёного, исследователя и изобретателя Рыбникова Юрия Степановича на тему «Настоящая таблица Менделеева и её ошибки»
www.glubinnaya.info
А теперь о «Таблице Менделеева»
Каждый советский школьник, знавший химию на отлично (я, например), был уверен в следующем факте: Периодический закон и Периодическая система химических элементов были изобретены великим русским ученым Менделеевым, и точка. Первенство, уникальность и гений Менделеева не подлежали никакому сомнению.
Но на первом курсе университета, в учебнике немецкого языка мной с удивлением был обнаружен текст под названием Lothar Meyer, из которого я узнал, что у периодической системы как минимум два автора, которые сделали открытия вроде бы как независимо друг от друга. И это зародило серьезные сомнения в уникальности гения, тем более что своё открытие немец Лотар Мейер опубликовал… в 1864 году, на 5 лет раньше Менделеева (1869).
Сегодня вы можете узнать настоящую историю открытия Периодического Закона.
Немаловажным является тот факт, что оба ученых — и Лотар Мейер, и Дмитрий Менделеев, в 1860-м году посетили съезд химиков в Карлсруэ, Германия. На этом съезде идея зависимости свойств химических элементов от их атомных весов просто витала в воздухе.
Но еще задолго до этого съезда попытка систематизации элементов была сделана Дёберайнером (в 1829 году). Идеи Дёберайнера в 1843 году развил другой немецкий химик Леопольд Гмелин, который показал, что взаимосвязь между свойствами элементов и их атомными массами значительно сложнее, чем триады Дёберайнера.
Француз де Шанкуртуа в 1862 предложил систематизацию химических элементов, основанную на закономерном изменении атомных масс — «земную спираль». Де Шанкуртуа был одним из первых учёных, отметивших периодичность свойств элементов; его винтовой график действительно фиксирует закономерные отношения между атомными массами элементов.
Таблица де Шанкуртуа (1862):

Химик Джон Ньюлендс в августе 1864 года составил таблицу, в которой расположил все известные элементы в порядке увеличения их атомных весов. Он, безусловно, первым дал ряд элементов, расположенных в порядке возрастания атомных масс, присвоил химическим элементам соответствующий порядковый номер и заметил систематическое соотношение между этим порядком и физико-химическими свойствами элементов. Но его таблица имела ряд недостатков (напр. в некоторых ячейках было по два элемента), поэтому была воспринята научным обществом скептически.
Таблица Ньюлендса:
В 1864 же году Уильям Одлинг опубликовал таблицу, в которой элементы были размещены согласно их атомным весам и сходству химических свойств, однако не сопроводил её какими-либо комментариями.
И в том же 1864 году опубликована книга Лотара Мейера «Die modernen Theorien der Chemie» (Современная Теория Химии), и его первая таблица из 28 элементов, размещённых в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное изменение атомной массы в рядах сходных элементов. Мейер указал, что если элементы располагаются в порядке их атомных весов, они попадают в группы, в которых подобные химические и физические свойства повторяются через определенные промежутки.
Ранняя версия таблицы Мейера (1862):
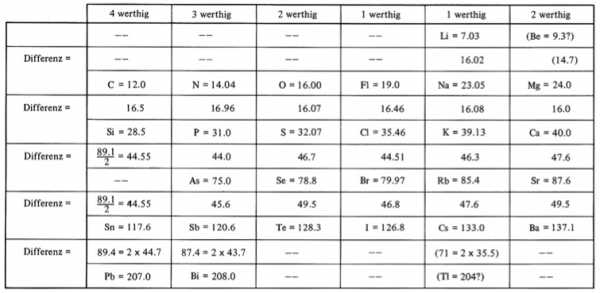
Доработанная версия таблицы (1870):
Через пять лет после Мейера, в 1969 году Менделеев опубликовал доклад, в котором сообщил об открытии им зависимости между атомными весами элементов и их химическими свойствами. В том же году он опубликовал «Основы химии», в которых был приведен первый вариант его таблицы, содержащей 19 горизонтальных рядов и 6 вертикальных. Таблица Менделеева весьма значительно отличались от той, которую Вы видели на уроках химии. На то время было известно только 63 элемента, из которых один — дидим — оказался смесью празеодима и неодима.
Первый вариант таблицы Менделеева (1869):

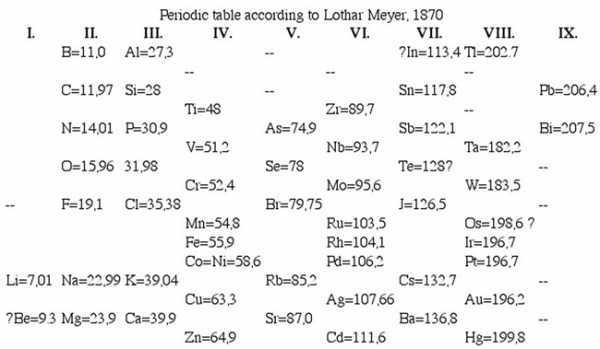
В 1870 году вышла работа Мейера, содержащая обновленную таблицу под названием «Природа элементов как функция их атомного веса», состоявшая из девяти вертикальных столбцов. Сходные элементы располагались в горизонтальных рядах таблицы; некоторые ячейки Мейер оставил незаполненными. Таблица сопровождалась графиком зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид, прекрасно иллюстрирующий термин «периодичность».
В ноябре 1870 года Менделеев опубликовал статью «Естественная система элементов и применение её к указанию свойств неоткрытых элементов», в которой он впервые употребил термин «периодический закон» и указал на существование нескольких не открытых ещё элементов и предсказал их свойства (так же, как и у Мейера, таблица Менделеева имела незаполненные ячейки).
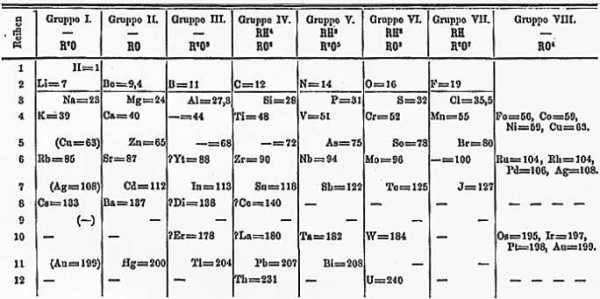
В 1871-м году Менделеев сформулировал закон как: «Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
В 1882 году Мейер и Менделеев одновременно получили медали от Royal Society (Королевского общества) за их исследования в области Периодического закона. Необходимо знать, что таблицы Мейера и Менделеева и в 1870-м, и в 1871-м, и в 1891-м годах все еще значительно отличались от привычной нам и по форме, и по содержанию: даже в 1891-м году, к примеру, там не было благородных газов.
Таблица элементов версии 1871 года:
Доработанная таблица Менделеева, 1891 год, благородные газы все еще отсутствуют, зато есть дидим:

Еще одна версия таблицы 1891 года (напоминает таблицу де Шанкуртуа, не находите?):
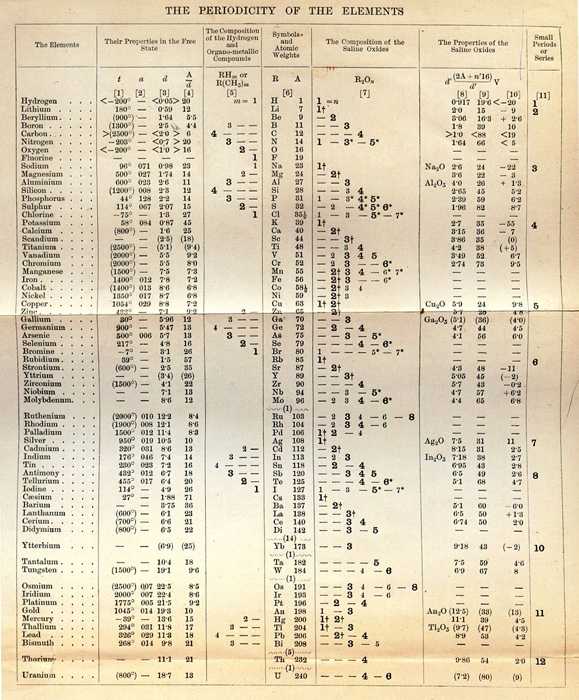
Но самое главное заключается в том, что заблуждались и Мейер, и Менделеев. Современный закон звучит так: «Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от ЗАРЯДА ЯДЕР атомов элементов». То есть не от атомного веса (массы), а от заряда ядер. Это в корне меняет всю суть закона. Ведь существуют изотопы — атомы одного элемента с одним зарядом ядер, практически одинаковыми химическими свойствами, но разной атомной массой (водород, дейтерий и тритий; уран 235 и уран 238 и т.п.).
Для того, чтобы прийти к этой формулировке Закона и современному виду Таблицы элементов, потребовались многие годы работы и исследования Рамзая, Браунера, Сведберга, Содди, Мозли и других ученых.
В 1911 году голландец Ван Дер Брук предположил совпадение атомного номера с величиной положительного заряда ядра атома, что стало основой современной классификации химических элементов. В 1920-м году англичанин Чедвик экспериментально подтвердил гипотезу Ван ден Брука; тем самым был раскрыт физический смысл порядкового номера элемента в Периодической системе, а закон приобрел современную формулировку (зависимость от заряда ядер).
И, наконец, в 1923 году Нильс Бор заложил основы современного представления о теории Периодического закона: причина периодичности свойств элементов заключается в периодическом повторении строения внешнего электронного уровня атома.
Нужно ли говорить, что на сегодня в Таблице присутствуют (существуют в природе и синтезированы) 118 химических элементов, в отличие от 63-х, известных во второй половине 19 века; а короткая версия Таблицы, которую вы видели в школе, официально отменена на международном уровне в 1989 году (хоть и продолжает приводиться в большом числе российских справочников и пособий и после этого времени). Кроме основного общепринятого вида таблицы, существует множество форм (иногда довольно вычурных), предложенных разными учеными.
Современная таблица:
Резюме: при всем уважении к Менделееву и его работам, он внес важный вклад, но был лишь одним из многих, приложивших руку к тому, что мы сегодня называем Периодическим законом и Периодической системой химических элементов. И да, в тех исследованиях Мейер его в общем-то опередил, хотя в 19 веке разница в пять лет считалась «практически одновременно» 🙂 Сравнив вид таблиц Менделеева и современной (и формулировки законов), становится понятно, почему во всем мире таблицу и закон называют просто Периодической таблицей элементов и Периодическим законом — из уважения к огромному труду большого количества ученых.
Если Вы дочитали до этого места — Вы молодец 🙂
brandexpert.livejournal.com
Таблица Менделеева. Такая разная. : moris_levran
1 марта 1869 года Менделеев закончил свою работу «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Этот день считается днём открытия периодического закона элементов Д.М. Менделеева. «Открытие Д.И. Менделеева относится к фундаментальным законам мироздания, таким как закон всемирного тяготения Ньютона или теория относительности Эйнштейна, а Д.М. Менделеев стоит в одном ряду с именами этих великих физиков». Академик А.И. Русанов.«Периодическая система как была, так и осталась в самых новейших решениях проблемы о веществе главной путеводной звездой». Проф. А. Н. Реформатский.
«Когда подходишь к оценке личностей, подобных Д. И. Менделееву, к анализу их научного творчества, невольно является желание отыскать в этом творчестве элементы, всего более отмеченные печатью гения. Из всех признаков, отличающих гениальность и ее проявление, два, кажется, являются наиболее показательными: это, во-первых, способность охватывать и объединять широкие области знания и, во-вторых, способность к резким скачкам мысли, к неожиданному сближению фактов и понятий, которые для обыкновенного смертного кажутся далеко стоящими друг от друга и ничем не связанными, по крайнем мере до того момента, когда такая связь будет обнаружена и доказана». Л. А. Чугаев, профессор химии.
Да и сам Менделеев понимал огромное значение открытого им закона для науки. И верил в его дальнейшее развитие. «По видимому, периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает». Д.И. Менделеев.
Первоначальный вид таблицы, написанный рукой Д.И. Менделеева.
Если бы все научные знания мира пропали бы, из-за какого либо катаклизма, то для возрождения цивилизации одним из главных законов стал бы периодический закон Д.И. Менделеева. Успехи атомной физики, включая ядерную энергетику и синтез искусственных элементов, стали возможными лишь благодаря Периодическому закону. В свою очередь, они расширили и углубили сущность закона Менделеева.
Периодический закон сыграл огромную роль в развитии химии и других естественных наук. Была открыта взаимная связь между всеми элементами, их физическими и химическими свойствами. Это поставило перед естествознанием научно-философскую проблемы огромной важности: эта взаимная связь должно получить объяснение.
Открытию периодического закона предшествовало 15 лет напряженной работы. Ко времени открытия периодического закона было известно 63 химических элемента, существовало около 50 различных классификаций. Большинство ученых сравнивали между собой только сходные по свойствам элементы, поэтому не смогли открыть закон. Менделеев же сравнивал между собой все, в том числе и несходные элементы. Менделеев выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях, расположил их в порядке возрастания их относительных атомных масс и всесторонне проанализировал всю эту совокупность, пытаясь найти в ней определенные закономерности. В результате напряженного творческого труда он обнаружил в этой цепочке отрезки, в которых свойства химических элементов и образованных ими веществ изменялись сходным образом – периодически – периоды. С развитием учения о строении электронной оболочки атомов стало ясно, почему свойства атомов показывают периодичность с возрастанием атомной массы. Атомы с одинаковой внешней сферой составляют одну группу. Атомы с одинаковым числом внешних сфер — составляют один ряд. Атомы с ядрами, имеющими одинаковые заряды, но разные массы, обладают одинаковыми химическими свойствами, но разными атомными весами и представляют собой изотопы одного и того же химического элемента. По существу свойства атомов отражают свойства внешних электронных оболочек, которые тесно связанны с законами квантовой физики.
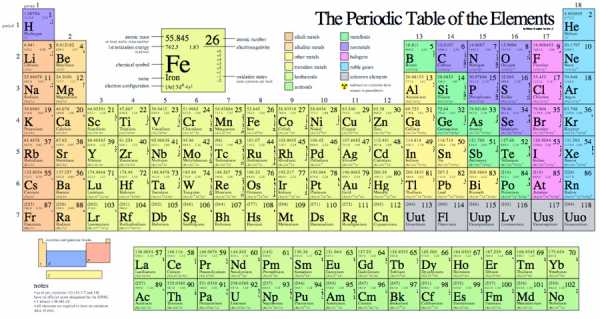
Сама таблица Менделеева много раз трансформировалась, отображая разную информацию о свойствах атомов. Встречаются и курьёзные таблицы.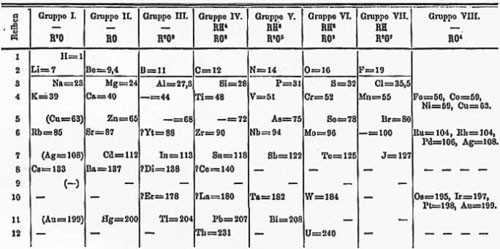
Так называемая короткопериодная или короткая форма ТМ 
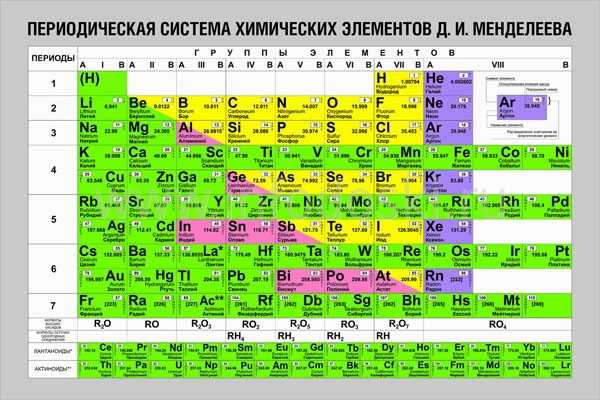
Длиннопериодная или длинная форма ТМ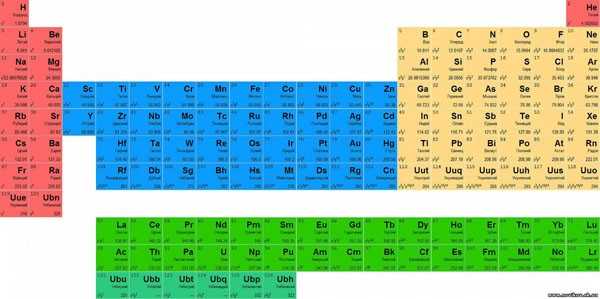
Сверхдлинная.
Флаги государств, обозначающие страну, где впервые открыли данный элемент.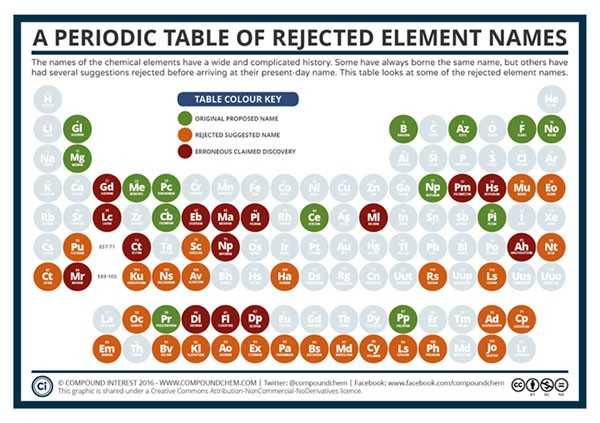
Названия элементов, которые были отменены или оказались ошибочными, как например, история с дидимом Di — оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима.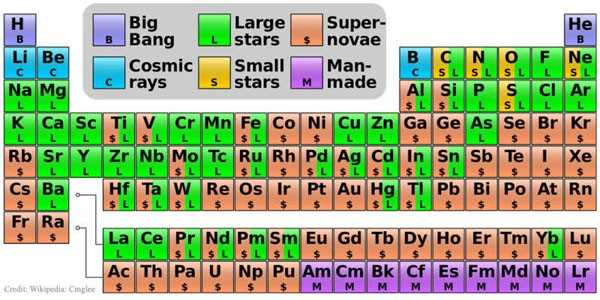
Здесь синим цветом обозначены элементы, образованные во время Большого Взрыва, голубым — синтезированные во время первичного нуклеосинтеза, жёлтые и зелёные цвета обозначают элементы, синтезированные соответственно в недрах «малых» и «больших» звёзд. Розовым цветом — вещества (ядра), синтезируемые во время вспышек сверхновых звёзд. Кстати, золото (Au) ещё синтезируется во время столкновений нейтронных звёзд. Фиолетовые — созданные в лабораториях искусственно. Но это ещё не вся история… 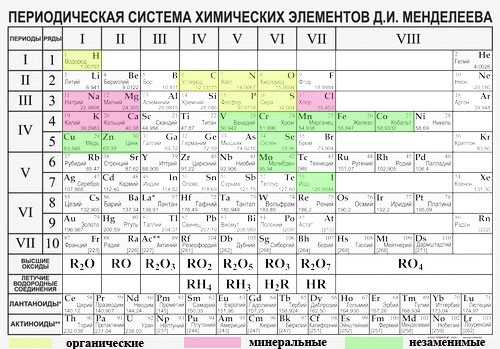
Здесь разными цветами обозначены органические, неорганические и незаменимые элементы, необходимые для построения тел живых существ, в том числе и нас. 


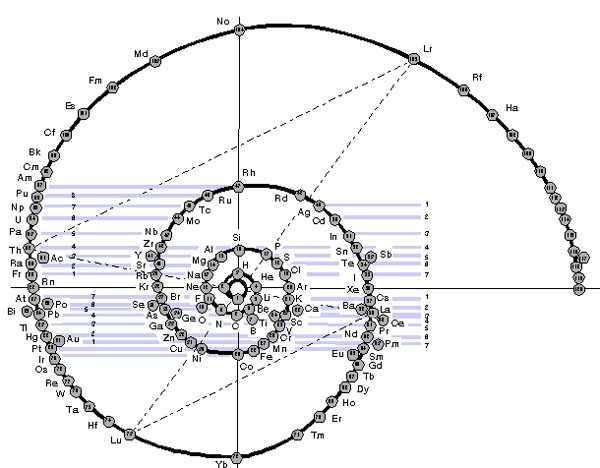
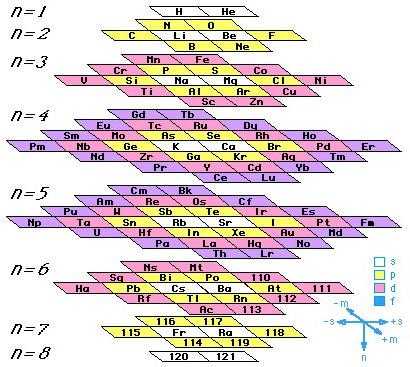
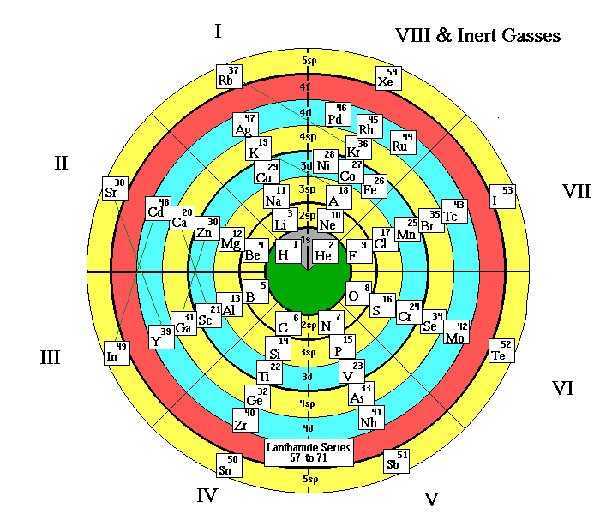

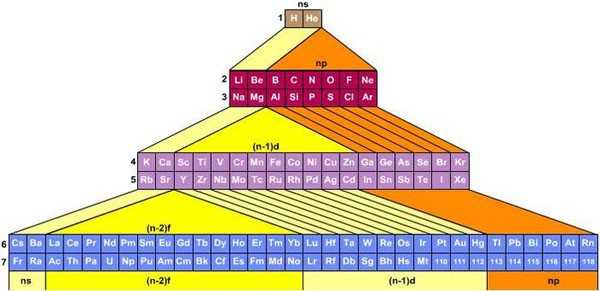
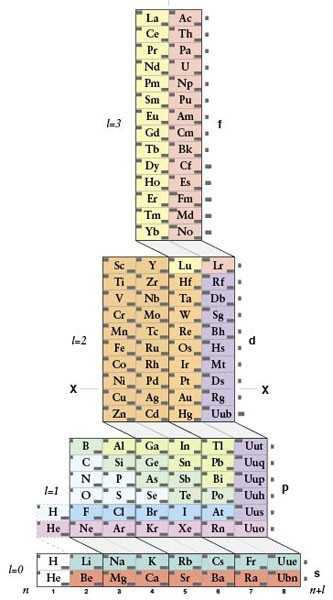
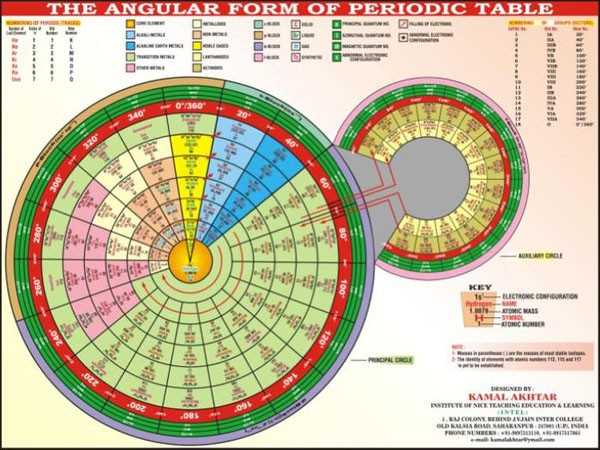

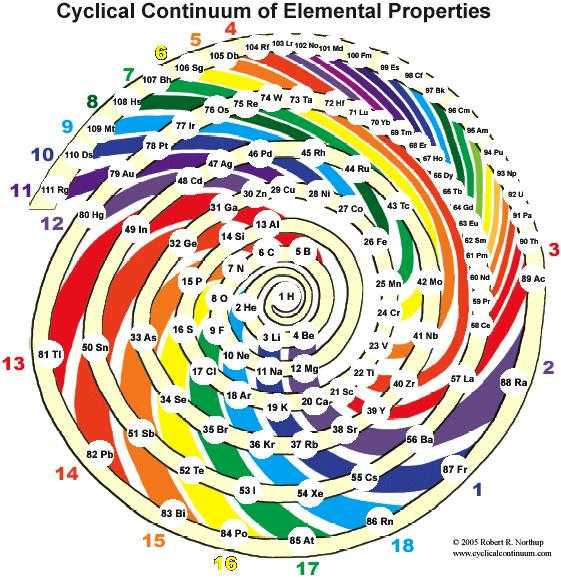
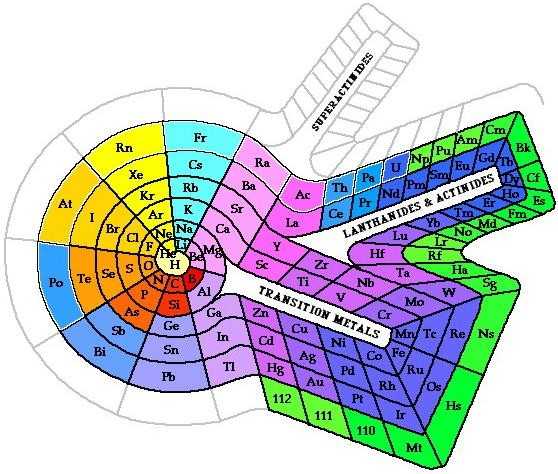
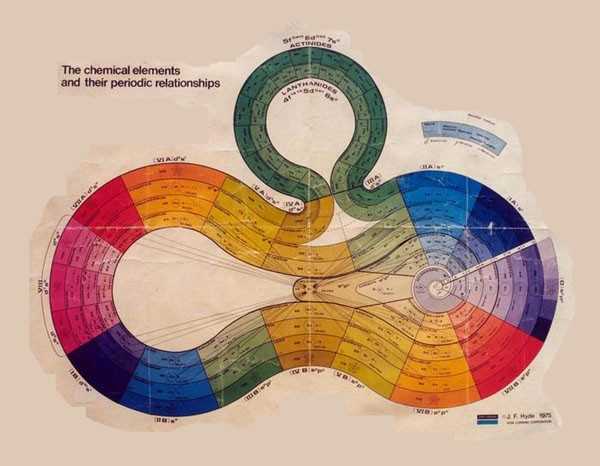
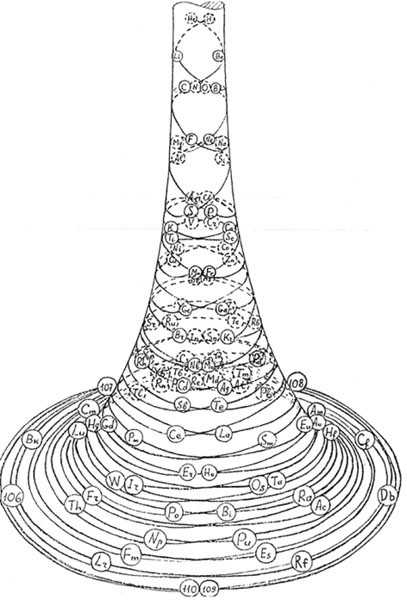
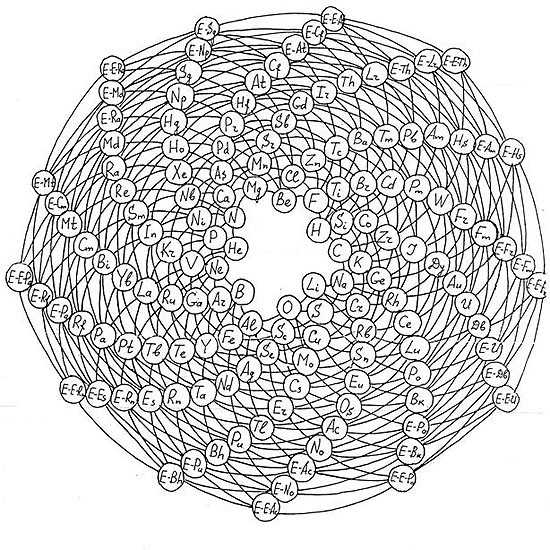
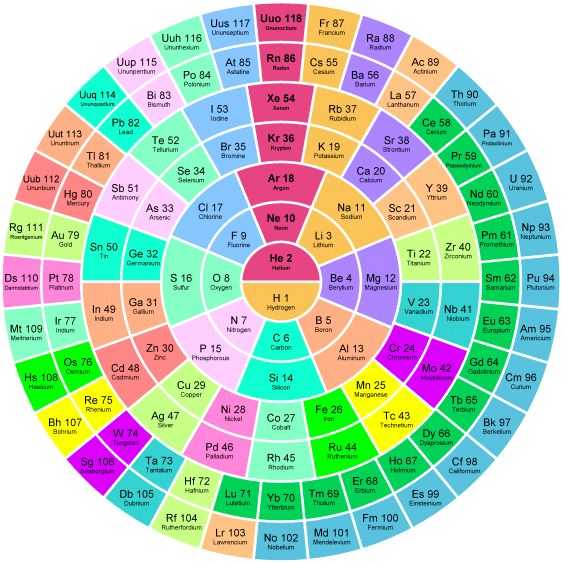
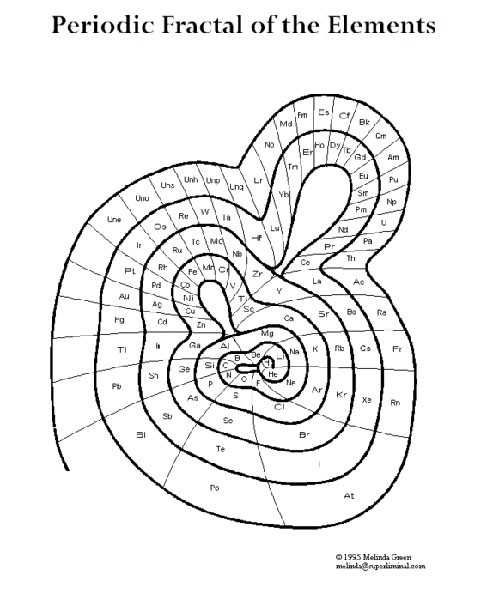

Эти таблицы отображают последовательность заполнения электронных оболочек. Во всяком случае некоторые из них. Все эти таблицы выглядят весьма экзотично.
moris-levran.livejournal.com
Периодическая таблица Менделеева в хорошем качестве
Разумеется, любой, кто учился в школе знает о том, что среди обязательных предметов уже долгие годы располагается химия. В каждом классе обязательно присутствовала периодическая таблица Менделеева в хорошем качестве, без нее никак. Большинству учеников предмет не нравился, а кто-то им увлекался – сейчас главное не это. Скорее всего, все знания, полученные в ходе долгих лет обучения, уже полностью забыты и никак не пригодились в жизни. Однако, как выглядит таблица помнит каждый ученик. Для большинства учеников она осталась обычным полотном на стене, с кучей непонятных квадратиков и букв, вписанных в них.
Когда была открыта периодическая таблица Д.И. Менделеева и сколько элементов в ней
Будущий легендарный химик Д.И. Менделеев появился на свет 8 февраля по новому календарю, и 27 января по-старому, в 1834 году. Семья ученого была многодетной, он был самым младшим из 14 детей. В 10 лет умер отец, мать занималась воспитанием детей. В школе Дмитрий не выделялся на фоне остальных своими способностями. Однако в институте он начал демонстрировать неплохие знания, закончив его с золотой медалью в 1855 году. После чего ученый переезжает в Одессу, после в Германию и Петербург, где и начинается его тернистый путь к великим открытиям.
На сегодняшний день в таблице находится 118 химических элемента, но так было не всегда. Еще во второй половине 19 века было обнаружено лишь 63 элемента. И многие ученые мира безуспешно пытались соединить их в одну определенную концепцию. Сперва предлагали распределить элементы по возрастанию их атомной массы и поделить на группы схожести химических свойств.
Шел 1863 год, Джон Ньюленд, меломан по совместимости химик, предложил собственную версию расстановки химических элементов. Очень похожую на ту, которую открыл сам Менделеев. Однако, все попытки ученого доказать свою правому были отклонены другими химиками. Поскольку автор идеи увлекался музыкой, и искал ее связь с химией, его попросту считали несерьезным.
Именно в 1869, когда была открыта периодическая таблица Д.И. Менделеева и сколько элементов в ней уже было известно, но не до конца. Ученый выложил свою схему в журнале одного из сообществ химиков. Разумеется, в будущем таблица много раз корректировалась, пока не стала, такой, какой ее можно наблюдать сегодня.

На дворе 1871 год, великий химик окончательно доработал свою идею в закон. Также, Менделеев говорил о якобы открытии в будущем новых элементов и даже уточнил их свойства. В дальнейшем, все предсказания ученого случились. Все новые открытые элементы располагают такими же свойствами, какими еще в 19 веке предсказал их Дмитрий Иванович.
Это интересно: Менделеев Дмитрий Иванович краткая биография
Существует былина о том, что Менделеев увидел готовую таблицу во сне. Якобы ученый долгое время не мог представить таблицу в виде четкого и строгого решения без изъянов. Как то, после нескольких дней упорного труда он прилег отдохнуть и уснул. По рассказам Дмитрия Ивановича, во все он увидел таблицу, где все было выстроено, как необходимо. После пробуждения он тут же записал всю нужную информацию, которая оказалось верной практически на 100%. Пришлось внести лишь одну поправку.
Почему таблица Менделеева периодическая и в чем её суть
Данная таблица систематично раскладывает не только элементы, но все разнообразие их свойств. Поэтому, зачастую, ученому достаточно просто взглянуть на нее, чтобы правильно ответить на необходимый вопрос. Почему таблица Менделеева периодическая и в чем её суть – ответ на данный вопрос весьма прост.
Название «периодическая» она получила благодаря тому, что основные горизонтальные ряды называются – периодами. Также смысл великого открытия в том, что с увеличением атомной массы химические характеристики всех элементов меняются с некой периодичностью. Отсюда и название.
В чем тогда ее смысл — для полноценного понимания, следует еще разок направить взор на таблицу. Кроме крепкой связи между составляющими, она показывает ряд очень полезных для изучения химических закономерностей.
Как расположены металлы в периодической таблице Менделеева
В обсуждаемой таблице, металлы прочно заняли свою нишу в главных подгруппах первой и третьей групп. А также в побочных подгруппах, где сформировали отдельное семейство. Они находятся в начале и середине периодов, за счет чего их радиусы выглядят сравнительно больше.
Не глядя в таблицу очень сложно представить расположения элементов, особенно тому, кто не разбирается в химии.
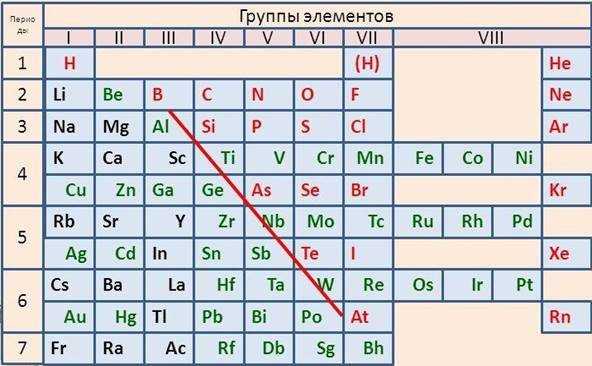
Изображение: Как расположены металлы в периодической таблице Менделеева
На изображении видно диагональ, она является условной и в оригинальной таблице ее конечно же нет. Линия берет начало от B к At через другие элементы. Под диагональю на изображении свою позицию занимают – металлы. Из всех элементов в системе к металлам относят 88.
Периодическая таблица Менделеева металлы неметаллы
Периодический закон является полноценной химической структурой, и дает шанс проанализировать местоположение элементарных веществ с учетом их уникальных свойств. Все знают по школьной программе, что все простые вещества делят на пару категорий – металлы и соответственно неметаллы. Данная классификация базируется на том, что физические свойства элемента имеют значительные отличия от химических свойств.
Итак, периодическая таблица Менделеева, металлы, неметаллы, как распознать где что? Для этого снова потребуется заглянуть в таблицу и провести воображаемую диагональ от элемента B, то есть – Бериллия, к элементу At – Астат.
Таблица разделена, теперь слева под линией располагаются металлы. Кстати, чем ниже от воображаемой черты находится элемент, тем более сильны его характеристики, как металла. В этом невероятно просто убедиться, все что нужно – глянуть в систему. В самом нижнем углу слева уже более столетия расположен Франций. Данный элемент самый мощный из щелочных металлов.
Разумеется, элементы, которые расположены вверху справа являются неметаллами. В данном случае действует то же правило. Чем правее и выше элемент, чем сильнее его неметаллические характеристики. Самый сильный неметалл в таблице Дмитрия Ивановича – Фтор. Он является очень мощным окислителем. Его активность просто невероятна, за что химики ранее давали ему кличку – «Все разгрызающий».

Валентность всех химических элементов таблица
Изначально за одну единицу измерения брали валентность водорода. Данный показатель у иных элементов при этом выражался количеством атомов водорода. Которые подключают к себе или заменяют один из атомов иного элемента.
Что такое валентность — проще говоря, это атом, который может создавать некое число связей с другими атомами.

Принято считать, что валентность определяется колонкой в таблице. На самом деле, все очень правдоподобно, однако на практике химические элементы ведут себя куда сложнее. Причина большого количества значений валентности состоит в том, что имеются разнообразные способы заполнения, с помощью которых происходит стабилизация оболочки электрона. Для простоты понимания и нахождения такого понятия, как валентность всех химических элементов, таблица который была создана еще в 19 веке.
Группы периодической таблицы Менделеева
Что из себя представляют группы периодической таблицы Менделеева? Это построение атомов по усилению ядерного заряда, при этом они обладают одинаковым строением.
Порядковый номер подобных групп вычисляется по количеству расположенных электронов на внешней атомной оболочке. Существует правило, что номер группы равен максимальной валентности атома.
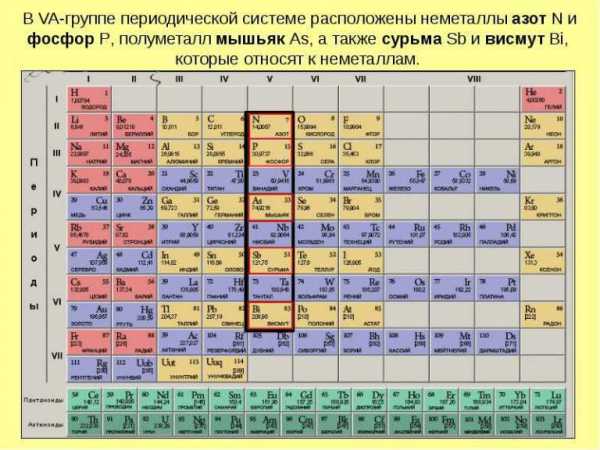
Также имеется некий вариант системы с короткими периодами, в нем группы разделяются на подгруппы – главные и побочные группы. Подгруппы тоже имеют названия по элементу с минимальным зарядом. Элементы с такой же подгруппой имеют очень похожие химические свойства.
Мы рассмотрели статью периодическая таблица Менделеева в хорошем качестве. А вы верите, что она могла ему присниться? Оставьте свое мнение или отзыв для всех на форуме.
womaninc.ru

