Цвет воды — Справочник химика 21
Студент Гейдельбергского университета Карл Левиг в 1825 г. изучал воды минеральных источников Германии. Одна из приготовленных им проб воды обладала интересной особенностью — она желтела под действием хлора. Левиг извлек неизвестное вещество, придававшее желтый цвет воде, с помощью диэтилового эфира, а после испарения эфира обнаружил красно-бурую жидкость с резким неприятным запахом. Студент уже собрался опубликовать результаты своих опытов, но научный руководитель посоветовал повременить. Решено было выделить новое вещество в большем количестве, чтобы иметь возможность детально исследовать его свойства. Но именно в это время 23-летний лаборант-химик Антуан Балар из Монпелье во Франции получил то же самое вещество и сразу отправил его образец в Парижскую академию наук. Известные химики Жозеф Гей-Люссак и Луи Тенар подтвердили открытие нового элемента (Балар назвал его муридом ), но переменили название на производное от греческого зловонный . Какой неметалл открыли Левиг и БаларВкус воды характеризуется определениями соленый, кислый, сладкий, горький, а все остальные вкусовые ощущения называют привкусами. Оценивают вкус по такой же пятибалльной шкале, как и запах, с градациями очень слабый, слабый, заметный, отчетливый, очень сильный. Цвет воды определяют фотометрически, путем сравнения испытуемой воды с эталонными растворами, имитирующими цвет природной воды. Оценивают цвет по специальной шкале цветности с градациями от нуля до 14. Сходным образом исследуют мутность. [c.44]
Для нормирования содержания вредных веществ в воде водоема применяют три лимитирующих показателя вредного действия (пороговые концентрации, мг/л). Санитарно-токсикологический показатель лимитирует токсическое действие данного вещества на людей и животных общесанитарный — нормирует влияние этого вещества на природные свойства водоема и его способность обезвреживать органические вещества органолептический— характеризует вкус, запах, цвет воды водоема после смешения со сточными водами.
Проксанол-305 Подвижная маслообразная жидкость молочно-серого цвета Вода — [c.290]
Х-2647 1 (100 %-ный) Слабоокрашенная подвижная жидкость светло-желтого цвета Вода, бензол [c.290]
Х-2647 (65 %-ный) Подвижная маслянистая жидкость светло-коричневого цвета Вода
Цвет. Растворитель должен иметь цвет воды, т. е. цвет, соот-ветствуюш,ий показателю — -21 по колориметру Сейболта. [c.114]
Совершенно очевидно, что применяемый спецификацией термин цвет воды тре ует более точного определения. Для установления цвета масел и растворителей в нефтяной промышленности широко применяется колориметр Сейболта. По этой причине в спецификацию включено требование о проверке соответствия цве- [c.114]
Цвет в % поглощения света (цвет воды принят за О) [c.134]
Попадая в окружающую среду, углеводороды нефти оказывают угнетающее действие на локальные экологические системы губят живые организмы и существенно изменяют условия их обитания. Нефтяная пленка нарушает энерго-, тепло-, влаго- и газообмен загрязненной водной поверхности с атмосферой, изменяет цвет воды, pH, придает ей специфический вкус и запах, а главное — вызывает наругае-ние физиологической активности у гидробионтов. Обитатели морских и пресных водоемов, подвергаясь токсическому действию нефтепродуктов, обладают способностью аккумулировать их в своих тканях. Углеводороды могут затем по пищевым цепям передаваться в организм человека (например, канцерогенные полициклические компоненты нефти) и отрицательно воздействовать на его здоровье.
Результат опыта. Цвет воды, окружающей диализатор, не изменяется. Следовательно, коллоидные.частицы гидроксида железа (III) не проходят сквозь мембрану. В пробе воды, отобранной через 10—15 мин после начала процесса диализа, обнаруживаются ионы хлора (интенсивное помутнение раствора от прибавления А ЫОз). Таким образом, ионы электролитов (в данном случае ионы хлора) свободно диффундируют сквозь полупроницаемую мембрану. [c.159]
Щ этанол (5к) -I- гексагидрат хлорида кобальта(II) (тв) —> раствор (цвет) + вода (п/к) — изменение окраски. [c.194]
Разумеется, причины, вызывающие дурной запах, плохой вкус и странный цвет воды, изучаются методами химического анализа, чтобы выявить вредоносные примеси и определить их концентрации. Чтобы завершить эту тему, напомню, что на каждую такую примесь имеется свой ПДК — предельно допустимая концентрация, то есть такая, которая не накосит вреда нашему организму Разумеется, есть вещества, вирусы и бактерии, для которых ПДК равен нулю, то есть их вообще не должно быть в воде. Но это не математический, а практический ноль — вредные вещества и микрофлора могут присутствовать, но в столь ничтожной концентрации, что их не определить самыми тонкими и точными методами анализа.
Цвет. ………………………………… подобен цвету воды [c.324]
Цвет воды определяется путем сравнения цвета воды над. погруженным в воду белым диском с цветом жидкости в пробирках шкалы Фореля — Уле. При определении цвета воды
Оценка влияния флокулянтов на органолептические свойства. воды заключается. в определении запаха, привкуса и цвета воды, содержащей различные количества полимера, и наблюдении, за образованием в этой воде пены. [c.55]
Цвет вод, содержащих большие количества взвешенных веществ, определяют после отстаивания. Объективно определить цвет проб довольно трудно, и когда определение цвета провести нельзя, оттенок и интенсивность его описывают словесно. [c.31]
Цвет воды рекомендуется определять измерением ее оптической плотности на спектрофотометре при различных длинах волн проходящего света. Исследуемую воду предварительно профильтровывают, отбрасывая первые порции фильтрата. Оптическую плотность измеряют при толщине слоя 10 см, вторую кювету прибора заполняют дистиллированной водой. Длина волны света, максимально поглощаемого водой, является характеристикой ее цвета. Если на полученной кривой имеется несколько пиков, то соответствующие им длины волн должны быть отмечены.
Прозрачность зависит от цвета воды и ее мутности. Мерой прозрачности служит высота водяного столба, сквозь который можно еще наблюдать черный крест на белой доске с крестом из черных линий шириной 1 мм. определенных размеров или прочесть шрифт определенного типа. Прозрачность воды характеризует наличие в ней взвешенных и коллоидных примесей.
Большой практический интерес представляют те концентрации так называемых ядовитых веществ, которые еще не являются токсичными, о обнаруживаются органами чувств. Очень, часто, например, запах и прив(кус или изменение цвета воды могут быть обнаружены человеком при таких концентрациях ядовитых веществ, которые безвредны для организма. Это относится к веществам, для которых лимитирующими являе
www.chem21.info
Вода. Какой цвет у воды?
Вода. Какой цвет у воды?
Глядя на различные оттенки воды в морях и океанах, задаешься вопросом – а какого же цвета вода? Ведь в стакане она вообще бесцветная.
Оказывается, что чистая вода – голубая. Но эта окраска такая слабая, что в маленьком объёме она незаметна. А вот уже в большом аквариуме будет заметен голубой оттенок воды.
Цвет воды зависит от особенностей поглощения и отражения света молекулами воды.
Белый свет, например солнечный, можно разложить на составляющие цвета. Их совокупность называется спектром. Спектр белого цвета состоит из цветов радуги. Молекулы воды поглощают цвет в красно-зеленой части спектра. А лучи его синей части отражаются молекулами. Поэтому мы воспринимаем цвет воды как голубой.

Однако в естественных водоёмах цвет воды может быть очень разнообразным. Так посреди океана вода имеет глубокий темно-синий, почти фиолетовый, цвет. Вдоль береговой линии оттенки воды меняются от голубого до зелёного и жёлто-зелёного.
Разнообразие оттенков зависит от того, какие именно частицы взвешены в воде и какова глубина водоёма.
Около берега вода океана заполнена мелкими плавающими растениями и органическими частицами, попадающими с суши.
Водные растения, так называемый фитопланктон, содержит хлорофилл, который отражает зелёный цвет. Поэтому около берега вода часто имеет зелёный оттенок.
На снимках из космоса хорошо видно, какие океаны изобилуют жизнью, а какие нет. Так, глубокие синие воды бедны жизнью, а зеленые – ею наполнены.

Поглощение света частицами, взвешенными в воде, меняет восприятие цвета под водой. Представим, что мы погружаемся под воду в известной жёлтой подводной лодке.
Близко от поверхности она будет выглядеть жёлтой, но чем глубже мы погружаемся, тем большее расстояние должен преодолеть луч света от поверхности воды до лодки. Когда она опустится на глубину 30 метров, большинство лучей жёлтого, оранжевого и красного цветов будет поглощено молекулами воды.
До лодки дойдут лучи синей и зелёной части спектра, и выглядеть «еллоу сабмарин» будет сине-зелёной. С увеличением глубины будут отсечены и зелёные лучи, лодка будет казаться тускло-синей.
Мутные воды океана, в которых взвешены органические остатки, поглощают больше света, чем прозрачная чистая вода. Поэтому при погружении в мутную воду темнота наступает быстрее.
Источник: www.gismeteo.ru
Знаете ли вы?
… немного об оптике
… Весьма точные измерения углов преломления света в разных средах произвел еще Клавдий Птолемей (140 год н. э.) Однако установить соотношение между углами падения и углами преломления ему не удалось.
… Своей известностью, причем не только в научных кругах. Ньютон при жизни более всего был обязан своим оптическим исследованиям, а самым популярным его произведением была «Оптика», которая в течение многих десятилетий оставалась энциклопедией науки о свете.
class-fizika.ru
Цвет воды. Определение, свойства воды
Все теории возникновения жизни на Земле так или иначе связаны с водой. Она постоянно рядом с нами, более того, внутри нас. Самая обыкновенная, простая вода, включенная в ткани организма, делает возможным каждый новый вдох и удар сердца. Во всех этих процессах она участвует благодаря своим уникальным свойствам.
Что такое вода: определение
С научной точки зрения главная жидкость планеты представляет собой оксид водорода — бинарное неорганическое соединение. Молекулярная формула воды, пожалуй, известна всем. Каждый структурный элемент ее состоит из одного атома кислорода и двух атомов водорода, соединенных полярной ковалентной связью. При обычных условиях она находится в жидком состоянии, не имеет вкуса и запаха. В малых объемах простая вода без примесей бесцветна.
Биологическая роль
Вода — главный растворитель. Именно характер строения молекулы делает возможным подобное определение. Свойства воды связаны с ее поляризованностью: каждая молекула обладает двумя полюсами. Отрицательный связан с кислородом, а положительный — с атомами водорода. Молекула воды способна образовывать так называемые водородные связи с частичками других веществ, притягивая противоположно заряженные атомы к своему «+» и «-». При этом вещество, которое становится раствором, также должно быть поляризованным. Одна молекула его окружается несколькими частицами воды. После преобразования вещество приобретает большую реакционную способность. В качестве растворителя вода используется всеми клетками живых организмов. Это одно из тех свойств, которые определяют ее биологическую роль.
Три состояния
Вода известна нам в трех формах: жидкой, твердой и газообразной. Первое из названных агрегатных состояний, как уже было сказано, характерно для воды при обычных условиях. При нормальном атмосферном давлении и температуре ниже 0 ºС она становится льдом. Если же нагрев вещества достигает 100 ºС, из жидкости образуется пар.
Нужно заметить, что схожие по строению вещества в нормальных условиях находятся в газообразном состоянии и имеют низкую температуру кипения. Причина относительной стабильности воды — в водородных связях между молекулами. Для перехода в состояние пара необходимо их разорвать. Водородные связи достаточно прочные, и чтобы их разрушить, требуется большое количество энергии. Отсюда и высокая температура кипения.
Поверхностное натяжение
Благодаря водородным связям для воды характерно высокое поверхностное натяжение. В этом плане она уступает только ртути. Поверхностное натяжение возникает на границе двух разных сред и требует затраты определенного количества энергии. Результатом этого свойства являются интересные эффекты. В невесомости капля принимает сферическую форму, так как жидкость стремится сократить собственную поверхность, чтобы сберечь энергию. Аналогично вода ведет себя иногда и на несмачиваемых материалах. Пример — капля росы на листьях. Благодаря силе поверхностного натяжения по глади пруда могут скользить водомерки и другие насекомые.

Изолятор или проводник?
На уроках по безопасности жизнедеятельности детям часто объясняют, что вода хорошо проводит электричество. Однако это не совсем так. В силу особенностей своего строения чистая вода слабо диссоциирована и не проводит ток. То есть, по сути, она является изолятором. Вместе с тем в обычных условиях встретить настолько чистую воду практически нельзя, поскольку она растворяет многие вещества. И благодаря многочисленным примесям жидкость становится проводником. Более того, по способности проводить электричество можно определить, насколько вода чистая.
Преломление и поглощение
Еще одно свойство воды, известное со школы всем, — это способность преломлять световые лучи. Пройдя сквозь жидкость, свет несколько изменяет свое направление. С этим эффектом связано формирование радуги. Также преломление света и наше восприятие его лежат в основе ошибок в определении глубины водоемов: она всегда кажется меньшей, чем на самом деле.
Однако преломляется свет видимой части спектра. А, например, инфракрасные лучи водой поглощаются. Именно поэтому возникает парниковый эффект. Для понимания скрытых возможностей воды в этом смысле можно обратиться к характеристикам атмосферы на Венере. По одной из версий к парниковому эффекту на этой планете привело испарение воды.
Цвет воды
Каждый, кто видел море или любой пресный водоем и сравнивал его с жидкостью в стакане, замечал некое несоответствие. Цвет воды в природном или искусственном водоеме никогда не совпадает с тем, что наблюдается в чашке. В первом случае он голубой, синий, даже зеленовато-желтый, во втором просто отсутствует. Так какого цвета вода на самом деле?
Оказывается, что чистая жидкость не бесцветна. Она обладает легким голубоватым оттенком. Цвет воды настолько бледный, что в малых объемах она кажется абсолютно прозрачной. Однако в природных условиях она предстает во всей красе. Более того, многочисленные примеси, как и в случае с проведением электричества, изменяют свойства воды. Все встречали хотя бы однажды зеленый пруд или коричневатые лужи.
Цвет воды и жизнь
Окраска водоема часто зависит от микроорганизмов, активно размножающихся в нем, примеси горных пород. Зеленоватый цвет воды часто свидетельствует о наличии мелких водорослей. В море участки, окрашенные в такой оттенок, как правило, изобилуют живностью. Поэтому рыбаки всегда обращают внимание на то, какого цвета вода. Чистые синие воды бедны планктоном, а значит, и теми, кто им питается.
Иногда микроорганизмы придают самые причудливые оттенки. Известны озера с шоколадной по цвету водой. Деятельность одноклеточных водорослей и бактерий сделала бирюзовым водоем на острове Флорес в Индонезии.

В Швейцарии на перевале Sanetsch расположилось озеро с ярко-розовой водой. Чуть более бледный оттенок имеет водоем в Сенегале.
Разноцветное чудо
Поразительное зрелище предстает перед туристами в Америке, в национальном парке Йеллоустон. Здесь расположено озеро Morning Glory. Его воды имеют чистейший голубой цвет. Причина такого оттенка — все те же бактерии. Йеллоустон славится многочисленными гейзерами и горячими источниками. На дне озера Morning Glory расположено узкое жерло вулкана. Поднимающееся оттуда тепло и поддерживает температуру воды, а также развитие бактерий. Когда-то все озеро было кристально-голубого цвета. Однако со временем жерло вулкана засорилось, чему поспособствовали и туристы со своей любовью бросать монетки и другой мусор. В результате температура поверхности снизилась, здесь стали размножаться другие типы бактерий. Сегодня окраска воды меняется с глубиной. На дне озеро по-прежнему насыщенного голубого цвета.

Несколько миллиардов лет назад вода способствовала появлению жизни на Земле. С тех пор ее значение нисколько не уменьшилось. Вода необходима для целого ряда химических реакций, протекающих на клеточном уровне, она входит в состав всех тканей и органов. Мировой океан покрывает примерно 71% поверхности планеты и играет огромную роль в поддержании стабильности состояния такой гигантской системы, как Земля. Физические и химические свойства воды позволяют назвать ее главным веществом для всего живого. Водоемы, являясь местом обитания многоклеточных микроорганизмов, кроме того, становятся источником красоты и вдохновения, демонстрируют огромные творческие способности природы.
fb.ru
запах, цвет, прозрачность, вкус, плотность, температура, вязкость, сжимаемость, электропроводность и радиоактивность
Свойства воды. Физические свойства воды.
Вещество, которое имеет молекулярное строение является водой. Молекулы воды имеют между собой прочную связь, не зависимо от того в твердом или жидком состоянии она находится. Благодаря этому вода и обладает довольно большим количеством физических свойств. Давайте рассмотрим какими удивительными физическими свойствами обладает вода.
В условиях комнатной температуры вода находится в жидком состоянии без запаха и прозрачного цвета. Вода не имеет цвета в тонком слое, но если толщина водяного слоя составляет несколько метров, она приобретает голубой оттенок. Чистая вода обладает плохой проводимостью тока. Поэтому по проходимости тока можно определять чистоту воды – чем нижу будет уровень электропроводности, тем чище будет вода. Большинство веществ, которые находятся в твердом состоянии наблюдается более высокая плотность, чем в жидком состоянии. Но в отличии от всех этих веществ, вода, которая находится в твердом состоянии (лед) обладает более низкой плотностью, чем в жидком состоянии.
Вода медленно нагревается благодаря высокой теплоемкости, но тем не менее процесс остывания происходит намного медленнее. Это дает возможность в летнее время года накапливать тепло океанам и морям, а высвобождение тепла происходит в зимний период, именно поэтому нет резкого перепада температуры воздуха на территории нашей планеты на протяжении всего года. Океаны и моря – это оригинальный и природный аккумулятор тепла на территории нашей планеты.
Основными физическими свойствами воды являются – запах, цвет, прозрачность, вкус, плотность, температура, вязкость, сжимаемость, электропроводность, а также радиоактивность.
Цвет подземных вод будет напрямую зависеть от ее химического состава, а также от механических примесей, которые находятся в воде. Чаще всего подземные воды не имеют цвета. Воды болотного происхождения обладают желтоватым оттенком, а также в их состав входят гуминовые вещества. Изумрудный оттенок присутствует в сероводородных водах. Оценку цвета воды необходимо проводить с помощью стандартной платино-кобальтовой шкале в градусах.
В подземных водах, в большинстве случаев, отсутствует запах. Если в воде присутствует запах, это говорит о том, что в воде присутствует наличие газов биохимического происхождения, а также может являться признаком того, что в воде находятся гниющие органические вещества. Характер запаха определяется описательно – сероводородный, без запаха, гнилостный, болотный, плесневелый и др. По шкале в балах происходит оценка интенсивности запахов.
От состава растворенных в воде веществ будет зависеть ее вкус. Из-за присутствия в воде хлористого натрия преобладает соленый вкус, из-за сульфата магния – горький, а благодаря солям железа – ржавый вкус. Воды, в которых находится большое количество органических веществ имеют сладковатый вкус, а освежающий вкус получается благодаря наличию свободной углекислоты. По специальной таблице в баллах происходит оценка вкуса воды.
От количества растворенных в воде минеральных веществ, коллоидов, органических веществ, а также содержания механических примесей будет зависеть ее прозрачность. Для определения степени прозрачности подземных вод используется следующая номенклатура – слабопалесцирующая, прозрачная, слегка мутная, опалесцирующая, сильно мутная, мутная. Чаще всего подземные воды бывают прозрачными. По стандартной шкале в мг/л происходит оценка мутности воды.
В зависимости от геотермических особенностей района происходит изменение температуры воды. Она является отражателем тектонических, возрастных, гидродинамических, а также литологических особенностей водовмещающих толщ. Температура воды оказывает непосредственное влияние на вязкость, коэффициент фильтрации, а также на химический состав.
Подземные воды, которые находятся в естественных условиях могут переохлаждаться, быть холодными, термальными, а также перегретыми.
Отношением массы к объему определяется плотность воды при определенной температуре. Единицей плотности воды является плотность дистиллированной воды, температура которой составляет четыре градуса. От температуры, газов, растворенных в ней солей, а также от взвешенных частиц зависит плотность воды.
Практически нет сжимаемости воды, и определяется с помощью коэффициента сжимаемости. Благодаря внутреннему сопротивлению частиц жидкости к ее движение происходит определение вязкости воды, она выражается кинематической вязкостью и коэффициентами динамической вязкости.
От количества растворенных в воде солей будет зависеть электропроводность подземных вод. Незначительная электропроводность наблюдается в пресных водах. Изолятором является дистиллированная вода. Благодаря удельному электрическому сопротивление происходит оценка электропроводности воды.
По количеству содержания в воде радона определяется радиоактивность воды. Довольно редко встречаются радиоактивные подземные воды.
www.watermap.ru
Химия цвета качественных реакций
Разделы: Химия
Цели занятия:
- определение факторов, вызывающих окраску химических веществ;
- расширение и систематизация знаний по химическим основам теории возникновения цвета;
- развитие познавательного интереса к изучению качественных реакций.
Формируемые компетенции студентов:
- способность анализировать явления окружающего мира в химических терминах;
- способность объяснять химические явления, связанные с появлением окраски растворов;
- готовность самостоятельно работать с информацией;
- готовность взаимодействовать с коллегами и выступать перед аудиторией.
«Все живое стремится к цвету». В.Гете
Актуализация знаний
На предыдущих занятиях мы изучали свойства неорганических и органических веществ, часто используя качественные реакции, показывающие наличие определенного вещества по цвету, запаху или осадку. Предложенный вам кроссворд состоит из названий химических элементов, имеющих цветовые различия
Решение кроссворда:
По вертикали:
1) Вещество, окрашивающее пламя в фиолетовый цвет (калий).
2) Самый легкий серебристого цвета металл (литий).
По горизонтали:
3) Название этого элемента — «зеленая ветка» (таллий)
4) Металл, окрашивающий стекло в голубой цвет (ниобий)
5) Название металла означает небесно-голубой (цезий)
6) Фиолетовые пары этого вещества впервые получил Куртуа благодаря своему коту (йод).
Мотивация учебной деятельности.
Обратите внимание, что решение кроссворда было связано с цветом веществ. Но не только химические вещества, но и окружающий нас мир красочен.
«Все живое стремится к цвету». Эти слова великого гения поэзии верно отражают особенность эмоций, которые у нас вызывает тот или иной цвет. Мы воспринимаем его ассоциативно, т.е. вызываем в памяти что-то привычное и знакомое. Восприятие цвета сопровождается определенными эмоциями. (Демонстрация картин художников).
Студенты отвечают на вопросы об эмоциях по восприятию цвета.
- Синий цвет вызывает спокойствие, он приятен, повышает оценку самоутверждения.
- Зеленый — цвет зеленых растений, настроение покоя, умиротворения.
- Желтый- дух счастья, веселья, ассоциируется с солнцем.
- Красный — цвет активности, действия, хочется добиваться результата.
- Черный — вызывает грусть, раздражение.
Почему же окружающий мир красочен?
Сегодня мы пробуем найти ответ на вопрос «Что такое цвет?» с точки зрения химии.
Тема занятия — «Химия цвета качественных реакций» .
Определение факторов цвета
Рассматривать химическую сущность цвета нельзя без знаний физических свойств видимого света. Без света нет окраски предметов, все кажется темным. Свет — это электромагнитные волны. Сколько радости и детям, и взрослым доставляет радуга на небе, однако, она появляется только в том случае, если солнечные лучи отражаются в капельках воды и возвращаются в глаз человека разноцветным спектром. Великому английскому физику Исааку Ньютону мы обязаны тем, что он объяснил это явление: белый цвет представляет собой совокупность лучей разного цвета. Каждой длине волны соответствует определенная энергия, которую несут эти волны. Цвет любого вещества определяется длиной волны , энергия которой преобладает в данном излучении. Цвет неба зависит от того, какая часть солнечного света доходит до наших глаз. Лучи с короткой длиной волны (голубые) отражаются от молекул газов воздуха и рассеиваются. Наш глаз воспринимает их и определяет цвет неба — синий, голубой (табл. 1.)
Таблица 1 — Цвет веществ, имеющих одну полосу поглощения в видимой части спектра.
| Длина волны, полосы поглощения, нм | Цвет поглощенного спектра | Цвет вещества |
| 400 — 435 | Фиолетовый | Желто-зеленый |
| 480 — 490 | Зеленовато-голубой | Оранжевый |
| 500 — 560 | Зеленый | Красный |
| 580 — 595 | Желтый | Голубой |
| 595 — 600 | Оранжевый | Зеленый |
То же самое происходит и в случае окрашенных веществ. Если вещество отражает лучи определенной длины волны, то оно окрашено. Если одинаково поглощается или отражается энергия световых волн всего спектра, то вещество кажется черным или белым. Из уроков биологии вы знаете, что глаз человека содержит оптическую систему: хрусталик и стекловидное тело. В сетчатку глаза входят светочувствительные элементы: колбочки и палочки. Благодаря колбочкам мы различаем цвета.
Таким образом, то что мы называем цветом - результат двух физико-химических явлений: взаимодействие света с молекулами вещества и воздействие волн, идущих от вещества, на сетчатку глаз.
1 фактор образования цвета — свет.
Рассмотрим примеры следующего фактора - структуру веществ.
Кристаллическую структуру имеют металлы, у них упорядоченное строение атомов и электронов. Цвет связан с подвижностью электронов. При освещении металлов преобладает отражение, их цвет зависит от длины волны, которую они отражают. (Демонстрация коллекции металлов). Белый блеск обусловлен равномерным отражением почти всего набора видимых лучей. Такой цвет у алюминия, цинка. Золото имеет красновато — желтый цвет, потому что поглощает голубые, синие и фиолетовые лучи. Медь тоже имеет красноватый цвет. Порошок магния — черный, значит это вещество поглощает весь спектр лучей.
Посмотрим, как изменяется цвет вещества от состояния структуры на примере серы.
Демонстрация видеофильма «Химические элементы».
Делаем вывод: сера в кристаллическом состоянии желтого цвета, а в аморфном — черного, т.е. в данном случае фактор цвета — структура вещества.
Что же происходит с цветом веществ при разрушении структуры, например, при диссоциации молекул солей , если эти растворы окрашены.
CuS04 (голубой) Cu2++ SO42-
NiS04 (зеленый) Ni2+ + SO42-
СиСI2(голубой) Сu2+ + 2СI—
FeCI3(желтый) Fe3++3CI—
В этих растворах одинаковые анионы, окраску придают разные катионы.
Следующие растворы имеют один и тот же катион, но разные анионы, значит за окраску отвечают анионы:
K2Cr2O7(оранжевый) 2K++Cz2O42-
K2Cr04 (желтый) 2К++ Cz042-
КМnO4(фиолетовый) К++ Мп04—
3 фактор появления цвета — ионное состояние веществ.
Цвет зависит и от среды вокруг окрашенных частиц. Катионы и анионы в растворе окружены оболочкой растворителя, который влияет на ионы.
Проводим следующий эксперимент. Имеется раствор сока свеклы (малиновый цвет). Добавим к этому раствору следующие вещества:
- опыт. Раствор сока свеклы и уксусная кислота
- опыт. Раствор сока свеклы и раствор NH40H
- опыт. Раствор сока свеклы и вода.
В 1 опыте кислая среда приводит к изменению цвета в пурпурный, во 2 опыте щелочная среда изменяет цвет свеклы в голубой, а добавление воды (нейтральная среда) не вызывает изменений цвета.
Известен индикатор определения щелочной среды — фенолфталеин, который изменяет цвет растворов щелочей в малиновый.
Проводится опыт:
NaOH + фенолфталеин -> цвет малиновый
Делаем вывод: 4 фактор изменения цвета - окружающая среда.
Рассмотрим случай окружения атома одного элемента различными комплексами.
Проводится опыт: качественная реакция на ион Fe3+:
FeCl3 + KCNS -> красный цвет
FeCl3 + K4(Fe(CN)6) -> p-p темно-синий
С изменением цвета железа-иона при окружении его роданидом калия в кровавый цвет связан исторический факт.
Сообщения студентов.
1720г политические противники Петра I из духовенства организовали в одном из петербургских соборов «чудо» — икона Богоматери начала проливать слезы, что комментировалось как знак ее неодобрения петровским реформам. Петр I тщательно осмотрел икону и заметил нечто подозрительное: в глазах у образа он нашел маленькие дырочки. Нашел он и источник слез: это была губка, пропитанная раствором роданипа железа, который имеет кроваво-красный цвет. Грузик равномерно надавливал на губку, выдавливая капли через дырочку в иконе. «Вот источник чудесных слез», — сказал государь.
Проводим опыт.
На бумаге напишем слова растворами CuS04 (голубой) и FeСI3(желтый), затем обработаем лист желтой кровяной солью K4(Fe(CN)6) . Слово CuSO4 (голубой) превращается в красный цвет, а слово FeCI3(желтый) становится сине-зеленым. Здесь нет изменения степени окисления металла, изменялось только окружение:
2CuS04+ K4(Fe(CN)6) Cu2(Fe(CN)6) + 2K2SO4
4FeCl3 + 3 K4(Fe(CN)6) Fe4(Fe(CN)6) 3+12 KCI
5 фактор цвета — окружение ионов комплексами.
Вывод.
Мы определили основные факторы, влияющие на проявление цвета веществ.
Мы осознали, что цвет — это результат поглощения веществом определенной части видимого спектра солнечного света.
Качественная реакция — особая реакция, обнаруживающая ионы или молекулы по цвету.
Сообщения студентов на тему «Цвет служит людям».
Кровь животных и зелень листьев содержат похожие структуры, но в крови содержатся ионы железа — Fe, а в растениях — Mg. Этим обеспечивается цвет: красный и зеленый. Кстати, изречение «голубая кровь» верно для глубоководных животных, у которых в крови вместо железа содержится ванадий. Также и водоросли, произрастающие в местах, где мало кислорода, имеют синий цвет.
Растения, обладающие хлорофиллом, способны образовывать магнийорганические вещества и используют энергию света. Цвет фотосинтезирующих растений зеленый.
Гемоглобин крови, содержащий железо, служит для переноса кислорода в организме. Гемоглобин с кислородом окрашивает кровь в ярко-красный цвет, а без кислорода придает крови темный цвет.
Краски и красители используются художниками, декораторами и текстильщиками. Гармония цвета составной частью входит в искусство «дизайна». Самыми древними красками служили уголь, мел, глина, киноварь и некоторые соли, такие как ацетат меди (медянка).
Люминофорные краски применяют для дорожных указателей и реклам, спасательных лодок.
В целях отбеливания в состав стиральных порошков вводят вещества, придающие ткани синеватую флуоресценцию.
Поверхность всех металлических предметов под воздействием окружающей среды разрушается. Наиболее эффективна их защита цветными пигментами: алюминиевая пудра, цинковая пыль, свинцовый сурик, оксид хрома.
Рефлексия.
1. Какие факторы вызывают окраску химических веществ?
2. Какие вещества можно определять качественными реакциями по изменению цвета?
3. Какие факторы определяют цвет солей калия и меди?
Природа, частью которой являются химические вещества, окружает нас загадками, и попытки их решения принадлежат к величайшей радости жизни.
Сегодня мы постарались подойти к истине «Химия цвета» с одной стороны, а может быть вам откроется и другая. Самое главное — мир цвета познаваем.
Человек рождается на свет,
Чтоб творить, дерзать — и не иначе,
Чтоб оставить в жизни добрый след,
И решить все трудные задачи.
Для чего? Ищите свой ответ!
Домашнее задание.
Привести примеры качественных реакций на ионы железа по изменению цвета.
13.08.2009
xn--i1abbnckbmcl9fb.xn--p1ai
Урок 27. Состав и физические свойства воды – HIMI4KA
В уроке 27 «Состав и физические свойства воды» из курса «Химия для чайников» узнаем, что из себя представляет вода, выясним её состав, а также физические свойства.

Наиболее распространенным оксидом на Земле является оксид водорода H2O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.

Состав и строение воды
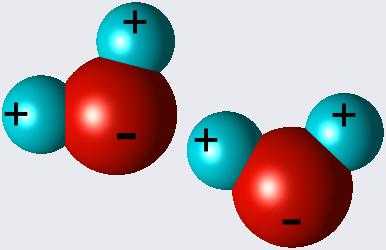
Как вы уже знаете, молекула воды состоит из трех атомов — двух атомов водорода и одного атома кислорода (рис. 105). Относительная молекулярная масса воды равна:
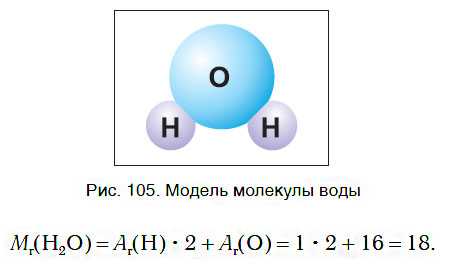
Следовательно, молярная масса воды равна:
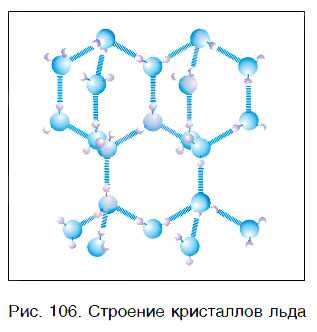
Вода — это вещество с молекулярным строением. В твердом (рис. 106) и жидком агрегатных состояниях молекулы воды прочно связаны друг с другом. Этим во многом объясняется целый ряд удивительных физических свойств воды.
Физические свойства воды
При комнатных условиях вода представляет собой жидкость без вкуса и запаха. В тонком слое вода не имеет цвета. Однако при толщине более 2 м она имеет голубой цвет. Совершенно чистая вода очень плохо проводит электрический ток.
На заметку: По тому, как проводит электрический ток вода, можно судить о ее чистоте — чем ниже электропроводность, тем чище вода.
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком. При 0 °С плотность льда равна примерно 0,92 г/см3, а плотность жидкой воды — примерно 1,00 г/см3. Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
У воды высокая теплоемкость, поэтому она медленно нагревается, но и медленно остывает. Это позволяет морям и океанам накапливать тепло летом (и днем) и высвобождать его зимой (и ночью), что предотвращает резкие колебания температуры воздуха на нашей планете в течение года (и суток). Моря и океаны служат своеобразными аккумуляторами тепла на нашей планете.

При нормальном давлении (101,3 кПа) температура кипения воды равна 100 °С. При понижении давления температура кипения воды понижается. Например, в горах на высоте около 5000 м давление существенно ниже нормального (примерно в два раза), поэтому вода закипает в этих условиях при температуре около 84 °С. Понятно, что варить продукты до готовности в горах необходимо более длительное время. И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
Вода как растворитель
С совершенно чистой водой, не содержащей никаких других веществ, большинство людей никогда не встречается. Такая вода используется только в специальных целях.
Почти все жидкости, с которыми мы сталкиваемся в повседневной жизни и деятельности, представляют собой растворы различных веществ.
Раствор — это однородная смесь двух и более веществ.
Одно из веществ, входящих в состав раствора, называется растворителем, а остальные — растворенными веществами. Очень часто растворителем является вода. Вода может растворять твердые, жидкие и газообразные вещества.
Все природные воды содержат растворенные соли. Их легко обнаружить экспериментально, выпарив воду на часовом стекле. Кроме солей, вода может растворять различные газы. Их присутствие (правда, не всегда) можно обнаружить экспериментально. Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).

Многие жидкости также хорошо растворимы в воде. Например, серная кислота и спирт неограниченно растворяются в воде. В таком случае говорят, что вещество смешивается с водой в любых соотношениях. Из-за хорошей растворимости многих веществ в воде ее иногда называют универсальным растворителем.
Краткие выводы урока:
- Вода не имеет вкуса, цвета (в тонком слое) и запаха, кипит при 100 °С, а переходит в твердое состояние при 0 °С.
- Плотность твердой воды меньше, чем жидкой.
- Раствор — это однородная смесь двух и более веществ.
- Вода является универсальным растворителем — она хорошо растворяет многие твердые, жидкие и газообразные вещества.
Надеюсь урок 27 «Состав и физические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Изучение физико-химических свойств воды
Определение физико-химических свойств природных вод
Определение основных физических свойств природных вод
Температура воды измеряется с помощью водного термометра (спиртового термометра в пластмассовом или деревянном защитном кожухе). В отдельных случаях удобно измерять температуру обычным термометром, опустив его в ведро или другой сосуд объемом не менее 1 л; первый отсчет по термометру берут спустя 5-10 минут после его погружения в воду. Запись отсчетов ведут с максимально возможной точностью.
Прозрачность воды зависит от количества растворенных в ней веществ, содержания механических частиц и коллоидов. Прозрачность воды определяют в цилиндре, например, в тонкостенном стакане из бесцветного стекла, визуально определяя ее на свет или с помощью мерного цилиндра по обычному шрифту любого текста с высотой букв 3,5 мм. При визуальной оценке прозрачности природные воды характеризуются как прозрачные, слегка мутные, мутные и очень мутные. Определение прозрачности воды по шрифту выполняют при дневном освещении, но не на прямом солнечном свету. Под мерный цилиндр помещают текст и постепенно заполняют его предварительно взболтанной пробой воды. Когда текст становится плохо различимым, высоту столба воды измеряют линейкой и полученное значение записывают в журнал с точностью до 1 см.
Для источников хозяйственно-питьевого водоснабжения вода должна быть прозрачной в столбике воды высотой около 20 см, а для водоемов, используемых для купания и коммунальных целей – около 10 см.
Цвет воды зависит от их химического состава, наличия микроорганизмов, частиц ила, глины и других примесей. Например, взвешенные минеральные частицы делают цвет воды сероватым, органические соединения придают воде желтый цвет, трудно окисляемые гуминовые кислоты – бурый или коричневый, закисные соли железа – зеленовато-голубой, а окисные – ржаво-бурый.
Определение цвета воды можно проводить как в полевых, так и в камеральных условиях. Для этого воду наливают в тонкостенный стакан и ставят его на лист белой бумаги. Цвет определяют, просматривая воду сверху вниз. При загрязнении вод стоками промышленных предприятий окраска может быть не типичной для естественной цветности вод.
Запах воды естественного происхождения обычно связан с деятельностью бактерий, разлагающих органические вещества. Поэтому вода родников, ключей, артезианских скважин обычно не имеет запаха. Застойная вода прудов, колодцев с деревянным срубом часто обладает специфическим затхлым плесневым запахом, гуминовые соединения придают водам болотный, илистый, тинистый запах, а сероводород – запах тухлых яиц. Фекальные и сточные воды имеют гнилостный, а иногда и рыбный запах. Грунтовые воды и воды верховодки пахнут свежевспаханной землей (глинистый, землистый запах).
Запахи искусственного происхождения называют по соответствующим веществам: например, бензиновый, хлорный или неопределенный. Интенсивность запаха определяется при разной температуре, что требует использования водного термометра. Если запах ощущается при +20°, то его интенсивность характеризуется как заметная, отчетливая или сильная, а при +60° – как слабая.
Определение данной характеристики проводят в помещении, где воздух не имеет постороннего запаха. Для этого воду (около 200 мл) подогревают и анализируют при 200, а затем при 40-60°. Ее сразу переливают в колбу или бутылку до половины объема, закрывают горлышко пробкой или рукой, сильно встряхивают 3-5 раз, а затем быстро производят однократное (для каждого из нескольких исследователей) определение характера и интенсивности запаха воды. Питьевая вода при температуре 200 не должна иметь запаха, привлекающего внимание потребителя. Для характеристики видов запаха используется специальная шкала, разработанная для гидрологических исследований.
Определение запаха воды (по кн. «Унифицированные методы анализа вод СССР», Л.: Гидрометеоиздат, 1978).Вид запаха Примеры или возможные источники запаха
Ароматный — Камфара, гвоздика, лаванда, лимон
Огуречный — Золотистая водоросль синура
Бальзамический — Герань, ирис, ваниль
Гкраниевый — Диатомовая водоросль астерионелла
Фиалковый — Золотистая водоросль мелломонас
Химический — Промышленные сточные воды
Хлорный — Свободный хлор
Лекарственный — Фенол и йодоформ
Сернистый — Сероводород
Рыбный — Золотистая водоросль динобрион
Навозный — Синезеленая водоросль анабена
Гнилостный — Застоявшиеся сточные воды
Землистый — Сырая земля
Торфяной — Торф
Травянистый — Лежалая трава
Затхлый — Преющая солома
Плесневелый -Сырой подвал
Вкус и привкус воде придают ей растворенные в ней соединения, газы и примеси. Различают четыре основные виды вкуса: горький, сладкий, соленый и кислый. Горький вкус связан с наличием в воде сульфатов магния и натрия, сладкий и кислый – с большим количеством органических веществ, соленый — обусловлен растворением хлористого натрия. Привкусы — прочие вкусовые ощущения — более субъективны, поэтому они характеризуются менее четко, Например, вода может иметь металлический, рыбный, огуречный привкус.
Определение вкуса и привкуса, а также их интенсивности производят только для источников питьевого водоснабжения при температурах около 20°. В рот набирают небольшое количество воды (около 10 мл) и держат, не проглатывая, несколько минут.
Воду сомнительных в санитарном отношении источников и открытых водоемов предварительно кипятят, остужают до указанной температуры и только после этого проводят определение вкуса и привкуса.
Механический осадок характерен для подземных вод, высачивающихся из карстовых каналов и трещин, а также для речных и других вод. Визуально отмечают состав, цвет осадка и его количество (ничтожный, незначительный, заметный, большой), а также характер осадка: кристаллический, илистый, песчаный, аморфный и т.п. Осадок в воде наземных водоемов определяют в прозрачном тонкостенном стакане спустя 1 час после взбалтывания пробы, а в воде подземных источников — спустя сутки.
Определение основных химических свойств природных вод.
Наличие осадка (налета) определяется и характеризуется аналогично исследованию механического осадка (см. выше).
рН воды определяется соотношением концентраций свободного диоксида углерода и гидрокарбонат-иона. Это соотношение может быстро изменяться в результате происходящих в воде химических и биологических процессов, поэтому рН определяют непосредственно в полевых условиях или же сразу после возвращения. Оценивают величину рН с помощью универсальной индикаторной бумаги или полевым рН-метром Более точное определение рН проводят в лаборатории с помощью лабораторного (потенциалометрического) рН-метра.
По величине рН воды подразделяют на семь групп:
сильнокислые……………….рН менее 1,9
кислые………………………..2,0 < рН <4,1
слабокислые………………..4,2 < рН < 7,0
нейтральные…………………рН = 7,0
слабощелочные…………….7,1< рН < 8,3
щелочные…………………….8,4 < рН < 10,3
сильнощелочные…………рН более 10,3
Питьевая вода должна быть нейтральной, для водоемов хозяйственного и культурно-бытового назначения (рек, озер, водохранилищ и т.п.) допускается наличие слабощелочной воды (рН — в пределах 6,8 -8,3).
Жесткость воды обусловливается присутствием в воде ионов кальция (Са2+) и магния (Мд2+). В бутылку с образцом воды добавляют немного мыльного раствора и взбалтывают ее. Если вода жесткая, то пена почти не образуется, а в мягкой воде ее будет много. Можно опросным методом выяснить много ли накипи образуется в чайниках, что свидетельствует о повышенной жесткости воды. Принято различать воду по жесткости на очень мягкую, мягкую, умеренно жесткую, жесткую и очень жесткую.
Присутствие железа можно определить в камеральных условиях по потемнению настоя чая или листьев брусники, по окрашиванию в синий цвет раствора желтой кровяной соли, по почернению раствора танина.
Присутствие нефтепродуктов в воде обнаруживается в полевых условиях визуально по радужным пятнам и серым пленкам на поверхности воды, по вымазанным нефтью берегам водоемов, по пленкам нефти на прибрежных растениях. Для определения присутствия продуктов нефти в камеральных условиях пробу воды наносят на фильтровальную бумагу или подкисляют ее слабым раствором перманганата калия. Если в образце присутствуют нефтепродукты, то после высыхания нанесенной пробы на фильтровальной бумаге остаются масляные пятна, а розовый раствор «марганцовки» обесцвечивается.
Методы изучения подземных вод.
Статьи о внутренних водах Воронежской области.
www.xn--36-6kc0bd0b.xn--p1ai