ОСОБЕННОСТИ СТРОЕНИЯ И РАЗМНОЖЕНИЯ КОМНАТНОЙ МУХИ
ОСОБЕННОСТИ СТРОЕНИЯ И РАЗМНОЖЕНИЯ КОМНАТНОЙ МУХИ
Койло Е.Н. 11Филиал МАОУ «Аромашевская СОШ им. В.Д. Кармацкого» Юрминская СОШ
Булатова С.И. 11филиал МАОУ
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Влияние температурного фактора на интенсивность размножения комнатной
мухи.
Гипотеза.
На интенсивность размножения комнатной мухи влияет температурный фактор.
Цель: Выявить интенсивность размножения комнатной мухи в разных температурных условиях на основе биологических особенностей данного вида.
Задачи.
Раскрыть характерные признаки комнатной мухи.
Выяснить особенности размножения и развития комнатной мухи.
Доказать, что на размножения и интенсивность развития комнатной мухи влияет температурный фактор.
По вопросу о строения и размножения комнатной мухи нами рассмотрена литература отечественных и зарубежных ученых биологов. Которые описывают особенности строения, поведения и размножения комнатной мухи.
 Е. Сыроечковскому журнал «Юный натуралист» статья «Необыкновенная амуниция».
Е. Сыроечковскому журнал «Юный натуралист» статья «Необыкновенная амуниция».
Особенности строения и поведения комнатной мухи.
Отряд двукрылых сравнительно молодой среди насекомых. Самые ранние находки ископаемых мух относятся к юрскому периоду, около 150 миллионов лет назад. Их расцвет начался с экспансией по планете цветковых растений и млекопитающих.
Комнатная муха является синантропом, т.е. более или менее тесно связана с человеком. Комнатная муха (Musca domestica) уже не встречается в дикой природе, вне населенных пунктов. Она великолепно себя чувствует в чуме, небоскребе и полинезийской хижине.
У нашей соседки крыльев мало – всего два! Но какие 330 взмахов в секунду, высший пилотаж, оптимальный в энергетическом отношении профиль крыла, легкость конструкции. Комнатные мухи дальше, чем на пятьсот метров, от человеческого жилья обычно не улетают.
Тоненькое, прозрачное крыло комнатной мухи пронизывают трахеи и нервы. Оно несет на себе сложное навигационное оборудование: мельчайшие щетинки и колбочки, которые помогают
ориентироваться. Помогают мухе и три крошечных глазика, треугольником разместившиеся между двумя огромными фасеточными глазами, состоящими из 4000 омматидией.
Но, не смотря на обилие глаз, муха подслеповата и отчетливо видит лишь в пределах 40 – 70 сантиметров.
Грудь и брюшко, состоит у комнатной мухи из 5 – 9 видимых сегментов.
Три грудных сегмента плотно спаяны между собой, образуя прочный грудной отдел – вместилище мощной мускулатуры. Он служит надежной опорой для крыльев. Здесь же расположена жужжальца – короткие булавовидные придатки, представляющие собой видоизмененную вторую пару крыльев. Их считают органами равновесия.
Здесь же расположена жужжальца – короткие булавовидные придатки, представляющие собой видоизмененную вторую пару крыльев. Их считают органами равновесия.
Строение ног мухи тесно связано с их образом жизни. Подвижные, быстро бегающие мухи имеют короткие ноги. Лапки ног заканчиваются коготками, у основания которых прикрепляются 2-3особые подушечки – присоски. С их помощью комнатная муха может передвигаться по совершенно гладкой поверхности (прил. 1).
Лапки мухи покрыты густой щетинкой очень тоненьких волосиков – нервных нитей. Эти волосики и сообщают мухе о химическом составе предмета, на который она наступила.
[Е.Е. Сыроечковский Необыкновенная амуниция. «Юный натуралист» №3. 1991. с.32-33.]

Когда ноги сообщают, что она села на съедобное вещество, муха пробует его на вкус неким подобием языка – пористой подушечкой – лабеллой на кончике хоботка. Вдавливая хоботок в пищу, муха втягивает в него мельчайшие частички. Муха ест, вернее, все время пьет, только хорошо растворимые вещества.
Если нам положить в чай сахар или сахарин, мы не сразу поймем разницу. Мы провели такой опыт, растворили в одной чашке сахар, а в другой сахарин капнули на чашку Петри две капли одну с растворенным сахаром, а другую с сахарином, муха стала слизывать с растворенным сахаром.
Хоботок мухи, образованный нижней губой и заканчивающийся сосательными лопастями.
У комнатной мухи свои температурные пределы. При плюсовой температуре она активна, а при понижении температуры впадает в оцепенение. Ей все равно, какая зима.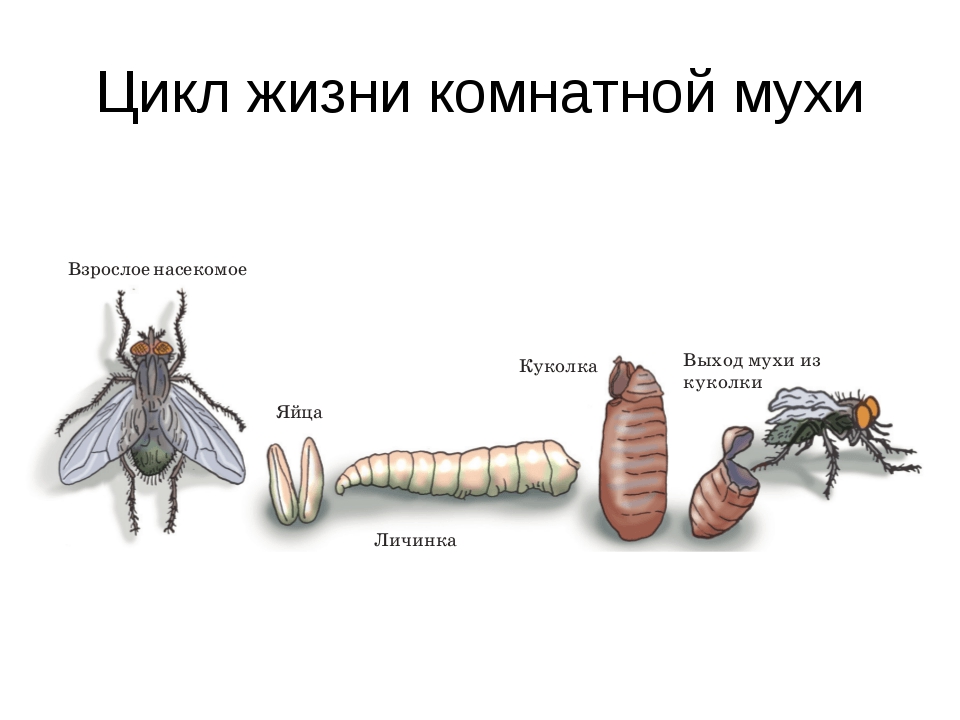 Ведь зимует она не в поле и не в лесу, а в жилище человека – спит где-нибудь между рамами или в другом укромном местечке.
Ведь зимует она не в поле и не в лесу, а в жилище человека – спит где-нибудь между рамами или в другом укромном местечке.
Размножение комнатной мухи.
Для эксперимента мы поймали в период оплодотворения три комнатные мухи, посадили их в три садка, по одной в каждый.
Муха за неделю может давать почти тысячу потомков. Но мы не стали ждать такого огромного количества мух.
И после того, как мухи отложили яйца, мы их уничтожили.
Каждая кучка составляла по 50 – 60 яиц (прил.2,3). А всего в кладках их количество составляла от 100 – 120 2015г. 2016г.100 – 130 штук. Самки их отложили быстро в течение 20 – 22 минут, через 12 часов в 3 пробе вывелись безголовые личинки, а в 1 и 2 через сутки (прил.3).
Личинки разжижают пищу, выпуская на нее пищеварительные соки, — такой способ пищеварения носит название внекишечного. В результате вся колония личинок мух оказывается плавающей в разжиженной полупереваренной среде, которая ими постоянно заглатывается. Пища используется с удивительной экономией. «Чтобы личинка развилась ей достаточно всего семи миллиграммов питательных веществ».
В результате вся колония личинок мух оказывается плавающей в разжиженной полупереваренной среде, которая ими постоянно заглатывается. Пища используется с удивительной экономией. «Чтобы личинка развилась ей достаточно всего семи миллиграммов питательных веществ».
Через день – полтора личинки линяют первый раз, затем еще и еще
Личинка растет урывками лишь в определенные периоды своей жизни. Прочный наружный скелет членистоногих не позволяет им увеличивать размеры тела. Только во время линьки личинка может расти. Линек у личинок комнатной мухи обычно 5. После последней личинка готова перейти к следующей стадии развития. Перед окукливанием личинка старается зарыться туда, где по суше. Оболочка пупария образуется из последней личиночной шкурки, которая твердеет, темнеет и раздувается. Глядя на куколку снаружи, и не подумаешь, какие сложные процессы происходят под ее покровами.
«Особенно сложные перестройки происходят у таких насекомых, как мухи, у которых в первые дни после окукливания основная масса внутренних органов куколки представляет жидкую кашицу».
Затем получившиеся после переваривания вещества поступают в кровь куколки. Они служат строительным материалом для особых клеток, из которых образуются органы, необходимые взрослому насекомому.
Через 8 дней в 3 пробе личинки окуклились, а в 1 и 2 через 9 дней. 3 пробу мы поставили в тепло, где искусственно поддерживали температуру, 2 пробу вынесли на улицу, где происходило колебание температуры в течение суток, 1 пробу на сутки поставили в холодильник с температурой – 00С.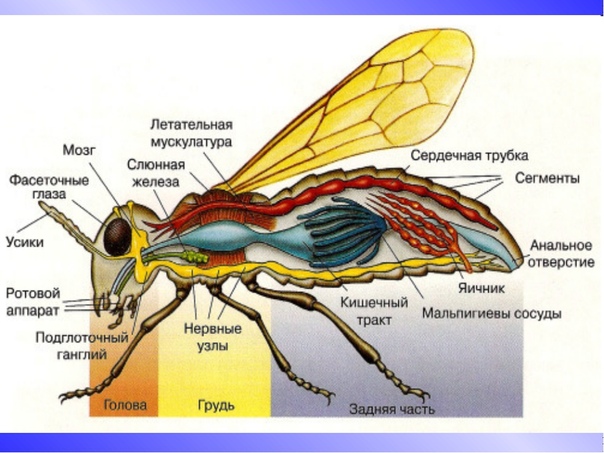 Теперь осталось только ждать молодого поколения, через три дня в 3 пробе появились молодые мухи.
Теперь осталось только ждать молодого поколения, через три дня в 3 пробе появились молодые мухи.
Маленькие с помятыми крыльями, беспомощно ползающие по стенкам садка, но менее чем через час из беспомощной, слабенькой мухи она превращается в полнее уверенную в себе молодую муху, подливаем охлажденный Куринный бульон, мухи облепляют его и начинают слизывать. Обильное питание приводит к скорому росту молодых мух. Вот они уже приступают к оплодотворению и размножению.
Если бы мы оставили мух живыми, то они могли бы приблизительно дать потомство 1500 за одну кладку яиц, ведь их вылупилось, 98 штук с силу каких-то обстоятельств небольшое количество погибло еще в стадии личинки.
Во второй пробе мухи появились через 7 дней. Молодое потомство составило 101 муху. Значит, из 120 яиц 19 погибло. А вот в первой пробе потомство появилось только через 19 дней, и оно составило 54 мухи. 2006г. 1 проба – 50 мух; 2 проба – 92 мухи; 3 проба – 110 мух.
2006г. 1 проба – 50 мух; 2 проба – 92 мухи; 3 проба – 110 мух.
Вывод: Выходит на развитие комнатной мухи влияет температура. Чем она выше, тем развитие мухи происходит быстрее. (прил.5)
Опыт №2.
Цель: Выяснить на какой глубине может происходить развитие комнатной мухи, и не погибнет ли она после того как вылупится из пупария.
Пупарий комнатной мухи помещаем на дно стеклянной пробирки, засыпаем сухим песком, через 4 дня на дне пробирки появилась молодая муха. Но муха не будет заживо погребено, у нее есть временный таран – лобный пузырь. Выпячиваясь, он раздвигает частицы песка, потом сжимается, и муха протискивается на освободившееся место. Так, мало помалу, раздвигая землю эластичным лбом, слабенькая, еще не разу неевшая новорожденная муха может преодолеть расстояние в 20см.
Нас заинтересовало, а сможет – ли новорожденная муха преодолеть гораздо большее расстояние, емкость вместимостью 35литров и высотой 1метр. Мы положили на дно 5 пупариев перед тем, как из него должны были появиться мухи, засыпали сухим песком. Емкость сверху накрыли марлей. Через 5 дней на песке под марлей мы обнаружили 3 молодых комнатных мухи. Если мухи вылупились через день, то выходит, что муха за 4 дня преодолела расстояние в 1метр.
Мы положили на дно 5 пупариев перед тем, как из него должны были появиться мухи, засыпали сухим песком. Емкость сверху накрыли марлей. Через 5 дней на песке под марлей мы обнаружили 3 молодых комнатных мухи. Если мухи вылупились через день, то выходит, что муха за 4 дня преодолела расстояние в 1метр.
Вывод: Таким образом я доказала, что комнатная муха может развиваться на глубине 1 метр и не погибнет за счет своего приспособления, лобного пузыря. Цыплят по осени считают, мух легче сосчитать весной.
Заключение.
Таким образом, проведенные нами опыты показали, что синантропное насекомое – комнатная муха необычно плодовита и скороспела. Самка откладывает через каждые 2 – 4 дня более 100 яиц, всего5 – 6 раз за жизнь. Полный цикл развития яйцо → личинка → куколка → взрослое насекомое проходит быстро, если создать для этого благоприятные условия. При наличии пищи и тепла весь процесс полного превращения проходит за 11 дней, а ведь через 3 дня после вылупления муха достигает половозрелости и способна откладывать яйца. Ее червеобразные личинки развиваются во всякого рода гниющих отбросах. Они разжижают пищу, выпуская на нее пищеварительные соки – такой способ пищеварения носит название внекишечного. Личинка несколько раз линяет, из последнего личиночного покрова образуется пупарий, а через 3 – 4 дня из пупария выходит муха.
При наличии пищи и тепла весь процесс полного превращения проходит за 11 дней, а ведь через 3 дня после вылупления муха достигает половозрелости и способна откладывать яйца. Ее червеобразные личинки развиваются во всякого рода гниющих отбросах. Они разжижают пищу, выпуская на нее пищеварительные соки – такой способ пищеварения носит название внекишечного. Личинка несколько раз линяет, из последнего личиночного покрова образуется пупарий, а через 3 – 4 дня из пупария выходит муха.
Комнатная муха входит в цепь питания, поэтому на всех стадиях развития может быть съедена консументами.
В дальнейшем нужно провести подобные опыты и на других видах мух. Ведь на территории Аромашевского района обитает огромное количество двукрылых.
Использованная литература.
Игорь Акимушкин. Мир животных. – М «Просвещение»1989, 154с.
Мир животных. – М «Просвещение»1989, 154с.
М.С. Гиляров, Ф.Н.Правдин. Жизнь животных том 3, Москва «Просвещение» 1984, с. 388 – 391, с. 411 – 412.
Е.Е. Сыроечковский. Необыкновенная амуниция. «Юный натуралист», 1991, №3, с. 32, 33.
Ж. Фабр. Жизнь насекомых. М. Издательство детской литературы, 1938, с.44.
5. В.Ф. Шалаев., Н.А. Рыков. Зоология. – М. «Просвещение» 1965,с. 77,78.
Приложение №1.
Комнатная муха
Приложение№2
Комнатная муха и ее превращения.
Приложение№3
Размножение и развитие комнатной мухи.
|
N пробы |
Количество яиц отложенных комнатной мухой |
Время, через которое появляются личинки |
Температура |
Окукливания |
Количество вышедших молодых мух |
Период, через которое появились мухи |
||
|
2015 |
2016 |
2015 |
2016 |
|||||
|
I |
114 |
120 |
24ч |
00 – 150 |
9 дней |
54 |
50 |
19 дней |
|
II |
120 |
100 |
24ч |
150 |
9 дней |
101 |
92 |
7 дней |
|
III |
110 |
130 |
12ч |
200 |
8 дней |
98 |
110 |
3 дня |
Приложение№4.
Стадии развития комнатной мухи 2015 — 2016
Размножение и развитие комнатной мухи
Просмотров работы: 1342
строение пищеварительной и репродуктивной системы насекомого
Комнатная муха (на латинском языке название насекомого звучит как Musca domestica) считается самый обыкновенной среди многочисленных представителей класса.
Муха сидящая на цветке
В зоологии принято выделять две разновидности крылатых насекомых: типичная и южная комнатная мухи.
Последнюю от комнатного подвида отличают более крупные размеры. Рассмотрим особенности строения комнатной мухи, как устроены крылья и ротовой аппарат насекомого
Содержание статьи
Отличительные черты домашней мухи
Домашние мухи имеют несколько отличительных характеристик, что позволяет распознать их среди других подвидов.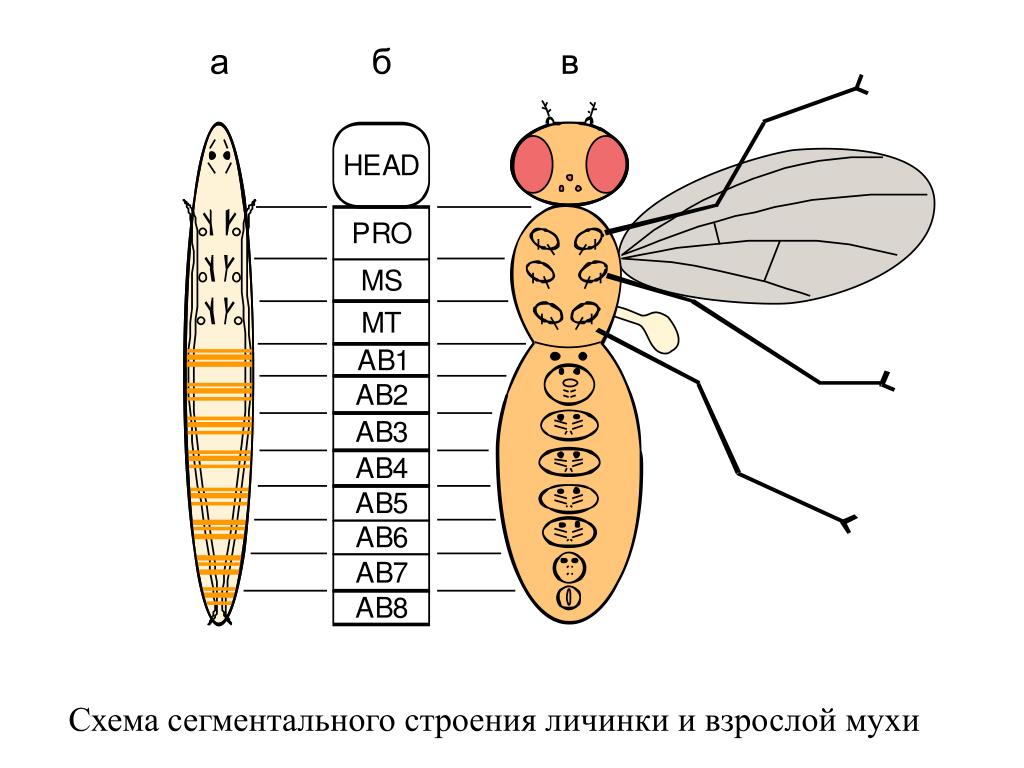
Тело насекомого в большей части случаев серого оттенка. Нижний сегмент головы получил желтую расцветку.
Верхняя часть грудной клетки украшена четырьмя полосочками черного цвета. На брюшке просматриваются пятна черного цвета правильной четырехугольной формы.
Его нижняя часть имеет незначительный желтоватый отлив. Размер тела насекомого достигает шести – восьми миллиметров.
Особенности строения домашней мухи
Основным отличием комнатной мухи от других сородичей становится наличие только одной пара крыльев.
Вторая задняя пара в процессе эволюционирования насекомого превратилась в придатки-жужжальца, используемые для поддержания равновесия.
К тому же насекомое, несмотря на сложное строение глаза, подслеповата. Предел видимости органичен расстоянием в 40 – 70 см.
Внешнее строение
Скелетное строение комнатной мухи ничем не отличается от других классов насекомых.
Представлено головой, грудью и брюшком. Голова оснащена ротовым аппаратом, глазами и антеннами.
Внешний вид комнатной мухи
Грудь имеет сегментарное строение – всего их три. Крыльев два, они полностью прозрачные. Ног – три пары.
В грудной полости расположена хорошо развития мускулатура. Внутри брюшка размещена основная часть органов пищеварительной и всей половой системы.
Грудь
Грудь представлена тремя соединенными между собой сегментами. Выделяют передне-, средне- и заднегрудь.
Возможность летать насекомое получает за счет мощной мускулатуры, поэтому максимально развитым является средний сегмент.
Тело оснащено тремя парами лапок, каждая из которых делится на пять соединенных между собой частичек. Лапы имеют отлично развитую мускулатуру.
На кончиках лап расположены миниатюрнее коготки и присоски, при помощи которых насекомое получает возможность прикрепляться и удерживаться на любой поверхности.
Лапка комнатной мухи под микроскопом
Благодаря этому комнатные мухи обладают способностью двигаться кверху брюшком. Во время передвижения из подушечек в результате сжатия выделяется липкий секрет.
Эта особенность помогает мухе крепко удерживаться на стеклянной и абсолютно гладкой поверхности.
Лапы комнатной мухи выполняют обязанности органов обоняния. Благодаря расположенным на них рецепторам-ворсинкам, насекомое определят съедобность – несъедобность пищи.
Голова
Строение головы мухи несложное. На ее поверхности располагаются органы зрения, слуха и питания.
Ротовой аппарат мухи – строение зависит от типа питания насекомого – представлен хоботком лижущего либо сосущего формата.
В непосредственный контакт с пищевой массой вступают губы, представленные нижней и верхней лопастями.
Ротовой аппарат комнатной мухи
В пищевой хоботок мухи сходится большое количество каналов, через которые пища поступает в пищеварительную систему.
Муха обладает мощным челюстным аппаратом. Ротовой аппарат мухи, основу рациона которой составляет кровь, имеет острые и твердые чешуйки.
Это своеобразная имитация зубов, которые помогают мухе повреждать поверхность кожного покрова человека. За втягивание жидкости и разжиженной пищи отвечает расположенный в глотке насос.
За втягивание жидкости и разжиженной пищи отвечает расположенный в глотке насос.
Также Вы можете прочесть нашу статью: Чем питаются мухи в домашних условиях
Большую часть поверхности головы занимают глаза, обладающие весьма сложным строением. Они составлены большим числом простых глазков.
Визуально – при значительном приближении – это выглядит как фасеточная сетка.
Глаза мухи
Подобное строение обеспечивает комнатной мухе всестороннее изображение предметов, но общая картинка воспринимается как мозаика.
У комнатной мухи общее количество простых глазков достигает 4 тысяч штук. Насекомое способно мгновенно реагировать на любое движение, но полноценного объемного изображения оно не получает.
Усики-антенны используются насекомым в роли ориентиров. Они помогают в восприятии различных запахов и определения направления полета и движения. Имеют характерные различия у самок и самцов.
Крылья
Строение крыла мухи несложное. У насекомого имеется одна пара крыльев. Они хорошо развиты, полностью прозрачны, имеют перепонки.
У насекомого имеется одна пара крыльев. Они хорошо развиты, полностью прозрачны, имеют перепонки.
Прочность крыла обеспечивают пронизывающие его жилки цилиндрической формы. Задняя пара в ходе эволюции трансформировалась в придатки-жужжальца. Крылья помогают мухе удерживать равновесие в период полета.
Крылья комнатной мухи
Кроме того, позволяют зависать в воздухе, если это необходимо. В ходе полета издают характерное жужжание.
В полёте комнатная муха умеет отключать одно из крыльев, что помогает ей резко изменять траекторию полета, выполнять сложные маневры, стартовать с места без предварительного разбега.
Брюхо
Брюшко комнатной мухи имеет форму вытянутого цилиндра.
Сегментарное, представлено десятью, соединенными между собой частичками-сегментами.
Тельце мухи
Внутри брюшной полости расположены органы репродуктивной, дыхательной, пищеварительной и прочих жизненно важных систем.
Поверхность брюшка покрыта хитиновым слоем, обладающим хорошими показателями эластичности. При необходимости – после еды и в период вынашивания потомства – покров способен расширяться.
При необходимости – после еды и в период вынашивания потомства – покров способен расширяться.
Внутреннее строение
Внутреннее строение мухи представлено системой пищеварения, репродуктивной системой и другими важными для обеспечения жизнедеятельности насекомого органами.
Пищеварительная система
В брюшной полости насекомого находится основная часть органов, отвечающих и обеспечивающих усвоение пищи.
Это:
- зоб;
- кишечник;
- мальпигиевы сосуды;
- выводящие канальца.
Пищеварительной системы в ее прямом понимании у комнатной мухи не существует. Еда переваривается до попадания в ЖКТ насекомого, т.е. в полость зоба пища поступает в полностью готовой для усвоения форме. До начала всасывания пищи муха обрабатывает его специальным секретом, который обеспечивает ее переваривание.
Половая и репродуктивная система
В брюшной полости размещены также внутренние половые органы. У самцов это семенники, у самок – яйцеклетки, придаточные железы и протоки.
Наружные половые органы у подвидов комнатной мухи имеют свои характерные особенности.
Самцы отличаются особенным строением захватов, при помощи которых они удерживают самку в процессе спаривания.
Кладка яиц мухи
Количество яиц в кладке комнатной мухи вариативно и может достигать 70 – 150 штук. Число зависит от подвида насекомого.
Другие системы организма насекомого
Мозг представляет собой многочисленные нервные узлы, которые размещены на разных участках тела насекомого. Сложная мозговая система, присущая человеку, в насекомых отсутствует.
Основная задача головного мозга – помощь в координировании движений. За рефлексы ответственен иной орган – рефлекторная дуга.
Мозг имеет крохотные размеры, но составлен из нескольких сотен тысяч нейронов. Это помогает насекомому выполнять во время полета невероятно сложные маневры.
Кровеносная система представлена следующими органами:
- аорта;
- мышца крыловидная;
- спинной сосуд;
- сердце.

Сердце отличается простейшим строением. Привычных человеку функций орган не выполняет.
Кровеносную систему заполняет кровь – полностью бесцветная либо слегка желтоватая по оттенку жидкость.
Схема кровоносной системы мухи
Главная функция этой биологической жидкости – транспортировка необходимых насекомому питательных веществ. Она не принимает участия в переносе кислорода, не содержит в составе эритроцитов.
Система дыхание представлена большим числом трахей, которые расположены по всему тельцу. Поступление кислорода внутрь дыхательных каналов обеспечивают открывающиеся дыхальца.
Трахеи в свою очередь сильно ветвятся, представляя собой довольно сложную капиллярную систему. Благодаря этому кислород поставляется непосредственно к жизненно важным органам.
Всего у насекомого имеется 10 пар дыхальцев: две находятся на поверхности груди, остальные восемь пар – на нижней поверхности брюшка.
Заключение
Комнатная муха, несмотря на внешнюю примитивность, – летающее двукрылое насекомое с достаточно сложным внутренним и внешним строением.
Видео: Муха комнатная. Распространитель заразы.
Строение мухи, её вес, количество лап и прочее
- Строение головы мухи
- Строение мухи
Строение мухи с виду простое, но если начинать в нем разбираться – очень даже сложное. Насекомые являются предметом для исследования многих научных центров, институтов, секрет некоторых их способностей до сих пор не раскрыт. Сколько весит муха – часто задаваемый вопрос. Эластичное брюшко способно растягиваться во время беременности, питания, поэтому вес меняется и отличается у самок, самцов.
Анатомия мухи – внешнее строение
Общий план строения двукрылых, скелет мухи такой же, как у других насекомых – голова, грудь, брюшко. На голове располагается ротовой аппарат, антенны, глаза. Грудь состоит из трех сегментов, с парой прозрачных крыльев, тремя парами ног. Пространство в груди заполнено мощной мускулатурой. Брюшко включает большую часть пищеварительных органов, половую систему.
Грудь состоит из трех сегментов, с парой прозрачных крыльев, тремя парами ног. Пространство в груди заполнено мощной мускулатурой. Брюшко включает большую часть пищеварительных органов, половую систему.
На заметку!
У мух ярко выраженный половой диморфизм, когда внешность и строение самки отличается от самца.
Голова мухи
Включает органы зрения, питания, слуха.
- Ротовой аппарат. В независимости от различия в питании многих видов мух, их ротовой аппарат представлен хоботком сосущего, лижущего типа. С пищей контактирует пара расширенных лопастей верхней, нижней губы. Челюсти мухи мощные. Многочисленные канальца сходятся в хоботок мухи, в его центральной точке. Ротовой аппарат мухи, которая питается кровью, дополнительно оснащен твердыми, острыми чешуйками, что выполняют функцию зубов, помогают проколоть кожу животного, человека. Жидкость втягивается в голову с помощью глоточного насоса.
- Глаза занимают большую часть головы.
 Составляют сложную систему, которая была взята за основу разработки современной фото камеры. Состоят из множества простых глазков, что выглядят снаружи, как фасеточная сеточка. Насекомое получает всестороннее, но мозаичное изображение объектов. Каждый глаз включает несколько сотен, тысяч фасеток. У комнатной мухи их около 4 тыс. У многих видов имеется 3 простых глазка, расположенных на темени. Такое строение позволяет моментально улавливать движение, но не дает полной картины изображения.
Составляют сложную систему, которая была взята за основу разработки современной фото камеры. Состоят из множества простых глазков, что выглядят снаружи, как фасеточная сеточка. Насекомое получает всестороннее, но мозаичное изображение объектов. Каждый глаз включает несколько сотен, тысяч фасеток. У комнатной мухи их около 4 тыс. У многих видов имеется 3 простых глазка, расположенных на темени. Такое строение позволяет моментально улавливать движение, но не дает полной картины изображения. - Усики. Своеобразные антенны выполняют функцию ориентира. Помогают улавливать запахи, определяют направление движения. В процессе эволюции видоизменялись, имеются отличия у самцов, самок.
Строение головы мухиИнтересно!
У самцов глаза всегда больше, нежели у самок. Что позволяет им быстрее реагировать на движение, лучше оценивать окружающую обстановку. У самок больше развита система обоняния, с помощью которой она находит благоприятную среду для откладывания яиц.
Грудь
Состоит из трех сегментов – передне-, средне-, заднегрудь. Кости у мухи и основная часть мускулатуры обеспечивают полет, поэтому средняя часть наиболее развита. Сколько ног у мухи – 3 пары. Каждая состоит из 5 частей, имеет собственную мощную мускулатуру. Строение лап у мухи завершается коготками, присосками, которые позволяют насекомому держаться на вертикальной, горизонтальной поверхности и даже вверх ногами. При ходьбе мягкие подушечки сжимаются, выделяются липкий секрет. Такая особенность помогает мухам свободно держаться и перемешаться по оконному стеклу и гладкой поверхности.
Кости у мухи и основная часть мускулатуры обеспечивают полет, поэтому средняя часть наиболее развита. Сколько ног у мухи – 3 пары. Каждая состоит из 5 частей, имеет собственную мощную мускулатуру. Строение лап у мухи завершается коготками, присосками, которые позволяют насекомому держаться на вертикальной, горизонтальной поверхности и даже вверх ногами. При ходьбе мягкие подушечки сжимаются, выделяются липкий секрет. Такая особенность помогает мухам свободно держаться и перемешаться по оконному стеклу и гладкой поверхности.
На заметку!
Лапки являются одним из основных органов чувств – обоняния. Лапками насекомое определяет вкус пищи, анализирует качество. После нескольких секунд анализа, приступает к питанию либо улетает прочь.
Крылья мухи
Верхние хорошо развиты, прозрачные, перепончатые. Задняя пара деформирована в придатки – жужжальца. Поддерживают равновесие в полете, позволяют зависать в воздухе, а также издают звук жужжания. Тонкие крылья укреплены цилиндрическими жилами.
Интересно!
В процессе полета насекомое может отключать то одно, то другое крыло, резко менять траекторию движения, совершает сложные маневры, срывается с места без предварительного разгона. Строение и способности насекомого было взято за основу многих летательных конструкций в самолетах, вертолетах.
Брюшко
Имеет цилиндрическую форму, вытянутое, состоит из 10 сегментов, включает органы мухи, отвечающие за репродукцию, дыхание, питание и другие важные функции. Эластичный хитиновый покров расширяется по мере поступления пищи, во время беременности. Поэтому вес мухи меняется в зависимости от этих состояний.
Интересно!
Обычная домашняя или комнатная муха весит 12 мг, при беременности масса увеличивается до 15 мг. До такого же показателя способен увеличиться вес после трапезы. Самец имеет меньшие размеры, весит около 12 мг. В одно грамме вмещается около 80 этих насекомых.
Лицо у мухи можно легко рассмотреть под микроскопом, но и при тщательном разглядывании невооруженным глазом, просматривается вытянутый ротовой аппарат, большие глаза зеленого, красного, желтого, коричневого, синего цвета.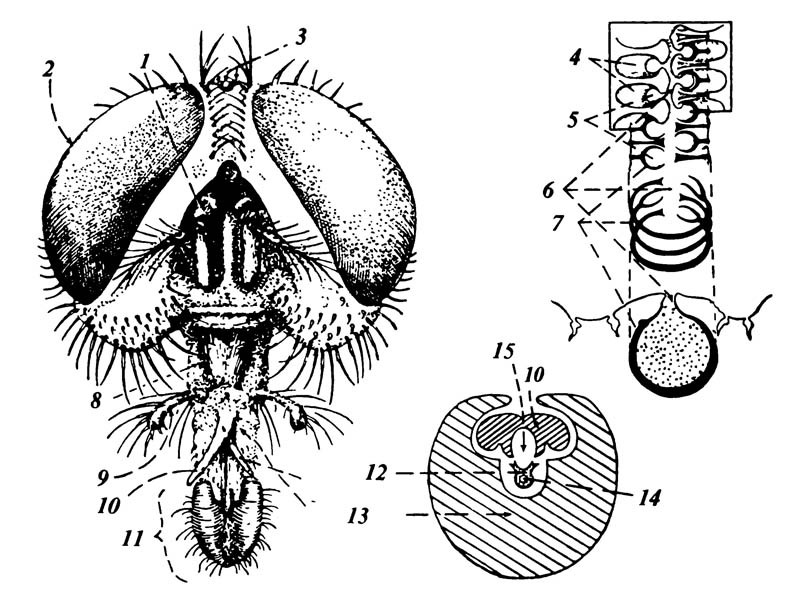 Уши мухи располагаются на разных частях тела, помогают улавливать колебания воздуха, ультразвук.
Уши мухи располагаются на разных частях тела, помогают улавливать колебания воздуха, ультразвук.
Внутреннее строение
Как дышит муха, может ли думать, имеется ли у нее память и другие вопросы часто интересуют обычного человека, который не раз сталкивался с вредителями.
Половая система
Внутренние половые органы размещаются в брюшке, состоят из семенников у самцов, яйцеклеток у самок, придаточных желез, протоков. Форма наружных придатков у разных видов двукрылых отличается. Строение специальных «захватов» у самцов является единственным явным признаком отличия рода. За один раз самка комнатной мухи откладывает от 70 до 150 яиц, в зависимости от вида. Среди мясных (трупных) мух имеются живородящие виды. Воспроизводят на свет опарышей в таком же большом количестве.
Пищеварительная система
В брюшке располагается большая часть пищеварительных органов – кишечник, зоб, мальпигиевы сосуды, выводящие канальца. Как такового пищеварительного органа нет, пища переваривается снаружи, поступает в зоб в уже готовом виде. Перед всасыванием пищи муха изначально выделяет секрет, который и переваривает еду.
Перед всасыванием пищи муха изначально выделяет секрет, который и переваривает еду.
Другие органы, системы
Мозг у мухи представлен множеством нервных сплетений, расположенных по разным участкам тела. Такой сложной системы, как у человека, животных нет. Головной мозг выполняет главную роль в координации поведения насекомого, но за рефлексы отвечает совсем другой орган – рефлекторная дуга. Крохотный мозг состоит из сотни тысяч нейронов и, несмотря на кажущуюся простоту строения, позволяет мухам вытворять неимоверные трюки.
На заметку!
Нервная система и мозг позволяют насекомым за доли миллисекунд определить правильное направление движения в противоположную от опасности сторону. Памяти хватает всего на 3 секунды, интеллекта в полном его понимании нет.
Кровеносная система представлена аортой, крыловидной мышцей, спинным сосудом, сердцем. Однако сердце у мухи имеет чрезвычайно простое строение, не выполняет тех функций, что у человека, животных. Кровь мухи желтоватого цвета или бесцветная. Ее основная функция – перенос питательных компонентов. Не участвует в насыщении органов кислородом, не содержит эритроцитов.
Кровь мухи желтоватого цвета или бесцветная. Ее основная функция – перенос питательных компонентов. Не участвует в насыщении органов кислородом, не содержит эритроцитов.
Дыхательная система представлена множеством трахей по всему телу. Открывается наружу с помощью дыхалец. Трахеи разветвляются на многочисленные капилляры, имеют сложную структуру. Доставляют кислород непосредственно к разным органам, тканям. Развито 10 пар дыхалец, 2 пары на груди, остальные на брюшке.
Биология развития / Курс / Энтомология
Яйцо. Для насекомых характерны относительно крупные, богатые желтком яйца. Развиваясь в полости овариолы и испытывая давление её стенок, они несколько вытягиваются в длину, утрачивая характерную для яиц членистоногих округлую форму. У бабочек и некоторых клопов они становятся округлыми вторично.
Яйца насекомых разнообразны по форме и размерам (рис.:max_bytes(150000):strip_icc()/excretorysystem-56a51ed65f9b58b7d0dae789.jpg) 141). Наиболее крупные из них достигают 15 мм в длину (у пчелы Xylocopa), а самые мелкие не превышают 0,05 мм. Они варьируют от 1,35 % длины тела самки (микротипические яйца мух-тахин) до 44 и даже до 70 % (зимующие яйца тлей). У тараканов и прямокрылых яйца уплощены с вентральной и выпуклы с дорсальной стороны развивающихся в них эмбрионов, а у двукрылых и перепончатокрылых дорсальная сторона яйца вогнута, а вентральная выпукла.
141). Наиболее крупные из них достигают 15 мм в длину (у пчелы Xylocopa), а самые мелкие не превышают 0,05 мм. Они варьируют от 1,35 % длины тела самки (микротипические яйца мух-тахин) до 44 и даже до 70 % (зимующие яйца тлей). У тараканов и прямокрылых яйца уплощены с вентральной и выпуклы с дорсальной стороны развивающихся в них эмбрионов, а у двукрылых и перепончатокрылых дорсальная сторона яйца вогнута, а вентральная выпукла.
Рисунок 141. Форма яиц насекомых:
1 — ядро яйца; 2 — полярное тельце; 3 — зародышевая полоска
Плотная скорлупа яйца — хорион, секретируемый фолликулярными клетками, — двухслойная, пронизана системой воздухоносных полостей и функционирует по принципу трахейных жабр, или пластрона (рис. 142). Очевидно, способность к абсорбции кислорода из водной и воздушной сред особенно важна при периодическом затоплении яиц при обильной росе. Изредка под хорионом отлагаются слой воска и дополнительная кутикула. Яйца насекомых некоторых живородящих и паразитических форм вообще лишены хориона или сбрасывают его в начале развития.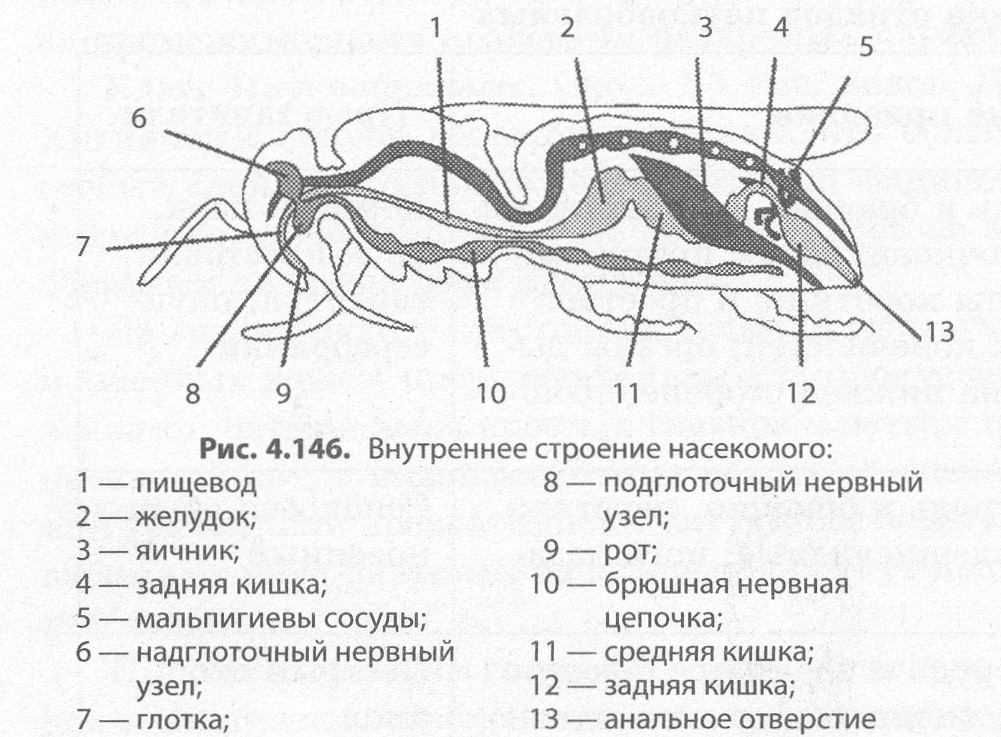
Рисунок 142. Ультраструктура хориона яйца (по Hinton, 1981):
1 — воздухоносные полости; 2 — экзохорион; 3 — эндохорион
Защищённое хорионом яйцо выделяет собственную, проницаемую для жидкостей и газов желточную оболочку. По-видимому, она сравнима с вителлиновой мембраной, формирующейся при оплодотворении и препятствующей проникновению избыточных сперматозоидов. Яйцо представляет собой гигантскую специализированную клетку, густо и равномерно заполненную гранулами желтка. Лишь на его периферии, непосредственно под желточной оболочкой, остаётся свободный от желтка слой цитоплазмы — периплазма, связанная тончайшими тяжами с околоядерным скоплением цитоплазмы в глубине яйца (см. рис. 138).
Рисунок 138. Строение сформированного яйца насекомых:
1 — оосома; 2 — хорион; 3 — периплазма; 4 — желток; 5 — ядро яйца; 6 — полярное тельце
У многих других животных, в частности у кольчатых червей, распределение желтка, напротив, неравномерно. Концентрируясь в нижней вегетативной половине яйца, желток оставляет свободной верхнюю, анимальную, половину, создавая анимально-вегетативный градиент в распределении желточных гранул, а также в свойствах яйца. Например, верхний, анимальный, полюс (рис. 143), обычно отмеченный положением полярных телец, служит очагом метаболических процессов, и именно здесь впоследствии зарождаются многие формообразовательные процессы, например формируется головной конец эмбриона. Противоположный, вегетативный, полюс яйца отличается иными признаками, в частности развитием процессов гаструляции и формированием заднего конца тела. Исходная анимально-вегетативная полярность яйца совпадает с главной осью тела развивающегося организма и предопределяет ход и направление основных процессов формообразования.
Концентрируясь в нижней вегетативной половине яйца, желток оставляет свободной верхнюю, анимальную, половину, создавая анимально-вегетативный градиент в распределении желточных гранул, а также в свойствах яйца. Например, верхний, анимальный, полюс (рис. 143), обычно отмеченный положением полярных телец, служит очагом метаболических процессов, и именно здесь впоследствии зарождаются многие формообразовательные процессы, например формируется головной конец эмбриона. Противоположный, вегетативный, полюс яйца отличается иными признаками, в частности развитием процессов гаструляции и формированием заднего конца тела. Исходная анимально-вегетативная полярность яйца совпадает с главной осью тела развивающегося организма и предопределяет ход и направление основных процессов формообразования.
Рисунок 143. Проявления анимально-вегетативной полярности яйца кольчатых червей:
а, б — соответственно нормальные и уродливые личинки; 1, 2 — соответственно вегетативный и анимальный полюс; 3 — дробление
У насекомых сколько-нибудь явных проявлений анимально-вегетативной полярности яйца не обнаружено, и все градиенты его свойств направлены от центра к периферии. Положение полярных телец здесь непостоянно, хотя чаще всего они выделяются близ переднего полюса на дорсальной стороне эллиптического яйца (рис. 144).
Положение полярных телец здесь непостоянно, хотя чаще всего они выделяются близ переднего полюса на дорсальной стороне эллиптического яйца (рис. 144).
Рисунок 144. Топография важнейших событий в сформированных яйцах насекомых:
А — шкала частот событий; цифры — число наблюдаемых вариантов в пределах класса
Лишь при сопоставлении ориентации всех основных формообразовательных процессов у примитивных ногохвосток (и членистоногих других групп) с соответствующими процессами у щетинохвосток и прочих насекомых можно признать продольную ось их яиц гомологичной оси полярности (оси анимально-вегетативного градиента) у тех организмов, где проявления ее очевидны. Таким образом, сравнивают самый общий план формообразования у насекомых и животных других групп (рис. 145).
Рисунок 145. Сопоставление координат формообразования в яйцах ногохвосток (А) и щетинохвосток (Б):
1 — дорсальный орган; 2 — полярные тельца; 3 — веретено первого деления; 4 — морфологические оси яйца и зародыша; 5 — борозда вентрального изгиба
Эмбриональное развитие
Эмбриональное развитие животных начинается дроблением яйца и формированием множества клеток, объединённых в бластулу. Далее происходит гаструляция, ведущая к обособлению зародышевых листков (эктодермы, мезодермы и энтодермы), и оформляющийся зародыш начинает сегментироваться.
Далее происходит гаструляция, ведущая к обособлению зародышевых листков (эктодермы, мезодермы и энтодермы), и оформляющийся зародыш начинает сегментироваться.
Несколько позднее появляются зачатки отдельных органов. Их развитие и дифференциация (органогенез) продолжаются до вылупления из яйца. С началом свободного существования период эмбриогенеза заканчивается и сформированный организм вступает в период постэмбриональных преобразований, длящихся до наступления половой зрелости.
Формирование зародыша
Мелкие округлые яйца ногохвосток, сформированные в лишённом овариол яичнике, подвергаются полному (тотальному) дроблению. При этом тело яйца последовательно дробится на 2, затем на 4, 8, 16, 32 клетки-бластомеры (рис. 146). Те из них, которые впоследствии дадут начало вспомогательным, внезародыщевым структурам (обслуживающим зародыш), группируются точно так же, как у кольчатых червей, по принципу спирального дробления. Другие располагаются по принципу двусторонней симметрии в соответствии с планом строения формируемого ими зародыша. Примечательно, что в пределах отряда ногохвосток наблюдается постепенный переход от полного дробления к поверхностному. Этот переход определяется расхождением ритмов деления ядер и цитоплазмы.
Примечательно, что в пределах отряда ногохвосток наблюдается постепенный переход от полного дробления к поверхностному. Этот переход определяется расхождением ритмов деления ядер и цитоплазмы.
Рисунок 146. Строение и последовательные стадии дробления (I–XV) яйца ногохвосток
При типичном поверхностном дроблении, свойственном насекомым, тело яйца вообще не дробится на бластомеры, и размножающиеся в нем ядра лишь впоследствии приобретают вокруг себя стенки клеток. Таким образом, на примере ногохвосток прослеживаются общие тенденции преобразований эмбриогенеза кольчатых червей и членистоногих.
Дальнейшие деления бластомеров у ногохвосток приводят к образованию периферического слоя мелких клеток, облекающих центральную массу более крупных, иногда сливающихся друг с другом бластомеров.
Первым признаком оформления тела зародыша служит зародышевая полоска, образованная направленной миграцией и концентрацией периферических клеток в вегетативном полушарии яйца. Охватывая полукольцом его вегетативный полюс, она имеет явственные головные доли и туловище (протокорм), а несколько позже разделяется на сегменты. Продолжая дифференцироваться, зародыш ногохвостки перегибается на вентральную сторону посредством глубокой борозды вентрального изгиба, и после выделения зародышевых листков в нем начинают формироваться органы (рис. 147). Не касаясь отдельных аспектов эмбриологии этих весьма своеобразных членистоногих, по многим признакам близких к многоножкам, выделим на схеме (см. рис. 145) лишь те из них, которые существенны для последующего сравнения с насекомыми.
Охватывая полукольцом его вегетативный полюс, она имеет явственные головные доли и туловище (протокорм), а несколько позже разделяется на сегменты. Продолжая дифференцироваться, зародыш ногохвостки перегибается на вентральную сторону посредством глубокой борозды вентрального изгиба, и после выделения зародышевых листков в нем начинают формироваться органы (рис. 147). Не касаясь отдельных аспектов эмбриологии этих весьма своеобразных членистоногих, по многим признакам близких к многоножкам, выделим на схеме (см. рис. 145) лишь те из них, которые существенны для последующего сравнения с насекомыми.
Рисунок 147. Дифференциация и вентральное изгибание зародышевой полоски ногохвосток:
1 — эмбриональная кутикула; 2 — лопнувший хорион; 3 — антенна; 4 — дорсальный орган; 5 — ноги; 6 — вентральное изгибание; I–VI — стадии развития
Положение ядра (синкариона) в яйце насекомых предопределяет положение центра дробления, в котором зарождаются первые митозы. Формирующиеся здесь ядра дробления остаются связанными друг с другом тяжами плазмы. Их потомки, продолжая делиться, постепенно расходятся к периферии, и обычно после седьмого синхронного деления большая часть образовавшихся при этом 128 ядер достигает периплазмы. При следующих митозах они проникают в периплазму и окружаются клеточными стенками. В результате на поверхности желтка формируется бластодерма — однослойный клеточный эпителий, но некоторые ядра остаются в его глубинах как первичные желточные клетки — вителлофаги (рис. 148). Таким образом достигается состояние бластулы, которая в данном случае при поверхностном дроблении именуется перибластулой.
Формирующиеся здесь ядра дробления остаются связанными друг с другом тяжами плазмы. Их потомки, продолжая делиться, постепенно расходятся к периферии, и обычно после седьмого синхронного деления большая часть образовавшихся при этом 128 ядер достигает периплазмы. При следующих митозах они проникают в периплазму и окружаются клеточными стенками. В результате на поверхности желтка формируется бластодерма — однослойный клеточный эпителий, но некоторые ядра остаются в его глубинах как первичные желточные клетки — вителлофаги (рис. 148). Таким образом достигается состояние бластулы, которая в данном случае при поверхностном дроблении именуется перибластулой.
Рисунок 148. Дробление яйца (I–III — стадии дробления) насекомых и формирование перибластулы (IV–VI — последовательность формирования):
1 — ядра дробления; 2 — половые клетки; 3 — зародышевая полоска
В центробежной миграции ядер к периферии, сопровождаемой ритмической пульсацией яйца, наступает момент, когда одно из них проникает в расположенный близ заднего полюса яйца центр активации. Влияние этого центра определяет ход последующих процессов формообразования, в чем можно убедиться при анализе результатов следующих экспериментов. При перешнуровывании пополам свежеотложенного яйца стрекозы Platycnemis (рис. 149) получают зародыш только в заднем изоляте, тогда как передний дегенерирует. В других экспериментах было обнаружено, что при смещении перетяжки назад развитие либо приостанавливается, либо область формирования зародыша ограничивается все более малым задним изолятом.
Влияние этого центра определяет ход последующих процессов формообразования, в чем можно убедиться при анализе результатов следующих экспериментов. При перешнуровывании пополам свежеотложенного яйца стрекозы Platycnemis (рис. 149) получают зародыш только в заднем изоляте, тогда как передний дегенерирует. В других экспериментах было обнаружено, что при смещении перетяжки назад развитие либо приостанавливается, либо область формирования зародыша ограничивается все более малым задним изолятом.
Рисунок 149. Роль центра активации и центра дифференциации в ранцем эмбриогенезе насекомых:
1 — центр активации; 2 — центр дифференциации; А–Г — последовательность стадий
Однако развитие происходит только в том случае, если в задний изолят успевает проникнуть хотя бы одно из ядер. Если же перетягивающая яйцо петля пройдёт позади «центра активации», то результат эксперимента изменяется: развитие зародыша происходит только впереди от петли, в обширном переднем изоляте.
На ранних стадиях эмбриогенеза ядра генетически однородны. Выжигая пучком ультрафиолетового света сразу после седьмого деления все ядра, кроме одного, можно лишь притормозить, но не нарушить ход развития. Оставшееся ядро, испытав дополнительные митозы вскоре восстанавливает их набор без видимых последствий для дальнейшего формообразования. Эти эксперименты, проведённые в начале XX века Ф. Зейделем, привели к открытию ещё одного морфогенетического центра на вентральной стороне яйца стрекозы Platycnemis — центра дифференциации, определяющего формирование зародышевой полоски, последовательность выделения в ней сегментов и их дифференциацию.
Приведённое описание выражает состояние, типичное для насекомых, но у паразитических перепончатокрылых, яйца которых не содержат желтка, дробление своеобразно. При первом делении яйцо Litomastbc рассекается снизу глубокой бороздкой, не дойдя до экватора, она пересекается бороздой второго деления (рис. 150). Верхняя нераздробившаяся половина, включающая полярные тельца, постепенно разрастается в виде парануклеарного тела вокруг нижней, интенсивно дробящейся половины. Когда число эмбриональных клеток в ней достигнет 200–250, некоторые на них приобретают веретено-видную форму и разделяют зародыш на дробящиеся фрагменты по 15–20 клеток. Продолжая делиться, эти фрагменты, в свою очередь, распадаются на отдельные группы клеток, и процесс, многократно повторяясь, приводит к образованию громадного числа отдельностей — будущих личинок паразита. Между тем парануклеарное тело становится органом, проводящим питательные вещества из гемолимфы хозяина. Благодаря этому явлению, называемому полиэмбрионией, исходная продуктивность материнской особи увеличивается в сотни и тысячи раз; оно отмечено по меньшей мере у 30 видов.
Когда число эмбриональных клеток в ней достигнет 200–250, некоторые на них приобретают веретено-видную форму и разделяют зародыш на дробящиеся фрагменты по 15–20 клеток. Продолжая делиться, эти фрагменты, в свою очередь, распадаются на отдельные группы клеток, и процесс, многократно повторяясь, приводит к образованию громадного числа отдельностей — будущих личинок паразита. Между тем парануклеарное тело становится органом, проводящим питательные вещества из гемолимфы хозяина. Благодаря этому явлению, называемому полиэмбрионией, исходная продуктивность материнской особи увеличивается в сотни и тысячи раз; оно отмечено по меньшей мере у 30 видов.
Рисунок 150. Полиэмбриония перепончатокрылого Litomastix:
I, II — соответственно осеменение и созревание яйца; 1 — зигота; 2 — парануклеарное тело; 3 — дробление яйца; 4 — обособление зародышей
Обычно делящиеся ядра генетически однородны, но у галлицы Wachtliella после третьего деления одно из ядер проникает в плазму заднего полюса и в дальнейшем приобретает собственный ритм митозов. При следующем (четвёртом) делении семь ядер, оставшихся за пределами этой области, подвергаются элиминации хроматина и впоследствии формируют бластодерму. Когда эти ядра достигают периферии яйца, в них вновь происходит элиминация хроматина, но только в тех яйцах, которые развиваются в самцов. В результате исследований были выявлены факторы элиминации, противоположные свойствам заднего полюса, где впоследствии формируются крупные клетки полового зачатка.
При следующем (четвёртом) делении семь ядер, оставшихся за пределами этой области, подвергаются элиминации хроматина и впоследствии формируют бластодерму. Когда эти ядра достигают периферии яйца, в них вновь происходит элиминация хроматина, но только в тех яйцах, которые развиваются в самцов. В результате исследований были выявлены факторы элиминации, противоположные свойствам заднего полюса, где впоследствии формируются крупные клетки полового зачатка.
Таким образом, уже после третьего деления ядра дифференцируются в зависимости от их положения в яйце, но для большинства насекомых характерна более поздняя дифференциация ядер, наступающая при выходе их в периплазму. При этом дифференциация ранее однородных ядер происходит за счёт неоднородности цитоплазмы в разных местах периплазмы.
Например, в яйцах мух периплазма с самого начала представляет собой мозаику предопределяемых зачатков и зон развития органов (рис. 151).
Рисунок 151. Карта расположения зачатков в яйце дрозофилы до дробления:
1 — передняя кишка; 2 — головной мозг; 3 — слюнные железы; 4 — сегменты тела; 5 — задняя кишка
Повреждая до начала дробления ту или иную зону, можно вызвать дефекты определённых органов и структур. Таким образом, основные процессы дифференциации клеток и образуемых ими тканей и органов предопределены или детерминированы до начала развития, ещё в ходе оогенеза. Из этого, однако, не следует, что судьба ядер, вышедших в определённую зону периплазмы, не может быть изменена в процессе развития и что все вызванные дефекты не регулируются. В опытах с центрифугированием яиц комара Chironomus в зависимости от их положения в поле искусственно созданной силы тяжести возможно появление уродцев с непропорционально крупной головой, с двумя брюшными отделами или вообще лишённых головы (рис. 152).
Таким образом, основные процессы дифференциации клеток и образуемых ими тканей и органов предопределены или детерминированы до начала развития, ещё в ходе оогенеза. Из этого, однако, не следует, что судьба ядер, вышедших в определённую зону периплазмы, не может быть изменена в процессе развития и что все вызванные дефекты не регулируются. В опытах с центрифугированием яиц комара Chironomus в зависимости от их положения в поле искусственно созданной силы тяжести возможно появление уродцев с непропорционально крупной головой, с двумя брюшными отделами или вообще лишённых головы (рис. 152).
Рисунок 152. Результаты экспериментов по центрифугированию яиц Chironomus:
а — передний полюс яйца; р — задний полюс
В ещё большей мере способность к регуляции проявляется в яйцах стрекоз, прямокрылых, некоторых клопов и других насекомых. Например, получение двух гармонично развитых, но соответственно уменьшенных эмбрионов-двойников в одном яйце здесь достигается с большей лёгкостью, чем у высших двукрылых, а в приведённом выше описании полиэмбрионии сам факт её существования обязан регуляции. Следовательно, противопоставление детерминированного и регулятивного развития насекомых не лишено смысла. Различна лишь степень проявления способности к регуляции, например у сверчков она больше, чем у мух.
Следовательно, противопоставление детерминированного и регулятивного развития насекомых не лишено смысла. Различна лишь степень проявления способности к регуляции, например у сверчков она больше, чем у мух.
Однако изучение генетических нарушений развития и мутаций, проявляющихся на самых ранних стадиях развития, показало, что они зависят лишь от материнского генотипа, под контролем которого осуществляется оогенез. Генотип самого зародыша, объединяющий свойства обоих родителей, проявляется позже, в дифференциации клеток бластодермы и в органогенезах. С этим положением вполне согласуются факты развития энуклеированных (лишённых ядер) и впоследствии дегенерирующих яиц, в которых происходят «дробление» безъядерных плазматических островков, их выход на периферию, а иногда и концентрация в некое подобие зародышевой полоски.
Сходные результаты могут быть и при скрещивании особей с несовместимыми генотипами: ранние стадии развития не требуют непосредственного участия ядер и содержащейся в них генетической информации. Не следует, однако, считать, что в этот период генетическая информация вообще не имеет значения: ведь формирование яйца со всеми его свойствами происходит при непосредственном участии и под контролем ядра ооцита, точнее, его генов, представляющих собой генотип матери. Эти свойства, весьма важные для ранних стадий эмбриогенеза, служат проводниками генетической информации, своеобразными посредниками между ядром ооцита и дифференцирующимися впоследствии ядрами клеток зародыша.
Не следует, однако, считать, что в этот период генетическая информация вообще не имеет значения: ведь формирование яйца со всеми его свойствами происходит при непосредственном участии и под контролем ядра ооцита, точнее, его генов, представляющих собой генотип матери. Эти свойства, весьма важные для ранних стадий эмбриогенеза, служат проводниками генетической информации, своеобразными посредниками между ядром ооцита и дифференцирующимися впоследствии ядрами клеток зародыша.
После оформления бластодермы начинается концентрация её клеток в зародышевую полоску, которая, как и у ногохвосток, имеет зачатки головных долей и туловища. В этот момент влияние возбуждённого центра активации, распространяясь по яйцу, достигает центра дифференциации, который индуцирует волны судорожных сокращений желтка. При этом желток оттягивается от хориона и высвобождается пространство, необходимое для закладки зародышевой полоски.
В исходном для насекомых состоянии зародышевая полоска, как и у ногохвосток, закладывается на заднем полюсе яйца, но затем погружается в желток, в формирующуюся амниотическую полость.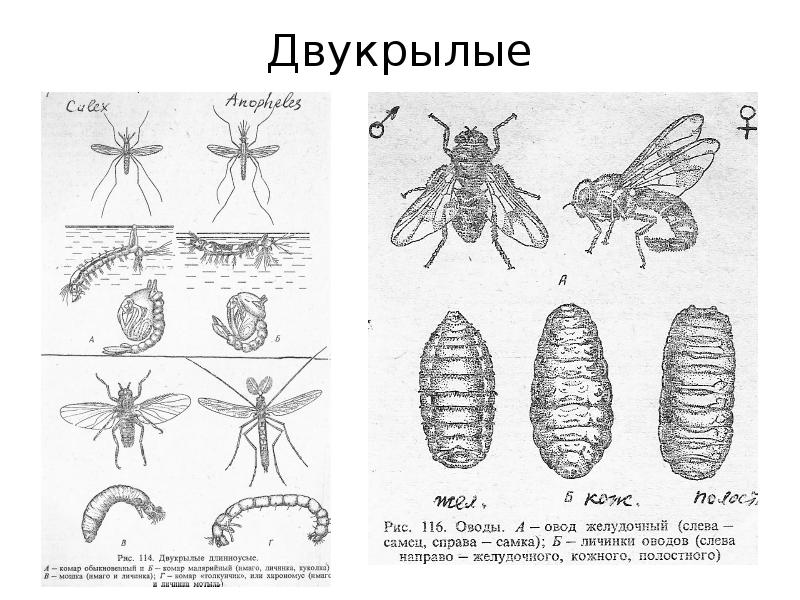 У щетинохвосток Machilis и Petrobius формирующиеся амниотические складки (рис. 153), нависая над зародышевой полоской, не смыкаются друг с другом, и ограничиваемая ими полость остаётся открытой.
У щетинохвосток Machilis и Petrobius формирующиеся амниотические складки (рис. 153), нависая над зародышевой полоской, не смыкаются друг с другом, и ограничиваемая ими полость остаётся открытой.
Рисунок 153. Бластокинез щетинохвостки Petrobius: I–VI — последовательность стадий
Однако гораздо чаще складки срастаются над эмбрионом, изолируя его от периферии двумя эмбриональными оболочками: внешней — серозой и внутренней — амнионом (рис. 154). Погружение зародышевой полоски в желток сопровождается формированием вентрального изгиба, как у ногохвосток. Оставаясь в глубине желтка, зародышевая полоска подвергается сегментации и через некоторое время возвращается на поверхность, занимая постоянное положение на вентральной стороне яйца.
Рисунок 154. Бластокинез (I–VIII последовательность стадий) и формирование зародышевых оболочек у щетинохвостки Lepisma (по Шарову, 1953):
1 — вителлофаги; 2 — зародышевая полоска; 3 — сероза; 4 — амнион; 5 — амниотическая полость; 6 — желток; 7 — обрастание желтка зародышем
Это перемещение зародыша, названное бдастокинезом (лат. blastos — зародыш, kinesis — движение), весьма характерно для насекомых и, видимо, связано с необходимостью изменения исходного положения зародыша в удлинённых и обогащённых желтком яйцах (рис. 155). Выход зародышевой полоски на вентральную сторону яйца значительно сокращает последующие процессы обрастания желтка её стенками. В противном случае эти процессы проходили бы от заднего полюса яйца к переднему, по наиболее долгому пути.
blastos — зародыш, kinesis — движение), весьма характерно для насекомых и, видимо, связано с необходимостью изменения исходного положения зародыша в удлинённых и обогащённых желтком яйцах (рис. 155). Выход зародышевой полоски на вентральную сторону яйца значительно сокращает последующие процессы обрастания желтка её стенками. В противном случае эти процессы проходили бы от заднего полюса яйца к переднему, по наиболее долгому пути.
Рисунок 155. Разнообразие бластокииезов у насекомых
У многих, более совершенных насекомых зародыш с самого начала закладывается в задней вентральной области яйца и бластокинезы существенно ограничиваются. У высших двукрылых и перепончатокрылых бластокинезы вообще редуцированы, так как оформляющаяся зародышевая полоска с самого начала занимает положение на вентральной стороне яйца. Приведённая трактовка эволюционных преобразований положения зародыша в координатах яйца, начиная с состояния кольчатых червей, иллюстрируется схемой, представленной на рисунке 156.
Рисунок 156. Эволюция положения зародыша в координатах яйца
Указанному ходу преобразований положения зародыша отвечает пополнение морфогенетических потенций периплазмы яйца, которое проявляется следующим образом. При типе короткого зародыша, свойственном яйцам относительно примитивных форм, повреждение участков зародышевой полоски не приводит к развитию дефектов или они проявляются в самой общей форме; при типе длинного зародыша, характерном для яиц двукрылых (рис. 157), нанесённые повреждения вызывают адекватные нарушения. Например, повреждение области зачатка слюнных желез лишает сформированных насекомых этих органов, повреждение зачатка головного мозга приводит к нарушениям в его развитии.
Рисунок 157. Морфогенетические типы зародышей у насекомых:
I, II, III — соответственно типы короткого, полудлинного, длинного зародыша
Переходу от типа короткого зародыша к типу длинного зародыша соответствуют пополнение набора детерминированных зачатков, а также последовательная редукция бластокинезов (рис. 158).
158).
Рисунок 158. Редукция бластокинезов у насекомых
В ходе дальнейшего эмбрионального развития зародышевая полоска образует по всей длине продольную первичную бороздку (рис. 159), со дна которой выклиниваются клетки нижнего зародышевого листка — совокупного зачатка мезодермы и эндодермы. Распространяясь под поверхностью, они оформляются в две ленты, подстилающие эктодермальную зародышевую полоску с обеих сторон от бороздки.
Рисунок 159. Первичная бороздка и выделение зародышевых листков у насекомых:
1 — ядра дробления; 2 — мезодерма; 3 — первичная бороздка
Её передний конец, углубляясь в желток в виде слепой трубки, даёт начало передней кишке эмбриона — стомодеуму, а задний — задней кишке — проктодеуму (рис. 160).
Рисунок 160. Образование стомодеума (1) и проктодеума (2) (по Ивановой-Казас, 1965)
Эти процессы, сравнимые с гаструляцией других животных, особенно своеобразны в крупных, заполненных гранулами желтка яйцах перелётной саранчи. В соответствии с разработанной на этом объекте концепцией мультифазной гаструляции её первая фаза начинается при дроблении с выделения первичных желточных клеток, которые можно сравнить с первичной энтодермой, вторая фаза — с появления первичной бороздки. Выделяющиеся из бороздки клетки, оседая на желтке, образуют желточную мембрану — временный эпителий средней кишки эмбриона; третья фаза, отмеченная появлением вторичной бороздки, сопровождается выделением клеточных элементов нижнего зародышевого листка, четвёртая фаза мультифазной гаструляции состоит в обособлении вторичных желточных клеток, соответствующих вторичной энтодерме. Если принять, что удельный вес и значение каждой фазы не постоянны, а меняются в связи с общими эволюционными преобразованиями эктодермы, мезодермы и энтодермы, то приведённую концепцию можно распространить на весь класс насекомых.
В соответствии с разработанной на этом объекте концепцией мультифазной гаструляции её первая фаза начинается при дроблении с выделения первичных желточных клеток, которые можно сравнить с первичной энтодермой, вторая фаза — с появления первичной бороздки. Выделяющиеся из бороздки клетки, оседая на желтке, образуют желточную мембрану — временный эпителий средней кишки эмбриона; третья фаза, отмеченная появлением вторичной бороздки, сопровождается выделением клеточных элементов нижнего зародышевого листка, четвёртая фаза мультифазной гаструляции состоит в обособлении вторичных желточных клеток, соответствующих вторичной энтодерме. Если принять, что удельный вес и значение каждой фазы не постоянны, а меняются в связи с общими эволюционными преобразованиями эктодермы, мезодермы и энтодермы, то приведённую концепцию можно распространить на весь класс насекомых.
Одновременно с выделением зародышевых листков начинается сегментация. Сначала обособляется сегмент нижней губы, расположенный в области центра дифференциации, затем выделяются сегменты максилл, переднегруди, и процесс сегментации распространяется далее в обоих направлениях. Наряду с появлением межсегментных перетяжек в эктодерме из подстилающих её лент нижнего листка выделяются мезодермальные сомиты, которые вскоре приобретают замкнутые целомические полости. Однако у термита Anacanthotermes сначала обособляются сомиты лабиального, максиллярного и мандибулярного сегментов. Далее выделяются сомиты преантенн, антенн и премандибулярного сегмента, а у палочника Carausius формируются также парные сомиты верхней губы (см. рис. 8). Впрочем, у большинства насекомых сомиты верхней губы, преантенн и премандибулярного сегмента не развиваются или чрезвычайно малы.
Наряду с появлением межсегментных перетяжек в эктодерме из подстилающих её лент нижнего листка выделяются мезодермальные сомиты, которые вскоре приобретают замкнутые целомические полости. Однако у термита Anacanthotermes сначала обособляются сомиты лабиального, максиллярного и мандибулярного сегментов. Далее выделяются сомиты преантенн, антенн и премандибулярного сегмента, а у палочника Carausius формируются также парные сомиты верхней губы (см. рис. 8). Впрочем, у большинства насекомых сомиты верхней губы, преантенн и премандибулярного сегмента не развиваются или чрезвычайно малы.
Рисунок 8. Формирующиеся сегменты головы зародыша палочника:
в. г, пант, ант, пмд, мд, мк — зачатки сегментов верхней губы, преантенн, антенн, премандибулярного, мандибулярного и максиллярного сегментов соответственно
После выделения головных и челюстных сегментов в зародышевой полоске Anacanthotermes происходит обособление четырех туловищных сегментов и передними формируется зона нарастания—скопление недифференцированных мезодермальных клеток (рис. 161). Однако впоследствии мезодерма этих сегментов сливается в единую массу, и вторично они обособляются уже после формирования впередилежащих сегментов из зоны нарастания. После образования сомитов оформляются межсегментные границы в эктодерме, и процесс сегментации, распространяясь в область груди и брюшка зародыша термита, завершается выделением одиннадцатого брюшного сегмента.
161). Однако впоследствии мезодерма этих сегментов сливается в единую массу, и вторично они обособляются уже после формирования впередилежащих сегментов из зоны нарастания. После образования сомитов оформляются межсегментные границы в эктодерме, и процесс сегментации, распространяясь в область груди и брюшка зародыша термита, завершается выделением одиннадцатого брюшного сегмента.
Рисунок 161. Сегментация зародышевой полоски термита:
1 — зона нарастания; 2 — стомодеум; 3 — антенны; 4 — верхняя губа; 5 — первый сегмент брюшка; 6 — проктодеум; I–VII — последовательность сегментации; VIII — голова зародыша
Последовательность выделения сегментов подчиняется влияниям центра дифференциации, но экспериментальные исследования эмбриогенеза цикадки Euscelis выявили более сложную зависимость (рис. 162). Перешнуровывая яйцо пополам на разных стадиях развития, начиная с делений созревания яйца и заканчивая концентрацией бластодермы в головные доли зародыша, удалось установить, что способность заднего изолята к формообразованию приобретается не сразу. В яйце, перетянутом до начала дробления, зародышевая полоска не образуется. Однако сходная процедура, проведённая в конце дробления, приводит к формированию в яйце зародышевой полоски, лишённой головы. При ещё более поздних воздействиях такого рода в заднем изоляте образуется полноценный, но несколько уменьшенный зародыш.
В яйце, перетянутом до начала дробления, зародышевая полоска не образуется. Однако сходная процедура, проведённая в конце дробления, приводит к формированию в яйце зародышевой полоски, лишённой головы. При ещё более поздних воздействиях такого рода в заднем изоляте образуется полноценный, но несколько уменьшенный зародыш.
Рисунок 162. Взаимодействие факторов переднего (а) и заднего (р) полюсов в экспериментах с цикадкой Euscelis:
1 — фрагмент зародыша; 2 — зародыш; 3 — симбионты
Приведённые результаты расходятся с данными, полученными для стрекозы Platycnemis, которые нельзя объяснить только деятельностью центров активации и дифференциации.
У цикадки Euscelis при изоляции заднего полюса яйца, отмеченного присутствием симбиотических организмов, наблюдается следующее. Если такую изоляцию создают до начала дробления, то в переднем изоляте образуется фрагмент головного отдела зародышевой полоски; если в более поздние сроки, то указанный фрагмент пополняется 1–2 сегментами. При оформлении бластодермы передний изолят приобретает способность к развитию полноценного зародыша.
При оформлении бластодермы передний изолят приобретает способность к развитию полноценного зародыша.
Сопоставляя способности переднего и заднего изолятов к формообразованию, можно предположить, что развитие нормальной зародышевой полоски обеспечивается взаимодействием факторов, исходящих от переднего и заднего полюсов яйца. Это предположение позволяет объяснить результаты экспериментов, в которых изоляции частей яйца предшествовало перенесение симбионтов с окружающей их плазмой во впередилежащие части яйца (см. рис. 162).
Формирование перевёрнутых зародышевых полосок, зеркально-симметричных дупликаций и фрагментов разного состава вскрыло взаимодействие обоих факторов в более наглядной форме. Оказалось, что до начала дробления фактор переднего полюса контролирует до 60 % длины яйца и продолжает распространяться к заднему полюсу в ходе дробления. Фактор заднего полюса распространяется медленнее: к началу дробления область проявления его деятельности ограничена лишь 10 %.
Таким образом, экспериментальные нарушения эмбриогенеза цикадки свидетельствуют о динамичности отношений и о значительных способностях к регуляциям. Предполагая, что область распространения обоих факторов до начала дробления варьирует у разных видов, можно объяснить результаты многих экспериментов, выполненных на других объектах: в частности, у стрекозы Platycnemis — более ранним распространением фактора переднего полюса, который к началу проведения экспериментов уже охватывает все яйцо. В таком случае деятельность центра активации можно свести к проявлению активности только одного фактора заднего полюса.
Предполагая, что область распространения обоих факторов до начала дробления варьирует у разных видов, можно объяснить результаты многих экспериментов, выполненных на других объектах: в частности, у стрекозы Platycnemis — более ранним распространением фактора переднего полюса, который к началу проведения экспериментов уже охватывает все яйцо. В таком случае деятельность центра активации можно свести к проявлению активности только одного фактора заднего полюса.
Рассмотрим органогенезы, происходящие в зародышевых листках и зачатках. Общее представление о природе и генеалогии отдельных тканей и органов насекомого даёт схема, приведённая на рисунке 163.
Рисунок 163. Генеалогия отдельных тканей и органов у насекомых
Производные мезодермы
Формирующиеся сомиты стрекозы Epiophlebia представлены скоплениями распределённых в один слой клеток мезодермы. Их последующие деления приводят к образованию двухслойных пластинок, и полость, возникающая при их расщеплении, становится полостью целома (рис. 164). При этом внешний слой, за счёт клеток которого развивается скелетная, соматическая, мускулатура, назван слоем соматической мезодермы, а внутренний, используемый для обслуживания и формирования внутренних, висцеральных, органов, — слоем висцеральной мезодермы.
164). При этом внешний слой, за счёт клеток которого развивается скелетная, соматическая, мускулатура, назван слоем соматической мезодермы, а внутренний, используемый для обслуживания и формирования внутренних, висцеральных, органов, — слоем висцеральной мезодермы.
Рисунок 164. Формирование целомов в сомитах разных сегментов:
1 — мезодерма; 2 — эктодерма; 3 — целом; 4 — мезодерма придатка; 5 — кардиобласт; 6 — половые клетки
Головное скопление мезодермы делится на два участка: передний образует парные целомы верхней губы, задний — целомы антенн. Кроме целомической мезодермы у заднего края грудных и челюстных сегментов развивается первичная медиальная мезодерма. Вместе со вторичной медиальной мезодермой, образованной краями сближенных сомитов грудных сегментов, она используется для создания гемоцитов.
Позднее вентральные стенки грудных целомов значительно утолщаются, а дорсальные становятся все более тонкими. Наконец они разрываются, полости целомов и тела объединяются в смешанную полость — миксоцель. В это же время целомы верхней губы, распадаясь на отдельные клетки, участвуют в образовании мускулатуры данного придатка.
Наконец они разрываются, полости целомов и тела объединяются в смешанную полость — миксоцель. В это же время целомы верхней губы, распадаясь на отдельные клетки, участвуют в образовании мускулатуры данного придатка.
Дорсальная стенка самого крупного антеннального целома впоследствии поставляет клетки жирового тела, а вентральная стенка позднее преобразуется в аорту. Вместе с клетками миниатюрного премандибулярного целома эта стенка участвует также в образовании мускулатуры стомодеума.
Большая часть клеток распадающихся целомов максилл и мандибул формирует челюстную мускулатуру, так же как и вентральные лопасти целомов нижней губы. Их дорсолатеральные части наряду с соответствующими частями целомов грудных и первых брюшных сегментов становятся висцеральной мезодермой, облекающей желточную массу и участвующей в образовании жирового тела.
Целомы брюшных сегментов дольше остаются замкнутыми и помимо висцеральной мускулатуры образуют жировое тело и скелетную мускулатуру. Сплошные сомиты десятого и одиннадцатого сегментов брюшка участвуют в формировании спинного сосуда личинки стрекозы.
При обрастании желтка клетки висцеральной мезодермы разных сегментов тела объединяются в две продольные ленты. Располагаясь по вентральной поверхности массы желтка, по сторонам от средней линии тела, эти ленты подходят к слепым концам стомодеума и проктодеума. Края лент разрастаются, и вскоре они облекают желток формирующимися продольными и кольцевыми мышцами кишечника. На дорсолатеральных краях целомов седьмого — девятого сегментов брюшка, в том месте, где слой висцеральной мезодермы смыкается с соматической, дифференцируются крупные клетки — кардиобласты. Подходя друг к другу с обеих сторон тела при обрастании желтка, они формируют спинной сосуд, позднее соединяющийся с аортой.
Центральная диафрагма, отделяющая эпиневральный синус от околокишечного, формируется из соматической мезодермы грудных и брюшных сегментов, а дорсальная диафрагма — из клеток соматической мезодермы, расположенных вблизи кардиобластов. Под дорсальной стенкой целомов пятого-шестого сегментов брюшка располагаются первичные половые клетки. Возникая при дифференциации бластодермы на заднем полюсе яйца, они связываются с задним концом зародышевой полоски и вместе с ней погружаются в желток при бластокинезах. Впоследствии они проникают в целомы соответствующих сегментов и входят в состав генитального гребня, образованного висцеральной мезодермой третьего — пятого сегментов. При обрастании желтка этот гребень сближается со спинным сосудом и разделяется на зачаток мезодермальной капсулы с включёнными в неё половыми клетками и на зачаток терминального филамента овариолы.
Возникая при дифференциации бластодермы на заднем полюсе яйца, они связываются с задним концом зародышевой полоски и вместе с ней погружаются в желток при бластокинезах. Впоследствии они проникают в целомы соответствующих сегментов и входят в состав генитального гребня, образованного висцеральной мезодермой третьего — пятого сегментов. При обрастании желтка этот гребень сближается со спинным сосудом и разделяется на зачаток мезодермальной капсулы с включёнными в неё половыми клетками и на зачаток терминального филамента овариолы.
Производные эктодермы
При обособлении сомитов в грудных и челюстных сегментах происходят заметные изменения в эктодер-мальном листке зародышевой полоски. У оснований формирующихся здесь придатков (рис. 165) располагается зона медиальной эктодермы, которая вскоре рассекается строго по средней линии тела нервной бороздкой. С обеих сторон от бороздки формируются нервные валики — сегментарные скопления крупных клеток — нейробластов. На дне нервной бороздки выделяются более анального нервного тяжа. Продуцируя мелкие ганглиозные клетки в направлении к периферии, медиальные нейробласты противопоставляются нейробластам нервных валиков, образующих ганглиозные клетки. Последние располагаются в направлении к мезодерме. Позднее, когда нервные валики покрываются слоем недифференцированных клеток эктодермы, в них обнаруживаются местные утолщения — зачатки трёх челюстных, трёх грудных и одиннадцати брюшных ганглиев.
Продуцируя мелкие ганглиозные клетки в направлении к периферии, медиальные нейробласты противопоставляются нейробластам нервных валиков, образующих ганглиозные клетки. Последние располагаются в направлении к мезодерме. Позднее, когда нервные валики покрываются слоем недифференцированных клеток эктодермы, в них обнаруживаются местные утолщения — зачатки трёх челюстных, трёх грудных и одиннадцати брюшных ганглиев.
Рисунок 165. Дифференциация производных эктодермы:
1 — амнион; 2 — эктодерма; 3 — мезодерма; 4 — целом; 5 — нейробласты; I–IV — последовательные стадии
Затем ганглии челюстных сегментов сливаются в единый подглоточный нервный узел, а ганглии десятого и одиннадцатого сегментов брюшка объединяются с ганглием девятого сегмента.
В формировании головного мозга, составленного протоцеребрумом, дейтоцеребрумом и тритоцеребрумом, обнаруживается определённое сходство с формированием брюшной нервной цепочки. Тритоцеребрум возникает из пары зачатков, расположенных позади стомодеума, и эктодермальных клеток, находящихся между зачатками. Дейтоцеребрум формируется из парных зачатков, лежащих впереди антенн, и некоторых клеток стомодеума. Зачатки этих отделов представлены 5–6 нейробластами. Формирование протоцеребрума происходит следующим образом. Сначала в области премандибулярного сегмента появляется несколько нейробластов, и из образуемых ими ганглиозных клеток оформляются три пары протоцеребральных лопастей. Затем латеральные лопасти разделяются на три массы, отвечающие зачаткам оптических пластинок, и в каждой из них возникают группы из 3–5 нейробластов. Две другие лопасти протоцеребрума также включают отдельные группы нейробластов, продуцирующих ганглиозные клетки. Впоследствии все эти зачатки объединяются друг с другом в надглоточный ганглий.
Тритоцеребрум возникает из пары зачатков, расположенных позади стомодеума, и эктодермальных клеток, находящихся между зачатками. Дейтоцеребрум формируется из парных зачатков, лежащих впереди антенн, и некоторых клеток стомодеума. Зачатки этих отделов представлены 5–6 нейробластами. Формирование протоцеребрума происходит следующим образом. Сначала в области премандибулярного сегмента появляется несколько нейробластов, и из образуемых ими ганглиозных клеток оформляются три пары протоцеребральных лопастей. Затем латеральные лопасти разделяются на три массы, отвечающие зачаткам оптических пластинок, и в каждой из них возникают группы из 3–5 нейробластов. Две другие лопасти протоцеребрума также включают отдельные группы нейробластов, продуцирующих ганглиозные клетки. Впоследствии все эти зачатки объединяются друг с другом в надглоточный ганглий.
Формирование стоматогастрической нервной системы, в частности фронтального ганглия, связано с дорсальной стенкой стомодеума, но в дальнейшем эта связь утрачивается. Как впячивания гиподермы формируются трахеи, эноциты, линочные железы, а от слепого конца проктодеума образуются пальцевидные врастания мальпигиевых сосудов. Стомодеум утрачивает подстилающую мезодерму и, окружаясь тонкой мембраной, дифференцируется на глотку, пищевод, зоб и провентрикулус. На конце стомодеума, упирающегося в массу желтка, остаются крупные недифференцированные клетки эктодермы — передний зачаток эпителия средней кишки. Сходные клетки остаются и на конце проктодеума в качестве заднего зачатка эпителия средней кишки.
Как впячивания гиподермы формируются трахеи, эноциты, линочные железы, а от слепого конца проктодеума образуются пальцевидные врастания мальпигиевых сосудов. Стомодеум утрачивает подстилающую мезодерму и, окружаясь тонкой мембраной, дифференцируется на глотку, пищевод, зоб и провентрикулус. На конце стомодеума, упирающегося в массу желтка, остаются крупные недифференцированные клетки эктодермы — передний зачаток эпителия средней кишки. Сходные клетки остаются и на конце проктодеума в качестве заднего зачатка эпителия средней кишки.
Производные энтодермы
В процессе эмбриогенеза передний и задний отделы средней кишки у личинок стрекоз формируются из соответствующих эктодермальных зачатков, и лишь срединная её часть образуется из иного источника, только после вылупления из яйца. При этом вителлофаги, оставшиеся в желтке, выходят на его периферию и образуют под слоем висцеральной мезодермы отдельные скопления клеток (рис. 166). Желток распадается на отдельные блоки, и у вылупляющейся из яйца личинки между этими блоками образуется просвет.
Рисунок 166. Формирование средней кишки из желточных клеток у стрекозы:
1 — желток; 2 — эктодерма; 3 — энтодерма; 4 — вителлофаги; 5 — первичная энтодерма; 6 — кишечник; 7 — эпителии средней кишки; А, Б — соответственно продольный и поперечный срезы; I–VI — последовательные стадии
Происходящие затем интенсивные деления клеток периферических скоплений приводят к оформлению сплошного эпителия средней кишки, который, таким образом, имеет двойственную природу: его передняя и задняя части происходят из эктодермы, а срединная часть — из энтодермы, представленной желточными клетками — вителлофагами.
Однако у более примитивных щетинохвосток эктодерма не принимает участия в построении средней кишки, она образуется целиком за счёт потомков вителлофагов. У многих, более совершенных насекомых, напротив, весь кишечник развивается из эктодермы. У паразитического перепончатокрылого Prestwichia он формируется из разросшегося стомодеума, а функции энтодермы ограничиваются присутствием в массе желтка постепенно дегенерирующих вителлофагов. Таким образом, в эволюционных преобразованиях эмбриогенезов насекомых происходит постепенное замещение энтодермы эктодермальными зачатками кишечника.
Таким образом, в эволюционных преобразованиях эмбриогенезов насекомых происходит постепенное замещение энтодермы эктодермальными зачатками кишечника.
Своеобразие органогенезов определяется конкретными взаимоотношениями зародышевых листков друг с другом. Это отчётливо проявляется в эксперименте (рис. 167). Например, при разрушении срединной части зародышевой полоски, почти целиком представляющей собой мезодерму, формирующийся эмбрион златоглазки Chrysopa оказывается лишённым мезодермальных органов, хотя его эктодерма вполне дифференцирована. В эктодерме развиваются нейробласты, оформляются придатки и другие производные этого зародышевого листка. Они отличаются от нормальных более или менее обширными деформациями, морщинистостью и другими дефектами, обусловленными отсутствием мезодермальной основы. Из этого следует, что в процессе обрастания желтка мезодерма исполняет роль каркаса для формирующейся эктодермы и экзодерма способна самодифференцироваться в отсутствие мезодермы. Отсутствие мезодермальной основы проявляется особенно резко при формировании придатков, которые напоминают пустые чехлы. Однако при более внимательном анализе дефектов обнаруживается, что роль мезодермы не сводится к роли каркаса. В отсутствие мезодермы придатки не расчленяются, а эктодерма, не обрастая желток, смыкается под ним.
Отсутствие мезодермальной основы проявляется особенно резко при формировании придатков, которые напоминают пустые чехлы. Однако при более внимательном анализе дефектов обнаруживается, что роль мезодермы не сводится к роли каркаса. В отсутствие мезодермы придатки не расчленяются, а эктодерма, не обрастая желток, смыкается под ним.
Рисунок 167. Взаимодействия эктодермы (индуктор) и мезодермы (компетентная ткань) в органогенезах златоглазки. Зачернённые области — участки повреждений:
1 — эктодерма; 2 — мезодерма
Более ограниченные повреждения срединной пластинки, например одной её половины, приводят к частичному нарушению формирования мезодермы, что свидетельствует об ограниченности регуляционных способностей в пределах мезодермального листка. При этом мезодермальные клетки, оставшиеся неповреждёнными, распространяются в латеральном направлении под эктодермой и дифференцируются как латеральные производные мезодермы даже в том случае, если они происходят из середины срединной пластинки. Это свидетельствует о том, что способность к распространению под эктодермой сохраняется в мезодерме, но характер дифференциации определяется положением под эктодермальным листком. Например, если срединные клетки мезодермы оказываются вблизи латерального края эктодермы, то они образуют не срединный мезодермальный тяж, как при нормальном развитии эмбриона, а его кардиобласты.
Это свидетельствует о том, что способность к распространению под эктодермой сохраняется в мезодерме, но характер дифференциации определяется положением под эктодермальным листком. Например, если срединные клетки мезодермы оказываются вблизи латерального края эктодермы, то они образуют не срединный мезодермальный тяж, как при нормальном развитии эмбриона, а его кардиобласты.
Влияние эктодермы на дифференциацию мезодермы проявляется также при разрушении латеральных пластинок зародышевой полоски, которые представляют собой эктодерму. При разрушении одной из латеральных пластинок клетки мезодермы сохраняют способность перемещаться в латеральном направлении, но не дифференцируются и вскоре дегенерируют. Более ограниченное повреждение латеральной пластинки приводит к тому, что мезодерма оформляется в уменьшенный целомический пузырёк, несмотря на то что число её клеток остаётся прежним. При повреждении латерального края пластинки не развиваются латеральные производные мезодермы — кардиобласты, а при разрушении медиального края — медиальные производные мезодермы. Следовательно, эктодерма насекомых определяет формообразование в мезодерме, а не наоборот, как у амфибий и других позвоночных животных.
Следовательно, эктодерма насекомых определяет формообразование в мезодерме, а не наоборот, как у амфибий и других позвоночных животных.
Постэмбриональное развитие
Переход к самостоятельному существованию обычно начинается с выходом из яйца личинки I возраста. Продолжая развиваться, она через несколько дней линяет на личинку II, затем — на личинку III возраста и наконец после нескольких линек и превращений достигает состояния имаго.
Однако изредка процессы постэмбрионального развития заметно сокращаются. Вылупляющаяся из яйца личинка мухи Hylemya сразу приступает к линьке, а личинка мухи Termitoxenia — к окукливанию. Таким образом, большая часть онтогенеза этих двукрылых проходит под защитой яйцевых оболочек, и стадии развития, ведущие у других близких видов свободное существование, становятся стадиями эмбриогенеза. В результате такого рода эмбрионизации развития выходящий из яйца организм становится более сформированным и приспособленным к самостоятельной жизни. Сходные тенденции преобразования онтогенеза нередки у обитателей пещер — троглобионтов и у видов, существующих в суровых условиях высоких широт и горных районов. Впрочем, некоторые из них размножаются живорождением, исходные формы которого проявляются в виде факультативного яйцеживорождения. Например, у жуков рода Chrysomela развитие эмбриона может начаться в овариолах яичника и из откладываемых самкой яиц вскоре выходят сформированные личинки. При некоторой задержке овуляции личинка вылупляется из яйца ещё в недрах материнского организма и лишь после этого выходит на свет. Нередко данному яйцеживорождению сопутствуют редукция хориона и сокращение запасов желтка, замещаемого секретом придаточных желез самки.
Сходные тенденции преобразования онтогенеза нередки у обитателей пещер — троглобионтов и у видов, существующих в суровых условиях высоких широт и горных районов. Впрочем, некоторые из них размножаются живорождением, исходные формы которого проявляются в виде факультативного яйцеживорождения. Например, у жуков рода Chrysomela развитие эмбриона может начаться в овариолах яичника и из откладываемых самкой яиц вскоре выходят сформированные личинки. При некоторой задержке овуляции личинка вылупляется из яйца ещё в недрах материнского организма и лишь после этого выходит на свет. Нередко данному яйцеживорождению сопутствуют редукция хориона и сокращение запасов желтка, замещаемого секретом придаточных желез самки.
При аденотрофическом живорождении мух цеце и кровососок яйцо сохраняет хорион и желток, но вылупляющаяся личинка остаётся в теле матери до III возраста. Питаясь секретом, она вскоре после рождения окукливается. У многих тлей, сеноедов и гемимерид формируется псевдоплацента, проводящая питательные вещества к лишённым хориона и желтка яйцам. У педогенетических галлиц и веерокрылых отмечено гемоцельное живорождение: формирующиеся яйца проникают в полость тела, и, используя ткани и гемолимфу своей матери, развиваются личинки, которые после гибели матери переходят к самостоятельному существованию.
У педогенетических галлиц и веерокрылых отмечено гемоцельное живорождение: формирующиеся яйца проникают в полость тела, и, используя ткани и гемолимфу своей матери, развиваются личинки, которые после гибели матери переходят к самостоятельному существованию.
Живорождение, как и эмбрионизация развития, содействует освоению новых сред обитания, и основное различие между этими процессами состоит в том, формирует ли самка желток или выкармливает своих потомков непосредственно гемолимфой. Основу постэмбрионального развития насекомых составляет рост, периодически прерываемый в каждом возрасте. Его периодичность обусловлена жёсткостью кутикулы, под покровом которой формирующееся насекомое не способно к увеличению объёма и линейных размеров тела. Однако его масса возрастает относительно непрерывно, и лишь сбрасывание покровов в период линьки позволяет насекомому увеличиваться в размерах.
Исходная периодичность роста, свойственная кольчатым червям, предопределяется периодичным наращиванием новых сегментов тела в постэмбриональный период. Это явление, названное анаморфозом, сохраняется у многоножек и бессяжковых в весьма ограниченной степени. Вылупляясь из яйца с 9-сегментным брюшком, личинка с каждой линькой добавляет по одному сегменту и через три линьки завершает анаморфоз уже с 12 сегментами в брюшном отделе. Эластичность покровов многих личинок не препятствует росту, и, очевидно, его периодичность связывается не с исходной жесткостью кутикулы, а с периодичностью анаморфоза. Однако жёсткие покровы более совершенных насекомых предельно ограничивают рост в интервалах между линьками, что нашло выражение в эмпирических правилах Дайара и Пржибрама.
Это явление, названное анаморфозом, сохраняется у многоножек и бессяжковых в весьма ограниченной степени. Вылупляясь из яйца с 9-сегментным брюшком, личинка с каждой линькой добавляет по одному сегменту и через три линьки завершает анаморфоз уже с 12 сегментами в брюшном отделе. Эластичность покровов многих личинок не препятствует росту, и, очевидно, его периодичность связывается не с исходной жесткостью кутикулы, а с периодичностью анаморфоза. Однако жёсткие покровы более совершенных насекомых предельно ограничивают рост в интервалах между линьками, что нашло выражение в эмпирических правилах Дайара и Пржибрама.
Сущность первого правила заключается в следующем. Например, увеличение линейных размеров головной капсулы гусениц бабочек выражается формулой х/у = const, что составляет 1,2–1,4. При этом х — данные измерений в определённом возрасте, у — данные измерений в следующем возрасте. В логарифмических координатах этим изменениям соответствуют прямые, наклон которых отражает интенсивность роста.
Второе правило, основанное на измерениях растущего богомола Sphrodomantis, более конкретно. Удвоение массы в каждом возрасте проявляется в увеличении линейных размеров насекомого пропорционально отношению х/у = ?3/2 = 1,26. Применение вычисленных констант ограничивается немногочисленными примерами гармонического (изометрического) роста. Однако рост многих частей тела существенно неравномерен, что показано на рисунке 168.
Рисунок 168. Неравномерность роста отдельных частей тела насекомых (по Romoser, 1981)
Типы постэмбрионального развития насекомых
Испытывая периодические линьки, в которых фаза аполизиса характеризует переход от одного возраста к другому, насекомые вырастают во многие сотни и тысячи раз. Наиболее примитивные из них, продолжая линять с достижением половой зрелости, не имеют фиксированного числа возрастов. Например, у щетинохвостки Therrnobia domestica L. отмечено до 60 линек, и постепенности постэмбрионального развития соответствуют весьма ограниченные преобразования от возраста к возрасту. Их даже иногда именуют развивающимися без превращения (Ametabola), но все же при более внимательном анализе можно видеть различия между молодыми и более взрослыми особями. В частности, вылупляющиеся из яйца личинки, питающиеся остатками эмбрионального желтка, имеют нерасчленённые на голень и лапку ноги, небольшое число фасеток глаз, члеников антенн и хвостовых нитей. По мере развития они приобретают признаки более взрослых форм: характерные чешуйки на теле пополняют наборы члеников и фасеток и в конце концов наружные половые придатки (рис. 169).
Их даже иногда именуют развивающимися без превращения (Ametabola), но все же при более внимательном анализе можно видеть различия между молодыми и более взрослыми особями. В частности, вылупляющиеся из яйца личинки, питающиеся остатками эмбрионального желтка, имеют нерасчленённые на голень и лапку ноги, небольшое число фасеток глаз, члеников антенн и хвостовых нитей. По мере развития они приобретают признаки более взрослых форм: характерные чешуйки на теле пополняют наборы члеников и фасеток и в конце концов наружные половые придатки (рис. 169).
Рисунок 169. Типы постэмбрионального развития насекомых (по Gillot, 1980, с изменениями)
У крылатых насекомых постэмбриональные преобразования выражены резче. Появление зачатков крыльев преображает облик развивающегося организма, но, например, у подёнок всё ещё сохраняются постепенность хода развития и большое число (до 30–35) возрастов. Вылупляющиеся из их яиц личинки имеют весьма отдалённое сходство со взрослыми насекомыми, отличаясь непропорционально крупной головой, нерасчленённостью голени и лапки, отсутствием зачатков крыльев и трахейных жабр, которые развиваются позднее. Особенно своеобразна фаза субимаго подёнок, которая представляет собой крылатое, способное к полёту существо, после очередной линьки превращающееся в имаго. По-видимому, и подёнки, и щетинохвостки сохранили до наших дней черты именно того типа развития, который отличал ископаемых предков и послужил общей основой для формирования полного и неполного превращения современных насекомых.
Особенно своеобразна фаза субимаго подёнок, которая представляет собой крылатое, способное к полёту существо, после очередной линьки превращающееся в имаго. По-видимому, и подёнки, и щетинохвостки сохранили до наших дней черты именно того типа развития, который отличал ископаемых предков и послужил общей основой для формирования полного и неполного превращения современных насекомых.
Типичное неполное превращение, свойственное тараканам, прямокрылым, клопам и многим другим насекомым группы Hemimetabola, отличается сокращённым и фиксированным числом линек и явным сходством вылупляющегося из яйца организма со взрослой формой. Различия между ними только в размерах, неразвитости гениталий и крыльев и некоторых других, менее заметных признаках. Преобразования, испытываемые по ходу развития, ограничены и обычно не сопровождаются сколько-нибудь резкими изменениями образа жизни, повадок и пищевой специализации.
Полное превращение, характерное для жуков, бабочек, мух и других представителей группы Holometabola, отличается резкими преобразованиями организации и образа жизни личинки. Испытав сравнительно небольшое число линек и накопив достаточные резервы, она окукливается. Куколка не реагирует на внешние раздражители и облечена толстым слоем покровов; на этой фазе развития происходят самые существенные изменения. Если вскрыть оболочку куколки, то под ней не видно ни гусеницы, ни бабочки. Под оболочкой находится лишь густая беловатая жидкость с плавающими обрывками тканей и клетками-фагоцитами. Лишь нервная цепочка и спинной кровеносный сосуд остаются неразрушенными. При этом из скоплений мельчайших клеток, которые находились под кожей, развиваются органы бабочки.
Испытав сравнительно небольшое число линек и накопив достаточные резервы, она окукливается. Куколка не реагирует на внешние раздражители и облечена толстым слоем покровов; на этой фазе развития происходят самые существенные изменения. Если вскрыть оболочку куколки, то под ней не видно ни гусеницы, ни бабочки. Под оболочкой находится лишь густая беловатая жидкость с плавающими обрывками тканей и клетками-фагоцитами. Лишь нервная цепочка и спинной кровеносный сосуд остаются неразрушенными. При этом из скоплений мельчайших клеток, которые находились под кожей, развиваются органы бабочки.
Наконец, наступает мгновение, подготовленное всей предшествующей жизнью личинки: шкурка куколки лопается, и из образующейся щели появляются сначала спинка и голова, а затем ноги, крылья и брюшко бабочки. Под давлением нагнетаемой гемолимфы и воздуха сморщенные чехлы расправляются в упругие яркие крылья. Таким образом, совершилось превращение в бабочку — существо, абсолютно непохожее на куколку и гусеницу.
Противопоставление исходно примитивного, полного и неполного превращений не исчерпывает разнообразия типов развития насекомых. Не стремясь описать все возможные варианты, отметим явные черты полного превращения у трипсов, белокрылок и самцов червецов, развивавшиеся на основе типичного неполного превращения. Здесь различия ранних и конечных стадий определяются крайним упрощением организации, сочетающимся с выработкой средств пассивной защиты у ведущих прикрепленное существование неполовозрелых особей. Теряя всякое сходство с подвижными крылатыми имаго, они вынуждены преобразовываться в процессе развития и приобретают некоторое подобие фазы куколки.
Типичное полное превращение (Holometabola) формируется не из неполного, а из примитивного исходного состояния. Его природу и соотношение стадий и фаз с неполным превращением (Hemimetabola) можно пояснить схемой, показанной на рисунке 170. Приведённая здесь трактовка соответствует эмбрионизации ранних стадий, которые у примитивных форм ведут свободное существование.
Рисунок 170. Соотношение разных типов постэмбрионального развития насекомых:
О — яйцо; l — эмбрионизированная личинка; L1–L10 — личинки I–X возрастов; N1–N10 — нимфы I–X возрастов; Р — куколка; I — имаго
Сходство молодых особей Hemimetabola с имаго существенно облегчает их определение и классификацию. Желая подчеркнуть это сходство, их часто именуют не личинками, а нимфами. Однако при смене сред обитания, например, у веснянок или стрекоз развивающиеся в воде нимфы все же мало похожи на взрослых особей.
Трахейные жабры и другие приспособления для подводного существования придают их облику значительное своеобразие. Покидая водную среду непосредственно перед окрылением, они утрачивают эти ненужные в наземных условиях приспособления и заметно преобразуются. Именно поэтому нимф амфибиотических насекомых иногда называют наядами. Напомним, что нимфы белокрылок и червецов испытывают столь глубокую специализацию, что теряют сходство с имаго и даже утрачивают некоторые признаки класса насекомых.
Для личинок отдела Holometabola несходство с имаго является правилом; их классификация часто искусственна и условна. Хищные личинки некоторых жуков, сетчатокрылых и ручейников с прогнатической головой и хорошо развитыми грудными ногами (рис. 171) называются камподеоидными из-за некоторого сходства с представителями рода Campodea из отряда Diplura.
Рисунок 171. Различные типы личинок насекомых (по разным авторам)
Близких по внешнему виду личинок жуков-жужелиц (Carabidae), отличающихся, однако, более короткими ножками, именуют карабоидными, а упругих и жёстких личинок жуков-щелкунов (Elateridae) и жуков-чернотелок (Tenebrionidae) — соответственно проволочниками и ложнопроволочниками.
Гусеницы многих бабочек, ложногусеницы пилильщиков и скорпионовых мух, обладающие кроме грудных ног ложноножками на брюшке, составляют группу эрукоидных (eruca — гусеница) личинок.
Личинки некоторых перепончатокрылых, жуков-долгоносиков, блох и двукрылых, лишенные развитых конечностей, а иногда и обособленной головы, называются червеобразными.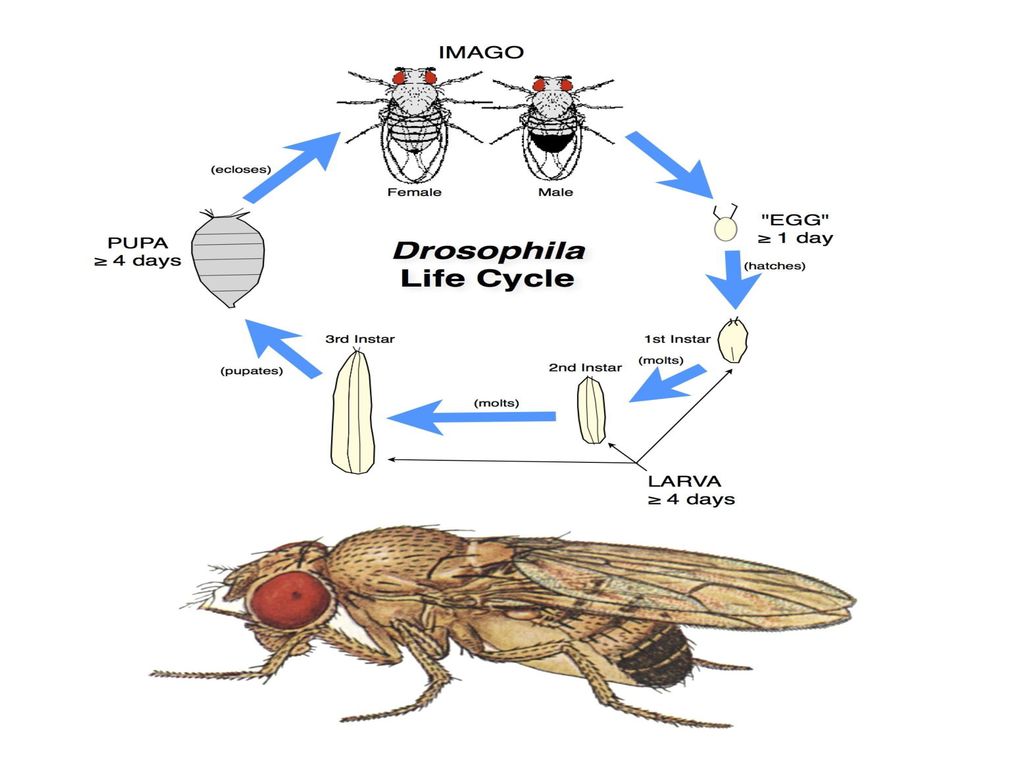
В ещё большей мере видоизменены личинки наездников-яйцеедов, развивающихся в желтке яиц избранных самкой хозяев. Теряя свойственный насекомым облик, они несколько напоминают низших ракообразных (род Cyclops) и именуются циклопоидными.
Фаза куколки и метаморфоз
Не менее условна и классификация куколок Holometabola. Предназначенная для перестройки организма личинки, эта фаза развития выражена с тем большей определённостью, чем глубже испытываемые преобразования. В исходном состоянии, например, у относительно примитивных ручейников и водных сетчатокрылых куколка сохраняет некоторую подвижность, но не способна к приёму пищи. Придатки, свободно прилегающие к телу, отличают куколок этого типа — свободных — от куколок покрытых, свойственных, например, бабочкам (рис. 172). Последние имеют спаянные с телом придатки и полностью неподвижны. Нередко они облечены коконом или чехликом. Куколки высших мух относятся к свободным, но заключены в бочонковидный пупарий — не сброшенную ранее и отвердевшую шкурку личинки последнего возраста.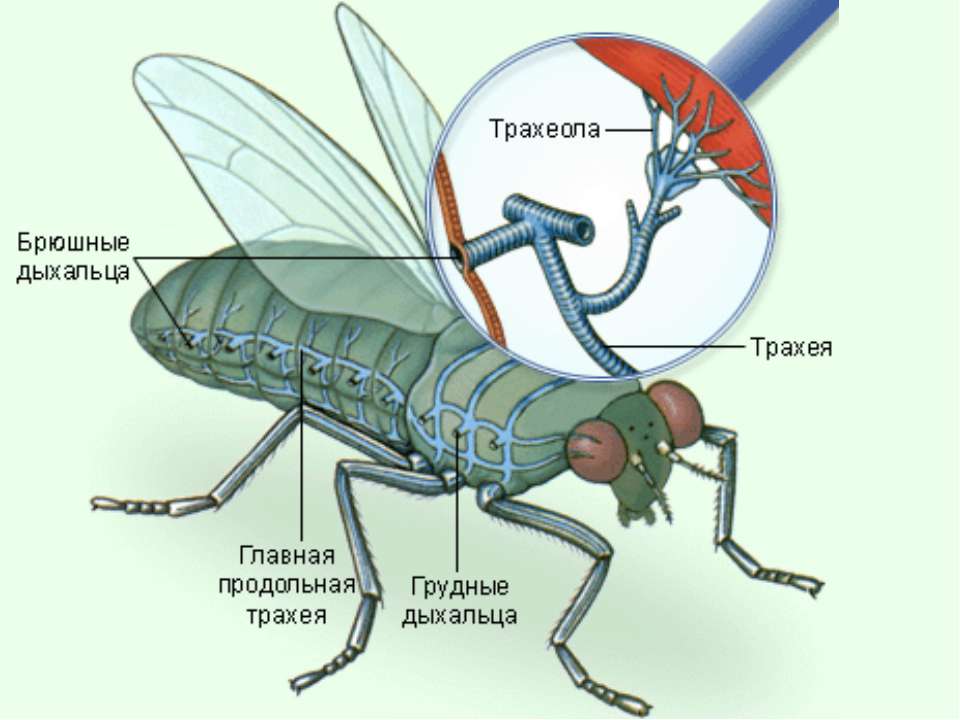
Рисунок 172. Типы куколок насекомых (по разным авторам)
Особенно глубокие преобразования испытывают в фазе куколки высшие двукрылые, перепончатокрылые, бабочки и жуки. В процессе гистолитического (гистолиз — растворение тканей) метаморфоза разрушаются кишечник, гиподерма, жировое тело и мускулатура личинки. Гистолиз включает фагоцитоз, лиоцитоз и автолиз. При фагоцитозе клетки гемолимфы — гемоциты — проникают в подлежащие распаду ткани и, захватывая псевдоподиями их фрагменты, расщепляют в своей цитоплазме. Наряду с этим гемоциты выделяют ферменты и способствуют внеклеточному перевариванию тканей личинки, или лиоцитозу. В то же время происходит автолиз, или самопереваривание тканей.
Образовавшиеся при лиоцитозе и автолизе продукты распада, так же как и отдельные фрагменты тканей, усваиваются гемоцитами и разносятся ими по всему телу. Полагают, что у высших двукрылых в процессе гистолиза преобладает фагоцитоз, а у бабочек, комаров и жуков — автолиз.
Источником пластических веществ для образования новых органов и тканей, или для гистогенеза, служат продукты распада, разносимые гемоцитами. Из гемоцитов они переходят к скоплениям недифференцированных эктодермальных клеток — имагинальным дискам, которые начинают интенсивно расти и дают начало органам взрослого насекомого. Имагинальные диски (рис. 173) обособляются в течение жизни личинок, а у высших двукрылых — на стадиях эмбриогенеза.
Из гемоцитов они переходят к скоплениям недифференцированных эктодермальных клеток — имагинальным дискам, которые начинают интенсивно расти и дают начало органам взрослого насекомого. Имагинальные диски (рис. 173) обособляются в течение жизни личинок, а у высших двукрылых — на стадиях эмбриогенеза.
Рисунок 173. Имагинальные диски (зачернены) в теле личинки мухи:
1 — верхняя губа; 2 — антенны; 3 — крылья; 4 — гонады
До перехода в фазу куколки имагинальные диски сохраняются относительно неизменными, но с наступлением метаморфоза начинают усиленно расти и выворачиваются под кутикулу куколки как формирующиеся ноги, антенны, крылья и половые придатки имаго (рис. 174).
Рисунок 174. Формирование конечности имаго в ходе метаморфоза (по Gillot, 1980):
1 — трахеи; 2 — эпидермис; 3 — личиночная кутикула; 4 — лапка; 5 — вертлуг; 6 — тазик; 7 — бедро; 8 — голень; 9 — кутикула куколки; I–V — последовательность фаз
У вислокрылок, верблюдок и сетчатокрылых — относительно примитивных насекомых с полным превращением — преобразования в ходе метаморфоза более ограничены, чем у жуков, бабочек, перепончатокрылых и мух. По своему объёму метаморфоз ручейников и скорпионовых мух занимает промежуточное положение. Таким образом, в пределах группы Holometabola отмечена тенденция к углублению превращений, которой соответствует усиление различий между личинками и взрослыми формами.
По своему объёму метаморфоз ручейников и скорпионовых мух занимает промежуточное положение. Таким образом, в пределах группы Holometabola отмечена тенденция к углублению превращений, которой соответствует усиление различий между личинками и взрослыми формами.
Полное превращение как один из способов постэмбрионального развития насекомых характеризуется в первую очередь покоящейся фазой куколки и гистолитическим метаморфозом. Однако и при типичном неполном превращении линьке на имаго сопутствуют заметные преобразования организации. Например, наяды стрекоз теряют свою ловчую маску (и связанную с ней мускулатуру) и жабры, но развивают заново мощные крыловые мышцы, при этом оставаясь некоторое время неактивными. Следовательно, отдельные признаки полного превращения отмечаются и у Hemimetabola, но в значительно меньшей степени.
Иногда противопоставление Hemimetabola и Holometabola основывают на способе развития крыльев: в виде либо наружных, либо ввёрнутых внутрь под гиподерму зачатков. В соответствии с этим насекомых первой группы именуют также Exopterygota, а второй — Endopterygota. Однако крыловые зачатки белокрылок и самцов червецов ввёрнуты внутрь, и противопоставление обеих групп по этому признаку не абсолютно.
В соответствии с этим насекомых первой группы именуют также Exopterygota, а второй — Endopterygota. Однако крыловые зачатки белокрылок и самцов червецов ввёрнуты внутрь, и противопоставление обеих групп по этому признаку не абсолютно.
С этим заключением согласуется общее сходство гормональных механизмов развития, рассмотренных ранее при обсуждении эндокринной системы насекомых. Совместное присутствие в гемолимфе линочного и ювенильного гормонов предопределяет линьку личинок из одного возраста в другой, при некотором снижении титра ЮГ личинка окукливается. В период линьки на имаго ЮГ исчезает из гемолимфы и появляется вновь лишь впоследствии, при развитии яичников и яиц. Это иллюстрируется рисунком 175: в зависимости от баланса гормонов в гемолимфе активируются разные группы генов, ответственные за развитие признаков, либо личинки (PHK-L), либо куколки (РНК-Р), либо имаго (PHK-I).
И полное, и неполное превращения — результат приспособления к конкретным условиям существования и развития. В этом смысле оба они одинаково совершенны. Происходящая нередко дифференциация онтогенеза по фазам на расселительную, вегетативную и генеративную требует соответствующих перестроек, и чем сильнее различия между фазами, тем эти перестройки глубже. Если у Hemimetabola все перечисленные функции осуществляются в одной жизненной форме, то у Holometabola вегетативные функции сосредоточены в личиночной фазе, а расселение и размножение — чаще всего привилегия имаго. Появление покоящейся фазы — куколки — в данном случае необходимо и естественно.
В этом смысле оба они одинаково совершенны. Происходящая нередко дифференциация онтогенеза по фазам на расселительную, вегетативную и генеративную требует соответствующих перестроек, и чем сильнее различия между фазами, тем эти перестройки глубже. Если у Hemimetabola все перечисленные функции осуществляются в одной жизненной форме, то у Holometabola вегетативные функции сосредоточены в личиночной фазе, а расселение и размножение — чаще всего привилегия имаго. Появление покоящейся фазы — куколки — в данном случае необходимо и естественно.
В ещё большей степени дифференцирован онтогенез при гиперметаморфозе, свойственном некоторым сетчатокрылым, жукам, двукрылым, перепончатокрылым и всем веерокрылым. У жуков-нарывников (Meloidae), например, из яйца вылупляется крошечная камподеоидная личинка — триунгулин, или планидия. Не принимая пищи, она активно отыскивает хозяев — кубышки с яйцами саранчовых и, проникнув в них, линяет на эруковдную личинку. Оставаясь в кубышке, эта личинка питается, трижды линяет и вскоре превращается в покоящуюся зимующую ложную куколку, которая имеет внешние признаки покрытой куколки. После зимовки она линяет на личинку, почти лишённую ног, которая, продолжая питаться, окукливается и через положенный срок преобразуется во взрослую особь. Сходным образом развиваются мухи-жужжала (Bombiliidae) и мантиспы из сетчатокрылых.
После зимовки она линяет на личинку, почти лишённую ног, которая, продолжая питаться, окукливается и через положенный срок преобразуется во взрослую особь. Сходным образом развиваются мухи-жужжала (Bombiliidae) и мантиспы из сетчатокрылых.
Отличительные особенности присущи гиперметаморфозу веерокрылых. Вылупляющийся из яйца триунгулин отыскивает хозяина и линяет на паразитирующую в нем личинку. При развитии самца последняя в конечном итоге окукливается и преобразуется в крылатое свободноживущее насекомое. Самка, сохраняя облик личинки, продолжает паразитировать, и это, пожалуй, единственный известный пример отсутствия фазы куколки у Holometabola.
Функции расселения и размножения, свойственные фазе имаго, нередко приводят к редукции структур и органов, отвечающих за вегетативные процессы. Например, взрослые подёнки вообще не питаются, не имеют челюстей и кишечника и живут в лучшем случае несколько дней. Столь же недолговечны многие взрослые бабочки, ручейники и веснянки. Однако царица термитов может прожить 25 лет. Наряду с наследственными факторами старения пределы жизни в состоянии имаго зависят от внешних обстоятельств. Имаго многих видов насекомых гибнут осенью или после откладки яиц.
Наряду с наследственными факторами старения пределы жизни в состоянии имаго зависят от внешних обстоятельств. Имаго многих видов насекомых гибнут осенью или после откладки яиц.
Примечательны различия в сроках жизни самцов и самок. Во многих случаях последние более долговечны: например, самки комнатной мухи живут в среднем 29 дней, а самцы — 17,5, самки жука-оленя (Lucanus cervus L.) — 32 дня, а самцы — лишь 19. Как правило, взрослые насекомые не растут и в отличие от нимф и личинок не регенерируют утраченных придатков, но обезглавленные палочники и некоторые кровососущие клопы существуют месяцами. Первые восстанавливают головную капсулу, однако лишённую мозга, вторые затягивают поверхность раны кутикулой.
Полиморфизм
В течение жизни насекомые проходят последовательные фазы развития и меняют свой облик. Для Hemimetabola характерны фазы яйца, нимфы и имаго, Holometabola после фазы личинки переходят в фазу куколки. Однако этим не исчерпывается индивидуальное разнообразие их форм. Многие насекомые обладают ярко выраженным полиморфизмом, и самое обычное его проявление — внешние различия самцов и самок. Нередко особи противоположного пола кроме различий половых органов и хромосом имеют разные размеры тела (самки, как правило, крупнее самцов), окраску и рисунок (самцы обычно окрашены ярче), другие признаки, включая формы поведения, способы развития и пищевые предпочтения. Самцы могут иметь кутикулярные выросты, например рога у жука-оленя и жука-носорога.
Многие насекомые обладают ярко выраженным полиморфизмом, и самое обычное его проявление — внешние различия самцов и самок. Нередко особи противоположного пола кроме различий половых органов и хромосом имеют разные размеры тела (самки, как правило, крупнее самцов), окраску и рисунок (самцы обычно окрашены ярче), другие признаки, включая формы поведения, способы развития и пищевые предпочтения. Самцы могут иметь кутикулярные выросты, например рога у жука-оленя и жука-носорога.
Одно из проявлений полового полиморфизма — дифференциация членов семей и колоний, свойственная общественным перепончатокрылым. Если у пчёл эта дифференциация ограничена трутнями (самцы), маткой (самка) и рабочими особями (недоразвитые самки), то у муравьёв наряду с ними выделяются фуражиры, солдаты, разведчики и другие, отличающиеся друг от друга формы. Кастовый полиморфизм термитов столь тесно не связан с половой принадлежностью особей и основывается главным образом на различиях хода онтогенеза (рис. 176).
Рисунок 176. Схема дифференциации каст у термитов
Схема дифференциации каст у термитов
Своеобразен фазовый полиморфизм прямокрылых и гусениц некоторых бабочек. При значительной скученности особей перелётной саранчи они приобретают черты и свойства «стадной фазы», которая отличается от «одиночной фазы» более тёмной пигментацией коренастого тела, повышенным уровнем метаболизма, активностью, скоростью развития и, что особенно существенно, способностью к продолжительным миграциям и прожорливостью. Более стройные и светлоокрашенные одиночные формы обладают несколько большим числом зачатков овариол. И стадная, и одиночные фазы способны преобразовываться друг в друга, что, по-видимому, можно считать приспособлением саранчи к меняющимся условиям существования.
Следует выделить также экологический полиморфизм, связанный с различиями в условиях существования, и один из его вариантов — сезонный полиморфизм. Особенно наглядны эти типы полиморфизма при дифференциации жизненных циклов.
Жизненные циклы
При свойственном подавляющему большинству насекомых обоеполом размножении весь жизненный цикл включает последовательные фазы развития и, начиная с яйца, отложенного самкой, завершается формированием особи следующего поколения. Нередко в течение года формируется только одно поколение (моновольтинные циклы): после выхода с мест зимовки половые партнёры отыскивают друг друга, самки откладывают оплодотворённые яйца и осенью обычно гибнут. Развивающиеся потомки достигают к концу лета фазы имаго и с наступлением холодов уходят на зимовку, чтобы следующей весной дать начало новому поколению. Это лишь один из примеров моновольтинного цикла; многие насекомые остаются зимовать в иных фазах развития: двукрылые обычно зимуют в фазе куколки, а саранчовые — в фазе яйца.
Нередко в течение года формируется только одно поколение (моновольтинные циклы): после выхода с мест зимовки половые партнёры отыскивают друг друга, самки откладывают оплодотворённые яйца и осенью обычно гибнут. Развивающиеся потомки достигают к концу лета фазы имаго и с наступлением холодов уходят на зимовку, чтобы следующей весной дать начало новому поколению. Это лишь один из примеров моновольтинного цикла; многие насекомые остаются зимовать в иных фазах развития: двукрылые обычно зимуют в фазе куколки, а саранчовые — в фазе яйца.
Гораздо чаще в течение одного года сменяется несколько поколений, и многие вредители сельскохозяйственных культур имеют такие поливольтинные жизненные циклы. Многолетние жизненные циклы, когда на развитие одного поколения требуется несколько лет, встречаются несравненно реже. Например, майский хрущ развивается в течение 3–4 лет, а североамериканская семнадцатилетняя цикада (Magicicada septendecim L.) — в течение 17 и даже 25 лет.
Развитие сезонного полиморфизма несколько нарушает монотонность поливольтинных циклов: нередко особи весеннего поколения отличаются по рисунку и цвету от особей летних поколений, а они, в свою очередь, от особей осенних и зимующих поколений. Положение, однако, резко меняется при гетерогонии — чередовании обоеполых и партеногенетических поколений в жизненном цикле. Например, орехотворка Callirhytis сначала развивается в тычиночных цветках клёна и дуба. После окрыления и спаривания она откладывает яйца на их листья, и вокруг развивающихся здесь личинок образуются галлы — опухолевидные разрастания тканей листа, имеющие вид орешков. Испытав ряд линек, личинка выпадает из галла на землю и окукливается в почве, преобразуясь в партеногенетическую самку. Последняя отыскивает цветочные почки и откладывает в них
| Главная » Статьи и полезные материалы » Микроскопы » Статьи о микроскопах, микропрепаратах и исследованиях микромира » Как выглядит муха под микроскопом Муха – весьма распространенное двукрылое насекомое. Столкнуться с ней можно не только в дикой природе, но и в собственной квартире. Большинство мух безобидны, но некоторые виды являются переносчиками опасных болезней и вирусов – к счастью, они обитают в основном в Африке. Домашнюю муху можно безбоязненно ловить и изучать под микроскопом. И посмотреть в ней есть на что. Как выглядит муха под микроскопом, можно увидеть на фото сбоку – насекомое сфотографировано при увеличении в 40 крат. Для наблюдений использовался обычный биологический микроскоп, а снимок сделан при помощи специальной цифровой камеры. После осмотра всей мухи целиком стоит перейти к изучению ее конечностей, крыльев и глаз. Лапки мухи под микроскопом следует рассматривать, начиная с небольшого увеличения в 40х. Получится детально рассмотреть сегменты конечностей, густо растущие щетинки, острые коготки и присоски, которыми муха «цепляется» за поверхность. Изучая то, как выглядит муха под микроскопом, стоит обратить внимание и на ее голову. Глаза лучше исследовать на кратности свыше 100х – так удастся увидеть их многоячеистую структуру. Каждая ячейка (фасетка) – это маленький орган зрения, который видит только небольшой кусочек окружающего мира. Оба глаза мухи состоят примерно из 3 500 фасеток и обеспечивают обзор на почти полные 360°. Еще один интересный объект для изучения – мушиный хоботок. Он мягкий, поэтому комнатные мухи не кусаются. Хоботок служит для всасывания мягкой и жидкой пищи: нектара, сока, фруктовых пюре и т.д. Не забудьте рассмотреть и крылья мухи – они красивы и переливаются всеми цветами радуги. Для изучения мухи необязательно ловить и препарировать живое насекомое, можно воспользоваться наборами готовых микропрепаратов. А если у вас нет микроскопа и вы не планируете его покупать в ближайшее время, увидеть строение мухи под микроскопом можно на картинках в книге знаний «Невидимый мир». Рекомендуем это пособие всем начинающим микробиологам и юным ученым, которые интересуются устройством окружающего мира. 4glaza.ru Использование материала полностью для общедоступной публикации на носителях информации и любых форматов запрещено. Разрешено упоминание статьи с активной ссылкой на сайт www.4glaza.ru. Производитель оставляет за собой право вносить любые изменения в стоимость, модельный ряд и технические характеристики или прекращать производство изделия без предварительного уведомления.
Другие обзоры и статьи о микроскопах, микропрепаратах и микромире:
|
Гены, от которых вырастают крылья. И ноги. И всё остальное
У каждого многоклеточного животного есть своё многоклеточное, только ему присущее тело. Любую муху мы можем отличить от слона. Это легко, ведь их тела соответствуют определённому плану строения. Для мухи, например, это шесть лап, крылья, сегменты тела. В то же время у слона конечностей меньше и крыльев нет. Но как этот особенный план записан в слоне или мухе? Если задуматься, то он должен быть уже в первой клетке, из которой разовьётся организм. И конечно, он записан в геноме этой первой клетки — в виде генов и межгенных регуляторных участков. Так можно ли сделать из мухи слона?Голова плодовой мушки дикого типа и мутанта с нарушенной работой гена Antennapedia. Вместо антенны выросли ноги! Фото: F. Rudolph Turner, Indiana University (USA).
Работа генов определяет устройство тела любого животного. Даже одиночная мутация может приводить к весьма выразительным эффектам. На фото: слева — плодовая мушка дикого типа, справа — мутант с нарушенной работой одного-единственного гена Ubx.
Чем мышь похожа на плодовую мушку? Гомеозисными генами. На схеме кластеров гомеозисных генов плодовой мушки Drosophila и мыши гены, обозначенные одинаковым цветом, имеют общее происхождение.
Схема Bithorax-комплекса генов плодовой мушки. Цвета сегментов тела мухи отвечают участкам комплекса генов того же цвета, мутации в которых влияют на эти сегменты. Стрелками обозначены гомеозисные гены Ubx, аbd-A, Abd-B.
‹
›
Особенные гены для особенных задач
Генетики часто используют в работе плодовую мушку. Как следствие, для неё известно впечатляющее количество нарушений в разных генах — мутаций. Мутации эти были выявлены в основном по изменению внешнего вида мухи. Например, есть гены, продукты которых — белки, синтезирующие красный пигмент в глазах насекомого. Благодаря этим генам у плодовой мушки дикого типа глаза красные. Если один из таких генов отключить, глаза лишатся пигмента и мухи-мутанты будут белоглазыми. Повреждения тех или иных генов могут вообще лишить насекомое глаз, или щетинок, или окраски тела. Но есть мутации, эффект от которых намного более драматичен.
В конце 40-х годов ХХ века биологам попалась муха с ногами вместо антенн на голове. Ноги на голове — это уже не просто другой цвет глаз! Такое происшествие — не «потеря чего-то», а «превращение одного в другое». Или ещё пример. Мушиная грудь состоит из трёх сегментов, на втором из которых располагаются крылья. Известны мутанты, у которых третий сегмент груди превращён во второй, и муха имеет две пары крыльев. Вы не задумывались, как появились четырёхкрылые бабочки? Их предкам было достаточно сохранить мутации, приводящие к развитию лишних, но столь пригодившихся им крыльев.
Мутации, вызывающие превращение одних частей тела в другие, назвали гомеозисными (от лат. homеo — подобный). Можно определить, где произошла та или иная мутация, и выяснить, какой именно ген она повредила. Такие гены были найдены, их тоже назвали гомеозисными. Насколько эти гены распространены у живых организмов и можно ли найти их у человека? Явные следы сегментации тел млекопитающих остались в строении скелета. Вы знаете, что бывают люди, у которых обе челюсти — верхние? Что можно легко превратить спинные позвонки мыши в грудные, выключая определённые гены? Подобно тому как мухе можно «подарить» вторую пару крыльев, мыши можно легко обеспечить дополнительную пару рёбер. И не одну. Это тоже результат мутаций в гомеозисных генах. Как выяснилось, они есть у всех многоклеточных организмов.
Раскрой мне свои гомеозисные гены, и я скажу, кто ты
Вообще говоря, где грань между мутацией и нормой? Вы обидитесь на слова о лишней паре крыльев, если вы бабочка. Замечания об избыточных ногах, возможно, расстроят креветку. А у неё просто работает ген, который у мухи отключён, и потому она имеет не шесть ног, а десять.
Гомеозисные гены у всех организмов очень похожи. Вероятно, с задачей планирования своего тела столкнулось уже первое многоклеточное животное. И решение этой задачи унаследовали все современные животные. Например, у мучного жука есть восемь гомеозисных генов, которые расположены в геноме поблизости друг от друга — в составе одного генного кластера. У плодовой мушки таких генов тоже восемь, но расположены они двумя группами далеко друг от друга. Вероятно, такая ситуация возникла из-за хромосомной перестройки, в результате которой исходный комплекс разделился надвое, но сохранил работоспособность. Большинство насекомых в этом смысле похожи на мучного жука. Похожа на мучного жука и мышь. У неё группа гомеозисных генов, аналогичная генам насекомых, расположена в едином кластере. Только таких кластеров — четыре. Очевидно, они возникли в результате последовательного удвоения одиночной предковой группы генов. Гомеозисных генов у мыши в несколько раз больше, чем у мухи, но все они похожи на восемь мушиных и, вероятно, возникли за счёт удвоения исходных генов и последующей самостоятельной эволюции.
В целом просматривается связь: чем сложнее устроен организм животного, тем больше у него гомеозисных генов. Так, у всех беспозвоночных есть только один содержащий их кластер. При этом у таких примитивных организмов, как губки, в нём всего один либо два гена. А вот у примитивных позвоночных — миног — уже четыре кластера, как у мыши. Кстати, первые гомеозисные мутации были обнаружены и описаны у растений… Например, на месте лепестков могут появляться тычинки.
Сферы влияния
Гомеозисные мутации у плодовой мушки обнаружили давно, в начале XX века, и с тех пор описали большое их количество. Как позже выяснилось, не все они расположены в генах. Но тогда генетики ещё не знали, что же, если не гены, может быть повреждено мутациями. Понимание принципов работы гомеозисных генов росло параллельно с развитием биологии, и едва ли не всем новым фактам о работе генома находилось место в кластерах гомеозисных генов. Часто изучение самих гомеозисных генов рождало новые знания, — многие генетические механизмы впервые были показаны именно на них. Попробуем разобраться, к чему это привело.
Лучше всего изучен комплекс гомеозисных генов плодовой мушки Bithorax («двойная грудь»), названный по найденной в нём мутации, которую обнаружили почти сто лет назад, в 1915 году. Bithorax-комплекс — это отделившаяся часть единого предкового комплекса гомеозисных генов. Он ответственен за развитие задних двух третей тела мухи. Первая треть тела контролируется другой частью разделившегося кластера — комплексом Antennapedia («ноги-вместо-антенн»). Может, не очень понятно, почему целый комплекс, отвечающий за формирование первой трети тела, назван в честь головных антенн, но слишком уж была примечательна мутация, превращающая антенны в ноги.
Когда разных мутаций в Bithorax-комплексе обнаружили несколько десятков, удалось вывести соответствие между их положением в геноме и частью тела мухи, в которой возникает нарушение. В комплексе всего три гена. Но именно они определяют строение девяти сегментов тела. Более удивительно, что многие участки Bithorax-комплекса, влияющие на целый сегмент, вообще лишены генов. Число таких участков влияния соответствует числу сегментов тела, подчинённых Bithorax-комплексу.
С развитием методов молекулярной биологии в 80-е годы XX века выяснилось, что в разных сегментах тела три гена Bithorax-комплекса работают по-разному. Стало очевидно, что работа генов эукариот (организмов, чьи клетки содержат ядра) может регулироваться отдалёнными участками ДНК, в которых генов нет. В этих участках могут находиться последовательности-энхансеры*, усиливающие работу гена, либо последовательности-сайленсеры**, способные работу гена прекратить. Причём энхансеры и сайленсеры сами могут быть отрегулированы: в каких-то тканях быть выключенными, а в каких-то других работать. Каждый цветной блок на рисунке вверху — это кластер регуляторных последовательностей, ключевых для правильного развития соответствующего сегмента тела. Именно под их управлением работа трёх генов Bithorax-комплекса различна в каждом сегменте. В свою очередь за счёт уникального сочетания продуктов гомеозисных генов в каждом сегменте они развиваются по-разному. Как так получается, что в каждом сегменте тела работает только свой уникальный регуляторный участок ДНК для гомеозисных генов? Сейчас этот вопрос активно изучается, но чёткого ответа на него пока нет.
Продукты гомеозисных генов — белки, которые связываются с ДНК и влияют на работу других генов. В результате «под ними» работают десятки генов, уникальная настройка которых позволяет выпустить крылья или отрастить ноги. Итак, понятно, как за счёт разной работы гомеозисных генов в теле появляется с десяток сегментов (в каждом из которых эти гены работают по-своему), но непонятно, за счёт чего возникают различия внутри сегмента. Почему, например, такие разные части тела, как крылья и ноги, находятся в одном сегменте? Ответ кроется в структуре регуляторных участков Bithorax-комплекса. Они включают энхансеры и сайленсеры для гомеозисных генов. В каждом сегменте тела главную роль играет один из регуляторных участков, но в разных тканях этого сегмента он ведёт себя по-разному, поскольку в разных тканях активны разные энхансеры и сайленсеры. Так один регуляторный участок может обеспечить тонкие различия в работе гомеозисных генов в каждом типе тканей одного сегмента. Откуда регуляторная ДНК «знает», в какой ткани ей работать, а в какой молчать? Скажем лишь, что она знает это намного лучше нас… У нас же на этот счёт есть лишь ряд гипотез.
Планы изменились
Сотни миллионов лет эволюция «лепила» животных, меняя их тела. Комплексы гомеозисных генов — ключевая деталь в конструкторе тела. Чтобы поверить, что этот конструктор способен на самые разные фокусы, можно взглянуть на муху и, скажем, кита.
Вам уже надоел детский Лего? Конечно, до создания новых тел ещё далеко и последствия таких действий неочевидны, но мы постепенно начинаем разбираться в правилах сборки. Можно идти путём эволюции. Например, чтобы понять, что требуется для образования конечностей, можно попробовать сравнить работу гомеозисных генов у рыб и мышей. Как считается, наши руки и ноги в ходе эволюции возникли из плавников. Было замечено, что активность одного из гомеозисных генов у мышей выше, чем у рыб. Исследователи предприняли попытку усилить его работу у рыб в надежде, что их плавники станут похожими если и не на мышиные лапы, то хотя бы на их примитивный аналог. В новых условиях костная ткань в плавниках развивалась активнее, форма плавников стала округлой и более близкой к форме лап. Конечно, это лишь намёк на настоящие ноги. Скорее всего, на пути к выходу на сушу у рыб менялась не только работа самих гомеозисных генов, но и ответ на неё других генов.
За последние сто лет, прошедшие со времени открытия первых мутантных мух с ногами на голове и лишними крыльями, мы поняли, почему подобные изменения возникают. Мы даже можем планомерно влиять на строение тела мухи, мыши или рыбы, меняя их геном. При этом до полного понимания того, как строение тела записано в геноме, ещё далеко. Но по крайней мере теперь мы можем многое сказать на тему, почему муха так непохожа на слона.
Комментарии к статье
* Энхансеры (от англ. enhance — усиливать) — последовательности ДНК, связывающие белки-активаторы и способные усиливать работу генов.
** Сайленсеры (от англ. silence — подавлять) — последовательности ДНК, связывающие белки, негативно влияющие на работу окружающих генов.
Комнатная муха. Особенности биологии вида
Характеристика комнатной мухи
Комнатная муха (лат. Musca domestica) — вид короткоусых двукрылых из семейства настоящие мухи .
Муха комнатная — распространённый синантропный организм. Ведёт преимущественно дневной образ жизни[2].
Систематическое положение
- Тип: Членистоногие
- Класс: Насекомые
- Отряд: Двукрылые
- Семейство: Настоящие мухи
- Род: Musca
- Род: Комнатная муха
- Международное научное название Musca domestica Linnaeus
Длина тела взрослого насекомого составляет 6—8 мм. Окраска серая, на верхней стороне груди — четыре чёрные продольные полосы, нижняя часть брюшка желтоватая. Всё тело покрыто редкими длинными волосками.
Глаза — большие, фасеточные, тёмно-красного цвета. У самок расстояние между глазами увеличено. Так, у самцов расстояние между глазами равно 2/3 длины глаза, а у самок равно этой длине. Самки также более крупных размеров, чем самцы.
Как и у всех двукрылых, для полёта используется лишь передняя пара крыльев. Задние же — редуцированы в размерах и носят название жужжальца. Они необходимы для поддержания равновесия в воздухе[3]
Питание
Ротовой аппарат лижуще-сосущий, прокусить кожу и пить кровь комнатные мухи не способны, в отличие от похожих на них осенних жигалок. Мухи могут поглощать лишь жидкую пищу, для потребления твёрдой они предварительно растворяют её в слюне. Комнатная муха — полифаг. Для созревания яиц самке необходима белковая пища.
Продолжительность жизни
Как у всех насекомых, продолжительность жизни мух сильно зависит от температуры окружающей среды и их полный жизненный цикл может длиться от 8 до 20 дней. Обычная комнатная температура 23—25 °С является для них оптимальной.
Распространение
Родиной комнатной мухи являются степи Центральной Азии, однако к настоящему времени она вслед за человеком распространилась повсеместно: на всех континентах и во всех природных зонах, как в сельской местности, так и в городах.
Размножение и цикл развития
Самка за раз откладывает 70—120 белых, около 1,2 мм в длину яиц. В течение жизни самка совершает 6 и более яйцекладок. В каждой кладке — около 100 яиц. Всего за свою жизнь муха может отложить от 600 до 2000 яиц в зависимости от климатических условий. При благоприятных условиях Musca domestica размножается круглый год.
Развитие яйца занимает от 8 до 50 часов. Мухи являются насекомыми с полным превращением. Личинки комнатных мух имеют длину до 13 мм, белого цвета, безногие, со стороны ротового отверстия заострённые, сзади усечённой формы. Живут в испражнениях, других гниющих полужидких средах.
Через 3—25 дней и после трёх линек, личинка отползает в сухое прохладное место и превращается в куколку, образуя пупарий (отставшая и затвердевшая оболочка личинки). Фаза куколки длится от 3 дней. Взрослые насекомые живут обычно от двух недель до месяца, но могут доживать и до двух месяцев. Через 36 часов (то есть 1,5 суток) после выхода из куколки они уже способны к размножению.
За год сменяется от 9 до 20 поколений комнатных мух. Зимуют как личинки и куколки, так и взрослые оплодотворённые самки. В холодных помещениях мухи переживают зиму в неактивном состоянии и пробуждаются при температуре наружного воздуха выше 10 градусов[4].
Биология цеце, систематика и распространение, методы
Биология цеце, систематика и распространение, методыСлово анатомия означает строение тела мухи цеце.
Как и все другие насекомые, муха цеце имеет жесткое внешнее покрытие или кутикулу . Все тело покрыто кутикулой, даже глаза. Части мачты твердые, но некоторые области остаются гибкими, особенно основание крыла, суставы предметов и места соединения ротовой части с головой; поэтому эти части можно легко перемещать.Кутикула на нижней (вентральной) стороне брюшка мухи цеце эластична, так что она может растягиваться, когда брюшко поглощает обильную кровяную муку (см. 2.1.6).
Движения ног контролируются мышцами, прикрепленными к внутренней стороне кутикулы ног; быстрое движение крыльев во время полета контролируется очень большими мышцами грудной клетки.
Мухи цеце почти всегда имеют оттенок коричневого или серо-коричневого; иногда появляется легкий розовый или песочно-красный оттенок.Некоторые виды очень темные. На теле обычно есть более темные и светлые пятна, из-за чего насекомое трудно увидеть, когда оно расположено на коре, камне или почве. В состоянии покоя цеце обычно выглядит довольно тонким, потому что крылья расположены друг над другом на спине (рис. 1.3), а не выступают наружу под углом к телу, как у домашних или большинства мясных мух. Сразу после кровопролития живот мухи цеце большой, округлый и красный.
Тело состоит из трех основных частей: головы , , грудной клетки , (к которой прикреплены крылья и ноги) и брюшка . Теперь эти части будут описаны более подробно.
Рис. 1.1 Схема Glossina , вид сверху, с распростертыми крыльями.
Рис. 1.2 Схема Glossina , вид сбоку, со сложенными крыльями.
Рис. 1.3 Glossina , вид сверху, со сложенными крыльями.
1.3.1 Сложные глаза На голове пара больших сложных глаз.Каждый из этих глаз состоит из тысяч маленьких единиц, называемых омматидий (единственное число: омматидий) . Часть омматидия, образующая поверхность глаза, — это хрусталик. Линзы у средней линии головы немного больше, чем у боковых сторон головы. Считается, что сложные глаза некоторых видов способны обнаруживать движущиеся объекты на расстоянии 137 метров (150 ярдов). Они очень хороши для более близкого обзора и небольшого движения вблизи. насекомое может заставить его улететь.Сложные глаза у живой мухи темно-карие.
1.3.2 Простые глаза На макушке три простых глаза или глазков (единственное число: глазков) ; они также чувствительны к свету, но их точная функция неизвестна.
1.3.3 Антенны (Рисунок 1.5) Две антенны размещены на передней части головы в углублении между двумя сложными глазами. Каждая антенна состоит из трех сегментов, третий из которых является самым большим и несет на себе arista.
Ариста представляет собой длинную тонкую структуру, похожую на ресницу, но с рядом разветвленных волосков на верхней стороне.
На третьем сегменте усиков также есть два маленьких отверстия, ведущих к обонятельным ямкам , которые содержат много сенсилл (сенсорных волосков), которые могут сужать воздух. Таким образом, антенна — это орган, обслуживающий обоняние.
1.3.4 Птилинальный шов (Рисунок 1.4) Это тонкая линия, которая частично окружает часть лица, несущую усики.Он отмечает место, где ptilinum (структура, похожая на воздушный шар) появляется, когда муха начинает выходить из куколки (см. 3.6.1). После появления птилинум загибается внутрь головы, и снаружи виден только птилинальный шов.
Рис. 1.4 Схема головки Glossina , вид спереди. Большая часть одного ариста была опущена, чтобы более четко показать птилинальный шов.
Фиг.1.5 Антенна Glossina ; 1, 2, 3: первый, второй и третий сегменты антенны.
1.3.5 Ротовые аппараты Ротовые аппараты (Рисунки 1.6, 1.7, 1.8) очень важны для жизни мух. Они длинные и узкие и могут проткнуть кожу животного, так что кровь может всосаться в муху; в то же время слюна может проходить через ротовой аппарат к животному, которого кормят.
Когда муха не ест, все ротовые части держатся так, что они смотрят вперед из-под головы.
Пара верхнечелюстных щупиков помогает защитить более тонкий хоботок или haustellum, который находится между ними, когда он не используется.
Хоботок очень узкий (Рисунок 1.6) • Он состоит из трех частей: нижней губы , верхней губы и гипофаринкс (рисунки 1.7, 1.8).
1.3.5.1 Губная губа Губная губа — самая толстая из этих очень тонких структур. На свободном конце у него большое количество очень мелких зубцов ( лабеллярных зубов) .Зубы могут прорезать кожу животного, так что муха может сосать кровь. Другой конец губы, где он прикрепляется к голове мухи, опухает. Эта часть (текальная луковица ) содержит мышцы, которые заставляют зубы двигаться.
1.3.5.2 Верхняя губа Верхняя губа образует трубку, по которой всасывается кровь от укушенного животного. Трубка называется пищевым каналом .
1.3.5.3 Гипофаринкс Гипофаринкс представляет собой чрезвычайно узкую трубку, по которой слюна перекачивается в животное-хозяина во время кормления мухи.
Грудь взрослой мухи покрыта жесткой кутикулой. Три пары ног прикреплены к нижней части грудной клетки, а два крыла прикреплены к верхней части боковых стенок грудной клетки.
Рис. 1.6 Головка Glossina , вид сбоку;
A, с ротовым аппаратом в положении покоя;
B, с опущенным haustellum.
Рис. 1.7 Голова Glossina , вид сбоку, с искусственно раздвинутыми ротовыми частями.
Рис. 1.8 Поперечный разрез хаустеллума Glossina .
Рис. 1.9 Ножка Glossina .
Рис. 1.10 Жилкование крыла Glossina ; 1, 2, 3, 4: жилки первого, второго, третьего и четвертого крыла.
Сразу за крыльями и близко к месту, где грудная клетка соединяется с брюшком, находится пара жужжальцев.
1.4.1 Ножки (рисунок 1.9) Каждая из ног состоит из следующих сегментов: тазика , вертела , бедренной кости , голени и пяти тарзальных сегментов . Последний членик предплюсны имеет две коготки и две pulvilli (подушечки). Тазик прикреплен к грудной клетке и не может двигаться.
1.4.2 Крылья (Рисунок 1.10) В состоянии покоя два крыла лежат одно на другом над задней частью живота (Рисунок 1.3). Каждое крыло имеет прочную переднюю (переднюю) кромку, поддерживаемую разумными жилками крыла ; задний (задний) край более слабый, поэтому мембрана крыла может быть легко разорвана и неровной, особенно у старых мух (см. 8.5.1).
Жилки крыльев образуют особый узор, характерный для мух цеце:
Жила 1 очень длинная.
Жилки 2 и 3 расположены очень близко друг к другу по всей своей длине.
Жилка 4 имеет сильно изогнутую базальную часть, прежде чем она встречается с передней поперечной жилкой. Это приводит к тому, что клетка (область крыла, окруженная жилками) сразу после жилки 4 принимает своеобразную форму; она известна как ячейка «топорик».
1.4.3 Жужжальца Это два булавовидных органа сразу за основанием крыльев. Они вибрируют, когда насекомое находится в полете, и помогают ему управлять. Они являются органом чувства равновесия.
1.4.4 Грудные дыхальца По бокам грудной клетки расположены две пары дыхалец (или дыхательных отверстий); одна пара находится чуть выше точки прикрепления передних ног, другая пара — у основания жужжальцев.
У отдыхающей мухи брюшко прикрыто крыльями.Он имеет семь видимых сегментов или частей, а у самца, кроме того, имеется дополнительная структура (гипопигий), складывающаяся под двумя последними сегментами (см. 1.5.1). На дорсальной (верхней) стороне брюшка имеются прочные пластинки (каждая пластинка называется тергитом ), по одной на каждый сегмент; но брюшная сторона сделана из высокоэластичной кутикулы, которая может растягиваться, позволяя животу переносить огромную кровяную муку, а в случае самки — большую личинку. Остатки кровяной муки часто можно увидеть в брюшной полости, если осмотреть ее с вентральной поверхности (см. 7.6.1).
По бокам живота семь пар дыхалец (дыхательных отверстий). Анус находится на заднем конце живота.
1.5.1 Мужские гениталии (Рисунки 1.11, 1.12) Слово гениталии означает части, используемые для спаривания. Если посмотреть на самцов мухи цеце с брюшной стороны, на заднем конце брюшка можно увидеть округлую структуру. Это гипопигий . Прямо перед гипопигием находится пластина с темными волосками, называемая гектор .
Обе эти структуры позволяют легко определить, какие мухи являются самцами (см. 8.2). Гипопигий и гекторы помогают самцу держаться за конец брюшка самки во время спаривания. В начале спаривания гипопигий самца раскрывается, открывая верхних кламмеров , нижних кламмеров и половых членов (или эдеагусов ).
1.5.2 Женские гениталии (Рисунок 1.11) На конце женского живота нет крупных явных структур, соответствующих мужскому гипопигию и гекторам.Но есть небольшое отверстие (вульва), через которое личинка выходит. Это отверстие может быть окружено несколькими небольшими пластинами; количество и расположение этих табличек в некоторых случаях может помочь специалисту определить вид.
Рис. 1.11 Разница между задним концом брюшка самца и самки Glossina , вид снизу.
Рис. 1.12 Вид сбоку мужского живота Glossina , чтобы показать структуры, не прикрытые, когда гипопигий открывается.
Освещена структура мозга мух: Nature News
Разноцветные методы визуализации выделяют нейронные сети у плодовых мух.
Два метода визуализации нейронов плодовых мух: dBrainbow (слева) и Flybow (справа).Мозги Fly еще никогда не выглядели так хорошо. Впечатляющие изображения сложных нейронных схем насекомых теперь были получены с использованием пары методов, которые позволяют визуализировать отдельные клоны нервных клеток с использованием диапазона цветов.
Оба метода являются адаптацией техники «Brainbow», разработанной в Гарвардском университете в Кембридже, штат Массачусетс, для визуализации нейронов мыши и опубликованной в журнале Nature в 2007 г. 1 .
«Нас вдохновила элегантность подхода Brainbow», — говорит Ирис Салекер, нейробиолог из Национального института медицинских исследований в Лондоне, которая работала над одним из методов плодовой мушки.
Новые методы, описанные в двух статьях, опубликованных сегодня в журнале Nature Methods 2 3 , включают внедрение цепочек генов в нейроны эмбрионов Drosophila melanogaster.Каждый ген производит разный флуоресцентный цвет, освещая отдельные нейроны или даже все клетки, произошедшие от эмбрионального нейрона — потому что они будут нести один и тот же ген и, следовательно, будут одного цвета. Оба метода приводят к красочным визуализациям, которые позволяют различать все нервные клетки в любой одной линии и отслеживать их развитие, показывая, как нейронные цепи развиваются и взаимодействуют.
Строка включает набор генов, продуцирующих окраску, но в каждой модифицированной нервной клетке активен только один ген — ближайший к области ДНК, называемой промотором.Поскольку строки идентичны, все модифицированные нейроны будут одного цвета, и их невозможно будет разделить визуально.
Но исследователи изменили генные цепочки с помощью ферментов, так что другой ген, производящий окраску, располагался рядом с промотором в разных клетках, и тогда можно было идентифицировать отдельные нейроны.
Два маршрута, один пункт назначения
Основное различие между двумя исследованиями заключается в методах, используемых для изменения цепочек генов.
Первый метод, получивший название dBrainbow, был разработан Джули Симпсон, нейробиологом из исследовательского кампуса Janelia Farm Медицинского института Говарда Хьюза в Эшберне, штат Вирджиния, и ее коллегами 2 .В этом методе используются ферменты, называемые рекомбиназами, для случайного удаления некоторых генов, продуцирующих окраску, из строки, оставляя разные гены рядом с промоторными областями в разных клетках. Таким образом, отдельные ячейки имеют уникальный цвет и легко различимы.
Хотя в методе Симпсона используется цепочка всего из трех генов, определяющих цвет — красного, зеленого и синего, — команда вставила две цепочки в нейроны мух, что позволило получить шесть разных оттенков.
«Это как телевизор, отображающий разные цвета путем смешивания красного, зеленого и синего», — объясняет Симпсон.«Каждый из шести цветов получается путем смешивания двух цветов».
ОБЪЯВЛЕНИЕ
Второй метод, получивший название Flybow, был разработан Салекер и ее коллегами 3 . Они использовали фермент, который «переворачивает» пары генов, продуцирующих цвет, на нити, оставляя разные гены рядом с промоторной областью. «Переворачивающий» фермент также является рекомбиназой, поэтому после инвертирования некоторые из генов, продуцирующих окраску, случайным образом удаляются. Это гарантирует, что все различные гены в строке потенциально могут оказаться рядом с промотором и отображаться отдельными модифицированными нейронами.. Flybow использует одну цепочку четырех цветов — красного, зеленого, синего и желтого.
Сотрудничество
Симпсон и Салекер поняли, что они работают для достижения схожих целей, когда они представили тезисы о своей работе на той же конференции. «Мы решили совместно представить работу», — говорит Симпсон. «Люди должны быть более коллегиальными в таких вещах — это принесло пользу нам обоим».
Салекер говорит, что эти методы могут быть полезны при исследовании того, как отдельные гены влияют на развитие нейронов, потому что генетика плодовых мух очень хорошо охарактеризована.«Вы можете нокаутировать или чрезмерно экспрессировать гены и наблюдать за последствиями для нервной системы», — говорит она.
«Приятно видеть, что эти методы используются не на мышах, а на животных, — говорит Джефф Лихтман, нейробиолог из Гарварда, который помогал в разработке Brainbow. Но он добавляет, что мы, возможно, никогда не узнаем, как работает нервная система. «Эти инструменты позволяют нам увидеть, насколько они сложны, — говорит он, — и чем больше мы узнаем, тем труднее их понять».
Список литературы
- Ливет, Дж. et al. Nature 450, 56-62 (2007).
- Hampel, S. et al. Nature Meth. DOI: 10.1038 / nmeth.1566 (2011).
- Hadjieconomou, D. et al. Nature Meth. DOI: 10.1038 / nmeth.1567 (2011).
Оценка структуры сообщества бактерий на разных этапах жизни китайской цитрусовой мухи, Bactrocera minax (Diptera: Tephritidae) | BMC Microbiology
Диллон Р., Диллон В. Кишечные бактерии насекомых: непатогенные взаимодействия. Анну Рев Энтомол. 2004. 49 (1): 71–92.
PubMed PubMed Central Статья CAS Google Scholar
Дуглас А.Е. Мультиорганизменные насекомые: разнообразие и функции резидентных микроорганизмов. Анну Рев Энтомол. 2015; 60: 17–34.
Артикул CAS Google Scholar
Энгель П., Моран Н.А. Микробиота кишечника насекомых — разнообразие по строению и функциям. FEMS Microbiol Rev.2013; 37 (5): 699–735.
PubMed PubMed Central Статья CAS Google Scholar
Пауэлл Дж. Э., Мартинсон В. Г., Урбан-Мид К., Моран Н. А.. Пути получения микробиоты кишечника медоносной пчелы Apis mellifera . Appl Environ Microbiol. 2014. 80 (23): 7378–87.
PubMed PubMed Central Статья CAS Google Scholar
Andongma AA, Wan L, Dong Y-C, Desneux N, White JA, Niu C-Y. Пиросеквенирование выявляет сдвиг в популяциях симбиотических бактерий на разных стадиях жизни у Bactrocera dorsalis . Научный доклад 2015; 5.
Ван А., Яо З., Чжэн В., Чжан Х. Бактериальные сообщества в кишечнике и репродуктивных органах Bactrocera minax (Diptera: Tephritidae) на основе 454 пиросеквенирования. 2014: 9 (9): e106988.
Морроу Дж., Фроммер М., Ширман Д., Риглер М.Микробиом выловленных в полевых условиях и адаптированных в лабораторных условиях видов австралийских плодовых мух-тефритидов с различным использованием и специализацией растений-хозяев. Microb Ecol. 2015: 1–11.
Бехар А., Ювал Б., Юркевич Э. Структура сообщества микробиоты средиземноморской плодовой мухи: сезонные и пространственные источники вариаций. Isr J Ecol Evol. 2008. 54 (2): 181–91.
Артикул Google Scholar
Capuzzo C, Firrao G, Mazzon L, Squartini A.Джиролами V: « Candidatus Erwinia dacicola », совместно эволюционировавшая симбиотическая бактерия оливковой мухи Bactrocera oleae (Гмелин). Int J Syst Evol Microbiol. 2005; 55 (4): 1641–7.
PubMed PubMed Central Статья CAS Google Scholar
Аарон Ю., Пастернак З., Бен Йосеф М., Бехар А., Лаузон С., Юваль Б., Юркевич Э. Филогенетическое, метаболическое и таксономическое разнообразие формируют микробиоты средиземноморских плодовых мух в онтогенезе.Appl Environ Microbiol. 2013. 79 (1): 303–13.
PubMed Статья CAS PubMed Central Google Scholar
Petri L. Untersuchung uber die darmbakterien der Olivenfliege. Zentbl Bakteriol. 1910; 26: 357–67.
Google Scholar
Hagen KS. Зависимость оливковой мухи, Dacus oleae, личинок от симбиоза с Pseudomonas savastanoi для использования оливок.Nat. 1966. 209 (5021): 423–4.
Артикул Google Scholar
Hilgenboecker K, Hammerstein P, Schlattmann P, Telschow A, Werren JH. Сколько видов заражено Wolbachia? — статистический анализ текущих данных. FEMS Microbiol Lett. 2008. 281 (2): 215–20.
PubMed PubMed Central Статья CAS Google Scholar
Веррен Дж. Х., Бальдо Л., Кларк МЭ.Вольбахия: мастера-манипуляторы биологии беспозвоночных. Nat Rev Microbiol. 2008. 6 (10): 741–51.
PubMed PubMed Central Статья CAS Google Scholar
Никох Н., Хосокава Т., Морияма М., Осима К., Хаттори М., Фукацу Т. Эволюционное происхождение насекомых — мутуализм питания Wolbachia. Proc Natl Acad Sci. 2014. 111 (28): 10257–62.
PubMed Статья CAS PubMed Central Google Scholar
Бен-Йосеф М., Аарон Й, Юркевич Э., Юваль Б. Дайте нам инструменты, и мы сделаем работу: симбиотические бактерии влияют на приспособленность оливковой мухи в зависимости от диеты. Proc R Soc Lond B Biol Sci. 2010: 1545–52.
PubMed Статья CAS PubMed Central Google Scholar
Бен-Йосеф М., Бехар А., Юркевич Э., Юваль Б. Взаимодействие бактерий и диеты влияет на продолжительность жизни средиземноморской мухи Ceratitis capitata . J Appl Entomol.2008. 132 (9–10): 690–4.
Артикул Google Scholar
Бехар А., Ювал Б., Юркевич Э. Сообщества кишечных бактерий средиземноморской плодовой мухи ( Ceratitis capitata ) и их влияние на продолжительность жизни хозяина. J. Insect Physiol. 2008. 54 (9): 1377–83.
Артикул CAS Google Scholar
Бехар А., Юваль Б., Юркевич Э. Энтеробактерия-опосредованная азотфиксация в естественных популяциях плодовой мухи Ceratitis capitata .Mol Ecol. 2005. 14 (9): 2637–43.
Артикул CAS Google Scholar
Ами Э.Б., Юваль Б., Юркевич Э. Манипуляции с микробиотой массово выращиваемых средиземноморских плодовых мух Ceratitis capitata (Diptera: Tephritidae) улучшает сексуальную активность бесплодных самцов. Int Soc Microb Ecol J. 2010; 4 (1): 28.
Google Scholar
Гавриэль С., Юркевич Э., Газит Ю., Юваль Б.Обогащенная бактериями диета улучшает половую активность стерильных самцов средиземноморских плодовых мух. J Appl Entomol. 2011; 135 (7): 564–73.
Артикул Google Scholar
Cheng D, Guo Z, Riegler M, Xi Z, Liang G, Xu Y. Кишечный симбионт повышает устойчивость к инсектицидам у значительного вредителя, восточной плодовой мухи Bactrocera dorsalis (Hendel). Микробиом. 2017; 5 (1): 13.
PubMed PubMed Central Статья Google Scholar
Wang H, Jin L, Peng T, Zhang H, Chen Q, Hua Y. Идентификация культивируемых бактерий в кишечном тракте Bactrocera dorsalis из трех разных популяций и определение их привлекательного потенциала. Pest Manag Sci. 2014; 70 (1): 80–7.
PubMed Статья CAS PubMed Central Google Scholar
Allwood AJ, Chinajariyawong A, Drew R, Hamacek E, Hancock D, Hengsawad C, Jipanin J, Jirasurat M, Krong CK, Kritsaneepaiboon S.Записи о растениях-хозяевах плодовых мух (Diptera: Tephritidae) в Юго-Восточной Азии: Департамент биологических наук Национального университета Сингапура; 1999. (август 2016).
Доржи К., Кларк А.Р., Дрю РАИ, Флетчер Б.С., Лодей П., Махат К., Рагху С., Ромиг М.С. Сезонная фенология Bactrocera minax (Diptera: Tephritidae) в западном Бутане. Bull Entomol Res. 2006. 96 (05): 531–8.
PubMed CAS PubMed Central Google Scholar
Zhou X-W, Niu C-Y, Han P, Desneux N. Полевая оценка привлекательных приманок для плодовой мухи Bactrocera minax (Diptera: Tephritidae) и их потенциальное использование для точечного распыления в провинции Хубэй (Китай). J Econ Entomol. 2012; 105 (4): 1277–84.
PubMed Статья PubMed Central Google Scholar
Донг Ю.С., Ван Зи-Дж., Кларк А.Р., Перейра Р., Десне Н., Ниу С.-И. Развитие и прекращение куколочной диапаузы у Bactrocera minax обусловлено низкотемпературным охлаждением.J Pest Sci. 2013. 86 (3): 429–36.
Артикул Google Scholar
Ван X, Луо Л. Прогресс в исследованиях китайской цитрусовой мухи. Entomol Knowl. 1995; 32: 310–5.
Google Scholar
Донг Й., Деснё Н., Лей С., Ниу С. Анализ характеристик транскриптома Bactrocera minax и новое понимание развития его куколочной диапаузы с анализом экспрессии генов.Int J Biol Sci. 2014; 10 (9): 1051.
PubMed PubMed Central Статья CAS Google Scholar
Чен Э-Х, Доу В., Ху Ф, Тан С., Чжао З-М, Ван Дж-Дж. Очистка и биохимическая характеристика s-трансфераз глутатиона в Bactrocera minax (Diptera: tephritidae). Fla Entomol. 2012; 95 (3): 593–601.
Артикул CAS Google Scholar
Drew RA, Dorji C, Romig MC, Loday P. Привлекательность различных комбинаций цветов и форм для самок и самцов Bactrocera minax (Diptera: Tephritidae) в коммерческой мандариновой роще в Бутане. J Econ Entomol. 2006. 99 (5): 1651–6.
PubMed Статья PubMed Central Google Scholar
Schloss PD, Westcott SL, Ryabin T, Hall JR, Hartmann M, Hollister EB, Lesniewski RA, Oakley BB, Parks DH, Robinson CJ.Представляем mothur: программное обеспечение с открытым исходным кодом, независимое от платформы, поддерживаемое сообществом, для описания и сравнения сообществ микробов. Appl Environ Microbiol. 2009. 75 (23): 7537–41.
PubMed PubMed Central Статья CAS Google Scholar
Pruesse E, Quast C, Knittel K, Fuchs BM, Ludwig W, Peplies J, Glöckner FO. SILVA: всеобъемлющий онлайн-ресурс для проверенных и согласованных данных о последовательностях рибосомных РНК, совместимых с ARB.Nucleic Acids Res. 2007. 35 (21): 7188–96.
PubMed PubMed Central Статья CAS Google Scholar
Ван К., Гаррити ГМ, Тидже Дж. М., Коул Дж. Р.. Наивный байесовский классификатор для быстрого отнесения последовательностей рРНК к новой бактериальной таксономии. Appl Environ Microbiol. 2007. 73 (16): 5261–7.
PubMed PubMed Central Статья CAS Google Scholar
Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Peña AG, Goodrich JK, Gordon JI. QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Нат методы. 2010. 7 (5): 335–6.
PubMed PubMed Central Статья CAS Google Scholar
Team, R. Core: R: язык и среда для статистических вычислений. R Фонд статистических вычислений, Вена, Австрия.На сайте: http: //www.R-project. орг (2013): 201. Проверено 8 августа th 2016.
Hajia M. Ограничения различных протоколов ПЦР, используемых в диагностических лабораториях: краткий обзор. Mod Med Lab J. 2017; 1 (2): 1–6.
Артикул Google Scholar
Ван А., Яо З., Чжэн В., Чжан Х. Бактериальные сообщества в кишечнике и репродуктивных органах Bactrocera minax (Diptera: Tephritidae) на основе 454 пиросеквенирования.PLoS One. 2014; 9 (9): e106988.
PubMed PubMed Central Статья CAS Google Scholar
Ван Х., Цзинь Л., Чжан Х. Сравнение разнообразия бактериальных сообществ в кишечном тракте взрослых особей Bactrocera dorsalis из трех разных популяций. J Appl Microbiol. 2011. 110 (6): 1390–401.
PubMed PubMed Central Статья CAS Google Scholar
Кузина Л.В., Пелокин Ю.Дж., Вацек Д.С., Миллер Т.А. Выделение и идентификация бактерий, связанных со взрослыми лабораторными мексиканскими дрозофилами, Anastrepha ludens (Diptera: Tephritidae). Curr Microbiol. 2001. 42 (4): 290–4.
PubMed CAS PubMed Central Google Scholar
Zhang M, Powell CA, Benyon LS, Zhou H, Duan Y. Расшифровка бактериального микробиома цитрусовых в ответ на инфекцию « Candidatus Liberibacter asiaticus » и лечение антибиотиками.PLoS One. 2013; 8 (11).
PubMed PubMed Central Статья CAS Google Scholar
Триведи П., Спанн Т., Ван Н. Выделение и характеристика полезных бактерий, связанных с корнями цитрусовых во Флориде. Microb Ecol. 2011. 62 (2): 324–36.
PubMed Статья CAS PubMed Central Google Scholar
Чандлер Дж. А., Ланг Дж. М., Бхатнагар С., Эйзен Дж. А., Копп А.Бактериальные сообщества различных видов дрозофилы: экологический контекст модельной системы хозяин – микроб. PLoS Genet. 2011; 7 (9): e1002272.
PubMed PubMed Central Статья CAS Google Scholar
Лаузон С., Маккомбс С., Поттер С., Пибоди Н. Зарождение и вертикальный проход Enterobacter ( Pantoea ) aglomerans и Klebsiella pneumoniae плодов мухи Diptera на всех стадиях жизни Средиземноморья. : Tephritidae).Ann Entomol Soc Am. 2009. 102 (1): 85–95.
Артикул Google Scholar
Бехар А., Юркевич Э., Юваль Б. Возвращение плодов во взаимодействие плодовых мух с бактериями. Mol Ecol. 2008. 17 (5): 1375–86.
Артикул CAS Google Scholar
Ley RE, Hamady M, Lozupone C, Turnbaugh PJ, Ramey RR, Bircher JS, Schlegel ML, Tucker TA, Schrenzel MD, Knight R.Эволюция млекопитающих и их кишечных микробов. Sci. 2008. 320 (5883): 1647–51.
Артикул CAS Google Scholar
Ochman H, Worobey M, Kuo C-H, Ndjango J-BN, Peeters M, Hahn BH, Hugenholtz P. Эволюционные взаимоотношения диких гоминидов, воспроизводимые сообществами кишечных микробов. PLoS Biol. 2010; 8 (11): e1000546.
PubMed PubMed Central Статья CAS Google Scholar
Бродерик Н.А., Раффа К.Ф., Гудман Р.М., Хандельсман Дж. Перепись бактериального сообщества средней кишки личинок непарного шелкопряда с использованием культивирования и методов, не зависящих от культуры. Appl Environ Microbiol. 2004. 70 (1): 293–300.
PubMed PubMed Central Статья CAS Google Scholar
Хуэй Х, Вэй Г-Ф, Цзя С., Хуан Дж, Мяо Х-Х, Чжоу З., Чжао Л-П, Хуан И-П. Микробные сообщества средней кишки личинок лабораторных и полевых популяций хлопковой совки ( Helicoverpa armigera ).Может J Microbiol. 2006. 52 (11): 1085–92.
Артикул Google Scholar
Yao Z, Wang A, Li Y, Cai Z, Lemaitre B, Zhang H. Двойной ген оксидазы BdDuox регулирует гомеостаз кишечного бактериального сообщества Bactrocera dorsalis . ISME J. 2016; 10 (5): 1037–50.
PubMed PubMed Central Статья CAS Google Scholar
Бен-Йосеф М, Пастернак З., Юркевич Э., Юваль Б.Симбиотические бактерии позволяют личинкам оливковой мухи преодолевать защиту хозяина. R Soc Open Sci. 2015; 2 (7): 150170.
PubMed PubMed Central Статья CAS Google Scholar
Thaochan N, Drew RAI, Hughes JM, Vijaysegaran S., Chinajariyawong A. Бактерии пищеварительного тракта, выделенные и идентифицированные с помощью API-20E и методов молекулярного клонирования у тропических плодовых мух Австралии, Bactrocera cacuminat a и B.Триони . J Insect Sci. 2010; 10.
Артикул Google Scholar
Robacker DC, Bartelt RJ. Химические вещества, привлекательные для мексиканской плодовой мухи, из культур Klebsiella pneumoniae и Citrobacter freundii , взятых с помощью твердофазной микроэкстракции. J Chem Ecol. 1997. 23 (12): 2897–915.
Артикул CAS Google Scholar
Ли CJ, Demilo AB, Moreno DS, Martinez AJ.Анализ летучих компонентов бактериальной ферментации, привлекательной для мексиканской плодовой мухи, Anastrepha ludens . J. Agric Food Chem. 1995. 43 (5): 1348–51.
Артикул CAS Google Scholar
Бен-Йосеф М., Юркевич Э., Юваль Б. Влияние бактерий на пищевой статус и репродуктивный успех средиземноморской плодовой мухи Ceratitis capitata . Physiol Entomol. 2008. 33 (2): 145–54.
Артикул Google Scholar
Ллойд А., Дрю Р., Тикл Д., Хейворд А. Бактерии, связанные с некоторыми видами Dacus (Diptera: Tephritidae) и их плодами-хозяевами в Квинсленде. Aust J Biol Sci. 1986. 39 (4): 361–8.
Артикул Google Scholar
Liu L, Martinez-Sañudo I, Mazzon L, Prabhakar C, Girolami V, Deng Y, Dai Y, Li Z. Бактериальные сообщества, связанные с инвазивными популяциями Bactrocera dorsalis (Diptera: Tephritidae) в Китае .Bull Entomol Res. 2016; 1.
Armougom F, Henry M, Vialettes B, Raccah D, Raoult D. Мониторинг бактериального сообщества кишечной микробиоты человека показывает увеличение количества Lactobacillus у пациентов с ожирением и метаногенов у пациентов с анорексией. PLoS One. 2009; 4 (9): e7125.
PubMed PubMed Central Статья CAS Google Scholar
Taylor SM, He Y, Zhao B., Huang J. Гетеротрофные характеристики удаления аммония аэробной гетеротрофной нитрифицирующей-денитрифицирующей бактерии, Providencia rettger i YL.J Environ Sci. 2009. 21 (10): 1336–41.
Артикул CAS Google Scholar
Новая адгезионная структура, способная к многократному прикреплению и отсоединению
Электронная микрофотография стопы мухи. Адгезивные щетинки в форме лопатки (голубые структуры) позволяют мухе прикрепляться к предметам. Предоставлено: Педагогический университет Хоккайдо,
.Совместимая с переработкой, экологически чистая технология, основанная на механизме образования подушечек ног во время метаморфоза куколки мухи.
NIMS, HUE и HUSM преуспели в разработке метода простого и недорогого изготовления адгезивной структуры, способной к многократному прикреплению и отсоединению. Дизайн этой структуры был вдохновлен липкими лопаткообразными волосками (щетинками), обнаруженными на подушечках лап мух, в то время как на способ их создания намекает образование щетинок у куколок мух. Эти экологически безопасные технологии потенциально могут способствовать созданию более устойчивого общества.
Многие виды выпускаемой продукции армируются прочными клеями.Однако использование этих клеев затрудняет процессы переработки (то есть сортировку и разложение), противодействуя усилиям по продвижению экономики замкнутого цикла. По этой причине были разработаны и разработаны адгезивные технологии, способные к многократному прикреплению и отсоединению. Биомиметический подход к разработке высокоэффективных адгезивных технологий направлен на имитацию сложных адгезионных структур живых организмов. Однако этот подход часто является дорогостоящим, поскольку требует использования MEMS (микроэлектромеханических систем) для создания сложных структур.
Эта исследовательская группа сосредоточилась на биологических адгезивных структурах (например, подушечках лап насекомых), которые, как известно, образуются энергоэффективным образом при комнатной температуре. Группа разработала адгезивные структуры и эффективные методы их создания, имитируя биологические процессы.
В этом исследовательском проекте группа специально сосредоточилась на липких щетинках в форме лопаток, которые растут на подушечках лап мух, в качестве модели для разработки адгезивных структур, которые можно многократно прикреплять и отсоединять от предметов.Группа наблюдала биологический процесс образования щетинок у куколок плодовых мух (Drosophila melanogaster) путем окрашивания лапок мух для иммуногистохимического анализа и маркировки актина цитоскелета флуоресцентными красителями.
В результате группа обнаружила, что липкие лопатчатые щетинки подушечек стопы образуются в результате простого двухэтапного процесса: (1) клетки, образующие щетинки, удлиняются, а актиновые филаменты цитоскелета в клетках накапливаются на дистальных концах удлиненных клеток, образуя шпатель. -подобные каркасы; (2) отложения кутикулы образуются на поверхности щетинок, укрепляя их.Затем группе удалось разработать аналогичный простой двухэтапный процесс изготовления адгезивной лопатчатой структуры при комнатной температуре путем (1) растяжения нейлоновых волокон до образования лопатчатой структуры и (2) ее затвердевания. Было подтверждено, что адгезионная сила и легкость отсоединения структуры различаются в зависимости от направления, в котором она отрывается от объекта, к которому она прикреплена — аналогично механизмам, которые насекомые используют для прикрепления или отсоединения от объектов.
Одно лопатчатое волокно достаточно прочно, чтобы подвесить на нем кремниевую пластину весом 52.8 г. Исходя из этого, можно ожидать, что пучок из 756 волокон (площадь поперечного сечения 9 см2) выдержит человека весом 60 кг.
Эта адгезивная структура, способная к многократному прикреплению и отсоединению, может предложить множество новых роботизированных приложений. Например, он может быть интегрирован в руки промышленных роботов, чтобы они могли лучше справляться со скользкими объектами, и он может быть встроен в ноги уличных роботов, чтобы они могли взбираться по вертикальным стенам, как насекомые.Многоразовая адгезивная структура и недорогой, энергоэффективный метод производства являются экологически безопасными технологиями, которые потенциально могут способствовать повышению устойчивости общества.
###
Ссылка: «Каркас с актиновыми филаментами цитоскелета, образующими волоски на подушечках лап насекомых, вдохновляет на создание биомиметических адгезивных устройств» Кен-ичи Кимура, Рюноскэ Минами, Юми Ямахама, Такахико Харияма и Наое Хосода, 29 мая 2020 г., Communications Biology .
DOI: 10.1038 / с42003-020-0995-0
В этом исследовательском проекте Наое Хосода (руководитель группы, Исследовательский центр конструкционных материалов, NIMS) руководил разработкой механизмов адгезии, а группа, возглавляемая Кен-чи Кимура (профессор Педагогического университета Хоккайдо (HUE)), Рюноскэ Минами (Специально назначенный исследователь, HUE (в настоящее время член Национального центра гериатрии и геронтологии)), Такахико Харияма (профессор, Медицинский факультет Университета Хамамацу (HUSM)) и Юми Ямахама (преподаватель, HUSM) исследовали адгезивные структуры, образованные в куколки мух.
Данный проект поддержан грантами НИМС «Семена» на исследования в области развития и грантом на научные исследования в инновационных областях (номер проекта: 24120004). Это исследование было опубликовано 29 мая 2020 г. в журнале с открытым доступом Communications Biology .
Филогеография и популяционная структура мухи цеце Glossina pallidipes в Кении и экосистеме Серенгети
Образец цитирования: Батета Р., Саарман Н. П., Окейо В. А., Дион К., Джонсон Т., Миреджи ПО и др.(2020) Филогеография и структура популяции мухи цеце Glossina pallidipes в Кении и экосистеме Серенгети. PLoS Negl Trop Dis 14 (2): e0007855. https://doi.org/10.1371/journal.pntd.0007855
Редактор: Дэниел К. Масига, Международный центр физиологии и экологии насекомых, КЕНИЯ
Поступила: 11 декабря 2018 г .; Одобрена: 17 октября 2019 г .; Опубликовано: 24 февраля 2020 г.
Авторские права: © 2020 Bateta et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: генотипов микросателлитов, включенных в это исследование, доступны в формате GenePop от Dryad, https://doi.org/10.5061/dryad.gmsbcc2hw. Последовательности гаплотипов митохондриального гена цитохромоксидазы I депонированы в NCBI GenBank https: // www.ncbi.nlm.nih.gov/nucleotide/, номера доступа MN653959-MN653968.
Финансирование: Эта работа финансировалась Фондом национальных институтов здравоохранения (https://fnih.org/), грант номер U01 AI115648, выданный Серапу Аксою и Адальгисе Какконе, а также Фондом национальных институтов. of Health (https://fnih.org/) Глобальный учебный грант по инфекционным заболеваниям Fogarty номер D43TW007391, выданный Серапу Аксою. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Мухи цеце (род Glossina ) обитают в Африке к югу от Сахары и населяют в пределах своего ареала неоднородные и прерывистые среды обитания [1,2]. В Кении и Танзании [3,4], Glossina pallidipes является наиболее широко распространенным переносчиком трипаносом, вызывающих африканский трипаносомоз животных (AAT), и, в меньшей степени, также участвует в передаче африканского трипаносомоза человека (HAT). [5,6].Распространение G. pallidipes проходит от Эфиопии до Кении, Уганды, Танзании, Демократической Республики Конго, Мозамбика и Замбии [7–9], а его плотность населения зависит от наличия подходящей среды обитания и млекопитающих-хозяев [10] . Присутствие, распространение и численность мухи цеце зависит от наличия подходящей среды обитания [11]. Степень пространственного распределения мухи цеце соответствует сезонным изменениям, когда численность популяции мухи цеце уменьшается в несколько засушливых периодов года, но увеличивается в размере в сезоны дождей [12–14].
Модели прогнозирования Географической информационной системы (ГИС)использовались, чтобы показать районы численности и распространения мухи цеце [13,15], и эти модели предполагают, что на распространение мухи цеце в разное время влияли некоторые антропогенные и естественные нарушения. Этот вывод подтверждается популяционным генетическим анализом, который показал генетические сдвиги [16], особенно в регионах, где деятельность человека изменила условия [17,18]. Наше предыдущее исследование показало, что усилия по борьбе с мухой цеце в 1960-х и 1980-х годах (Африканский союз 2009) [19] не повлияли на генетическое разнообразие мухи цеце [16].Через более длительные промежутки времени эпидемии болезней, такие как вспышка чумы крупного рогатого скота, произошедшая в начале 1990-х годов [20,21], и биогеографический сдвиг, вызванный образованием Эфиопского разлома (участок Великой рифтовой долины в центральной Кении; рис. ), вероятно, также повлияли на генетическую дифференциацию мух цеце, как и на многие другие группы животных и растений [22–25]. Понимание относительного воздействия этих различных биогеографических факторов важно для разработки и координации эффективных и осуществимых стратегий борьбы с переносчиками болезней в Кении и Танзании, двух странах, которые серьезно обременены экономическими издержками AAT.
Целью этого исследования было оценить закономерности и уровни генетической связности G . pallidipes во многих пространственных масштабах, а также для понимания эволюционных сил, которые сформировали и поддерживают их. Мы использовали образцы, собранные в 21 месте в Кении и национальном парке Серенгети в Танзании (рис. 1), и проверили около 600 образцов на генетические вариации в 11 микросателлитных локусах. Отбор проб был произведен на пяти из восьми поясов мухи цеце, признанных Кенийским советом по искоренению мухи цеце и трипаносомоза (KENTTEC).Используя рекомендованную KENTTEC терминологию, мы включили образцы из мух-пояса бассейна озера Виктория (KAR и RUM), летающего пояса Нарок-Каджиадо (национальный заповедник Масаи Мара в экосистеме Серенгети: GVR, MRT, FGT, NBS и MRB), Mbeere -Меру-муховой пояс (MNP), мух-пояс Центральной Кении (KIB) и прибрежный мух-пояс (HND, TSW, KIN, SHI и SHT). Мы исследовали паттерн генетической структуры в трех пространственных масштабах с более высоким разрешением, чем предыдущие генетические анализы G . pallidipes [26–30]. В самом большом пространственном масштабе (рис. 1) мы исследовали генетическую структуру из 21 участка в G . pallidipes распространение в Кении и национальном парке Серенгети в Танзании. В промежуточном пространственном масштабе мы исследуем 13 и восемь участков, которые падают к западу и востоку (соответственно) от «Эфиопского рифта» Великой рифтовой долины, которая является биогеографической границей, знаменующей генетический разрыв в G . pallidipes [26].В самом маленьком пространственном масштабе мы исследовали 11 участков в экосистеме Серенгети, которая является одним из самых больших пространств (~ 25 000 км 2 ) естественной среды обитания саванн в мире [31]. Экосистема Серенгети — знаковое место одного из самых известных периодических миграций крупных позвоночных, которое пересекает границу Кении и Танзании [32]. Экосистема охраняется как в Кении, так и в Танзании Национальным заповедником Масаи Мара и Национальным парком Серенгети, соответственно.Результаты нашего исследования в трех пространственных масштабах в Кении и Танзании могут помочь в разработке эффективных стратегий борьбы с переносчиками болезней и мониторинга для координации усилий в местном, региональном, национальном и международном пространственных масштабах.
Методы
Заявление об этике
Полевые сборы мухи цеце проводились в соответствии с номером разрешения NACOSTI / P / 18/28381/22226, выданным Национальной комиссией Кении по науке, технологиям и инновациям.
Места исследования и образцы мухи цеце
Биконические [33] и Ngu [34] ловушки использовались для сбора мухи цеце из 21 места отбора проб в период с марта 2015 года по ноябрь 2016 года (рис. 1, таблица 1).Чтобы обеспечить равномерное усилие отлова на разных участках, в каждом месте было размещено 7–15 ловушек в радиусе 1 км на расстоянии не менее 150 м друг от друга и опорожнялись через 24 часа. Мух консервировали индивидуально в пробирках объемом 1,5 мл, содержащих 80% этанола. Дата сбора, номер ловушки и координаты, а также пол были записаны в каждой пробирке с образцом. Glossina pallidipes образцов были собраны с 21 участка по всей Кении и северной Танзании (рис. 1), в том числе с 11 участков в экосистеме Серенгети и восьми участков из предыдущего исследования [26].Всего было генотипировано 600 мух цеце, что составляет ~ 30 мух на участок, за исключением двух участков (SHI и SHT), где было 22 и 8 мух, соответственно. Чтобы избежать возможной предвзятости по признаку пола, было включено одинаковое количество мужчин и женщин.
Для оценки генетической структуры этих популяций в масштабе всей страны мы включили образцы по всему распространению видов в Кении (Рис. 1; Таблица 1). Мы также посетили еще 14 мест, где не было мух, несмотря на прошлые записи о сборе, указывающие на присутствие G . pallidipes (таблица S1). Отсутствие мух в этих 14 местах могло быть вызвано недавними изменениями в землепользовании, которые изменили среду обитания для сельскохозяйственного использования. Для исследования закономерностей генетической структуры в экосистеме Серенгети мы использовали образцы из пяти участков (GVR, MRT, FGT, NBS и MRB) из национального заповедника Масаи Мара в Кении и шести участков (GTR, IKR, KLM, MSN, MSS и NGK) из национального парка Серенгети в Танзании.
Экстракция ДНК, микросателлитное генотипирование и секвенирование мтДНК
ДНКэкстрагировали из двух лапок каждой мухи с использованием наборов для экстракции ДНК насекомых PrepGEM (ZYGEM Corp Ltd, Гамильтон, Новая Зеландия) или Qiagen DNAeasy (Qiagen, Hilden, Германия) в соответствии с протоколом производителя.Мы использовали флуоресцентные меченые (FAM, TAM, HEX и NED) прямые праймеры для 11 микросателлитных локусов (таблица S2), используя опубликованные протоколы, которые были проверены для G . pallidipes [16]. Вкратце, ПЦР-амплификации проводили в термоциклере Mastercycler Pro (Eppendorf, Германия) в реакциях объемом 13 мкл, состоящих из 6 мкл дистиллированной H 2 0, 1,1 мкл 25 мМ MgCl 2 , 0,5 мкл каждого из 10 мМ вперед и обратные праймеры, 0,1 мкл 100X BSA, 1,1 мкл 10 мМ смеси dNTP, 1 мкл ДНК-матрицы и 0.1 мкл 5 ед. / Мкл ДНК-полимеразы GoTaq с 2,6 мкл 5-кратного буфера для ПЦР (Promega, США). Мы использовали следующие условия цикла: 95 ° C в течение пяти минут, 12 циклов касания (95 ° C в течение 30 секунд, 60–50 ° C в течение 25 секунд и 72 ° C в течение 30 секунд), 40 дополнительных циклов (95 ° C в течение 30 секунд, 50 ° C в течение 25 секунд и 72 ° C в течение 30 секунд) и окончательное расширение до 72 ° C в течение 20 минут. Продукты ПЦР были мультиплексированы в группы по два или три локуса так же, как это было опубликовано ранее [16], и генотипированы на автоматическом секвенаторе ABI 3730xL (Life Technologies, США) в центре анализа ДНК на Science Hill Йельского университета (http: // ДНК-анализ.yale.edu/). Аллели подсчитывали с помощью программы GENEMARKER v2.4.0 (Soft Genetics, США). Чтобы гарантировать репликацию вызовов генотипа, автоматически сгенерированные пики визуально проверялись дважды независимо с использованием согласованных критериев для каждого локуса (файл S1), и сохранялись только согласованные вызовы генотипа.
Для приблизительного байесовского вычислительного анализа, исследующего возможные причины популяционной структуры, мы секвенировали фрагмент митохондриальной ДНК (мтДНК) размером 439 п.н. из гена цитохромоксидазы I, амплифицировали с помощью ПЦР у 24 человек с использованием праймеров, разработанных Саймоном и др. [37] (подробности секвенирования находятся в файле S2).Программное обеспечение Geneious v6.0.6 [38] использовалось для редактирования и выравнивания последовательностей, а уникальные гаплотипы мтДНК и эволюционные отношения между гаплотипами были построены с помощью сети на основе экономичности с использованием программного обеспечения TCS var 1.21 [39], реализованного в PopART (Анализ популяции с сетчатыми деревьями). : http://popart.otago.ac.nz/index.shtm).
Валидация и разнообразие микросателлитных маркеров
Мы проверили наличие нулевых аллелей с помощью Micro-Checker v2.2.3 [40], и локусы с признаками нулевых аллелей во всех выбранных сайтах были исключены из последующих анализов.Мы протестировали все микросателлитные локусы на предмет неравновесия по сцеплению и отклонения от равновесия Харди-Вайнберга, используя Genepop v4.6 [41]. Все локусы были оценены с использованием метода цепей Маркова [42] с 10 000 шагов демеморизации, 1000 партиями и 10 000 итераций на партию. Метод Фишера был использован для получения значений значимости, которые были скорректированы для нескольких тестов с использованием метода Бенджамини-Хохберга ([43]). Мы использовали Arlequin v3 . 5 . 2 . 2 [44] для определения наблюдаемой (Ho) и ожидаемой гетерозиготности (He).Аллельное богатство (AR) и коэффициент инбридинга (F IS ) были рассчитаны с использованием FSTAT v2.9.3.2 [45].
Оценки эффективной численности населения (N
e ) и узких мест в популяцииМы оценили динамику популяции с помощью оценок эффективного размера популяции (N e ), который можно рассматривать как показатель степени изменчивости, присутствующей в популяции, и тестов на недавние узкие места в популяции. Эти параметры определяют количество размножающихся особей в регионе, эффективную способность к расселению, потенциальную силу отбора на устойчивость к манипуляциям с переносчиками (генетическая или парагенная инженерия или выпуск стерильных самцов) [46–49].Таким образом, улучшенное понимание этих параметров может помочь в моделировании динамики передачи и информировании о стратегиях борьбы с переносчиками на земле. Мы использовали одновыборочный метод неравновесия по сцеплению [50], реализованный в NeESTIMATOR v2 [51]. Мы проверили недавние узкие места в BOTTLENECK 1.2.02 [52], программе, которая может обнаруживать узкие места примерно от 2N и до 4N и поколений до отбора проб [52,53]. Мы проверили избыточную гетерозиготность по сравнению с наблюдаемым аллельным разнообразием, используя односторонний знаковый ранговый критерий Вилкоксона [52] в рамках модели двухфазных мутаций (TPM) с 70% одношаговых мутаций и 30% многоступенчатых мутаций, а также бесконечным аллелем. модель (IAM), обе имеют 10 000 итераций.Мы сообщили исходные p-значения и p-значения, которые были скорректированы для нескольких тестов с использованием метода Бенджамини-Хохберга ([43]). Модели TPM и IAM различаются по степени аппроксимации мутаций, при этом модель TPM обычно считается наиболее подходящей для микросателлитных данных [54]. Мы также включили модель IAM для сравнения, но считалось, что популяция недавно столкнулась с узким местом, только если обе модели достигли консенсуса. Функция сдвига мод BOTTLENECK использовалась для определения частотных распределений аллелей и заключения о том, могут ли искажения в распределении быть вызваны узким местом [53].
Структура населения
Мы использовали метод байесовской кластеризации, реализованный в BAPS v 6 [55,56], для исследования общей структуры населения среди всех участков выборки с учетом географического происхождения каждой выборки с опцией «пространственная кластеризация людей». Этот метод превосходит методы кластеризации, когда выборка неравномерна по ландшафту и / или существует изоляция по расстоянию [57–60]. Мы выполнили 10 независимых повторов начального шага кластеризации с максимальным количеством кластеров (K) 21 (количество точек выборки), 10 и 5, чтобы гарантировать стабильность результатов, как рекомендовано авторами метода [55,56 ].Затем мы оценили примесь, которая отражает вероятность принадлежности каждого индивида к разным генетическим единицам (q-значения в диапазоне от 0 до 1) во всех кластерах с использованием 50 эталонных индивидов из каждого кластера, идентифицированного в анализе «пространственной кластеризации индивидов» с использованием 10000 итераций . Для сравнения результатов BAPS со вторым байесовским методом, не учитывающим географическое происхождение, мы также запустили STRUCTURE v2 . 3 . 4 [35,36] с K = 1–10, модель примеси, частоты независимых аллелей и выгорание 50 000, за которыми следуют 250 000 шагов, и использовали CLUMPAK [61] для выравнивания 10 независимых повторов для каждого K .
Для дальнейшей визуализации паттернов генетической структуры мы также выполнили анализ главных компонентов (PCA) и дискриминантный анализ главных компонентов (DAPC) [62] в пакете adagenet v2.1.0 [63] в R v3.3.3 (R Development Core Team), которые являются многомерными процедурами без использования моделей, которые (в отличие от BAPS и STRUCTURE) не делают никаких предположений о соблюдении равновесия Харди Вайнберга.
Мы измерили генетическую дивергенцию среди населенных пунктов выборки, вычислив попарно F ST , используя Арлекин со статистикой Райта [64], и протестировали на значимость с помощью метода дисперсии, разработанного Вейром и Кокерхэмом [65], вычисленного при 10 000 перестановок для получения точных p-значений. .Полученные значения F ST и географические расстояния, сгенерированные с помощью веб-генератора матрицы географических расстояний v1.2.3 (Ersts, http://biodiversityinformatics.amnh.org/open_source/gdmg, Интернет), были использованы для проверки изоляции по расстоянию. со следующим Rousset 1997 [66] с использованием F ST / (1- F ST ) и записать преобразованное географическое расстояние в км, как реализовано в веб-сервисе «изоляция расстоянием» v3.23 [67] с тестом Mantel с 10 000 рандомизаций [68].
Связь и миграция
Связь между индивидуумами в генетических кластерах была проверена с помощью программы ML-Relate [69], чтобы определить, является ли наблюдаемая генетическая кластеризация результатом выборки связанных особей. Мы разделили попарные отношения внутри каждой популяции на одну из четырех категорий отношений; неродственные (U), полные братья и сестры (HS), полные братья и сестры (FS) или родитель / потомок (PO).
Для проверки отдельных мигрантов между географически соседними участками выборки мы использовали два метода.Мы использовали GENECLASS v2.0 [70–73] для обнаружения мигрантов первого поколения. Мы использовали алгоритм повторной выборки Монте-Карло Paetkau и др. ., 2004 [71] с 1000 рандомизаций для вычисления статистики теста L h (вероятность отнесения человека к местности, где была произведена выборка), L max (самая высокая вероятность среди всего населения, включенного в выборку), и их соотношение (L h / L max ) для идентификации мигрантов. Мы использовали байесовский метод Rannala and Mountain, 1997 [72], чтобы обнаружить истинных мигрантов с пороговым значением p, равным 0.05. Мы сообщили необработанные p-значения и p-значения, которые были скорректированы для нескольких тестов с использованием метода Бенджамини-Хохберга ([43]).
Биогеографическое моделирование с помощью ABC
Структура популяции может иметь несколько причин, включая медленное накопление генетических различий в географическом пространстве из-за длительного равновесия миграции и дрейфа или из-за генетической дивергенции через географический разрыв (викариантность). Поскольку причина структуры остается неясной и имеет четкие последствия для контроля переносчиков, мы исследовали причину, моделируя время дивергенции основных генетических кластеров, идентифицированных в BAPS, с приблизительным байесовским вычислением (ABC) в DIYABC [74] v2.Анализ 0.4 ABC был завершен с двумя наборами данных: подмножеством существующего набора микросателлитных данных и фрагментом митохондриальной ДНК (мтДНК) размером 439 п.н., секвенированным для этой цели у 24 человек. Мы добавили набор данных мтДНК, чтобы сделать вывод об эволюционной истории в более отдаленном прошлом, поскольку мтДНК имеет более низкую скорость мутаций, чем микросателлиты. Моделирование DIYABC предполагало отсутствие миграции между линиями и панмиктическими популяциями, поэтому мы использовали индивидуумов из каждого крупного кластера, у которых не было признаков примеси или мигранта (северо-запад, юго-запад, восток; полное описание этих кластеров см. В разделе результатов).В наборе микросателлитных данных три генетических кластера были представлены 50 особями каждый (по 25 на участок) из KAP и RUM (северо-запад), GTR и MSS (юго-запад) и MNP и KIB (восток) соответственно. В наборе данных мтДНК три генетических кластера были представлены пятью индивидами из RUM (северо-запад), 10 людьми из GTR (юго-запад) и девятью индивидами из KIB (восток).
Приоры для всех параметров (таблица S3) допускали широкий диапазон возможностей, которые соответствовали оценкам частоты мутаций [75–79], размеров популяции [16,26,28,29,80–82], времени генерации [ 74, 82–84], а также время раскола популяции [25,83–86], сделанное в предыдущих исследованиях G . pallidipes и виды саванн из Восточной Африки (файл S2). Мы выполнили два анализа, в которых было проведено уникальное сравнение альтернативных сценариев. Анализ 1 был разработан для определения наиболее вероятной наследственной линии и сравнения четырех сценариев (1a, 2a, 3a и 4a; S1 Рис.), В то время как Анализ 2 был разработан, чтобы различать вероятные сроки разделения и N e путем сравнения двух сценарии с каждым из возможных паттернов происхождения (1a против 1b, 2a против 2b, 3a против 3b и 4a против 4b; S1 рис.).Мы оценили точность сценариев, сравнив сводную статистику, такую как разнообразие, M-индекс [44,87], дифференциация [53] (файл S2), а затем выполнили PCA с этой статистикой для оценки относительной апостериорной вероятности альтернативных сценариев с метод взвешенной логистической регрессии, описанный в [88]. Мы также оценили апостериорную ошибку прогнозирования (частоту принятия сценария, отличного от истинного сценария) с помощью 1000 запусков проверки модели с использованием метода, описанного в [74], чтобы подтвердить надежность моделей, и сделали оценки параметров, используя линейную регрессию. из 1% моделирования, наиболее близких к наблюдаемым данным.
Результаты
Проверка микросателлитных маркеров и последовательности мтДНК, созданные для анализа ABC
Glossina pallidipes были генотипированы в общей сложности по 11 локусам для 21 участка отбора проб, всего 600 мух. Мы наблюдали 49 случаев значительного отклонения от HWE после корректировки количества ложных открытий с помощью метода Бенджамина Хохберга [43]. Однако ни один из этих локусов не показал последовательной картины отклонений от HWE на всех участках выборки (таблица S4), а также не было доказательств LD среди локусов (таблица S5).24 последовательности мтДНК, сгенерированные для анализа ABC, попали в 10 гаплотипов, причем наиболее распространенный гаплотип представлен тремя группами образцов, выбранными для представления северо-западных, юго-западных и восточных генетических кластеров (описание этих кластеров см. Ниже в результатах структуры популяции) . Все остальные девять гаплотипов были уникальными для одного кластера (S2 рис; S2 файл).
Генетическое разнообразие и демографические оценки
Статистика разнообразия представлена в таблице 1. Среднее аллельное богатство по всем локусам было самым высоким как для TSW, так и для KIN (2.55), а самый низкий — в RUM (1,81). RUM также показал самые низкие значения H o и H e , 0,38 и 0,42 соответственно. H o был самым высоким на четырех участках (0,58: MSS, KLM, KIB, MNP), в то время как максимум H e наблюдался в SHT (0,72). На всех участках выборки были выявлены положительные и достоверные значения F IS (p <0,05). Наименьшее значение F IS (0,04) наблюдалось в MRT, а самое высокое (0,48) — в SHT. Оценки Ho, H e и F IS указывают на небольшой дефицит гетерозигот по сравнению с тем, что ожидается при случайном спаривании.
Оценки среднего аллельного богатства после исключения близкородственных особей (см. Ниже) варьировались от 1,87 в RUM до 2,62 в SHT (таблица S6) и отражали результаты, полученные с использованием полного набора данных. RUM постоянно демонстрировал самые низкие значения H o и H e (0,42 и 0,45, соответственно), как наблюдалось с использованием полного набора данных. Наивысшие значения H o и H e 0,59 и 0,76 наблюдались в HND и SHT соответственно. F IS оценки для этого подмножества данных варьировались от 0.06 в RUM до 0,45 в SHT (таблица S6) и оставался значительно выше нуля, за исключением RUM, что указывает на то, что особи в среднем были более родственны, чем можно было бы ожидать в рамках модели случайного спаривания, даже после исключения близкородственных особей.
N и оценки широко варьировались от 2,7 (2,2–3,3 95% доверительный интервал [ДИ]) в KAP до 3507 (125,8 — бесконечный 95% доверительный интервал [ДИ]) в HND (Таблица 2). Некоторые оценки неотличимы от бесконечности, что указывает на недостаточную мощность для оценки N e для этих участков отбора проб.
Результаты модели TPM не показали значительного уменьшения эффективного размера популяции ни на одном из участков выборки (таблица 2), в то время как модель IAM указала на узкие места популяции в RUM, MSS, IKR, KLM, TSW и MNP (p < 0,05), но после поправки на множественное тестирование значимым оказался только MSS (таблица 2). Точно так же не было отклонений от нормального L-образного распределения частот аллелей, что указывает на равновесие между мутациями и дрейфом и отсутствие узких мест в популяции.
Тесты максимального правдоподобия на родство показывают, что большинство людей не были родственниками (> 70%; Таблица 2).Процент полукровных братьев и сестер колебался от 0% в SHT до 14% в NGU, при общем среднем уровне 10%. Полный брат, от 0% в SHT до 4,8% в KAP, с общим средним значением 1,42%. Родительское потомство варьировалось от 0 в SHT до 11% в KAP, с общим средним значением 1,9%. Эти результаты указывают на более низкую степень родства на востоке, чем на западе.
Состав и дифференциация населения
Байесовский анализ структуры популяции с использованием BAPS выявил три основных генетических кластера (рис. 2), которые соответствуют географическому происхождению, и один кластер выбросов, который содержит только четыре человека без явного географического рисунка (два из RUM и два из IKR).Основные генетические кластеры состояли из образцов из северо-западных участков (KAP и RUM), юго-западных участков (экосистема Серенгети: GVR, MRT, FGT, NBS, MRB, GTR, IKR, KLM, MSN, MSS, NGK) и восточных участков. (MNP, KIP, TSW, KIN, SHT, SHI, HND). НГУ был помещен в восточный кластер в БАТ, но не в других анализах (см. Ниже). С этого момента мы будем называть образцы из западной Кении за пределами Серенгети «северо-западом», образцы из экосистемы Серенгети — «юго-западом», а все другие образцы — «востоком».В описании этих результатов для Кении с использованием рекомендованной KENTTEC терминологии, мухи из мух-пояса бассейна озера Виктория (KAR и RUM) составили один из трех генетических кластеров (северо-запад), мухи из мух-пояса Нарок-Каджиадо (плюс все образцы из Танзании). из экосистемы Серенгети) составили другой генетический кластер (юго-запад), а мухи из мух-пояса Мбере-Меру, мух-пояса Центральной Кении и прибрежного мух-пояса составили третий генетический кластер. Средняя вероятность присвоения (q-значения) для северо-запада была равна 0.97, юго-запад (экосистема Серенгети) составил 0,97, а восток — 0,98 (таблица 1; таблица S7). В то время как большинство особей были отнесены только к одному кластеру, связанному с их регионом происхождения, два человека как с северо-запада, так и с юго-запада принадлежали к кластеру выбросов, а восемь особей с юго-запада и востока были генетически смешаны с максимальными значениями q <0,90 ( Рис 2, Таблица S7).
Рис. 2. Результаты байесовского кластерного анализа на основе микроспутниковых данных.
Пространственно явная генетическая кластеризация была выполнена в программе BAPS v 6 [55,56] Вертикальные полосы указывают вероятность отнесения (q-значение) индивидуума к каждому кластеру (таблица S7). Тонкие вертикальные линии разделяют участки отбора проб, указанные вдоль нижней оси x, и предполагают, что вертикальные линии разделяют три основных кластера, представленных вдоль верхней оси x.
https://doi.org/10.1371/journal.pntd.0007855.g002
Результаты PCA полностью поддерживают BAPS, с сильным разделением между западом (северо-запад / юго-запад) и востоком, очевидным через ПК 1 и 2 (что составляет 4 .02% и 3,13% от общей дисперсии, соответственно), и разделение между северо-западом и юго-западом, видимое вдоль ПК 4 (что составляет 2,08% от общей дисперсии; S3, рис.). Результаты STRUCTURE (S4 рис.) И DAPC (S5 рис.) В значительной степени согласуются с BAPS с одним исключением: эти анализы поместили NGU на северо-запад, а не на восток, и указали на большее смешение между северо-западом и юго-западом (S4 и S5 рис.) .
Попарно F ST между участками отбора проб в среднем 0.123 и широко варьировались от нуля (NGK против MSS и KLM против MSN) до 0,312 (SHT против RUM) и были значимыми в 79% пар (таблица 3; таблица S8) на среднем географическом расстоянии ~ 330 км ( Рисунок 1).
Северо-запад содержал только одну пару участков отбора проб (KAP и RUM), разделенных расстоянием ~ 155 км со значительным F ST , равным 0,123 (таблица 3A), и не мог быть включен в какие-либо статистические тесты. На юго-западе среднее значение F ST составляет 0,040 на среднем географическом расстоянии ~ 111 км (Таблица 3A).62% оценок юго-западного F ST были значительными. На востоке F ST был значительно выше, чем на юго-западе (t-критерий Стьюдента p = 0,0273; рис. 3A), в среднем 0,067 на среднем географическом расстоянии ~ 282 км, что неудивительно, учитывая большие географические расстояния, разделяющие участки (таблица 3А). 82% оценок восточного F ST были значительными. Также наблюдалась значительно более высокая генетическая дифференциация между кластерами (средний F ST = 0,123), чем среди участков в юго-западном или восточном кластерах (t-критерий Стьюдента p <0.0001; Рис 3A).
Рис. 3. Сравнение F ST среди кластеров и между ними, а также взаимосвязь между F ST и географическим расстоянием.
(a) Генетическая дифференциация (F ST ), вычисленная в Arlequin [44] на основе Weir and Cockerham 1984 [65] внутри и между кластерами. Коробчатые диаграммы показывают среднее значение, 1 -й квартиль и 3 -й квартиль , 95% квантили (усы) и выбросы (точки). T-критерии Стьюдента показали, что средний F ST был значительно ниже на юго-западе, чем на востоке (p = 0.0273, помечено *) и значительно выше межкластерных сравнений, чем на юго-западе или востоке (p <0,0001, помечено ***). (b) Генетическое расстояние в сравнении с географическим расстоянием с использованием F ST / (1- F ST ) для корректировки конечных размеров популяции [66], нанесенных на северо-запад (звезда), юго-запад (треугольники, указывающие вниз), восток (вверх) указывающие треугольники) и между кластерами (серые круги), с линейной линией наилучшего соответствия с R 2 и p-значениями для тестов Mantel для изоляции по расстоянию [66,68], выполняемых в веб-сервисе «изоляция по расстоянию» v3 .23 [67].
https://doi.org/10.1371/journal.pntd.0007855.g003
Наблюдалась значительная изоляция по расстоянию через каждый генетический разрыв: через генетический разрыв восток / запад (в целом: p = 0,0002) и через северо-запад / юго-западный генетический разрыв (запад: p = 0,0361). Напротив, не было значительной изоляции по расстоянию внутри любого из генетических кластеров (рис. 3B). Действительно, генетические и географические расстояния на юго-западе и востоке были заметно разорваны. На юго-западе пара участков отбора проб с самым низким F ST (KLM и MSN: F ST = -0.005) были разделены полными 69,6 км, а пара участков отбора проб с самым высоким F ST (MRT и MRB: F ST = 0,121) были разделены всего на 14,4 км (Таблица 3A). На востоке пара участков отбора проб с самым низким F ST (KIB и HND: F ST = 0,003) была разделена полными 303,6 км, а пара участков отбора проб с самым высоким F ST ( KIN и NGU: F ST = 0,175) были разделены 400 км, что меньше максимального значения 509.3 км, разделяющие SHT и MNP (Таблица 3B).
Миграция
При относительно консервативном пороговом значении p (0,05), предназначенном для идентификации всех потенциальных мигрантов первого поколения, GENECLASS идентифицировал 83 мигранта, из которых ноль мигрантов на северо-западе, 38 мигрантов на юго-западе и 38 мигрантов на востоке (рис. Таблица S9). На юго-западе был самый высокий обмен между любыми двумя участками между MRT и FGT (8 мигрантов; таблица S9), два участка, разделенных всего на 15 км в кенийской части экосистемы Серенгети.На востоке наблюдалась миграция как в большом, так и в малом географическом масштабе, поскольку мы обнаружили мигрантов между участками, разделенными на 278 км (MNP и KIB) и всего на 20 км (SHI и SHT; Таблица 3). Было обнаружено 9 межкластерных мигрантов, по одному в каждом направлении между северо-западом и юго-западом и семь между юго-западом и востоком (четыре с юго-запада, которые были обнаружены на востоке, и три с востока, которые были обнаружены на юго-западе; Таблица S9). Статистической разницы в скорости миграции между полами не было (43 женщины против 40 мужчин; таблица S9).Только два миграционных события в экосистеме Серенгети (из IKR в GTR и из IKR в MRB) были значительными после корректировки для множественного тестирования (таблица S9).
Рис. 4. Мигранты первого поколения среди участков отбора проб.
Мигранты, обнаруженные с помощью программы GENECLASS [70], обозначены стрелками, указывающими направление движения. Участки были сгруппированы вместе, если расстояние между ними составляло менее 50 км. Каждая точка представляет собой участок отбора проб, помеченный кодами участков (таблица 1). Пунктирными линиями обозначены три генетических кластера, идентифицированные в BAPS v 6 [55,56].Карта была создана в QGIS v2.12.1 (август 2017 г .; http://qgis.osgeo.org) с бесплатными и общедоступными данными, доступными в DIVA-GIS (август 2017 г .; http://www.diva-gis.org) .
https://doi.org/10.1371/journal.pntd.0007855.g004
История населения смоделирована ABC
Предварительная проверка выявила незначительные различия между наиболее суммарными статистическими данными, рассчитанными для смоделированных и наблюдаемых данных мтДНК и микросателлитных данных в рамках победившего сценария (файл S3; файл S4, соответственно), а также некоторое совпадение результатов PCA смоделированного и наблюдаемого сводных данных. статистика (S6 рис).Однако в обоих Анализах 1 (таблица S3) была высокая апостериорная ошибка прогноза, что свидетельствует об отсутствии возможности надежно определить правильный сценарий. Эти результаты предполагают, что ни один из наборов данных (мтДНК или микросателлиты) не предоставил мощности, необходимой для точного определения истинного образца происхождения (Анализ 1). Более того, вероятно, что набор данных микроспутников не может предоставить точные оценки времени расхождения (Анализ 2), потому что микроспутники обычно имеют высокие темпы мутаций, что делает их непригодными для оценки времени расщепления порядка миллионов лет, что было указано в таблице. анализ мтДНК (S7 фиг.).
Тем не менее, из анализа 2 мтДНК были согласованы показания того, что сценарии с переменной N e (сценарии 1b, 2b, 3b и 4b) поддерживались по сравнению со сценариями с константой N e (сценарии 1b, 2b, 3b, и 4b; таблица S3). Оценки параметров показали, что время расхождения между северо-западом и юго-западом соответствовало отсутствию расхождения (т. Е. Способ оценки t1 = 0), что существовало древнее расхождение порядка миллионов лет между западом (северо-запад и юго-запад) и востоком. (S7 Рис), и что узкие места на северо-западе и юго-западе могли возникнуть в течение последних 2–100 лет.Результаты микросателлитного анализа в целом согласуются с результатами по мтДНК, но мы также обнаружили несколько отличий. В отличие от результатов мтДНК (файл S3), микросателлитный анализ показал, что расхождение между северо-западом и юго-западом (t1) произошло между 1000 и 10 миллионами лет назад (S7 Рис). Кроме того, микросателлитные результаты в сценарии 3 подтвердили константу над переменной N и , что противоречит результатам всех анализов мтДНК и микросателлитного анализа в сценариях 1, 2 и 4 (S1 рис; S3 таблица).
Обсуждение
Генетическое разнообразие
Оценки генетического разнообразия на северо-западе и юго-западе имели несколько более низкие средние значения аллельного богатства по сравнению с востоком. Это различие в генетическом разнообразии может отражать различия в экологии и / или различия в антропогенной истории, включая разрушение среды обитания, нагрузку на выпас скота и борьбу с переносчиками. Экологические различия включают меньшую сезонность и большие площади нетронутой среды обитания в речных бассейнах на востоке (см. Обсуждение генетической связи ниже).Различия в антропогенном нарушении, вероятно, сыграли роль в формировании моделей генетического разнообразия. Урбанизация, разрушение среды обитания, сельскохозяйственная деятельность, высокая нагрузка на выпас скота и история применения мер борьбы с мухой цеце [28] в западной Кении [4–6] в 1980-х и 2000-х годах [89–91], вызванных наличием HAT и повторяющимися вспышками Возможно, все AAT сыграли роль в уменьшении размеров популяции и, таким образом, уменьшили генетическое разнообразие G . pallidipes на северо-западе и юго-западе по сравнению с востоком.Нижние оценки N e на северо-западе и юго-западе (таблица 2) и признаки недавнего сокращения популяции в результатах ABC (т.е. способ оценок даты узкого места db NW и db SW = 2–100 лет назад ; S7 рис; S3 таблица), оба предоставляют дополнительную поддержку гипотезе о том, что антропогенное нарушение уменьшило G . pallidipes размеров популяции в западной Кении за последние 100 лет.
Мы обнаружили 49 случаев значительного отклонения от HWE (таблица S4), это могло быть из-за дефицита гетерозигот, приводящего к положительным и значимым значениям F IS , и предполагаем, что люди в нашем исследовании могут быть связаны (~ 10% людей ; Таблица 2), или что может быть история инбридинга.Однако оценки отклонений от HWE после исключения предполагаемых родственников (таблица S6) были очень похожи на оценки, сделанные с полным набором данных, который был аналогичен результату, полученному в [26], и поддерживает инбридинг как объяснение отклонений от HWE. Одна из возможностей состоит в том, что сигнал о высоком родстве может быть результатом инбридинга, вызванного чертами жизненного цикла, общими для этого рода, Glossina . Например, живородство [80] требует, чтобы в репродуктивном цикле было только одно потомство и только ~ три потомка за всю жизнь самки.Это приводит к небольшому эффективному размеру популяции и высокой вероятности инбридинга, когда близкие родственники сталкиваются друг с другом во время размножения. Другим фактором может быть небольшое расстояние среднего распространения мух цеце при полете <2 км [92–94] и др. 92 Rodgers et al, что также может увеличить вероятность встречи родственников друг с другом во время размножения.
Мы не обнаружили никаких сигналов о генетических узких местах (таблица 2) с использованием моделей TPM и IAM, а также с помощью теста индикатора смены режима.Предыдущая работа Ciosi et al., 2014 [82] выявила генетическое «узкое место» в KAP, и это было связано с предыдущими усилиями по борьбе с мухой цеце, которые проводились в этом районе [89]. Расхождение между двумя результатами может быть связано со сроками отбора проб в двух исследованиях и ограниченной чувствительностью подхода BOTTLENECK для обнаружения узких мест в далеком прошлом. Ciosi et al., 2014 [82] использовали образцы, которые были собраны в 2000 году, всего через несколько лет после введения в действие мер по борьбе с мухой цеце, в то время как образцы для этого исследования были собраны в 2016 году, т.е. разница составляет ~ 128 поколений.Возможно, за это время население могло оправиться от эффекта «бутылочного горлышка».
Структура населения
Результаты генетической кластеризации, хотя в значительной степени согласуются с выводами предыдущего анализа узкой трансекты вдоль южной границы Кении [26], обеспечивают более четкое определение трех генетических кластеров (северо-запад, юго-запад и восток) и их границ. Все методы кластеризации (BAPS, STRUCTURE, DAPC, PCA) выявили явный генетический разрыв между участками отбора проб к востоку и западу от Эфиопского разлома и генетический разрыв между северо-западом (KAR и RUM) и экосистемой Серенгети на юго-западе ( Рис. 2, S3 – S5 Рис.).Принадлежность NGU к кластеру к востоку или западу от Эфиопского рифта была иной в BAPS, чем в других анализах (Рис. 2, S3 – S5, Рис.). Мы предпочитаем результаты BAPS здесь, потому что этот метод учитывает неравномерную пространственную выборку (пространственная автокорреляция) [55,56]. Однако следует отметить, что ни один из использованных анализов не может также исправить возможность того, что генетические разрывы были вызваны изоляцией из-за расстояния, а не генетической дивергенцией через географический барьер [95], и это остается возможностью.Действительно, анализ ABC предполагает, что генетический разрыв между северо-западом и юго-западом может не отражать генетическое расхождение через географический разрыв, потому что есть некоторые свидетельства того, что время этого разделения популяции было современным (см. Ниже). Тем не менее, тот факт, что нет сигнала об изоляции по расстоянию внутри генетических кластеров, свидетельствует о том, что причиной генетических разрывов не была единообразная изоляция по расстоянию. Вместо этого паттерны дивергенции и равновесия Харди-Вайнберга, выявленные в анализах BAPS и STRUCTURE, предполагают, что три идентифицированных генетических кластера могут иметь уникальную популяционную динамику [35, 36, 52].
Генетическая дифференциация и миграция
В целом, большинство пар участков отбора проб были значительно дифференцированы, несмотря на географическое разделение всего на ~ 13 км (Таблица 3), и была общая картина изоляции по расстоянию (Рис. 3B). Однако не было модели изоляции по расстоянию в генетических кластерах, и каждый регион, по-видимому, имел уникальные образцы генетической связи. На юго-западе наблюдалась удивительно высокая генетическая дифференциация на небольших географических расстояниях с парами участков, разделенными всего 13.2 км (NBS и FGT), 13,9 км (GVR и MRT) и 14,4 км (MRT и MRB) показали очень значимую генетическую дифференциацию со значениями FST ~ 0,1 (Таблица 3). И наоборот, среди участков, расположенных в центре юго-запада, был низкий уровень генетической дифференциации. Это указывает на высокую дифференциацию в северной части экосистемы Серенгети и низкую генетическую дифференциацию в центральном регионе экосистемы Серенгети независимо от географического расстояния. Низкая генетическая дифференциация в центральном регионе Серенгети может быть вызвана связностью мест обитания во время сезона дождей, что может способствовать расселению мух и, следовательно, потоку генов через несколько поколений [96–99].
На востоке наблюдались высокие уровни генетической связи даже на расстояниях более 300 км, при этом значения F ST варьировались от минимума 0,003 между HND и KIB, разделенными на 317,4 км, до максимума 0,024 между TSW и HND. разделены 303,6 км (таблица 3). Восток имел лишь немного более высокие оценки F ST , чем юго-запад (0,067 против 0,040), и это было на гораздо больших средних географических расстояниях (110,6 км против 282,2 км; Рис. 3; Таблица 3).Это подразумевает большую генетическую связанность в целом на востоке (Таблица 3), что согласуется с большим генетическим разнообразием (Таблица 1) и более высокими темпами миграции (Рисунок 4), обе модели отмечены в предыдущих исследованиях [26] [98]. Примечательно, что наблюдалась удивительно низкая генетическая дифференциация на больших географических расстояниях (рис.1) среди участков в бассейне реки Ати-Галана-Сабики, разделенных 74 км (KIB и TSW), и участков в бассейне реки Тана, разделенных расстоянием 389,5 км (HND и МНП; таблица 3). Эти низкие уровни генетической дифференциации подразумевают G . pallidipes Поток генов высок в бассейне реки Ати-Галана-Сабаки и между бассейнами рек Тана и Ати-Галана-Сабаки, и подчеркивает потенциально важную роль бассейнов крупных рек в формировании моделей потока генов в G . паллидипес .
Высокая генетическая взаимосвязь на востоке, особенно между участками в бассейнах рек, может отражать экологию региона и / или антропогенную историю региона. С экологической точки зрения высокая связанность может быть обусловлена низкими сезонными колебаниями в доступности воды в прибрежных лесных средах обитания, что позволяет поддерживать более высокую плотность населения.Это подтверждается оценками N и и результатами ABC, которые указывают на более крупные размеры популяции на востоке и более постоянный размер популяции на протяжении всей эволюционной истории. Кроме того, связь мест обитания в речных бассейнах, которые на востоке больше, чем на западе, и с другими G . pallidipes популяций, которые существуют в непрерывном распределении от северо-востока Танзании до юга Сомали [100–102], оба могут способствовать более стабильным размерам популяций, более высокой генетической связности и более высокому генетическому разнообразию на востоке, чем на северо-западе и юго-западе.Что касается антропогенного прошлого, более низкие уровни урбанизации, плотности поголовья скота и риска болезней HAT в восточной части Кении [4–6] привели к более низкому уровню изменения среды обитания и деятельности по борьбе с переносчиками, что, возможно, способствовало более постоянным и стабильным популяциям мухи цеце, и может помочь объяснить более высокое генетическое разнообразие на востоке.
История населения смоделирована ABC
Результаты анализа ABC было трудно интерпретировать из-за высокой ошибки прогноза ~ 0.7 в анализе, предназначенном для различения модели предков (Анализ 1: Таблица S3) и несогласованности в оценках параметров в анализе, предназначенном для уточнения оценок размера популяции и времени разделения популяции (Анализ 2: S7 Рис).
Тем не менее, в результате анализа мтДНК были выявлены некоторые закономерности, которые показали минимальное расхождение между северо-западом и юго-западом, глубокое расхождение между востоком и западом и колебания численности населения на северо-западе и юго-западе.Выигрышные сценарии в Анализе 2 всегда включали G . pallidipes колебания численности популяции на северо-западе и юго-западе в течение последнего столетия (таблица S3) и незначительное расхождение между северо-западом и юго-западом (S7 рис). Это предполагает, что генетический разрыв между северо-западом и юго-западом, возможно, представляет собой изоляцию расстоянием через географический разрыв в выборке. Сигнал о генетическом разрыве мог быть усилен недавними колебаниями численности популяции в этих регионах, которые увеличили бы различия в частотах генотипов и неравновесие Харди-Вайнберга между выборками из двух регионов [35,36].Напротив, результаты ABC предполагают время глубокой дивергенции порядка миллионов лет между востоком и западом (S7 Рис). Это открывает возможность существования репродуктивных барьеров между этими двумя генетическими кластерами, но это должно быть подтверждено дальнейшими исследованиями, которые предоставят доказательства дивергенции за пределами изоляции расстоянием. Существование репродуктивных барьеров будет означать, что даже когда мухи мигрируют между востоком и западом, как обнаружено в нашем анализе миграции (рис.4), репродуктивный успех у мигрирующих особей будет низким и будет представлять низкий риск увеличения популяции или внедрения Роман G . pallidipes генетическая изменчивость в принимающей популяции.
Если возраст расхождения составляет миллион лет, репродуктивные барьеры могли накапливаться. Репродуктивные барьеры снизят риск увеличения популяции за счет популяций из соседнего генетического кластера. Однако это не устранило бы угрозу восстановления после локального уничтожения популяций из соседних генетических кластеров, если бы экологические потребности вторгшейся популяции были удовлетворены. В будущих исследованиях следует оценить уровни скрещивания между тремя генетическими кластерами и охарактеризовать любые репродуктивные барьеры, которые могут существовать, чтобы определить уровень угрозы, создаваемой повторным вторжением через границы между генетическими кластерами.
Выводы и рекомендации по эффективным стратегиям борьбы с переносчиками инфекции
Наши результаты позволяют понять уровни и закономерности генетического разнообразия, дифференциации, потока генов и популяционной динамики внутри и внутри G . pallidipes популяций, отобранных в западной и прибрежной Кении, а также в экосистеме Серенгети в Танзании. Результаты нескольких анализов показывают, что во всем диапазоне существует неслучайное спаривание, и что G . pallidipes популяций разделены на три кластера (северо-запад, юго-запад и восток), с G . pallidipes генотипов соответствуют ожиданиям равновесия Харди-Вайнберга только при разделении на эти три группы. Наряду со значительной дифференциацией популяций на разных уровнях и отсутствием изоляции по расстоянию внутри генетических кластеров эти результаты предполагают, что основная динамика популяций, такая как плотность популяции, расстояние среднего расселения и динамика передачи болезней, будет уникальной для каждого генетического кластера.Даже если генетический разрыв между северо-западом и юго-западом был вызван изоляцией расстоянием, а не географическим барьером, эти регионы экологически и эпидемиологически различаются из-за статуса сохранности экосистемы Серенгети (т. Е. Присутствуют разные крупные млекопитающие, характер выпаса скота , и коэффициенты посещений людей), поэтому во время кампаний по борьбе с мухой цеце к ним следует относиться иначе.
Используя рекомендованную KENTTEC терминологию, эти результаты показывают, что пояс мухи цеце озера Виктория и мухой пояс Нарок-Каджиадо находятся в отдельных генетических кластерах, но что три пояса мухи цеце на востоке (мухобойка Мбере-Меру, мухой пояс Центральной Кении, и прибрежный пояс мух) имеют высокую генетическую связь в G . pallidipes и следует рассматривать как одиночный G . pallidipes жителей. Результаты предполагают, что в восточной части Кении для всех трех ремней безопасности KENTTEC (прибрежные ремни, ремни Mbeere-Meru и Central Kenya) G . Искоренение pallidipes , вероятно, никогда не будет осуществимым, и это подавление, а не искоренение, было бы более реалистичной целью. Результаты также указывают на свидетельства нечастой миграции между кластерами, которая может представлять угрозу повторного заражения после локального искоренения, если оно будет успешным на северо-западе или юго-западе.
N e оценки и результаты ABC показали, что северо-запад и юго-запад недавно пережили сокращение численности популяции и в настоящее время имеют более низкий N e и меньшую генетическую изменчивость, чем популяции на востоке. Результаты также показали относительно небольшой N e (<100) в подмножестве G . pallidipes (KAP на северо-западе, IKR, MRB, GTR и MSN на юго-западе, KIB и MNP на востоке), что позволяет предположить, что новые методы борьбы с переносчиками могут быть применимы в этих регионах.На моделях передачи болезней есть свидетельства того, что новые методы контроля, такие как затопление и замена естественных популяций стерильными самцами или генетически / эндосимбионтно-модифицированными мухами (например, замена искусственно отобранными индивидуумами с низкой переносчиками, как предложено Пауэллом и Табачником [103], или замена мух модифицированными эндосимбионтами, как предлагает Аксой ([46]), более эффективны в небольших популяциях [46, 103]. С другой стороны, маленький N и предполагает локализованное расселение и размножение и означает, что генетическая модификация потребует многих локальные выбросы, нацеленные на пространственно разделенные популяции на большей целевой территории [103].Таким образом, успешная замена может быть осуществима только в подмножестве популяций с небольшими N и , которые также распределены по небольшой географической области, такой как население на северо-западе (то есть в регионе RUM).
Взятые вместе, результаты показывают, что модели динамики передачи должны рассматривать отдельно северо-запад, юго-запад и восток, а стратегии борьбы с мухой цеце должны разрабатываться как скоординированные усилия для каждого генетического кластера. В частности, искоренение, вероятно, никогда не будет осуществимо в восточной части Кении для всех трех ремней безопасности, используемых по терминологии KENTTEC (прибрежные ремни, ремни безопасности Мбере-Меру и Центральной Кении), в то время как есть потенциал для успеха новых методов борьбы с переносчиками болезней, которые требуют затопления и замены естественных популяций в географически изолированных популяциях с маленькими N и , например, на северо-западе.Кроме того, наши данные показывают, что нечастые события миграции на большие расстояния действительно происходят даже между отдельными популяциями, разделенными более чем на 200 км (рис.4), что подчеркивает необходимость активного мониторинга движения мух для минимизации риска увеличения соседних популяций и восстановления после успешного местное искоренение. Необходимы дальнейшие исследования для изучения репродуктивных барьеров среди генетических кластеров, чтобы определить риск субсидирования и / или замены населения после мер контроля.Аналогичным образом, необходимы дальнейшие исследования по изучению распределений популяций с маленькими N и с помощью пространственного моделирования для выявления изолированных популяций, в которых можно тестировать и развивать новые методы контроля, такие как генетически модифицирующие популяции переносчиков. Наконец, необходимы дальнейшие исследования для определения моделей демографической и генетической взаимосвязанности на северо-западе, поскольку у нас была редкая выборка в этом регионе, и результаты показали уникальную взаимосвязь населения, генетические вариации и демографические модели.
Вспомогательная информация
S1 Рис. Сценарии конкуренции, рассматриваемые в моделях ABC истории популяции.
Альтернативные сценарии (a) без колебаний размеров популяции (сценарии 1a, 2a, 3a, 4a), рассмотренные в Анализе 1, предназначенном для определения наиболее вероятной наследственной линии, и (b) с колебаниями численности населения на северо-западе и юго-запад (сценарии 1b, 2b, 3b, 4b), рассмотренные в Анализе 2 для дальнейшего уточнения оценок времени и N e для каждого из генетических кластеров.Приоры были основаны на опубликованных оценках и геологических данных (таблица S3).
https://doi.org/10.1371/journal.pntd.0007855.s001
(DOCX)
S2 Рис. Анализ основных компонентов генетической изменчивости.
Результаты анализа основных компонентов, проведенного с помощью пакета «adegenet» v2.1.1 (Jombart et al., 2018) в R Studio v1.1.383, показывающие дисперсию, обнаруженную в трех основных компонентах, которые отображают разделение между обнаруженными основными кластерами в БАПС v 6 [55,56].Этими тремя компонентами были PC 1, 2 и 4, и они объясняли 4,02%, 3,13% и 2,08% дисперсии микросателлитных генотипов соответственно. Отдельные лица представлены точками, цветными кластерами которых соответствуют S1 Fig (северо-запад = оранжевый, юго-запад = синий, восток = фиолетовый, кластер выбросов = желтый, а смешанные особи = серый).
https://doi.org/10.1371/journal.pntd.0007855.s002
(DOCX)
S3 Рис. СТРУКТУРА результатов.
СТРУКТУРА результатов для K = 1–10. Каждая полоса представляет собой одну муху с пропорцией цветов, представляющих байесовскую вероятность присвоения (q-значение) индивидуума.Черные линии отделяют места отбора проб.
https://doi.org/10.1371/journal.pntd.0007855.s003
(DOCX)
S4 Рис. Дискриминантный анализ главного компонента (DAPC).
DAPC на основе G . pallidipes микроспутниковые данные для 21 участка отбора проб, завершенные в R (основная группа разработчиков R) с использованием пакета «adegenet» [63] с 40 основными компонентами. Индивидуумы представлены точками, соединенными линией с центроидом и охвачены 95% доверительным интервалом.Цвета представляют принадлежность к генетическому кластеру из анализа BAPS v 6 [55,56] (оранжевый = северо-запад, синий = юго-запад, фиолетовый = восток). Собственные значения PCA представляют собой дисперсию, объясняемую основными компонентами, при этом компоненты, включенные в анализ, заштрихованы темно-серым цветом.
https://doi.org/10.1371/journal.pntd.0007855.s004
(DOCX)
S5 Рис. Сеть гаплотипов последовательностей митохондриальной ДНК.
Сеть гаплотипов TCS, где гаплотипы представлены кружками, размер которых пропорционален частоте и заштрихован генетическим кластером, который они были выбраны для представления в анализе ABC.Хеши вдоль ветвей сети представляют собой одно нуклеотидное изменение (одну предполагаемую мутацию), а черные точки представляют собой не выбранные гаплотипы.
https://doi.org/10.1371/journal.pntd.0007855.s005
(DOCX)
S6 Рис. Анализ достоверности результатов ABC.
Анализ основных компонентов (PCA) из (a) мтДНК при сценариях без колебаний размера популяции (сценарии 1a, 2a, 3a, 4a), (b) Результаты на основе мтДНК при сценариях с колеблющимся размером популяции (сценарии 1b, 2b, 3b, 4b), (c) результатов на основе микроспутников при сценариях без колебаний численности населения (сценарии 1a, 2a, 3a, 4a), (b) результаты на основе микроспутников при сценариях с колебаниями численности населения (сценарии 1b, 2б, 3б, 4б).Результаты различных сценариев окрашены, как указано в легенде. ABC-анализ проводился в программе DIYABC v2.0.4 [74].
https://doi.org/10.1371/journal.pntd.0007855.s006
(DOCX)
S7 Рис. Оценки параметров из анализа ABC.
Режим DIYABC v2.0.4 [74] оценок параметров из выигрышных сценариев анализа 2 (сценарии 1b, 2b, 3b, 4b) зеленым, красным, синим и розовым цветом соответственно, включая оценки (a ) размер популяции из анализа мтДНК (b) временные рамки смоделированных событий из анализа мтДНК, (c) размер популяции из микросателлитного анализа и (d) временные рамки смоделированных событий из микросателлитного анализа, нанесенные на график на шкала журнала, чтобы все оценки были видны на одном изображении.Оценки численности популяции представлены для северо-запада после «узкого места» (NW b ), юго-запада после «узкого места» (SW b ), предкового северо-запада (NW), предкового юго-запада (SW) и востока (E). . Расчетные сроки представлены для даты возникновения узкого места на северо-западе (db NW ), даты узкого места на юго-западе (db SW ), распределения населения между северо-западом и юго-западом (t1) и разделения населения между запад и восток (t2).
https://doi.org/10.1371/journal.pntd.0007855.s007
(DOCX)
S1 Таблица. Четырнадцать участков отбора проб в Кении, где мухи цеце не были пойманы во время исследования.
Название участка, идентификатор участка, округ, широта, долгота и данные выборки из 14 мест, где не было мух во время полевых сборов, несмотря на прошлые записи сбора, которые указывали на присутствие G . паллидипес .
https://doi.org/10.1371/journal.pntd.0007855.s008
(DOCX)
S2 Стол. Информация о микросателлитных локусах, используемых в анализах.
В таблице показаны названия локусов в первом столбце, за которыми следует флуоресцентный краситель, используемый для каждого локуса, последовательности ДНК прямого и обратного праймеров, диапазон размеров аллелей в парах оснований (п.о.), длина повторяющегося мотива в парах оснований и ссылки на публикацию для грунтовочный дизайн.
https://doi.org/10.1371/journal.pntd.0007855.s009
(DOCX)
S3 Таблица. Априорные ABC и апостериорные вероятности конкурирующих сценариев.
Моделирование ABC было выполнено с помощью DIYABC v2.0.4 [74]. Панель (a) отображает предыдущие минимальные (минимальные) и максимальные (максимальные) значения априорных значений, используемых в моделировании, и сценарии, к которым эти априорные значения применялись. На панели (b), и (c) показаны результаты ABC-анализов на основе мтДНК и микросателлитов, соответственно. Отображаемые результаты включают относительную апостериорную вероятность сценария, протестированного с использованием метода взвешенной логистической регрессии, описанного в [70], нижний 95% доверительный интервал апостериорной вероятности (ДИ), верхний ДИ и апостериорную ошибку прогноза (частота принятия сценарий, отличный от истинного сценария в 1000 прогонов проверки модели с смоделированными данными).Все временные априорные значения (t1, t2) и время возникновения узких мест отображаются в годах, предполагая, что время генерации составляет 5 в год.
https://doi.org/10.1371/journal.pntd.0007855.s010
(DOCX)
S5 Таблица. Результаты попарных тестов для LD, оцененных с использованием
Genepop v4.6 [41], показывающие распределение хи-квадрат (χ2) на пару локусов, степени свободы (df) и исходные p-значения для теста значимости и p-значений после поправки Бенджамини-Хохберга для множественного тестирования.https://doi.org/10.1371/journal.pntd.0007855.s012
(DOCX)
S6 Таблица. Сводная статистика с подмножеством данных без близкородственных особей из каждого участка, количество оставшихся образцов (N), среднее аллельное богатство по локусам (AR), наблюдаемая (HO) и ожидаемая гетерозиготность (HE), коэффициент инбридинга (FIS), и p-значения FIS.
https://doi.org/10.1371/journal.pntd.0007855.s013
(DOCX)
S7 Таблица. Индивидуальные отнесения к генетическим кластерам.
Вероятность отнесения (q-значение) индивидуумов к каждому из четырех кластеров, определенных в BAPS v 6 [55,56]. Смешанные лица (вероятность отнесения к какому-либо кластеру <0,9) и лица, отнесенные к кластеру выбросов, выделены жирным шрифтом.
https://doi.org/10.1371/journal.pntd.0007855.s014
(DOCX)
S8 Таблица. Генетическая и географическая дистанция межкластерных пар.
В этой таблице показано (a) парных генетических различий (F ST ) и (b) географических расстояний (в км) между парами, которые не были включены в Таблицу 3 в основном тексте.Попарный F ST был вычислен в Arlequin [44] на основе Weir and Cockerham 1984 [65]. Значимые значения (p> 0,05) выделены жирным шрифтом.
https://doi.org/10.1371/journal.pntd.0007855.s015
(DOCX)
S9 Таблица. Мигранты первого поколения среди участков отбора проб.
Домашний сайт, идентификатор образца, пол мигранта, предполагаемое происхождение мигранта и p-значение теста мигрантов, обнаруженных с помощью GENECLASS [70] (a) в пределах юго-запада, (b) в пределах восток, (c) между северо-западом и юго-западом и (d) между юго-западом и востоком.Незначительные после поправки Бенджамини-Хохберга для множественного тестирования (скорректированное значение p = 0,0308) отмечены *.
https://doi.org/10.1371/journal.pntd.0007855.s016
(DOCX)
S1 Файл. Правила биннинга, используемые в программе GENEMARKER v2.4.0 (Soft Genetics, США).
Мы настоятельно предупреждаем, что эти правила могут быть действительны только для амплификаций ПЦР и определения генотипов, сделанных с образцами, обработанными на одном и том же термоциклере Mastercycler Pro (Eppendorf, Германия) и автоматическом секвенсоре ABI 3730xL (Life Technologies, США) в Центре анализа ДНК на Science Hill в Йельском университете (http: // dna-analysis.yale.edu/). Вместо того, чтобы полагаться на эти правила биннинга, мы рекомендуем исследователям запрашивать и использовать ДНК у одних и тех же людей в качестве контрольных образцов для калибровки будущих исследований, проводимых на другом оборудовании.
https://doi.org/10.1371/journal.pntd.0007855.s017
(TXT)
S2 Файл. Подробные методы и результаты приближенных байесовских вычислений (ABC).
Описываются методы секвенирования митохондриальной ДНК для анализа ABC и используемые сценарии ABC.Приведены основные результаты митохондриальных данных и ABC-анализа.
https://doi.org/10.1371/journal.pntd.0007855.s018
(DOCX)
S3 Файл. Подробная информация о последовательности митохондриальной ДНК на основе результатов приблизительного байесовского вычисления (ABC).
DIYABC v2.0.4 [74] вывод для анализа на основе мтДНК из (a) Анализ 1, сравнивающий сценарии 1a, 2a, 3a и 4a, (b) Анализ 2, сравнивающий сценарии 1a и 1b, ( c) Анализ 2, сравнивающий сценарии 2a и 2b, (d) Анализ 2, сравнивающий сценарии 3a и 3b, и (e) Анализ 2, сравнивающий сценарии 4a и 4b.Выходные данные включают предварительную проверку, апостериорное сравнение вероятностей сценариев и оценку параметров. Подробная информация о сценариях представлена на S1 Рис.
.https://doi.org/10.1371/journal.pntd.0007855.s019
(TXT)
S4 Файл. Подробная информация о результатах приближенных байесовских вычислений (ABC) на основе микроспутников.
DIYABC v2.0.4 [74] вывод для микроспутникового анализа из (a) Анализ 1, сравнивающий сценарии 1a, 2a, 3a и 4a, (b) Анализ 2, сравнивающий сценарии 1a и 1b, ( c) Анализ 2, сравнивающий сценарии 2a и 2b, (d) Анализ 2, сравнивающий сценарии 3a и 3b, и (e) Анализ 2, сравнивающий сценарии 4a и 4b.Выходные данные включают предварительную проверку, апостериорное сравнение вероятностей сценариев и оценку параметров. Подробная информация о сценариях представлена на S1 Рис.
.https://doi.org/10.1371/journal.pntd.0007855.s020
(TXT)
Механизм отталкивания между нейронами управляет структурой мозга мух — ScienceDaily
Исследователи из Университета Канадзавы сообщают в Nature Communications об открытии, что в развивающемся мозге мухи нейроны, происходящие из одной и той же родительской клетки, испытывают отталкивание.Это зависящее от клонов отталкивание регулируется белком, известным как Dscam1.
Структура мозга имеет столбчатые черты, которые, как предполагается, возникают из нервных клеток (нейронов), происходящих из одной и той же родительской клетки, первоначально образующих радиальные единицы. Однако как именно этот процесс протекает на молекулярном уровне, остается невыясненным. Макото Сато и его коллеги из Университета Канадзавы сделали важный вывод о том, как в мозге мухи ген, известный как Dscam, регулирует то, как нейроны одной линии отталкиваются друг от друга и проецируют свои аксоны на разные столбцы.(Аксоны или нервные волокна представляют собой длинные выступы нервных клеток, функция которых заключается в передаче электрических сигналов.) Это открытие подтверждает «гипотезу радиальных единиц», при этом задействованным механизмом является зависящее от клонов отталкивание между сестринскими нейронами.
Сначала исследователи изучили эволюцию роста нейронов в мозговом веществе, части зрительной системы мухи, имеющей столбчатую структуру. Его развитие аналогично развитию коры больших полушарий в головном мозге млекопитающих; он включает нейробласты (нервные стволовые клетки), которые продуцируют радиально ориентированные и клонально связанные группы нейронов.Сато и его коллеги записали расстояния между сестринскими нейронами (т.е. нейронами, происходящими из одного нейробласта и образующими радиальную единицу) и между парами аксонов. Из полученных данных о расстоянии ученые смогли сделать вывод, что сестринские нейроны часто отталкиваются друг от друга — это наблюдение согласуется с образованием столбцов. Сато и его коллеги называют этот процесс «зависимым от происхождения отталкиванием».
Механизм, обеспечивающий зависящее от клонов отталкивание, должен лежать в дочерних нейронах, происходящих из одного и того же нейробласта, «помня» идентичность своего общего материнского нейробласта.Сато и его коллеги выдвинули объяснение, что в этом участвует белок Dscam1. Dscam1 может развить около 20000 вариантов, но когда две идентичные молекулы Dscam1 связываются, они приводят к сигналу отталкивания, который, как известно, контролирует самопроизвольное избегание в определенных дендритных процессах — дендриты являются ветвями нервных клеток. Обоснование этого состоит в том, что дочерние нейроны, происходящие из одного и того же нейробласта, производят один и тот же вариант Dscam1 и поэтому отталкиваются друг от друга, тогда как нейроны разных клонов экспрессируют разные варианты Dscam1, которые не отталкиваются друг от друга и могут проецироваться в один и тот же столбец.
Ученые смогли подтвердить свою аргументацию серией экспериментов, подтверждающих связь между Dscam1 и зависимым от происхождения отталкиванием. Сато и его коллеги отмечают, что «предлагаемый нами механизм … очень прост», и добавляют, что «будет интересно определить, существуют ли подобные механизмы в других биологических системах, включая формирование столбцов в мозге млекопитающих».
Фон
Гипотеза радиальных единиц
Гипотеза радиальной единицы — это теория, описывающая развитие коры головного мозга.(Кора головного мозга — это внешний слой нервной ткани большей части человеческого мозга. Она играет важную роль в таких функциях мозга, как восприятие, мышление, память, язык и сознание.) Гипотеза утверждает, что на ранних стадиях развития В процессе развития кора головного мозга формируется как совокупность взаимодействующих «столбцов» или «радиальных единиц», каждая из которых происходит из слоя стволовых клеток, содержащего нервные стволовые клетки. Макото Сато и его коллеги из Университета Канадзавы теперь представляют результаты, показывающие, что в мозге мух нейроны одной линии проецируют свои аксоны на разные столбцы, и что этот механизм регулируется геном Dscam (молекула клеточной адгезии с синдромом Дауна).
Dscam1
Ген Dscam1 мухи Drosophila кодирует более 19 000 вариантов («изоформ»). Связывание Dscam1 с идентичными изоформами приводит к отталкивающему сигналу, который важен для определенных механизмов самозащиты внутри клеток. Сато и его коллеги показали, что у личинок мух Dscam1 экспрессируется в нейробластах и, следовательно, наследуется нейронами того же происхождения. Это приводит к зависимому от клонов отталкиванию между нейронами в радиальных единицах, которое затем играет важную роль в развитии столбчатой структуры мозгового вещества мух.
История Источник:
Материалы предоставлены Университетом Канадзавы . Примечание. Содержимое можно редактировать по стилю и длине.
Управление лесным хозяйством влияет на структуру сообщества журавлей (Tipuloidea) из-за изменений почвенных условий
Основные моменты
- •
Отказ от ведения лесного хозяйства увеличивает численность и богатство журавлей.
- •
Управление лесным хозяйством влияет на видовой состав журавлей.
- •
Эдафические факторы сильно влияют на структуру сообщества.
- •
Управление лесным хозяйством влияет на влажность почвы, что вызывает реакцию сообщества.
Реферат
Прекращение ведения лесного хозяйства считается полезным для широкого круга таксонов, но доказательства отсутствуют для многих видов, особенно таксонов, обитающих в почве. Мы исследовали влияние лесопользования на структуру и состав сообщества журавлей (Tipuloidea) на семи участках леса в восточной части Дании.Журавлиных мух собирали вместе с почвенными и структурными переменными в управляемых и неуправляемых стендах с использованием попарного экспериментального плана. Видовое богатство журавлей было значительно выше в неуправляемых насаждениях, в том числе при исключении сапроксильных видов. Влага, азот и pH почвы оказали сильное положительное влияние на видовое богатство, и наблюдаемые различия между режимами управления в основном объяснялись влажностью почвы. Точно так же численность была значительно выше в неуправляемых насаждениях и была положительно связана с влажностью и pH почвы.Видовой состав управляемых и неуправляемых насаждений существенно различается на четырех из семи участков. Управление имело небольшое, но значительное влияние на видовой состав в большом географическом масштабе, в то время как географическое положение участка имело большее влияние. Основываясь на наших выводах, мы рекомендуем в будущем при обозначении неуправляемых лесных участков учитывать почвенные условия, а также географическое положение.


 Составляют сложную систему, которая была взята за основу разработки современной фото камеры. Состоят из множества простых глазков, что выглядят снаружи, как фасеточная сеточка. Насекомое получает всестороннее, но мозаичное изображение объектов. Каждый глаз включает несколько сотен, тысяч фасеток. У комнатной мухи их около 4 тыс. У многих видов имеется 3 простых глазка, расположенных на темени. Такое строение позволяет моментально улавливать движение, но не дает полной картины изображения.
Составляют сложную систему, которая была взята за основу разработки современной фото камеры. Состоят из множества простых глазков, что выглядят снаружи, как фасеточная сеточка. Насекомое получает всестороннее, но мозаичное изображение объектов. Каждый глаз включает несколько сотен, тысяч фасеток. У комнатной мухи их около 4 тыс. У многих видов имеется 3 простых глазка, расположенных на темени. Такое строение позволяет моментально улавливать движение, но не дает полной картины изображения.