Распространённость химических элементов в природе
Распространённость химических элементов в природе
Из химических элементов наиболее распространены в Земной коре Кислород и Кремний.
Эти элементы вместе с Алюминием, Железом, Кальцием, Натрием, Калием, Магнием, Водородом и Титаном составляют более 99% массы всей земной оболочки.
Так что на остальные элементы приходится чуть менее 1%.
В морской воде которая занимает более 2/3 суши, помимо Кислорода и Водорода — составных частей самой воды, высокое содержание имеют такие элементы, как Хлор, Натрий, Магний, Сера, Калий, Бром и Углерод.
В атмосфере земли так же содержится большое количество химических элементов — но об этом мы поговорим в одной из следующих статей.
Массовое содержание определённого элемента в земной коре называется кларковым числом или (Кларком Элемента).
Содержание элементов в коре Земли отличается от содержания элементов в Земле, взятой как целое, поскольку хим составы коры, мантии и ядра Земли различны. При этом залегание скоплений элементов преимущественно расположено слоями.
Так, ядро земли состоит в основном из железа и никеля, благодаря чему у нашей планеты есть магнитное поле без которого не возможно было бы зарождение жизни на планете.
В свою очередь, содержания элементов в нашей Солнечной системе и в целом во Вселенной также отличаются от земных.
Наиболее распространённым элементом во Вселенной является Водород, за ним идёт Гелий.
Исследования распространённостей химических элементов и их изотопов в космосе является важным источником информации о процессах нуклеосинтеза и об эволюции Солнечной системы и небесных тел таких как звёзды и планеты.
Большинство химических элементов (94 из известных 118) были найдены в природе в земле, а точнее в земной коре, хотя некоторые из них были изначально получены искусственно например: технеций Tc (порядковый номер 43), прометий Pm (61), астат At (85), а также трансурановые нептуний Np (93) и плутоний Pu (94).
Эти пять элементов после их искусственного создания были в исчезающе малых количествах обнаружены и в земной коре.
Они возникают как промежуточные ядра при радиоактивном распаде Урана и Тория, а также при захвате Ураном нейтронов и последующем бета распаде.
Таким образом, в Земной коре наличествуют (в очень разных концентрациях) все первые 94 элемента таблицы Менделеева.
(Таблицу Менделеева в школе наверно все изучали?!)
Среди этих 94 химических элементов, обнаруженных в земной коре, большинство а точнее 83, является первичными, или примордиальными. Они возникли при нуклеосинтезе в Галактике до образования Солнечной системы, и у этих элементов есть изотопы, которые являются либо стабильными, либо достаточно долгоживущими, чтобы не распасться за прошедшие с этого момента 4,5 млрд лет.
Остальные 11 природных элементов (Технеций, Прометий, Полоний, Астат, Радон, Франций, Радий, Актиний, Протактиний, Нептуний и Плутоний) являются радиогенными — они не имеют настолько долгоживущих изотопов, поэтому все существующие в земной коре природные атомы этих элементов возникли при радиоактивном распаде других химических элементов.
Все химические элементы, следующие после Плутония Pu в периодической системе Дмитрия Ивановича Менделеева, в земной коре полностью отсутствуют, хотя некоторые из них могут образовываться в космосе во время взрывов сверхновых и в месте с метеоритами попадать на землю.
Периоды полураспада всех известных изотопов этих элементов малы по сравнению с временем существования Земли. Многолетние поиски гипотетических природных сверхтяжёлых элементов пока не дали никаких результатов.
Большинство химических элементов, кроме нескольких самых лёгких, возникли во Вселенной главным образом в ходе звёздного нуклеосинтеза (элементы до Железа — в результате термоядерного синтеза, более тяжёлые элементы — при последовательном захвате нейтронов ядрами атомов и последующем бета распаде, а также в ряде других ядерных реакций).
Легчайшие элементы Водород и Гелий — почти полностью, Литий, Бериллий и Бор — частично образовались в первые три минуты после Большого взрыва (первичный нуклеосинтез), когда всё только началось.
Одним из главных источников особо тяжёлых элементов во Вселенной должны быть, согласно расчётам учёных, слияния нейтронных звёзд, с выбросом значительных количеств этих элементов, которые впоследствии участвуют в образовании новых звёзд, галактик и их планет.
А в нашей повседневной жизни все эти элементы присутствуют постоянно и помогают нам комфортно жить, из них сделана наша одежда и обувь, наши машины и дома, наша пища и что уж говорить и Мы сами состоим полностью из химических элементов.
Распространенность элементов в космосе — Справочник химика 21
Из данных, которыми мы сейчас располагаем, видно, что самый распространенный элемент в космосе — водород, который составляет основную массу вещества звезд, космических лучей и некоторых планет. Второе место занимает гелий, которого в среднем в десять раз меньше, чем водорода. После гелия на кривой наблюдается резкий спад, соответствующий распространенности изотопов лития, бериллия и бора. Среднее суммарное содержание этих элементов в солнечной системе в 10 раз меньше, чем водорода, и в 300 раз меньше, чем кальция. После этого провала кривая средней распространенности поднимается вверх распространенность изотопов углерода, азота, кислорода и других элементов только в 10 —Ю раз меньше распространенности водорода. Наибольшей распространенностью обладают изотопы С , и О , затем распространенность изотопов медленно уменьшается по мере увеличения их массовых чисел вплоть до скандия, содержание которого очень мало и приближается к содержанию бериллия. После скандия кривая еще раз очень круто поднимается вверх и достигает максимума для железа и соседних с ним элементов.Водород — самый распространенный элемент в космосе.

Столь резкая диспропорция между едва обозримым множеством органических соединений и ничтожным (6—18) количеством составляющих их органогенов, так же как и исключительно дифференцированный отбор того же минимума элементов для построения живых систем, нельзя всецело объяснить факторами различной распространенности элементов в Космосе и на Земле. В Космосе вообще безраздельно господствуют лишь два элемента — водород и гелий, тогда как все остальные элементы можно рассматривать только как примесь к ним.
Распространение в природе. Водород — наиболее распространенный элемент в космосе (звезды, межзвездная среда, туманности, большие планеты — Юпитер, Сатурн), в состав космической материи входит 63 % Н, 36 % Не и 1 % остальных элементов. На Земле водород встречает(у1 главным образом в химически связанном виде (вода, живые организмы, нефть, уголь, минералы) в составе стратосферы имеется частично ионизированный свободный водород. В земной коре до глубины 17 км содержание водорода составляет [c.263]
Самым распространенным элементом в космосе является водород. Он составляет основную массу вещества звезд и некоторых [c.430]
Нахождение в природе. Водород — наиболее распространенный элемент в космосе (в состав космической материи входит 63% Н, 36% Не и 1% остальных элементов).
В.— самый распространенный элемент в космосе. Он преобладает на Солнце и на большинстве звезд, составляя до половины их массы. В. имеет три изотопа про-тий ( H), дейтерий (О или Н), радиоактивный тритий (1 или Н). Атом В. имеет один электрон. Молекула состоит из двух атомов, связанных ковалентной связью. В соединениях В. положительно и отрицательно одновалентен. В.— хороший восстановитель. При обычных условиях малоактивен, непосредственно соединяется лишь с наиболее активными неметаллами (с фтором, а на свету и с хлором). При нагревании В. реагирует со многими элементами. С фтором реакция идет со взрывом, с хлором и с бромом при освещении или нагревании, а с иодом лишь при нагревании. Соединяется с азотом в присутствии катализатора, образуя аммиак. Практическое значение имеют реакции В. с оксидом углерода СО, при которых образуются углеводороды, спирты, альдегиды и т. д. В. непосредственно реагирует со щелочными и щелочноземельными металлами, образуя гидриды (Ма, Н, СаНз и др.). В. применяется для синтеза ЫНз, НС1, производства метанола (исходя из СО), используется для сварки и резки металлов, для гидрогенизации твердого и жидкого топлива, жиров и различных органических соединений и др Дейтерий и тритий используют в атомной промышленности.
РАСПРОСТРАНЕННОСТЬ ЭЛЕМЕНТОВ В КОСМОСЕ [c.9]
Водород — наиболее распространенный элемент в космосе (Солнце, большие планеты Юпитер и Сатурн, звезды, межзвездная среда, туманности), в состав космической материи входит 63% Н, 36% Не и 1% всех остальных элементов. В природе третий по химической распространенности элемент в земной коре (после О и Si), основа гидросферы. В основном встречается в химически связанном виде (вода, живые организмы, нефть, природный уголь, минералы), содержится в верхних слоях атмосферы. [c.151]
[c.151]
Создание любой модели ранней истории Земли возможно только на основе исчерпывающего анализа всех геофизических и геохимических данных о поверхности и глубинных областях Земли, о метеоритах и других телах солнечной системы, а также на основе спектральных данных (добытых с необычайной изобретательностью) о распространенности элементов в космосе. Юри [451 рассмотрел такие данные, полученные до 1952 г., и высказал ряд [c.51]
В свободном состоянии водород в небольших количествах содержится в вулканических и некоторых природных газах. В связанном виде входит в состав воды, бурых каменных углей, нефти, глины, животных и растительных организмов, ряда минералов. Девятый элемент по распространенности в земной коре, самый распространенный элемент в космосе. [c.190]
Сильным сродством к сере обладают халькофильные, а сильным сродством к кислороду — литофильные элементы. Сидерофильные элементы, судя по структуре, стабильны в металлической фазе (гл. 3, разд. 5), и сродство к сере у них больше, чем к кислороду (табл. 5.11 и 5.12). Предполагается, что относительный элементный состав первичной атмосферы был близок к составу космоса. Основным фактором, определяющим относительное распространение элементов в космосе, является скорость ядерных реакций тот факт, что содержание серы составляет около 1/200 от содержания кислорода, связан с невыгодностью образования атомных ядер серы (16 протонов). Если бы в первичной атмосфере было много серы, то сидерофильные элементы с большой вероятностью превратились бы в сульфиды, и поэтому имеется глубокая связь между си-дерофильными и халькофильными элементами. [c.302]
Отправной точкой общей схемы биогенеза, известной теперь под названием гипотезы Холдейна — Опарииа, послужили астрономические и астрофизические данные по распространенности элементов в космосе. Спектральный анализ большого числа астрономических объектов показал, что водород встречается повсеместно и, несомненно, представляет собой наиболее распространенный элемент в космосе [I, 36]. Была показана также повсеместная распространенность в относительно больших количествах углерода, как в различных состояниях ионизации, так и связанного ковалентно с другими элементами. Было обнаружено, например, что звезды и кометы содержат С » , С» , С, С , СН, СН и N» [1]. Если исключить инертный газ гелий, то после водорода самыми распространенными элементами в космосе являются углерод, кислород и азот (см. табл. 7). Углерод, кроме того, и наиболее характерный элемент современных земных ( юрм жизни и вместе с водородом, кислородом и азотом составляет основную массу живого вещества [37]. [c.43]
Была показана также повсеместная распространенность в относительно больших количествах углерода, как в различных состояниях ионизации, так и связанного ковалентно с другими элементами. Было обнаружено, например, что звезды и кометы содержат С » , С» , С, С , СН, СН и N» [1]. Если исключить инертный газ гелий, то после водорода самыми распространенными элементами в космосе являются углерод, кислород и азот (см. табл. 7). Углерод, кроме того, и наиболее характерный элемент современных земных ( юрм жизни и вместе с водородом, кислородом и азотом составляет основную массу живого вещества [37]. [c.43]
Основные положения Юрп сводятся к следующему поскольку водород, несомненно, является самым распространенным элементом в космосе (табл. 7), газовая фаза плаиетезималей, а также примитивной атмосферы полностью сфор.мированной Зе.млн содержала избыток молекулярного водорода. Поэтому если достигалось равновесие, то углерод, азот и кислород должны были восстанавливаться до СН4, МНд и Н О. Молекулярный водород, вероятно, рассеялся в межпланетном пространстве до того, как образовалась Земля ведь, как мы знаем, иа протяжении гипотетической планетезималыюй стадии происходила потеря гораздо более тяжелых газов, таких, как Ме, Хе н Кг. Однако, но оценке Юри, давление водорода на конечной стадии консолидации земной массы составляло но крайней мере 10 атм (в настоящее время 10 атм) [171. Это свое заключение Юри обосновывает целым комплексом данных, в том числе данными о скорости потери На в верхних слоях современной атмосферы, об общем количестве Н2, утерянного на протяжении геологического времени (исходя из парциального давления молекулярного кислорода в настоящее время, причем принимается, что весь этот кислород первоначально находился в виде Н2О), и о состоянии окио/чения С, N и Ре в настоящее время. На вопрос о том, как долго могло существовать такое давление водорода, дать ответ крайне трудно, и это вносит большую долю неопределенности в наши рассуждения о длительности процесса эволюции атмосферы [91. Позже мы еще вернемся к этой фундаментальной проблеме.. [c.120]
Позже мы еще вернемся к этой фундаментальной проблеме.. [c.120]
Возможно, эталонный состав, основанный на распространенности элементов в космосе, был бы более фундаментальным. К сожалению, его нельзя определить, так как сам космос претерпел разделение на различные компоненты, такие, как звезды, межзвездное пространство и планетарные тела, а дать интегральную оценку состава всех этих объектов невозможно. Кроме того, мы хорошо знаем, что относительная распространенность составляющих звездную массу нуклидов меняется в процессе эволюции звезды в результате рождения более тяжелых элементов за счет относительно легких. Нам, таким образом, остается довольствоваться теми значениями распространенности, которые только приближаются к обпдему составу космоса и которые, вероятно, представительны лишь для нашей собственной Солнечной системы. [c.32]
Горение водорода. Мы уже указывали, что водород — наиболее распространенный элемент в космосе . Приблизительно 90% всех нуклидов в веществе звезд составляет водород. Следовательно, разумно принять водород за исходное вещество для образования элементов во внутренних областях звезды. Бер-бидж и др. [42] в своей теории нуклеосинтеза постулировали, что водород был единственным веществом первых звезд, а поэтому требуется изначальная ядерная реакция, в ходе которой за счет водорода образуются более тяжелые нуклиды. Любые такие процессы определяются как горение водорода. [c.40]
Водород – самый распространённый элемент Вселенной
Несмотря на то, что водород является самым распространённым химическим элементом в природе, открыт он был только в 18 веке. В1766 году английский ученый Генри Кавендиш провёл ряд опытов с различными металлами, помещая их в растворы серной и соляной кислот. В результате каждого эксперимента он получал одно и то же легкое газообразное вещество, которое назвал «горючим воздухом». При сжигании «горючий воздух» давал воду. Полученную таким способом воду в 1783 году детально изучил французский химик Антуан Лавуазье, осуществив её анализ, разлагая водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё выделен.
Полученную таким способом воду в 1783 году детально изучил французский химик Антуан Лавуазье, осуществив её анализ, разлагая водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё выделен.
Лавуазье дал полученному газу название hydrogène (др. греч. — рождающий воду). Русский термин «водород» предложил химик Михаил Соловьёв в 1824 году — по аналогии с «кислородом» Ломоносова.
Водород — самый легкий, самый простой и самый распространенный химический элемент во Вселенной, обозначается символом H, занимает клетку № 1 в Таблице Менделеева и имеет относительную атомную массу равную 1. При нормальных условиях это бесцветный газ без вкуса и запаха с формулой H2, который, перемешиваясь с воздухом, горюч и взрывоопасен. В больших количествах он присутствует в туманностях, звездах и планетах класса «газовый гигант».
Во Вселенной на долю водорода приходится около 88% всех атомов (примерно 11 % составляют атомы гелия, доля всех остальных вместе взятых элементов — меньше 1 %).
Таким образом, водород — основная составная часть звёзд и межзвёздного газа. Он играет ключевую роль в реакциях первичного и звёздного нуклеосинтеза, который, в свою очередь, является причиной наблюдаемой распространённости химических элементов.
Особое положение, которое занял водород с момента открытия, привлекало внимание ученых различных направлений. Так, в 1815 году английский химик, врач и религиозный философ Уильям Праут анонимно опубликовал статью, в которой впервые предположил, что все атомы построены из простейшего водорода. Если масса водорода равна 1, то атомные массы всех других элементов должны выражаться целыми числами. Противники гипотезы, в частности Якоб Берцелиус, утверждали, что атомные массы элементов не находятся в целочисленных отношениях по отношению к водороду. Уровень развития техники измерения масс атомов в то время был достаточно высок, поэтому изначально ряду учёных удалось опровергнуть его теорию, так как полученный атомный вес (как тогда говорили) например хлора, был равен 35,5. С открытием изотопов в начале 20 века доказательства некорректности гипотезы Праута, основанные на измерениях атомных масс, оказались также ошибочными — дробный атомный вес хлора был следствием того, что природный хлор является смесью разных изотопов, о существовании которых во времена Праута не знали. И сейчас у этой теории есть сторонники и противники, а в историю науки это научное предположение вошло как «Гипотеза Праута».
Уровень развития техники измерения масс атомов в то время был достаточно высок, поэтому изначально ряду учёных удалось опровергнуть его теорию, так как полученный атомный вес (как тогда говорили) например хлора, был равен 35,5. С открытием изотопов в начале 20 века доказательства некорректности гипотезы Праута, основанные на измерениях атомных масс, оказались также ошибочными — дробный атомный вес хлора был следствием того, что природный хлор является смесью разных изотопов, о существовании которых во времена Праута не знали. И сейчас у этой теории есть сторонники и противники, а в историю науки это научное предположение вошло как «Гипотеза Праута».
По распространённости в земной коре водород стоит на 9 месте со средним содержанием около 1% по массе, находясь там, в основном, в виде соединений. Свободный водород h3 относительно редко встречается в земной коре, но в составе воды он принимает активное участие в геохимических процессах. Основной потребитель водорода — химическая промышленность. Более 50 % мирового выпуска водорода идёт на производство аммиака (Nh4), ещё 10 % используется для производства метанола (Ch4OH). Из этих веществ производят пластмассы, удобрения, взрывчатые вещества и многое другое.
Какого металла больше всего во Вселенной
Самым распространенным химическим элементом на нашей планете является углерод. Но в масштабах Вселенной Земля — лишь песчинка среди бескрайнего моря звезд и галактик. И в связи с этим становится интересным, а из чего состоит наша Вселенная? Что является основой далеких планет и астероидов? Какой элемент периодической таблицы самый главный?
Самый распространенный химический элемент во Вселенной
Если говорить о том, какой элемент самый распространенный во Вселенной, то тут все будет очень просто. На первом месте идет водород, затем гелий, кислород, неон и замыкает пятерку лидеров железо. А теперь давайте подумаем, какой элемент выбивается из общей картины.
Правильно! Железо! Почему? Да потому, что все остальные представители таблицы Менделеева, кроме железа, являются газами. А железо — это металл. Таким образом железо — это самый распространенный металл во всей Вселенной. При этом он и один из самых важных, ведь если газы формируют в основном атмосферу небесных тел, то железо является основой планет. А значит можно сказать, что если бы не было железа, то не было бы и большинства объектов во Вселенной.
Как ученые определили, что железо — самый распространенный металл во Вселенной
По сообщению журнала The Astrophysical Journal, группа астрохимиков из США пришла к такому выводу, рассчитав спектр поглощения кластеров железа. То есть ученые провели спектральный анализ удаленных объектов. Если не вдаваться в подробности, то объяснить это можно следующим образом.
Когда мы что-либо видим, это означает, что от этого объекта отражается свет и мы улавливаем эти световые волны. Свет – это смесь электромагнитных колебаний, и каждое колебание имеет свою длину волны, и, соответственно, свой цвет. Есть 7 основных цветов, а также оттенков и переходов между ними. Когда проводится спектральный анализ, изучается именно то, как химические элементы поглащают или отражают свет. В итоге получается спектрограмма. На основе получившейся картины можно сделать вывод о характеристиках испустившего свет объекта. Простой пример — радуга после дождя. Капли дождя разделяют свет, исходящий от Солнца.
Спектрограмма. 1,4 — спектры натрия, 2,5 — спектры водорода, 3,6 — спектры гелия
Это интересно: Как будет умирать вселенная?
Где находится «космическое железо»
Большая часть железа Вселенной сконцентрирована внутри планет и в межзвездном газе. Кроме того, как показывает новое исследование, не мало железа находится в связи с углеродом, формируя особые молекулы, называемые полиинами. При этом ранее предполагалось, что эти самые полиины — это соединения углерода без примесей железа.
«Атомы железа объединяются в особые соединения с углеродом и основная проблема в том, что эти соединения имеют почти такой же спектр, что и чистые углеводороды. Поэтому ранее мы могли легко их проглядеть», — говорит ведущий автор исследования Фрэнк Тиммес
Хотите узнать что-то новое? Подписывайтесь на наш канал в Яндекс.Дзен. Там регулярно выходят материалы, которых не найти на сайте.
Происхождение нефти, ее состав и основные свойства
Нефтяные месторождения — уникальное хранилище энергии, образованной и накопленной на протяжении миллионов лет в недрах нашей планеты. В этом материале — о том, какой путь проделала нефть, прежде чем там оказаться, из чего она состоит и какими свойствами обладает
Две гипотезы
У ученых до сих пор нет единого мнения о том, как образовалась нефть. Существуют две принципиально разные теории происхождения нефти. Согласно первой — органической, или биогенной, — из останков древних организмов и растений, которые на протяжении миллионов лет осаждались на дне морей или захоронялись в континентальных условиях. Затем перерабатывались сообществами микроорганизмов и преобразовывались под действием температуры и давлений в результате тектонического опускания вглубь недр, формируя богатые органическим веществом нефтематеринские породы.
Необходимые условия для превращения органики в нефть возникают на глубине 1,5–6 км в так называемом нефтяном окне — при температуре от 70 до 190°C. В верхней его части температура недостаточно высока — и нефть получается «тяжелой»: вязкой, густой, с высоким содержанием смол и асфальтенов. Внизу же температура пластов поднимается настолько, что молекулы органического вещества дробятся на самые простые углеводороды — образуется природный газ. Затем под воздействием различных сил, в том числе
градиента
характеризует степень изменения давления в пространстве, в данном случае — в зависимости от глубины пласта
давления, углеводороды мигрируют из нефтематеринского пласта в выше- или нижележащие породы.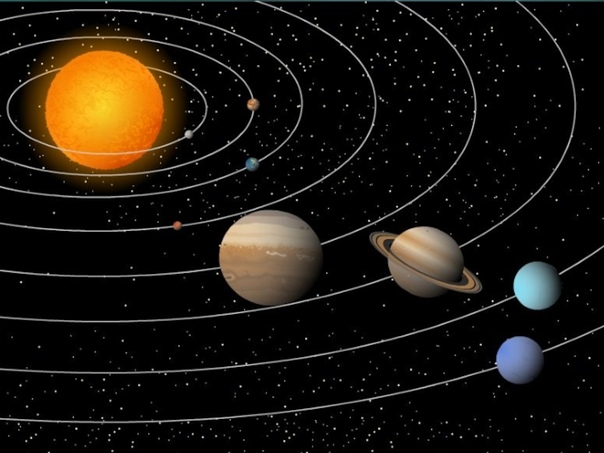
60 млн лет может занимать природный процесс образования нефти из органических останков
Природный процесс образования нефти из органических останков занимает в среднем от 10 до 60 млн лет, но если для органического вещества искусственно создать соответствующий температурный режим, то на его переход в растворимое состояние с образованием всех основных классов углеводородов достаточно часа. Подобные опыты сторонники органической гипотезы толкуют в свою пользу: преобразование органики в нефть налицо. В пользу биогенного происхождения нефти есть и другие аргументы. Так, большинство промышленных скоплений нефти связано с осадочными породами. Мало того — живая материя и нефть сходны по элементному и изотопному составу. В частности, в большинстве нефтяных месторождений обнаруживаются биомаркеры, такие как порфирины — пигменты хлорофилла, широко распространенные в живой природе. Еще более убедительным можно считать совпадение изотопного состава углерода биомаркеров и других углеводородов нефти.
Состав и свойства нефти
ХАРАКТЕРИСТИКИ НЕФТИ МОГУТ ЗНАЧИТЕЛЬНО РАЗЛИЧАТЬСЯ ДЛЯ РАЗНЫХ МЕСТОРОЖДЕНИЙ
Основные химические элементы, из которых состоит нефть: углерод — 83–87%, водород — 12–14% и сера — до 7%. Последняя обычно присутствует в виде сероводорода или меркаптанов, которые могут вызывать коррозию оборудования. Также в нефтях присутствует до 1,7% азота и до 3,5% кислорода в виде разнообразных соединений. В очень небольших количествах в нефтях содержатся редкие металлы (например, V, Ni и др.).
От месторождения к месторождению характеристики и состав нефти могут различаться очень значительно. Ее плотность колеблется от 0,77 до 1,1 г/см³. Чаще всего встречаются нефти с плотностью 0,82–0,92 г/см³.Температура кипения варьирует от 30 до 600°C в зависимости от химического состава. На этом свойстве основана разгонка нефтей на фракции. Вязкость сильно меняется в зависимости от температуры. Поверхностное натяжение может быть различным, но всегда меньше, чем у воды: это свойство используется для вытеснения нефти водой из пор пород-коллекторов.
Поверхностное натяжение может быть различным, но всегда меньше, чем у воды: это свойство используется для вытеснения нефти водой из пор пород-коллекторов.
Большинство ученых сегодня объясняют происхождение нефти биогенной теорией. Однако и неорганики приводят ряд аргументов в пользу своей точки зрения. Есть различные версии возможного неорганического происхождения нефти в недрах земли и других космических тел, но все они опираются на одни и те же факты. Во-первых, многие, хотя и не все месторождения связаны с зонами разломов. Через эти разломы, по мнению сторонников неорганической концепции, нефть и поднимается с больших глубин ближе к поверхности Земли. Во-вторых, месторождения бывают не только в осадочных, но также в магматических и метаморфических горных породах (впрочем, они могли оказаться там и в результате миграции). Кроме того, углеводороды встречаются в веществе, извергающемся из вулканов. Наконец, третий, наиболее весомый аргумент в пользу неорганической теории состоит в том, что углеводороды есть не только на Земле, но и в метеоритах, хвостах комет, в атмосфере других планет и в рассеянном космическом веществе. Так, присутствие метана отмечено на Юпитере, Сатурне, Уране и Нептуне. На Титане, спутнике Сатурна, обнаружены реки и озера, состоящие из смеси метана, этана, пропана, этилена и ацетилена. Если на других планетах Солнечной системы эти вещества могут образовываться без участия биологических объектов, почему это невозможно на Земле?
С точки зрения современных сторонников неорганической, или минеральной, гипотезы, углеводороды образуются из содержащихся в мантии Земли воды и углекислого газа в присутствии закисных соединений металлов на глубинах 100–200 км. Высокое давление в недрах земли препятствует термической деструкции сложных молекул углеводородов. В свою очередь сторонники органики не отрицают, что простые углеводороды, например метан, могут иметь и неорганическое происхождение. Опыты, направленные на подтверждение абиогенной теории, показали, что получаемые углеводороды могут содержать не более пяти атомов углерода, а нефть представляет собой смесь более тяжелых соединений. Этому противоречию объяснений пока нет.
Этому противоречию объяснений пока нет.
Этапы образования нефти
СТАДИИ ОБРАЗОВАНИЯ ОСАДОЧНЫХ ПОРОД И ПРЕОБРАЗОВАНИЯ НЕФТИ
- осадконакопление (седиментогенез) — в процессе накопления осадка остатки живых организмов выпадают на дно водных бассейнов или захороняются в континентальной обстановке;
- биохимическая (диагенез) — происходит уплотнение, обезвоживание осадка и биохимические процессы в условиях ограниченного доступа кислорода;
- протокатагенез — опускание пласта органических остатков на глубину до 1,5–2 км при медленном подъеме температуры и давления;
- мезокатагенез, или главная фаза нефтеобразования (ГФ Н), — опускание пласта органических остатков на глубину до 3–4 км при подъеме температуры до 150°C. При этом органические вещества подвергаются термокаталитической деструкции, в результате чего образуются битуминозные вещества, составляющие основную массу микронефти. Далее происходит «отжим» нефти за счет перепада давления и эмиграционный вынос микронефти в пласты-коллекторы, а по ним — в ловушки;
- апокатагенез керогена, или главная фаза газообразования (ГФГ ), — опускание пласта органических остатков на глубину (как правило, более 4,5 км) при подъеме температуры до 180—250°C. При этом органическое вещество теряет нефтегенерирующий потенциал и генерирует газ.
В ловушке
Помимо чисто научного интереса гипотезы, объясняющие происхождение нефти и газа, имеют еще и политическое звучание. Действительно, раз уж нефть может получаться из неорганических веществ и темпы ее образования не десятки миллионов лет, как предполагает биогенная концепция, а во много тысяч раз выше, значит, проблема скорого исчерпания запасов становится как минимум не столь однозначной. Однако для нефтяников вопрос о том, откуда берется нефть, принципиален скорее с той точки зрения, может ли теория предсказать, где именно нужно искать месторождения. С этой задачей органики справляются лучше.
В сугубо прагматическом отношении для добычи важно знать даже не то, где нефть зародилась, а где она находится сейчас и откуда ее можно извлечь. Дело в том, что в земной коре большая часть нефти не остается в материнской породе, а перемещается и скапливается в особых геологических объектах, называемых ловушками. Даже если предположить, что нефть имеет неорганическое происхождение, ловушки для нее все равно за редким исключением находятся в осадочных бассейнах.
Под действием различных факторов углеводороды отжимаются из нефтематеринских пород в породы-коллекторы, способные вмещать флюиды (нефть, природный газ, воду). Таким образом, нефтяное месторождение — вовсе не подземное «озеро», заполненное жидкостью, а достаточно плотная структура. Коллекторы характеризуются пористостью (долей содержащихся в них пустот) и проницаемостью (способностью пропускать через себя флюид). Для эффективного извлечения нефти из коллектора важно благоприятное сочетание обоих этих параметров.
Типы коллекторов
БОЛЬШАЯ ЧАСТЬ ЗАПАСОВ НЕФТИ СОДЕРЖИТСЯ В ДВУХ ТИПАХ КОЛЛЕКТОРОВ
Терригенные (пески, песчаники, алевролиты, некоторые глинистые породы и др.) состоят из обломков горных пород и минералов. Этот тип коллекторов наиболее распространен: на них приходится 58% мировых запасов нефти и 77% газа. В качестве пустотного пространства, в котором накапливается нефть, в основном выступают поры — свободное пространство между зернами, из которых состоит коллектор.
Карбонатные (в основном известняки и доломиты) занимают второе место по распространенности (42% запасов нефти и 23% газа). Имеют сложную трещиноватую структуру. Нефть обычно содержится в кавернах, появившихся в результате выветривания и вымывания твердой породы, а также в трещинах. Наличие трещин влияет и на фильтрационные свойства коллектора, обеспечивая проводимость жидкости.
Вулканогенные и вулканогенно-осадочные (кислые эффузивы и интрузивы, пемзы, туфы, туфопесчаники и др.) коллекторы отличаются характером пустотного пространства — в основном это трещины, — резкой изменчивостью свойств в пределах месторождений.
Глинисто-кремнисто-битуминозные отличаются значительной изменчивостью состава, неодинаковой обогащенностью органическим веществом. Промышленная нефтеносность глинисто-кремнисто-битуминозных пород установлена в баженовской (Западная Сибирь) и пиленгской (Сахалин) свитах.
Двигаясь по коллектору, флюид в какой-то момент может упереться в непроницаемый для него экран — флюидоупор. Слои такой породы называют покрышками, а вместе с коллектором они формируют ловушки, удерживающие нефть и газ в месторождении. В классическом варианте в верхней части ловушки может присутствовать газ (он легче). Снизу залежь подстилается более плотной, чем нефть, водой.
Классификации ловушек чрезвычайно разнообразны (часть из них см. на рис.). Наиболее простая и с точки зрения геологоразведки, и для дальнейшей добычи — антиклинальная ловушка (сводовое поднятие), перекрытая сверху пластом флюидоупора. Такие ловушки образуются в результате изгибов пластов осадочного чехла. Однако помимо изгибов внутренние пласты претерпевают и множество других деформаций. В результате тектонических движений, например, пластколлектор может деформироваться и потерять свою однородность. В этом случае процессы геологоразведки и добычи оказываются намного сложнее. Еще одна неприятность, которая поджидает нефтяников со стороны ловушек, — замещение проницаемых пород, обладающих хорошими коллекторскими свойствами, например песчаников, непроницаемыми. Такие ловушки называются литологическими.
Антиклиналь
Тектоническая экранированная ловушка
Соляной купол
Стратиграфическая ловушка
Ровесница динозавров
Когда же образовались те структуры, в которых сегодня находят нефть? Основные ее ресурсы сосредоточены в относительно молодых мезозойских и кайнозойских отложениях, сформировавшихся от нескольких десятков млн до 250 млн лет назад. Однако добыча нефти ведется и из палеозойских отложений (до 500 млн лет назад), а в Восточной Сибири — даже из отложений верхнего протерозоя, которым более полумиллиарда лет.
Многочисленные нефтяные месторождения встречаются в отложениях девона (420–360 млн лет назад). В этот период на Земле появились насекомые и земноводные, в морях большого разнообразия достигли рыбы и кораллы. Во время пермского периода (300–250 млн лет назад) климат стал более засушливым, в результате чего высыхали моря и образовывались мощные соляные толщи, ставшие впоследствии идеальными флюидоупорами.
Эпоха господства динозавров — юрский (200–145 млн лет назад) и меловой (145–66 млн лет назад) периоды мезозоя — характеризуется максимальным расцветом жизни и связана с высоким осадконакоплением. Некоторые гигантские и крупные месторождения (Иран, Ирак) нефти находят в отложениях палеогена(66—23 млн лет назад). Известны месторождения нефти в четвертичных породах возрастом менее 2 млн лет (Азербайджан).
Впрочем, связь между возрастом пород-коллекторов и временем образования нефти не прямолинейна. Этот процесс может быть последовательным: в юрском или меловом периоде органический осадок начал опускаться вниз и преобразовываться в нефть, которая по прошествии нескольких десятков миллионов лет мигрировала в коллекторы, принадлежащие к более молодым комплексам пород. С другой стороны, древние нефтематеринские породы, образованные в палеозое, могли опуститься на достаточную для созревания нефти глубину намного позднее. Таким образом, в одних и тех же коллекторах можно найти и более молодую, и древнюю нефть, значительно различающиеся по своим свойствам.
Смешанные свойства
Между тем моментом, когда на дно морского бассейна опускается отмерший планктон, и тем, когда накопившийся слой органики, погрузившись на несколько километров вниз, отдает нефть, миллионы лет и целый ряд химических и физических преобразований. Поэтому нет ничего удивительного в том, что состав нефти крайне разнообразен и неоднороден. Именно поэтому сами нефтяники привыкли употреблять это слово во множественном числе — говоря о разведке или добыче нефтей и подразумевая, что каждый раз извлекаемая жидкость будет уникальной, отличающейся от всего, что было добыто ранее.
Именно поэтому сами нефтяники привыкли употреблять это слово во множественном числе — говоря о разведке или добыче нефтей и подразумевая, что каждый раз извлекаемая жидкость будет уникальной, отличающейся от всего, что было добыто ранее.
В своей основе нефть — сложная смесь углеводородов различной молекулярной массы. Преобладают в ней алканы, нафтены и арены. Наиболее простые из них — алканы (парафиновые углеводороды), у которых к атомам углерода присоединено максимальное количество атомов водорода. К алканам относятся метан, этан, пропан, бутан, пентан и т. д. Они могут быть представлены газами, жидкостями и твердыми кристаллическими веществами. Количество алканов в нефти колеблется от четверти до семидесяти процентов объема. При большом проценте алканов нефть считается парафинистой. С точки зрения добычи такое свойство считается проблемным — при подъеме нефти из скважины и соответственном уменьшении температуры парафины могут кристаллизоваться и выпадать на стенки скважин.
Нафтены — соединения, в которых атомы углерода соединяются в циклическое кольцо (циклопропан, циклобутан, циклопентан и др.). Все связи углерода и водорода здесь насыщены, поэтому нафтеновые нефти обладают устойчивыми свойствами. Нафтены могут иметь от 2 до 5 циклов в молекуле, по их составу химики пытаются определять зрелость и другие свойства нефти.
В составе аренов, или ароматических углеводородов, также есть циклические структуры — бензольные ядра. Для них характерны большая растворяемость, более высокая плотность и температура кипения. Обычно нефть содержит 10–20% аренов, а в ароматических нефтях их содержание доходит до 35%. Наиболее богаты аренами молодые нефти. Арены — ценное сырье при производстве синтетических каучуков, пластмасс, синтетических волокон, анилино-красочных и взрывчатых веществ, фармацевтических препаратов.
Нефть любят называть черным золотом, однако чистые углеводороды бесцветны. Цвет нефтям придают разнообразные примеси, в основном смолы. Асфальтосмолистая часть нефтей — вещество темного цвета. Входящие в ее состав асфальтены растворяются в бензине.
Асфальтосмолистая часть нефтей — вещество темного цвета. Входящие в ее состав асфальтены растворяются в бензине.
Нефтяные смолы, напротив, не растворяются. Они представляют собой вязкую или твердую, но легкоплавкую массу. Наибольшее количество смол отмечается в тяжелых темных нефтях, богатых ароматическими углеводородами. Такие нефти обладают повышенной вязкостью, что затрудняет их извлечение из пласта.
Во Вселенной слишком много золота. И никто не знает, откуда оно взялось
Золото кажется нам редким и дорогим металлом, но его в наблюдаемой нами Вселенной все еще гораздо больше, чем должно быть. И ученые не знают, почему так произошло.
И вот в чем проблема: золото — это элемент, а это означает, что вы не можете получить его путем обычных химических реакции, хотя алхимики пытались это сделать веками. Чтобы создать этот блестящий металл, вам нужно связать вместе 79 протонов и 118 нейтронов, чтобы сформировать единое атомное ядро. Это сложная и энергоемкая реакция ядерного синтеза. Но такой интенсивный синтез не происходит достаточно часто, по крайней мере, поблизости от нас, чтобы создать все те запасы золота, который мы находим на Земле и в других местах Солнечной системы.
Новое исследование показало, что наиболее распространенный процесс производства золота — столкновения нейтронных звезд — не может объяснить его изобилие. Так откуда же взялось все это золото? Ну, этот драгоценный металл также может создаваться при взрывах сверхновых. Только вот новая работа показала, что даже такие необычные космические явления не могут объяснить все количество золота, что мы видим.
При столкновениях нейтронных звезд за короткое время выделяется огромное количество энергии, что позволяет связать несколько легких элементов в тяжелые атомные ядра, такие как золото, и затем выкинуть их в космос. Что касается обычных сверхновых, то они вообще не отвечают за золото в привычной нам Вселенной, потому что звезды, достаточно массивные, чтобы создать этот драгметалл перед смертью, во-первых, очень редки, а, во-вторых, становятся черными дырами при взрыве, объясняет Чиаки Кобаяши, астрофизик из Университета Хартфордшира в Соединенном Королевстве и автор нового исследования. Так что при взрыве обычной массивной сверхновой золото просто попадает в черную дыру и теряется для нас навсегда.
Так что при взрыве обычной массивной сверхновой золото просто попадает в черную дыру и теряется для нас навсегда.
А что насчет необычных сверхновых? Да, такие действительно есть и называются магнитовращательными, и они являются «очень редким типом сверхновой, очень быстро вращающейся», — сказала Кобаяши.
Во время превращения в магнитовращательную сверхновую умирающая звезда вращается настолько быстро и подвергается воздействию таких сильных магнитных полей, что при взрыве буквально выворачивается наизнанку. При этом она запускает в космос раскаленные струи вещества. А поскольку при превращении звезды в сверхновую выделяется огромное количество энергии, то в таких струях может содержаться в том числе и только что синтезированное золото. Проблема в том, что звезды, достаточно массивные, чтобы синтезировать золото, встречаются редко. Звезды, которые синтезируют золото, а затем выбрасывают его в космос, встречаются еще реже.
Но даже нейтронные звезды вместе с магнитовращательными сверхновыми не могут объяснить изобилие золота в наблюдаемой нами Вселенной, как выяснили Кобаяши и ее коллеги. «В этой загадке есть два важных момента», — сказала она. «Момент номер один: слияния нейтронных звезд недостаточно. Момент номер два: даже со вторым источником мы все еще не можем объяснить наблюдаемое количество золота».
По ее словам, прошлые исследования подтвердили, что столкновения нейтронных звезд действительно вызывают «дожди из золота». Но эти исследования не учитывали редкость таких столкновений. Трудно точно оценить, как часто крошечные нейтронные звезды, которые сами являются сверхплотными остатками древних сверхновых, сталкиваются друг с другом. Но, в любом случае, едва ли такие коллизии постоянно происходят во Вселенной: ученые видели, как это происходило, лишь однажды. Кобаяши и ее коллеги обнаружили, что даже приблизительные оценки показывают, что нейтронные звезды не сталкиваются достаточно часто, чтобы произвести все золото, обнаруженное в Солнечной системе.«Это исследование не первое, в котором предполагается, что столкновений нейтронных звезд недостаточно для объяснения изобилия золота во Вселенной», — сказал Ян Родерер, астрофизик из Мичиганского университета, который ищет следы редких элементов в далеких звездах.
Но новая статья Кобаяши и ее коллег, опубликованная в The Astrophysical Journal, имеет одно важное преимущество: она чрезвычайно тщательная, сказал Родерер. Исследователи собрали огромное количество данных и включили их в надежные модели эволюции галактик и производства в них новых химических веществ. «В новой работе есть ссылки на 341 другую публикацию, что примерно в три раза больше, чем в типичных статьях в Astrophysical Journal в наши дни», — говорит Родерер. По его словам, собрать все эти данные вместе требует «титанических усилий».
У золота много различных применений. Например, им покрывали ножки старых процессоров.
Используя этот подход, авторы смогли объяснить образование как легких атомов, таких как углерод-12 (шесть протонов и шесть нейтронов), так и тяжелых, как уран-238 (92 протона и 146 нейтронов). По словам Родерера, это впечатляющий диапазон, охватывающий элементы, которые обычно игнорируются в подобных исследованиях.
И в основном расчеты дали правильные результаты.
Например, при столкновении нейтронных звезд в модели Кобаяши образуется стронций. Это соответствует обнаружению стронция в космосе после одного такого столкновения, которое ученые непосредственно наблюдали. К тому же магнитовращательные сверхновые объяснили присутствие в космосе еще одного редкого тяжелого элемента — европия, который в прошлом было сложно объяснить.
Но золото остается загадкой.
Кобаяши считает, что где-то в космосе есть нечто, о чем ученые не знают, которое активно производит золото. Или, возможно, столкновения нейтронных звезд приносят больше золота, чем предполагают существующие модели. В любом случае астрофизикам предстоит проделать еще много работы, прежде чем они смогут объяснить, откуда взялся весь этот драгоценный металл для красивых побрякушек.
iGuides в Telegram — t.me/igmedia
iGuides в Яндекс.Дзен — zen.yandex.ru/iguides.ru
Открытое образование — Неорганическая химия: введение в химию элементов
- 12 weeks
- from 7 to 9 hours per week
- 2 credit points
Курс посвящен современному состоянию теории периодичности – развитию Периодического закона Д.И.Менделеева от открытия до наших дней. На многочисленных примерах раскрываются закономерности изменения свойств s, p, d, f-элементов и химических соединений, демонстрируется возможность прогнозирования важнейших характеристик веществ. Представлены современные направления развития неорганической химии в СПбГУ.
About
Вы растеряны? Утонули в море фактического материала по химии элементов? Хотите уметь предсказывать их свойства? Понять, каких реакций от них можно ожидать? Тогда этот курс для Вас.
На основании периодического закона Д.И. Менделеева и современных представлениях о периодичности Вы научитесь: систематизировать материал; понимать сходство и отличие химических элементов в зависимости от их положения в Периодической системе; предсказывать химические свойства элементов и их соединений. Цель курса: привить обучающимся навыки анализа и предсказания свойств химических соединений с позиций Периодического закона Д.И. Менделеева.
Format
Форма обучения заочная (дистанционная). Еженедельные занятия будут включать просмотр тематических видеолекций, изучение дополнительных материалов и выполнение тестовых заданий с автоматизированной проверкой результатов, тестирование по пройденному материалу. Для получения сертификата необходимо выполнить все задания, тесты и написать финальный экзамен.
Requirements
Курс рассчитан на бакалавров 1 курса, успешно освоивших курс общей химии в рамках образовательной программы бакалавриата по направлению химия.
Course program
Занятие 1. Периодический закон. История открытия Периодического закона. Попытки систематизации элементов(Деберейнер, Ньюлендс, де Шанкуртуа, Мейер). Формулировка ПЗ Менделеева. Структура Периодической системы.Основные закономерности. Правило четности, диагональное сходство. Предсказание свойств, пустые ячейки. Сравнение экасилициума и германия. Признание ПЗ. Современные представления принципа периодичности. Связь ПЗ со строением атома, современная формулировка ПЗ. Формы Периодической Системы элементов – Менделеева, Сиборга, Бора. Плюсы и минусы. Развитие Периодического закона. Типические элементы, концепция кайносимметрии. Гипервалентные связи.
Занятие 2. Водород. Две элементарные частицы – протон и электрон. Самый распространенный элемент во Вселенной.Водород на Земле и в солнечной системе. Солнечный ветер. Уникальное электронное строение атома. Характеристики атома: потенциал ионизации, сродство к электрону. Изотопы водорода: протий, дейтерий, тритий. Ядерный синтез.Водородная бомба. Водород как простое вещество. Двухатомная молекула, ее характеристики: длина связи, энергия связи.Схема МО. Возможность существования h3+, h3-. Тяжелый водород (заметное отличие свойств, изотопный эффект). Орто и параводород. Получение молекулярного водорода. История открытия. Лабораторные способы. Примеси при получении водорода при реакции металлов с кислотами. Получение водорода в промышленности. Химические свойства молекулярного водорода. Водород как окислитель. Водород как восстановитель (экзотермичность, теплоноситель). Кинетическая инертность молекулярного водорода. Водород «в момент выделения». Опыт Марша. Бинарные соединения с водородом. От ионных к молекулярным гидридам. Схемы МО LiH и HF. Комплексные гидриды: катионные Nh5+, Ph5+, h4O+.Анионные: Bh5-, Alh5-, Al(Bh5)3. Кислотно-основные реакции бинарных водородных соединений. Неустойчивость гидридов в водных растворах. Конпропорционирование H+ + H- = h3. Водородные связи. Уникальность (размер) протона.Трехцентровое взаимодействие. Линейность фрагментов HF2-. Температуры кипения аммиака, HF, воды. Межмолекулярные водородные связи. Водородные связи в биологических системах: ДНК, РНК. Диводородные связи.Изоэлектронные этан и амминборан. Различие свойств (дегидрирование).
Занятие 3. Кислород. Кислород как простое вещество. История открытия, происхождение названия, содержание кислорода на Земле (аномально высокое содержание), физические свойства. Кислород как простое вещество. Электронное строение атома кислорода.Валентные возможности кислорода. Аллотропия кислорода. Озон. Строение молекулы, схема МО парамагнетизм. Кислород в биологических системах. Связывание молекулярного кислорода в комплексы. Опыты с жидким кислородом (горение сигареты, взрыв губки) и получение озона. Горение железа в кислороде и в озоне. Оксиды. Определение оксидов. Различные классификации оксидов. Оксиды как производные атома кислорода. Отсутствие кислорода в оксидах в степени окисления-1. Ионные оксиды. Местоположение в периодической системе. Особенности строения. Взаимодействие с водой.Молекулярные оксиды. Особенности строение и летучесть. Сложные оксиды. Соли кислородсодержащих кислот, как продукт взаимодействия двух оксидов. Промежуточные оксиды. ВТСП, магнитные свойства. Высокотемпературная керамика. Пероксиды. Устойчивость иона O22-. История открытия, общие свойства пероксидов. Пероксид водорода.Строение молекулы. Получение и свойства перекиси водорода. Пероксиды щелочных металлов как соли перекиси водорода.Пероксиды в органических соединениях. Необычные степени окисления кислорода. Ион кислорода O2- . Супероксиды,озониды. Соединения кислорода в положительных степенях окисления. Фториды кислорода. Ион О2+. Диоксигенил.
Занятие 4. Вода. Строение молекулы воды. Электронное строение молекулы воды как фактор, определяющий тенденции к образованию водородных связей. Жидкая вода. Современные представления о структуре жидкой воды. Водные растворы.Образование растворов. Учение Д.И. Менделеева о растворах. Доказательства химической природы растворов. Гидратация.Гидратация одноатомных ионов и Периодический закон. Термохимия процессов гидратации и Периодический закон.Изменение растворимости солей в рамках групп Периодической системы. Взаимодействие воды с простыми и сложными(на примере оксидов) веществами. Взаимодействие воды с простыми веществами. Растворимость газообразных простых веществ в воде. Окислительно-восстановительное взаимодействие простых веществ с водой. Взаимодействие оксидов с водой. Влияние степени ионности оксида на продукты взаимодействия. Сила кислородсодержащих кислот. Правила Полинга. Изменение силы кислородсодержащих кислот по группе П.С. Изменение силы бескислородных кислот в группе П.С., его причины. Основания как продукт взаимодействия ионных оксидов с водой. Сила оснований и Периодический закон. Гидролиз – обменное взаимодействие веществ с водой. Гидратированные ионы как протолиты. Гидролиз как результат поляризации молекул воды в первой гидратной сфере: симбатность изменений ионизационных потенциалов, поляризующей способности и константы гидролиза в рамках групп П.С. Гидролитическая полимеризация. Процессы оляции и оксоляции.Периодическая система форм гидроксокомплексов в растворе. Окислительно-восстановительные свойства воды. Вода как окислитель и как восстановитель. Общие правила запрета на существование окисленных (восстановленных) форм в водных растворах. Восстановительные потенциалы и Периодический закон. Вода как сырье для водородной энергетики.Актуальные проблемы: управление состоянием вещества в растворе как способ синтеза материалов с заданными свойствами.
Занятие 5. s-элементы. Щелочные металлы. Общие свойства щелочных металлов. Нахождение в природе, основные соединения. Свойства атомов. Особенности изменения восстановительных потенциалов вниз по группе. Физические свойства. Взаимодействие натрия и калия с водой и кислородом. Щелочные металлы в отрицательных степенях окисления. Натриды и электриды. Элементы 2й группы. Общие свойства элементов 2й группы. Классификация элементов2й группы. Химия бериллия. Амфотерность соединений бериллия. Комплексы бериллия. Взаимодействие магния и кальция с водой. Взаимодействие солей бериллия с кислотой и щелочью. Диагональное сходство. Причины возникновения.Особенности химии лития и магния. Литийорганические соединения. Реактивы Гриньяра. Роль натрия и калия, магния и кальция в биологических системах. Актуальные проблемы: Li-ионные аккумуляторы.
Занятие 6. 2p-элементы. Типические элементы у Д.И. Менделеева. Кайносимметрия 2р-элементов: в чем она проявляется: 1) 2р-орбитали 2) все элементы – неметаллы; 3) к.ч.≤4; 4) способность к образованию кратных связей; 5) специфика фтора и кислорода. Общая характеристика 2р-элементов. Способность к образованию σ и π-связей. Изменение размеров атомов,потенциалы ионизации, электронные конфигурации, сродство к электрону, ЭО. Нарастание неметаллических свойств при горизонтальном сопоставлении р-элементов. Образование σ и π-связей. Ранние и поздние элементы. Физические и химические свойства простых веществ. Тпл, кип. Агрегатное состояние Молекулы F2, N2 (схемы МО). Сопоставление химической активности поздних 2р-элеменnов. Ранние 2р-элементы: углерод, бор. Аллотропные модификации.Химические свойства. Водородные соединения 2р-элементов. Строение. Гибридизация. Изменение кислотно-основные свойств по периоду (от HF к Ch5). Особенности гидридов бора. Фториды бора и азота. Отношение к воде. CF4 — кинетическая инертность. Ионные и молекулярные фториды. Кислотно-основной характер. Фториды инертных газов. Электроноизбыточные связи. Оксиды 2р-элементов. Кратные связи в оксидах.Оксиды NO, СО, ВО в методе МО. Димеризация NO. Ион NO+.Оксид бора (BO)x, B2O3. CO2. NO2. Кислотно-основные свойства оксидов. Высшие кислородсодержащие кислоты h4BO3, h3CO3, HNO3, /HOF/. Особенности кислорода и фтора.Бориды, карбиды, нитриды. Состав. Свойства. Техническое использование.
Занятие 7. p-элементы. Общая характеристика р-элементов. Электронные конфигурации. Степени окисления. Правило четности и нечетности.Формы соединений. Увеличение к.ч. с появлением d-орбиталей. Возможности dπ- pπ перекрывания. Тенденции в изменении свойств простых веществ при движении вниз по группе. Характер изменения базовых характеристик (r, I, E,ЭО) по группе. Простые вещества. Физические и химические свойства. Тенденции в изменении свойств соединений при движении вниз по группе. Изменение устойчивости, кислотно-основных, окислительно-восстановительных свойств водородных соединений и их производных по группе. Кислородсодержащие гидратированные формы. Амфотерность.Кислоты поздних элементов. Состав, сила, окислительная способность. Соли. Вторичная периодичность. Электронное строение. Неустойчивость высших соединений брома, селена, мышьяка. Окислительные свойства соединений Tl(III), Pb(IV), Bi(V). Диагональное сходство. Кислород-хлор. Оксохлориды. Бор-кремний. Боросиликатные структуры. Стекла.Бериллий-алюминий. Амфотерность. Предсказание состава и свойствбинарных соединений. Например, Sn-Se, Pb-S, In-Br, S-F, S-Cl , Ge-O, Sn-O. Занятие 8. Введение в координационную химию. Теория Вернера, особенности строения координационных соединений.Геометрия комплексов, примеры. Типы изомерии в координационной химии. Описание электронного строения координационных соединения. Теория кристаллического поля. Октаэдрическое и тетраэдическое расщепление орбиталей.Окраска и магнитные свойства комплексов. Высокоспиновые и низкоспиновые комплексы. Спектрохимический ряд.Эффект Яна-Теллера. Плоско-квадратные комплексы. Теория поля лигандов.
Занятие 9. 3d-элементы. Свойства элементов и простых веществ. Легкие переходные элементы. Распространенность в природе. Основные минералы – сродство к кислороду и сродство к сере. Электронное строение атомов. Важнейшие характеристики элементов:ионизационный потенциал, сродство к электрону. 3d-элементы как кайносимметрики. Изменение плотности и температуры плавления простых веществ. Изменение высшей степени окисления в ряду легких переходных металлов и факторы, определяющие высшую степень окисления. Химические свойства простых веществ, закономерности их изменения в ряду 3d-элементов. Способы получения простых веществ, факторы, определяющие возможность их реализации. Соединения переменного состава. Причины их образования. Оксиды и гидроксосоединения. Формы оксо- и гидроксосоединений. Факторы, определяющие представительность плеяд этих соединений. Кислотно-основные свойства оксо-гидроксосоединений в ряду легких переходных элементов. Влияние положения элемента в П.С. и степени окисления металла на кислотно-основные свойства соединений. Окислительно-восстановительные свойства оксо-гидроксосоединений и их производных. Влияние среды. Ионы в водных растворах. Влияние степени окисления металла на форму существования ионов в водных растворах. Титанил- и ванадил-катионы. Гидролиз ионов железа. Галогениды 3d-металлов. Представительность плеяд галогенидов легких переходных металлов и факторы, ее определяющие. Влияние степени окисления металла на свойства галогенидов. Комплексы легких переходных металлов. Высокоспиновые и низкоспиновые октаэдрические комплексы, доминирование высокоспиновых. Конкуренция октаэдрических и тетраэдрических комплексов. Отражение ЭСКП на характеристиках высокоспиновых комплексов. Ряд Ирвинга-Вильямса. Горизонтальное сходство в ряду 3d-элементов. Комплексы 3d-металлов в биологических системах. Гемоглобин, другие металлокомплексы. Комплексы меди и перенос кислорода.
Занятие 10. 4,5d-элементы. Общая характеристика тяжелых металлов. Особенности электронного строения тяжелых d-металлов. Лантаноидное сжатие.Причины сходства в химическом поведении. Сравнение окислительное-восстановительных свойств и устойчивых степеней окисления тяжелых d-элементов с 3-d металлами. Триады хром-молибден-вольфрам, марганец-технеций рений.Стандартные восстановительные потенциалы. Сравнение поведения 3d и тяжелых металлов в водных растворах. Низкие степени окисления тяжелых d-элементов. Кластерообразование. Связь металл-металл. Структура кластерных каркасов. Образование изо- и гетерополианионов на примере хрома, молибдена и вольфрама. Анионы Кеггина, Доусона и Андерсена. Влияние размера гетероатома на структуру аниона. Платиновые металлы. Особенное положение в периодической системе. Схожесть характеристик в триадах. Плоскоквадратные комплексы. Эффект транс-влияния. Актуальные проблемы: Комплексы Pd как катализаторы органических реакций.
Занятие 11. f-элементы. Лантаноиды. Электронное строение. Кайносимметрия. Лантаноидное сжатие. Цериевая и иттриевая группа. Химия лантаноидов. Нахождение в природе. Получение и разделение лантаноидов. Реакционная способность простых веществ. Наиболее устойчивые степени окисления. Оксиды, гидроксиды, галогениды. Особенности химии Ce, Eu,Tb,Yb.Актиноиды. Электронное строение. Ураниды и кюриды. Изменение свойств по ряду 5f элементов. Химия актиноидов.Характерные степени окисления. Химия водных растворов. Иловые ионы. Особенности комплексов актиноидов (отсутствие связи М-М). Границы периодической системы. Синтез новых элементов.Сверхтяжелые элементы. Островок стабильности. Границы периодической системы. Сейчас полностью завершен 7 период(Og)! Актуальные проблемы: люминесцентные комплексы лантаноидов.
Занятие 12. Итоговое занятие. ПЗ в современной химии. Предсказание свойств и реакционной способности соединений. Разбор примеров: h3SO3 + h3SeO3; SnCl2 + Bi(NO3)3 + NaOH. Актуальные проблемы: химическое осаждение из газовой фазы.
Education results
Студенты по окончанию курса должны:
1. Знать:
- классификацию неорганических соединений, их структуру и физико-химические свойства, кислотно-основной и окислительно-восстановительный характер простых веществ и их соединений
- периодический закон и периодическую систему Д.И. Менделеева
- строение комплексных соединений и их свойства
- классификацию химических элементов по группам и периодам
- диагональное сходство, понятие о кайносимметрии и ее проявление в химии элементов и их соединений
- понятие о вторичной периодичности, химические свойства s, p, d, f-элементов и их соединений
- растворы и процессы, протекающие в водных растворах
2. Уметь:
- использовать химическую терминологию, номенклатуру, символику
- общаться на языке науки
- обсуждать научные проблемы химии
- осуществлять выбор химических приемов и методов для эффективного решения проблемы
- использовать основные понятия и методы химии в решении научных задач.
Formed competencies
Дисциплина участвует в формировании универсальных компетенций обучающихся по образовательным программам бакалавриата/специалитета, а также иных компетенций, предусмотренных образовательной программой.
самых распространенных элементов в Солнечной системе
Солнечная система состоит из Солнца, восьми планет и нескольких других различных объектов, таких как кометы, астероиды и карликовые планеты. Наиболее распространенными элементами среди этих объектов являются водород и гелий, в первую очередь потому, что Солнце и четыре самые большие планеты преимущественно состоят из этих двух элементов.
№ 1: Водород
Водород — самый распространенный элемент во Вселенной, потому что это самый простой элемент во Вселенной.У атома водорода есть один протон, один электрон и нет нейтронов, что делает его самым легким элементом. Чем больше объект, тем сильнее его гравитационное притяжение и, следовательно, тем больше в нем водорода. Солнце в основном состоит из водорода, как и четыре газовые планеты-гиганты (Юпитер, Сатурн, Уран и Нептун). Первоначальное образование Солнечной системы составляло примерно 75 процентов водорода.
№ 2: Гелий
Гелий — второй по распространенности элемент во Вселенной, и, как и водород, он относительно прост, поскольку имеет два протона и два электрона.Гелий составлял около 25 процентов солнечной системы, когда он первоначально формировался; однако изотоп гелия также образуется на Солнце во время ядерного синтеза. В ядерном синтезе четыре атома водорода собираются вместе, чтобы сформировать изотоп гелия, состоящий из двух протонов и двух нейтронов. Гелий также является вторым по распространенности элементом среди газовых гигантов.
Другие газы
Другие газы присутствуют в солнечной системе в небольших количествах, но не на уровне водорода и гелия.Например, атмосфера Земли состоит в основном из азота с небольшим количеством кислорода. Нептун, несмотря на то, что он почти полностью состоит из водорода и гелия, имеет характерный синий оттенок из-за наличия в его атмосфере метана (сочетание углерода и кислорода). В конце концов — примерно через пять миллиардов лет — когда Солнце выгорит из водорода, оно начнет плавить гелий в своем ядре и производить больше углерода и кислорода в солнечной системе.
Твердые тела — редкость
Твердые элементы исключительно редки в общей схеме Солнечной системы.Несмотря на то, что они преобладают на Земле, они составляют менее 1 процента от общего количества элементов в Солнечной системе, в первую очередь из-за размера и процентного содержания газа на Солнце и газовых гигантах. Тем не менее, некоторые твердые элементы существуют, наиболее важным из которых является железо. Считается, что железо лежит в основе каждой планеты земного типа.
Почему водород — самый распространенный элемент во Вселенной?
Эта история была обновлена 4 апреля в 12:24. ЛЕТНЕЕ СЕВЕРОАМЕРИКАНСКОЕ ВОСТОЧНОЕ ВРЕМЯ.
Водород — самый распространенный элемент во Вселенной, но почему?
Чтобы ответить на этот вопрос, «нам нужно вернуться к Большому взрыву», — сказала Мэй Найман, профессор химии в Университете штата Орегон.
Большой взрыв создал элементы периодической таблицы, строительные блоки, из которых состоит Вселенная. Каждый элемент имеет уникальное количество субатомных частиц: протонов (положительно заряженных), нейтронов (нейтральных) и электронов (отрицательно заряженных). [Каковы составляющие жизни?]
Водород — всего лишь с одним протоном и одним электроном (это единственный элемент без нейтрона) — самый простой элемент во Вселенной, что объясняет, почему его также больше всего, — сказал Найман.(Однако изотоп водорода, называемый дейтерий, содержит один протрон и один нейтрон, а другой, известный как тритий, имеет один протон и два нейтрона.)
В звездах атомы водорода сливаются, образуя гелий — второй по распространенности элемент. во Вселенной, согласно Encyclopedia.com. Гелий имеет два протона, два нейтрона и два электрона. По данным Encyclopedia.com, вместе гелий и водород составляют 99,9% известного вещества во Вселенной.
Даже в этом случае водорода во Вселенной примерно в 10 раз больше, чем гелия, сказал Найман.Она добавила, что кислород, третий по распространенности элемент, примерно в 1000 раз менее распространен, чем водород.
В целом, чем выше атомный номер, тем меньше количество элемента, сказал Найман.
Однако состав Земли отличается от состава всей Вселенной. Например, кислород является наиболее распространенным элементом в земной коре по весу, за ним следуют кремний, алюминий и железо, согласно HyperPhysics, сайту, управляемому Государственным университетом Джорджии.
Согласно HyperPhysics, в организме человека наиболее распространенным элементом по массе является кислород, за которым следуют углерод и водород.
Водород играет в организме человека ряд ключевых ролей. По словам Наймана, водородные связи помогают придать ДНК характерный поворот, а также помогают желудку и другим органам поддерживать правильный pH или то, насколько он кислый или щелочной.
«Если ваш желудок станет слишком обычным, водород будет выделяться туда, с чем он связан», — сказала она. «Если он слишком кислый, [водород] с чем-то связан».
Кроме того, водород позволяет льду плавать по воде (h30), поскольку водородные связи раздвигают молекулы замороженной воды, делая их менее плотными.
«Обычно вещества более плотные в твердом состоянии, чем в жидком», — сказал Найман. «Вода — единственное вещество, которое менее плотно, чем когда оно [] твердое».
Однако водород также может быть опасным. Газообразный водород, вступающий в реакцию с кислородом, привел к катастрофе с дирижаблем в Гинденбурге, унесшей жизни 36 человек в 1937 году, сообщает Airships.net. Более того, водородные бомбы могут быть невероятно разрушительными, хотя они никогда не использовались в качестве оружия, «только что продемонстрировали США, СССР, Великобритания, Франция и Китай в 1950-х годах», — сказал Найман.
Водородные бомбы, как и атомные бомбы, используют комбинацию ядерных реакций синтеза и деления, чтобы вызвать разрушение и высвобождают как радиацию, так и механические ударные волны при взрыве, сказала она.
Примечание редактора : Эта статья была обновлена, чтобы включить информацию об изотопах водорода и сказать, что водородные бомбы могут испускать радиацию.
Оригинальная статья о Live Science.
Сравнение элементов Вселенной с элементами на Земле — видео и стенограмма урока
Вселенная
Вселенная огромна и, согласно теории, увеличивается с каждой секундой.Когда вы смотрите в ночное небо, какие две самые заметные вещи вы видите? Звезды и тьма! Если вы знаете, что ищете, вы можете определить пару планет, но очевидно, что количество звезд значительно превышает количество планет. Фактически, из всего, что можно увидеть во Вселенной, звезды являются наиболее распространенными объектами.
Звезды — это гигантские массы плазмы, представляющей собой перегретый газ. Ключевое слово в этом предложении — «газ». Поскольку звезды являются наиболее распространенными объектами во Вселенной и представляют собой гигантские газовые сферы, элементы, которые доминируют в составе звезд, должны быть газами.
Элементы Вселенной
Если вы посмотрите на таблицу Менделеева, то там всего 11 элементов, которые являются газообразными. Из этих 11 два из них составляют большую часть звезды: водород и гелий. Это означает, что наиболее распространенными элементами во Вселенной являются водород и гелий.
Эти два элемента составляют около 98% всех элементов во Вселенной, из которых водород составляет 75%, а гелий — 23%. Водород — самый простой элемент, который существует, потому что он имеет только один протон и один электрон.Каждый существующий элемент начался с водорода.
Следующие три элемента в периодической таблице (литий, бериллий и бор) более чем в 107 раз менее распространены. Имея дело со вселенной, вам придется иметь дело с непостижимыми числами!
Наблюдается значительный рост содержания следующих нескольких элементов: углерода, азота и кислорода, но их содержание примерно в 103–104 раз меньше, чем содержание водорода.
Если смотреть на таблицу Менделеева, начиная с кислорода, можно увидеть резкое снижение содержания остальных элементов.Десять самых распространенных элементов во Вселенной в порядке убывания их содержания:
- Водород
- Гелий
- Кислород
- Углерод
- Неон
- Азот
- Магний
- Кремний
- Утюг
- Сера
Чем больше звезда, тем тяжелее элемент, который она может сделать. Самые большие звезды могут образовывать все элементы от гелия до железа. Земля содержит все элементы, генерируемые звездами, но преимущественно состоит из нескольких.
Планеты
Когда звезды умирают, особенно гигантские звезды, они схлопываются сами по себе и подвергаются мощному взрыву, который называется сверхновой . Этот взрыв запускает нейтроны в уже существующие атомы, создавая новые и более тяжелые элементы.
Некоторые из этих элементов радиоактивны и распадаются на другие элементы. Все эти атомы выбрасываются наружу. В течение очень долгого времени эта межзвездная пыль коллапсирует под действием гравитационного притяжения, образуя новые звезды, а иногда и планеты.
Есть два типа планет. Планеты земной группы в основном состоят из горных пород и металлов, что делает Землю планетой земной группы. Юпитерианские планеты — это гигантские газовые сферы, которые не настолько велики, чтобы превращаться в звезды.
Элементы Земли
Самым распространенным элементом на Земле с точки зрения общей массы является железо, самый большой элемент, образующийся в крупнейших звездах. Железо составляет около 35% всех элементов на Земле по массе.Мы также можем построить график содержания элементов в зависимости от количества атомов, существующих на планете.
Глядя на график, можно увидеть десять наиболее распространенных элементов на Земле с точки зрения количества атомов и в порядке убывания:
- Кислород
- Кремний
- Алюминий
- Натрий
- Водород
- Калий
- Кальций
- Утюг
- Титан
- Фтор
Обратите внимание, что только три из них являются газами.Причина, по которой Земля состоит в основном из металлов, заключается в ее близости к Солнцу. Солнечный ветер вытеснил большинство газов во внешние границы Солнечной системы. Относительно высокие температуры из-за близости к Солнцу заставили эти элементы конденсироваться в небольшие сгустки массы, которые в конечном итоге сформировали Землю.
Итак, каково общее количество элементов, которые естественным образом существуют во Вселенной? Ответ — 98. Остальные элементы производятся синтетическим путем в ядерных реакторах.Возможно, однажды эти элементы будут обнаружены в природе, но это еще предстоит выяснить.
Краткое содержание урока
Звезды отвечают за образование 98 элементов периодической таблицы. Самые большие звезды могут производить все элементы от гелия до железа. Остальные элементы образуются при взрывах сверхновой (коллапс, который запускает нейтроны в уже существующие атомы, генерируя новые и более тяжелые элементы) и в результате радиоактивного распада.
Большинство элементов во Вселенной — газы.Первые три самых распространенных элемента во Вселенной — это водород, гелий и кислород (именно в таком порядке).
Существует два типа планет: земных, , которые состоят из металлов и горных пород, таких как Земля, и юпитерианцев, , газообразных. Близость к Солнцу привела к тому, что металлические элементы и скальные элементы конденсировались в сгустки вещества, которые в конечном итоге объединились, чтобы сформировать Землю. Солнечный ветер вытеснил большинство газов во внешние области Солнечной системы.
Три самых распространенных элемента на Земле по количеству атомов: кислород, кремний и алюминий (в указанном порядке). По общей массе железо является самым распространенным элементом на Земле.
химический элемент | Определение, происхождение, распространение и факты
Химический элемент , также называемый элементом , любое вещество, которое не может быть разложено на более простые вещества обычными химическими процессами. Элементы — это фундаментальные материалы, из которых состоит вся материя.
Британская викторина
27 правильных или ложных вопросов из самых сложных викторин «Британника»
Что вы знаете о Марсе? Как насчет энергии? Думаете, будет проще, если вам придется выбирать только истину или ложь? Узнайте, что вы знаете о науке, с помощью этой сложной викторины.
В этой статье рассматривается происхождение элементов и их распространенность во Вселенной.Подробно рассматривается геохимическое распределение этих элементарных веществ в земной коре и недрах, а также их присутствие в гидросфере и атмосфере. В статье также рассматривается периодический закон и табличное расположение элементов на его основе. Для получения подробной информации о соединениях элементов, см. Химическое соединение .
Редакция Британской энциклопедииОбщие наблюдения
В настоящее время известно 118 химических элементов.Около 20 процентов из них не существуют в природе (или присутствуют только в следовых количествах) и известны только потому, что были синтетически получены в лаборатории. Из известных элементов 11 (водород, азот, кислород, фтор, хлор и шесть благородных газов) являются газами при обычных условиях, два (бром и ртуть) являются жидкостями (еще два, цезий и галлий, плавятся примерно при температуре выше комнатной температуры), а остальное — твердые частицы. Элементы могут объединяться друг с другом, образуя широкий спектр более сложных веществ, называемых соединениями.Число возможных соединений практически бесконечно; возможно, известен миллион, и каждый день открывается все больше. Когда два или более элемента объединяются в соединение, они теряют свою индивидуальность, и продукт имеет характеристики, совершенно отличные от характеристик составляющих элементов. Газообразные элементы водород и кислород, например, с совершенно разными свойствами, могут объединяться с образованием сложной воды, которая имеет совершенно другие свойства, чем кислород или водород.Очевидно, что вода не является элементом, потому что она состоит из двух веществ, водорода и кислорода, и фактически может быть химически разложена на них; эти два вещества, однако, являются элементами, потому что они не могут быть разложены на более простые вещества никаким известным химическим процессом. Большинство образцов естественного вещества представляют собой физические смеси соединений. Например, морская вода представляет собой смесь воды и большого количества других соединений, наиболее распространенным из которых является хлорид натрия или поваренная соль. Смеси отличаются от соединений тем, что их можно разделить на составные части с помощью физических процессов; например, простой процесс испарения отделяет воду от других компонентов морской воды.
Историческое развитие концепции элемента
Современная концепция элемента однозначна, поскольку она зависит от использования химических и физических процессов как средства отделения элементов от соединений и смесей. Однако существование фундаментальных веществ, из которых состоит вся материя, было основой многих теоретических предположений с самого начала истории. Древнегреческие философы Фалес, Анаксимен и Гераклит предполагали, что вся материя состоит из одного существенного принципа — элемента.Фалес считал, что этот элемент — вода; Анаксимен предложил воздух; и Гераклит, огонь. Другой греческий философ, Эмпедокл, выразил иную веру — что все вещества состоят из четырех элементов: воздуха, земли, огня и воды. Аристотель согласился и подчеркнул, что эти четыре элемента являются носителями фундаментальных свойств: сухость и тепло связаны с огнем, тепло и влага — с воздухом, влажность и холод — с водой, а холод и сухость — с землей. В мышлении этих философов все другие вещества должны были быть комбинациями четырех элементов, и считалось, что свойства веществ отражают их элементный состав.Таким образом, греческая мысль заключала в себе идею о том, что вся материя может быть понята в терминах элементарных качеств; в этом смысле сами элементы считались нематериальными. Греческое понятие элемента, которое было принято почти 2000 лет, содержало только один аспект современного определения, а именно, что элементы обладают характерными свойствами.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасВо второй половине средневековья, когда алхимики стали более изощренными в своих знаниях о химических процессах, греческие концепции состава материи стали менее удовлетворительными.Были введены дополнительные элементарные качества, чтобы приспособиться к недавно обнаруженным химическим превращениям. Таким образом, сера стала олицетворять горючесть, ртуть — летучесть или текучесть, а соль — стойкость в огне (или негорючесть). Эти три алхимических элемента или принципа также представляют собой абстракции свойств, отражающих природу материи, а не физических субстанций.
Важное различие между смесью и химическим соединением в конце концов было понято, и в 1661 году английский химик Роберт Бойль осознал фундаментальную природу химического элемента.Он утверждал, что четыре греческих элемента не могут быть настоящими химическими элементами, потому что они не могут соединяться с образованием других веществ и не могут быть извлечены из других веществ. Бойль подчеркивал физическую природу элементов и соотносил их с соединениями, которые они образуют, современными методами.
В 1789 году французский химик Антуан-Лоран Лавуазье опубликовал то, что можно считать первым списком элементарных веществ, основанным на определении Бойля. Список элементов Лавуазье был составлен на основе тщательного количественного исследования реакций разложения и рекомбинации.Поскольку он не мог проводить эксперименты по разложению определенных веществ или формированию их из известных элементов, Лавуазье включил в свой список элементов такие вещества, как известь, глинозем и кремнезем, которые, как теперь известно, являются очень стабильными соединениями. На то, что Лавуазье все еще сохранилось влияние древнегреческой концепции элементов, указывает его включение света и тепла (калорийности) в число элементов.
Семь веществ, признанных сегодня элементами, — золото, серебро, медь, железо, свинец, олово и ртуть — были известны древним, поскольку встречаются в природе в относительно чистой форме.Они упоминаются в Библии и в раннем индуистском медицинском трактате Caraka-samhita . Шестнадцать других элементов были открыты во второй половине 18 века, когда методы отделения элементов от их соединений стали более понятными. Еще восемьдесят два последовали после внедрения количественных аналитических методов.
Какого элемента во Вселенной больше всего?
Водород — самый распространенный элемент во Вселенной, за ним следует гелий. Кислород составляет около 1 процента.Все остальные элементы вместе составляют немногим больше одного процента!Самый распространенный элемент во Вселенной — водород. На водород приходится почти три четверти всего вещества, а на гелий — почти четверть. Кислород является третьим по распространенности элементом. Сумма всех остальных элементов составляет около одного процента от общей массы!
Изобилие элементов во Вселенной
Вот примерное количество элементов в галактике Млечный Путь, которое вы можете принять за представление о составе Вселенной:
| Атомный номер | Элемент | Массовый процент | |||
| 1 | Водород (H) | 73.9 | |||
| 2 | Гелий (He) | 24,0 | |||
| 8 | Кислород (O) | 1,0 | |||
| 6 | Углерод (C) | 10 | 0,5 | 0,5 901 Неон (Ne) | 0,1 |
| 26 | Железо (Fe) | 0,1 | |||
| 7 | Азот (N) | 0,1 | |||
| 14 | Кремний (Si) | ||||
| 12 | Магний (Mg) | 0.058 | |||
| 16 | Сера | 0,044 | |||
| — | Все остальные вместе | ~ 0,05 |
Ученые используют спектроскопические данные об изобилии элементов во вселенной. Наше понимание состава Вселенной постоянно меняется, а новые инструменты меняют способ измерения. Но Вселенная не везде одинакова, и содержание элементов является оценочным.В основном, ссылки согласны в порядке элементов с точки зрения изобилия, но расходятся (иногда широко) по фактическим числам. Вы должны знать, что водород наиболее распространен, за ним следует гелий, а затем кислород, углерод, неон и железо.
Почему водород — самый распространенный элемент?
Причина, по которой водород является самым распространенным элементом во Вселенной, восходит к Большому взрыву. Большой взрыв быстро привел к образованию протонов, нейтронов и электронов. Поскольку водород является самым простым элементом, он образуется наиболее легко.Технически даже одиночный протон классифицируется как атом водорода. У нейтрального атома тоже есть электрон. Большинство атомов водорода не имеют нейтронов, хотя менее распространенный изотоп дейтерия имеет один нейтрон, а более редкий изотоп трития имеет два нейтрона.
Как формируются элементы?
Первоначально Вселенная была богаче водородом, чем сегодня. Около четверти гелия во Вселенной образовалось во время Большого взрыва, но еще 3% образовалось из водорода во время синтеза в звездах.
Нуклеосинтез элементов Периодической таблицы (Дженнифер Джонсон; ESA / NASA / AASNOVA)Кислород образуется в результате слияния звезд незадолго до того, как они станут сверхновыми. По мере того как звезды стареют и умирают, процентное содержание кислорода во Вселенной увеличивается. Углерод образуется в основном в красных гигантах. Неон, как и кислород, образуется в звездах до сверхновой. Азот поступает из звезд, таких как Солнце, в процессе синтеза углерода и кислорода. Магний образуется в результате синтеза при взрыве массивных звезд. Кремний, железо и сера образуются в результате взрыва массивных звезд и белого карлика.Более тяжелые элементы образуются в результате слияния нейтронных звезд и слияния умирающих звезд с меньшей массой. Технеций и элементы тяжелее урана в основном синтезируются в ускорителях и ядерных реакторах. Хотя вполне возможно, что они могут образоваться естественным путем, они распадаются так быстро, что их невозможно обнаружить в заметных количествах.
Материя против темной материи
Элементы являются примерами обычной или барионной материи. Барионная материя состоит из планет, звезд, межзвездных облаков и межгалактических газов.Ученые считают, что только около 4,6% Вселенной состоит из обычной материи и энергии, 68% — это темная энергия, а 27% — темная материя. Но мы не смогли напрямую наблюдать темную материю и темную энергию, поэтому их природа недостаточно изучена или охарактеризована.
Ссылки
- Anders, E; Эбихара, М. (1982). «Изобилие элементов в солнечной системе». Geochimica et Cosmochimica Acta . 46 (11): 2363. doi: 10.1016 / 0016-7037 (82)
-3
- Кэмерон, А.G.W. (1973). «Изобилие элементов в солнечной системе». Обзоры космической науки . 15 (1): 121. doi: 10.1007 / BF0017244
- Кросвелл, Кен (февраль 1996 г.). Алхимия небес . Якорь. ISBN 0-385-47214-5.
- Suess, Hans; Юри, Гарольд (1956). «Изобилие элементов». Обзоры современной физики . 28 (1): 53. doi: 10.1103 / RevModPhys.28.53
Водород — самый распространенный элемент: вот причина, почему
Не только на планете Земля, но и во всей вселенной водород считается наиболее распространенным и распространенным элементом.Почему это так? В чем причина этого? Все эти ответы и объяснения дает профессор химии Орегонского государственного университета.
Согласно Live Science, Мэй Найман, профессор химии в Университете штата Орегон, сказала, что, чтобы найти причину, по которой водород является наиболее распространенным элементом во Вселенной, сначала необходимо проверить теории Большого взрыва. Это потому что; Большой взрыв ответственен за создание элементов таблицы Менделеева. Эти элементы считаются строительными блоками всей вселенной.
С точки зрения науки, такие элементы, как водород, гелий, сера или любые другие элементы, содержат субатомные частицы с уникальным числом этих частиц, а именно протоны, электроны и нейтроны. Они содержат в себе определенный заряд, например, протоны заряжены положительно, нейтроны по своей природе нейтральны, а электроны заряжены отрицательно.
Элемент Водород имеет только один протон и один электрон и является единственным элементом, у которого нет нейтронов. Поэтому он считается самым простым элементом во Вселенной и дает веские основания считать его самым распространенным и распространенным элементом во Вселенной.
По оценке лаборатории Джефферсона, примерно 90 процентов видимой Вселенной обрамлено Водородом, что доказывает, что, будучи в простейшей форме, этот элемент является наиболее распространенным и распространенным элементом во Вселенной. Найман также сказал, что атомы водорода сливаются и производят гелий, который является вторым по распространенности и распространенности элементом во Вселенной. Оба элемента вместе, то есть гелий и водород, составляют 99% Вселенной.
Тем не менее, во Вселенной примерно в 10 раз больше водорода, чем гелия.Кислород, третий по величине и распространенный элемент во Вселенной, в 1000 раз менее распространен, чем водород. Найман сообщил, что чем выше атомный номер в периодической таблице, тем меньше этот элемент во Вселенной. Она добавила, что помимо Вселенной водород с точки зрения водородных связей играет очень важную роль в организме человека.
Введение в программу обучения астрономии 1.0 — Введение 9.0 — Земля в космосе Глоссарий: изменение климата |
Юпитер и Сатурн вместе составляют более 90 процентов массы всех планет. Как уже упоминалось, основная их масса состоит из водорода и гелия. Кроме того, в их атмосферах видны соединения аммиак (гидрид азота), метан (гидрид углерода) и вода (гидрид кислорода).Это наиболее очевидные комбинации четырех наиболее распространенных элементов (помимо гелия), и тот факт, что их много, отражает относительно низкую температуру внешней атмосферы двух основных планет. (Гелий, как благородный газ, не соединяется с другими элементами.) Следующими двумя крупнейшими планетами являются Уран (открытый в 1781 году Уильямом Гершелем) и Нептун (открытый в 1846 году Иоганнесом Галле; см. Также Адамса и Леверье). Они примерно равны по размеру и массе, примерно пять процентов от Юпитера и менее одной пятой от Сатурна.По составу Уран очень похож на Юпитер и Сатурн. Кроме того, как и у этих двух гигантов, у него есть (тонкие) кольца и множество спутников. По-видимому, Нептун впервые увидел Галилей (он зарисовал его при наблюдении Юпитера в 1613 году), но он не узнал его природу как планету. Нептун имеет состав, очень похожий на другие «юпитерианские» планеты, но имеет несколько большую плотность. Он также окружен обломками и спутниками. Плутон, самая удаленная планета, размером примерно с Луну и состоит из пыльного льда, очень похожего на комету.У него есть большой спутник «Харон».
|
