Ученые составили карту микробов в организме человека
- Смита Мундасад
- Би-би-си
Автор фото, SPL
Подпись к фото,До недавнего времени ученые могли распознать лишь микробы, культивируемые в лабораториях
«Когда я встаю со стула, со мной встают в 10 раз больше бактериальных клеток, чем человеческих», — говорит доктор Брюс Биррен. Он — один из сотен американских ученых, участвовавших в создании самой подробной карты микробов, которые живут внутри и снаружи нас.
Проект «Микробиом человека»( Human Microbiome Project), запущенный в США в 2007 году, определил генетическую идентичность многих бактерий, вирусов и других микроорганизмов, которые живут в тесном контакте с нами.
Исследователи предупреждают, что речь идет не о вредных микробах, которых необходимо уничтожать, а о микроорганизмах, которые являются важной частью того, что делает нас людьми.
Тем не менее, до недавнего времени мало что было известно о триллионах микроорганизмов, населяющих наше тело.
Микробы-помощники
На протяжении веков мы могли исследовать только микроорганизмы, способные выжить в лабораториях, и изучать их по отдельности — часто одного микроба за раз.
Но с появлением все более совершенных методов анализа ДНК участникам проекта «Микробиом человека» удалось обнаружить микробов, которых никогда раньше не видели, и посмотреть на их коллективное поведение.
Результаты пятилетнего труда, начатого Национальном институтом здоровья США, были опубликованы в журналах Nature, Genome Biology и PLoS.
В рамках проекта у более чем 200 здоровых мужчин и женщин в США были взяты образцы микробов, причем из различных частей тела.
Исследователи обнаружили, что в здоровом человеческом микробиоме обитает более 10 тысяч различных видов микроорганизмов.
Большинство из этих микробов оказались абсолютно безвредными. Появляется даже все больше доказательств того, что эти организмы помогают нам во многих отношениях.
Некоторые помогают нам получать энергию из пищи, в то время как другие помогают нам усваивать питательные вещества, такие как витамины.
Общий микробный коктейль
Мы все больше узнаем об их роли в формировании нашей иммунной системы, а не только в нападении на нее, говорит профессор Барбара Мете из Института Крейга Вентера, которая также участвует в проекте.
Одним из ключевых вопросов, на который пытались получить ответ составители карты микробов: существует ли базовый набор микробов, одинаковый для всех людей?
Ученые обнаружили разнообразие простейших у разных людей и уникальные сообщества микроорганизмов, живущих в разных частях тела.
Но некоторых микробиологов по-настоящему поразило то, что в определенных частях тела многие из микробов отвечают за аналогичные процессы.
«На наших с вами языках могут жить разные простейшие, но вместе они вносят те же гены в общий коктейль и помогают выполнять одинаковые функции — например, разрушать сахар,» – поясняет Брюс Биррен.
Это открытие может заставить ученых пересмотреть модель «один микроб — одна болезнь», которая возлагает ответственность за возникновение заболевания на одного представителя прокариотов.
«Бактериальная телефонная книга»
Возможно, что при возникновении некоторых заболеваний имеет значение не конкретный вид простейших, а то, что общее функционирование группы микроорганизмов пошло наперекосяк, полагает доктор Кертис Хаттенхауэр из Гарвардской школы общественного здравоохранения.
Исследователи обнаружили, что здоровые добровольцы переносят небольшое количество микробов, которых принято считать болезнетворными.
Например, бактерия метициллин — резистентный золотистый стафилококк, — которая может вызвать сепсис и двустороннюю пневмонию, была найдена в носу около 30% участников эксперимента.
«Теперь у нас есть «телефонная книга» из более чем 100 подобных микроорганизмов, которые при определенном стечении обстоятельств могут повести себя плохо. Мы знаем, где они живут у здоровых людей и какие организмы их окружают. Поэтому, возможно, мы можем начать понимать, что их сдерживает и где они размножаются», — говорит доктор Хаттенхауэр.
И микробы несут в себе многие гены. Эти гены обладают такой же способностью влиять на наше здоровье и болезни, как и наши собственные, уверяет Кертис Хаттенхауэр..
«Терра инкогнита»
Программный директор проекта Лита Проктор и ее коллеги склоняются к выводу о том, что мы выбираем наши микробиомы в самом начале жизни.
«Геном человека передается по наследству, но микробиом людьми приобретается — это означает, что он сильно подвержен изменениям и мутациям. Над этим мы и работаем в клинических условиях. Если вы можете управлять микробиомом, вы сможете сохранить его здоровым или изменить нездоровый баланс», — поясняет Проктор.
По словам профессора Дэвида Релмана из Стэнфордского университета, эти исследования — только половина дела, поскольку нам предстоит гораздо больше узнать о «диалоге» микробиомов с клетками человека.
«До сих пор это «терра инкогнита». Даже в привычных условиях мы по-прежнему открываем новые формы жизни», — говорит Релман.
Вопросы и ответы — Ветеринарная лаборатория Пастер
Токсоплазмоз – это паразитарное заболевание, вызываемое простейшими Toxoplasma gondii, для которого характерно поражение нервной и лимфатической систем, глаз, скелетных мышц, миокарда и других органов и тканей. Болезнь может протекать в виде бессимптомного носительства или острого процесса различной степени тяжести.Жизненный цикл gondii протекает с участием большого круга окончательных (кошки и другие представители семейства кошачьих) и промежуточных хозяев (более 350 видов животных, птицы и некоторые виды рыб), включая человека.
Попадая в организм промежуточного хозяина токсоплазмы проходят ряд специфических стадий развития, разносятся по всем органам и тканям. Количество токсоплазм быстро увеличивается, по мере развития болезни, часть их превращается в цисты, которые могут долго сохраняться в организме хозяина.
Аналогичные изменения при токсоплазмозе происходят и в организме кошек, но кроме этого, токсоплазмы проникают в кишечник, где проходит половое развития паразита, в конце которого незрелые ооцисты выделяются с фекалиями во внешнюю среду в колоссальных количествах. Ооцисты очень устойчивы во внешней среде, в почве могут сохранять жизнеспособность до 1,5 лет.
Распространение. Токсоплазмоз распространен повсеместно.
Клинические признаки. У кошек паразитирование токсоплазм в кишечнике практически не вызывает заметных патологических изменений и болезненного состояния. Что же касается других животных и человека, выполняющих роль промежуточного хозяина, то у них токсоплазмы вызывают серьезные заболевания с различными клиническими проявлениями. При этом могут наблюдаться характерные симптомы. В острую стадию болезни возможно увеличение температуры тела до 40oС, истечения из носа, глаз, явления расстройства желудочно-кишечного тракта, увеличение лимфоузлов. У беременных животных наступают аборты. Нарушения со стороны центральной нервной системы и степень клинических симптомов зависит от места локализации токсоплазм, эти нарушения могут протекать в виде различных двигательных отклонений, парезов, параличей, манежных движений, эпилепсии и др. Нередко поражаются глаза, наиболее часто развиваются хориоретиниты.
По мере развития болезни и формирования иммунитета острая стадия токсоплазмоза переходит в хроническую, когда все признаки проявляются в стертой форме. Также возможно бессимптомное течение токсоплазмоза, особенно опасное осложнениями во время беременности человека.
Также возможно бессимптомное течение токсоплазмоза, особенно опасное осложнениями во время беременности человека.
Человек может заразиться токсоплазмозом при контакте с собаками и другими животными, больными токсоплазмозом в острой стадии, когда возбудитель выделяется во внешнюю среду с истечениями из глаз, носа, слюной.
Профилактика. Для предотвращения заражения токсоплазмозом собак и кошек, необходимо полностью исключить из их рациона продукты животного происхождения в сыром виде (допустимо длительное замораживание мяса в холодильной камере, при температуре -18o, ошпаривание мяса или фарша крутым кипятком не обеспечивает обеззараживание от токсоплазм; предотвратить ловлю и поедание птиц, грызунов и контакт с другими животными. Часто такие условия для профилактики токсоплазмоза трудно осуществимы, особенно если собаки содержатся вольерным способом, принимают участие в охоте или когда квартирные животные периодически имеют доступ на улицу при выезде за город.
Диагностика. Диагностика токсоплазмоза на сегодняшний день производится многими способами, которые имеют свои особенности.
Диагностика токсоплазмоза на сегодняшний день производится многими способами, которые имеют свои особенности.
У кошек можно исследовать фекалии на наличие ооцист токсоплазм. Особенность исследования заключается в том, что окончательный диагноз в случае обнаружения ооцист не ставится, так как у кошек могут паразитировать еще два вида простейших, ооцисты которых не отличимы от ооцист T.gondii. В этом случае необходимо провести серологическое исследование крови на наличие специфических антител к токсоплазмам.
Исследования крови у кошек и собак проводят с целью выявления специфических антител к токсоплазмам (особенность исследования заключается в том, что выявляют, как правило, только антитела группы G, их наличие в крови говорит о том, что острый период заболевания уже прошел). Выявление таких антител не является поводом для лечения животного.)
Для ПЦР диагностики токсоплазмоза исследуют мазки из глаз и носа. Данный метод на сегодняшний день является весьма надежным, но он эффективен только в острую фазу болезни, которая может остаться незамеченной.
Как сон влияет на здоровье
Сон – это физиологическая потребность человека, точно такая же, как голод или жажда. Если лишить человека сна, то в конце концов он погибнет. В древности люди считали сон подобием смерти – ведь когда человек ложился в постель, закрывал глаза, его дыхание становилось реже и снижалась реакция на внешние раздражители. Недаром в древнегреческой мифологии бог сна Гипнос и бог смерти Танатос были братьями-близнецами. Тысячелетиями люди думали, что основная функция сна – отдых. Однако, с изобретением в 1928 году электроэнцефалографа – прибора, позволяющего зафиксировать электрическую активность головного мозга, и открытием в 1953 году фазы сна с быстрыми движениями глаз, ученые поняли, что сон – это не монотонное состояние, а активный процесс со множеством функций.
Всех функций сна мы не знаем до сих пор. Но принудительное или сознательное ограничение сна серьезно влияет на психическое и физическое здоровье человека. Недаром в Китае лишение сна считалось одним из самых страшных наказаний. Книга рекордов Гиннесса не фиксирует эксперименты с сознательным лишением сна, считая их смертельно опасными. В настоящее время научно и документально зарегистрированный рекорд максимального пребывания без сна принадлежит Рэнди Гарднеру, который в 1963 году бодрствовал подряд, без использования каких-либо стимуляторов, 260 часов и 17 минут (11 суток).
Недаром в Китае лишение сна считалось одним из самых страшных наказаний. Книга рекордов Гиннесса не фиксирует эксперименты с сознательным лишением сна, считая их смертельно опасными. В настоящее время научно и документально зарегистрированный рекорд максимального пребывания без сна принадлежит Рэнди Гарднеру, который в 1963 году бодрствовал подряд, без использования каких-либо стимуляторов, 260 часов и 17 минут (11 суток).
Даже после одной бессонной ночи, которая случалась в жизни практически у каждого человека, появляется усталость, снижается концентрация внимания, возникают трудности со сложной деятельностью. Если не спать 2-3 ночи, то нарушается координация движений и фокусировка зрения. В дальнейшем появляется раздражительность, замедление движений, нечеткость речи, галлюцинации, странности в поведении. Человек не может поддерживать беседу, становится безразличен к окружающему миру, возникают трудности в совершении простейших бытовых навыков… Все это лишь подтверждает, что качественный сон крайне необходим нашему организму.
Тем не менее, с развитием технологий люди на нашей планете спят все меньше и меньше. По данным американского Национального фонда сна в 1910 году средняя продолжительность сна составляла 9 часов в сутки, в 1975 году – 7,5 часов, а в 2005 году – 6,8 часа в сутки. И тенденция к сокращению среднего времени сна продолжается.
Звуковое, световое (уличное освещение, экраны различных электронных устройств: телефонов, ноутбуков, планшетов и мониторы обычных компьютеров) и информационное (в первую очередь, Интернет) «загрязнение» способствует сокращению продолжительности сна. Желание быть всегда «онлайн», следить за новостями в мире, существенно подрывают психику человека, потому что наш мозг не адаптирован к переработке такого огромного количества информации, порой довольно противоречивой.
Человек становится тревожным и возникают трудности с качественным сном – чаще всего это проблемы с засыпанием или частые ночные пробуждения. Сон человека становится поверхностным и не освежающим. Это, в свою очередь, еще больше усиливает нехватку сна, и в конце концов проявляются те же симптомы, что и у людей, не спавших подряд двое-трое суток.
Это, в свою очередь, еще больше усиливает нехватку сна, и в конце концов проявляются те же симптомы, что и у людей, не спавших подряд двое-трое суток.
В первую очередь сон – это отдых для организма. Если сна будет не хватать количественно или качественно, то человек начнет испытывать физическое недомогание, головные боли, раздражительность. Причем большинство людей даже не осознают, что причина их плохого самочувствия – неполноценный сон. Часто они говорят «у меня сейчас большой стресс», «я закрутился на работе» или «я испытываю усталость». Таким людям необходимо в кратчайшие сроки наверстать дефицит сна и восстановить свой организм. Иначе в дальнейшем они начнут совершать ошибки, которые никогда не совершили бы, если бы их сон был качественным.
В глубоких стадиях сна в нашем организме вырабатывается гормон роста – соматотропин, который запускает программу комплексного обновления организма и регулирует обмен веществ. Поэтому при недостатке сна возрастает риск развития сахарного диабета, гипертонической болезни, ожирения, а также усиливается тяжесть хронических возрастных заболеваний. Недаром, когда человек болеет, ему постоянно хочется спать – так организм «обновляет» себя.
Недаром, когда человек болеет, ему постоянно хочется спать – так организм «обновляет» себя.
Недостаток сна снижает сопротивляемость болезням. Во время сна вырабатываются нейромидиаторы – специальные химические вещества, которые наподобие дирижера заставляют наш организм работать слаженно, как часы. Поэтому иммунная система очень нуждается во сне. Люди, которые хорошо спят – меньше болеют.
Опытные специалисты клиники «Семейный доктор» помогут вам справиться с любыми проблемами со здоровьем. Если же вы не удовлетворены качеством своего сна, у вас храп, остановки дыхания во сне (по словам окружающих) или имеются другие жалобы, связанные со сном или возникающие только в ночное время, то рекомендуем обратиться к врачу-неврологу – специалисту в области расстройств сна. Чтобы записаться на прием невролога, позвоните по телефону контакт-центра +7 (495) 775 75 66, воспользуйтесь сервисом онлайн-записи к врачу или обратитесь в регистратуру клиники.
Врачи объяснили, почему возникает постоянное желание что-нибудь съесть
Гормональный фон
Чувство голода напрямую зависит от гормонального фона. Если вы постоянно чувствуете желание что-нибудь съесть, врачи советуют сдать анализы на несколько гормонов. В первую очередь, это гормон лептин, который вырабатывается после еды и в норме дает сигнал о том, что в организм поступило достаточно питательных веществ. Если же человек регулярно переедает, это означает, что в организме вырабатывается избыток лептина, его концентрация в крови значительно повышается, и сигналы до мозга доходят все хуже и хуже.
Если вы постоянно чувствуете желание что-нибудь съесть, врачи советуют сдать анализы на несколько гормонов. В первую очередь, это гормон лептин, который вырабатывается после еды и в норме дает сигнал о том, что в организм поступило достаточно питательных веществ. Если же человек регулярно переедает, это означает, что в организме вырабатывается избыток лептина, его концентрация в крови значительно повышается, и сигналы до мозга доходят все хуже и хуже.
«Ваш организм «думает», что голодает, хотя на самом деле энергии с пищей он получает более, чем достаточно. С лептинорезистентностью часто сталкиваются люди с лишним весом. Из-за избытка жировой ткани вырабатывается больше лептина, чем нужно», — объясняет Ирина Арар, врач-эндокринолог, специалист по LOWFOODMAP и современному питанию клиники эстетики и качества жизни GMTClinic.
Еще один гормон, отвечающий за чувство голода, – это инсулин. Он регулирует уровень глюкозы в крови и при ее снижении дает сигнал мозгу, что пора принимать пищу. «Если в рационе много простых углеводов, недостаточно белка, или человек не соблюдает кратность питания, уровень инсулина в крови достаточно высок», — предупреждает Ирина Арар. Из-за избытка инсулина рецепторы, находящиеся на поверхности клетки, теряют чувствительность к этому гормону.
Он регулирует уровень глюкозы в крови и при ее снижении дает сигнал мозгу, что пора принимать пищу. «Если в рационе много простых углеводов, недостаточно белка, или человек не соблюдает кратность питания, уровень инсулина в крови достаточно высок», — предупреждает Ирина Арар. Из-за избытка инсулина рецепторы, находящиеся на поверхности клетки, теряют чувствительность к этому гормону.
«Получается, что питательных веществ в крови много, но проникнуть в клетку они не могут, и в мозг начинают поступать сигналы о том, что клетки голодают и их срочно нужно накормить», — объясняет врач.
Как рассказал «Газете.Ru» Валерий Саванович, основатель и владелец медицинской онлайн-лаборатории Lab4U, сильное чувство голода, сопровождающееся жаждой и позывами к частому мочеиспусканию, может быть признаком сахарного диабета — и это напрямую связано с чувствительностью клеток к инсулину.
«Диабет развивается, когда в организме есть нехватка инсулина или ткани тела становятся нечувствительными к нему. В итоге уровень сахара в крови повышается до аномальных значений, что представляет серьезную угрозу жизни», — предупреждает он.
В итоге уровень сахара в крови повышается до аномальных значений, что представляет серьезную угрозу жизни», — предупреждает он.
Повышенное чувство голода также может быть вызвано болезнями щитовидной железы, гормоны которой контролируют скорость обмена веществ в организме. По словам Савановича, изменения в функциях щитовидной железы отражаются на настроении человека, его весе и уровне энергии в целом. Однако не стоит бежать сдавать анализы «наобум», выявить проблемы поможет врач-эндокринолог.
Нарушения работы ЖКТ
К ним относятся различного рода ферментопатии и нарушение всасывания питательных веществ в ЖКТ, объясняют врачи. По словам Ирины Арар, человек может съедать свое привычное количество калорий, но эта еда просто не будет нормально расщепляться и усваиваться. Нарушение функций ЖКТ часто сопровождается расстройством стула, синдромом раздраженного кишечника и метеоризмом.
Связь мозга и пищеварительной системы обеспечивают гормоны желудочно-кишечного тракта, которые выделяют эндокринные клетки в кишечнике. Эти гормоны способны влиять на секрецию инсулина и активировать участки мозга, отвечающие за прием пищи.
Эти гормоны способны влиять на секрецию инсулина и активировать участки мозга, отвечающие за прием пищи.
«Яркий пример – гормон грелин, повышающий аппетит. Его секреция возрастает, если человек недоедает, и падает, когда человек сыт. Но иногда система дает сбой, и возникает стойкое чувство голода», — объясняет Валерий Саванович.
Нарушение сна
Многочисленные исследования показали: при нехватке сна происходит активация отдельных зон мозга, которая приводит к усиленному голоду. Валерий Саванович объясняет: на фоне недосыпа активируется выделение грелина и падает уровень лептина, результатом чего становится рост аппетита и тяга к калорийной пище.
«Если человек нормально не поспал хотя бы одну ночь, то он съедает на следующий день на 150 ккал больше», — утверждает Ирина Арар.
Врач объясняет этот факт нарушением гормонального баланса, в частности, сбоями в синтезе гормона стресса – кортизола. В результате человек пытается компенсировать дисбаланс с помощью еды.
Пищевые расстройства
С расстройством пищевого поведения сегодня может столкнуться каждый. К этим состояниям относят не только анорексию и булимию, но и увлечение жесткими диетами, постоянное недовольство своим телом и эмоциональное «заедание» стресса.
«Если практикуются частые перекусы, в особенности состоящие из быстрых углеводов (сладостей, например), чувство голода будет быстро возвращаться. Все просто: такие продукты резко повышают уровень сахара в крови, но после скачка происходит резкое падение», — говорит Валерий Саванович.
Причины развития пищевых расстройств до сих пор не до конца ясны, но разбираться и решать их должен врач, уверена Ирина Арар. «Тема нарушения пищевого поведения очень сложная, и с ней должен работать психиатр», — говорит она.
Свою позицию эндокринолог объясняет тем, что пищевые расстройства всегда связаны с нарушениями синтеза и работы нейромедиаторов. И в случае любых проявлений нарушения пищевого поведения врач должен собрать полный анамнез, в том числе, узнать о генетических предрасположенностях пациента. «Если в генотипе есть поломки, то это всегда связано с психиатрией», — утверждает она.
«Если в генотипе есть поломки, то это всегда связано с психиатрией», — утверждает она.
По мнению Ирины Арар, вместе с психиатрами побороть пищевые расстройства помогают также health-коучи. «Эта профессия появилась в США и уже набирает популярность в нашей стране. Их задача поддерживать тех, кто лечится от пищевой зависимости, в течение всего периода терапии», — рассказывает Арар.
Паразитарные инфекции
Многие уверены, что паразиты – проблема маленьких детей. Но врачи утверждают, что это совсем не так. Правда, выявить паразитоз у взрослого человека действительно сложнее, ведь яркие симптомы отсутствуют, а чувство усталости и постоянное желание перекусить мы списываем на стресс и недосып. Между тем паразиты часто могут быть причиной воспалений, нарушений сна и расстройств пищевого поведения.
Между тем паразиты часто могут быть причиной воспалений, нарушений сна и расстройств пищевого поведения.
«Когда ко мне на прием приходят полные люди с запросом похудеть, я часто назначаю им анализ кала. В результате нередко обнаруживаются такие паразиты, как лямблии или кандида. Они в достаточной степени влияют на наши пищевые привычки.
По сути, мы их кормим, они едят то, чем питаемся мы сами. И потом выдают нам свои «пожелания» — то, чего им самим хочется.
Так что если вам хочется сладкого, то вполне возможно, что это просто кандида сидит и скучает», — рассказывает Ирина Арар.
Как и в случае с гормонами, анализы на типы паразитарной инфекции должен назначать врач. «Это могут быть антитела к гельминтам, анализ кала на яйца гельминтов и цисты простейших», — говорит Валерий Саванович.
Микробы для здоровья | Наука и жизнь
Человеческое тело даёт приют огромному количеству микроорганизмов — бактерий, микроскопических грибов, простейших, вирусов. Даже если взять из них только бактерии, то их всё равно окажется заметно больше, чем наших собственных клеток: на среднего человека массой 70 кг приходится около 30 трлн клеток тела и около 40 трлн бактерий*. И далеко не все они вредные, многие живут с нами как микроскопические квартиранты, образуя разнообразную микрофлору: в кишечнике, на коже, даже в глазах.
Флорис Герритс ван Схотен. Натюрморт с фруктами, овощами и сценой ужина в Эммаусе. 1630 год. Амстердам, Государственный музей (Рейксмюсеум).
И далеко не все они вредные, многие живут с нами как микроскопические квартиранты, образуя разнообразную микрофлору: в кишечнике, на коже, даже в глазах.
Флорис Герритс ван Схотен. Натюрморт с фруктами, овощами и сценой ужина в Эммаусе. 1630 год. Амстердам, Государственный музей (Рейксмюсеум).‹
›
Самые многочисленные в организме — кишечные бактерии. Их как минимум около 1000 видов (хотя 99% из них приходится на 30—40 главных видов). В научно-популярной литературе кишечную микрофлору порой называют дополнительным органом. Бактерии желудочно-кишечного тракта помогают нам расщеплять многие трудноперевариваемые соединения, в первую очередь сложные углеводы, вроде крахмала, пищевых волокон и др., облегчают всасывание магния, кальция и железа, синтезируют для нас витамин К и некоторые витамины группы В. Но этим роль кишечных бактерий не ограничивается: они влияют буквально на всё, от иммунитета до мозга. Каждый месяц выходит множество научных статей, посвящённых различным аспектам микрофлоры: кто-то исследует, откуда она берётся и как меняется в течение жизни; кто-то изучает её взаимоотношения с другими микрообитателями организма — вирусами, грибами, простейшими; кто-то анализирует состав микрофлоры с точки зрения эволюции. Чтобы описать всё, что мы знаем о наших бактериях, понадобится целая книга, и не одна, поэтому сейчас мы бегло упомянем лишь о некоторых, по нашему мнению, наиболее интересных «микрофлорных» темах.
Чтобы описать всё, что мы знаем о наших бактериях, понадобится целая книга, и не одна, поэтому сейчас мы бегло упомянем лишь о некоторых, по нашему мнению, наиболее интересных «микрофлорных» темах.
Микрофлора против ожирения
У биологов и медиков накопилась масса данных о том, что микрофлора людей с диабетом или избыточным весом отличается от микрофлоры здоровых людей. Естественно, возникает вопрос, в какую сторону тут работает причинно-следственная связь. Для начала попробовали проследить эту связь на мышах. Что будет, если, например, пересадить бактерии от толстой мыши к худой? Не потолстеет ли она? И наоборот, не похудеет ли толстая мышь от бактерий, взятых от худой? Результаты экспериментов подтвердили: микрофлора влияет на массу тела, а заодно и на вероятность диабета второго типа, который часто сопутствует избыточному весу.
Если подсунуть мышам человеческие штаммы микроорганизмов, результат окажется тот же: бактерии от полных людей заставят мышей пополнеть, даже если они будут есть свою обычную еду, — такой эксперимент несколько лет назад описали в статье в «Science» исследователи из Вашингтонского университета в Сент-Луисе. Более того, когда животным, потолстевшим из-за человеческих бактерий, давали другие бактерии, взятые уже у худых людей, то мыши переставали набирать вес. Но при этом «бактерии нормального веса» не приживались в кишечнике толстых мышей, если животных держали на нездоровой диете, бедной клетчаткой и перенасыщенной жирами. То есть питание играет существенную роль в том, какие бактерии получат преимущество.
Более того, когда животным, потолстевшим из-за человеческих бактерий, давали другие бактерии, взятые уже у худых людей, то мыши переставали набирать вес. Но при этом «бактерии нормального веса» не приживались в кишечнике толстых мышей, если животных держали на нездоровой диете, бедной клетчаткой и перенасыщенной жирами. То есть питание играет существенную роль в том, какие бактерии получат преимущество.
Было бы интересно узнать, какие именно группы микробов можно назвать «бактериями нормального веса». Среди тех, кому можно приписать защиту от ожирения, чаще всего упоминают род Bacteroides и ещё ряд других, например бактерию Akkermansia muciniphila. Конечно, вряд ли всё сводится к конкретному виду или роду. В последнее время обычно говорят о том, что здоровая микрофлора — это разно-образная микрофлора, то есть не столько та, в которой преобладают какие-то особо полезные бактериальные штаммы, сколько собранная из большого количества самых разных видов. Но в любом случае важно знать механизм, с помощью которого бактерии влияют на обмен веществ.
С одной стороны, они питаются в прямом смысле с нашего стола. И есть свидетельства в пользу того, что кишечные микробы могут влиять на наши предпочтения в еде. Причём изменения в предпочтениях начинаются как раз тогда, когда микрофлора утрачивает разнообразие. Можно предположить, что, если в кишечнике живёт много разных видов, они тратят много сил на конкуренцию друг с другом, поэтому им не до того, чтобы диктовать хозяину, как питаться. Если же всё сводится к небольшому числу видов, то микробы начинают использовать хозяина как инструмент для получения еды, причём еды высокоэнергетической и легкоперерабатываемой, — так что человек начинает есть то, что называется вредной едой. Бактерии получают свою порцию легкодоступной энергии, но всё остальное достаётся человеку в виде лишних калорий.
С другой стороны, микробы продуцируют массу химических веществ, часть которых получается при переваривании пищи, а часть синтезируют они сами. Эти вещества могут работать сигналами для наших клеток, направляя обмен веществ в ту или иную сторону. Например, известно, что короткоцепочечные жирные кислоты (пропионовая, масляная и им подобные), которые образуются при расщеплении бактериями растительной клетчатки, благотворно влияют на метаболизм глюкозы. А особый бактериальный белок позволяет управлять синтезом жёлчных кислот в печени, которые, в свою очередь, получаются из холестерина. Превращая холестерин в жёлчные кислоты, печень отправляет их в кишечник, и бактерии могут сообщить печени, когда жёлчных кислот много, а когда мало, тем самым отрегулировав уровень холестерина.
Например, известно, что короткоцепочечные жирные кислоты (пропионовая, масляная и им подобные), которые образуются при расщеплении бактериями растительной клетчатки, благотворно влияют на метаболизм глюкозы. А особый бактериальный белок позволяет управлять синтезом жёлчных кислот в печени, которые, в свою очередь, получаются из холестерина. Превращая холестерин в жёлчные кислоты, печень отправляет их в кишечник, и бактерии могут сообщить печени, когда жёлчных кислот много, а когда мало, тем самым отрегулировав уровень холестерина.
Саму жёлчь микрофлора также перерабатывает, и в результате получается соединение под названием «дезоксихолиевая кислота». В 2012 году в «Nature» вышла статья, в которой говорилось, что при ожирении уровень этой кислоты становится особенно высок и, что важно, из-за неё возрастает вероятность рака печени (эксперименты ставили на мышах). Известно, что избыточный вес связан с онкологическими заболеваниями, и по крайней мере в некоторых случаях связующим звеном тут выступают кишечные бактерии.
Можно ещё вспомнить об индоле и индолпропионовой кислоте — их также производят желудочно-кишечные бактерии. В двух статьях, опубликованных в прошлом году в журналах «PNAS» и «Scientific Reports», говорится о том, какую пользу получает организм от обоих этих веществ. Индол, как показали эксперименты с круглыми червями, дрозофилами и мышами, помогает противостоять возрастным болезням: животные, у которых было много «индольных» бактерий, умирали не позже обычного, но зато у них была здоровая старость. В другой статье речь идёт уже о людях: авторы работы утверждают, что высокий уровень индолпропионовой кислоты в крови предотвращает диабет второго типа. Бактерии производят особенно много индолпропионовой кислоты, если в нашем рационе много растительной клетчатки — тех самых трудноперевариваемых углеводов.
Наконец, влияние бактерий на обмен веществ может зависеть от иммунитета. В частности, иммунная система с помощью гамма-интерферона может изгонять из кишечника одну из «бактерий похудения» — Akkermansia muciniphila. Если она есть, то клетки организма нормально реагируют на инсулин и впитывают глюкозу, если же A. muciniphila становится мало, клетки перестают чувствовать инсулин, а это — один из главных предвестников и симптомов диабета второго типа. В статье в «Nature Communications», опубликованной в 2016 году, говорится, что численность бактерий можно поднять, если подавить синтез гамма-интерферона — иными словами, нормальный обмен веществ зависит от того, в каком состоянии находится иммунитет.
Если она есть, то клетки организма нормально реагируют на инсулин и впитывают глюкозу, если же A. muciniphila становится мало, клетки перестают чувствовать инсулин, а это — один из главных предвестников и симптомов диабета второго типа. В статье в «Nature Communications», опубликованной в 2016 году, говорится, что численность бактерий можно поднять, если подавить синтез гамма-интерферона — иными словами, нормальный обмен веществ зависит от того, в каком состоянии находится иммунитет.
Микрофлора и иммунитет
Тут самое время поразмышлять о взаимоотношениях иммунитета и кишечной микрофлоры в целом. Вообще говоря, иммунная система должна уничтожать бактерии. В тимусе, или вилочковой железе, специальные иммунные клетки учатся отличать собственные клетки организма от чужеродных элементов. Но кишечные бактерии уничтожать нельзя. Отличить же в огромной массе кишечной микрофлоры хорошие бактерии от плохих очень непросто. В кишечнике для этого есть свой департамент иммунной системы, так называемая кишечная лимфоидная ткань, причём некоторых иммунных клеток тут больше, чем в селезёнке, лимфатических узлах и костном мозге, вместе взятых.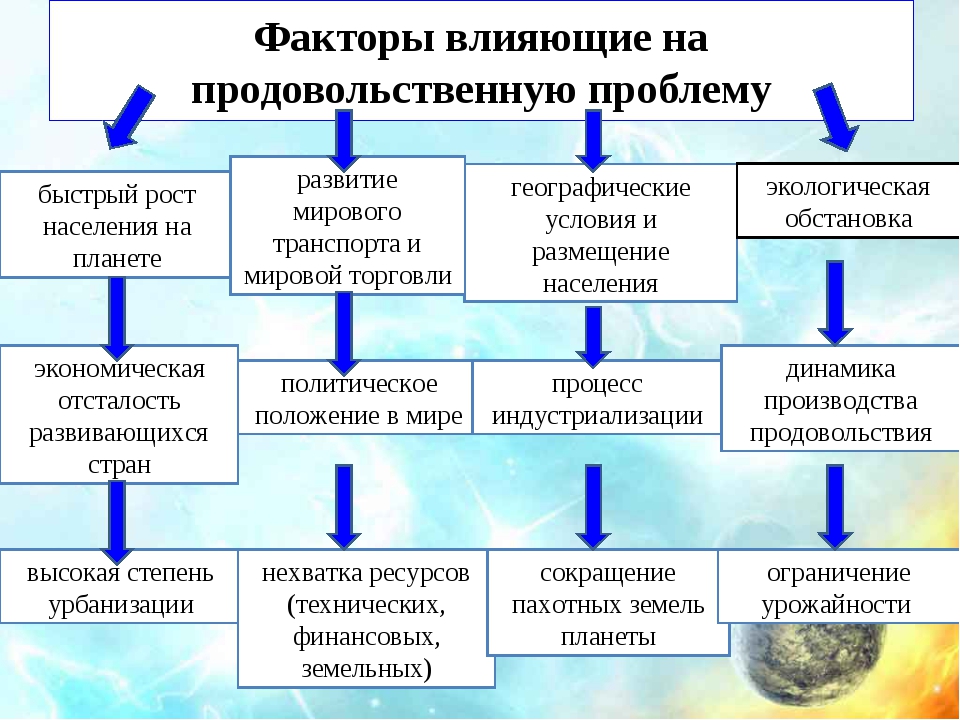 Несколько лет назад в «Nature» появилась статья, авторы которой утверждали, что созревающие иммунные клетки, в чьи обязанности входит отличать своих от чужих, проходят дополнительный «учебный курс» в кишечнике, где запоминают дружественную микрофлору, так сказать, в лицо. С другой стороны, даже дружественные бактерии могут превратиться в патогенные, если слишком близко подойдут к эпителиальным клеткам кишечника (обычно их разделяет друг от друга толстый слой слизистой оболочки). Чтобы этого не случилось, иммунитет формирует вокруг бактериальных клеток особые белковые капсулы, не позволяя им подойти к эпителию вплотную. Но если такое всё-таки случится, иммунные клетки, вероятно, могут как-то перенастроиться, чтобы отбить атаку друзей, ставших врагами. Так или иначе, пока мы не знаем во всех деталях, как микрофлора и иммунитет притираются друг к другу.
Несколько лет назад в «Nature» появилась статья, авторы которой утверждали, что созревающие иммунные клетки, в чьи обязанности входит отличать своих от чужих, проходят дополнительный «учебный курс» в кишечнике, где запоминают дружественную микрофлору, так сказать, в лицо. С другой стороны, даже дружественные бактерии могут превратиться в патогенные, если слишком близко подойдут к эпителиальным клеткам кишечника (обычно их разделяет друг от друга толстый слой слизистой оболочки). Чтобы этого не случилось, иммунитет формирует вокруг бактериальных клеток особые белковые капсулы, не позволяя им подойти к эпителию вплотную. Но если такое всё-таки случится, иммунные клетки, вероятно, могут как-то перенастроиться, чтобы отбить атаку друзей, ставших врагами. Так или иначе, пока мы не знаем во всех деталях, как микрофлора и иммунитет притираются друг к другу.
Однако не стоит думать, что всё взаимодействие между иммунитетом и микрофлорой заключается в том, что иммунитет выдаёт хорошим бактериям разрешение на работу. Например, известно, что многие аутоиммунные заболевания происходят из-за малого разнообразия микрофлоры в детском возрасте. Иммунные клетки, которые видели мало бактерий в кишечнике (и не только в кишечнике), хуже различают «своих» и «чужих» и могут внезапно атаковать дружественную бактерию или безобидную пищевую молекулу. Предрасположенность к аллергии, астме, диабету первого типа (при котором иммунитет атакует клетки поджелудочной железы) может возникать из-за того, что иммунная система в своё время общалась со слишком скудным набором кишечных бактерий. С другой стороны, такие серьёзные желудочно-кишечные заболевания воспалительной природы, как болезнь Крона и неспецифический язвенный колит, возникают на фоне разбалансированной микрофлоры, когда её разнообразие уменьшается и преимущество получают какие-то отдельные штаммы.
Например, известно, что многие аутоиммунные заболевания происходят из-за малого разнообразия микрофлоры в детском возрасте. Иммунные клетки, которые видели мало бактерий в кишечнике (и не только в кишечнике), хуже различают «своих» и «чужих» и могут внезапно атаковать дружественную бактерию или безобидную пищевую молекулу. Предрасположенность к аллергии, астме, диабету первого типа (при котором иммунитет атакует клетки поджелудочной железы) может возникать из-за того, что иммунная система в своё время общалась со слишком скудным набором кишечных бактерий. С другой стороны, такие серьёзные желудочно-кишечные заболевания воспалительной природы, как болезнь Крона и неспецифический язвенный колит, возникают на фоне разбалансированной микрофлоры, когда её разнообразие уменьшается и преимущество получают какие-то отдельные штаммы.
Очевидно, кишечные бактерии активно общаются с иммунными клетками с помощью каких-то сигнальных веществ. Причём было замечено, что одни бактерии, например Bacteroides fragilis и некоторые клостридии, помогают затушить воспаление, другие же, наоборот, активируют в иммунных клетках воспалительные молекулы. Иными словами, чтобы воспалительная реакция была не слишком сильной и не слишком слабой, в кишечнике должен быть правильный баланс между разными микробами.
Иными словами, чтобы воспалительная реакция была не слишком сильной и не слишком слабой, в кишечнике должен быть правильный баланс между разными микробами.
Короткие жирные кислоты, о которых мы упоминали в связи с метаболизмом глюкозы, играют роль и во взаимодействии бактерий и иммунитета. Они подавляют иммунные сигналы, которые могут привести к аутоиммунной реакции. В частности, известно, что высокий уровень коротких жирных кислот снижает вероятность астмы. Что до пищевой аллергии, то тут можно вспомнить эксперименты сотрудников Чикагского университета, которые давали мышам с аллергией на арахис раствор с клостридиями, и аллергия у животных слабела. Дальнейшие исследования показали, что клостридии побуждают иммунитет синтезировать противовоспалительный белок, который подавляет аллергическую реакцию.
Некоторое время назад исследователи из Гарварда обнаружили, что кишечные бактерии помогают иммунитету создавать новые белки иммуноглобулины, или антитела. Как мы знаем, антитела — продукт В-лимфоцитов, которые постоянно тасуют куски генов иммуноглобулинов; в результате получается множество разновидностей антител. Если в организме появится какая-то абсолютно незнакомая инфекция, то среди разнообразнейших антител явно найдётся то, которое сможет опознать молекулы неизвестного патогена. И вот оказалось, что В-лимфоциты активнее перемонтируют иммуноглобулиновые гены, если в кишечнике есть бактерии, — то есть микрофлора каким-то образом стимулирует разнообразие антител.
Если в организме появится какая-то абсолютно незнакомая инфекция, то среди разнообразнейших антител явно найдётся то, которое сможет опознать молекулы неизвестного патогена. И вот оказалось, что В-лимфоциты активнее перемонтируют иммуноглобулиновые гены, если в кишечнике есть бактерии, — то есть микрофлора каким-то образом стимулирует разнообразие антител.
Наконец, последний замечательный пример благотворного влияния кишечных бактерий на иммунитет — это их помощь в борьбе со злокачественными опухолями. И эксперименты на животных, и наблюдения за онкобольными говорят о том, что микрофлора помогает иммунной системе атаковать раковые клетки в полную силу и что без микрофлоры или с ослабленной микрофлорой эффективность противораковых средств будет заметно ниже.
Микрофлора и мозг
Но самые интригующие новости связаны, пожалуй, с действием микрофлоры на нервную систему. В кишечнике находится огромное количество нервов, в том числе и отростки блуждающего нерва, который сообщает информацию прямо в мозг. В кишечнике же синтезируется 90% серотонина и половина всего дофамина, содержащихся в нашем теле, — а серотонин и дофамин активно используют нейроны мозга. Естественно, бактерии, которые живут в желудочно-кишечном тракте и активно с ним взаимодействуют, через кишечник могут общаться и с центральной нервной системой.
В кишечнике же синтезируется 90% серотонина и половина всего дофамина, содержащихся в нашем теле, — а серотонин и дофамин активно используют нейроны мозга. Естественно, бактерии, которые живут в желудочно-кишечном тракте и активно с ним взаимодействуют, через кишечник могут общаться и с центральной нервной системой.
Впервые о том, что микрофлора влияет на поведение, активно заговорили в первой половине 2000-х, после экспериментов с мышами, лишёнными кишечных бактерий. Оказалось, что такие мыши острее реагируют на стресс. Это заметно по активности гипоталамуса и гипофиза в мозге и по активности надпочечников (так называемая гипоталамо-гипофизарно-надпочечниковая ось — важная нейроэндокринная система, которая контролирует огромное количество физиологических процессов, в том числе и стрессовые реакции). В 2011 году в журнале «PNAS» вышла статья, авторы которой утверждали, что присутствие или отсутствие бактерий в пищеварительной системе сказывалось на активности 40 генов в нервных клетках. Дальнейшие исследования показали, что кишечные бактерии синтезируют целый ряд нейроактивных молекул, включая такие нейромедиаторы, как ацетилхолин и серотонин, и что микробы могут влиять на мозг в том числе и через иммунные сигнальные белки.
Дальнейшие исследования показали, что кишечные бактерии синтезируют целый ряд нейроактивных молекул, включая такие нейромедиаторы, как ацетилхолин и серотонин, и что микробы могут влиять на мозг в том числе и через иммунные сигнальные белки.
Например, в экспериментах исследователей из Калифорнийского технологического института бактерия Bacteroides fragilis избавила мышей от отдельных симптомов аутизма. Некоторые изменения в микрофлоре сопутствуют депрессии и повышенной тревожности, и это можно исправить с помощью тех или иных микробов. Большая часть таких исследований выполняется на животных, однако в последнее время в них всё чаще фигурируют люди. Например, в недавней статье в «EBioMedicine» говорится, что пробиотики ослабляют послеродовую депрессию, а в более старой работе в журнале «Gastroenterology» сотрудники Калифорнийского университета в Лос-Анджелесе даже описали, как пробиотики меняют активность человеческого мозга: большая часть изменений касалась зон, связанных с эмоциями. Хотя исследования на людях пока что не столь многочисленны, чтобы делать какие-то надёжные выводы, тем не менее накапливается всё больше данных, что микрофлора влияет на эмоциональную сферу и на способность противостоять стрессам. Вероятно, антистрессовое влияние бактерий связано с тем, что они подавляют воспалительную реакцию (о том, как связаны стресс и воспаление, можно прочесть в статье «Говорят, все болезни от нервов» в «Науке и жизни» № 12, 2016 г.).
Хотя исследования на людях пока что не столь многочисленны, чтобы делать какие-то надёжные выводы, тем не менее накапливается всё больше данных, что микрофлора влияет на эмоциональную сферу и на способность противостоять стрессам. Вероятно, антистрессовое влияние бактерий связано с тем, что они подавляют воспалительную реакцию (о том, как связаны стресс и воспаление, можно прочесть в статье «Говорят, все болезни от нервов» в «Науке и жизни» № 12, 2016 г.).
Еда для бактерий
Конечно, порой случается так, что вред от микрофлоры перевешивает пользу. О том, что кишечные бактерии бывают связаны с избыточным весом, мы уже говорили. Заодно можно вспомнить статью в «Cell» в позапрошлом году, в которой сообщалось, что кишечные бактерии могут ускорить болезнь Паркинсона, и прошлогоднюю статью в «Science» про бактерий, которые помогают выживать раковой опухоли, расщепляя лекарства против неё. Чтобы такого не происходило, нужно знать, как поддерживать свою микрофлору в здоровом состоянии.
Поскольку микрофлора имеет дело непосредственно с едой, то и действовать на неё лучше с помощью еды. «Хорошие» бактериальные молекулы — короткоцепочечные жирные кислоты — получаются, когда бактерии расщепляют клетчатку, значит, нужно есть больше растительной пищи, овощей и фруктов.
О том, что овощи и фрукты улучшают микрофлору, написано много. В качестве примера можно привести статью в журнале «Nutrients», опубликованную в мае этого года исследователями из Университета ИТМО и их коллегами из других научных центров России, США, Нидерландов и Великобритании. Они оценили рацион 248 добровольцев, разработали для них персональную диету, более сбалансированную и обогащённую пищевыми волокнами, которую нужно было соблюдать две недели, а затем сравнили состояние микрофлоры до двухнедельной диеты и после. Разумеется, исследователи принимали во внимание и другие факторы, которые могли повлиять на кишечные бактерии, включая пищевые привычки, приём антибиотиков, пол и возраст. Изначально состояние микрофлоры было лучше у тех, кто регулярно потреблял много овощей и фруктов. Но и у тех, у кого микрофлора была не очень, она заметно улучшалась через эти две недели на специальной диете. В частности, становилось больше тех бактерий, что дают масляную кислоту, одну из тех коротких жирных кислот, которые хорошо влияют на метаболизм и иммунитет. Обычно подобные исследования проводятся в условиях клиники под жёстким контролем, но сейчас смысл был в другом: показать, что даже нестрогое соблюдение «волокнистой» дие-ты всего лишь через две недели приводит к положительным изменениям.
Изначально состояние микрофлоры было лучше у тех, кто регулярно потреблял много овощей и фруктов. Но и у тех, у кого микрофлора была не очень, она заметно улучшалась через эти две недели на специальной диете. В частности, становилось больше тех бактерий, что дают масляную кислоту, одну из тех коротких жирных кислот, которые хорошо влияют на метаболизм и иммунитет. Обычно подобные исследования проводятся в условиях клиники под жёстким контролем, но сейчас смысл был в другом: показать, что даже нестрогое соблюдение «волокнистой» дие-ты всего лишь через две недели приводит к положительным изменениям.
Также есть работы, в которых говорится, что микрофлору можно улучшить, если в еде присутствуют растительные полифенолы. Полифенолов содержится много в чае, как зелёном, так и чёрном, какао-бобах, винограде (и красном вине), брокколи, миндале. Другой источник радости для кишечных бактерий — ферментированная еда, от кислой капусты до разнообразных кисломолочных продуктов. Здесь, кстати, стоит напомнить, что о пользе молочнокислых продуктов для кишечной микрофлоры много писал наш нобелевский лауреат Илья Ильич Мечников. Он вообще считал, что «кислое молоко» может отсрочить старость и смерть (в свете новейших исследований микрофлоры надо признать, что Мечников, вероятно, был не так уж неправ в своём отношении к «кислому молоку»). В целом общий вывод такой: чтобы поддерживать кишечную микрофлору в здоровом состоянии, нужно питаться разнообразно.
Он вообще считал, что «кислое молоко» может отсрочить старость и смерть (в свете новейших исследований микрофлоры надо признать, что Мечников, вероятно, был не так уж неправ в своём отношении к «кислому молоку»). В целом общий вывод такой: чтобы поддерживать кишечную микрофлору в здоровом состоянии, нужно питаться разнообразно.
В то же время многие исследования посвящены тому, чего есть не надо. Одна из самых масштабных статей на эту тему опубликована в «Science» в 2016 году. В ней сотрудники Лёвенского католического университета описывают 126 факторов, влияющих на микрофлору. Среди факторов, которые влияют негативно, предсказуемо оказались еда с быстроусваиваемыми углеводами, а также чипсы, попкорн и прочие «печеньки» вкупе со сладкими напитками; кроме того, разнообразные лекарства: антибиотики, осмотические слабительные, бензодиазепины, антидепрессанты, антигистаминные и гормональные препараты. Конечно, надо помнить, что состав микрофлоры у людей может довольно сильно отличаться, потому что все мы по-разному питаемся и живём с разными привычками; однако, например, антибиотики или недостаток овощей в питании влияют на микрофлору независимо от индивидуальных различий.
Говоря об улучшении микрофлоры, нельзя не вспомнить про пребиотики (пищевые добавки, которые стимулируют размножение полезных кишечных бактерий) и пробиотики (препараты, которые содержат эти самые бактерии). Действительно, и те и другие часто рекомендуется пить после курса антибиотиков, чтобы восстановить микрофлору, те и другие регулярно используют в исследованиях как на животных, так и на людях. Однако если нужно добиться долгого и надёжного эффекта в отношении микрофлоры, то лучше всё-таки это делать с помощью правильного питания и вообще здорового образа жизни, без вредных привычек, и регулярно занимаясь спортом. Кстати, физические упражнения сами по себе помогают создать здоровую микрофлору. Здесь напоследок мы вспомним статью в журнале «Gut Microbes», вышедшую в конце прошлого года. В ней описан эксперимент, в котором несколько десятков людей, страдающих ожирением, заставляли трижды в неделю по 30—60 минут активно заниматься физическими упражнениями. При этом питались они так же, как и раньше, тем не менее через полтора месяца их микрофлора стала более здоровой. А то, что изменения в лучшую сторону исчезли, как только участники эксперимента вернулись к сидячему образу жизни, с очевидностью доказывает: физическая активность может сильно помочь тому, кто хочет сохранить хорошие отношения со своими кишечными бактериями.
А то, что изменения в лучшую сторону исчезли, как только участники эксперимента вернулись к сидячему образу жизни, с очевидностью доказывает: физическая активность может сильно помочь тому, кто хочет сохранить хорошие отношения со своими кишечными бактериями.
Комментарии к статье
* Раньше считалось, что число бактериальных клеток в 10 раз превосходит число клеток тела, однако в последние годы это соотношение было скорректировано.
Паразитические простейшие и взаимодействие с кишечной микробиотой хозяина
Infect Immun. 2017 авг; 85(8): e00101-17.
Энтони Т. Маурелли, редакторЭнтони Т. Маурелли, Университет Флориды;
Отделение инфекционных заболеваний и международного здравоохранения, медицинский факультет Университета Вирджинии, Шарлоттсвилль, Вирджиния, США
Автор, ответственный за переписку. Citation Burgess SL, Gilchrist CA, Lynn TC, Petri WA, Jr. 2017. Паразитические простейшие и взаимодействие с кишечной микробиотой хозяина. Заразить Иммуна 85:e00101-17. https://doi.org/10.1128/IAI.00101-17.Эта статья была процитирована другими статьями в PMC.
Заразить Иммуна 85:e00101-17. https://doi.org/10.1128/IAI.00101-17.Эта статья была процитирована другими статьями в PMC.РЕФЕРАТ
Паразитарные протозойные инфекции представляют собой серьезное бремя для здоровья в развивающихся странах и вносят значительный вклад в заболеваемость и смертность. Эти инфекции часто связаны со значительной вариабельностью клинических проявлений. Новые исследования предполагают, что кишечная микробиота может помочь объяснить некоторые из этих различий в проявлении болезни.Цель этого мини-обзора состоит в том, чтобы обобщить последние достижения в этой быстро развивающейся области. Обсуждаются исследования человека и животных и in vitro исследований вклада кишечной микробиоты в инфекционные заболевания. Мы надеемся дать представление о взаимодействии человека, протозойного патогена и микробиома и предположить, как это можно использовать для лечения.
КЛЮЧЕВЫЕ СЛОВА: микробиота, паразит, патоген-хозяин, простейшие
ВВЕДЕНИЕ
В отличие от основных бактериальных и вирусных патогенов, не существует общепризнанных и доступных вакцин для предотвращения паразитарных протозойных инфекций. Лучшее понимание факторов, влияющих на иммунитет к этим заболеваниям, может стать основой для разработки новых мер общественного здравоохранения. Передача кишечных простейших обычно происходит фекально-оральным путем. Кишечник густо населен комменсальными бактериями, способными влиять на поведение простейших паразитов, с которыми они непосредственно взаимодействуют (1). Однако потенциальное влияние микробиоты на паразитов не ограничивается кишечными простейшими.Простейшие, которые живут в крови или тканях человека, также могут быть затронуты взаимодействием между микрофлорой кишечника и метаболизмом хозяина и иммунной системой (1,–6). Таким образом, в этом обзоре основное внимание будет уделено влиянию микробиоты человека на паразитических простейших, поражающих кишечник ( Entamoeba histolytica , Giardia , Cryptosporidium , Blastocystis hominis ) или влагалище ( Trichomonas). вызывают системные инфекции ( Plasmodium falciparum ) (7).Изменения в составе кишечной микробиоты могут повышать устойчивость к инфекциям на слизистых оболочках, а также изменять системный иммунитет к этим паразитам (4).
Лучшее понимание факторов, влияющих на иммунитет к этим заболеваниям, может стать основой для разработки новых мер общественного здравоохранения. Передача кишечных простейших обычно происходит фекально-оральным путем. Кишечник густо населен комменсальными бактериями, способными влиять на поведение простейших паразитов, с которыми они непосредственно взаимодействуют (1). Однако потенциальное влияние микробиоты на паразитов не ограничивается кишечными простейшими.Простейшие, которые живут в крови или тканях человека, также могут быть затронуты взаимодействием между микрофлорой кишечника и метаболизмом хозяина и иммунной системой (1,–6). Таким образом, в этом обзоре основное внимание будет уделено влиянию микробиоты человека на паразитических простейших, поражающих кишечник ( Entamoeba histolytica , Giardia , Cryptosporidium , Blastocystis hominis ) или влагалище ( Trichomonas). вызывают системные инфекции ( Plasmodium falciparum ) (7).Изменения в составе кишечной микробиоты могут повышать устойчивость к инфекциям на слизистых оболочках, а также изменять системный иммунитет к этим паразитам (4).
Микробиота кишечника хозяина и взаимодействие с хозяином и паразитом. Изменения в составе кишечной микробиоты (изображение 1) могут повышать устойчивость к заражению паразитами на участках слизистой оболочки, таких как кишечник, за счет таких механизмов, как снижение вирулентности или прилипание паразитов (изображение 2). Изменения в микробиоте также могут изменить системный иммунитет к паразитам за счет изменения гранулопоэза или адаптивного иммунитета (изображение 3).Лучшее понимание механизмов, лежащих в основе защиты, опосредованной микробиотой, может помочь объяснить клиническую изменчивость и помочь в лечении паразитарных протозойных инфекций.
ПРОСТЕЙШИЕ ПАРАЗИТЫ И СФЕРА ВОЗДЕЙСТВИЯ НА ОБЩЕСТВЕННОЕ ЗДОРОВЬЕ
Во всем мире диарея в настоящее время является второй по значимости причиной смерти детей в возрасте до 5 лет и связана примерно с 500 000 смертей в год (8,–10). Хотя диарею могут вызывать многие патогены, в значительной части случаев возбудителем является паразитическое простейшее (11). По оценкам, в 2010 г. 357 миллионов случаев заболевания по крайней мере одним из трех кишечных простейших, Entamoeba , Cryptosporidium и Giardia , привели к 33 900 смертельным исходам и потере 2,94 миллиона лет жизни с поправкой на инвалидность (12). . В недавнем исследовании диареи средней и тяжелой степени у африканских и азиатских детей Cryptosporidium spp. были одними из основных патогенов, вызывающих диарею (13).
По оценкам, в 2010 г. 357 миллионов случаев заболевания по крайней мере одним из трех кишечных простейших, Entamoeba , Cryptosporidium и Giardia , привели к 33 900 смертельным исходам и потере 2,94 миллиона лет жизни с поправкой на инвалидность (12). . В недавнем исследовании диареи средней и тяжелой степени у африканских и азиатских детей Cryptosporidium spp. были одними из основных патогенов, вызывающих диарею (13).
Несмотря на значительную нагрузку на здоровье, вызываемую простейшими, инфекции могут протекать бессимптомно.Например, в когорте детей из Бангладеш было обнаружено, что Entamoeba histolytica , возбудитель амебиаза, вызывает диарею только в 1 из 4 инфекций (14, 15). Инфекции, вызванные Cryptosporidium и Giardia , также характеризуются широким разнообразием клинических проявлений (16,–19). Инфекция Plasmodium приводит к клиническим проявлениям, которые варьируются от бессимптомной до тяжелой малярии, и ежегодно приводит к смерти около 1 миллиона человек. Несмотря на эти потери, факторы, определяющие тяжесть заболевания, остаются плохо изученными (20).Генетика хозяина и вариации иммунного ответа способствуют защите от паразитов; однако становится все более очевидным, что кишечная микробиота может оказывать значительное влияние на прогрессирование заболевания как кишечными простейшими (1), так и переносимыми кровью малярийными паразитами (4).
Несмотря на эти потери, факторы, определяющие тяжесть заболевания, остаются плохо изученными (20).Генетика хозяина и вариации иммунного ответа способствуют защите от паразитов; однако становится все более очевидным, что кишечная микробиота может оказывать значительное влияние на прогрессирование заболевания как кишечными простейшими (1), так и переносимыми кровью малярийными паразитами (4).
КИШЕЧНАЯ МИКРОБИОТА
Кишечная бактериальная микробиота (21, 22) представляет собой сложное сообщество бактерий, состоящее как минимум из нескольких сотен видов. Эти организмы образуют симбиотические отношения, которые влияют на физиологию человека и прогрессирование заболевания (23, 24).Эпидемиологические исследования показали, что состав кишечной бактериальной микробиоты может коррелировать с развитием или устойчивостью к ожирению (25), недоеданию (26, 27) и аллергическим заболеваниям (28), а также может влиять на когнитивную функцию и развитие. 29). Кишечная микробиота не ограничивается прокариотами (30), при этом археи и эукариоты могут вносить вклад в клиническую изменчивость (31, 32).
Состав микробиоты может значительно варьироваться от одного человека к другому (33), даже у здоровых людей или близнецов в одном домохозяйстве (34).В нескольких исследованиях было отмечено, что бактериальная микробиота может влиять на вирулентность отдельных патогенов и потенциально увеличивать изменчивость исходов паразитарных протозойных инфекций (1, 22). Например, совместное культивирование со штаммами Escherichia coli может усиливать или ослаблять вирулентность Entamoeba histolytica (35, 36). Недавно опубликованные исследования подчеркивают влияние микробиоты на инфекции кишечными простейшими и на инфекции внекишечными паразитами Plasmodium .
слизистые паразиты и микробионные взаимодействия в популяциях человека
слизистая инфекция с энтероковым процветанием Entamoeba , Giardia , Cryptosporidium и Blastocystis может быть бессимптомным или причиной диареи, боли в животе и / или потеря веса. Заражающие паразиты обитают в слизистой оболочке кишечника и, следовательно, окружены микробиотой, ассоциированной со слизистой оболочкой. Было высказано предположение, что динамическое взаимодействие, которое происходит между простейшим паразитом, микробиотой хозяина и иммунной системой хозяина, определяет клинический исход кишечных инфекций (1, 37).
Заражающие паразиты обитают в слизистой оболочке кишечника и, следовательно, окружены микробиотой, ассоциированной со слизистой оболочкой. Было высказано предположение, что динамическое взаимодействие, которое происходит между простейшим паразитом, микробиотой хозяина и иммунной системой хозяина, определяет клинический исход кишечных инфекций (1, 37).
Заражение кишечным паразитом Entamoeba достоверно коррелировало с составом и разнообразием фекального микробиома. Инфекция видов Entamoeba была предсказана по составу кишечной микробиоты человека с точностью 79% в исследовании фермерских и рыболовецких популяций на юго-западе Камеруна (38). Одним из наиболее важных таксонов для прогнозирования заражения Entamoeba был Prevotellaceae . В отдельном независимом исследовании, посвященном E.histolytica , связанная с диареей, которая часто встречается у младенцев в Бангладеш, уровни Prevotella copri , члена Prevotellaceae , были повышены у пациентов с диареегенными инфекциями E. histolytica (39) (). Камерунское исследование было сосредоточено на инфицированных взрослых, у которых не было симптоматического амебиаза; поэтому интересно, что как P. copri , так и Prevotella stercorea были значительно подавлены у инфицированных людей (38, 40, 41).Оба исследования предполагают, что состав микробиоты может играть значительную роль во время инфекции E. histolytica . Эти исследования также подчеркивают потенциальное влияние воспаления, вызванного кишечным микробиомом, на изменение исходов паразитарной инфекции (37, 39). Повышенные уровни P. copri были связаны с тяжелым воспалением и повышенным риском аутоиммунного заболевания и колита, что позволяет предположить, что микроорганизм является провоспалительным (41).
histolytica (39) (). Камерунское исследование было сосредоточено на инфицированных взрослых, у которых не было симптоматического амебиаза; поэтому интересно, что как P. copri , так и Prevotella stercorea были значительно подавлены у инфицированных людей (38, 40, 41).Оба исследования предполагают, что состав микробиоты может играть значительную роль во время инфекции E. histolytica . Эти исследования также подчеркивают потенциальное влияние воспаления, вызванного кишечным микробиомом, на изменение исходов паразитарной инфекции (37, 39). Повышенные уровни P. copri были связаны с тяжелым воспалением и повышенным риском аутоиммунного заболевания и колита, что позволяет предположить, что микроорганизм является провоспалительным (41).
Таблица 1
Конкретные компоненты микробиоты во время простейшей инфекции человека
| Protozoan | Микробиота Компонент | Влияние | Ссылка |
|---|---|---|---|
E. гистолитика гистолитика | Prevotellaceae | Прогнозируемая инфекция | 38 |
| E. гистолитика | Prevotella COPRI | Прогнозируемая диарея | 39 |
| Cryptosporidium | протеобактерии , Firmicutes , Escherichia coli CFT073, Bacillus spp., Clostridium spp. | Увеличение относительной численности у Cryptosporidium -отрицательных субъектов | 42 |
| G.duodenalis | бифидобактерии | Увеличение относительной численности в Giardia -позитивных предметы | 47 |
| Blastocystis | клостридии, энтеробактерии | Повышенные уровни клостридии , но ниже Enterobacteriaceae Уровни в Blastocystis -позитивные предметы4 | 50 | 9013
| 52 | 52 | ||
| Bifidobacterium , streptococcus 1 более высокая доля Bifidobacterium и streptococcus Организмы в группе низкой инфекции | 4 | Инфекции
Cryptosporidium , Giardia , Blastocystis и Trichomonas также могут зависеть от микробиоты кишечника.В ретроспективном исследовании добровольцев, первоначально включенных в исследование инфекционности Cryptosporidium (42), изучалась взаимосвязь между относительной численностью нескольких таксонов бактерий, обычно обнаруживаемых у взрослых до или в течение 48 часов после заражения, и исходами инфекции. У пациентов, которые были защищены от инфекции, было большее количество Proteobacteria и более низкие уровни Bacteriodetes и Verrucomicrobia , чем у инфицированных субъектов. Отношение Firmicutes к Bacteriodetes у неинфицированных субъектов было выше, чем у инфицированных.Семь конкретных таксонов имели различия не менее чем в 2,5 раза между двумя группами. В частности, у неинфицированных субъектов было повышено относительное содержание индол-продуцирующих бактерий Escherichia coli CFT073 и Bacillus spp., а также Clostridium spp. Напротив, инфицированные субъекты имели повышенную относительную численность Bacteroides fragilis , Bacteroides pyogenes и Prevotella bryantii , а также Akkermansia muciniphila ().В настоящее время механизм, с помощью которого повышенная продукция индола может защищать от Cryptosporidium , неизвестен. Индол может непосредственно неблагоприятно воздействовать на паразита или, возможно, изменять ткани хозяина для усиления врожденного ответа за счет повышения целостности эпителия (43) и/или стимуляции противовоспалительных путей (42, 44).
Отношение Firmicutes к Bacteriodetes у неинфицированных субъектов было выше, чем у инфицированных.Семь конкретных таксонов имели различия не менее чем в 2,5 раза между двумя группами. В частности, у неинфицированных субъектов было повышено относительное содержание индол-продуцирующих бактерий Escherichia coli CFT073 и Bacillus spp., а также Clostridium spp. Напротив, инфицированные субъекты имели повышенную относительную численность Bacteroides fragilis , Bacteroides pyogenes и Prevotella bryantii , а также Akkermansia muciniphila ().В настоящее время механизм, с помощью которого повышенная продукция индола может защищать от Cryptosporidium , неизвестен. Индол может непосредственно неблагоприятно воздействовать на паразита или, возможно, изменять ткани хозяина для усиления врожденного ответа за счет повышения целостности эпителия (43) и/или стимуляции противовоспалительных путей (42, 44).
Исследование кишечных паразитарных инфекций у людей в южной части Кот-д’Ивуара с использованием ПЦР-временного температурного гель-электрофореза (TTGE) и количественной ПЦР показало, что профили TTGE сгруппированы в четыре существенно различающиеся группы, т.е.д., группы, положительные на Giardia duodenalis , положительные на Entamoeba spp. и Blastocystis hominis , отрицательный для простейших и положительный для всех трех паразитов. Количественная ПЦР выбранных видов бактерий в этих четырех группах показала значительное увеличение относительной численности Bifidobacterium у G. duodenalis -положительных пациентов. Это исследование показало, что протестированные кишечные простейшие могут вызывать значительные изменения в микробиоме, что приводит к существенному изменению бактериальных сообществ (1).
Относительное содержание Faecalibacterium prausnitzii и E. coli использовалось в качестве маркера дисбактериоза, вызванного воспалительным заболеванием кишечника (ВЗК), связанного с повышенным уровнем E. coli (45, 46). Применение этого инструмента к образцам из когорты пациентов в Кот-д’Ивуаре показало, что результаты исследований в Кот-д’Ивуаре и Камеруне согласуются и что увеличение разнообразия микробиома происходит при бессимптомных инфекциях видов Entamoeba .Результаты в Кот-д’Ивуаре также предполагают, что это наблюдение может быть расширено и что увеличение разнообразия микробиома также произошло во время инфекций Blastocystis hominis (47). Однако спорно, может ли Blastocystis вызывать диарею (48). Частично причина этого противоречия может быть связана с огромным генетическим разнообразием внутри Blastocystis spp. Blastocystis hominis состоит как минимум из семи морфологически идентичных, но генетически различных организмов (49).Микробиом кишечника, с которым сталкивается Blastocystis при заражении человека-хозяина, также может влиять на клинические результаты. Одеберт и др. сравнили микробиомы Blastocystis -колонизированных и Blastocystis -свободных пациентов в дизайне исследования случай-контроль, в котором учитывались экологические и клинические факторы риска, такие как сезонные колебания (50).
coli (45, 46). Применение этого инструмента к образцам из когорты пациентов в Кот-д’Ивуаре показало, что результаты исследований в Кот-д’Ивуаре и Камеруне согласуются и что увеличение разнообразия микробиома происходит при бессимптомных инфекциях видов Entamoeba .Результаты в Кот-д’Ивуаре также предполагают, что это наблюдение может быть расширено и что увеличение разнообразия микробиома также произошло во время инфекций Blastocystis hominis (47). Однако спорно, может ли Blastocystis вызывать диарею (48). Частично причина этого противоречия может быть связана с огромным генетическим разнообразием внутри Blastocystis spp. Blastocystis hominis состоит как минимум из семи морфологически идентичных, но генетически различных организмов (49).Микробиом кишечника, с которым сталкивается Blastocystis при заражении человека-хозяина, также может влиять на клинические результаты. Одеберт и др. сравнили микробиомы Blastocystis -колонизированных и Blastocystis -свободных пациентов в дизайне исследования случай-контроль, в котором учитывались экологические и клинические факторы риска, такие как сезонные колебания (50). Авторы также сообщили о более высоком бактериальном разнообразии в фекальной микробиоте пациентов, колонизированных Blastocystis , с более высоким содержанием Clostridia , а также с более низким содержанием Enterobacteriaceae ().Эти результаты показали, что колонизация Blastocystis может быть связана с экспансией представителей кишечной микробиоты, обычно связанной со здоровой кишечной микробиотой, а не с экспансией бактерий, связанных с дисбиозом кишечника.
Авторы также сообщили о более высоком бактериальном разнообразии в фекальной микробиоте пациентов, колонизированных Blastocystis , с более высоким содержанием Clostridia , а также с более низким содержанием Enterobacteriaceae ().Эти результаты показали, что колонизация Blastocystis может быть связана с экспансией представителей кишечной микробиоты, обычно связанной со здоровой кишечной микробиотой, а не с экспансией бактерий, связанных с дисбиозом кишечника.
Trichomonas vaginalis , возбудитель трихомониаза и внеклеточный паразит урогенитального тракта человека, является наиболее распространенной в мире невирусной инфекцией, передающейся половым путем (51). Трихомониаз непропорционально поражает женщин, при этом симптоматическая инфекция в первую очередь поражает слизистую оболочку влагалища.На изменение клинической картины заболевания может влиять состав вагинальной микробиоты. В исследовании вагинальной микробиоты T. vaginalis — положительных и T. vaginalis — отрицательных женщин инфекция была связана с вагинальной микробиотой, состоящей из небольшого количества лактобацилл (52) (). Взаимодействие T. vaginalis с различными видами Lactobacillus подавляет взаимодействие паразита с клетками человека (53).
vaginalis — отрицательных женщин инфекция была связана с вагинальной микробиотой, состоящей из небольшого количества лактобацилл (52) (). Взаимодействие T. vaginalis с различными видами Lactobacillus подавляет взаимодействие паразита с клетками человека (53).
Таким образом, упомянутые исследования на людях предполагают, что существует тесная связь между составом кишечной бактериальной микробиоты и кишечными простейшими, ассоциированными со слизистой оболочкой ().Необходимы дальнейшие исследования, чтобы понять природу этой связи и то, как ее можно использовать для профилактики заболеваний.
ПЛАЗМОДИЙ И КИШЕЧНАЯ МИКРОБИОТА
Приблизительно 60% населения мира подвержены риску заражения Plasmodium (54, 55). Однако распространение клинической малярии весьма неоднородно. В исследованиях, проведенных в Кении и Сенегале, количество клинических эпизодов заболевания колебалось от 0 до 40 на ребенка в течение 5-летнего периода в одном и том же сообществе (56, 57). Клиническая изменчивость объясняется генетическими различиями. Например, гетерозиготные носители гемоглобинового варианта HbS, связанного с серповидно-клеточной анемией, здоровы и защищены от тяжелых форм малярии, включая церебральную малярию (58). Различия в воздействии и различия в иммунном ответе также вовлечены. Однако эти факторы не могут полностью объяснить такую большую клиническую изменчивость (55, 59). Кишечная бактериальная микробиота может представлять собой фактор окружающей среды, который может способствовать этой изменчивости.
Клиническая изменчивость объясняется генетическими различиями. Например, гетерозиготные носители гемоглобинового варианта HbS, связанного с серповидно-клеточной анемией, здоровы и защищены от тяжелых форм малярии, включая церебральную малярию (58). Различия в воздействии и различия в иммунном ответе также вовлечены. Однако эти факторы не могут полностью объяснить такую большую клиническую изменчивость (55, 59). Кишечная бактериальная микробиота может представлять собой фактор окружающей среды, который может способствовать этой изменчивости.
В недавнем исследовании образцы стула были собраны у когорты малийских детей и взрослых непосредственно перед сезоном передачи P. falciparum (4). Состав кишечных бактериальных сообществ у этих людей был определен и сопоставлен с риском заражения P. falciparum и фебрильной малярией. Была обнаружена значительная связь между составом микробиоты и предполагаемым риском заражения P. falciparum . В кишечной микробиоте субъектов, которые не заразились, была значительно более высокая доля видов Bifidobacterium и Streptococcus , чем у субъектов, заразившихся P. фальципарум . Однако никакой связи между составом микробиоты и риском развития фебрильной малярии после установления инфекции P. falciparum не наблюдалось. Авторы отмечают, что это, возможно, связано с отсутствием статистической мощности. Предварительный вывод о связи между составом кишечной микробиоты и риском заражения P. falciparum предполагает, что изменение состава кишечной микробиоты может снизить риск заражения P. falciparum в районах, эндемичных по малярии, и потенциально может частично увеличить эффективные вакцины против малярии (4) ().
фальципарум . Однако никакой связи между составом микробиоты и риском развития фебрильной малярии после установления инфекции P. falciparum не наблюдалось. Авторы отмечают, что это, возможно, связано с отсутствием статистической мощности. Предварительный вывод о связи между составом кишечной микробиоты и риском заражения P. falciparum предполагает, что изменение состава кишечной микробиоты может снизить риск заражения P. falciparum в районах, эндемичных по малярии, и потенциально может частично увеличить эффективные вакцины против малярии (4) ().
Кишечные бактерии могут воздействовать на внекишечные заболевания многими путями, такими как изменение адаптивного иммунитета и увеличение величин Т- и В-клеточно-опосредованных ответов и, возможно, усиление врожденных иммунных путей посредством тренированного иммунитета (60). Механизмы, лежащие в основе этих внекишечных эффектов, плохо изучены. Продукты метаболизма, такие как жирные кислоты с короткой цепью (61, 62), или факторы хозяина, такие как молекулы молекулярного паттерна, связанные с повреждением, индуцируемые микробиотой (63, 64), могут быть частично ответственны за эти эффекты. Пулы метаболитов, присутствующие в моделях животных с дифференциальной, зависящей от микробиоты восприимчивостью к инфекции Plasmodium , значительно различались в одном исследовании со снижением количества нуклеотидов, аминокислот и субстратов, участвующих в биосинтезе этих соединений у устойчивых мышей, наряду с более — стойкий ответ Т- и В-клеток (20, 65). Также было показано, что кишечная микробиота оказывает системное влияние на метаболиты сыворотки как на животных моделях, так и на людях (66, 67). Было показано, что паразиты на стадии крови очень восприимчивы к нарушению регуляции метаболизма, вызванному противомалярийными препаратами (68), и на них также могут влиять изменения, вызванные микробиотой.Следовательно, кишечная микробиота может влиять на клинический исход инфекции Plasmodium посредством изменения метаболома и модуляции врожденного или адаптивного иммунитета.
Пулы метаболитов, присутствующие в моделях животных с дифференциальной, зависящей от микробиоты восприимчивостью к инфекции Plasmodium , значительно различались в одном исследовании со снижением количества нуклеотидов, аминокислот и субстратов, участвующих в биосинтезе этих соединений у устойчивых мышей, наряду с более — стойкий ответ Т- и В-клеток (20, 65). Также было показано, что кишечная микробиота оказывает системное влияние на метаболиты сыворотки как на животных моделях, так и на людях (66, 67). Было показано, что паразиты на стадии крови очень восприимчивы к нарушению регуляции метаболизма, вызванному противомалярийными препаратами (68), и на них также могут влиять изменения, вызванные микробиотой.Следовательно, кишечная микробиота может влиять на клинический исход инфекции Plasmodium посредством изменения метаболома и модуляции врожденного или адаптивного иммунитета.
ИЗМЕНЕНИЕ МИКРОБИОТЫ КАК ТЕРАПИЯ ПРОТОЗОЙНЫХ ИНФЕКЦИЙ?
Когорты пациентов и будущие эпидемиологические исследования микробиома позволят получить более полное представление о вариациях клинических проявлений инфекции паразитарными простейшими. Однако популяционные исследования не позволяют нам проверить влияние микробиоты на выживание и размножение паразитов.Таким образом, модели заболеваний in vitro и in vivo представляют собой полезный инструмент для понимания того, как кишечная бактериальная микробиота может влиять на тяжесть и прогрессирование инфекции и какие механизмы могут лежать в основе этого прогрессирования.
Однако популяционные исследования не позволяют нам проверить влияние микробиоты на выживание и размножение паразитов.Таким образом, модели заболеваний in vitro и in vivo представляют собой полезный инструмент для понимания того, как кишечная бактериальная микробиота может влиять на тяжесть и прогрессирование инфекции и какие механизмы могут лежать в основе этого прогрессирования.
Культуральные модели In vitro позволяют анализировать взаимодействия между инфекционными агентами и отдельными компонентами микробиоты. Например, исследование in vitro эффектов шести штаммов Lactobacillus acidophilus и Lactobacillus johnsonii La1 на выживаемость Giardia duodenalis показало, что L.johnsonii La1 значительно ингибировал пролиферацию трофозоитов Giardia . Потенциальная защитная роль L. johnsonii La1 (NCC533) была независимо подтверждена экспериментами in vivo с песчанками, получавшими La1, которые были защищены от инфекции Giardia и повреждения слизистой оболочки (69,–71). В другом исследовании in vitro обычные человеческие комменсальные бактерии культивировали совместно с E. histolytica . Культура Lactobacillus casei и Enterococcus faecium отдельно с амебами снижала выживаемость паразита на 71%.Когда обе бактерии использовались в комбинации, выживаемость снижалась на 80%. Предыдущее исследование продемонстрировало связь между уменьшением количества Lactobacillus и амебиазом у индийских пациентов (72), что еще раз подтвердило потенциальную связь между этими бактериями и устойчивостью к амебной инфекции.
В другом исследовании in vitro обычные человеческие комменсальные бактерии культивировали совместно с E. histolytica . Культура Lactobacillus casei и Enterococcus faecium отдельно с амебами снижала выживаемость паразита на 71%.Когда обе бактерии использовались в комбинации, выживаемость снижалась на 80%. Предыдущее исследование продемонстрировало связь между уменьшением количества Lactobacillus и амебиазом у индийских пациентов (72), что еще раз подтвердило потенциальную связь между этими бактериями и устойчивостью к амебной инфекции.
Как упоминалось ранее, лактобациллы могут влиять на восприимчивость женщин к инфекции T. vaginalis (52). Механизмы, лежащие в основе этого эффекта, все еще изучаются; однако ингибирование адгезии паразита может помочь объяснить защиту.В одном исследовании анализы адгезии проводились путем инкубации вагинальных эпителиальных клеток (ВЭК) с T. vaginalis и лактобациллами вместе, а также путем сравнения уровней адгезии паразита с контролем реципиента, не содержащим лактобактерий. Lactobacillus gasseri ATCC 9857 и CBI3 вызывали значительное ингибирование адгезии паразитов дозозависимым образом (53).
Lactobacillus gasseri ATCC 9857 и CBI3 вызывали значительное ингибирование адгезии паразитов дозозависимым образом (53).
Исследования, подобные этим, могут заложить основу для использования отдельных компонентов микробиоты для обеспечения экономически эффективного профилактического лечения паразитарной инфекции без чрезмерного использования противомикробных препаратов () (73).К сожалению, текущие эксперименты по совместному культивированию не позволяют нам исследовать влияние иммунной системы хозяина. Хотя существуют различия между кишечной микробиотой мыши и человека, мышиные модели представляют собой мощный инструмент для изучения взаимодействия хозяина, микробиоты и патогена в контексте активной иммунной системы (74).
ВЗАИМОДЕЙСТВИЕ ХОЗЯИНА С МИКРОБИОМОМ И ИНФЕКЦИЯ СЛИЗИСТЫХ ПАРАЗИТОВ НА МЫШИНЫХ МОДЕЛЯХ
Разработка мышиных моделей паразитарных протозойных инфекций позволила провести более детальное иммунофенотипирование реакции хозяина-млекопитающего на изменения в микробиоте и ее влияние на инфекционное заболевание (1, 75). Мышиные модели также предложили неожиданные достижения в нашем понимании взаимодействия между микробиотой и хозяином из-за различий в сообществах бактерий, присутствующих в помещениях коммерческих поставщиков животных, особенно сегментированных нитчатых бактерий (SFB) (44, 45, 93). Таким образом, изменение кишечного микробиома в модельных системах и тщательное наблюдение за вариациями между моделями в разных средах позволяют лучше понять иммунные факторы, которые могут помочь объяснить клинические вариации паразитарных заболеваний.
Мышиные модели также предложили неожиданные достижения в нашем понимании взаимодействия между микробиотой и хозяином из-за различий в сообществах бактерий, присутствующих в помещениях коммерческих поставщиков животных, особенно сегментированных нитчатых бактерий (SFB) (44, 45, 93). Таким образом, изменение кишечного микробиома в модельных системах и тщательное наблюдение за вариациями между моделями в разных средах позволяют лучше понять иммунные факторы, которые могут помочь объяснить клинические вариации паразитарных заболеваний.
Изменение микробиоты в коммерческих животноводческих помещениях может привести к значительным изменениям в развитии воспалительных и инфекционных заболеваний (76, 77). Ярким примером этого является колонизация одним мышиным комменсалом Clostridium SFB (78, 79). Было замечено, что у мышей C57BL/6 из Jackson Laboratories не наблюдалось значительной индукции интерлейкина 17A (IL-17A) в слизистой оболочке кишечника, в отличие от мышей C57BL/6 из Taconic Farms (80). Это позволяет предположить, что разница в микробиоте мышей этих двух поставщиков может лежать в основе различий в индукции цитокинов.Иванов и др. (80), используя мышей, свободных от специфических патогенов, как от поставщиков, так и от мышей, свободных от микробов, показали, что SFB, которые присутствовали у мышей из Taconic Farms, были компонентом микробиоты, лежащим в основе изменений иммунной функции. Исследования на мышиных моделях также показали, что иммунный ответ, индуцированный SFB, изменяет тяжесть внекишечного аутоиммунного энцефаломиелита (77, 80,-82).
Это позволяет предположить, что разница в микробиоте мышей этих двух поставщиков может лежать в основе различий в индукции цитокинов.Иванов и др. (80), используя мышей, свободных от специфических патогенов, как от поставщиков, так и от мышей, свободных от микробов, показали, что SFB, которые присутствовали у мышей из Taconic Farms, были компонентом микробиоты, лежащим в основе изменений иммунной функции. Исследования на мышиных моделях также показали, что иммунный ответ, индуцированный SFB, изменяет тяжесть внекишечного аутоиммунного энцефаломиелита (77, 80,-82).
Недавно на мышиной модели инфекции E. histolytica мы продемонстрировали, что мыши, колонизированные SFB, защищены от экспериментального амебиаза (83).При изучении реактивности иммунных клеток у этих мышей было обнаружено, что дендритные клетки костного мозга (BMDC) от мышей, колонизированных SFB, продуцировали значительно более высокие уровни IL-23. в результате только после заражения амебой (28). IL-23 представляет собой цитокин (29), связанный с индукцией IL-17A и нейтрофилов, которые, в свою очередь, играют важную роль в иммунитете к амебам (30, 31). Перенос BMDC, полученных от мышей, колонизированных SFB, обеспечил защиту от E.histolytica инфекции. В этой работе было высказано предположение, что связанный с кишечником комменсал может изменить реакцию клеток костного мозга на последующие воспалительные процессы (12).
Перенос BMDC, полученных от мышей, колонизированных SFB, обеспечил защиту от E.histolytica инфекции. В этой работе было высказано предположение, что связанный с кишечником комменсал может изменить реакцию клеток костного мозга на последующие воспалительные процессы (12).
Модель SFB-опосредованной защиты от колонизации E. histolytica . Колонизация кишечника SFB (сегментарными нитчатыми бактериями) может индуцировать растворимые медиаторы, в том числе SAA, которые могут усиливать кишечный иммунный ответ против амебы, а также запускать системные эпигенетические изменения в костном мозге, которые поддерживают более сильный гранулопоэз и защиту от кишечной E.histolytica инфекции. (Переиздано с изменениями из mBio [83].)
В этой модели амебиаза молекула молекулярного паттерна, связанная с повреждением хозяина, сывороточный амилоид A (SAA) (84) также увеличивалась в сыворотке мышей, колонизированных SFB. по сравнению с уровнем в сыворотке мышей, лишенных комменсала. Временная колонизация кишечника только введением SFB или SAA увеличивала гистондеметилазу h4K27 Jmjd3 в костном мозге и постоянно повышала экспрессию Csf2ra в костном мозге, а также предшественников гранулоцитов-моноцитов (GMP) и защищала от амебной инфекции.Защита была связана с увеличением числа нейтрофилов кишечника (63). Фармакологическое ингибирование активности деметилазы Jmjd3 h4K27 во время лечения SAA или блокада передачи сигналов гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) у мышей, колонизированных SFB, предотвращало экспансию GMP, уменьшало нейтрофилы кишечника и блокировало защиту от амебной инфекции. Эти результаты показывают, что изменение микробиоты и системное воздействие SAA хозяина может влиять на гранулопоэз и восприимчивость к амебиазу, возможно, через эпигенетические механизмы.Взаимодействие микробиоты кишечника и костного мозга является ранее непризнанным механизмом врожденной защиты от амебной инфекции (63, 83) (и ). Кишечная микробиота, вероятно, оказывает значительное внекишечное влияние на иммунный ответ хозяина на паразитов.
Временная колонизация кишечника только введением SFB или SAA увеличивала гистондеметилазу h4K27 Jmjd3 в костном мозге и постоянно повышала экспрессию Csf2ra в костном мозге, а также предшественников гранулоцитов-моноцитов (GMP) и защищала от амебной инфекции.Защита была связана с увеличением числа нейтрофилов кишечника (63). Фармакологическое ингибирование активности деметилазы Jmjd3 h4K27 во время лечения SAA или блокада передачи сигналов гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) у мышей, колонизированных SFB, предотвращало экспансию GMP, уменьшало нейтрофилы кишечника и блокировало защиту от амебной инфекции. Эти результаты показывают, что изменение микробиоты и системное воздействие SAA хозяина может влиять на гранулопоэз и восприимчивость к амебиазу, возможно, через эпигенетические механизмы.Взаимодействие микробиоты кишечника и костного мозга является ранее непризнанным механизмом врожденной защиты от амебной инфекции (63, 83) (и ). Кишечная микробиота, вероятно, оказывает значительное внекишечное влияние на иммунный ответ хозяина на паразитов. Эти изменения могут быть относительно долгосрочными, возможно, за счет индукции путей иммунной памяти, таких как тренированный врожденный иммунитет (60), или за счет влияния на адаптивный иммунитет, которое еще предстоит полностью понять.
Эти изменения могут быть относительно долгосрочными, возможно, за счет индукции путей иммунной памяти, таких как тренированный врожденный иммунитет (60), или за счет влияния на адаптивный иммунитет, которое еще предстоит полностью понять.
Лечение антибиотиками, разрушающее комменсальную микробиоту, часто используется для установления инфекции патогенами в модельных системах.Таким образом, наблюдение различий между иммунным ответом у мышей, получавших антибиотики, и мышей, не получавших лечения, может привести к пониманию роли микробиоты в ответе хозяина. Например, в модели инфекции Giardia duodenalis было показано, что изменение микробиома антибиотиками предотвращает активацию Т-клеток CD8 Giardia (6). У мышей, инфицированных Giardia , которых не лечили антибиотиками, было больше активированных CD8 + αβ Т-клеток в собственной пластинке тонкого кишечника, чем у неинфицированных мышей.Увеличение CD8 + Т-клеток отсутствовало у предварительно обработанных антибиотиками мышей, инфицированных Giardia . Один из возможных механизмов заключается в том, что во время инфекции паразит способствует разрушению кишечного барьера. Транслокация люминальных бактерий в слизистую приводит к активации CD8 + Т-клеток; следовательно, снижение бактериальной нагрузки с помощью лечения антибиотиками может уменьшить ее и предотвратить патологическую активацию Т-клеток CD8 + (6).
Один из возможных механизмов заключается в том, что во время инфекции паразит способствует разрушению кишечного барьера. Транслокация люминальных бактерий в слизистую приводит к активации CD8 + Т-клеток; следовательно, снижение бактериальной нагрузки с помощью лечения антибиотиками может уменьшить ее и предотвратить патологическую активацию Т-клеток CD8 + (6).
Инфекции Giardia duodenalis могут оказывать долгосрочное воздействие на здоровье человека, и важную роль может играть снижение уровня дисахаридазы хозяина, связанное с инфекциями Giardia .Дисахаридаза необходима для полного усвоения почти всех углеводов, содержащихся в пище и напитках. Считалось, что дефицит дисахаридаз возникает в результате повреждения эпителия и укорочения микроворсинок кишечного эпителия. Однако у мышей, инфицированных Giardia , дефицит дисахаридазы может быть устранен путем блокирования активации Т-клеток CD8 + посредством передачи сигналов CD4 или лечения антибиотиками (6). Это исследование предполагает, что различия в использовании антибиотиков и их влияние на микробиом человека могут быть важными факторами, которые следует учитывать при оценке клинического исхода инфекции Giardia .
Это исследование предполагает, что различия в использовании антибиотиков и их влияние на микробиом человека могут быть важными факторами, которые следует учитывать при оценке клинического исхода инфекции Giardia .
МЫШИ
ПЛАЗМОДИЙ ИНФЕКЦИЯ И МИКРОБИОТА Недавно было изучено влияние микробиоты на инфекцию Plasmodium с использованием генетически сходных инбредных линий мышей (C57BL/6), поддерживаемых различными поставщиками, лабораторией Джексона, Taconic Farms, Национальный институт рака/Чарльз Ривер (NCI) и Харлан (20). Мыши C57BL/6 от каждого из этих поставщиков были инфицированы Plasmodium yoelii . После заражения наблюдались значительные различия в паразитемии между генетически идентичными мышами от разных поставщиков, при этом мыши из лаборатории Джексона и Taconic Farms были устойчивы к паразиту.Безмикробные мыши, которым пересадили слепую кишку от «резистентных» или «восприимчивых» мышей, имели низкую и высокую паразитарную нагрузку, соответственно, демонстрируя, что микробиота кишечника может влиять на тяжесть течения малярии. У резистентных мышей наблюдалось повышенное содержание Lactobacillus и Bifidobacterium по сравнению с восприимчивыми мышами. Кроме того, у восприимчивых мышей, получавших антибиотики, а затем пробиотики, полученные из этих родов бактерий, наблюдалось снижение паразитарной нагрузки.В соответствии с различиями в паразитарной нагрузке, резистентные мыши демонстрировали повышенный профиль антител и повышенное количество CD4 + Т-клеток и В-клеток по сравнению с таковыми у восприимчивых мышей. Таким образом, состав кишечной микробиоты может быть неидентифицированным фактором риска тяжелой малярии, а изменение кишечной микробиоты может усиливать реакцию хозяина на внекишечные паразиты.
У резистентных мышей наблюдалось повышенное содержание Lactobacillus и Bifidobacterium по сравнению с восприимчивыми мышами. Кроме того, у восприимчивых мышей, получавших антибиотики, а затем пробиотики, полученные из этих родов бактерий, наблюдалось снижение паразитарной нагрузки.В соответствии с различиями в паразитарной нагрузке, резистентные мыши демонстрировали повышенный профиль антител и повышенное количество CD4 + Т-клеток и В-клеток по сравнению с таковыми у восприимчивых мышей. Таким образом, состав кишечной микробиоты может быть неидентифицированным фактором риска тяжелой малярии, а изменение кишечной микробиоты может усиливать реакцию хозяина на внекишечные паразиты.
РОЛЬ ПРОСТЕЙШЕЙ МИКРОБИОТЫ В ИНФЕКЦИИ И ВОСПАЛЕНИИ
Основное внимание в этом обзоре уделяется паразитическим простейшим и влиянию бактериальной микробиоты на иммунитет хозяина к этим простейшим.Однако важно отметить, что новые исследования показывают, что простейшие могут также изменять иммунитет хозяина к последующим воздействиям (30). Фекально-оральное проглатывание цист Giardia приводит к различным клиническим синдромам, начиная от острой или хронической диареи и заканчивая длительной бессимптомной колонизацией (16). Недавнее исследование детей в Бангладеш показало, что воздействие Giardia в раннем возрасте не увеличивает и не снижает вероятность острой диареи по любой причине. Однако инфекция Giardia была фактором риска задержки роста, но не плохой прибавки в весе (85).Также было отмечено, что у пациентов, инфицированных Giardia , часто наблюдается дисфункция кишечника после того, как их инфекция излечена (86, 87). Инфекция Giardia была связана с защитой от диареи в других случаях (17, 88, 89). Механизмы, лежащие в основе этих несопоставимых результатов при инфекции Giardia у людей, в настоящее время недостаточно изучены. Однако недавняя работа на мышиных моделях демонстрирует, как протозойная инфекция может обеспечивать защиту от инфекции при обострении колита.
Фекально-оральное проглатывание цист Giardia приводит к различным клиническим синдромам, начиная от острой или хронической диареи и заканчивая длительной бессимптомной колонизацией (16). Недавнее исследование детей в Бангладеш показало, что воздействие Giardia в раннем возрасте не увеличивает и не снижает вероятность острой диареи по любой причине. Однако инфекция Giardia была фактором риска задержки роста, но не плохой прибавки в весе (85).Также было отмечено, что у пациентов, инфицированных Giardia , часто наблюдается дисфункция кишечника после того, как их инфекция излечена (86, 87). Инфекция Giardia была связана с защитой от диареи в других случаях (17, 88, 89). Механизмы, лежащие в основе этих несопоставимых результатов при инфекции Giardia у людей, в настоящее время недостаточно изучены. Однако недавняя работа на мышиных моделях демонстрирует, как протозойная инфекция может обеспечивать защиту от инфекции при обострении колита.
Tritrichomonas musculis — это обычный мышиный комменсал, обнаруживаемый у диких мышей и некоторых колоний животных. Недавно было показано, что он вызывает разрастание пучковых клеток, уникального подтипа эпителиальных клеток, важного для генерации иммунных ответов типа 2 (90). Эта работа предполагает, что комменсальные простейшие могут играть важную роль в установлении базовой структуры кишечника млекопитающих. Также только что было показано, что простейшие приводят к экспансии адаптивных клеток Th2 и эффекторных клеток Th27 в слизистой оболочке толстой кишки.Эта экспансия зависела от различных мигрирующих подмножеств DC, но также требовала продукции IL-18 эпителиальными клетками. Эти результаты вместе с высокой экспрессией рецептора IL-18 IL-18Rα на эффекторных Т-клетках, проникающих в толстую кишку, позволяют предположить, что T. musculis -специфический Т-клеточный иммунитет, вероятно, инициируется в дренирующих лимфатических узлах мигрирующими ДК толстой кишки и, вероятно, размножаются в тканях эпителиальным IL-18 (91). Интересно, что колонизация T. musculis также обеспечивала значительную защиту от энтерита, вызванного инфекцией Salmonella , зависимым от IL-18 образом (91).Однако колонизация T. musculis , наряду с ролью «протистического» антибиотика, усугубляла развитие Т-клеточного колита и приводила к развитию спорадических колоректальных опухолей у колонизированных мышей. Этот эффект T. musculis также наблюдался в независимом исследовании колита у мышей (92). В совокупности эти исследования выявили новые взаимодействия между хозяином и простейшими, которые привели к усилению защиты слизистой оболочки хозяина, а также увеличили риск воспалительных заболеваний.
Интересно, что колонизация T. musculis также обеспечивала значительную защиту от энтерита, вызванного инфекцией Salmonella , зависимым от IL-18 образом (91).Однако колонизация T. musculis , наряду с ролью «протистического» антибиотика, усугубляла развитие Т-клеточного колита и приводила к развитию спорадических колоректальных опухолей у колонизированных мышей. Этот эффект T. musculis также наблюдался в независимом исследовании колита у мышей (92). В совокупности эти исследования выявили новые взаимодействия между хозяином и простейшими, которые привели к усилению защиты слизистой оболочки хозяина, а также увеличили риск воспалительных заболеваний.
ВЫВОДЫ
Недавние исследования выявили потенциальный вклад кишечного микробиома в клиническую изменчивость при паразитарных протозойных инфекциях. Микробиом и паразиты могут взаимодействовать различными способами, которые могут включать (i) изменение вирулентности паразита, (ii) индукцию дисбактериоза или, возможно, даже полезные сдвиги в микробиоте, которые усиливают конкуренцию за нишу просвета кишечника, и, наконец, , (iii) модуляция иммунитета хозяина к паразиту. Течение как слизистой, так и системной паразитарной инфекции также может определяться специфическими представителями микробиоты, и, в свою очередь, паразитарная инфекция может изменить микробиоту таким образом, что уникальный признак может служить диагностическим признаком присутствия паразита.
Течение как слизистой, так и системной паразитарной инфекции также может определяться специфическими представителями микробиоты, и, в свою очередь, паразитарная инфекция может изменить микробиоту таким образом, что уникальный признак может служить диагностическим признаком присутствия паразита.
Точные механизмы, лежащие в основе модуляции микробиотой иммунитета хозяина, еще полностью не изучены; однако становится все более очевидным, что компоненты микробиоты могут изменять популяции как врожденных, так и адаптивных иммунных клеток, так что после последующего заражения инфекционными агентами, включая паразитических простейших, возникает более сильный ответ.Механизмы, лежащие в основе этого сдвига, могут включать недавно описанную концепцию тренированного врожденного иммунитета, в которой эпигенетические изменения позволяют клеткам врожденного иммунитета более эффективно устранять неродственные патогены, а также за счет усиления адаптивного иммунитета. В конечном счете, дальнейшее изучение взаимодействия между кишечным микробиомом и паразитическими простейшими предоставит дополнительные инструменты и подходы, которые помогут в диагностике и лечении инфекционных и воспалительных заболеваний. Изучение взаимодействия простейших с иммунной системой хозяина и микробиотой также помогает нам лучше понять фундаментальные механизмы иммунологии млекопитающих.
Изучение взаимодействия простейших с иммунной системой хозяина и микробиотой также помогает нам лучше понять фундаментальные механизмы иммунологии млекопитающих.
БЛАГОДАРНОСТЬ
Этот мини-обзор и работа, представленная в нашей лаборатории, были поддержаны грантом NIH AI-26649 и Фондом Гейтса (OPP1173478).
ССЫЛКИ
1. Бэр А-К, Фукан Н, Пинейро Дж, Симоес-Барбоза А. 2015. Взаимодействие микробиоты хозяина и паразитических простейших на поверхности слизистых оболочек: последствия для исходов инфекций и заболеваний. PLoS Negl Trop Dis 9:e0004176. doi:10.1371/journal.pntd.0004176. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]2.Абрахам Н.М., Лю Л., Ютрас Б.Л., Ядав А.К., Нарасимхан С., Гопалакришнан В., Ансари Дж.М., Джефферсон К.К., Кава Ф., Джейкобс-Вагнер С., Фикриг Э. 2017. Опосредованные патогенами манипуляции с микробиотой членистоногих для стимуляции инфекции. Proc Natl Acad Sci U S A 114: Е781–Е790. doi:10.1073/pnas.1613422114. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]3. Гендрин М., Роджерс Ф.Х., Йербанга Р.С., Уэдраого Дж.Б., Басаньес М.Г., Коуэ А., Кристофидес Г.К.
2015.
Антибиотики в проглоченной человеческой крови влияют на микробиоту комаров и их способность передавать малярию.Нац Коммуна
6:5921. дои: 10.1038/ncomms6921. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Юсеф С., Киркнесс Э.Ф., Тран Т.М., Харкинс Д.М., Джонс М.Б., Торралба М.Г., О’Коннелл Э., Натман Т.Б., Думбо С., Думбо О.К., Траоре Б., Кромптон П.Д., Нельсон К.Е.
2015.
Состав микробиоты стула связан с предполагаемым риском инфицирования Plasmodium falciparum. Геномика BMC
16:631. doi: 10.1186/s12864-015-1819-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]6. Кесельман А., Ли Э., Мэлони Дж., Сингер С.М.2016.
Микробиота способствует активации Т-клеток CD8 + и нарушению всасывания питательных веществ после кишечной инфекции Giardia duodenalis. Заразить иммунитет
84:2853–2860. doi: 10.1128/IAI.00348-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]7.
Гендрин М., Роджерс Ф.Х., Йербанга Р.С., Уэдраого Дж.Б., Басаньес М.Г., Коуэ А., Кристофидес Г.К.
2015.
Антибиотики в проглоченной человеческой крови влияют на микробиоту комаров и их способность передавать малярию.Нац Коммуна
6:5921. дои: 10.1038/ncomms6921. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Юсеф С., Киркнесс Э.Ф., Тран Т.М., Харкинс Д.М., Джонс М.Б., Торралба М.Г., О’Коннелл Э., Натман Т.Б., Думбо С., Думбо О.К., Траоре Б., Кромптон П.Д., Нельсон К.Е.
2015.
Состав микробиоты стула связан с предполагаемым риском инфицирования Plasmodium falciparum. Геномика BMC
16:631. doi: 10.1186/s12864-015-1819-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]6. Кесельман А., Ли Э., Мэлони Дж., Сингер С.М.2016.
Микробиота способствует активации Т-клеток CD8 + и нарушению всасывания питательных веществ после кишечной инфекции Giardia duodenalis. Заразить иммунитет
84:2853–2860. doi: 10.1128/IAI.00348-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]7. Лозано Р., Нагави М., Форман К., Лим С., Сибуя К., Абоянс В., Абрахам Дж., Адаир Т., Аггарвал Р., Ан С.Ю., Альварадо М., Андерсон Х.Р., Андерсон Л.М., Эндрюс К.Г., Аткинсон С., Баддур Л.М., Баркер- Колло С., Бартельс Д.Х., Белл М.Л., Бенджамин Э.Дж., Беннетт Д., Бхалла К., Бикбов Б., Бин Абдулхак А., Бирбек Г., Блит Ф., Боллигер И., Буфус С., Буселло С., Берч М., Берни П., Карапетис Дж., Чен Х., Чоу Д., Чух С.С., Коффенг Л.Е., Колан С.Д., Колкухун С., Колсон К.Е., Кондон Дж., Коннор М.Д., Купер Л.Т., Корриер М., Кортиновис М., де Ваккаро К.С., Коузер В., Коуи Б.К., Крики М.Х., Кросс М. , Дабхадкар К.С. и др..
2012.
Глобальная и региональная смертность от 235 причин смерти для 20 возрастных групп в 1990 и 2010 годах: систематический анализ для исследования глобального бремени болезней 2010 года. Lancet
380:2095–2128. doi: 10.1016/S0140-6736(12)61728-0. [PubMed] [CrossRef] [Google Scholar]8. DALY и сотрудники ГББ 2013 ХЕЙЛ, Мюррей С.Дж., Барбер Р.М., Форман К.Дж., Аббасоглу Озгорен А., Абд-Аллах Ф.
Лозано Р., Нагави М., Форман К., Лим С., Сибуя К., Абоянс В., Абрахам Дж., Адаир Т., Аггарвал Р., Ан С.Ю., Альварадо М., Андерсон Х.Р., Андерсон Л.М., Эндрюс К.Г., Аткинсон С., Баддур Л.М., Баркер- Колло С., Бартельс Д.Х., Белл М.Л., Бенджамин Э.Дж., Беннетт Д., Бхалла К., Бикбов Б., Бин Абдулхак А., Бирбек Г., Блит Ф., Боллигер И., Буфус С., Буселло С., Берч М., Берни П., Карапетис Дж., Чен Х., Чоу Д., Чух С.С., Коффенг Л.Е., Колан С.Д., Колкухун С., Колсон К.Е., Кондон Дж., Коннор М.Д., Купер Л.Т., Корриер М., Кортиновис М., де Ваккаро К.С., Коузер В., Коуи Б.К., Крики М.Х., Кросс М. , Дабхадкар К.С. и др..
2012.
Глобальная и региональная смертность от 235 причин смерти для 20 возрастных групп в 1990 и 2010 годах: систематический анализ для исследования глобального бремени болезней 2010 года. Lancet
380:2095–2128. doi: 10.1016/S0140-6736(12)61728-0. [PubMed] [CrossRef] [Google Scholar]8. DALY и сотрудники ГББ 2013 ХЕЙЛ, Мюррей С.Дж., Барбер Р.М., Форман К.Дж., Аббасоглу Озгорен А., Абд-Аллах Ф. , Абера С.Ф., Абоянс В., Авраам Дж.П., Абубакар И., Абу-Раддад Л.Дж., Абу-Рмейлех Н.М., Ачоки Т., Акерман И.Н., Адеми З., Аду А.К., Адсуар Дж.К., Афшин А., Агард Э.Е., Алам С.С., Аласфур Д., Альбиттар М.И., Алегретти М.А., Алему З.А., Альфонсо-Кристанчо Р., Алхабиб С., Али Р., Алла Ф., Аллебек П., Алмазроа М.А., Альшариф У., Альварес Э., Алвис-Гузман Н., Амаре А.Т., Амех Э.А., Амини Х., Аммар В., Андерсон Х.Р., Андерсон Б.О., Антонио К.А., Анвари П., Арнлов Дж., Арсич Арсениевич В.С., Артаман А., Асгар Р.Дж. , Ассади Р., Аткинс Л.С., Авила М.А., Авуа Б., Бахман В.Ф., Бадави А., Бахит М.С., Балакришнан К. и др..
2015.
Глобальные, региональные и национальные годы жизни с поправкой на инвалидность (DALY) для 306 заболеваний и травм и ожидаемая продолжительность здоровой жизни (HALE) для 188 стран, 1990–2013 гг.: количественная оценка эпидемиологического перехода. Ланцет
386: 2145–2191. doi: 10.1016/S0140-6736(15)61340-X. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]9. Liu L, Johnson HL, Cousens S, Perin J, Scott S, Lawn JE, Rudan I, Campbell H, Cibulskis R, Li M, Mathers C, Black RE, Справочная группа по эпидемиологии детского здоровья ВОЗ и ЮНИСЕФ.
, Абера С.Ф., Абоянс В., Авраам Дж.П., Абубакар И., Абу-Раддад Л.Дж., Абу-Рмейлех Н.М., Ачоки Т., Акерман И.Н., Адеми З., Аду А.К., Адсуар Дж.К., Афшин А., Агард Э.Е., Алам С.С., Аласфур Д., Альбиттар М.И., Алегретти М.А., Алему З.А., Альфонсо-Кристанчо Р., Алхабиб С., Али Р., Алла Ф., Аллебек П., Алмазроа М.А., Альшариф У., Альварес Э., Алвис-Гузман Н., Амаре А.Т., Амех Э.А., Амини Х., Аммар В., Андерсон Х.Р., Андерсон Б.О., Антонио К.А., Анвари П., Арнлов Дж., Арсич Арсениевич В.С., Артаман А., Асгар Р.Дж. , Ассади Р., Аткинс Л.С., Авила М.А., Авуа Б., Бахман В.Ф., Бадави А., Бахит М.С., Балакришнан К. и др..
2015.
Глобальные, региональные и национальные годы жизни с поправкой на инвалидность (DALY) для 306 заболеваний и травм и ожидаемая продолжительность здоровой жизни (HALE) для 188 стран, 1990–2013 гг.: количественная оценка эпидемиологического перехода. Ланцет
386: 2145–2191. doi: 10.1016/S0140-6736(15)61340-X. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]9. Liu L, Johnson HL, Cousens S, Perin J, Scott S, Lawn JE, Rudan I, Campbell H, Cibulskis R, Li M, Mathers C, Black RE, Справочная группа по эпидемиологии детского здоровья ВОЗ и ЮНИСЕФ. 2012.
Глобальные, региональные и национальные причины детской смертности: обновленный систематический анализ за 2010 г. с временными тенденциями с 2000 г. Lancet
379: 2151–2161. doi: 10.1016/S0140-6736(12)60560-1. [PubMed] [CrossRef] [Google Scholar] 10. Сотрудники ГББ 2015 Смертность и причины смерти. 2015.
Глобальная, региональная и национальная возрастно-половая смертность от всех причин и причинно-специфическая смертность по 240 причинам смерти, 1990–2013 гг.: систематический анализ для исследования глобального бремени болезней, 2013 г. Lancet
385: 117–171.doi: 10.1016/S0140-6736(14)61682-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]11. Котлофф К.Л., Натаро Дж.П., Блэквелдер В.К., Насрин Д., Фараг Т.Х., Панчалингам С., Ву И., Соу С.О., Сур Д., Брейман Р.Ф., Фарук А.С., Заиди А.К., Саха Д., Алонсо П.Л., Тамбура Б., Саного Д., Онвучеква У. , Манна Б., Рамамурти Т., Канунго С., Очиенг Д.Б., Оморе Р., Оундо ДЖО, Хоссейн А., Дас С.К., Ахмед С., Куреши С., Квадри Ф., Адегбола Р.
2012.
Глобальные, региональные и национальные причины детской смертности: обновленный систематический анализ за 2010 г. с временными тенденциями с 2000 г. Lancet
379: 2151–2161. doi: 10.1016/S0140-6736(12)60560-1. [PubMed] [CrossRef] [Google Scholar] 10. Сотрудники ГББ 2015 Смертность и причины смерти. 2015.
Глобальная, региональная и национальная возрастно-половая смертность от всех причин и причинно-специфическая смертность по 240 причинам смерти, 1990–2013 гг.: систематический анализ для исследования глобального бремени болезней, 2013 г. Lancet
385: 117–171.doi: 10.1016/S0140-6736(14)61682-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]11. Котлофф К.Л., Натаро Дж.П., Блэквелдер В.К., Насрин Д., Фараг Т.Х., Панчалингам С., Ву И., Соу С.О., Сур Д., Брейман Р.Ф., Фарук А.С., Заиди А.К., Саха Д., Алонсо П.Л., Тамбура Б., Саного Д., Онвучеква У. , Манна Б., Рамамурти Т., Канунго С., Очиенг Д.Б., Оморе Р., Оундо ДЖО, Хоссейн А., Дас С.К., Ахмед С., Куреши С., Квадри Ф., Адегбола Р. А., Антонио М., Хоссейн М.Дж., Акинсола А., Мандомандо И., Нампосса Т., Акацио С., Бисвас К., О’Рейли К.Э., Минц Э.Д., Беркли Л.И., Мухсен К., Зоммерфельт Х., Робинс-Браун Р.М., Левин М.М.2013.
Бремя и этиология диарейных заболеваний у младенцев и детей младшего возраста в развивающихся странах (Глобальное многоцентровое исследование кишечных инфекций, GEMS): проспективное исследование случай-контроль. Ланцет
382: 209–222. doi: 10.1016/S0140-6736(13)60844-2. [PubMed] [CrossRef] [Google Scholar] 12. Торгерсон П.Р., Девлисшаувер Б., Прает Н., Спейбрук Н., Уиллингем А.Л., Касуга Ф., Рокни М.Б., Чжоу Х.Н., Февр Э.М., Срипа Б., Гаргури Н., Фюрст Т., Будке К.М., Карабин Х., Кирк М.Д., Ангуло Ф.Дж., Хавелаар А. , де Сильва Н.
2015.
Оценки Всемирной организации здравоохранения глобального и регионального бремени 11 паразитарных болезней пищевого происхождения, 2010 г.: обобщение данных.ПЛОС Мед
12:e1001920. doi:10.1371/journal.pmed.1001920. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]13.
А., Антонио М., Хоссейн М.Дж., Акинсола А., Мандомандо И., Нампосса Т., Акацио С., Бисвас К., О’Рейли К.Э., Минц Э.Д., Беркли Л.И., Мухсен К., Зоммерфельт Х., Робинс-Браун Р.М., Левин М.М.2013.
Бремя и этиология диарейных заболеваний у младенцев и детей младшего возраста в развивающихся странах (Глобальное многоцентровое исследование кишечных инфекций, GEMS): проспективное исследование случай-контроль. Ланцет
382: 209–222. doi: 10.1016/S0140-6736(13)60844-2. [PubMed] [CrossRef] [Google Scholar] 12. Торгерсон П.Р., Девлисшаувер Б., Прает Н., Спейбрук Н., Уиллингем А.Л., Касуга Ф., Рокни М.Б., Чжоу Х.Н., Февр Э.М., Срипа Б., Гаргури Н., Фюрст Т., Будке К.М., Карабин Х., Кирк М.Д., Ангуло Ф.Дж., Хавелаар А. , де Сильва Н.
2015.
Оценки Всемирной организации здравоохранения глобального и регионального бремени 11 паразитарных болезней пищевого происхождения, 2010 г.: обобщение данных.ПЛОС Мед
12:e1001920. doi:10.1371/journal.pmed.1001920. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]13. Лю Дж., Платтс-Миллс Дж. А., Джума Дж., Кабир Ф., Нкезе Дж., Окой С., Operario DJ, Уддин Дж., Ахмед С., Алонсо П.Л., Антонио М., Беккер С.М., Блэквелдер В.К., Брейман Р.Ф., Фарук АСГ, Филдс Б., Грац Дж., Хак Р., Хоссейн А., Хоссейн М.Дж., Ярджу С., Камар Ф., Икбал Н.Т., Квамбана Б., Мандомандо И., Макмерри Т.Л., Очиенг С., Очиенг Дж.Б., Очиенг М., Оньянго С., Панчалингам С., Калам А., Азиз Ф. , Куреши С., Рамамурти Т., Робертс Дж. Х., Саха Д., Соу С.О., Строуп С.Е., Сур Д., Тамбура Б., Таниучи М., Теннант С.М., Тоэма Д., У И, Заиди А., Натаро Д.П., Котлофф К.Л., Левин М.М., Хоупт Скорая помощь.2016.
Использование количественных методов молекулярной диагностики для выявления причин диареи у детей: повторный анализ исследования случай-контроль GEMS. Ланцет
388: 1291–1301. doi: 10.1016/S0140-6736(16)31529-X. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]14. Хак Р., Али И.М., Сак Р.Б., Фарр Б.М., Рамакришнан Г., Петри В.А.
2001.
Амебиаз и IgA-антитела слизистых оболочек против лектина прилипания Entamoeba histolytica у бангладешских детей.
Лю Дж., Платтс-Миллс Дж. А., Джума Дж., Кабир Ф., Нкезе Дж., Окой С., Operario DJ, Уддин Дж., Ахмед С., Алонсо П.Л., Антонио М., Беккер С.М., Блэквелдер В.К., Брейман Р.Ф., Фарук АСГ, Филдс Б., Грац Дж., Хак Р., Хоссейн А., Хоссейн М.Дж., Ярджу С., Камар Ф., Икбал Н.Т., Квамбана Б., Мандомандо И., Макмерри Т.Л., Очиенг С., Очиенг Дж.Б., Очиенг М., Оньянго С., Панчалингам С., Калам А., Азиз Ф. , Куреши С., Рамамурти Т., Робертс Дж. Х., Саха Д., Соу С.О., Строуп С.Е., Сур Д., Тамбура Б., Таниучи М., Теннант С.М., Тоэма Д., У И, Заиди А., Натаро Д.П., Котлофф К.Л., Левин М.М., Хоупт Скорая помощь.2016.
Использование количественных методов молекулярной диагностики для выявления причин диареи у детей: повторный анализ исследования случай-контроль GEMS. Ланцет
388: 1291–1301. doi: 10.1016/S0140-6736(16)31529-X. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]14. Хак Р., Али И.М., Сак Р.Б., Фарр Б.М., Рамакришнан Г., Петри В.А.
2001.
Амебиаз и IgA-антитела слизистых оболочек против лектина прилипания Entamoeba histolytica у бангладешских детей. J заразить Dis
183: 1787–1793. дои: 10.1086/320740. [PubMed] [CrossRef] [Google Scholar] 15.Хак Р., Хьюстон К.Д., Хьюз М., Хоупт Э., Петри В.Дж.
2003.
амебиаз. N Engl J Med
348: 1565–1573. дои: 10.1056/NEJMra022710. [PubMed] [CrossRef] [Google Scholar] 17. Солаймани-Мохаммади С., Сингер С.М.
2010.
Giardia duodenalis: обоюдоострый меч иммунных реакций при лямблиозе. Опыт Паразитол
126: 292–297. doi: 10.1016/j.exppara.2010.06.014. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]18. Косек М., Алькантара С., Лима А.А., Геррант Р.Л.
2001.
Криптоспоридиоз: обновление. Ланцет Infect Dis
1: 262–269.doi: 10.1016/S1473-3099(01)00121-9. [PubMed] [CrossRef] [Google Scholar] 19. Chen X-M, Keithly JS, Paya CV, LaRusso NF.
2002.
Криптоспоридиоз. N Engl J Med
346: 1723–1731. дои: 10.1056/NEJMra013170. [PubMed] [CrossRef] [Google Scholar] 20. Вилларино Н.Ф., Леклер Г.Р., Денни Дж.Э., Диарт С.П., Хардинг С.Л., Слоан С.С., Гриббл Д.Л., Кампанья С.Р., Вильгельм С.В., Шмидт Н.В.
2016.
Состав кишечной микробиоты модулирует тяжесть малярии.
J заразить Dis
183: 1787–1793. дои: 10.1086/320740. [PubMed] [CrossRef] [Google Scholar] 15.Хак Р., Хьюстон К.Д., Хьюз М., Хоупт Э., Петри В.Дж.
2003.
амебиаз. N Engl J Med
348: 1565–1573. дои: 10.1056/NEJMra022710. [PubMed] [CrossRef] [Google Scholar] 17. Солаймани-Мохаммади С., Сингер С.М.
2010.
Giardia duodenalis: обоюдоострый меч иммунных реакций при лямблиозе. Опыт Паразитол
126: 292–297. doi: 10.1016/j.exppara.2010.06.014. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]18. Косек М., Алькантара С., Лима А.А., Геррант Р.Л.
2001.
Криптоспоридиоз: обновление. Ланцет Infect Dis
1: 262–269.doi: 10.1016/S1473-3099(01)00121-9. [PubMed] [CrossRef] [Google Scholar] 19. Chen X-M, Keithly JS, Paya CV, LaRusso NF.
2002.
Криптоспоридиоз. N Engl J Med
346: 1723–1731. дои: 10.1056/NEJMra013170. [PubMed] [CrossRef] [Google Scholar] 20. Вилларино Н.Ф., Леклер Г.Р., Денни Дж.Э., Диарт С.П., Хардинг С.Л., Слоан С.С., Гриббл Д.Л., Кампанья С.Р., Вильгельм С.В., Шмидт Н.В.
2016.
Состав кишечной микробиоты модулирует тяжесть малярии. Proc Natl Acad Sci U S A
113:2235–2240. doi: 10.1073/pnas.1504887113.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Мари К., Петри В.А.
2014.
Регуляция вирулентности Entamoeba histolytica. Анну Рев Микробиол
68: 493–520. doi:10.1146/annurev-micro-0-103550. [PubMed] [CrossRef] [Google Scholar] 23. Лозупоне К.А., Стомбог Дж.И., Гордон Дж.И., Янссон Дж.К., Найт Р.
2012.
Разнообразие, стабильность и устойчивость микробиоты кишечника человека. Природа
489: 220–230. дои: 10.1038/природа11550. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]24. Сассоне-Корси М., Раффателлу М.2015.
Нет вакансии: как полезные микробы сотрудничают с иммунитетом, чтобы обеспечить колонизационную устойчивость к патогенам. Дж Иммунол
194:4081–4087. doi: 10.4049/jиммунол.1403169. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]25. Дибейз Дж. К., Фрэнк Д. Н., Матхур Р.
2012.
Влияние микробиоты кишечника на развитие ожирения: современные представления. Am J Gastroenterol Suppl
1:22–27.
Proc Natl Acad Sci U S A
113:2235–2240. doi: 10.1073/pnas.1504887113.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Мари К., Петри В.А.
2014.
Регуляция вирулентности Entamoeba histolytica. Анну Рев Микробиол
68: 493–520. doi:10.1146/annurev-micro-0-103550. [PubMed] [CrossRef] [Google Scholar] 23. Лозупоне К.А., Стомбог Дж.И., Гордон Дж.И., Янссон Дж.К., Найт Р.
2012.
Разнообразие, стабильность и устойчивость микробиоты кишечника человека. Природа
489: 220–230. дои: 10.1038/природа11550. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]24. Сассоне-Корси М., Раффателлу М.2015.
Нет вакансии: как полезные микробы сотрудничают с иммунитетом, чтобы обеспечить колонизационную устойчивость к патогенам. Дж Иммунол
194:4081–4087. doi: 10.4049/jиммунол.1403169. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]25. Дибейз Дж. К., Фрэнк Д. Н., Матхур Р.
2012.
Влияние микробиоты кишечника на развитие ожирения: современные представления. Am J Gastroenterol Suppl
1:22–27. doi:10.1038/ajgsup.2012.5. [Перекрестная ссылка] [Академия Google] 26. Миллион М., Диалло А., Рауль Д.
2016.
Микробиота кишечника и недостаточность питания.Микроб Патог
106:127–138. doi: 10.1016/j.micpath.2016.02.003. [PubMed] [CrossRef] [Google Scholar] 27. Гордон Дж.И., Дьюи К.Г., Миллс Д.А., Меджитов Р.М.
2012.
Микробиота кишечника человека и недостаточное питание. Sci Transl Med
4:137пс12. doi:10.1126/scitranslmed.3004347. [PubMed] [CrossRef] [Google Scholar] 28. Фуджимура К.Е., Линч С.В.
2015.
Микробиота при аллергии и астме и возникающие отношения с кишечным микробиомом. Клеточный микроб-хозяин
17: 592–602. doi:10.1016/j.chom.2015.04.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]29.Mayer EA, Knight R, Mazmanian SK, Cryan JF, Tillisch K.
2014.
Кишечные микробы и мозг: смена парадигмы в неврологии. Джей Нейроски
34:15490–15496. doi:10.1523/JNEUROSCI.3299-14.2014. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]30. Парфри Л.В., Уолтерс В.А., Найт Р.
2011.
doi:10.1038/ajgsup.2012.5. [Перекрестная ссылка] [Академия Google] 26. Миллион М., Диалло А., Рауль Д.
2016.
Микробиота кишечника и недостаточность питания.Микроб Патог
106:127–138. doi: 10.1016/j.micpath.2016.02.003. [PubMed] [CrossRef] [Google Scholar] 27. Гордон Дж.И., Дьюи К.Г., Миллс Д.А., Меджитов Р.М.
2012.
Микробиота кишечника человека и недостаточное питание. Sci Transl Med
4:137пс12. doi:10.1126/scitranslmed.3004347. [PubMed] [CrossRef] [Google Scholar] 28. Фуджимура К.Е., Линч С.В.
2015.
Микробиота при аллергии и астме и возникающие отношения с кишечным микробиомом. Клеточный микроб-хозяин
17: 592–602. doi:10.1016/j.chom.2015.04.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]29.Mayer EA, Knight R, Mazmanian SK, Cryan JF, Tillisch K.
2014.
Кишечные микробы и мозг: смена парадигмы в неврологии. Джей Нейроски
34:15490–15496. doi:10.1523/JNEUROSCI.3299-14.2014. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]30. Парфри Л.В., Уолтерс В.А., Найт Р.
2011. Микробные эукариоты в микробиоме человека: экология, эволюция и будущие направления. Фронт микробиол
2:153. doi: 10.3389/fmicb.2011.00153. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]31. Рэй К.
2016.Микробиота кишечника: защитные простейшие при инфекциях слизистых оболочек. Нат Рев Гастроэнтерол Гепатол
13:682–682. doi:10.1038/nrgastro.2016.174. [PubMed] [CrossRef] [Google Scholar] 32. Лукас Лопес Р., Гранде Бургос М.Х., Гальвес А., Перес Пулидо Р.
2017.
Желудочно-кишечный тракт человека и микробиота полости рта при воспалительных заболеваниях кишечника: обзор состояния науки. АПМИС
125:3–10. doi: 10.1111/apm.12609. [PubMed] [CrossRef] [Google Scholar] 33. Хаттенхауэр С., Геверс Д., Найт Р., Абубакер С., Барсук Дж. Х., Чинвалла А. Т., Кризи Х. Х., Эрл А. М., Фитцджеральд М. Г., Фултон Р. С., Джиглио М. Г., Холлсворт-Пепин К., Лобос Э. А., Мадупу Р., Магрини В., Мартин Дж. К., Митрева М., Музный Д.М., Содергрен Э.Дж., Версалович Дж., Воллам А.М., Уорли К.С., Вортман Дж.Р.
Микробные эукариоты в микробиоме человека: экология, эволюция и будущие направления. Фронт микробиол
2:153. doi: 10.3389/fmicb.2011.00153. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]31. Рэй К.
2016.Микробиота кишечника: защитные простейшие при инфекциях слизистых оболочек. Нат Рев Гастроэнтерол Гепатол
13:682–682. doi:10.1038/nrgastro.2016.174. [PubMed] [CrossRef] [Google Scholar] 32. Лукас Лопес Р., Гранде Бургос М.Х., Гальвес А., Перес Пулидо Р.
2017.
Желудочно-кишечный тракт человека и микробиота полости рта при воспалительных заболеваниях кишечника: обзор состояния науки. АПМИС
125:3–10. doi: 10.1111/apm.12609. [PubMed] [CrossRef] [Google Scholar] 33. Хаттенхауэр С., Геверс Д., Найт Р., Абубакер С., Барсук Дж. Х., Чинвалла А. Т., Кризи Х. Х., Эрл А. М., Фитцджеральд М. Г., Фултон Р. С., Джиглио М. Г., Холлсворт-Пепин К., Лобос Э. А., Мадупу Р., Магрини В., Мартин Дж. К., Митрева М., Музный Д.М., Содергрен Э.Дж., Версалович Дж., Воллам А.М., Уорли К.С., Вортман Дж.Р. , Янг С.К., Зенг К., Аагард К.М., Аболюд О.О., Аллен-Верко Э., Алм Э.Дж., Альварадо Л., Андерсен Г.Л., Андерсон С., Аппельбаум Э., Арачи Х.М., Армитаж Г., Арзе К.А., Айваз Т., Бейкер К.С., Бегг Л., Белачью Т., Бхонагири В., Бихан М., Блазер М.Дж., Блум Т., Бонацци В., Пол Брукс Дж., Бак Г.А., Бухай С.Дж., Бусам Д.А., Кэмпбелл Дж.Л. и соавт..
2012.
Структура, функции и разнообразие микробиома здорового человека. Природа
486: 207–214. дои: 10.1038/природа11234. [Перекрестная ссылка] [Академия Google] 34. Смит М.И., Яцуненко Т., Манари М.Дж., Трехан И., Мкакося Р., Ченг Дж., Кау А.Л., Рич С.С., Конкэннон П., Михалецкий Дж.С., Лю Дж., Хоупт Э., Ли Дж.В., Холмс Э., Николсон Дж., Найтс Д., Урселл Л.К. , Найт Р., Гордон Дж.И.
2013.
Микробиомы кишечника малавийских пар близнецов не соответствуют квашиоркору. Наука
339: 548–554. doi:10.1126/наука.1229000. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]35.Падилья-Вака Ф., Анкри С., Брача Р., Куле Л.А., Мирельман Д.
1999.
Понижающая регуляция вирулентности Entamoeba histolytica моноксеновым культивированием с Escherichia coli O55 связана со снижением экспрессии легкой (35 килодальтон) субъединицы лектина Gal/GalNAc.
, Янг С.К., Зенг К., Аагард К.М., Аболюд О.О., Аллен-Верко Э., Алм Э.Дж., Альварадо Л., Андерсен Г.Л., Андерсон С., Аппельбаум Э., Арачи Х.М., Армитаж Г., Арзе К.А., Айваз Т., Бейкер К.С., Бегг Л., Белачью Т., Бхонагири В., Бихан М., Блазер М.Дж., Блум Т., Бонацци В., Пол Брукс Дж., Бак Г.А., Бухай С.Дж., Бусам Д.А., Кэмпбелл Дж.Л. и соавт..
2012.
Структура, функции и разнообразие микробиома здорового человека. Природа
486: 207–214. дои: 10.1038/природа11234. [Перекрестная ссылка] [Академия Google] 34. Смит М.И., Яцуненко Т., Манари М.Дж., Трехан И., Мкакося Р., Ченг Дж., Кау А.Л., Рич С.С., Конкэннон П., Михалецкий Дж.С., Лю Дж., Хоупт Э., Ли Дж.В., Холмс Э., Николсон Дж., Найтс Д., Урселл Л.К. , Найт Р., Гордон Дж.И.
2013.
Микробиомы кишечника малавийских пар близнецов не соответствуют квашиоркору. Наука
339: 548–554. doi:10.1126/наука.1229000. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]35.Падилья-Вака Ф., Анкри С., Брача Р., Куле Л.А., Мирельман Д.
1999.
Понижающая регуляция вирулентности Entamoeba histolytica моноксеновым культивированием с Escherichia coli O55 связана со снижением экспрессии легкой (35 килодальтон) субъединицы лектина Gal/GalNAc.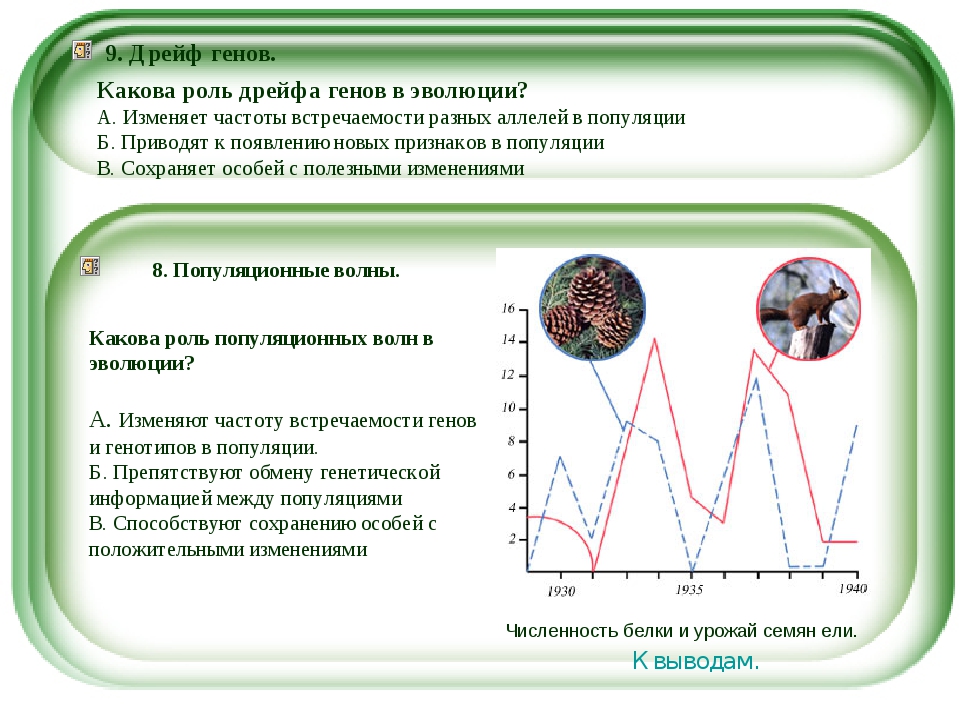 Заразить иммунитет
67:2096–2102. [Бесплатная статья PMC] [PubMed] [Google Scholar]36. Гальван-Моройоки Х.М., Дель Кармен Домингес-Роблес М., Франко Э., Меза И.
2008.
Взаимодействие между Entamoeba и энтеропатогенными бактериями модулирует повреждение эпителиальных клеток.PLoS Negl Trop Dis
2:е266. doi:10.1371/journal.pntd.0000266. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]38. Мортон Э.Р., Линч Дж., Фромент А., Лафосс С., Хейер Э., Пшеворски М., Блехман Р., Сегурель Л., Гринблюм С., Тернбо П., Боренштейн Э., Консорциум Н., Петроф Э., Глор Г., Ваннер С., Виз С., Картер Д. , Дэвид Л., Морис С., Кармоди Р., Гутенберг Д., Баттон Дж., Гудрич Дж., Уотерс Дж., Пул А., Саттер Дж., Корен О., Найтс Д., Лассен К., Ксавье Р., Спор А., Корен О., Лей Р., Блехман Р., Гудрич Дж., Хуанг К., Сунь К., Буковски Р., Домингес-Белло М., Костелло Э., Контрерас М., Магрис М., Идальго Г., Тернбо П., Лей Р., Хамади М., Фрейзер-Лиггетт К., Найт Р., Чо И. , Блазер М. и др..
2015.
Различия в кишечной микробиоте сельской Африки сильно коррелируют с колонизацией Entamoeba и средствами к существованию.
Заразить иммунитет
67:2096–2102. [Бесплатная статья PMC] [PubMed] [Google Scholar]36. Гальван-Моройоки Х.М., Дель Кармен Домингес-Роблес М., Франко Э., Меза И.
2008.
Взаимодействие между Entamoeba и энтеропатогенными бактериями модулирует повреждение эпителиальных клеток.PLoS Negl Trop Dis
2:е266. doi:10.1371/journal.pntd.0000266. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]38. Мортон Э.Р., Линч Дж., Фромент А., Лафосс С., Хейер Э., Пшеворски М., Блехман Р., Сегурель Л., Гринблюм С., Тернбо П., Боренштейн Э., Консорциум Н., Петроф Э., Глор Г., Ваннер С., Виз С., Картер Д. , Дэвид Л., Морис С., Кармоди Р., Гутенберг Д., Баттон Дж., Гудрич Дж., Уотерс Дж., Пул А., Саттер Дж., Корен О., Найтс Д., Лассен К., Ксавье Р., Спор А., Корен О., Лей Р., Блехман Р., Гудрич Дж., Хуанг К., Сунь К., Буковски Р., Домингес-Белло М., Костелло Э., Контрерас М., Магрис М., Идальго Г., Тернбо П., Лей Р., Хамади М., Фрейзер-Лиггетт К., Найт Р., Чо И. , Блазер М. и др..
2015.
Различия в кишечной микробиоте сельской Африки сильно коррелируют с колонизацией Entamoeba и средствами к существованию. Генетика PLoS
11:e1005658. doi: 10.1371/journal.pgen.1005658. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]39. Гилкрист К.А., Петри С.Е., Шнайдер Б.Н., Райхман Д.Дж., Цзян Н., Бегум С., Ватанабэ К., Янсен К.С., Эллиотт К.П., Берджесс С.Л., Ма Дж.З., Алам М., Кабир М., Хак Р., Петри В.А.
2016.
Роль кишечной микробиоты у детей при диарее, вызванной простейшим паразитом Entamoeba histolytica.J заразить Dis
213: 1579–1585. дои: 10.1093/infdis/jiv772. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]40. Хофер У.
2014.
Микробиом: провоспалительный Prevotella?
Нат Рев Микробиол
12:5. doi: 10.1038/nrmicro3180. [PubMed] [CrossRef] [Google Scholar]41. Шер Ю.Ю., Щеснак А., Лонгман Р.С., Сегата Н., Убеда С., Бельски С., Рострон Т., Церундоло В., Памер Э.Г., Абрамсон С.Б., Хаттенхауэр С., Литтман Д.Р.
2013.
Распространение Prevotella copri в кишечнике коррелирует с повышенной восприимчивостью к артриту.электронная жизнь
2:e01202. doi: 10.7554/eLife.01202. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]42.
Генетика PLoS
11:e1005658. doi: 10.1371/journal.pgen.1005658. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]39. Гилкрист К.А., Петри С.Е., Шнайдер Б.Н., Райхман Д.Дж., Цзян Н., Бегум С., Ватанабэ К., Янсен К.С., Эллиотт К.П., Берджесс С.Л., Ма Дж.З., Алам М., Кабир М., Хак Р., Петри В.А.
2016.
Роль кишечной микробиоты у детей при диарее, вызванной простейшим паразитом Entamoeba histolytica.J заразить Dis
213: 1579–1585. дои: 10.1093/infdis/jiv772. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]40. Хофер У.
2014.
Микробиом: провоспалительный Prevotella?
Нат Рев Микробиол
12:5. doi: 10.1038/nrmicro3180. [PubMed] [CrossRef] [Google Scholar]41. Шер Ю.Ю., Щеснак А., Лонгман Р.С., Сегата Н., Убеда С., Бельски С., Рострон Т., Церундоло В., Памер Э.Г., Абрамсон С.Б., Хаттенхауэр С., Литтман Д.Р.
2013.
Распространение Prevotella copri в кишечнике коррелирует с повышенной восприимчивостью к артриту.электронная жизнь
2:e01202. doi: 10.7554/eLife.01202. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]42.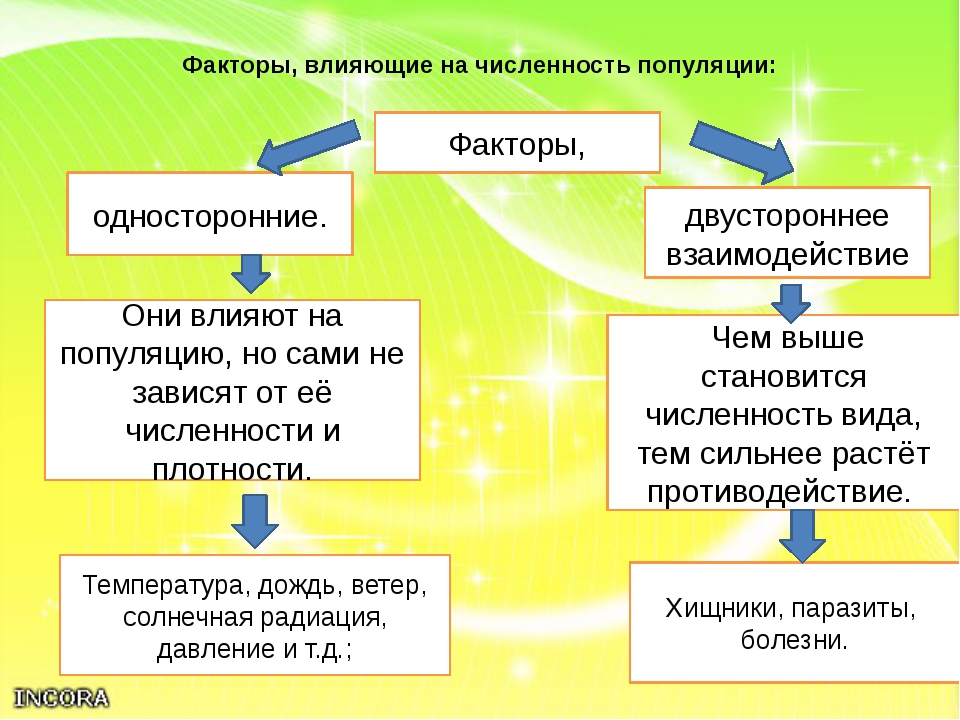 Chappell CL, Darkoh C, Shimmin L, Farhana N, Kim D-K, Okhuysen PC, Hixson J.
2016.
Фекальный индол как биомаркер восприимчивости к инфекции Cryptosporidium. Заразить иммунитет
84:2299–2306. doi: 10.1128/IAI.00336-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]43. Шимада Й, Киношита М, Харада К, Мизутани М, Масахата К, Каяма Х, Такеда К.
2013.
Зависимая от комменсальных бактерий продукция индола усиливает функцию эпителиального барьера в толстой кишке.PLoS один
8:e80604. doi:10.1371/journal.pone.0080604. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]44. Джин У-Х, Ли С-О, Шридхаран Г., Ли К., Дэвидсон Л.А., Джаяраман А., Чапкин Р.С., Аланиз Р., Сейф С.
2014.
Метаболиты триптофана, полученные из микробиома, и их активность агонистов и антагонистов, зависящих от арильных углеводородных рецепторов. Мол Фармакол
85:777–788. doi:10.1124/мол.113.0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]45. Сокол Х., Пиньер Б., Ваттерлот Л., Лахдари О., Бермудес-Умаран Л.
Chappell CL, Darkoh C, Shimmin L, Farhana N, Kim D-K, Okhuysen PC, Hixson J.
2016.
Фекальный индол как биомаркер восприимчивости к инфекции Cryptosporidium. Заразить иммунитет
84:2299–2306. doi: 10.1128/IAI.00336-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]43. Шимада Й, Киношита М, Харада К, Мизутани М, Масахата К, Каяма Х, Такеда К.
2013.
Зависимая от комменсальных бактерий продукция индола усиливает функцию эпителиального барьера в толстой кишке.PLoS один
8:e80604. doi:10.1371/journal.pone.0080604. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]44. Джин У-Х, Ли С-О, Шридхаран Г., Ли К., Дэвидсон Л.А., Джаяраман А., Чапкин Р.С., Аланиз Р., Сейф С.
2014.
Метаболиты триптофана, полученные из микробиома, и их активность агонистов и антагонистов, зависящих от арильных углеводородных рецепторов. Мол Фармакол
85:777–788. doi:10.1124/мол.113.0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]45. Сокол Х., Пиньер Б., Ваттерлот Л., Лахдари О., Бермудес-Умаран Л. Г., Гратаду Дж.Дж., Блюжон С., Бридонно С., Фюре Дж.П., Кортье Г., Гранжетт С., Васкес Н., Пошар П., Труньян Г., Томас Г., Блоттьер Х.М., Доре Дж., Марто П., Сексик П., Ланджелла П.2008.
Faecalibacterium prausnitzii представляет собой противовоспалительную комменсальную бактерию, идентифицированную при анализе микробиоты кишечника пациентов с болезнью Крона. Proc Natl Acad Sci U S A
105:16731–16736. doi:10.1073/pnas.0804812105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]46. Лопес-Сайлес М., Мартинес-Медина М., Бускетс Д., Сабат-Мир М., Дункан С.Х., Флинт Х.Дж., Альдегер Х., Гарсия-Хил Л.Дж.
2014.
Совместное обилие Faecalibacterium prausnitzii и Escherichia coli, ассоциированных со слизистой оболочкой, позволяет отличить фенотипы синдрома раздраженного кишечника и воспалительного заболевания кишечника.Int J Med Microbiol
304: 464–475. doi:10.1016/j.ijmm.2014.02.009. [PubMed] [CrossRef] [Google Scholar]47. Иебба В., Сантанджело Ф., Тотино В., Пантанелла Ф., Монсия А., Ди Кристанциано В.
Г., Гратаду Дж.Дж., Блюжон С., Бридонно С., Фюре Дж.П., Кортье Г., Гранжетт С., Васкес Н., Пошар П., Труньян Г., Томас Г., Блоттьер Х.М., Доре Дж., Марто П., Сексик П., Ланджелла П.2008.
Faecalibacterium prausnitzii представляет собой противовоспалительную комменсальную бактерию, идентифицированную при анализе микробиоты кишечника пациентов с болезнью Крона. Proc Natl Acad Sci U S A
105:16731–16736. doi:10.1073/pnas.0804812105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]46. Лопес-Сайлес М., Мартинес-Медина М., Бускетс Д., Сабат-Мир М., Дункан С.Х., Флинт Х.Дж., Альдегер Х., Гарсия-Хил Л.Дж.
2014.
Совместное обилие Faecalibacterium prausnitzii и Escherichia coli, ассоциированных со слизистой оболочкой, позволяет отличить фенотипы синдрома раздраженного кишечника и воспалительного заболевания кишечника.Int J Med Microbiol
304: 464–475. doi:10.1016/j.ijmm.2014.02.009. [PubMed] [CrossRef] [Google Scholar]47. Иебба В., Сантанджело Ф., Тотино В., Пантанелла Ф., Монсия А., Ди Кристанциано В. , Ди Кейв Д., Схиппа С., Беррилли Ф., Д’Альфонсо Р.
2016.
Микробиота кишечника, связанная с инфекциями Giardia duodenalis, Entamoeba spp и Blastocystis hominis у людей из Кот-д’Ивуара. J Infect Dev Cries
10:1035–1041. дои: 10.3855/jidc.8179. [PubMed] [CrossRef] [Google Scholar]49. Кларк КГ.
1997.
Обширное генетическое разнообразие Blastocystis hominis.Мол Биохим Паразитол
87:79–83. doi: 10.1016/S0166-6851(97)00046-7. [PubMed] [CrossRef] [Google Scholar]50. Одебер К., Эвен Г., Циан А., Сафади Эль Д., Сертад Г., Делхаес Л., Перейра Б., Нурриссон К., Пуарье П., Вавжиняк И., Дельбак Ф., Морель К., Бастьен П., Лашо Л., Белланже А.П., Боттерель Ф., Кандольфи Э, Десобо Г., Морио Ф., Помарес К., Рабодонирина М., Лойвик А., Мерлин С., Вискольози Э., Чабе М., Алауи Эль Х., Сканлан П.Д., Дено Ф., Вавжиняк И., Вавжиняк И., Лим М.Х., Ву З., Мирза Х. , Tan KSW, Wu Z, Mirza H, Teo JDW, Tan KSW, Scanlan PD, Marchesi JR, Scanlan PD, Petersen AM, Krogsgaard LR, Engsbro AL, Stensvold CR, Nielsen HV, Bytzer P, Rossen NG, Manichanh C, Borruel Н и др.
, Ди Кейв Д., Схиппа С., Беррилли Ф., Д’Альфонсо Р.
2016.
Микробиота кишечника, связанная с инфекциями Giardia duodenalis, Entamoeba spp и Blastocystis hominis у людей из Кот-д’Ивуара. J Infect Dev Cries
10:1035–1041. дои: 10.3855/jidc.8179. [PubMed] [CrossRef] [Google Scholar]49. Кларк КГ.
1997.
Обширное генетическое разнообразие Blastocystis hominis.Мол Биохим Паразитол
87:79–83. doi: 10.1016/S0166-6851(97)00046-7. [PubMed] [CrossRef] [Google Scholar]50. Одебер К., Эвен Г., Циан А., Сафади Эль Д., Сертад Г., Делхаес Л., Перейра Б., Нурриссон К., Пуарье П., Вавжиняк И., Дельбак Ф., Морель К., Бастьен П., Лашо Л., Белланже А.П., Боттерель Ф., Кандольфи Э, Десобо Г., Морио Ф., Помарес К., Рабодонирина М., Лойвик А., Мерлин С., Вискольози Э., Чабе М., Алауи Эль Х., Сканлан П.Д., Дено Ф., Вавжиняк И., Вавжиняк И., Лим М.Х., Ву З., Мирза Х. , Tan KSW, Wu Z, Mirza H, Teo JDW, Tan KSW, Scanlan PD, Marchesi JR, Scanlan PD, Petersen AM, Krogsgaard LR, Engsbro AL, Stensvold CR, Nielsen HV, Bytzer P, Rossen NG, Manichanh C, Borruel Н и др. .
2016.
Колонизация кишечными простейшими Blastocystis связана с увеличением разнообразия бактериальной микробиоты кишечника человека. научный представитель
6:25255. дои: 10.1038/srep25255. [CrossRef] [Google Scholar]51. ВОЗ. 2014.
Распространенность и заболеваемость отдельными инфекциями, передающимися половым путем. ВОЗ, Женева, Швейцария. [Google Академия]52. Бротман Р.М., Брэдфорд Л.Л., Конрад М., Гаджер П., Олт К., Перальта Л., Форни Л.Дж., Карлтон Дж.М., Абдо З., Равель Дж.
2012.
Связь между Trichomonas vaginalis и составом бактериального сообщества влагалища у женщин репродуктивного возраста.Секс Трансм Дис
39:807–812. doi: 10.1097/OLQ.0b013e3182631c79. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]53. Фукан Н., Парсаманд Т., Брукс А.Е.С., Нгуен Т.Н.М., Симоес-Барбоса А.
2013.
Прикрепление Trichomonas vaginalis к эктоцервикальным клеткам хозяина находится под влиянием лактобацилл. Секс Трансм Заражение
89: 455–459. doi: 10.1136/sextrans-2013-051039. [PubMed] [CrossRef] [Google Scholar]54.
.
2016.
Колонизация кишечными простейшими Blastocystis связана с увеличением разнообразия бактериальной микробиоты кишечника человека. научный представитель
6:25255. дои: 10.1038/srep25255. [CrossRef] [Google Scholar]51. ВОЗ. 2014.
Распространенность и заболеваемость отдельными инфекциями, передающимися половым путем. ВОЗ, Женева, Швейцария. [Google Академия]52. Бротман Р.М., Брэдфорд Л.Л., Конрад М., Гаджер П., Олт К., Перальта Л., Форни Л.Дж., Карлтон Дж.М., Абдо З., Равель Дж.
2012.
Связь между Trichomonas vaginalis и составом бактериального сообщества влагалища у женщин репродуктивного возраста.Секс Трансм Дис
39:807–812. doi: 10.1097/OLQ.0b013e3182631c79. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]53. Фукан Н., Парсаманд Т., Брукс А.Е.С., Нгуен Т.Н.М., Симоес-Барбоса А.
2013.
Прикрепление Trichomonas vaginalis к эктоцервикальным клеткам хозяина находится под влиянием лактобацилл. Секс Трансм Заражение
89: 455–459. doi: 10.1136/sextrans-2013-051039. [PubMed] [CrossRef] [Google Scholar]54. Нур А.М., Киньоки Д.К., Мундиа К.С., Кабария К.С., Мутуа Д.В., Алегана В.А., Фолл И.С., Сноу П.В.
2014.
Изменение риска заражения малярией Plasmodium falciparum в Африке: 2000–2010 годы: пространственный и временной анализ интенсивности передачи.Ланцет
383: 1739–1747. doi: 10.1016/S0140-6736(13)62566-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]55. Ндунгу Ф.М., Марш К., Феган Г., Вамбуа Дж., Ньянгвесо Г., Огада Э., Мванги Т., Нюндо С., Мачария А., Уйога С., Уильямс Т.Н., Бейджон П.
2015.
Выявление детей с избыточными эпизодами малярии после поправки на вариации воздействия: идентификация на основе лонгитюдного исследования с использованием моделей статистического подсчета. БМК Мед
13:183. doi: 10.1186/s12916-015-0422-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]56.Mwangi TW, Fegan G, Williams TN, Kinyanjui SM, Snow RW, Marsh K, Marsh K, Kinyanjui S, Bonnet S, Paul R, Gouagna C, Safeukui I, Meunier J, Mwangi T, Ross A, Snow R, Marsh K , Trape J, Rogier C, Rogier C, Trape J, Trape J, Pison G, Spiegel A, Enel C, Rogier C, Rogier C, Imbert P, Tall A, Sokhna C, Spiegel A, Rogier C, Tall A, Diagne Н.
Нур А.М., Киньоки Д.К., Мундиа К.С., Кабария К.С., Мутуа Д.В., Алегана В.А., Фолл И.С., Сноу П.В.
2014.
Изменение риска заражения малярией Plasmodium falciparum в Африке: 2000–2010 годы: пространственный и временной анализ интенсивности передачи.Ланцет
383: 1739–1747. doi: 10.1016/S0140-6736(13)62566-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]55. Ндунгу Ф.М., Марш К., Феган Г., Вамбуа Дж., Ньянгвесо Г., Огада Э., Мванги Т., Нюндо С., Мачария А., Уйога С., Уильямс Т.Н., Бейджон П.
2015.
Выявление детей с избыточными эпизодами малярии после поправки на вариации воздействия: идентификация на основе лонгитюдного исследования с использованием моделей статистического подсчета. БМК Мед
13:183. doi: 10.1186/s12916-015-0422-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]56.Mwangi TW, Fegan G, Williams TN, Kinyanjui SM, Snow RW, Marsh K, Marsh K, Kinyanjui S, Bonnet S, Paul R, Gouagna C, Safeukui I, Meunier J, Mwangi T, Ross A, Snow R, Marsh K , Trape J, Rogier C, Rogier C, Trape J, Trape J, Pison G, Spiegel A, Enel C, Rogier C, Rogier C, Imbert P, Tall A, Sokhna C, Spiegel A, Rogier C, Tall A, Diagne Н. , Фонтениль Д., Шпигель А., Вулхаус М., Дай С., Этард Дж., Смит Т., Чарлвуд Дж., Смит Д., Душофф Дж., Сноу Р., Хэй С., Элисса Н., Мигот-Набиас Ф., Люти А., Рено А., Туре Ф и др..
2008.
Доказательства чрезмерной дисперсии в распределении клинических эпизодов малярии у детей. PLoS один
3:e2196. doi:10.1371/journal.pone.0002196. [Перекрестная ссылка] [Академия Google] 57. Роно Дж., Фернерт А., Мурунги Л., Оджал Дж., Камую Г., Гулейд Ф., Ньянгвесо Г., Вамбуа Дж., Китсао Б., Олоту А., Марш К., Осьер Ф.Х.
2015.
Множественные клинические эпизоды малярии Plasmodium falciparum в условиях низкой интенсивности передачи: воздействие против иммунитета. БМК Мед
13:114. doi: 10.1186/s12916-015-0354-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]58.Мин-Оо Г, Грос П.
2005.
Варианты эритроцитов и характер их противомалярийного защитного действия. Клеточная микробиология
7: 753–763. doi:10.1111/j.1462-5822.2005.00524.x. [PubMed] [CrossRef] [Google Scholar]59. Гонг Л., Парих С., Розенталь П.
, Фонтениль Д., Шпигель А., Вулхаус М., Дай С., Этард Дж., Смит Т., Чарлвуд Дж., Смит Д., Душофф Дж., Сноу Р., Хэй С., Элисса Н., Мигот-Набиас Ф., Люти А., Рено А., Туре Ф и др..
2008.
Доказательства чрезмерной дисперсии в распределении клинических эпизодов малярии у детей. PLoS один
3:e2196. doi:10.1371/journal.pone.0002196. [Перекрестная ссылка] [Академия Google] 57. Роно Дж., Фернерт А., Мурунги Л., Оджал Дж., Камую Г., Гулейд Ф., Ньянгвесо Г., Вамбуа Дж., Китсао Б., Олоту А., Марш К., Осьер Ф.Х.
2015.
Множественные клинические эпизоды малярии Plasmodium falciparum в условиях низкой интенсивности передачи: воздействие против иммунитета. БМК Мед
13:114. doi: 10.1186/s12916-015-0354-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]58.Мин-Оо Г, Грос П.
2005.
Варианты эритроцитов и характер их противомалярийного защитного действия. Клеточная микробиология
7: 753–763. doi:10.1111/j.1462-5822.2005.00524.x. [PubMed] [CrossRef] [Google Scholar]59. Гонг Л., Парих С., Розенталь П. Дж., Гринхаус Б., Уильямс Т., Квятковски Д., Луони Г., Маккиннон М., Мванги Т., Сноу Р., Марш К., Уильямс Т., Тейлор С., Керами С., Фэйрхерст Р., Пил Ф., Патил А. , Хоус Р., Ньянгири О., Гетинг П., Уильямс Т., Уэзеролл Д., Хэй С., Бит Э., Эллисон А., Брейн П., Ингрэм В., Банн Х., Холдейн Дж., Жиль Х., Флетчер К., Хендрикс Р., Линднер Р., Редди С., Аллан Н., Хилл А., Аллсопп С., Квятковски Д., Ансти Н., Твумаси П., Роу П., Беннетт С., Брюстер Д., МакМайкл А., Гринвуд Б., Мэй Дж., Эванс Дж., Тимманн С., Эймен С. и др..
2013.
Биохимические и иммунологические механизмы, с помощью которых признак серповидноклеточной анемии защищает от малярии. Малар Дж.
12:317. дои: 10.1186/1475-2875-12-317. [Перекрестная ссылка] [Академия Google] 60. Netea MG, Joosten LAB, Latz E, Mills KHG, Natoli G, Stunnenberg HG, ONeill LAJ, Xavier RJ.
2016.
Тренированный иммунитет: программа врожденной иммунной памяти в норме и при болезни. Наука
352:ааф1098. doi:10.1126/science.aaf1098. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]61.
Дж., Гринхаус Б., Уильямс Т., Квятковски Д., Луони Г., Маккиннон М., Мванги Т., Сноу Р., Марш К., Уильямс Т., Тейлор С., Керами С., Фэйрхерст Р., Пил Ф., Патил А. , Хоус Р., Ньянгири О., Гетинг П., Уильямс Т., Уэзеролл Д., Хэй С., Бит Э., Эллисон А., Брейн П., Ингрэм В., Банн Х., Холдейн Дж., Жиль Х., Флетчер К., Хендрикс Р., Линднер Р., Редди С., Аллан Н., Хилл А., Аллсопп С., Квятковски Д., Ансти Н., Твумаси П., Роу П., Беннетт С., Брюстер Д., МакМайкл А., Гринвуд Б., Мэй Дж., Эванс Дж., Тимманн С., Эймен С. и др..
2013.
Биохимические и иммунологические механизмы, с помощью которых признак серповидноклеточной анемии защищает от малярии. Малар Дж.
12:317. дои: 10.1186/1475-2875-12-317. [Перекрестная ссылка] [Академия Google] 60. Netea MG, Joosten LAB, Latz E, Mills KHG, Natoli G, Stunnenberg HG, ONeill LAJ, Xavier RJ.
2016.
Тренированный иммунитет: программа врожденной иммунной памяти в норме и при болезни. Наука
352:ааф1098. doi:10.1126/science.aaf1098. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]61. Ричардс Дж.Л., Яп Ю.А., Маклеод К.Х., Маккей Ч.Р., Мариньо Э.2016.
Пищевые метаболиты и микробиота кишечника: альтернативный подход к контролю воспалительных и аутоиммунных заболеваний. Клин Трансл Иммунол
5:e82. doi: 10.1038 / cti.2016.29. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]63. Берджесс С.Л., Салех М., Ковардин К.А., Буономо Э., Нур З., Ватанабэ К., Абхьянкар М., Ладжуа С., Уиллс-Карп М., Петри В.А.
2016.
Роль сывороточного амилоида А, GM-CSF и экспансии предшественников гранулоцитов-моноцитов костного мозга в опосредованной сегментированными нитчатыми бактериями защите от Entamoeba histolytica .Заразить иммунитет
84:e00316-16. doi: 10.1128/IAI.00316-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]64. Де Пальма Г., Бленнерхассет П., Лу Дж., Денг И., Парк А.Дж., Грин В., Дену Э., Сильва М.А., Сантакруз А., Санс И., Сюретт М.Г., Верду Э.Ф., Коллинз С.М., Берчик П., Ларкин В., Рид Дж., Брэдфорд К., Ли М., Сюэ Х., Шао С., Шао Ф., Ван В., О’Лири О.
Ричардс Дж.Л., Яп Ю.А., Маклеод К.Х., Маккей Ч.Р., Мариньо Э.2016.
Пищевые метаболиты и микробиота кишечника: альтернативный подход к контролю воспалительных и аутоиммунных заболеваний. Клин Трансл Иммунол
5:e82. doi: 10.1038 / cti.2016.29. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]63. Берджесс С.Л., Салех М., Ковардин К.А., Буономо Э., Нур З., Ватанабэ К., Абхьянкар М., Ладжуа С., Уиллс-Карп М., Петри В.А.
2016.
Роль сывороточного амилоида А, GM-CSF и экспансии предшественников гранулоцитов-моноцитов костного мозга в опосредованной сегментированными нитчатыми бактериями защите от Entamoeba histolytica .Заразить иммунитет
84:e00316-16. doi: 10.1128/IAI.00316-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]64. Де Пальма Г., Бленнерхассет П., Лу Дж., Денг И., Парк А.Дж., Грин В., Дену Э., Сильва М.А., Сантакруз А., Санс И., Сюретт М.Г., Верду Э.Ф., Коллинз С.М., Берчик П., Ларкин В., Рид Дж., Брэдфорд К., Ли М., Сюэ Х., Шао С., Шао Ф., Ван В., О’Лири О. Ф., Крайан Дж.Ф., О’Махони С.М., Хайленд Н.П., Динан Т.Г., Крайан Дж.Ф., Барро Ф., Ферриер Л., Фиорамонти Дж., Буэно Л. , Гаро М.Г., Сильва М.А., Пердью М.Х., Варгезе А.К., Липпманн М., Бресс А., Немерофф К.Б., Плоцкий П.М., Монтеджиа Л.М., Айса Б., Чанг Э.К., Молони Р.Д., Хайланд Н.П., Барро Ф., Ферриер Л., Фиорамонти Дж., Буэно Л., Гаро М.Г. и соавт..
2015.
Микробиота и детерминанты хозяина поведенческого фенотипа у мышей, разлученных с матерью. Нац Коммуна
6:7735. дои: 10.1038/ncomms8735. [Перекрестная ссылка] [Академия Google] 65. Stough JMA, Dearth SP, Denny JE, LeCleir GR, Schmidt NW, Campagna SR, Wilhelm SW.
2016.
Функциональные характеристики кишечного микробиома у мышей C57BL/6, дифференциально восприимчивых к Plasmodium yoelii. Фронт микробиол
7:1520. doi: 10.3389/fmicb.2016.01520. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]66. Swann JR, Want EJ, Geier FM, Spagou K, Wilson ID, Sidaway JE, Nicholson JK, Holmes E.2011.
Системная кишечная микробная модуляция метаболизма желчных кислот в тканевых компартментах хозяина.
Ф., Крайан Дж.Ф., О’Махони С.М., Хайленд Н.П., Динан Т.Г., Крайан Дж.Ф., Барро Ф., Ферриер Л., Фиорамонти Дж., Буэно Л. , Гаро М.Г., Сильва М.А., Пердью М.Х., Варгезе А.К., Липпманн М., Бресс А., Немерофф К.Б., Плоцкий П.М., Монтеджиа Л.М., Айса Б., Чанг Э.К., Молони Р.Д., Хайланд Н.П., Барро Ф., Ферриер Л., Фиорамонти Дж., Буэно Л., Гаро М.Г. и соавт..
2015.
Микробиота и детерминанты хозяина поведенческого фенотипа у мышей, разлученных с матерью. Нац Коммуна
6:7735. дои: 10.1038/ncomms8735. [Перекрестная ссылка] [Академия Google] 65. Stough JMA, Dearth SP, Denny JE, LeCleir GR, Schmidt NW, Campagna SR, Wilhelm SW.
2016.
Функциональные характеристики кишечного микробиома у мышей C57BL/6, дифференциально восприимчивых к Plasmodium yoelii. Фронт микробиол
7:1520. doi: 10.3389/fmicb.2016.01520. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]66. Swann JR, Want EJ, Geier FM, Spagou K, Wilson ID, Sidaway JE, Nicholson JK, Holmes E.2011.
Системная кишечная микробная модуляция метаболизма желчных кислот в тканевых компартментах хозяина.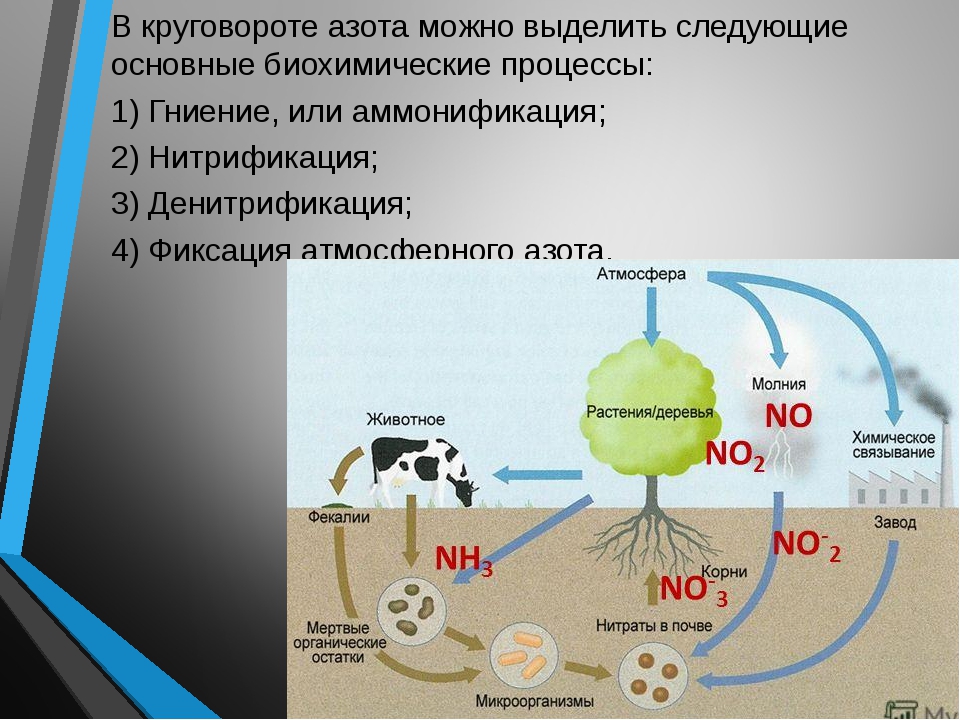 Proc Natl Acad Sci U S A
108 (прил.): 4523–4530. doi: 10.1073/pnas.1006734107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]67. Педерсен Х.К., Гудмундсдоттир В., Нильсен Х.Б., Хиотилайнен Т., Нильсен Т., Йенсен Б.А., Форслунд К., Хильдебранд Ф., Прифти Э., Фалони Г., Ле Шателье Э., Левенес Ф., Доре Дж., Маттила И., Плихта Д.Р., Похо П., Хеллгрен LI, Arumugam M, Sunagawa S, Vieira-Silva S, Jørgensen T, Holm JB, Trošt K, MetaHIT Consortium, Kristiansen K, Brix S, Raes J, Wang J, Hansen T, Bork P, Brunak S, Oresic M, Ehrlich С.Д., Педерсен О.2016.
Микробы кишечника человека влияют на метаболизм сыворотки хозяина и чувствительность к инсулину. Природа
535:376–381. дои: 10.1038/природа18646. [PubMed] [CrossRef] [Google Scholar]68. Cobbold SA, Chua HH, Nijagal B, Creek DJ, Ralph SA, McConville MJ.
2016.
Метаболическая дисрегуляция, вызванная у Plasmodium falciparum дигидроартемизинином и другими противомалярийными препаратами первой линии. J заразить Dis
213: 276–286. дои: 10.
Proc Natl Acad Sci U S A
108 (прил.): 4523–4530. doi: 10.1073/pnas.1006734107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]67. Педерсен Х.К., Гудмундсдоттир В., Нильсен Х.Б., Хиотилайнен Т., Нильсен Т., Йенсен Б.А., Форслунд К., Хильдебранд Ф., Прифти Э., Фалони Г., Ле Шателье Э., Левенес Ф., Доре Дж., Маттила И., Плихта Д.Р., Похо П., Хеллгрен LI, Arumugam M, Sunagawa S, Vieira-Silva S, Jørgensen T, Holm JB, Trošt K, MetaHIT Consortium, Kristiansen K, Brix S, Raes J, Wang J, Hansen T, Bork P, Brunak S, Oresic M, Ehrlich С.Д., Педерсен О.2016.
Микробы кишечника человека влияют на метаболизм сыворотки хозяина и чувствительность к инсулину. Природа
535:376–381. дои: 10.1038/природа18646. [PubMed] [CrossRef] [Google Scholar]68. Cobbold SA, Chua HH, Nijagal B, Creek DJ, Ralph SA, McConville MJ.
2016.
Метаболическая дисрегуляция, вызванная у Plasmodium falciparum дигидроартемизинином и другими противомалярийными препаратами первой линии. J заразить Dis
213: 276–286. дои: 10. 1093/infdis/jiv372. [PubMed] [CrossRef] [Google Scholar]69. Перес П.Ф., Миннаард Дж., Руве М., Кнабенханс С., Брассарт Д., Де Антони Г.Л., Шиффрин Э.Дж.2001.
Ингибирование кишечной лямблии внеклеточными факторами лактобацилл: исследование in vitro. Appl Environ Microbiol
67: 5037–5042. doi: 10.1128/AEM.67.11.5037-5042.2001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]70. Хумен М.А., Де Антони Г.Л., Беньякуб Дж., Костас М.Е., Кардозо М.И., Козубский Л., Саудан К.Ю., Боенцли-Бруанд А., Блюм С., Шиффрин Э.Дж., Перес П.Ф.
2005.
Lactobacillus johnsonii La1 противодействует лямблиям кишечным in vivo. Заразить иммунитет
73:1265–1269. дои: 10.1128/IAI.73.2.1265-1269.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]71. Беррилли Ф., Ди Кейв Д., Кавальеро С., Д’Амелио С.
2012.
Взаимодействия между паразитами и микробными сообществами в кишечнике человека. Front Cell Infect Microbiol
2:141. doi:10.3389/fcimb.2012.00141. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]72.
1093/infdis/jiv372. [PubMed] [CrossRef] [Google Scholar]69. Перес П.Ф., Миннаард Дж., Руве М., Кнабенханс С., Брассарт Д., Де Антони Г.Л., Шиффрин Э.Дж.2001.
Ингибирование кишечной лямблии внеклеточными факторами лактобацилл: исследование in vitro. Appl Environ Microbiol
67: 5037–5042. doi: 10.1128/AEM.67.11.5037-5042.2001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]70. Хумен М.А., Де Антони Г.Л., Беньякуб Дж., Костас М.Е., Кардозо М.И., Козубский Л., Саудан К.Ю., Боенцли-Бруанд А., Блюм С., Шиффрин Э.Дж., Перес П.Ф.
2005.
Lactobacillus johnsonii La1 противодействует лямблиям кишечным in vivo. Заразить иммунитет
73:1265–1269. дои: 10.1128/IAI.73.2.1265-1269.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]71. Беррилли Ф., Ди Кейв Д., Кавальеро С., Д’Амелио С.
2012.
Взаимодействия между паразитами и микробными сообществами в кишечнике человека. Front Cell Infect Microbiol
2:141. doi:10.3389/fcimb.2012.00141. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]72. Верма А.К., Верма Р., Ахуджа В., Пол Дж.
2012.
Анализ кишечной флоры в режиме реального времени у пациентов, инфицированных Entamoeba histolytica в Северной Индии. БМС Микробиол
12:183. дои: 10.1186/1471-2180-12-183.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]73. Сарджапурам Н., Мекала Н., Сингх М., Тату У.
2017.
Потенциал комбинации Lactobacillus casei и Enterococcus faecium в качестве профилактического пробиотика против Entamoeba. Пробиотики Антимикробные белки
9: 142–149. doi:10.1007/s12602-016-9232-z. [PubMed] [CrossRef] [Google Scholar]74. Нгуен Т.Л.А., Виейра-Силва С., Листон А., Раес Дж.
2015.
Насколько информативна мышь для исследования микробиоты кишечника человека?
Ди Модель Меха
8:1–16. doi: 10.1242/dmm.017400.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]75. Хоупт Э.Р., Глембоки Д.Дж., Обриг Т.Г., Москалюк К.А., Локхарт Л.А., Райт Р.Л., Синер Р.М., Хранители Т.Р., Уилкинс Т.Д., Петри В.А.
2002.
Модель амебного колита на мышах выявляет восприимчивость линии мышей к инфекции и обострению заболевания Т-клетками CD4 + .
Верма А.К., Верма Р., Ахуджа В., Пол Дж.
2012.
Анализ кишечной флоры в режиме реального времени у пациентов, инфицированных Entamoeba histolytica в Северной Индии. БМС Микробиол
12:183. дои: 10.1186/1471-2180-12-183.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]73. Сарджапурам Н., Мекала Н., Сингх М., Тату У.
2017.
Потенциал комбинации Lactobacillus casei и Enterococcus faecium в качестве профилактического пробиотика против Entamoeba. Пробиотики Антимикробные белки
9: 142–149. doi:10.1007/s12602-016-9232-z. [PubMed] [CrossRef] [Google Scholar]74. Нгуен Т.Л.А., Виейра-Силва С., Листон А., Раес Дж.
2015.
Насколько информативна мышь для исследования микробиоты кишечника человека?
Ди Модель Меха
8:1–16. doi: 10.1242/dmm.017400.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]75. Хоупт Э.Р., Глембоки Д.Дж., Обриг Т.Г., Москалюк К.А., Локхарт Л.А., Райт Р.Л., Синер Р.М., Хранители Т.Р., Уилкинс Т.Д., Петри В.А.
2002.
Модель амебного колита на мышах выявляет восприимчивость линии мышей к инфекции и обострению заболевания Т-клетками CD4 + . Дж Иммунол
169:4496–4503. doi:10.4049/иммунол.169.8.4496. [PubMed] [CrossRef] [Google Scholar]76. Heczko U, Abe A, Finlay BB.
2000.
Сегментообразующие нитчатые бактерии предотвращают колонизацию энтеропатогенной кишечной палочки О103 у кроликов.J заразить Dis
181: 1027–1033. дои: 10.1086/315348. [PubMed] [CrossRef] [Google Scholar]77. Ли Ю.К., Менезес Дж.С., Умесаки Ю., Мазманян С.К.
2011.
Провоспалительные Т-клеточные ответы на микробиоту кишечника способствуют развитию экспериментального аутоиммунного энцефаломиелита. Proc Natl Acad Sci U S A
108 (прил.): 4615–4622. doi:10.1073/pnas.1000082107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]78. Чейз Д.Г., Эрландсен С.Л.
1976 год.
Доказательства сложного жизненного цикла и образования эндоспор у прикрепленной нитевидной сегментированной бактерии из подвздошной кишки мыши.J Бактериол
127: 572–583. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Кувахара Т., Огура Й., Осима К., Курокава К., Оока Т., Хиракава Х., Ито Т.
Дж Иммунол
169:4496–4503. doi:10.4049/иммунол.169.8.4496. [PubMed] [CrossRef] [Google Scholar]76. Heczko U, Abe A, Finlay BB.
2000.
Сегментообразующие нитчатые бактерии предотвращают колонизацию энтеропатогенной кишечной палочки О103 у кроликов.J заразить Dis
181: 1027–1033. дои: 10.1086/315348. [PubMed] [CrossRef] [Google Scholar]77. Ли Ю.К., Менезес Дж.С., Умесаки Ю., Мазманян С.К.
2011.
Провоспалительные Т-клеточные ответы на микробиоту кишечника способствуют развитию экспериментального аутоиммунного энцефаломиелита. Proc Natl Acad Sci U S A
108 (прил.): 4615–4622. doi:10.1073/pnas.1000082107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]78. Чейз Д.Г., Эрландсен С.Л.
1976 год.
Доказательства сложного жизненного цикла и образования эндоспор у прикрепленной нитевидной сегментированной бактерии из подвздошной кишки мыши.J Бактериол
127: 572–583. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Кувахара Т., Огура Й., Осима К., Курокава К., Оока Т., Хиракава Х., Ито Т. , Накаяма-Имаоджи Х., Ичимура М., Ито К., Исифуне С., Маэкава Й., Ясутомо К., Хаттори М., Хаяси Т.
2011.
Образ жизни сегментированной нитчатой бактерии: некультивируемый кишечно-ассоциированный иммуностимулирующий микроб, выведенный секвенированием всего генома. ДНК Res
18: 291–303. doi:10.1093/dnares/dsr022. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]80.Иванов И.И., Атараши К., Манел Н., Броди Э.Л., Сима Т., Караоз Ю., Вэй Д., Гольдфарб К.С., Санти К.А., Линч С.В., Таноуэ Т., Имаока А., Ито К., Такеда К., Умесаки Ю., Хонда К., Литтман Д.Р. .
2009.
Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями. Клетка
139: 485–498. doi:10.1016/j.cell.2009.09.033. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]81. Казелли М., Холтон Дж., Болдрини П., Вайра Д., Кало Г.
2010.
Морфология сегментированных нитчатых бактерий и характер их контакта с ассоциированным с фолликулами эпителием терминального отдела подвздошной кишки мыши: значение для связи с иммунной системой.
, Накаяма-Имаоджи Х., Ичимура М., Ито К., Исифуне С., Маэкава Й., Ясутомо К., Хаттори М., Хаяси Т.
2011.
Образ жизни сегментированной нитчатой бактерии: некультивируемый кишечно-ассоциированный иммуностимулирующий микроб, выведенный секвенированием всего генома. ДНК Res
18: 291–303. doi:10.1093/dnares/dsr022. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]80.Иванов И.И., Атараши К., Манел Н., Броди Э.Л., Сима Т., Караоз Ю., Вэй Д., Гольдфарб К.С., Санти К.А., Линч С.В., Таноуэ Т., Имаока А., Ито К., Такеда К., Умесаки Ю., Хонда К., Литтман Д.Р. .
2009.
Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями. Клетка
139: 485–498. doi:10.1016/j.cell.2009.09.033. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]81. Казелли М., Холтон Дж., Болдрини П., Вайра Д., Кало Г.
2010.
Морфология сегментированных нитчатых бактерий и характер их контакта с ассоциированным с фолликулами эпителием терминального отдела подвздошной кишки мыши: значение для связи с иммунной системой.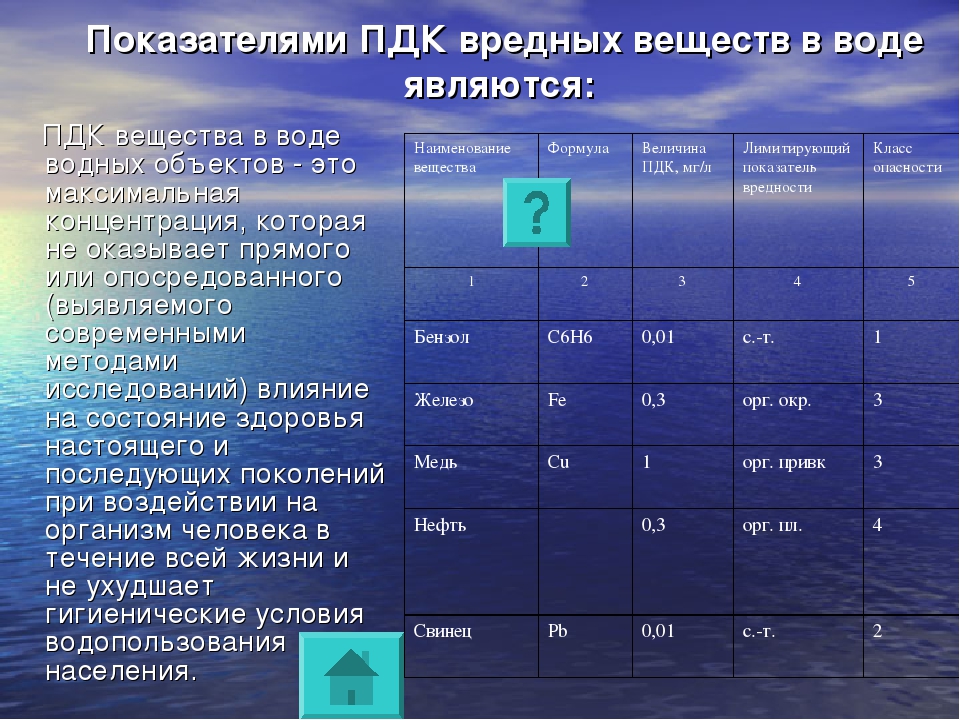 Кишечные микробы
1: 367–372. doi:10.4161/gmic.1.6.14390. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]82. Кригель М.А., Сефик Э., Хилл Дж.А., Ву Х.Дж., Бенуа С., Матис Д.
2011.
Сегрегация сегментированных нитчатых бактерий, передаваемых естественным путем, с защитой от диабета у мышей с диабетом без ожирения. Proc Natl Acad Sci U S A
108:11548–11553. doi:10.1073/pnas.11088. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]83. Берджесс С.Л., Буономо Э., Кэри М., Ковардин С., Нейлор С., Нур З., Уиллс-Карп М., Петри В.А.2014.
Дендритные клетки костного мозга мышей с измененной микробиотой обеспечивают зависимую от интерлейкина 17А защиту от колита Entamoeba histolytica. mBio
5:e01817-14. doi: 10.1128/mBio.01817-14. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]85. Доновиц Дж. Р., Алам М., Кабир М., Ма Дж. З., Назиб Ф., Платтс-Миллс Дж. А., Бартелт Л. А., Хак Р., Петри В. А.
2016.
Предполагаемая продольная когорта для изучения влияния лямблиоза в раннем возрасте на рост и всех причин диареи.
Кишечные микробы
1: 367–372. doi:10.4161/gmic.1.6.14390. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]82. Кригель М.А., Сефик Э., Хилл Дж.А., Ву Х.Дж., Бенуа С., Матис Д.
2011.
Сегрегация сегментированных нитчатых бактерий, передаваемых естественным путем, с защитой от диабета у мышей с диабетом без ожирения. Proc Natl Acad Sci U S A
108:11548–11553. doi:10.1073/pnas.11088. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]83. Берджесс С.Л., Буономо Э., Кэри М., Ковардин С., Нейлор С., Нур З., Уиллс-Карп М., Петри В.А.2014.
Дендритные клетки костного мозга мышей с измененной микробиотой обеспечивают зависимую от интерлейкина 17А защиту от колита Entamoeba histolytica. mBio
5:e01817-14. doi: 10.1128/mBio.01817-14. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]85. Доновиц Дж. Р., Алам М., Кабир М., Ма Дж. З., Назиб Ф., Платтс-Миллс Дж. А., Бартелт Л. А., Хак Р., Петри В. А.
2016.
Предполагаемая продольная когорта для изучения влияния лямблиоза в раннем возрасте на рост и всех причин диареи. Клин заразить Dis
63: 792–797.doi:10.1093/cid/ciw391. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]86. Венсаас К.А., Лангеланд Н., Ханевик К., Мёрх К., Эйде Г.Е., Рортвейт Г.
2012.
Синдром раздраженного кишечника и хроническая усталость через 3 года после острого лямблиоза: историческое когортное исследование. кишки
61:214–219. doi:10.1136/gutjnl-2011-300220. [PubMed] [CrossRef] [Google Scholar]87. Ханевик К., Венсаас К.А., Рортвейт Г., Эйде Г.Е., Мёрх К., Лангеланд Н.
2014.
Синдром раздраженного кишечника и хроническая усталость через 6 лет после инфицирования Giardia: контролируемое проспективное когортное исследование.Клин заразить Dis
59:1394–1400. doi:10.1093/cid/ciu629. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]88. Мухсен К., Коэн Д., Левин М.М.
2014.
Может ли инфекция Giardia lamblia снизить риск острой диареи у детей дошкольного возраста?
Джей Троп Педиатр
60:99–103. дои: 10.1093/тропей/FMT085. [PubMed] [CrossRef] [Google Scholar]89. Винеманс Дж.
Клин заразить Dis
63: 792–797.doi:10.1093/cid/ciw391. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]86. Венсаас К.А., Лангеланд Н., Ханевик К., Мёрх К., Эйде Г.Е., Рортвейт Г.
2012.
Синдром раздраженного кишечника и хроническая усталость через 3 года после острого лямблиоза: историческое когортное исследование. кишки
61:214–219. doi:10.1136/gutjnl-2011-300220. [PubMed] [CrossRef] [Google Scholar]87. Ханевик К., Венсаас К.А., Рортвейт Г., Эйде Г.Е., Мёрх К., Лангеланд Н.
2014.
Синдром раздраженного кишечника и хроническая усталость через 6 лет после инфицирования Giardia: контролируемое проспективное когортное исследование.Клин заразить Dis
59:1394–1400. doi:10.1093/cid/ciu629. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]88. Мухсен К., Коэн Д., Левин М.М.
2014.
Может ли инфекция Giardia lamblia снизить риск острой диареи у детей дошкольного возраста?
Джей Троп Педиатр
60:99–103. дои: 10.1093/тропей/FMT085. [PubMed] [CrossRef] [Google Scholar]89. Винеманс Дж. , Манк Т., Оттенхоф М., Байджо А., Мбуги Э.В., Демир А.Ю., Вилдерс Дж.П.М., Савелкоул Х.Ф.Дж., Верхуф Х.
2011.
Защита от диареи, связанной с кишечной лямблией, теряется при приеме мультинутриентных добавок: исследование на танзанийских детях.PLoS Negl Trop Dis
5:e1158. doi:10.1371/journal.pntd.0001158. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]90. Ховитт М.Р., Лавуа С., Мишо М., Блюм А.М., Тран С.В., Вайншток Дж.В., Галлини К.А., Реддинг К., Маргольски Р.Ф., Осборн Л.С., Артис Д., Гарретт В.С.
2016.
Клетки пучка, вкусовые хемосенсорные клетки, организуют паразитарный иммунитет 2 типа в кишечнике. Наука
351: 1329–1333. doi:10.1126/science.aaf1648. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]91. Чудновский А., Морта А., Кана В., Кеннард А., Рамирес Д.Д., Рахман А., Ремарк Р., Могно И., Нг Р., Гнятич С., Амир Э.Д., Соловьев А., Гринбаум Б., Клементе Дж., Фейт Дж., Белкаид Ю., Григг М.Е. , Мерад М.2016.
Взаимодействия между хозяином и простейшими защищают от инфекций слизистых за счет активации инфламмасомы.
, Манк Т., Оттенхоф М., Байджо А., Мбуги Э.В., Демир А.Ю., Вилдерс Дж.П.М., Савелкоул Х.Ф.Дж., Верхуф Х.
2011.
Защита от диареи, связанной с кишечной лямблией, теряется при приеме мультинутриентных добавок: исследование на танзанийских детях.PLoS Negl Trop Dis
5:e1158. doi:10.1371/journal.pntd.0001158. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]90. Ховитт М.Р., Лавуа С., Мишо М., Блюм А.М., Тран С.В., Вайншток Дж.В., Галлини К.А., Реддинг К., Маргольски Р.Ф., Осборн Л.С., Артис Д., Гарретт В.С.
2016.
Клетки пучка, вкусовые хемосенсорные клетки, организуют паразитарный иммунитет 2 типа в кишечнике. Наука
351: 1329–1333. doi:10.1126/science.aaf1648. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]91. Чудновский А., Морта А., Кана В., Кеннард А., Рамирес Д.Д., Рахман А., Ремарк Р., Могно И., Нг Р., Гнятич С., Амир Э.Д., Соловьев А., Гринбаум Б., Клементе Дж., Фейт Дж., Белкаид Ю., Григг М.Е. , Мерад М.2016.
Взаимодействия между хозяином и простейшими защищают от инфекций слизистых за счет активации инфламмасомы. Клетка
167:444e.14–456.e14. doi:10.1016/j.cell.2016.08.076. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]92. Эскаланте Н.К., Лемир П., Круз Тлеугабулова М., Прескотт Д., Морта А., Стройкер С.Дж., Жирарден С.Е., Филпотт Д.Дж., Маллевей Т.
2016.
Обычные мышиные простейшие Tritrichomonas muris изменяют гомеостаз Т-клеток слизистой оболочки и восприимчивость к колитам. J Эксперт Мед
213:2841–2850. дои: 10.1084 / джем.20161776. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]93. Хуфельдт М.Р., Нильсен Д.С., Вогенсен Ф.К., Мидтведт Т., Хансен А.К.
2010.
Изменение микробиоты кишечника лабораторных мышей связано как с генетическими факторами, так и с факторами окружающей среды. Комп Мед
60:336–347. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клетка
167:444e.14–456.e14. doi:10.1016/j.cell.2016.08.076. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]92. Эскаланте Н.К., Лемир П., Круз Тлеугабулова М., Прескотт Д., Морта А., Стройкер С.Дж., Жирарден С.Е., Филпотт Д.Дж., Маллевей Т.
2016.
Обычные мышиные простейшие Tritrichomonas muris изменяют гомеостаз Т-клеток слизистой оболочки и восприимчивость к колитам. J Эксперт Мед
213:2841–2850. дои: 10.1084 / джем.20161776. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]93. Хуфельдт М.Р., Нильсен Д.С., Вогенсен Ф.К., Мидтведт Т., Хансен А.К.
2010.
Изменение микробиоты кишечника лабораторных мышей связано как с генетическими факторами, так и с факторами окружающей среды. Комп Мед
60:336–347. [Бесплатная статья PMC] [PubMed] [Google Scholar]CDC — Parasites — About Parasites
Паразит – это организм, который живет в организме хозяина или в нем и получает пищу от хозяина или за его счет.Существует три основных класса паразитов, которые могут вызывать заболевания у человека: простейшие, гельминты и эктопаразиты.
Entamoeba histolytica является простейшим. Для просмотра этого паразита необходим микроскоп. Кредит: CDC.
Простейшие — это микроскопические одноклеточные организмы, которые могут быть свободноживущими или паразитическими по своей природе. Они способны размножаться в организме человека, что способствует их выживанию, а также позволяет серьезным инфекциям развиваться только из одного организма.Передача простейших, живущих в кишечнике человека, другому человеку обычно происходит фекально-оральным путем (например, через зараженную пищу или воду или при контакте между людьми). Простейшие, живущие в крови или тканях человека, передаются другим людям членистоногим-переносчиком (например, через укус комара или москита).
Простейшие, заразные для человека, можно разделить на четыре группы в зависимости от способа их передвижения:
Взрослый Ascaris lumbriocoides червь.Они могут быть от 15 до 35 см.
Кредит: CDC.
Гельминты — это крупные многоклеточные организмы, которые обычно видны невооруженным глазом во взрослом состоянии. Как и простейшие, гельминты могут быть как свободноживущими, так и паразитическими по своей природе. Во взрослой форме гельминты не могут размножаться в организме человека. Существует три основные группы гельминтов (от греческого слова «черви»), которые являются паразитами человека:
- Плоские черви (плоские черви) – к ним относятся трематоды (трематоды) и цестоды (ленточные черви).
- Колючие черви (акантоцефалины) – взрослые формы этих червей обитают в желудочно-кишечном тракте. Считается, что скребни занимают промежуточное положение между цестодами и нематодами.
- Круглые черви (нематоды) – взрослые формы этих червей могут обитать в желудочно-кишечном тракте, крови, лимфатической системе или подкожных тканях. В качестве альтернативы, незрелые (личиночные) состояния могут вызывать заболевание путем заражения ими различных тканей организма.
 Некоторые считают, что к гельминтам относятся также сегментированные черви (кольчатые черви) — единственными важными с медицинской точки зрения являются пиявки.Следует отметить, что эти организмы обычно не считаются паразитами.
Некоторые считают, что к гельминтам относятся также сегментированные черви (кольчатые черви) — единственными важными с медицинской точки зрения являются пиявки.Следует отметить, что эти организмы обычно не считаются паразитами.
Взрослая вошь. Фактический размер примерно такой же большой, как кунжутное семя.
Кредит: CDC.
Хотя термин эктопаразиты может в широком смысле включать кровососущих членистоногих, таких как комары (поскольку их выживание зависит от крови человека-хозяина), этот термин обычно используется в более узком смысле для обозначения таких организмов, как клещи, блохи, вши и клещи, которые прикрепляются к коже или внедряются в нее и остаются там в течение относительно длительного периода времени (например,г., от недель до месяцев). Членистоногие играют важную роль в возникновении болезней сами по себе, но еще более важны они как переносчики или передатчики многих различных патогенов, которые, в свою очередь, вызывают огромную заболеваемость и смертность от болезней, которые они вызывают.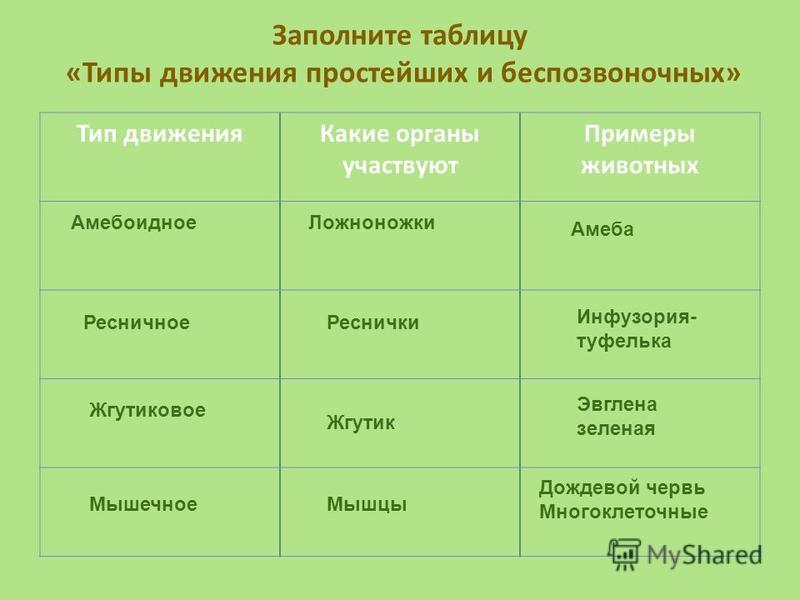
Паразитарные инфекции вызывают огромное бремя болезней как в тропиках, так и в субтропиках, а также в более умеренном климате. Из всех паразитарных заболеваний малярия вызывает наибольшее количество смертей во всем мире.Малярия ежегодно убивает более 400 000 человек, большинство из которых — маленькие дети в странах Африки к югу от Сахары.
Забытые тропические болезни (ЗТБ), которым не уделялось должного внимания со стороны общественного здравоохранения, включают паразитарные заболевания, такие как лимфатический филяриатоз, онхоцеркоз и дракункулез. ЗТБ поражают более 1 миллиарда человек во всем мире, в основном в сельских районах стран с низким уровнем дохода. Эти заболевания ложатся тяжелым бременем на эндемичное население, включая потерю способности посещать школу или работать, задержку роста у детей, нарушение когнитивных навыков и развития у детей раннего возраста, а также серьезное экономическое бремя, ложащееся на целые страны.
Однако паразитарные инфекции поражают и лиц, проживающих в развитых странах, включая США.
Наверх
Простейшие | Что такое микробиология?
Простейшие — одноклеточные организмы. Они бывают самых разных форм и размеров, начиная от Amoeba , которая может менять свою форму, до Paramecium с фиксированной формой и сложной структурой. Они живут в самых разнообразных влажных средах обитания, включая пресную воду, морскую среду и почву.
Некоторые из них являются паразитами, что означает, что они живут в других растениях и животных, включая человека, где они вызывают болезни. Например, Plasmodium, , вызывает малярию. Они подвижны и могут передвигаться:
- Реснички — крошечные волосовидные структуры, покрывающие микроб снаружи. Они бьются в регулярном непрерывном ритме, как гибкие весла.
- Жгутики — длинные нитевидные структуры, отходящие от поверхности клетки.
 Жгутики двигаются подобно хлысту, создавая волны, которые раскручивают микроб.
Жгутики двигаются подобно хлысту, создавая волны, которые раскручивают микроб. - Амебоидное движение — организм перемещается, выпуская псевдоподии, временные выпячивания, которые заполняются цитоплазмой, вытекающей из тела клетки.
О мышах и людях: миллиарды стали жертвами контроля над разумом токсоплазмы?
Toxoplasma gondii тихо обитает в мозгах миллиардов людей во всем мире.В течение долгого времени заражение T. gondii считалось безвредным, но недавние данные свидетельствуют о том, что он модулирует уровни нейротрансмиттеров, изменяя личность и поведение, чтобы увеличить вероятность дальнейшей передачи.

Брифинг по политике борьбы с малярией
Малярия — инфекционное заболевание, вызываемое одноклеточным паразитическим организмом Plasmodium , поражающим кровь и печень.
Друзья с выгодой или эксплуатация?
Эндосимбиозы, когда один вид живет внутри другого, встречаются во всей микробиологии. Например, зооксантеллы — это простейшие, живущие внутри кораллов, морских беспозвоночных, которые строят коралловые рифы.
Древний остаток внутри малярийного паразита
Малярия вызывается простейшими паразитами рода Plasmodium .Эти паразиты передаются через укусы комаров, и известно, что несколько различных видов заражают людей. Но загляните внутрь самой клетки Plasmodium , и вы обнаружите кое-что довольно неожиданное — клеточную структуру, удивительно похожую на хлоропласт.
Простейшие при патологии органов дыхания: обзор
В таблице 1⇓ показаны различные типы простейших, которые могут вызывать патологию органов дыхания. Предпочтительный путь и продолжительность терапии для каждого микроорганизма приведены в таблице 2⇓.
Предпочтительный путь и продолжительность терапии для каждого микроорганизма приведены в таблице 2⇓.
Тип Саркомастигофора
Этот тип включает подтипы Sarcodina (амебы) и Mastigophora (жгутиковые).
Общая характеристика подтипа Sarcodina состоит в том, что он представляет собой подвижные непостоянные по форме трофозоиты в виде ложноножек, хотя некоторые из них могут иметь временные жгутики. Однако у подтипа Mastigophora трофозоиты постоянны по форме и имеют один или два жгутика, иногда связанные с другими органеллами, как в основании, так и в виде ундулирующих мембран.
Род Entamoeba
В пределах этого рода единственным видом, традиционно считающимся патогенным для человека, который является его основным хозяином и резервуаром, является Entamoeba histolytica . Этот простейший распространен по всему миру, хотя чаще встречается в странах с плохими санитарными условиями. Недоедание, пожилой возраст, беременность, состояния подавления иммунитета, алкоголизм и определенные сексуальные практики являются факторами риска, способствующими его развитию. В данном контексте посещение эндемичных районов (Африка, Азия и Центральная Америка) и иммиграция являются двумя дополнительными факторами, которые следует принимать во внимание.
В данном контексте посещение эндемичных районов (Африка, Азия и Центральная Америка) и иммиграция являются двумя дополнительными факторами, которые следует принимать во внимание.
Это возбудитель, ответственный за такие клинические ситуации, как диарея путешественников, амебная диарея и амебная дизентерия, все из которых являются последствиями инфекции толстой кишки, а также за внекишечные амебиазы, вызванные трофозоитами (рис. 1⇓), присоединившимися к кровеносных сосудов, а затем переносятся кровотоком в различные органы, такие как печень, легкие, мозг, сердце, кожа, и т. д. .
Рис. 1—Entamoeba histolytica : два трофозоита во влажном препарате, окрашенном фекалиями йодом. Масштабная линейка = 15 мкм.
Плевропульмональная инфекция, вызываемая E. histolytica , является после инфекции печени наиболее частой формой внекишечного амебиаза и возникает в большинстве случаев как осложнение печеночного абсцесса (рис. 2а⇓ и б) вследствие образования свищей 6 –8, при этом наиболее часто поражается нижняя долька правого легкого. Однако гематогенный путь также описан как причина легочных поражений, вызванных E.histolytica 9, 10.
Однако гематогенный путь также описан как причина легочных поражений, вызванных E.histolytica 9, 10.
Амебный абсцесс печени. а) Эхографическое изображение, показывающее множественные полости. б) Компьютерная томография показывает, что поражение расположено в верхней части правой печеночной дольки, очень близко к куполу диафрагмы.
Клиническая картина во многом зависит от сопутствующей легочной патологии, частыми симптомами которой являются лихорадка, кашель, кровохарканье и плевритная боль 11, 12. Иногда абсцесс печени может провоцировать венозную компрессию и быть причиной дыхательной недостаточности и изменений артериальной газометрии 13 .Появление гнойной жидкости шоколадообразного вида (часто описываемой как паста из анчоусов) после прокола абсцесса, выделений или рвоты является весьма наводящим на размышления признаком 14.
Рентгенологические признаки разнообразны: от тонких базальных ретикулярных структур с фокальными участками ателектазов до обширных инфильтратов. Подъем правой диафрагмы (рис. 3⇓), гепатобронхиальный свищ, абсцесс легкого, плевральный выпот или отделяемое и бронхоплевральный свищ с пиопневмотораксом — другие описанные поражения [15–17].
Подъем правой диафрагмы (рис. 3⇓), гепатобронхиальный свищ, абсцесс легкого, плевральный выпот или отделяемое и бронхоплевральный свищ с пиопневмотораксом — другие описанные поражения [15–17].
Грудной амебиаз. На рентгенограмме грудной клетки видно возвышение правого купола диафрагмы и обширные инфильтраты.
Такие процедуры, как цитология мокроты или тонкоигольная пункционная аспирация, доказали свою полезность в диагностике поражений легких, при которых диагноз легочного амебиаза изначально не подозревался 18, 19. Более того, в случаях легочного амебиаза без данных, указывающих на кишечный и/ или печеночные последствия, которые необходимо отличать от других процессов, таких как бактериальные абсцессы, новообразования, эмпиема и туберкулез 20, сочетание визуализации трофозоитов посредством цитологического исследования мокроты с методами выделения ДНК оказалось очень полезным 21.Важно отметить, что в образцах мокроты может появиться непатогенный вид Entamoeba gingivalis , который присутствует в полости рта 22 и может быть перепутан с E.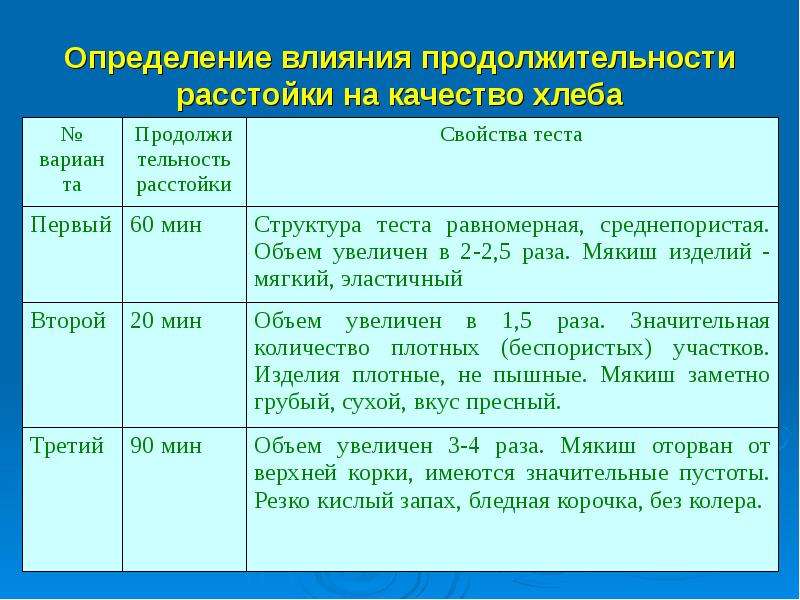 histolytica 23, 24. Дополнительные лабораторные тесты, такие как как серологическое определение антител, также помогают установить окончательный диагноз.
histolytica 23, 24. Дополнительные лабораторные тесты, такие как как серологическое определение антител, также помогают установить окончательный диагноз.
Роды Acanthamoeba и Balamuthia
Ряд простейших, повсеместно присутствующих в природе (они могут быть выделены из земли, воздуха и воды) и которые могут быть патогенными для человека независимо от того, является ли их состояние нормальным или иммуносупрессивным, были сгруппированы под наименованием «свободноживущие амебы» 25 .Знание этих простейших важно по двум причинам: с одной стороны, они вызывают патологии в различных органах (головной мозг, роговица, кожа, легкие, и т. д. .), а с другой стороны, они могут содержать и передавать патогенные бактерии 26– 29, некоторые из которых, такие как Legionella pneumophilia 30, 31, микобактерии 32, 33, Chlamydia pneumoniae 34 и Francisella tularensis 35, имеют важные последствия для дыхательной системы. Этот последний фактор может иметь клиническое значение, поскольку ряд микроорганизмов, связанных с амебами, упоминается как агенты, вызывающие нозокомиальную пневмонию 36.
Этот последний фактор может иметь клиническое значение, поскольку ряд микроорганизмов, связанных с амебами, упоминается как агенты, вызывающие нозокомиальную пневмонию 36.
Из известных в настоящее время родов только четыре связаны с патологией человека: Acanthamoeba, Balamuthia, Naegleria и Sappinia. Исследования, проведенные на экспериментальных животных, показали, что некоторые виды, такие как Naegleria fowleri , Acanthamoeba castellanii и Acanthamoeba polyphaga , могут вызывать прямое поражение легочной паренхимы в виде пневмонита, с утолщением альвеолярных стенок, мононуклеарной воспалительный инфильтрат и развитие гиалиновых мембран в альвеолярных пространствах 37–40.В случае человека только Acanthamoeba spp. и Balamuthia mandrillaris были связаны с легочной патологией 41–43.
Пневмонит — наиболее частое поражение с наличием кистозных форм и трофозоитов в альвеолярных пространствах. Рентгенологическое исследование выявляет диффузные участки альвеолярной консолидации. Идентификация трофозоитов в образцах бронхоальвеолярного лаважа и их последующее культивирование помогают установить диагноз [44, 45].и Acanthamoeba spp.) был описан 46.
Идентификация трофозоитов в образцах бронхоальвеолярного лаважа и их последующее культивирование помогают установить диагноз [44, 45].и Acanthamoeba spp.) был описан 46.
Роды Trichomonas, Tritrichomonas и Tetratrichomonas
Проанализированная литература показывает, что три вида трихомонад, патогенных для человека ( Trichomonas vaginalis , T. tenax и T. hominis ), участвуют в инфекционных процессах, поражающих дыхательный аппарат.
Легочная инфекция, вызванная T. vaginalis (рис.4⇓) может появиться у новорожденных 47, 48, у взрослых с подавленным иммунитетом 49, 50 и у пациентов с острым респираторным дистресс-синдромом 51, 52. 53, 54. Осложнения могут быть немедленными в виде затруднения дыхания 55 или отдаленными 56. Выявление наличия подвижных форм микроорганизма в секретах дыхательных путей и последующее их культивирование на соответствующей среде, процедуры, используемые в диагностике.
Trichomonas vaginalis : два трофозоита, окрашенных по Гимзе. Масштабная линейка = 15 мкм.
Что касается T. tenax , присутствующего в полости рта и часто обнаруживаемого в зубном налете, то этот вид наиболее часто описывается в проанализированной литературе. Появление этого микроорганизма является наиболее частой причиной развития легочной патологии 57; факторами, предрасполагающими к его развитию, являются плохая гигиена полости рта, неправильное питание, алкоголизм и предшествующие истощающие или легочные заболевания (карцинома, абсцесс, бронхоэктазы, и т. д. .) 58, 59. В этих случаях плевральные выделения являются наиболее частым осложнением 60–63, а в свежих препаратах полученных жидкостей наблюдают наличие подвижных форм. Окрашивание по Гимзе также весьма полезно. В других образцах, таких как бронхоальвеолярный лаваж, его присутствие вместе с многочисленными эозинофилами было описано у пациента с астмой в анамнезе 64. Идентификация вида возможна с использованием методов молекулярной биологии 65, 66.
Идентификация вида возможна с использованием методов молекулярной биологии 65, 66.
T. hominis , также известный как Pentratrichomonas hominis , реже всего упоминается в литературе 67, 68.Поскольку это микроорганизм, находящийся в кишечнике, предполагается, что он может попасть в органы дыхания путем аспирации или через бронхоэнтеральный свищ. Описаны патологические состояния: некротизирующий абсцесс легкого и плевральный выпот.
В родах Tritrichomonas и Tetratrichomonas имеется множество видов, которые могут быть патогенны для различных животных (овцы, свиньи, кошки, и др. ). Из них Tritrichomonas fetus и Tetratrichomonas gallinarum являются двумя наиболее репрезентативными.Недавно было высказано предположение, что некоторые из этих видов, происходящих от животных, могли адаптироваться к человеку. Доказательством этого являются два исследования, которые с помощью биологических тестов продемонстрировали генетические последовательности этих простейших в образцах дыхательного аппарата человека 69, 70. Эти открытия были признаны открытием важной новой области исследований 3.
Эти открытия были признаны открытием важной новой области исследований 3.
Род Lophomonas
Простейшие, принадлежащие к этому роду, встречаются в качестве симбионтов в кишечнике некоторых членистоногих, таких как термиты и тараканы, и участвуют в процессе переваривания некоторых материалов, таких как целлюлоза.
В опубликованной литературе упоминаются два исследования из Китая, в которых простейшие отряда Hypermastigida связаны с легочной патологией, отвечающей на терапию метронидазолом 71, 72. трансплантат, у которого развилась легочная патология; во всех этих случаях также был продемонстрирован терапевтический эффект метронидазола 73.
Формы Protozoa, еще не каталогизированные, но которые по своим морфологическим характеристикам и характеристикам окраски предположительно относятся к жгутиковым простейшим (рис.5a⇓ и b), были описаны в мокроте больных астмой 74, выделениях из носа больных аллергическим ринитом 75 и мокроте больных с ослабленным иммунитетом, особенно больных СПИДом 76, 77.
Многожгутиковые простейшие в мазках мокроты от больных СПИДом (окраска по Папаниколау). Масштабные полосы = 20 мкм.
Поразительным фактом является обнаружение сходных жгутиковых простейших в кишечных экстрактах пылевых клещей и тараканов, что указывает на возможную связь между этими микроорганизмами и респираторной аллергией 78–80.
Род Leishmania
Этот род включает большое количество видов, среди которых следует отметить L. donovani , L. tropica , L. major и L. infantum (присутствует в Средиземноморском бассейне), с интегрированным биологическим циклом. внеклеточной формой или промастиготой в кишечном тракте флеботомов (мелких насекомых, похожих на комаров), и внутриклеточной формой или амастиготой, поражающей в основном клетки ретикулоэндотелиальной системы.Лейшманиоз является эндемичным в регионах Азии, Африки, Центральной и Южной Америки и Средиземноморья в Европе 81.
Различают три формы лейшманиоза: кожный, кожно-слизистый и висцеральный (кала-азар). Многие из форм, поражающих внутренние органы (легкие, гортань, желудочно-кишечный тракт, и т.д. .), считаются оппортунистическими инфекциями при СПИДе 82, 83.
В экспериментальных моделях на животных легочное поражение, вызванное Leishmania spp.характеризуется хроническим диффузным интерстициальным пневмонитом с утолщением альвеолярных перегородок за счет отложения коллагена и клеточного экссудата, образованного преимущественно макрофагами, лимфоцитами и плазматическими клетками 84. Аналогичная легочная патология с очагами септального фиброза и интерстициальным пневмонитом с преобладанием мононуклеарные клетки были также описаны у людей 85. Другими формами, в которых проявляется заболевание, являются гранулематозное воспаление слизистой оболочки бронхов и медиастинальных лимфатических узлов 86 и развитие плеврального выпота с присутствием внутриклеточных простейших в макрофагах 87, 88. В других типах образцов дыхательного аппарата, таких как трансбронхиальная биопсия 89 и бронхоальвеолярный лаваж 90, 91, также было обнаружено присутствие Leishmania amastigotes.
В других типах образцов дыхательного аппарата, таких как трансбронхиальная биопсия 89 и бронхоальвеолярный лаваж 90, 91, также было обнаружено присутствие Leishmania amastigotes.
Инфицирование слизистой оболочки гортани является еще одним осложнением лейшманиоза. Эта инфекция часто встречается у больных СПИДом 92, 93, хотя случаи были описаны и у иммунокомпетентных пациентов 94. В этих последних случаях была предложена дифференциальная диагностика относительно неопластических процессов 95; Помимо гистологических данных, демонстрация специфических последовательностей ДНК в пораженных тканях с помощью методов молекулярной биологии также очень полезна 96.
Непосредственное наблюдение за паразитом (рис. 6⇓) является одним из лучших методов диагностики и, в случае висцерального лейшманиоза, обычно проводится в аспиратах костного мозга с помощью гематологического окрашивания. В настоящее время методы молекулярной биологии являются альтернативой, которую также следует учитывать.
Leishmania infantum : Окрашенные по Гимзе амастиготы в мазке из костного мозга. Масштабная линейка = 7 мкм.
Использование таких препаратов, как производные пятивалентной сурьмы, является одним из методов лечения лейшманиоза, хотя другие вещества, такие как паромомицин и липосомальный амфотерицин В, являются эффективными альтернативами 97.
Род Trypanosoma
Род Trypanosoma включает различные виды геможгутиковых простейших, передающихся человеку через укусы мух и клопов. Их названия отражают регион планеты, в котором они обитают: T. brucei rhodesiense и T. brucei gambiense (Африка), ответственные за сонную болезнь или африканский трипаносомоз; и T. ( Schizotrypanum ) cruzi (Южная Америка), ответственный за болезнь Шагаса или американский трипаносомоз.Именно последний может поражать дыхательный аппарат либо в таких органах, как сердце и пищевод 98, либо при беременности через плаценту (врожденная форма заболевания).
В широкомасштабном исследовании посмертных случаев случаев как миокардит, так и мегаэзофагус были причиной ряда легочных осложнений, таких как плевральный выпот, тромбоэмболия, аспирационная пневмония, абсцесс легкого, бронхоэктазы и туберкулез 99.
На экспериментальных животных было продемонстрировано, что паразитемия, вызванная T.cruzi является причиной пневмонита 100 с изменениями легочной паренхимы, такими как утолщение альвеолярных стенок из-за пролиферации пневмоцитов II типа, макрофагов и мононуклеарной воспалительной инфильтрации с отеком. Альвеолярные пространства содержат жидкость, фибрин, гиалиновые мембраны и эритроциты. В стенках бронхов отмечено присутствие микроорганизмов, сопровождающееся воспалительной реакцией. В стенках крупных сосудов также появлялись микроорганизмы.
При врожденной форме заболевания наиболее частым поражением является пневмонит с наличием амастигот в легких, плацентарных оболочках и пуповине 101.
Во время острой фазы болезни Шагаса в периферической крови появляются многочисленные паразиты, которые могут быть обнаружены прямыми паразитологическими тестами. Микроскопическое исследование свежей крови может легко выявить наличие паразита благодаря его подвижности.
Мазки крови в тонких пленках и толстых каплях, окрашенные соответствующим образом, позволяют наблюдать типичные морфологические признаки паразита (рис.7⇓). Если степень паразитемии низкая, жизненно важно использовать методы концентрации, такие как микрогематокрит. Ксенодиагностика (визуализация паразита в фекалиях переносчика) и гемокультивация являются признанными непрямыми методами, чувствительность которых зависит от степени паразитемии больного. Кроме того, широко используются серологические и молекулярные методы.
Рис. 7—Trypanosoma brucei gambiense : Трипоматиготы, окрашенные по Гимзе, в тонком мазке крови.Масштабная линейка = 14 мкм.
Нифуртимокс, производное нитрофурана, и бензнидазол (нитроимидазол) являются практически единственными лекарствами, используемыми для лечения болезни Шагаса.
Тип Apicomplexa (споровые)
Эти простейшие являются внутриклеточными паразитами с одной исключительной характеристикой, наличием так называемого «апикального комплекса», внутрицитоплазматической структуры, связанной с адгезией и инвазией клеток-хозяев. Различные роды этого типа могут воздействовать на дыхательный аппарат.
Род Cyclospora
Из различных видов этого рода только Cyclospora cayetanensis является патогенным для человека; микроорганизм приобретается при проглатывании спорулированных ооцист с зараженной пищей и водой 102. У иммунокомпетентных лиц, в зависимости от их иммунного статуса, инфекция может протекать бессимптомно или провоцировать самокупирующийся эпизод диареи (случаи часто возникают после посещения тропических стран). ).У пациентов с иммунодепрессией, особенно при СПИДе, кишечный эпизод протекает более серьезно и имеет тенденцию становиться хроническим.
Хотя влияние Cyclospora на дыхательный аппарат до сих пор не выявлено, было зарегистрировано два случая присутствия в мокроте ооцист, соответствующих виду C. cayetanensis , с сопутствующей туберкулезной инфекцией в обоих случаях 103, 104
cayetanensis , с сопутствующей туберкулезной инфекцией в обоих случаях 103, 104
Микроскопическая идентификация ооцист Cyclospora (округлые структуры диаметром 7–10 мкм с видимой стенкой) может проводиться как в свежих образцах, так и с использованием специальных методов окраски (трихромная, модифицированная по Цилю–Нильсену, сафранин, калькофлуор белый, и др. .). Существуют также методы обнаружения, основанные на методе ПЦР. Терапией выбора является комбинация триметоприма и сульфаметоксазола.
Род Cryptosporidium
Род Cryptosporidium включает 13 видов внутриклеточных кишечных простейших, широко распространенных у животных, особенно у птиц, крупного рогатого скота и овец. У человека чаще всего обнаруживаются виды C. parvum , C. hominis и C. meleagridis 105.Заражение происходит при проглатывании ооцист (рис. 8⇓) через воду и пищу, загрязненную фекалиями, при контакте с животными или от человека к человеку.
Cryptosporidium sp. ооцисты (указатель стрелки) и ооцисты Cyclospora cayetanensis (стрелка) красного цвета в модифицированном кислотостойком окрашенном мазке фекалий. Масштабная линейка = 10 мкм.
Основным клиническим проявлением криптоспоридиоза является водянистая диарея различной продолжительности, при этом процесс проходит самостоятельно у иммунокомпетентных лиц и имеет тенденцию к переходу в хроническую форму у пациентов с иммунодепрессией, среди которых он может привести к летальному исходу.Именно среди этой последней группы могут наблюдаться клинические формы внекишечных последствий 106.
Все задокументированные случаи инвазии дыхательного аппарата Cryptosporidium относятся к больным с иммунодепрессией, основной причиной которой является появление СПИДа 107–116. Существуют и другие процессы, например, соответствующие злокачественным гематологическим патологиям 117 и реципиентам трансплантата костного мозга 118, 119.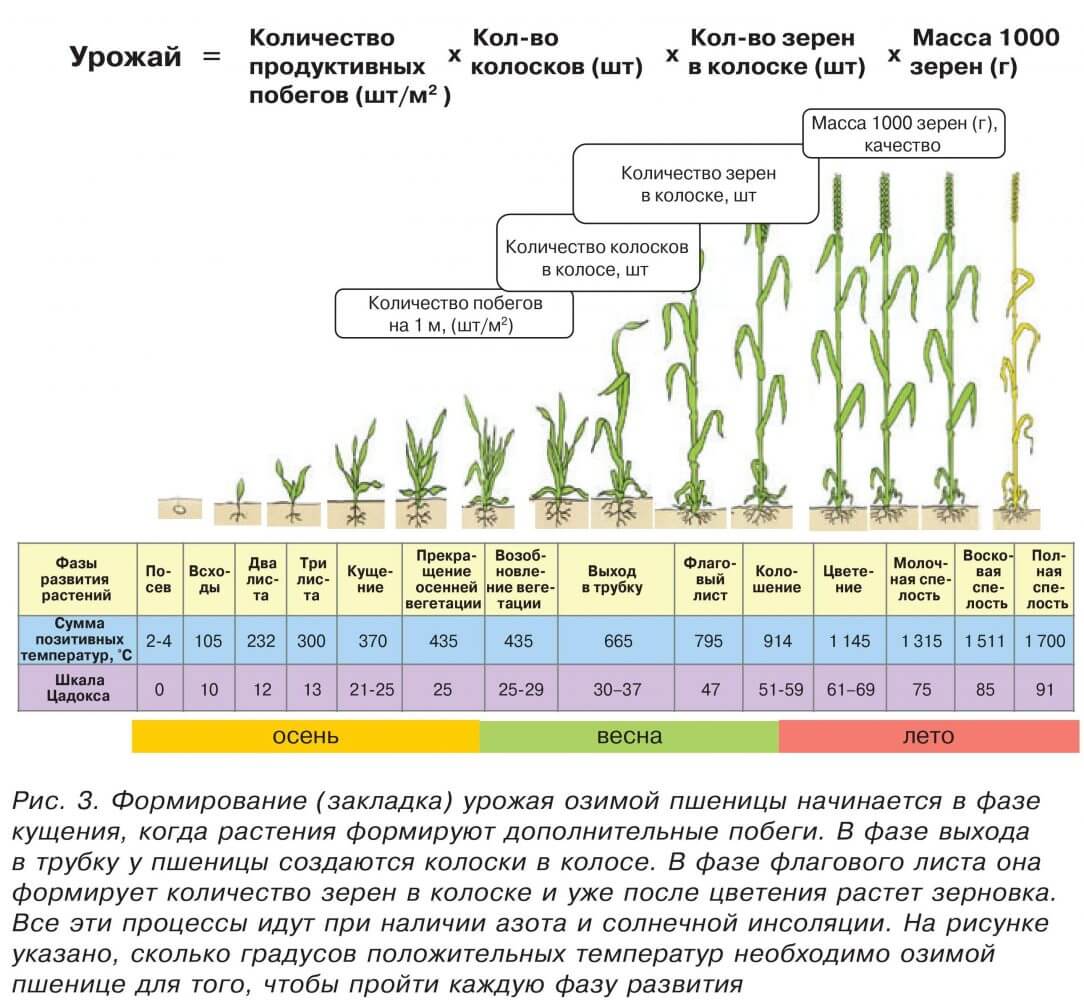 Хотя механизм, посредством которого Cryptosporidium колонизирует дыхательный аппарат, неясен, аспирация желудочного содержимого и гематогенная диссеминация, облегчаемые макрофагами, происходящими из в качестве возможных путей были предложены фокальные точки кишечника 120.
Хотя механизм, посредством которого Cryptosporidium колонизирует дыхательный аппарат, неясен, аспирация желудочного содержимого и гематогенная диссеминация, облегчаемые макрофагами, происходящими из в качестве возможных путей были предложены фокальные точки кишечника 120.
Как клиническое наблюдение, так и рентгенография, как правило, неточны, наиболее часто упоминаемые симптомы включают стойкий продуктивный кашель, лихорадку, одышку и тахипноэ, в некоторых случаях требующие ИВЛ из-за дыхательной недостаточности и гипоксемии. На рентгенограммах грудной клетки наиболее часто наблюдается картина интерстициальной пневмонии.
Исследования на экспериментальных животных, подвергнутых иммуносупрессии, показали, что Cryptosporidium может непосредственно повреждать респираторный эпителий 121–123, особенно следует отметить наличие трахеита с чешуйчатой метаплазией и инфильтрацией подслизистых лимфоцитов, перибронхиальной железистой гиперплазией, потерей ресничек и ядерными и цитоплазматическими изменениями. .Описано также заполнение гнойным экссудатом полостей бронхов с многочисленными микроорганизмами, прилипшими к поверхности эпителия. Наблюдалось утолщение внутриальвеолярных стенок с воспалительным инфильтратом на основе макрофагов и лимфоцитов, а также в альвеолярных пространствах и даже в макрофагах свободные микроорганизмы.
.Описано также заполнение гнойным экссудатом полостей бронхов с многочисленными микроорганизмами, прилипшими к поверхности эпителия. Наблюдалось утолщение внутриальвеолярных стенок с воспалительным инфильтратом на основе макрофагов и лимфоцитов, а также в альвеолярных пространствах и даже в макрофагах свободные микроорганизмы.
Те же самые изменения были описаны в посмертных находках пациентов, умерших от дыхательной недостаточности; также существуют данные о диффузном альвеолярном повреждении, особенно о гиперплазии пневмоцитов II типа и интерстициальном фиброзе.
Несмотря на это, даже когда вскрытие подтверждает наличие Cryptosporidium в легочной ткани, иногда трудно подтвердить его причастность к смерти из-за того, что в бронхиальном дереве присутствуют и другие возбудители 124.
В таких образцах, как , трахеальный аспират и бронхоальвеолярный лаваж 125.Здесь полезны такие методы окрашивания, как модификации Киньюна и Циля-Нильсена, а также окрашивание флуоресценцией аурамина. Методы молекулярной биологии помогают определить вид паразита 126.
Методы молекулярной биологии помогают определить вид паразита 126.
Паромомицин и азитромицин являются препаратами выбора для лечения этого простейшего 127, при этом следует помнить об ингаляционном способе 128.
Род токсоплазма
Toxoplasma gondii , облигатный внутриклеточный простейший, является агентом, вызывающим токсоплазмоз, инфекционное заболевание, распространенное во всем мире и поражающее людей и многие виды животных, причем кошки являются окончательным хозяином паразита.В своем жизненном цикле T. gondii принимает три формы: ооциста, обнаруживаемая в кишечнике кошки и выделяемая наружу с ее фекалиями; тахизоит, зрелая форма, ответственная за паразитемию; и брадизоит, который образует спящие внутриклеточные кистозные агрегаты и отвечает за иммунное состояние человека.
У здоровых лиц токсоплазмоз вызывает бессимптомную инфекцию или субклинические формы (лихорадку и лимфаденопатии). Наиболее серьезной формой является врожденный токсоплазмоз (заражение матери во время беременности), который поражает женщин с ослабленным иммунитетом и является причиной системных инфекций.
Наиболее серьезной формой является врожденный токсоплазмоз (заражение матери во время беременности), который поражает женщин с ослабленным иммунитетом и является причиной системных инфекций.
Хотя легочный токсоплазмоз может развиваться у иммунокомпетентных людей 129, в большинстве случаев наблюдается серьезный дефицит иммунной системы. Это вторая или третья наиболее частая системная инфекция среди лиц с ослабленным иммунитетом после локализации головного мозга и сердца 130, 131. Помимо СПИДа 132–136, другие процессы, такие как злокачественные гематологические патологии и трансплантация органов, также являются важными причинами токсоплазмоза легких 137–137. 143. В большинстве этих случаев наиболее широко распространенной гипотезой развития легочного токсоплазмоза является реактивация ранее латентной инфекции 144, 145, причем важными причинными факторами являются уровни интерферона-γ и активность альвеолярных макрофагов.Кроме того, в экспериментальных исследованиях на животных выявлено изменение уровня интерлейкинов, сегрегированных Т-хелперными лимфоцитами 1-го типа в легких при реактивации инфекции T.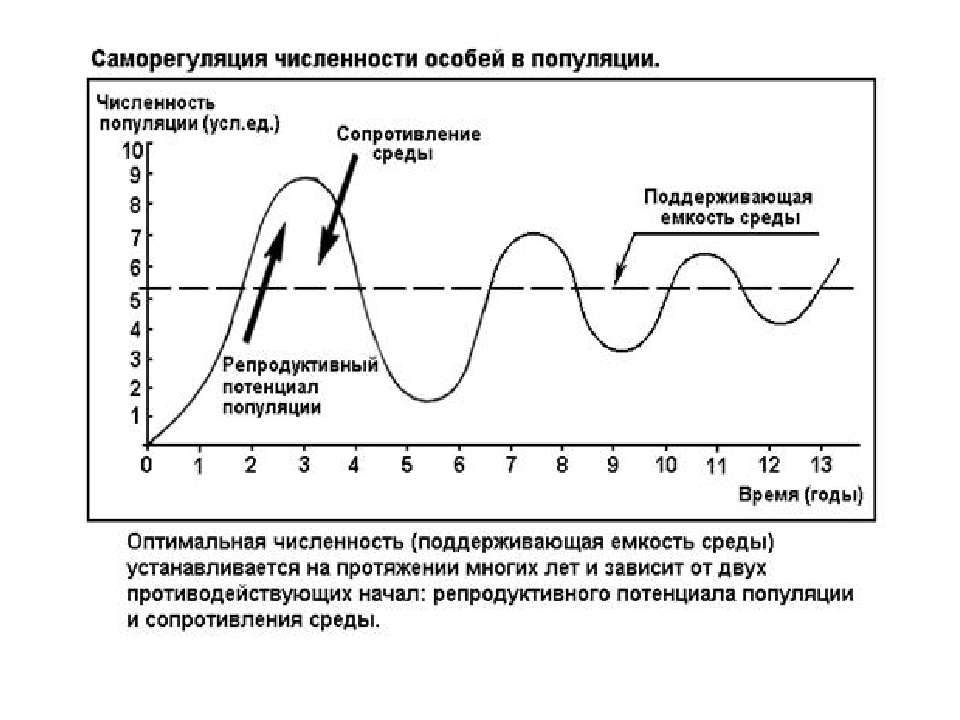 gondii 146.
gondii 146.
Наиболее частыми клиническими симптомами являются лихорадка, кашель, затрудненное дыхание, тахипноэ и одышка, причем последняя в ряде случаев приводит к гипоксемии с острым респираторным дистресс-синдромом, что является одной из основных причин смерти больных 147–149 .
Рентгенологическое исследование обычно выявляет две картины: типичный двусторонний диффузный инфильтрат (рис. 9⇓), неотличимый от других процессов, таких как пневмония, вызванная Pneumocystisis jiroveci ; и толстый узелковый двусторонний инфильтрат, который может быть использован в дифференциальной диагностике 150. В целом, эти эффекты выявляют интерстициальный пневмонит и альвеолярное уплотнение. Наличие сопутствующих плевральных выпотов является еще одним из описанных эффектов. Анатомопатологические исследования, проводимые либо при биопсии легких, либо при вскрытии, показывают поражения, связанные с состоянием и интенсивностью инфекции 135.Макроскопически легкие выглядят полнокровными, с точечными кровоизлияниями и участками уплотнения. Гистопатология показывает интерстициальный пневмонит с воспалительным лимфоцитарным инфильтратом, диффузное альвеолярное повреждение с фибринозным альвеолярным экссудатом и образованием альвеолярных гиалиновых мембран. Обычно имеются многочисленные альвеолярные макрофаги, содержащие цисты паразита. Некротизирующая пневмония проявляется как более запущенное поражение, характеризующееся обширными участками паренхиматозного некроза и наличием многочисленных тахизоитов, как внеклеточных, так и внутриклеточных.В цитологических мазках, приготовленных из плевральных выпотов и окрашенных по Май-Грюнвальду-Гимзе, описана визуализация множества тахизоитов, расположенных экстрацеллюлярно и внутриклеточно полиморфноядерных лейкоцитов и макрофагов 151, 152.
Гистопатология показывает интерстициальный пневмонит с воспалительным лимфоцитарным инфильтратом, диффузное альвеолярное повреждение с фибринозным альвеолярным экссудатом и образованием альвеолярных гиалиновых мембран. Обычно имеются многочисленные альвеолярные макрофаги, содержащие цисты паразита. Некротизирующая пневмония проявляется как более запущенное поражение, характеризующееся обширными участками паренхиматозного некроза и наличием многочисленных тахизоитов, как внеклеточных, так и внутриклеточных.В цитологических мазках, приготовленных из плевральных выпотов и окрашенных по Май-Грюнвальду-Гимзе, описана визуализация множества тахизоитов, расположенных экстрацеллюлярно и внутриклеточно полиморфноядерных лейкоцитов и макрофагов 151, 152.
Легочный токсоплазмоз в кости пациенту с трансплантацией костного мозга с двусторонними диффузными инфильтратами.
Различные диагностические процедуры позволяют визуализировать паразита в образцах из дыхательного аппарата, одним из наиболее важных является бронхоальвеолярный лаваж 153–156 с окрашиванием образцов по Гимзе. В мокроте также обнаруживается T. gondii , что является альтернативным методом диагностики, если инвазивные методы не могут быть выполнены 157. пригодиться 158, 159.
В мокроте также обнаруживается T. gondii , что является альтернативным методом диагностики, если инвазивные методы не могут быть выполнены 157. пригодиться 158, 159.
Наиболее подходящими терапевтическими мерами являются комбинация пириметамина и сульфадиазина, назначаемая для предотвращения гематологических осложнений, или замена сульфадиазина клиндамицином.Альтернативой этим комбинациям являются азитромицин и доксициклин. Помимо терапии, у пациентов с иммунодепрессией первичная профилактика и соответствующая профилактика против T. gondii могут значительно смягчить легочные последствия 160.
Род Plasmodium
Этот род включает внутриклеточных простейших, вызывающих малярию. Болезнь эндемична более чем в 90 странах, ежегодно поражает 200–300 миллионов человек и ежегодно уносит около 3 миллионов жизней.Таким образом, это одно из заболеваний с самой высокой заболеваемостью и смертностью. Четыре вида, принадлежащие к этому роду, поражают человека: P. falciparum, P. malariae, P. ovale и P. vivax . Болезнь передается при укусе самки комара Anopheles, а жизненный цикл Plasmodium состоит из бесполой стадии у человека-хозяина с внеэритроцитарной и внутриэритроцитарной фазами и половой стадии, развивающейся у комара.
falciparum, P. malariae, P. ovale и P. vivax . Болезнь передается при укусе самки комара Anopheles, а жизненный цикл Plasmodium состоит из бесполой стадии у человека-хозяина с внеэритроцитарной и внутриэритроцитарной фазами и половой стадии, развивающейся у комара.
В среде нынешних авторов малярия является одним из основных завозных острых заболеваний с легочными проявлениями 161, 162. P. falciparum и P. vivax (рис. 10⇓) наиболее часто поражают легкие, тогда как P. ovale и P. malariae встречаются реже всего 163. В основном поражаются дети. 164.
Рис. 10—Plasmodium vivax : инфицированный эритроцит, содержащий окрашенный трофозоит, имеющий типичный амебоидный вид в тонком мазке крови Гимза.Масштабная линейка = 7 мкм.
Отек легких является основным проявлением воздействия малярии на легкие 165, особенно в случаях, связанных с P. falciparum и, в меньшей степени, P. vivax 166. Повышенная проницаемость альвеолярных капилляров, по-видимому, основной механизм, с помощью которого плазматическая жидкость заполняет альвеолярные пространства 167. Экспериментальные модели in vitro продемонстрировали, что адгезия инфицированных эритроцитов к сосудистому эпителию через различные молекулы (молекула межклеточной адгезии-1, Е-селектин, сосудистые клетки молекула адгезии-1, и т.д. .), является одним из основных факторов, провоцирующих повреждение капилляров с последующим повышением проницаемости 168, 169. Другим частым легочным осложнением малярии является острый респираторный дистресс-синдром, при котором одновременно P. falciparum 170–172 и P. vivax 173 –179 замешаны.
vivax 166. Повышенная проницаемость альвеолярных капилляров, по-видимому, основной механизм, с помощью которого плазматическая жидкость заполняет альвеолярные пространства 167. Экспериментальные модели in vitro продемонстрировали, что адгезия инфицированных эритроцитов к сосудистому эпителию через различные молекулы (молекула межклеточной адгезии-1, Е-селектин, сосудистые клетки молекула адгезии-1, и т.д. .), является одним из основных факторов, провоцирующих повреждение капилляров с последующим повышением проницаемости 168, 169. Другим частым легочным осложнением малярии является острый респираторный дистресс-синдром, при котором одновременно P. falciparum 170–172 и P. vivax 173 –179 замешаны.
Клиническое воздействие малярии на легкие может варьироваться от легкого, с лихорадкой, кашлем, одышкой, отхаркиванием и болью в грудной клетке 180, 181, до серьезной дыхательной недостаточности, требующей госпитализации в отделение интенсивной терапии 182.
Рентгенологическое исследование выявляет наличие мелких диффузных и двусторонних инфильтратов с выраженным увеличением сосудистой сети и участками долевой консолидации 183. Также могут наблюдаться сопутствующие плевральные выделения.
При патологоанатомическом исследовании макроскопически легкие выглядят полнокровными и отечными, с многочисленными геморрагическими очагами. Может наблюдаться сосуществование плевральных и/или перикардиальных выделений. На гистологических срезах выявляют отек плевры, гиперемию капилляров, гиалиновые мембраны и утолщение альвеолярных перегородок.Внутри альвеолярных макрофагов можно наблюдать присутствие коричневого пигмента (гемозоина или малярийного пигмента). В литературе описан случай облитерирующего бронхиолита с организационной пневмонией, ассоциированной с P. vivax , с терапевтическим ответом на кортикоиды 184.
Визуализация простейших посредством микроскопического исследования крови является предпочтительным методом диагностики, хотя для правильной идентификации вида можно прибегнуть к другим методам диагностики, включая ПЦР 185.
В зависимости от соответствующего поддерживающего лечения для контроля гемодинамической и дыхательной функции, противомалярийная лекарственная терапия зависит от ряда факторов, таких как вид вида, клиническое состояние пациента и восприимчивость паразита к лекарствам, особенно по отношению к местности, где произошло заражение. Одним из заслуживающих внимания аспектов является легочная токсичность, которая может быть вызвана использованием мефлохина с развитием диффузного альвеолярного повреждения 186–188.
Род Бабезия
Бабезии представляют собой внутриэритроцитарные простейшие, из которых существуют различные виды, в основном B. divergens и B. microti . Их основными резервуарами являются крупный рогатый скот и дикие грызуны. Люди заражаются инфекцией (бабезиозом), в основном характеризующейся наличием лихорадки и гемолиза, через укусы клещей. К факторам риска системной инфекции относятся иммуносупрессия, пожилой возраст и предшествующая спленэктомия. Бабезиоз — довольно редкое заболевание, при котором воздействие на легкие, как и в случае с малярией, является следствием системной воспалительной реакции 189, которая в некоторых случаях может быть вторичной по отношению к используемой антипротозойной терапии 190, 191. Среди клинических проявлений — лихорадка, кашель и затрудненное дыхание, при этом наиболее часто развивается некардиогенный отек легких 192. Среди возможных причин этого легочного осложнения — отсутствие деформируемости инфицированных эритроцитов при прохождении через легочные капилляры и увеличение их адгезии к стенкам сосудов.
Бабезиоз — довольно редкое заболевание, при котором воздействие на легкие, как и в случае с малярией, является следствием системной воспалительной реакции 189, которая в некоторых случаях может быть вторичной по отношению к используемой антипротозойной терапии 190, 191. Среди клинических проявлений — лихорадка, кашель и затрудненное дыхание, при этом наиболее часто развивается некардиогенный отек легких 192. Среди возможных причин этого легочного осложнения — отсутствие деформируемости инфицированных эритроцитов при прохождении через легочные капилляры и увеличение их адгезии к стенкам сосудов.
В литературе описано три случая острого респираторного дистресс-синдрома, развившегося как осложнение заболевания 193, 194, с необходимостью ИВЛ из-за дыхательной недостаточности и гипоксемии. При рентгенологическом исследовании описаны двусторонние инфильтраты с альвеолярным рисунком и утолщением перегородок 195. В одном из случаев на посмертных находках обнаружены выраженный застой и легочная консолидация; на гистологических срезах наблюдают гиперплазию пневмоцитов II типа, интерстициальный отек и очаги образования гиалиновых мембран.
Диагноз бабезиоза устанавливают при обнаружении в периферической крови внутриэритроцитарных паразитов с характерной морфологией (почковидной формы или формы «мальтийского креста»). Такие методы, как ПЦР, позволяют поставить более точный диагноз. Терапией выбора является совместное введение клиндамицина и хинина сульфата.
Тип Микроспора
Простейшие, принадлежащие к этому типу, являются внутриклеточными облигатными паразитами (у них отсутствуют такие органы, как митохондрии и аппарат Гольджи).Их жизненный цикл состоит из инфекционной внеклеточной фазы и фазы размножения в клетке-хозяине со спорами, состоящими из мелких инкапсулированных элементов (1–4 мкм в диаметре, овальной морфологии), в качестве заражающих форм 196. Из восьми вовлеченных видов в патологии человека наиболее частыми видами являются Enterocytozoon bieneusi, Encephalitozoon cuniculi, Encephalitozoon hellem и Encephalitozoon enteralis .
У иммунокомпетентного человека микроспоридиоз может быть бессимптомной инфекцией или вызывать легкие эпизоды диареи, в то время как у пациентов с иммунодепрессией инфекция приобретает особое значение, причем наиболее часто встречается желудочно-кишечная форма, хотя также существуют полиорганные последствия 197, 198.Описаны оральный, глазной, половой и респираторный пути передачи, последний подтвержден обнаружением микроорганизмов в мокроте и в трахеобронхиальном дереве 199, 200.
Все задокументированные случаи легочного микроспоридиоза относятся к пациентам с иммунодепрессией, предрасполагающими факторами являются СПИД 201–204 и реципиенты трансплантата костного мозга 205–207. Среди возможных механизмов, с помощью которых микроорганизмы колонизируют дыхательный аппарат, выделяются вдыхание, регургитация, орофекальное заражение и гематогенная диссеминация из кишечного очага 208.
Клиническими проявлениями поражения органов дыхания микроспоридиями являются риносинусит 209, лихорадка, упорный кашель, одышка и острая дыхательная недостаточность, которые в ряде случаев развивались до смерти больных вследствие сердечно-дыхательной недостаточности.
При рентгенологическом исследовании обращает на себя внимание наличие инфильтратов и двусторонних легочных затемнений, а также наличие участков обширной консолидации.
Образцами, в которых был идентифицирован микроорганизм, являются выделения из носа, мокрота, трахеобронхиальный аспират и бронхоальвеолярный лаваж (рис.11⇓), при котором можно было проводить окрашивание (модифицированный трихром по Веберу и калькофлуор), иммунофлуоресценцию, электронную микроскопию и специфические культуры клеток 210, 211.
Рис. окрашивание в бронхоальвеолярном лаваже. Масштабная линейка = 6 мкм.В тех случаях, когда проводилось анатомопатологическое исследование, в биоптатах обнаруживают бронхиолит с эпителиальным воспалительным инфильтратом за счет лимфоцитов.При вскрытии легкие представлены множественными участками абсцесса, особенно в субплевральной области.
Хотя терапия зависит от вовлеченных видов и иммунологического статуса пациента, обычно используются альбендазол и фумагалин.
Тип Ciliophora (инфузории)
Фундаментальной особенностью этих простейших является наличие ресничек вдоль всей клеточной мембраны или в определенных местах, которые используются как для движения, так и для захвата пищи.До сих пор единственным известным видом, вызывающим патологию у человека, является Balantidium coli ; единственный вид этого рода. Это одно из самых крупных простейших (50–300 мкм в длину) с яйцевидным телом, покрытым ресничками (рис. 12⇓). Его основной естественной средой обитания и резервуаром является толстая кишка свиньи, хотя он также обитает в кишечнике человека. Хотя существуют разногласия по поводу того, как этот простейший передается людям, важным фактором, по-видимому, является некоторая связь со свиньями.Тем не менее, следует также учитывать возможность передачи от человека к человеку. Инфекция у человека принципиально поражает толстую кишку, провоцируя клинические ситуации различной интенсивности, начиная от бессимптомных форм и заканчивая тяжелой диареей с изъязвлением слизистой оболочки.
Balantidium coli : трофозоит во влажном препарате, окрашенный йодом. Масштабная линейка = 200 мкм.
Легочная инфекция, вызванная B. coli , встречается довольно редко, и в литературе описано несколько случаев.К предрасполагающим факторам относятся, в основном, иммуносупрессия 212, 213 и контакт со свиньями 214, 215, хотя также был описан случай пациента с предшествующей астмой, у которого не было иммунодепрессии 216. Хотя механизм поражения легких не вполне ясно, представляется вероятным гематогенная и лимфатическая диссеминация путем изъязвления кишки, а также, в случае перфорации, через диафрагму. В большинстве случаев среди клинических проявлений отмечают лихорадку, непродуктивный и упорный кашель, одышку различной интенсивности (одному из больных потребовалась вспомогательная вентиляция легких) и боль в грудной клетке.При рентгенологическом исследовании обращало на себя внимание наличие диффузных и двусторонних интерстициальных инфильтратов. При исследовании свежих образцов, полученных путем аспирации или бронхоальвеолярного лаважа, описывается наличие многочисленных трофозоитов.
При исследовании свежих образцов, полученных путем аспирации или бронхоальвеолярного лаважа, описывается наличие многочисленных трофозоитов.
Терапия метронидазолом или тетрациклином кажется эффективной.
Вирусы простейших паразитов и вирусная терапия: сейчас самое подходящее время? | Virology Journal
Short EE, Caminade C, Thomas BN.Вклад изменения климата в возникновение или повторное появление паразитарных заболеваний. Заразить Диса (Окла). 2017;10:1178633617732296. https://doi.org/10.1177/1178633617732296.
Артикул Google Scholar
Писарски К. Глобальное бремя зоонозных паразитарных болезней: 5 главных претендентов на приоритетное рассмотрение. Trop Med Infect Dis. 2019;4:44. https://doi.org/10.3390/tropicalmed4010044.
Артикул ПабМед Центральный Google Scholar
Торгерсон пр. Единое здоровье в мире: социально-экономическое бремя и приоритеты борьбы с паразитарными заболеваниями.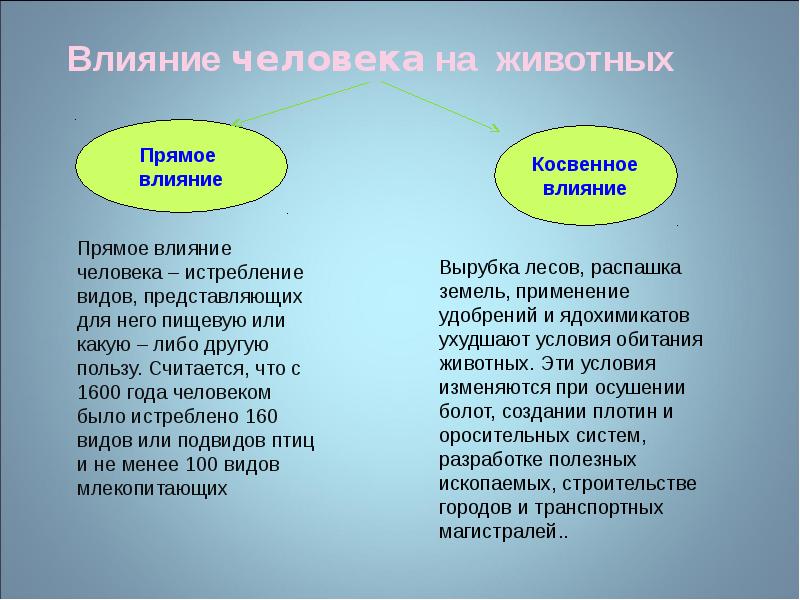 Вет Паразитол. 2013; 195: 223–32. https://doi.org/10.1016/j.vetpar.2013.04.004.
Вет Паразитол. 2013; 195: 223–32. https://doi.org/10.1016/j.vetpar.2013.04.004.
Артикул пабмед Google Scholar
Дженсен К. Глобальное бремя паразитарных заболеваний. https://faculty.ucmerced.edu/kjensen5/index.php/research/global-burden-of-parasitic-disease (2015). По состоянию на 12 мая 2020 г.
Ласточка БМ.Воздействие трипаносомоза на сельское хозяйство Африки. Техническая и научная серия PAAT. 2000. Продовольственная и сельскохозяйственная организация (ФАО). https://www.fao.org/3/X4755EN/x4755en.pdf.
Горбани М., Фархуди Р. Лейшманиоз у людей: лекарственная или вакцинная терапия? Препарат Des Devel Ther. 2017;12:25–40. https://doi.org/10.2147/DDDT.S146521.
Артикул пабмед ПабМед Центральный Google Scholar
Штутцер С., Ричардс С.А., Феррейра М., Барон С., Мариц-Оливье С.Вакцины против многоклеточных паразитов: современное состояние и перспективы на будущее. Front Cell Infect Microbiol. 2018;8:67. https://doi.org/10.3389/fcimb.2018.00067.
Front Cell Infect Microbiol. 2018;8:67. https://doi.org/10.3389/fcimb.2018.00067.
КАС Статья пабмед ПабМед Центральный Google Scholar
Нарула А.К., Азад К.С., Наинвал Л.М. Новые измерения в области противомалярийных исследований против возрождения малярии. Eur J Med Chem. 2019;181:111353. https://doi.org/10.1016/j.ejmech.2019.05.043.
КАС Статья пабмед Google Scholar
Уилсон К.Л., Фланаган К.Л., Пракаш М.Д., Плебански М. Вакцины против малярии в эпоху ликвидации: текущее состояние и перспективы на будущее. Эксперт Rev Вакцины. 2019;18:133–51. https://doi.org/10.1080/14760584.2019.1561289.
КАС Статья пабмед Google Scholar
Wen H, Vuitton L, Tuxun T и др. Эхинококкоз: достижения XXI века. Clin Microbiol Rev. 2019;32:e00075–e118. https://doi.org/10.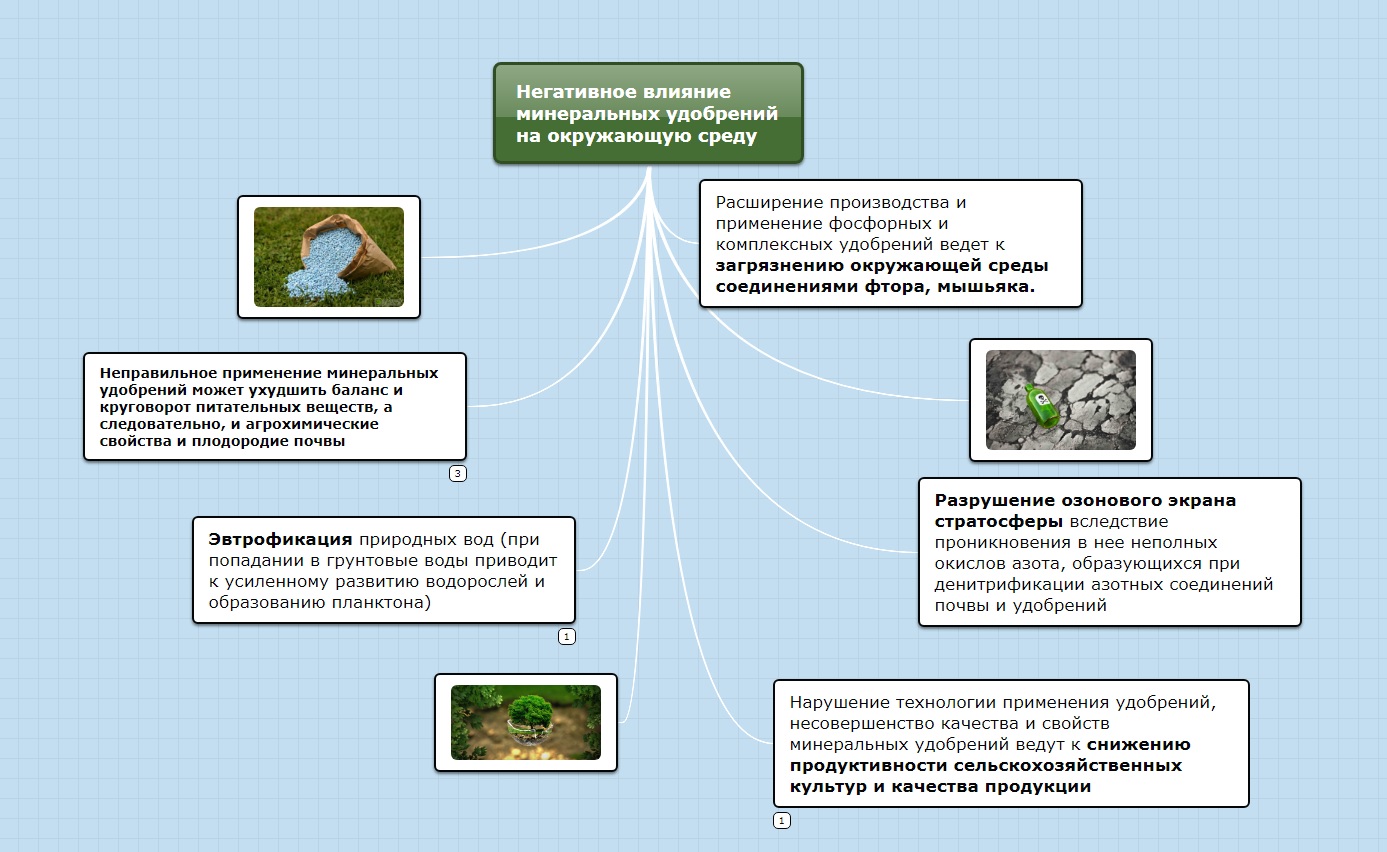 1128/CMR.00075-18.
1128/CMR.00075-18.
Артикул пабмед ПабМед Центральный Google Scholar
Capela R, Moreira R, Lopes F. Обзор лекарственной устойчивости при протозойных заболеваниях. Int J Mol Sci. 2019;20:5748. https://doi.org/10.3390/ijms20225748.
КАС Статья ПабМед Центральный Google Scholar
Feitosa IB, Aguida WR, Teles CBG. Иммуномодулирующие эффекты флеботомина слюны при лейшманиозной инфекции: обзор.ЭнтомоБразилис. 2018;11:156–61.
Артикул Google Scholar
Gargantini PR, Serradell MDC, Ríos DN, Tenaglia AH, Luján HD. Антигенная изменчивость кишечного паразита Giardia lamblia. Curr Opin Microbiol. 2016;32:52–8. https://doi.org/10.1016/j.mib.2016.04.017.
КАС Статья пабмед Google Scholar
Тхакур А. , Миккельсен Х., Юнгерсен Г.Внутриклеточные патогены: иммунитет хозяина и стратегии микробной персистенции. Дж. Иммунол Рез. 2019;14:1356540. https://doi.org/10.1155/2019/1356540.
, Миккельсен Х., Юнгерсен Г.Внутриклеточные патогены: иммунитет хозяина и стратегии микробной персистенции. Дж. Иммунол Рез. 2019;14:1356540. https://doi.org/10.1155/2019/1356540.
КАС Статья Google Scholar
Мукерджи Б., Мукхопадхай Р., Баннерджи Б., Чоудхури С., Мукерджи С., Наскар К., Аллам США, Чакравортти Д., Сундар С., Дюжардин Дж. К., Рой С. Leishmania donovani, устойчивая к сурьме, но не чувствительная к сурьме. — регулирует IL-10 хозяина для сверхэкспрессии белка 1 с множественной лекарственной устойчивостью.Proc Natl Acad Sci USA. 2013; 110:E575–E582582. https://doi.org/10.1073/pnas.1213839110.
Артикул пабмед Google Scholar
Rossi M, Castiglioni P, Hartley MA, Eren RO, Prével F, Desponds C. Интерфероны типа I, индуцированные эндогенными или экзогенными вирусными инфекциями, способствуют метастазированию и рецидиву лейшманиоза. Proc Natl Acad Sci USA. 2017; 114:4987–92. https://doi.org/10.1073/pnas.1621447114.
Proc Natl Acad Sci USA. 2017; 114:4987–92. https://doi.org/10.1073/pnas.1621447114.
КАС Статья пабмед Google Scholar
Рю JS, мин. DY. Trichomonas vaginalis и трихомониаз в Республике Корея. Корейский J Паразитол. 2006; 44:101–16. https://doi.org/10.3347/kjp.2006.44.2.101.
Артикул пабмед ПабМед Центральный Google Scholar
Laurent F, Lacroix-Lamandé S. Врожденные иммунные реакции играют ключевую роль в борьбе с заражением кишечного эпителия криптоспоридиями. Int J Паразитол. 2017;47:711–21.https://doi.org/10.1016/j.ijpara.2017.08.001.
КАС Статья пабмед Google Scholar
Хлопок JA, Amat CB, Buret AG. Нарушения иммунитета хозяина и воспаление лямблиями двенадцатиперстной кишки: возможные последствия коинфекций желудочно-кишечного тракта. Возбудители. 2015;10(4):764–92. https://doi.org/10.3390/pathogens4040764.
2015;10(4):764–92. https://doi.org/10.3390/pathogens4040764.
КАС Статья Google Scholar
Льюис А., Вентцель Дж. Ф., Джейкобс Г., Дю Плесси Л. Х. Возможности использования природных и структурных аналогов антимикробных пептидов в борьбе с забытыми тропическими болезнями. Молекулы. 2015;20:15392–433. https://doi.org/10.3390/molecules200815392.
КАС Статья пабмед ПабМед Центральный Google Scholar
Ospina-Villa JD, López-Camarillo C, Castañón-Sánchez CA, Soto-Sánchez J, Ramirez-Moreno E, Marchat LA.Достижения в области аптамеров против простейших паразитов. Гены (Базель). 2018;9:584. https://doi.org/10.3390/genes
КАС Статья Google Scholar
Sun Y, Chen D, Pan Y, et al. Наночастицы для доставки противопаразитарных препаратов. Наркотик Делив. 2019;26:1206–21. https://doi.org/10.1080/10717544.2019.1692968.
https://doi.org/10.1080/10717544.2019.1692968.
КАС Статья пабмед ПабМед Центральный Google Scholar
Хосрави М., Мирсамади Э.С., Мирджалали Х., Зали М.Р. Выделение и функции внеклеточных везикул паразитов: перспективы новой эры в иммунотерапии, вакцинации и диагностике. Int J Nanomed. 2020;15:2957–69. https://doi.org/10.2147/IJN.S250993.
Артикул Google Scholar
Hyman P, Atterbury R, Barrow P. Блохи и мелкие блохи: виротерапия паразитарных инфекций. Тенденции микробиол. 2013;21:215–20.https://doi.org/10.1016/j.tim.2013.02.006.
КАС Статья пабмед Google Scholar
Людвик Дж., Шипстоун А.С. Ультраструктура Entamoeba histolytica. Всемирный орган здравоохранения Быка. 1970; 43: 301–8.
ПабМед ПабМед Центральный Google Scholar

Molyneux DH. Вирусоподобные частицы паразитов Leishmania. Природа. 1974; 249: 588–9.
КАС Статья Google Scholar
Мохтар-Маамури Ф., Ламберт А., Майяр С., Ваго С. Вирусная инфекция у платигельминтного паразита. C R Acad Sci Hebd Seances Acad Sci D. 1976; 283: 1249–51.
КАС пабмед Google Scholar
Баник Г.Р., Старк Д., Рашид Х., Эллис Дж.Т. Последние достижения в области молекулярной биологии паразитарных вирусов. Заразить мишени для наркотиков. 2014;14:155–67. https://doi.org/10.2174/1871526514666140713160905.
КАС Статья пабмед Google Scholar
Shi M, Lin XD, Tian JH, Chen LJ, Chen X, Li CX и др. Новое определение виросферы РНК беспозвоночных. Природа. 2016; 540: 539–43. https://doi.org/10.1038/nature20167.
КАС Статья пабмед Google Scholar

Гомес-Арреаса А., Хаэнни А.Л., Дуниа И., Авилан Л. Вирусы паразитов как действующие лица в отношениях паразит-хозяин: «ménage à trois». Acta Trop. 2017; 166:126–32. https://doi.org/10.1016/j.actatropica.2016.11.028.
Артикул пабмед Google Scholar
Грибчук Д, Акопьянц Н.С., Костыгов А.Ю., и др. Открытие вирусов и разнообразие трипаносоматидных простейших с упором на родственников человеческого паразита Leishmania . Proc Natl Acad Sci USA. 2018;115:E506–E515515. https://doi.org/10.1073/pnas.1717806115.
КАС Статья пабмед Google Scholar
Руарк С.Л., Гарднер М., Митчем М.Г., Дэвис Э.Л., Сит Т.Л. Новые РНК-вирусы в нематодах, паразитирующих на растениях. ПЛОС ОДИН. 2018;13(3):e0193881. https://doi.org/10.1371/journal.pone.0193881.
КАС Статья пабмед ПабМед Центральный Google Scholar

Харон Дж., Григг М.Дж., Иден Дж.С. и др. Новые РНК-вирусы, связанные с Plasmodium vivax при малярии человека и паразитами Leucocytozoon при болезнях птиц.PLoS Патог. 2019;15(12):e1008216. https://doi.org/10.1371/journal.ppat.1008216.
КАС Статья пабмед ПабМед Центральный Google Scholar
Хан М.А., Росарио К., Лукас П., Дейли Н.М. Характеристика вирусов ленточного червя: филогенетическое положение, вертикальная передача и передача паразитирующему хозяину. ISME J. 2020;14(7):1755–67. https://doi.org/10.1038/s41396-020-0642-2.
КАС Статья пабмед ПабМед Центральный Google Scholar
Оверстрит Р.М., Йовонович Дж., Ма Х. Паразитические ракообразные как переносчики вирусов с акцентом на три пенеидных вируса. Интегр Комп Биол. 2009;49(2):127–41. https://doi.org/10.1093/icb/icp033.
Артикул пабмед Google Scholar

Кумар А., Мурти С., Капур А. Эволюция подходов к селективному секвенированию для обнаружения вирусов и анализа вирома. Вирус Рез. 2017; 239:172–9. https://doi.org/10.1016/j.virusres.2017.06.005.
КАС Статья пабмед ПабМед Центральный Google Scholar
Hillman BI, Cohen AB. Тотивириды (Totiviridae). В: Справочный модуль по наукам о жизни. 2020. https://doi.org/10.1016/B978-0-12-809633-8.21347-2
Prasad BV, Schmid MF. Принципы структурной организации вирусов. Adv Exp Med Biol. 2012; 726:17–47. https://doi.org/10.1007/978-1-4614-0980-9_3.
КАС Статья пабмед Google Scholar
Всемирная организация здравоохранения. (2011). Распространенность и заболеваемость отдельными инфекциями, передающимися половым путем, Chlamydia trachomatis, Neisseria gonorrhoeae, сифилисом и Trichomonas vaginalis : методы и результаты, использованные ВОЗ для получения оценок за 2005 год. Всемирная организация здравоохранения. https://apps.who.int/iris/handle/10665/44735.
Всемирная организация здравоохранения. https://apps.who.int/iris/handle/10665/44735.
Edwards T, Burke P, Smalley H, Hobbs G. Trichomonas vaginalis : клиническая значимость, патогенность и диагностика. Crit Rev Microbiol.2016;42:406–17. https://doi.org/10.3109/1040841X.2014.958050.
КАС Статья пабмед Google Scholar
Ван А.Л., Ван CC. Линейная двухцепочечная РНК в Trichomonas vaginalis . Дж. Биол. Хим. 1985; 260:3697–702.
КАС пабмед Google Scholar
Гудман Р.П., Габриал С.А., Фихорова Р.Н., Ниберт М.Л. Trichomonasvirus: новый род простейших вирусов семейства Totiviridae.Арх Вирол. 2011; 156:171–9. https://doi.org/10.1007/s00705-010-0832-8.
КАС Статья пабмед Google Scholar
Goodman RP, Freret TS, Kula T, et al. Клинические изоляты Trichomonas vaginalis одновременно инфицированы штаммами до четырех видов Trichomonasvirus (семейство Totiviridae). Дж Вирол. 2011;85:4258–70. https://doi.org/10.1128/JVI.00220-11.
Дж Вирол. 2011;85:4258–70. https://doi.org/10.1128/JVI.00220-11.
КАС Статья пабмед ПабМед Центральный Google Scholar
Conrad MD, Gorman AW, Schillinger JA, Fiori PL, Arroyo R, Malla N, et al. Обширное генетическое разнообразие, уникальная структура популяции и свидетельства генетического обмена у паразита, передающегося половым путем Trichomonas vaginalis . PLoS Negl Trop Dis. 2012;6:e1573. https://doi.org/10.1371/journal.pntd.0001573.
Артикул пабмед ПабМед Центральный Google Scholar
Родитель К.Н., Такаги Ю., Кардоне Г., Олсон Н.Х., Эрикссон М., Ян М. и др.Структура протозойного вируса мочеполового паразита человека Trichomonas vaginalis. мБио. 2013;4:e00056-13. https://doi.org/10.1128/mBio.00056-13.
Артикул пабмед ПабМед Центральный Google Scholar

Фихорова Р., Фрага Дж., Раппелли П., Фиори П.Л. Trichomonas vaginalis инфекция в симбиозе с трихомонадными вирусами и микоплазмами. Рез микробиол. 2017; 168:882–91. https://doi.org/10.1016/j.resmic.2017.03.005.
Артикул пабмед Google Scholar
Fraga J, Rojas L, Sariego I, Fernández-Caliines A. Генетическая характеристика трех вирусов кубинской влагалищной трихомонады. Филогения семейства Totiviridae. Заразить Генет Эвол. 2012;2:113–20. https://doi.org/10.1016/j.meegid.2011.10.020.
Артикул Google Scholar
Ривера ВЛ, Хусто САС, Релучио-Сан-Диего М, Лойола ЛМ.Обнаружение и молекулярная характеристика двухцепочечных РНК-вирусов в филиппинских изолятах Trichomonas vaginalis . J Microbiol Immunol Infect. 2017;50:669–76. https://doi.org/10.1016/j.jmii.2015.07.016.
КАС Статья пабмед Google Scholar

Benchimol M, Monteiro S, Chang TH, Alderete JF. Вирус трихомонады — ультраструктурное исследование. Паразитол Интерн. 2002; 51: 293–8. https://doi.org/10.1016/s1383-5769(02)00016-8.
КАС Статья пабмед Google Scholar
He D, Pengtao G, Ju Y, Jianhua L, He L, Guocai Z, Xichen Z. Дифференциальная экспрессия белков у инфицированных и неинфицированных вирусом Trichomonas vaginalis . Корейский J Паразитол. 2017;55:121–8. https://doi.org/10.3347/kjp.2017.55.2.121.
КАС Статья пабмед ПабМед Центральный Google Scholar
Хошнан А., Альдерете Дж. Ф. Trichomonas vaginalis с двухцепочечной РНК вируса имеет повышенные уровни мРНК фенотипически вариабельного иммуногена. Дж Вирол. 1994;68:4035–8.
КАС Статья Google Scholar
Провенцано Д., Хошнан А.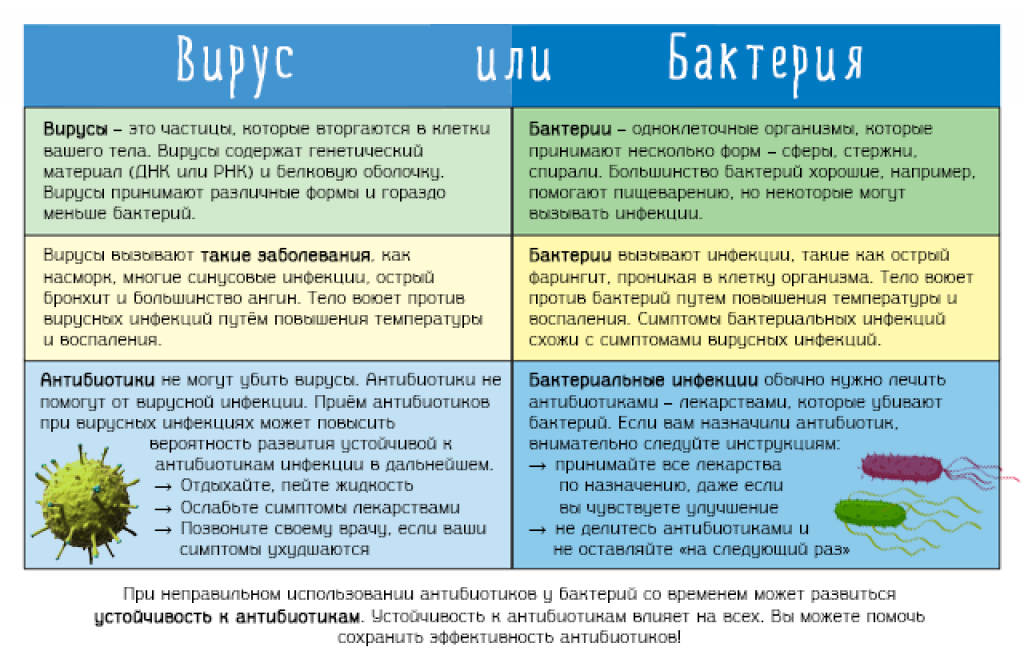 , Альдерете Дж.Ф. Участие вируса dsRNA в белковом составе и кинетике роста хозяина Trichomonas vaginalis . Арх Вирол. 1997; 142: 939–52.
, Альдерете Дж.Ф. Участие вируса dsRNA в белковом составе и кинетике роста хозяина Trichomonas vaginalis . Арх Вирол. 1997; 142: 939–52.
КАС Статья Google Scholar
Graves KJ, Ghosh AP, Schmidt N, Augostini P, Secor WE, Schwebke JR, et al. Вирус Trichomonas vaginalis (TVV) среди женщин с трихомониазом и связь с демографией, клиническими исходами и резистентностью к метронидазолу. Клин Инфекция Дис. 2019;69:2170–6. https://doi.org/10.1093/cid/ciz146.
Артикул пабмед ПабМед Центральный Google Scholar
Фихорова Р.Н., Бак О.Р., Ямамото Х.С., и др.Команда злодеев, или как Trichomonas vaginalis и бактериальный вагиноз совместно изменяют врожденный иммунитет. Секс Трансм Инфекция. 2013;89:460–6. https://doi.org/10.1136/sextrans-2013-051052.
Артикул пабмед ПабМед Центральный Google Scholar

Эль-Гайар Э.К., Мохтар А.Б., Хассан В.А. Молекулярная характеристика двухцепочечного РНК-вируса Trichomonas vaginalis египетских изолятов и его связь с патогенностью.Паразитол рез. 2016; 115:4027–36. https://doi.org/10.1007/s00436-016-5174-3.
Артикул пабмед Google Scholar
Fichorova RN, Lee Y, Yamamoto HS, Takagi Y, Hayes GR, et al. Эндобионтные вирусы, ощущаемые человеком-хозяином, выходят за рамки традиционной противопаразитарной терапии. ПЛОС ОДИН. 2012;7:e48418. https://doi.org/10.1371/journal.pone.0048418.
КАС Статья пабмед ПабМед Центральный Google Scholar
Кюнг Э., Фюрнкранц У., Валочник Дж. Химиотерапевтические возможности лечения трихомониаза человека. Противомикробные агенты Int J. 2019;53:116–27. https://doi.org/10.1016/j.ijantimicag.2018.10.016.
КАС Статья пабмед Google Scholar

Малла Н., Каул П., Сегал Р., Гупта И. Присутствие вируса дцРНК в изолятах Trichomonas vaginalis от симптоматических и бессимптомных индийских женщин и его корреляция с чувствительностью к метронидазолу in vitro.Индийская J Med Microbiol. 2011;29:152–7. https://doi.org/10.4103/0255-0857.81801.
КАС Статья пабмед Google Scholar
Margarita V, Marongiu A, Diaz N, Dessì D, Fiori PL, Rappelli P. Преобладание двухцепочечного РНК-вируса в Trichomonas vaginalis , выделенном в Италии, и ассоциация с симбионтом Mycoplasma hominis . Паразитол рез. 2019;118:3565–70. https://doi.org/10.1007/s00436-019-06469-6.
Артикул пабмед Google Scholar
Клебанофф М.А., Кэри Дж.К., Хаут Дж.К., Хиллиер С.Л., Ньюджент Р.П., Том Э.А. Неспособность метронидазола предотвратить преждевременные роды у беременных женщин с бессимптомной инфекцией Trichomonas vaginalis . N Engl J Med. 2001; 345: 487–93. https://doi.org/10.1056/NEJMoa003329.
N Engl J Med. 2001; 345: 487–93. https://doi.org/10.1056/NEJMoa003329.
КАС Статья пабмед Google Scholar
Cacciò SM, Lalle M, Svärd SG. Специфичность хозяина в комплексе видов Giardia duodenalis. Заразить Генет Эвол. 2018;66:335–45. https://doi.org/10.1016/j.meegid.2017.12.001.
Артикул пабмед Google Scholar
Лалле М., Ханевик К. Рефрактерный к лечению лямблиоз: проблемы и решения. Заразить устойчивостью к наркотикам. 2018; 11:1921–33. https://doi.org/10.2147/IDR.S141468.
КАС Статья пабмед ПабМед Центральный Google Scholar
Ван А.Л., Ван CC. Открытие специфического двухцепочечного РНК-вируса у Giardia lamblia. Мол Биохим Паразитол. 1986; 21: 269–76. https://doi.org/10.1016/0166-6851(86)-5.
КАС Статья пабмед Google Scholar

Ван А.Л., Ян Х.М., Шен К.А., Ван CC. Геном двухцепочечной РНК лямблии кодирует капсидный полипептид и слитый белок, подобный gag-pol, путем сдвига рамки считывания трансляции. Proc Natl Acad Sci USA.1993;90:8595–9. https://doi.org/10.1073/pnas.90.18.8595.
КАС Статья пабмед Google Scholar
Цао Л., Гонг П., Ли Дж. и др. Giardia canis: ультраструктурный анализ трофозоитов G. canis, трансфицированных полноразмерными транскриптами кДНК вируса G. canis. Опыт Паразитол. 2009; 123: 212–7. https://doi.org/10.1016/j.exppara.2009.07.001.
КАС Статья пабмед Google Scholar
Гарлапати С., Ван К.С. Идентификация нового внутреннего сайта посадки рибосомы у лямблий, который распространяется на обе стороны инициирующего кодона. Дж. Биол. Хим. 2004; 279:3389–97. https://doi.org/10.1074/jbc.M307565200.
КАС Статья пабмед Google Scholar
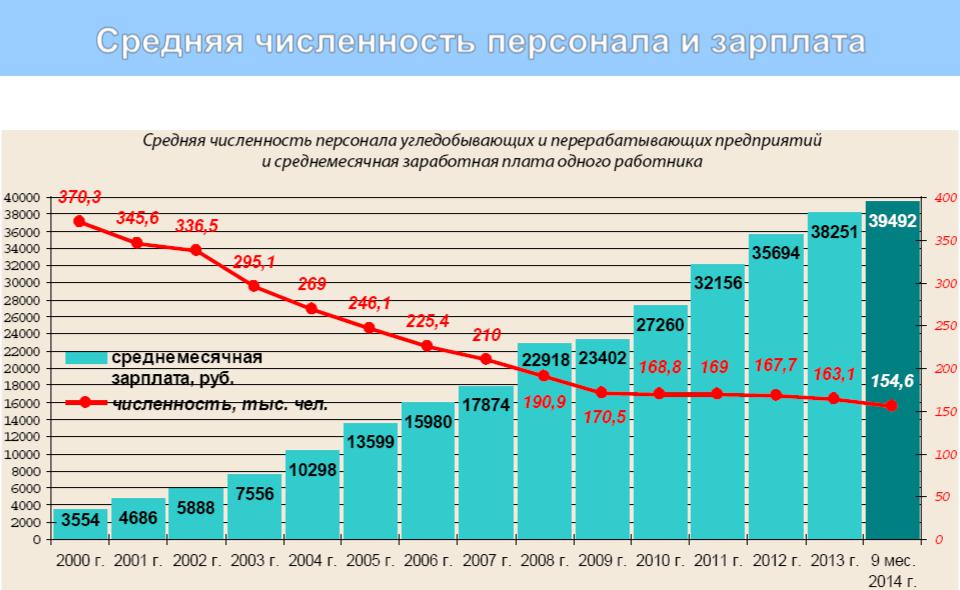
Janssen ME, Takagi Y, Parent KN, Cardone G, Nibert ML, Baker TS. Трехмерная структура протозойного двухцепочечного РНК-вируса, инфицирующего кишечный патоген Giardia lamblia.Дж Вирол. 2015;89:1182–94. https://doi.org/10.1128/JVI.02745-14.
КАС Статья пабмед Google Scholar
Furfine ES, Wang CC. Трансфекция двухцепочечного РНК-вируса Giardia lamblia в Giardia lamblia путем электропорации одноцепочечной РНК-копии вирусного генома. Мол Селл Биол. 1990; 10:3659–62. https://doi.org/10.1128/mcb.10.7.3659.
КАС Статья пабмед ПабМед Центральный Google Scholar
Сепп Т., Ван А.Л., Ван К.С. Giardia lamblia, устойчивые к вирусу лямблии, не имеют вирусного рецептора на поверхности клеточной мембраны. Дж Вирол. 1994; 68: 1426–31.
КАС Статья Google Scholar
Tai JH, Ong SJ, Chang SC, Su HM. Giardiavirus проникает в трофозоит Giardia lamblia WB посредством эндоцитоза. Опыт Паразитол. 1993; 76: 165–74. https://doi.org/10.1006/expr.1993.1019.
Giardiavirus проникает в трофозоит Giardia lamblia WB посредством эндоцитоза. Опыт Паразитол. 1993; 76: 165–74. https://doi.org/10.1006/expr.1993.1019.
КАС Статья пабмед Google Scholar
Ван А.Л., Миллер Р.Л., Ван CC. Антитела к основному белку двухцепочечной РНК вируса Giardia lamblia могут блокировать вирусную инфекцию. Мол Биохим Паразитол. 1988;30(3):225–32. https://doi.org/10.1016/0166-6851(88)-6.
КАС Статья пабмед Google Scholar
Williams FP. Электронно-микроскопическое исследование культур Giardia на наличие вирусов. В: Агентство по охране окружающей среды США, Лаборатория систем мониторинга окружающей среды.1990. https://nepis.epa.gov/Exe/ZyPURL.cgi?Dockey=20009K3D.txt.
De Jonckheere JF, Gordts B. Возникновение и трансфекция вируса Giardia. Мол Биохим Паразитол. 1987; 23:85–89. https://doi.org/10. 1016/0166-6851(87)-3.
1016/0166-6851(87)-3.
Артикул пабмед Google Scholar
Миллер Р.Л., Ван А.Л., Ван CC. Очистка и характеристика двухцепочечного РНК-вируса Giardia lamblia. Мол Биохим Паразитол.1988; 28: 189–95. https://doi.org/10.1016/0166-6851(88)
-5.КАС Статья пабмед Google Scholar
Sedinová J, Flegr J, Ey PL, Kulda J. Использование анализа случайной амплифицированной полиморфной ДНК (RAPD) для идентификации подтипов Giardia кишечника и построения филогенетического дерева. Дж Эукариот микробиол. 2003; 50:198–203. https://doi.org/10.1111/j.1550-7408.2003.tb00117.x.
Артикул пабмед Google Scholar
Miska KB, Jenkins MC, Trout JM, Santín M, Fayer R. Обнаружение и сравнение вируса Giardia (GLV) из различных групп Giardia duodenalis. J Паразитол. 2009;95:1197–200. https://doi. org/10.1645/GE-1876.1.
org/10.1645/GE-1876.1.
КАС Статья пабмед Google Scholar
Гордтс Б., Де Джонкере Дж., Каспрзак В., Маевска А.С., Бутцлер Дж.П. In vitro активность противопротозойных препаратов в отношении кишечной лямблии человека.Противомикробные агенты Chemother. 1987; 31: 672–3. https://doi.org/10.1128/aac.31.4.672.
КАС Статья пабмед ПабМед Центральный Google Scholar
Alvar J, Vélez ID, Bern C, et al. Лейшманиоз во всем мире и глобальные оценки его заболеваемости. ПЛОС ОДИН. 2012;7:e35671. https://doi.org/10.1371/journal.pone.0035671.
КАС Статья пабмед ПабМед Центральный Google Scholar
Burza S, Croft SL, Boelaert M. Лейшманиоз. Ланцет. 2018;392(10151):951–70. https://doi.org/10.1016/S0140-6736(18)31204-2.
Артикул пабмед Google Scholar

Видмер Г., Комо А.М., Ферлонг Д.Б., Вирт Д.Ф., Паттерсон Д.Л. Характеристика РНК-вируса паразита Leishmania. Proc Natl Acad Sci USA. 1989; 86: 5979–82. https://doi.org/10.1073/pnas.86.15.5979.
КАС Статья пабмед Google Scholar
Cantanhêde LM, Fernandes FG, Ferreira GEM, Porrozzi R, Ferreira RGM, Cupolillo E. Новый взгляд на генетическое разнообразие РНК-вируса Leishmania 1 и его видоспецифические отношения с паразитами Leishmania. ПЛОС ОДИН. 2018;13:e0198727. https://doi.org/10.1371/journal.pone.0198727.
КАС Статья пабмед ПабМед Центральный Google Scholar
Шефтер С.М., Ро Ю.Т., Чанг И.К., Паттерсон Д.Л. Полная последовательность РНК-вируса Leishmania LRV2-1, вируса штамма паразита Старого Света.Вирусология. 1995;212(1):84–90. https://doi.org/10.1006/viro.1995.1456.
КАС Статья пабмед Google Scholar

Налчаджи М., Каракуш М., Йылмаз Б., Демир С., Озбилгин А., Озбель Ю., Тёз С. Обнаружение РНК-вируса лейшмании 2 у видов Leishmania из Турции. Trans R Soc Trop Med Hyg. 2019;113:410–7. https://doi.org/10.1093/trstmh/trz023.
КАС Статья пабмед Google Scholar
Widmer G, Dooley S. Филогенетический анализ РНК-вируса Leishmania и Leishmania предполагает древнюю ассоциацию вирус-паразит. Нуклеиновые Кислоты Res. 1995; 23:2300–4. https://doi.org/10.1093/nar/23.12.2300.
КАС Статья пабмед ПабМед Центральный Google Scholar
Атайде В.Д., да Силва Лира Филью А., Чапарро В. и др. Использование экзосомального пути Leishmania РНК-вирусом Leishmania 1. Nat Microbiol.2019;4:714–23. https://doi.org/10.1038/s41564-018-0352-y.
КАС Статья пабмед Google Scholar
Сабери Р. , Факхар М., Мохебали М., Анвари Д., Голами С. Глобальный статус синхронизации РНК-вируса лейшмании у паразитов лейшмании: систематический обзор с метаанализом. Transbound Emerg Dis. 2019;66:2244–51. https://doi.org/10.1111/tbed.13316.
, Факхар М., Мохебали М., Анвари Д., Голами С. Глобальный статус синхронизации РНК-вируса лейшмании у паразитов лейшмании: систематический обзор с метаанализом. Transbound Emerg Dis. 2019;66:2244–51. https://doi.org/10.1111/tbed.13316.
Артикул пабмед Google Scholar
Brettmann EA, Shaik JS, Zangger H, et al. Нарушение баланса между РНК-интерференцией и репликацией уничтожает РНК-вирус Leishmania 1 и смягчает воспалительную реакцию. Proc Natl Acad Sci USA. 2016;113:11998–2005. https://doi.org/10.1073/pnas.1615085113.
КАС Статья пабмед Google Scholar
Кариявасам Р., Муккала А.Н., Лау Р., Валенсия Б.М., Льянос-Куэнтас А., Боггильд А.К. Экспрессия транскрипта РНК фактора вирулентности в подроде Leishmania Viannia: влияние видов, источника изолята и РНК-вируса Leishmania-1.Троп Мед Здоровье. 2019;47:25. https://doi.org/10.1186/s41182-019-0153-x.
Артикул пабмед ПабМед Центральный Google Scholar
Saiz M, Llanos-Cuentas A, Echevarria J, Roncal N, Cruz M, Muniz MT, et al. Краткий отчет: обнаружение лейшманиовируса в образцах биопсии человека лейшманиоза из Перу. Am J Trop Med Hyg. 1998; 58:192–4. https://doi.org/10.4269/ajtmh.1998.58.192.
КАС Статья пабмед Google Scholar
Ogg MM, Carrion R Jr, Botelho AC, Mayrink W, Correa-Oliveira R, Patterson JL. Краткий отчет: количественная оценка РНК лейшманиовируса в клинических образцах и ее возможная роль в патогенезе. Am J Trop Med Hyg. 2003; 69: 309–313.
Артикул Google Scholar
Ito MM, Catanhêde LM, Katsuragawa TH, Silva Junior CF, Camargo LM, Mattos Rde G и др. Корреляция между наличием РНК-вируса Leishmania 1 и клиническими характеристиками лейшманиоза слизистой оболочки носа. Браз Дж. Оториноларингол. 2015; 81: 533–40. https://doi.org/10.1016/j.bjorl.2015.07.014.
Браз Дж. Оториноларингол. 2015; 81: 533–40. https://doi.org/10.1016/j.bjorl.2015.07.014.
Артикул пабмед Google Scholar
Bourreau E, Ginouves M, Prévot G, Hartley MA, Gangneux JP, Robert-Gangneux F, et al. Присутствие РНК-вируса лейшмании 1 в Leishmania Guyanensis увеличивает риск неэффективности лечения первой линии и симптоматического рецидива. J заразить Dis. 2016; 213:105–11. https://doi.org/10.1093/infdis/jiv355.
КАС Статья пабмед Google Scholar
Hartley MA, Bourreau E, Rossi M, Castiglioni P, Eren RO, Prevel F, et al. Зависимый от лейшманиавируса метастатический лейшманиоз предотвращается путем блокирования IL-17A. PLoS Патог. 2016;12:e1005852. https://doi.org/10.1371/journal.ppat.1005852.
КАС Статья пабмед ПабМед Центральный Google Scholar

Parmentier L, Cusini A, Müller N, Zangger H, Hartley MA, Desponds C, et al. Тяжелый кожный лейшманиоз у пациента с вирусом иммунодефицита человека, коинфицированного Leishmania braziliensis и его эндосимбиотическим вирусом. Am J Trop Med Hyg. 2016;94:840–3. https://doi.org/10.4269/ajtmh.15-0803.
Артикул пабмед ПабМед Центральный Google Scholar
Росси М., Фазель Н. Как освоить иммунную систему хозяина? У паразитов Leishmania есть решения! Инт Иммунол.2018;30:103–11. https://doi.org/10.1093/intimm/dxx075.
КАС Статья пабмед Google Scholar
Rath CT, Schnellrath LC, Damaso CR, de Arruda LB, Vasconcelos PFDC, Gomes C. Амазонский флебовирус (Bunyaviridae) потенцирует инфекцию Leishmania (Leishmania) amazonensis: Роль PKR/IFN1/IL-10 ось. PLoS Negl Trop Dis. 2019;13:e0007500. https://doi.org/10.1371/journal.pntd.0007500.
КАС Статья пабмед ПабМед Центральный Google Scholar

Татемацу М., Сейя Т., Мацумото М. Помимо дцРНК: передача сигналов толл-подобного рецептора 3 в РНК-индуцированных иммунных реакциях. Биохим Дж. 2014;458(2):195–201. https://doi.org/10.1042/BJ20131492.
КАС Статья пабмед Google Scholar
Эрен Р.О., Реверте М., Росси М., Хартли М.А., Кастильони П., Превел Ф. и др. Врожденный иммунный ответ млекопитающих на резидентный РНК-вирус лейшмании увеличивает выживаемость макрофагов, способствуя персистенции паразита.Клеточный микроб-хозяин. 2016;20:318–28. https://doi.org/10.1016/j.chom.2016.08.001.
КАС Статья пабмед ПабМед Центральный Google Scholar
Грибчук Д., Маседо Д.Х., Клещенко Ю. и др. Первый РНК-вирус, не относящийся к LRV, в Leishmania . Вирусы. 2020;12:168. https://doi.org/10.3390/v12020168.
КАС Статья ПабМед Центральный Google Scholar

Khalil IA, Troeger C, Rao PC, et al. Заболеваемость, смертность и долгосрочные последствия, связанные с диареей от инфекции Cryptosporidium у детей в возрасте до 5 лет: исследование метаанализа. Ланцет Глоб Здоровье. 2018; 6:e758–e768768. https://doi.org/10.1016/S2214-109X(18)30283-3.
Артикул пабмед ПабМед Центральный Google Scholar
Храмцов Н.В., Вудс К.М., Нестеренко М.В., Дайкстра С.С., Аптон С.Дж. Вирусоподобные двухцепочечные РНК у паразитических простейших Cryptosporidium parvum.Мол микробиол. 1997; 26: 289–300. https://doi.org/10.1046/j.1365-2958.1997.5721933.x.
КАС Статья пабмед Google Scholar
Ниберт М.Л., Вудс К.М., Аптон С.Дж., Габриал С.А. Крисповирусы: новый род простейших вирусов семейства Partitiviridae. Арх Вирол. 2009; 154: 1959–65. https://doi.org/10.1007/s00705-009-0513-7.
КАС Статья пабмед Google Scholar

Jenkins MC, O’Brien CN, Santin M, Fayer R. Изменения уровней крисповируса во время развития Cryptosporidium parvum in vitro. Паразитол рез. 2015;114:2063–8. https://doi.org/10.1007/s00436-015-4390-6.
КАС Статья пабмед Google Scholar
Вонг М., Лудингтон Дж.Г., Уорд Х.Д., Ниберт М.Л. Полные последовательности генома крисповируса из изолята Cryptosporidium parvum из Айовы. Арх Вирол. 2017;162:2875–9. https://дои.орг/10.1007/s00705-017-3385-2.
КАС Статья пабмед ПабМед Центральный Google Scholar
Tai L, Li J, Yin J, Zhang N, Yang J, Li H, Yang Z, Gong P, Zhang X. Новый метод обнаружения инфекции Cryptosporidium parvum у крупного рогатого скота на основе вируса Cryptosporidium parvum 1. Acta Biochim Biophys Sin (Шанхай). 2019;51:104–11. https://doi.org/10.1093/abbs/gmy143.
КАС Статья Google Scholar

Jenkins MC, Higgins J, Abrahante JE, et al. Плодовитость Cryptosporidium parvum коррелирует с внутриклеточными уровнями вирусного симбионта CPV. Int J Паразитол. 2008;38:1051–5. https://doi.org/10.1016/j.ijpara.2007.11.005.
КАС Статья пабмед Google Scholar
Эшли Э.А. Pyae Phyo 2, Вудро CJ. Малярия. Ланцет. 2018;391(10130):1608–21. https://doi.org/10.1016/S0140-6736(18)30324-6.
Артикул пабмед Google Scholar
Лай Л.Ф., Акопянц Н.С., Добсон Д.Е., Беверли С.М., Нарнавирусоподобный элемент из трипаносоматидного простейшего паразита Leptomonas seymouri. Объявление генома. 2016;4: e00713-16. doi:10.1128/genomeA.00713-16
Sukla S, Roy S, Sundar S, Biswas S. Leptomonas seymouri narna-подобный вирус 1, а не лейшманиовирусы, обнаруженные в образцах кала-азар из Индии. Арх Вирол. 2017; 162:3827–35.
КАС Статья Google Scholar

Mietzsch M, Agbandje-McKenna M. О пользе вирусов. Анну Рев Вирол. 2017;4(1):iii–v. https://doi.org/10.1146/annurev-vi-04-071217-100011.
КАС Статья пабмед Google Scholar
Smith HW, Huggins MB. Успешное лечение экспериментальных инфекций Escherichia coli у мышей с использованием фага: его общее превосходство над антибиотиками. J Gen Microbiol. 1982; 128: 307–18. https://doi.org/10.1099/00221287-128-2-307.
КАС Статья пабмед Google Scholar
Группа EFSA по биологическим опасностям (BIOHAZ). Научное заключение об обновлении списка рекомендованных QPS биологических агентов, преднамеренно добавляемых в пищевые продукты или корма, как было уведомлено EFSA (2017–2019 гг.). EFSA J. 2019;18:5966. https://doi.org/10.2903/j.efsa.2020.5966.
Артикул Google Scholar
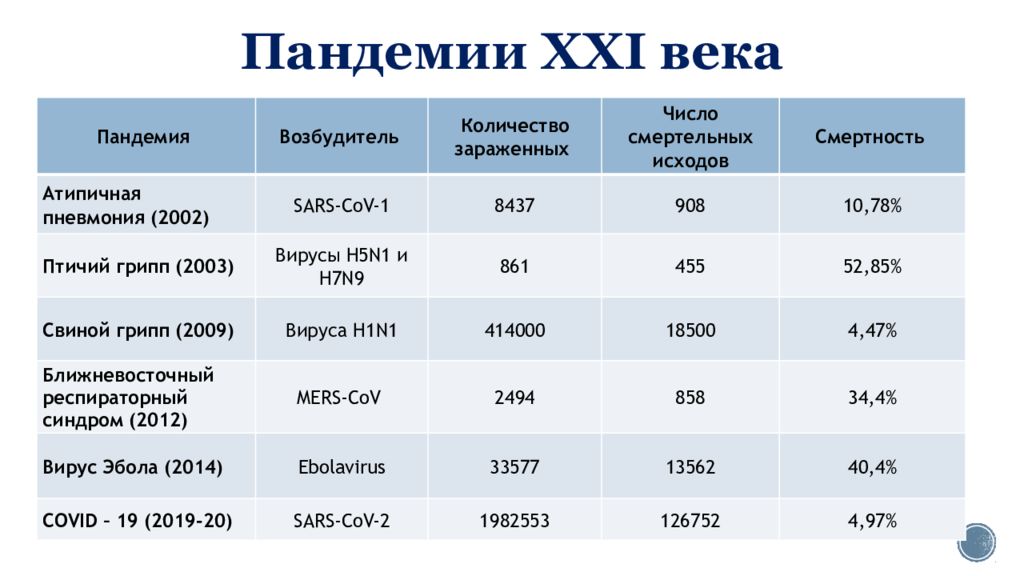
UC San Diego Health.Бактериофаговая терапия. https://health.ucsd.edu/news/topics/phage-therapy/Pages/default.aspx. По состоянию на 12 мая 2020 г.
Летний туалет. Бактериофаговая терапия. Анну Рев Микробиол. 2001; 55: 437–51. https://doi.org/10.1146/annurev.micro.55.1.437.
КАС Статья пабмед Google Scholar
Wittebole X, De Roock S, Opal SM. Исторический обзор бактериофаговой терапии как альтернативы антибиотикам для лечения бактериальных возбудителей.Вирулентность. 2014;5:226–35. https://doi.org/10.4161/viru.25991.
Артикул пабмед Google Scholar
Colom J, Batista D, Baig A, et al. Бактериофаг, специфичный для полового пилуса, повышает чувствительность бактериальной популяции к антибиотикам. Научный доклад 2019; 9: 12616. https://doi.org/10.1038/s41598-019-48483-9.
КАС Статья пабмед ПабМед Центральный Google Scholar
Николич М.П., Филиппов А.А. Бактериофаговая терапия: разработки и направления. Антибиотики. 2020;9:135. https://doi.org/10.3390/antibiotics35.
Артикул ПабМед Центральный Google Scholar
Саха Д., Мукерджи Р. Уменьшение кризиса устойчивости к противомикробным препаратам: фаговая терапия. Жизнь ИУБМБ. 2019;71:781–90. https://doi.org/10.1002/iub.2010.
КАС Статья пабмед Google Scholar
Йосеф И., Манор М., Киро Р., Кимрон У. Умеренные и литические бактериофаги, запрограммированные на сенсибилизацию и уничтожение устойчивых к антибиотикам бактерий. Proc Natl Acad Sci USA. 2015; 112:7267–72. https://doi.org/10.1073/pnas.1500107112.
КАС Статья пабмед Google Scholar
Тао П., Махалингам М., Мараса Б.С., Чжан З., Чопра А.К., Рао В.Б. Доставка генов и белков in vitro и in vivo с использованием машины для упаковки ДНК бактериофага Т4.Proc Natl Acad Sci USA. 2013; 110:5846–51. https://doi.org/10.1073/pnas.1300867110.
КАС Статья пабмед Google Scholar
Патент США WO2015070193. Композиции и способы направленного разрушения генов у прокариот. 2015. США 2015/0132263A1. https://patentscope.wipo.int/search/en/detail.jsf?docId=WO2015070193&tab=PCTBIBLIO.
Роудс Д.Д., Уолкотт Р.Д., Кусковский М.А., Уолкотт Б.М., Уорд Л.С., Сулаквелидзе А.Бактериофаговая терапия венозных язв нижних конечностей у людей: результаты первой фазы исследования безопасности. J Уход за ранами. 2009; 18: 237–43. https://doi.org/10.12968/jowc.2009.18.6.42801.
КАС Статья пабмед Google Scholar
Райт А., Хокинс С.Х., Ангард Э.Е., Харпер Д.Р. Контролируемое клиническое исследование лечебного препарата бактериофага при хроническом отите, вызванном резистентной к антибиотикам Pseudomonas aeruginosa; предварительный отчет об эффективности.Клин Отоларингол 2009;34:349-357. doi:10.1111/j.1749-4486.2009.01973.x
Кафлиш К.М., Су Г.А., Патель Р. Биологические проблемы фаговой терапии и предлагаемые решения: обзор литературы. Expert Rev Anti Infect Ther. 2019;17:1011–41. https://doi.org/10.1080/14787210.2019.1694905.
КАС Статья пабмед Google Scholar
Pirnay JP, Verbeken G, Ceyssens PJ, et al. Магистральный фаг.Вирусы. 2018;10:64. https://doi.org/10.3390/v10020064.
Артикул ПабМед Центральный Google Scholar
Мальфитано А.М., Ди Сомма С., Яннуцци К.А., Пентималли Ф., Портелла Г. Виротерапия: от отдельных агентов к комбинированному лечению. Биохим Фармакол. 2020;177:113986. https://doi.org/10.1016/j.bcp.2020.113986.
КАС Статья пабмед Google Scholar
Чиокка Э.А., Рабкин С.Д. Онколитические вирусы и их применение в иммунотерапии рака. Рак Иммунол Рез. 2014;2:295–300. https://doi.org/10.1158/2326-6066.CIR-14-0015.
КАС Статья пабмед ПабМед Центральный Google Scholar
Лемос де Матос А., Франко Л.С., Макфадден Г. Онколитические вирусы и иммунная система: динамический дуэт. Mol Ther Methods Clin Dev. 2020; 17: 349–58. https://doi.org/10.1016/j.omtm.2020.01.001.
КАС Статья пабмед ПабМед Центральный Google Scholar
Harrington K, Freeman DJ, Kelly B, Harper J, Soria JC. Оптимизация онколитической виротерапии в лечении рака. Nat Rev Drug Discov. 2019; 1: 689–706. https://doi.org/10.1038/s41573-019-0029-0.
КАС Статья Google Scholar
Фан М., Уотсон М.Ф., Ален Т., Диалло Дж.С.Онколитические вирусы на лекарствах: достижение большей терапевтической эффективности. ACS Infect Dis. 2018;4:1448–677. https://doi.org/10.1021/acsinfecdis.8b00144.
КАС Статья пабмед Google Scholar
Мартуза Р.Л., Малик А., Маркерт Дж.М., Руффнер К.Л., Коэн Д.М. Экспериментальная терапия глиомы человека с помощью генно-инженерного вируса-мутанта. Наука. 1991; 252:854–6. https://doi.org/10.1126/science.1851332.
КАС Статья пабмед Google Scholar
Ю Ф, Ван С, Го ЗС, Бартлетт ДЛ, Готшалк С.М., Сонг ХТ. Онколитический вирус коровьей оспы, вооруженный Т-клеточным активатором, значительно усиливает противоопухолевую терапию. Мол Тер. 2014;22:102–11. https://doi.org/10.1038/mt.2013.240.
КАС Статья пабмед Google Scholar
Wang P, Li X, Wang J, et al. Редизайн интерлейкина-12 для повышения его безопасности и потенциала в качестве противоопухолевого иммунотерапевтического средства. Нац коммун. 2017;8:1395.https://doi.org/10.1038/s41467-017-01385-8.
КАС Статья пабмед ПабМед Центральный Google Scholar
Li L, Liu S, Han D, Tang B, Ma J. Доставка и биобезопасность онколитической виротерапии. Фронт Онкол. 2020;10:475. https://doi.org/10.3389/fonc.2020.00475.
Артикул пабмед ПабМед Центральный Google Scholar
Кешаварз М., Саббаги А., Мири С.М., Резаеян А., Арджейни Ю., Гаэми А.Виротераностика, двуствольное вирусное ружье, нацеленное на рак; готовы стрелять? Раковая ячейка Интерн. 2020;20:131. https://doi.org/10.1186/s12935-020-01219-6.
Артикул пабмед ПабМед Центральный Google Scholar
Franzen S, Lommel SA. Борьба с раком с помощью «умных бомб»: оснащение наночастицами растительного вируса для миссии «найти и уничтожить». Наномедицина (Лонд). 2009; 4: 575–88. https://doi.org/10.2217/nnm.09.23.
КАС Статья Google Scholar
Ломоносов Г.П., Эванс Д.Дж. Применение вирусов растений в бионанотехнологии. URR Top Microbiol Immunol. 2014; 375:61–87. https://doi.org/10.1007/82_2011_184.
КАС Статья Google Scholar
Steele JFC, Peyret H, Saunders K, et al. Синтетическая вирусология растений для нанобиотехнологии и наномедицины.Wiley Interdiscip Rev Nanomed Nanobiotechnol. 2017;9:e1447. https://doi.org/10.1002/wnan.1447.
Артикул ПабМед Центральный Google Scholar
Cao J, Guenther RH, Sit TL, Opperman CH, Lommel SA, Willoughby JA. Механизм загрузки и высвобождения растительных вирусных наночастиц, полученных из вируса некротической мозаики красного клевера, для доставки лекарственного средства доксорубицина. Маленький. 2014;10:5126–36. https://doi.org/10.1002/smll.201400558.
КАС Статья пабмед Google Scholar
Чапар А.Е., Штейнмец Н.Ф. Вирусы растений и бактериофаги для доставки лекарств в медицине и биотехнологии. Curr Opin Chem Biol. 2017; 38:108–16. https://doi.org/10.1016/j.cbpa.2017.03.013.
КАС Статья пабмед ПабМед Центральный Google Scholar
Madden AJ, Oberhardt B, Lockney D, et al. Фармакокинетика и эффективность наночастиц растительного вируса, нагруженных доксорубицином, в доклинических моделях рака. Наномедицина (Лондон).2017;12:2519–32. https://doi.org/10.2217/nnm-2016-0421.
КАС Статья Google Scholar
Брукман М.А., Чапар А.Е., Штейнмец Н.Ф. Наночастицы на основе растительного вируса, содержащие лекарство, для доставки лекарств от рака. Методы Мол Биол. 2018; 1776: 425–36. https://doi.org/10.1007/978-1-4939-7808-3_28.
КАС Статья пабмед Google Scholar
Cao J, Guenther RH, Sit TL, Lommel SA, Opperman CH, Willoughby JA.Разработка наночастиц растительного вируса, нагруженных абамектином, для эффективной борьбы с нематодами, паразитирующими на растениях. Интерфейсы приложений ACS. 2015;7:9546–53. https://doi.org/10.1021/acsami.5b00940.
КАС Статья пабмед Google Scholar
Guenther RH, Lommel SA, Opperman CH, Sit TL. Наночастицы на основе вирусов растений для доставки агрономических составов в виде концентрата суспензии. Методы Мол Биол. 2018;1776:203–14.https://doi.org/10.1007/978-1-4939-7808-3_13.
КАС Статья пабмед Google Scholar
Chariou PL, Dogan AB, Welsh AG, Saidel GM, Baskaran H, Steinmetz NF. Подвижность синтетических и вирусных модельных нанопестицидов в почве. Нац Нанотехнолог. 2019;14:712–8. https://doi.org/10.1038/s41565-019-0453-7.
КАС Статья пабмед ПабМед Центральный Google Scholar
Ву З., Медликотт, Нью-Джерси, Раззак М., Такер И.Г. Разработка и оптимизация экспресс-метода ВЭЖХ для анализа рикобендазола и альбендазолсульфона в плазме овец. Джей Фарм Биомед Анал. 2005; 39: 225–32. https://doi.org/10.1016/j.jpba.2005.03.010).
КАС Статья пабмед Google Scholar
Nakashima N, Tamura T, Good L. Парные концы стабилизируют антисмысловые РНК и усиливают условное замалчивание генов в Escherichia coli.Нуклеиновые Кислоты Res. 2006;34:e138. https://doi.org/10.1093/nar/gkl697.
КАС Статья пабмед ПабМед Центральный Google Scholar
Солер Бистуэ А.Дж., Ха Х., Сарно Р., Дон М., Зоррегьета А., Толмаски М.Э. Внешние направляющие последовательности, нацеленные на мРНК aac(6′)-Ib, индуцируют ингибирование устойчивости к амикацину. Противомикробные агенты Chemother. 2007; 51: 1918–25. https://doi.org/10.1128/AAC.01500-06.
КАС Статья пабмед Google Scholar
Крткова Й, Паредес АР. Использование морфолино, блокирующих трансляцию, для нокдауна гена Giardia lamblia. Методы Мол Биол. 2017;1565:123–40. https://doi.org/10.1007/978-1-4939-6817-6_11.
КАС Статья пабмед Google Scholar
Zhang X, Kim CY, Worthen T, Witola WH. Опосредованное морфолином подавление in vivo лактатдегидрогеназы Cryptosporidium parvum снижает выделение ооцист и инфекционность. Int J Паразитол.2018; 48: 649–56. https://doi.org/10.1016/j.ijpara.2018.01.005.
КАС Статья пабмед ПабМед Центральный Google Scholar
Zhang WW, Matlashewski G. CRISPR-Cas9-опосредованное редактирование генома у leishmania donovani. мБио. 2015;6:e00861. https://doi.org/10.1128/mBio.00861-15.
КАС Статья пабмед ПабМед Центральный Google Scholar
Кудыба Х.М., Кобб Д.В., Флорентин А., Краковяк М., Муралидхаран В. Редактирование генов CRISPR/Cas9 для создания условных мутантов малярийного паразита человека P. falciparum . J Vis Exp. 2018;139:57747. https://doi.org/10.3791/57747.
Артикул Google Scholar
Янссен Б.Д., Чен Ю.П., Молгора Б.М., Ван С.Е., Симоес-Барбоза А., Джонсон П.Дж. CRISPR/Cas9-опосредованная модификация гена и нокаут гена у инфекционного паразита человека Trichomonas vaginalis .Научный представитель 2018; 8: 270. https://doi.org/10.1038/s41598-017-18442-3.
КАС Статья пабмед ПабМед Центральный Google Scholar
Макиналли С.Г., Хаген К.Д., Носала С., Уильямс Дж., Нгуен К., Букер Дж., Джонс К., Доусон С.К. Надежная и стабильная репрессия транскрипции у Giardia с использованием CRISPRi. Мол Биол Селл. 2019;30:119–30. https://doi.org/10.1091/mbc.E18-09-0605.
КАС Статья пабмед ПабМед Центральный Google Scholar
Qi LS, Larson MH, Gilbert LA, et al. Перепрофилирование CRISPR в качестве управляемой РНК платформы для специфичного для последовательности контроля экспрессии генов. Клетка. 2013; 152:1173–83. https://doi.org/10.1016/j.cell.2013.02.022.
КАС Статья пабмед ПабМед Центральный Google Scholar
Дэн М., Ван А.Л., Ван К.С. Ингибирование экспрессии гена пируват-ферредоксин-оксидоредуктазы в Giardia lamblia вирусопосредованным рибозимом «головка молотка».Мол микробиол. 2000;36(2):447–56. https://doi.org/10.1046/j.1365-2958.2000.01863.x.
КАС Статья пабмед Google Scholar
Скотт В.Г. Чему новые структуры рибозимов с головкой молота могут научить нас в дизайне? В: Erdmann VA, Barciszewski J, редакторы. РНК-технологии и их применение. РНК-технологии. Берлин: Спрингер; 2010. с. 305–323.
Глава Google Scholar
Дхейли Н.М., Мартинес Мартинес Дж., Росарио К., Бриндли П.Дж., Фихорова Р.Н., Кэй Дж.З. и др. Проект микробиома паразитов: большие задачи. PLoS Патог. 2019;15:e1008028. https://doi.org/10.1371/journal.ppat.1008028.
КАС Статья пабмед ПабМед Центральный Google Scholar
Хан М.А., Дхейли Н.М. Экспериментальные модели для изучения роли микробов во взаимодействиях паразит-хозяин. Фронт микробиол. 2016;7:1300.https://doi.org/10.3389/fmicb.2016.01300.
Артикул пабмед ПабМед Центральный Google Scholar
Kraft MR, Klotz C, Bücker R, Schulzke JD, Aebischer T. Взаимодействие эпителиальных клеток Giardia in vitro: имитация бессимптомной инфекции? Front Cell Infect Microbiol. 2017;7:421. https://doi.org/10.3389/fcimb.2017.00421.
КАС Статья пабмед ПабМед Центральный Google Scholar
Каранис П. Правда о культуре in vitro видов Cryptosporidium. Паразитология. 2018; 145:855–64. https://doi.org/10.1017/S0031182017001937.
Артикул пабмед Google Scholar
Брейнер Н.М., Хехт М., Нитц Н., Роуз Э., Карвальо Дж.Л. Модели in vitro для исследования взаимодействия хозяин-паразит — возможное применение при острой болезни Шагаса. Acta Trop. 2020;202:105262. https://doi.org/10.1016/j.actatropica.2019.105262.
Артикул пабмед Google Scholar
Пасини Э.М., Зееман А.М., Ворберг-ВАН ДЕР Вел А, Коккен ЧМ. Plasmodium knowlesi: актуальная универсальная экспериментальная модель малярии. Паразитология. 2018;145:56–70. https://doi.org/10.1017/S0031182016002286.
Артикул пабмед Google Scholar
Адамс М.Дж., Лефковиц Э.Дж., Кинг А.М., Карстенс Э.Б.Голосование по таксономическим предложениям в Международный комитет по таксономии вирусов (2014 г.). Арх Вирол. 2014;159:2831–41. https://doi.org/10.1007/s00705-014-2114-3.
КАС Статья пабмед Google Scholar
простейшие | микроорганизм | Британика
простейшие , организм, обычно одноклеточный и гетеротрофный (использующий органический углерод в качестве источника энергии), принадлежащий к любой из основных линий простейших и, как и большинство простейших, обычно микроскопический.Все простейшие являются эукариотами и, следовательно, обладают «настоящим» или мембраносвязанным ядром. Они также неволокнистые (в отличие от таких организмов, как плесень, группа грибов, у которых есть нити, называемые гифами), и ограничены влажными или водными средами обитания, будучи повсеместными в таких средах по всему миру, от Южного полюса до Северного полюса. Многие из них являются симбионтами других организмов, а некоторые виды являются паразитами.
Современные ультраструктурные, биохимические и генетические данные сделали термин простейших весьма проблематичным.Например, простейшее исторически относилось к протистам, обладающим звероподобными чертами, такими как способность передвигаться по воде, как если бы они «плавали», как животные. Простейшие традиционно считались прародителями современных животных, но современные данные показали, что это не относится к большинству простейших. Фактически, современная наука показала, что простейшие представляют собой очень сложную группу организмов, которые не обязательно имеют общую эволюционную историю.Эта неродственная или парафилетическая природа простейших заставила ученых отказаться от термина простейших в формальных схемах классификации. Следовательно, подцарство Protozoa теперь считается устаревшим. Сегодня термин простейших неофициально используется в отношении ненитевидных гетеротрофных простейших.
амебаамеба (увеличено).
Расс Кинн/Photo ResearchersБританская викторина
Викторина «Все о биологии»
Как по-другому называется так называемая морская оса? На каком континенте обитают две самые ядовитые ящерицы? Проверьте свои навыки в ответах на эти и другие вопросы в этой викторине, посвященной биологии.
К широко известным простейшим относятся репрезентативные динофлагелляты, амебы, парамеции и возбудитель малярии Plasmodium .
Особенности простейших
Наблюдение за простейшими микроорганизмами из капли прудовой воды под оптическим и электронным микроскопом
Парамеции и другие одноклеточные организмы в прудовой воде.
Encyclopædia Britannica, Inc. Просмотреть все видео к этой статьеХотя простейшие больше не признаются в качестве формальной группы в современных системах биологической классификации, простейшие все еще могут быть полезны в качестве строго описательного термина.Простейшие объединены гетеротрофным способом питания, а это означает, что эти организмы получают углерод в восстановленной форме из окружающей среды. Однако это не уникальная особенность простейших. Кроме того, это описание не так просто, как кажется. Например, многие протисты являются миксотрофами, способными как к гетеротрофии (вторичное получение энергии за счет потребления других организмов), так и к автотрофии (первичное получение энергии, например, за счет захвата солнечного света или метаболизма химических веществ в окружающей среде).Примеры простейших миксотрофов включают многие хризофиты. Некоторые простейшие, такие как Paramecium bursaria , развили симбиотические отношения с эукариотическими водорослями, в то время как амеба Paulinella chromatophora , по-видимому, приобрела автотрофию в результате относительно недавнего эндосимбиоза цианобактерий (сине-зеленая водоросль). Следовательно, многие простейшие либо сами осуществляют фотосинтез, либо извлекают выгоду из фотосинтетических способностей других организмов. Однако некоторые водорослевые виды простейших утратили способность к фотосинтезу (например,g., видов Polytomella и многих динофлагеллят), что еще больше усложняет понятие «простейшие».
представитель простейшихпредставитель простейших. Фитофлагеллята Gonyaulax является одним из динофлагеллят, ответственных за возникновение красных приливов. Зоофлагеллята Trypanosoma brucei является возбудителем африканской сонной болезни. Амеба — один из самых распространенных саркодинов. Другие представители подтипа Sarcodina, такие как радиолярии, гелиозои и фораминиферы, обычно обладают защитным покровом.Светлячок Pinaciophora показан покрытым чешуей. Тип Ciliophora, который включает реснитчатые Tetrahymena и Vorticella, , содержит наибольшее количество видов простейших, но является наиболее однородной группой. Возбудитель малярии Plasmodium распространяется через укус комара, который впрыскивает инфекционные споры (спорозоиты) в кровоток.
© Merriam-Webster Inc.Простейшие подвижны; почти у всех есть жгутики, реснички или псевдоподии, которые позволяют им ориентироваться в водной среде обитания.Однако эта общность не является уникальной чертой простейших; например, организмы, которые явно не являются простейшими, также производят жгутики на разных стадиях своего жизненного цикла (например, большинство бурых водорослей). Простейшие также строго немногоклеточны и существуют либо в виде одиночных клеток, либо в виде клеточных колоний. Тем не менее, некоторые колониальные организмы (например, Dictyostelium discoideum , надгруппа Amoebozoa) демонстрируют высокий уровень клеточной специализации, граничащий с многоклеточностью.
Описательные рекомендации, представленные выше, исключают многие организмы, такие как жгутиковые фотосинтезирующие таксоны (ранее Phytomastigophora), которые считались простейшими в соответствии с более ранними классификационными схемами. Организмы, соответствующие современному определению простейших, встречаются во всех основных группах протистов, признанных протистологами, что отражает парафилетическую природу простейших.
Узнайте, как отдельные реснички используют вязкое сопротивление для координации силовых и восстановительных движений при передвижении.
Encyclopædia Britannica, Inc. Просмотреть все видео к этой статьеНаиболее важные группы свободноживущих простейших встречаются в нескольких основных эволюционных кластерах протистов, включая инфузорий (надгруппа Chromalveolata), лопастных амеб (надгруппа Amoebozoa), нитевидные амебы (надгруппа Rhizaria), криптомонады (надгруппа Chromalveolata), раскопки (надгруппа Excavata), опистоконты (надгруппа Opisthokonta) и эвглениды (Euglenozoa).Эти группы организмов важны с экологической точки зрения из-за их роли в микробных циклах питательных веществ и встречаются в самых разных средах, от земных почв до пресноводных и морских местообитаний, водных отложений и морского льда. К важным простейшим паразитам относятся представители Apicomplexa (надгруппа Chromalveolata) и трипаносомы (Euglenozoa). Организмы из этих групп являются возбудителями таких заболеваний человека, как малярия и африканская сонная болезнь. Из-за распространенности этих патогенов человека и экологической важности упомянутых выше групп свободноживущих простейших об этих группах известно много.Поэтому эта статья посвящена биологии этих сравнительно хорошо изученных простейших. В конце этой статьи приводится краткое изложение современной схемы классификации протистанов.
Влияние на исходы инфекций и заболеваний
Инфекции паразитическими простейшими обычно связаны с изменениями в структуре и составе комменсальных бактерий. Путем отдельного изучения внутриклеточных и внеклеточных форм паразитических простейших во время их развития у человека в этом разделе обзора раскрываются тесные отношения между хозяином, нативной бактериальной микробиотой и простейшими, которые влияют на исходы многих из этих важных с медицинской точки зрения инфекций.
Внутриклеточные паразитические простейшие
Паразитические простейшие, в основном внутриклеточные, специализируются на уклонении от иммунного ответа и манипулировании им. По этой причине эти инфекции часто приводят к иммунопатологиям, при которых течение заболевания будет зависеть от типа и уровня иммунного ответа. В этом сценарии потенциальное преимущество микробиоты человека заключается в обеспечении более эффективного иммунного ответа против инфекций [3]. Хотя такие корреляции были обнаружены, влияние микробиоты на иммунный ответ хозяина на протозойные инфекции было изучено только в нескольких примерах, как обсуждается ниже.
Apicomplexans (тип Apicomplexa) являются облигатными внутриклеточными паразитами, демонстрирующими необычный тип подвижности и ассоциированные органеллы, необходимые для инвазии клетки-хозяина. Они также содержат уникальную органеллу пластидного типа (апикопласт) и демонстрируют бесполый и половой способы размножения с образованием спор. Кокцидии представляют собой верхушечные паразиты, которые используют эпителиальные клетки кишечника позвоночных (включая человека) в качестве временной или конечной среды обитания. Воздействие кишечных микробов на заражение кокцидиями-паразитами Cryptosporidium и Eimeria вариабельно и неясно.У Cryptosporidium parvum , оппортунистического кишечного кокцидиозного паразита человека, у стерильных и иммунодефицитных мышей через несколько недель развиваются тяжелые инфекции, что резко контрастирует с теми же иммунодефицитными мышами, имеющими нормальную микробиоту [11]. С другой стороны, некоторые виды Eimeria (кишечные кокцидиевые паразиты многих позвоночных) не могут заразить безмикробных животных по сравнению с животными, выращенными традиционным способом и колонизированными микробами [12,13].
Т . gondii является модельным организмом среди апикомплексных паразитов. Он вызывает токсоплазмоз, который, несмотря на клинически бессимптомное течение в подавляющем большинстве случаев, является наиболее распространенной паразитарной инфекцией человека во всем мире [14]. Очень удачное распространение T . gondii в человеческой популяции зависит от его необычной биологии и того, как люди реагируют на эту инфекцию, как описано ниже. Как никакие другие внутриклеточные паразитические простейшие, T . gondii является чрезвычайно универсальным хозяином, способным внедряться и размножаться в любой ядерной клетке любого теплокровного животного.Кроме того, Т . gondii легко передается человеку при проглатывании либо устойчивых к окружающей среде спор, выделяемых из кошачьих фекалий, либо псевдоцист, присутствующих в зараженном мясе из различных источников. Наконец, что не менее важно, защитный и Th2-поляризованный адаптивный иммунный ответ обычно развивается у иммунокомпетентных лиц [15,16], и инфекции у человека в большинстве случаев становятся клинически бессимптомными. Кишечные комменсальные бактерии могут в значительной степени способствовать развитию этого защитного иммунного ответа и связанной с ним патологии [17], как обсуждается ниже (рис. 2).
Рис. 2. Инициация врожденного иммунного ответа слизистой оболочки через дендритные клетки против инфекции Toxoplasma gondii у мышей.
Белок MyD88-адаптор толл-подобного рецептора (TLR) является ключевым элементом защитного ответа, основанного на продукции IL-12. Секреция IL-12 запускает эффективный клеточный иммунный ответ с продукцией INF-γ и активацией профиля Т-лимфоцитов Th2. (A) Этот врожденный ответ в основном зависит от TLR11, который образует эндолизосомальные димеры с TLR12, которые распознают профилин из T . гондии . Это распознавание играет центральную роль в иммунитете слизистых оболочек, запускающем выработку IL-12. (B) Однако в отсутствие TLR11 этот ответ по-прежнему минимально и в достаточной степени компенсируется косвенной стимуляцией, обеспечиваемой кишечными микробными комменсалами через TLR2, TLR4 и TLR9 [44]. В этом случае разрушение клеток, вызванное инфекцией, и дисбактериоз кишечника, по-видимому, вызывают потерю толерантности к кишечным комменсалам. Когда микробиота кишечника сильно снижается при длительном лечении антибиотиками, можно сделать следующие наблюдения: (C) мыши дикого типа, экспрессирующие TLR11, демонстрируют сниженный, но не исчезнувший ответ IL-12.Эти животные все еще могут вырабатывать иммунитет Th2. (D) Мыши с нокаутом TLR11 неспособны вызывать ответы IL-12 против этого паразита, и иммунитет Th2 серьезно нарушен. В заключение, кишечные комменсалы служат естественными молекулярными адъювантами во время T . инфекция gondii .
https://doi.org/10.1371/journal.pntd.0004176.g002
Когда T . gondii достигает кишечника человека с нативной и функциональной микробиотой, иммунный ответ инициируется на уровне слизистой оболочки кишечника путем активации толл-подобных рецепторов (TLR) в дендритных клетках (ДК) (рис. 2).Исследования in vitro указывают на участие различных TLR, таких как TLR2, TLR3, TLR4, TLR7 и TLR9, в ответ на T . gondii инфекции [18]. Однако эксперименты на мышах показывают, что распознавание T . Профилин gondii с помощью димера TLR11/12 играет ключевую роль в иммунном ответе против оральной инфекции (рис. 2А и 2С) [18,19]. Профилин является основным лигандом паразита, который активирует TLR11. Поскольку профилин является внутриклеточным белком, он либо высвобождается по неизвестному механизму, либо поглощается DC, когда они фагоцитируют мертвых паразитов и остатки.Это распознавание активирует фактор транскрипции интерферон (INF) регуляторный фактор 8, что приводит к продукции интерлейкина 12 (IL-12) [20,21]. IL-12 способствует клеточному иммунитету с продукцией INF-γ естественными клетками-киллерами и дифференцировкой Т-лимфоцитов Th2. Как описано ниже, эти клетки и молекулы играют роль в иммунопатогенезе T . gondii инфекций, а также необходимы для инициации адаптивной фазы иммунного ответа [18].
Этот ответ IL-12 у мышей зависит от TLR-адаптера MyD88 и миелоидного фактора дифференцировки 88 [22].Эта молекула играет центральную роль в иммунном ответе против T . gondii оральная инфекция (рис. 2). У мышей с генетической аблацией MyD88 ответ IL-12 отсутствует, и эти мыши с нокаутом погибают в течение двух недель после оральной инфекции [23]. Молекулы адаптера TLR, такие как MyD88, могут реагировать на многие типы TLR. MyD88 инициирует различные внутриклеточные сигнальные пути, но результирующий баланс костимулирующих молекул зависит от контекста лигандов TLR [24].В контексте TLR11/12 он запускает высвобождение IFN-γ через путь NF-κB, который стимулирует макрофаги и CD8α — ДК, «примирующие» иммунный ответ [18].
Важно отметить, что мыши TLR11 -/- не полностью нарушены, чтобы реагировать на T . gondii , пока присутствуют кишечные симбиотические бактерии (рис. 2B и 2D). В присутствии кишечных комменсалов (рис. 2B) сохраняется частичная резистентность со сниженным, но существующим ответом IL-12, который достаточен для производства аналогичных количеств INF-γ по сравнению с мышами дикого типа.Следовательно, мышей TLR11 -/- выживают в острой фазе инфекции. Когда мышей TLR11 -/- лечат антибиотиками с целью уничтожения кишечных симбиотических бактерий, этот оставшийся защитный ответ IL-12 теряется (рис. 2D). Этот защитный ответ можно снять пероральным введением бактериального липополисахарида (ЛПС) [17]. Кроме того, мыши с нокаутом TLR указывают на участие TLR2, TLR4 и TLR9 в способности устанавливать минимально достаточный ответ INF-γ на паразита.Все эти TLR зависят от MyD88, но не отвечают на T . gondii инфекция per se. ЛПС, например, является бактериальным агонистом TLR4. Следовательно, кишечные комменсальные бактерии функционируют как естественный молекулярный адъювант при оральной инфекции с помощью T . gondii , обеспечивающий непрямую стимуляцию ДК слизистой оболочки. Естественное сообщество кишечных микробов, по-видимому, необходимо, поскольку Bacteroides , многочисленный род кишечных бактерий, не может обеспечить эту стимуляцию в одиночку [17].
Повреждение эпителия в результате начальной репликации T . gondii внутри эпителиальных клеток кишечника, должно обеспечивать транслокацию люменных бактерий в собственную пластинку. Кроме того, Т . gondii оральная инфекция приводит к дисбиозу кишечника (т. е. бактериальному дисбалансу) с нарушением регуляции или потерей клеток Панета [19]. Эти специализированные эпителиальные клетки кишечника продуцируют антимикробные пептиды, которые важны для поддержания бактериального гомеостаза в кишечнике. Т . Дисбиоз, индуцированный gondii-, характеризуется снижением бактериального разнообразия кишечника со сдвигом в сторону грамотрицательных бактерий, являющихся ключевым источником ЛПС [19]. Комменсальный флагеллин, вездесущий и основной белок бактериального жгутика, также может быть источником непрямой стимуляции Т-лимфоцитов [25]. В целом ДК, по-видимому, вызывают потерю иммунологической толерантности к кишечной бактериальной флоре.
Эта непрямая иммунологическая стимуляция может быть важна для иммунопатологии T .Инфекция gondii у мышей. В отсутствие TLR11 кишечные бактерии не только обеспечивают достаточный Th2-ответ, но и предотвращают развитие иммунопатологии токсоплазмоза у орально инфицированных мышей [17]. У людей отсутствует функциональный TLR11, который обнаружен как псевдоген, а эквивалентный сенсор TLR для профилина не обнаружен. Кроме того, неясно, может ли один TLR12 выполнять роль TLR11 [18]. Участие других TLR и TLR-независимый механизм распознавания паразитов при оральных инфекциях человека еще не ясны [18].Между тем, заманчиво предположить интересный эволюционный сценарий с участием хозяина, паразита и бактериальной микробиоты. Коэволюция T . gondii , люди и микробиота их кишечника оказали большое влияние друг на друга, способствуя выживанию как хозяина, так и паразита. Коэволюция этой триады привела к сохранению хозяина, который характеризуется общим отсутствием опасных для жизни симптомов у инфицированных людей, и способствовала успешному распространению T . gondii в популяциях людей по всему миру.
Внеклеточные паразитические простейшие
Некоторые паразитические простейшие человека являются исключительно внеклеточными. Примерами являются Entamoeba histolytica , Giardia lamblia и Trichomonas vaginalis . Живя вне клеток и тканей человека, эти паразиты должны физически взаимодействовать с нативной микробиотой слизистой оболочки. Поддерживая тесные отношения и отношения сотрудничества между собой и с хозяином, нативная бактериальная микробиота кишечника человека и слизистой оболочки влагалища может представлять собой естественный барьер для инвазии патогенов.В этом разделе представлены взаимодействия между внеклеточными паразитическими простейшими и микробиотой слизистой оболочки человека, их эффекты и механизмы.
Е . histolytica представляет собой специфический для человека внеклеточный паразит, обнаруживаемый в просвете толстой кишки, месте с наибольшей плотностью бактериальной популяции у людей. Тяжесть амеобиаза связана со способностью этого паразита покидать просвет кишечника и разрушать слизистую оболочку кишечника, способствуя развитию геморрагической дизентерии и диссеминации в другие органы, тяжелому состоянию, известному как инвазивный или внекишечный амеобиаз [26].В ранних исследованиях вирулентность E . Было показано, что histolytica значительно усиливается кишечными бактериями в моделях животных с контролируемой микробиотой [27,28]. Дальнейшее понимание этой микробной взаимосвязи было получено в экспериментальных условиях in vitro и в лабораторных условиях [29,30].
Модуляция E . histolytica вирулентность кишечных бактерий зависит от времени, вида или штамма бактерий и штамма паразита [31–35].Бактериальный штамм Escherichia coli серотипа O55 прочно связывается с поверхностным лектином Gal/GalNAc E . histolytica из-за естественного поверхностного углеводного состава, богатого галактозой и N-ацетилгалактозамином. Распознавание E . coli O55 по E . histolytica через Gal/GalNAc, центральный фактор вирулентности этой амебы, усиливает ее вирулентность в первый час, вероятно, в результате активации нижестоящих путей, запускаемых распознаванием Gal/GalNAc.Однако в течение первого месяца моноасенального культивирования происходит значительное снижение вирулентности, которое восстанавливается через три месяца дальнейшего совместного культивирования. Это влияние на вирулентность амебы наблюдалось на разных уровнях, таких как регуляция экспрессии Gal/GalNAc, фагоцитоз, протеолиз, адгезия и цитотоксичность. Взаимодействие между этим паразитом и эндогенными бактериями вызывает существенные изменения в экспрессии генов амебы, что позволяет предположить, что некоторые из этих бактерий могут также играть роль в питании, поддерживающем рост амеб [31,34].
Прочие кишечные и некишечные патогенные бактерии, включая E . coli , Shigella dysenteriae и Staphylococcus aureus также способствуют существенным изменениям в обоих E . histolytica вирулентность и реакция хозяина. Значительное усиление вирулентных свойств E . histolytica наблюдали увеличение экспрессии Gal/GalNAc, протеолиза, адгезии и цитотоксичности. Примечательно, что это усиление вирулентности амебы наблюдалось только с этими патогенными бактериями, а не с непатогенными комменсалами E . кишечная палочка . Кроме того, Entamoeba dispar (кишечная непатогенная амеба, тесно связанная с E . histolytica ) не могла усиливать эти эффекты даже в сочетании с теми же патогенными бактериями. Важно отметить, что эти патогенные бактерии также изменили реакцию хозяина в отношении функции эпителиального барьера, хемоаттракции нейтрофилов и воспалительной реакции [32,35]. В целом вышеупомянутые исследования показывают, что синергетическое воздействие некоторых кишечных бактерий на реакцию хозяина и паразита может создать среду, более подходящую для инвазии паразита, что может способствовать развитию заболевания.Поскольку микробиом кишечника человека представляет собой сложную систему, включающую по крайней мере сотни видов бактерий, эти первоначальные наблюдения могут по-прежнему представлять собой чрезмерное упрощение того, что происходит при кишечных инфекциях на E . histolytica в естественных условиях.
Giardia lamblia — еще одно внеклеточное паразитическое простейшее, обнаруженное в просвете кишечника человека. Однако, в отличие от E . гистолитика , G . lamblia не является инвазивным и обитает в тонком кишечнике, где микроорганизмы не так многочисленны [36]. Лица с G . Инфекция lamblia (например, лямблиоз) демонстрирует изменения в бактериальном составе верхних отделов пищеварительного тракта [37,38]. Бактериальная микробиота кишечника потенциально может влиять на исходы лямблиоза, но неясно, являются ли эти микробные изменения причиной или следствием. Хотя лактобациллы могут ингибировать G . lamblia пролиферации in vitro [39] или могут помочь в качестве пробиотического вмешательства в животных моделях [40–42], неясно, являются ли эти бактерии аутохтонными или коренными жителями участка G . лямблии инфекция у человека. Интригующий отчет показал, что естественная устойчивость к G . Инфекция lamblia между мышами сходного генетического происхождения, но происходящими от разных заводчиков, может передаваться между этими животными исключительно при совместном содержании животных в течение нескольких недель [43].Хотя лечение антибиотиками и частичная характеристика этих микробных сообществ предполагают защитную роль кишечной микробиоты, механизмы, лежащие в основе устойчивости к G . Инфекция lamblia у этих животных остается неуловимой. Существующие данные еще не проясняют роль микробиоты кишечника при лямблиозе.
Т . vaginalis — единственное простейшее, паразитирующее в половых путях человека. Он вызывает трихомониаз, наиболее распространенную в мире инфекцию невирусной этиологии, передающуюся половым путем [2].Во влагалище женщин детородного возраста этот внеклеточный паразит вторгается в естественную среду обитания плотного и устойчивого сообщества бактерий. Вагинальный микробиом 396 бессимптомных женщин из Северной Америки недавно был охарактеризован по пяти типам состояния сообщества (рис. 1, круговая диаграмма). В четырех из них преобладают разные виды Lactobacillus — L . вкладыши , л . хрустящий , L . gasseri и L . jensenii — с относительно высоким (и почти исключительным) обилием таксонов. За исключением L . iners , лактобактерии слабо представлены в пятом типе сообщества, который преимущественно состоит из анаэробных бактерий, таких как Atopobium vaginae , Prevotella bivia , Megasphaera sp., Sneathia sp., и sp. [9]. Одиннадцать случаев бессимптомного T . вагинальные инфекции (т.э., 2,8%) были обнаружены в этой группе женщин [44]. Наблюдаем за распределением T . vaginalis среди этих типов бактериальных сообществ можно сделать два важных наблюдения. Во-первых, во влагалище была низкая численность лактобацилл 73% от Т . vaginalis — инфицированные женщины (8/11), что согласуется с предыдущими клиническими отчетами [45]. Исключение, опять же, составил L . iners , который был обнаружен при обилии таксона >80% во влагалище 18% T . vaginalis – инфицированных женщин (2/11). Во-вторых, те Т . vaginalis инфекций с отсутствием лактобацилл (8/11) были связаны с пятым типом сообщества, содержащим в основном анаэробные бактерии. Такой микробный сдвиг с исключением лактобактерий и более высокой распространенностью этих анаэробов обычно связан с распространенным заболеванием, известным как бактериальный вагиноз (БВ). л . iners также были связаны с этим состоянием [46].
Однако следует добавить предостережение.Во-первых, это представление бессимптомной популяции с относительно небольшим количеством T . vaginalis инфекций (11/396). Во-вторых, БВ является распространенным заболеванием среди афроамериканцев [47], и эта когорта была широко представлена в этом исследовании [9,44]. Могут потребоваться дополнительные метагеномные исследования с участием различных этнических групп, чтобы однозначно подтвердить существование строгой связи между T . vaginalis инфекции и специфического вагинального микробного сообщества.Если такая микробная ассоциация существует, можно сделать две гипотезы: (i) Lactobacilli и T . vaginalis являются конкурентами, антагонистически взаимодействующими в своей естественной среде; (ii) бактерии BV и T . vaginalis взаимодействуют совместно, и заболевание трихомониаз может быть результатом взаимодействия T . vaginalis с одним или несколькими типами бактерий BV.
Используя модели полимикробной инфекции в культуре тканей, два недавних исследования подтверждают вышеизложенную гипотезу [48,49].Во-первых, T . Было обнаружено, что vaginalis снижает количество Lactobacillus acidophilus , L . jensenii и L . crispatus [48]. Во-вторых, Т . Адгезия vaginalis к человеческим клеткам (ключевой аспект его вирулентности) значительно ингибировалась L . gasseri штаммоспецифическим и контактно-зависимым образом [49]. Наконец, было обнаружено, что две распространенные BV-ассоциированные бактерии, Atopobium и Gardnerella , вызывают синергетическое усиление T . vaginalis -индуцированные хемокины [48]. Кроме того, клинические изоляты T . vaginalis часто содержат микоплазмы. Mycoplasma hominis , в частности, часто ассоциируется с усиленным воспалением при трихомониазе [50].

 Vaginalis -полосные предметы
Vaginalis -полосные предметы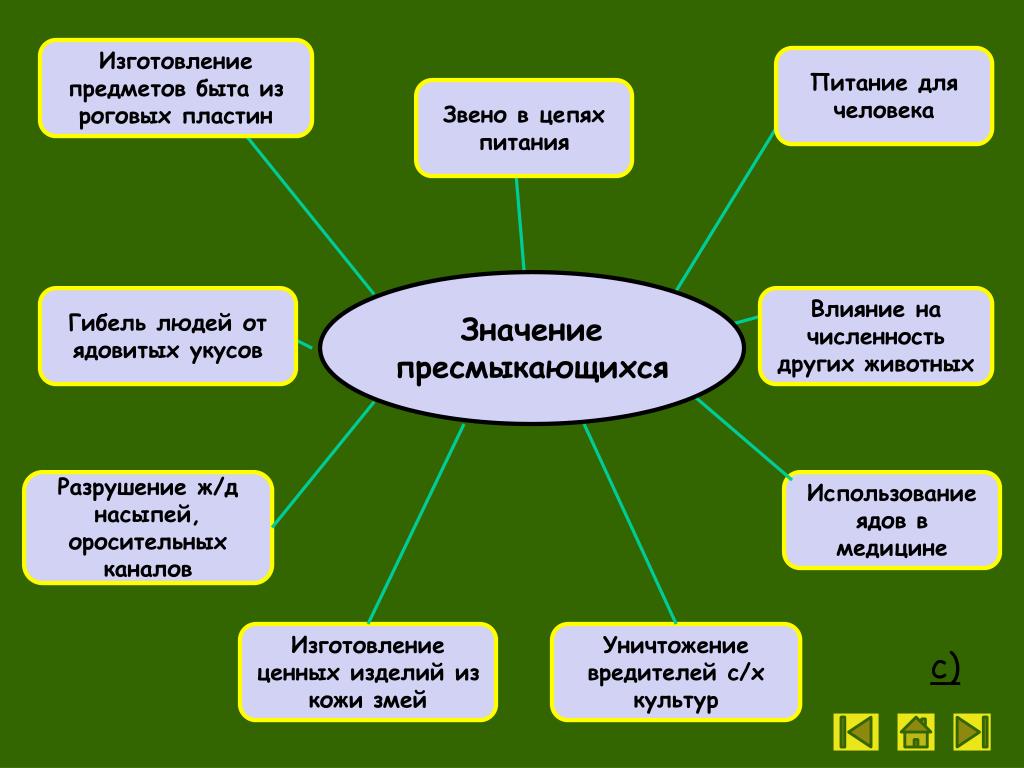 Некоторые считают, что к гельминтам относятся также сегментированные черви (кольчатые черви) — единственными важными с медицинской точки зрения являются пиявки.Следует отметить, что эти организмы обычно не считаются паразитами.
Некоторые считают, что к гельминтам относятся также сегментированные черви (кольчатые черви) — единственными важными с медицинской точки зрения являются пиявки.Следует отметить, что эти организмы обычно не считаются паразитами. Жгутики двигаются подобно хлысту, создавая волны, которые раскручивают микроб.
Жгутики двигаются подобно хлысту, создавая волны, которые раскручивают микроб.