что это такое и применение энзимов в косметике
Что такое энзимы
Энзимы, или ферменты, — это белки-катализаторы, то есть ускорители всех биохимических реакций, проистекающих в организме. По сути, они управляют всеми жизненными процессами и, как и все белки, представляют собой цепочку аминокислот. На сегодняшний день у человека обнаружено более 3000 ферментов. Около 400 разновидностей энзимов научились синтезировать и производить, используя животный и растительный материал. Сегодня энзимы применяются:
-
в пищевой промышленности;
-
бытовой химии;
-
медицине;
-
фармакологии.
В косметике и косметологии нашли применение лишь некоторые ферменты. Их число невелико, ведь контролировать деятельность этих крайне капризных молекул, способных к тому же увеличивать скорости реакций до космических, — весьма непростая задача.
Проверьте, какая косметика нужна вам прямо сейчас, ответив на вопросы теста.
Вернуться к оглавлениюВоздействие энзимов на организм
Каждую минуту в организме происходят миллионы биохимических реакций и метаморфоз, и ни одна из них не проходит без участия ферментов. Работа пищеварительного тракта, мышц (включая сердце), каждого органа и всех систем зависит от того, как поведут себя ферменты.
Энзимы заведуют обменом веществ, расщепляют сложные соединения на простые и решают, что с ними делать дальше: уничтожить за ненадобностью или пустить в оборот на благо общего дела, то есть жизни.Вернуться к оглавлению
Основные причины недостатка энзимов в организме
Энзимы бывают простые и сложные. Сложным энзимам для жизнедеятельности требуется союзник – кофермент. В этой роли выступают витамины и микроэлементы. Именно поэтому недостаток или избыток витаминов в целом негативно сказывается на здоровье, ведь ферменты, оставшись без партнера, не могут выполнять своих функций. Главными врагами энзимов считаются:
В этой роли выступают витамины и микроэлементы. Именно поэтому недостаток или избыток витаминов в целом негативно сказывается на здоровье, ведь ферменты, оставшись без партнера, не могут выполнять своих функций. Главными врагами энзимов считаются:
- 1
химически синтезированные добавки в продуктах питания;
- 2
воспалительные процессы в организме;
- 3
любая интоксикация;
- 4
курение;
- 5
стресс;
- 6
инфекции.
Для нормального функционирования ферментов организм должен получать достаточное количество витаминов и минералов, которыми богаты свежие овощи и фрукты. Нездоровое питание, вредные привычки и стрессы подавляют деятельность энзимов.
«Накормить» организм энзимами и запастись ими впрок – невозможно. Что, впрочем, не мешает использовать уникальные особенности этих белков для создания эффективных медицинских и косметических препаратов.
Частые гости в косметических формулах – энзимы экзотических фруктов
Свойства энзимов
Энзимы – это великая созидательная и разрушительная сила. В косметике и косметологии в основном используются ферменты-разрушители. В списке ингредиентов их можно легко узнать по окончанию «-аза». Исключение составляют только папаин и бромелайн – первопроходцы, появившиеся в косметическом мире еще до того, как ферменты были классифицированы.
У всех энзимов, независимо от специализации, есть общие свойства.
-
Активность в теплой среде
Им комфортно при температуре, близкой к температуре человеческого тела, – естественной для их жизнедеятельности.
-
Узкая направленность и избирательность
Каждая группа ферментов работает с определенным веществом: одни энзимы занимаются исключительно белками, другие – углеводами, третьи – жирами.

Виды энзимов
В косметике и косметологии используются энзимы преимущественно растительного происхождения. Наиболее распространенная сфера применения – эксфолиация. Действительно, энзимные или ферментные пилинги славятся своей способностью мягко и качественно отшелушивать роговые клетки. Но обновление кожи – не единственный эффект, которого ждут от ферментов.
В бьюти-сфере главная миссия энзимов – деликатное обновление кожи © iStock
Энзимы (ферменты) в косметике и косметологии
| Энзим (фермент) | Источник | Действие | Применение в косметике |
|
Папаин |
папайя |
Способствует разрушению белка (кератин), может вызвать раздражение. |
энзимные маски и пилинги |
| Бромелайн | ананас |
Способствует разрушению белковых связей, кератолитик. |
энзимные пилинги, обновляющие сыворотки |
| Трипсин и химотрипсин | биотехнологии | Разрушает протеины, в том числе в составе волосяных луковиц. | энзимная эпиляция |
| Липаза | злаки, бобовые, водоросли | Способствует расщеплению жиров. | средства для похудения, анти-целлюлитные гели, средства для очищения жирной кожи |
| Амилаза | биотехнологии | Способствует разрушению углеводов. | маски и пилинги для лечения жирной кожи и воспалений |
| Супероксиддисмутаза и оксиддисмутаза | биотехнологии | Способствует разрушению пероксида водорода | антиоксидант, используется в кремах для борьбы со свободными радикалами |
Ферменты (энзимы) — амилаза, протеазы, липаза
Ферменты (энзимы) — это белковые вещества, играющие очень важную роль в различных биохимических процессах в организме. Они необходимы для переваривания пищевых продуктов, стимуляции деятельности головного мозга, процессов энергообеспечения клеток, восстановления органов и тканей. Наиболее важной функцией ферментов является ускорение и запуск биохимических реакций в организме, многие, если не большинство, из которых, идут только в присутствии соответствующих энзимов. Функция каждого из ферментов уникальна, т.е. каждый фермент активизирует только один биохимический процесс. В связи с этим в организме существует огромное количество энзимов.
Они необходимы для переваривания пищевых продуктов, стимуляции деятельности головного мозга, процессов энергообеспечения клеток, восстановления органов и тканей. Наиболее важной функцией ферментов является ускорение и запуск биохимических реакций в организме, многие, если не большинство, из которых, идут только в присутствии соответствующих энзимов. Функция каждого из ферментов уникальна, т.е. каждый фермент активизирует только один биохимический процесс. В связи с этим в организме существует огромное количество энзимов.
В зависимости от того, какие виды реакций организма катализируют ферменты, они выполняют различные функции. Чаще всего их подразделяют на две основные группы: пищеварительные и метаболические.
 Различные виды амилазы расщепляют различные сахара. Протеазы, находящиеся в желудочном соке, панкреатическом секрете и в содержимом кишечника, помогают переваривать белки. Липаза, находящаяся в желудочном соке и панкреатическом секрете, расщепляет жиры.
Различные виды амилазы расщепляют различные сахара. Протеазы, находящиеся в желудочном соке, панкреатическом секрете и в содержимом кишечника, помогают переваривать белки. Липаза, находящаяся в желудочном соке и панкреатическом секрете, расщепляет жиры.Метаболические ферменты катализируют биохимические процессы внутри клеток. Каждый орган или ткань организма имеет свою сеть ферментов.
Некоторые виды пищевых продуктов содержат ферменты. К сожалению, ферменты очень чувствительны к высокой температуре и легко разрушаются при нагревании. Для того, чтобы организм получил дополнительное количество ферментов, следует или есть продукты, содержащие их, в сыром виде или принимать биологически активные пищевые добавки с такими ферментами.
Ферментами богаты продукты растительного происхождения: авокадо, папайя, ананасы, бананы, манго, ростки.
Большинство формул биологически активных пищевых добавок содержит различные пищеварительные ферменты и получены из продуктов животного или грибкового происхождения.
Обычно пищеварительные ферменты принимают после еды, но если вы едите продукты, прошедшие технологическую обработку или измельченные, то во время еды.
Все препараты и БАД, содержащие ферменты, следует хранить в прохладном месте. Таблетки и жидкости в холодильнике, порошок и капсулы — в сухом прохладном месте.
Вынужденная самоизоляция изменила привычный уклад жизни
Вынужденная самоизоляция изменила привычный уклад жизни. Но при этом всем нам хочется быть сильными и крепкими, не поддаваться панике, укрепить иммунитет, чтобы выстоять против сегодняшних невзгод! Диетологи X-Fit напомнили о важных помощниках, о которых многие даже не догадываются — это природные энзимы. Ещё их называют ферменты. Это особые белковые наноструктуры — главные участники всех биохимических процессов в живом организме. По сути, именно их количество и качественный состав определяют наше здоровье, успешность протекания всех процессов в организме и устойчивость к внешним факторам.
Ещё их называют ферменты. Это особые белковые наноструктуры — главные участники всех биохимических процессов в живом организме. По сути, именно их количество и качественный состав определяют наше здоровье, успешность протекания всех процессов в организме и устойчивость к внешним факторам.
В организме человека вырабатывается множество видов энзимов. Кстати, и витамины с микроэлементами также нужны для их построения. Без ферментов невозможно переваривание и усвоение пищи, не могут обновляться клетки, разрушаться токсины и яды, не может происходить очищение организма. Даже иммунная система не может правильно работать без этих волшебников, защищать нас от различных инфекций и вирусов! Как любые живые белковые структуры, они боятся нагревания и разрушаются при температуре выше 40-45 градусов. Считается, что в организме человека более пяти тысяч энзимов. Большая их часть производится с помощью кишечных бактерий, а другая должна пополнятся из пищи. И в связи с тем, что энзимы разрушаются при нагревании, нам очень нужна хотя бы часть пищи в сыром виде. В идеале её количество должно быть больше, чем термически обработанной, в два-три раза. Таким образом, чем больше в нашем рационе будет сырых термически необработанных продуктов, тем крепче будет наш иммунитет и здоровья в целом!
В идеале её количество должно быть больше, чем термически обработанной, в два-три раза. Таким образом, чем больше в нашем рационе будет сырых термически необработанных продуктов, тем крепче будет наш иммунитет и здоровья в целом!
Откуда мы можем получить ферменты? Самый лучший источник— это фрукты и ягоды. Причем лучше их есть не в качестве десерта, а в отдельный приём пищи. Чем разнообразнее фрукты и ягоды— тем лучше. В межсезонье можно полакомиться сухофруктами и замороженными ягодами. Отличным источником витаминов и энзимов будут домашние свежеприготовленные соки, смузи и лимонады. Еще один источник энзимов— сырые овощи и зелень. Чтобы полнее из них усвоить питательные вещества — их следует тщательно пережевывать, или делать смузи и готовить свежевыжатые соки. Обратите внимание на сырые орехи и семечки (только не жаренные и не соленые!). Здесь тоже есть один нюанс: чтобы энзимы из них лучше усваивались, орехи надо предварительно замачивать, а мелкие семена— перемалывать.
Не столь очевидные источники энзимов— кусочек сала или слабосоленая семга или сельдь. Чтобы контролировать количество поваренной соли, их лучше готовить самим. Можно сохранить массу энзимов и в яйце, если при его приготовлении оставлять желток жидким, например, яйцо всмятку или пашот. И готовьте «живые» соусы для приготовленных блюд и супов. Очень вкусно и полезно использовать для их приготовления рубленный чеснок, лук, любую зелень, лимонный сок. Полны энзимов и такие приправы, как хрен и горчица, самостоятельно приготовленная паста из свежих томатов. Кладезь энзимов, витаминов и микроэлементов— это зеленые, бурые и даже красные водоросли: ламинария, спирулина, нори, комбу и другие.
Чтобы контролировать количество поваренной соли, их лучше готовить самим. Можно сохранить массу энзимов и в яйце, если при его приготовлении оставлять желток жидким, например, яйцо всмятку или пашот. И готовьте «живые» соусы для приготовленных блюд и супов. Очень вкусно и полезно использовать для их приготовления рубленный чеснок, лук, любую зелень, лимонный сок. Полны энзимов и такие приправы, как хрен и горчица, самостоятельно приготовленная паста из свежих томатов. Кладезь энзимов, витаминов и микроэлементов— это зеленые, бурые и даже красные водоросли: ламинария, спирулина, нори, комбу и другие.
Доктор Эдвард Хоувелл, один из самых авторитетных специалистов по ферментам, предположил, что количество энзимов, вырабатываемое организмом, конечно. С его точки зрения, когда энзимный потенциал исчерпывается, тело болеет и умирает. Энзимы также могут разрушаться под действием неблагоприятных факторов жизни, таких как табак, алкоголь, пищевые добавки, лекарства, агрохимия, загрязнение окружающей среды, электромагнитные волны и солнечная радиация. Губительно на них сказываются и постоянные стрессы. Поэтому чтобы сохранить здоровье, необходимо знать, что истощает запасы «волшебных энзимов» и что их пополняет, и внести необходимые коррективы в свой рацион и образ жизни.
Губительно на них сказываются и постоянные стрессы. Поэтому чтобы сохранить здоровье, необходимо знать, что истощает запасы «волшебных энзимов» и что их пополняет, и внести необходимые коррективы в свой рацион и образ жизни.
Ежегодно в конце мая отмечается Всемирный день здорового пищеварения, учрежденный в 1958 году по инициативе Всемирной организации гастроэнтерологов. Его целью является привлечение внимания к проблемам нарушения пищеварения и повышение осведомленности населения о профилактике, диагностике и лечении заболеваний пищеварительного тракта.
Одним из наиболее распространенных проявлений гастроэнтерологических заболеваний является изжога. Каждому знакомо неприятное или даже болезненное чувство жжения и дискомфорта за грудиной, которое возникает, после употребления жареной, острой или жирной пищи. Возникновению изжоги также могут способствовать стресс, алкоголь, курение, переедание, то есть типичные для многих из нас спутники жизни. От изжоги страдают от 20% до 40% населения развитых стран.
Но если она регулярно дает о себе знать, это может быть симптомом гастроэзофагеальной рефлюксной болезни (ГЭРБ), которая возникает в результате регулярного заброса содержимого желудка в пищевод и требует своевременной диагностики и грамотного лечения. На информационном портале для людей с хроническими заболеваниями «Карта Жизни» доступен опросник, разработанный компанией «АстраЗенека» и более 10 лет применяемый во многих странах мира. В условиях пандемии COVID-19, когда необходимо соблюдать режим самоизоляции и максимально ограничить социальные контакты, опросник может использоваться в качестве инструмента для первичной диагностики. Согласно проведенному исследованию, у более 80% людей, набравших ≥ 8 баллов в ходе тестирования, диагноз был подтвержден специалистами. Но, конечно, использование опросника полностью не исключает необходимости консультации врача-гастроэнтеролога.
К воспалительным заболеваниям кишечника (ВЗК) относят два аутоиммунных хронических инвалидизирующих заболевания — болезнь Крона и язвенный колит. Это заболевания прогрессирующего течения, при которых поражаются все отделы кишечника, а также зачастую развиваются внекишечные проявления — поражения других органов и тканей: глаз, суставов и кожи. Воспалительные заболевания кишечника проявляются в основном у молодых людей трудоспособного возраста, преимущественно, жителей развитых стран. В России, по данным Комитета по социальной политике Совета Федерации на 2016 г., распространенность ВЗК составляла 16,6 случая на 100 тыс. населения для язвенного колита (ЯК) и 5,6 случая на 100 тыс. населения для болезни Крона (БК).
Это заболевания прогрессирующего течения, при которых поражаются все отделы кишечника, а также зачастую развиваются внекишечные проявления — поражения других органов и тканей: глаз, суставов и кожи. Воспалительные заболевания кишечника проявляются в основном у молодых людей трудоспособного возраста, преимущественно, жителей развитых стран. В России, по данным Комитета по социальной политике Совета Федерации на 2016 г., распространенность ВЗК составляла 16,6 случая на 100 тыс. населения для язвенного колита (ЯК) и 5,6 случая на 100 тыс. населения для болезни Крона (БК).
Поскольку ВЗК напрямую связаны с работой желудочно-кишечного тракта, а одними из основных их симптомов являются частая диарея и боли в животе, они не только становятся причиной сильного физического дискомфорта, но и способствуют развитию комплексов и чувства социальной изоляции. Это связано с тем, что по мере развития заболевания человек лишается возможности заниматься привычными делами — гулять, заниматься спортом, путешествовать, общаться с близкими и строить отношения, зачастую — теряет трудоспособность.
До недавнего времени, в отсутствие других терапевтических опций, практически половина пациентов с язвенным колитом подвергались оперативному вмешательству по удалению толстой кишки. Сегодня же доступны иные возможности медикаментозного лечения, среди которых — таргетная терапия, ставшая прорывом. Такие препараты, при условии длительного лечения по назначенной врачом схеме, исключающей перерывы в приеме лекарства, позволяют пациентам достичь глубокой ремиссии и вернуться к полноценной и активной жизни.
Будем здоровы!
Источник: https://echo.msk.ru/programs/medinfo/2654689-echo/
Пищеварение без проблем!
Каждый человек хотя бы раз в жизни сталкивался с проблемами пищеварения.
«Праздник живота», устроенный в отпуске или в выходной день, может стать причиной вздутия и дискомфорта. Помочь организму переварить пищу могут ферментные препараты. Что это такое и «с чем их едят»?
Когда организму нужна помощь?
Пищеварение – сложный и долгий процесс, задействующий все органы желудочно-кишечного тракта. Ведущую роль в этом процессе играют ферменты – вещества, при помощи которых пища расщепляется и усваивается, насыщая организм полезными веществами. Переваривание происходит в несколько этапов, и на каждом из них еда и напитки сталкиваются с ферментами:
Ведущую роль в этом процессе играют ферменты – вещества, при помощи которых пища расщепляется и усваивается, насыщая организм полезными веществами. Переваривание происходит в несколько этапов, и на каждом из них еда и напитки сталкиваются с ферментами:
1. Только попав в рот — с ферментами слюны.
2. В желудке – с желудочными ферментами.
3. В тонком кишечнике – с ферментами поджелудочной железы.
4. Завершают процесс пищеварения ферменты кишечного сока.
Порой на одном из этапов происходит сбой из-за нехватки ферментов. Вот здесь и приходят на помощь ферментные препараты. При сбоях процесса пищеварения человека могут беспокоить:
- тяжесть и боль в животе;
- метеоризм;
- тошнота, изжога, отрыжка;
- диарея, остатки непереваренной пищи в кале.
Такие симптомы могут сопровождать множество заболеваний органов желудочно-кишечного тракта, поэтому для уточнения диагноза и назначения лечения необходимо обратиться к врачу.
Какими бывают ферментные препараты
В аптеках можно увидеть огромное разнообразие препаратов, облегчающих процесс пищеварения. Все эти лекарства можно разделить на несколько групп:
- Препараты на основе экстракта слизистой оболочки желудка.
Основным веществом таких препаратов является пепсин. Это вещество вырабатывается слизистой оболочкой желудка и помогает расщеплять белки до пептидов. Пепсин «работает» только в кислой среде желудка и становится неактивным, попадая в щелочную среду кишечника. Лекарство с этим компонентом может быть назначено при диспепсии, гастрите с пониженной кислотностью, отсутствии соляной кислоты и ферментов в желудочном соке.
Пример препаратов пепсина: «Ацидин-пепсин» и др.
- Препараты на основе панкреатина.
Для усвоения белков, жиров и углеводов из пищи необходимы ферменты поджелудочной железы. Когда орган не справляется с перевариванием пищи, на помощь приходит панкреатин – вытяжка из поджелудочной железы животных, который компенсирует необходимые ферменты:
- Липаза – помогает расщеплять жиры.

- Амилаза – облегчает усвоение углеводов.
- Протеаза – способствует перевариванию белков.
Препараты панкреатина универсальны и часто назначаются в рамках комплексного лечения заболеваний органов ЖКТ, заболеваниях поджелудочной железы, а также разово, если организму нужна экстренная помощь в переваривании пищи.
Примеры препаратов панкреатина: «Энзистал-П», «Креон», «Мезим 20 000» и др.
- Ферментные лекарства растительного или грибкового происхождения.
Данная группа лекарственных средств имеет менее выраженное действие. В их составе содержатся энзимы растительного происхождения: папаин, грибковая амилаза, протеаза и др. Такие препараты могут назначаться в случае аллергии на препараты животного происхождения.
Примеры лекарств растительного происхождения: «Юниэнзим с МПС» и др.
- Комбинированные ферментные препараты.
Данная группа лекарственных средств содержит не только панкреатин животных, но и другие вещества, оказывающие дополнительное действие, например: желчегонное, ветрогонное (симетикон), расщепление растительной клетчатки (гемицеллюлаза) и др.
В результате применения такого препарата не только улучшается процесс пищеварения, но и устраняется сопутствующий симптом – вздутие живота, поэтому часто назначаются при метеоризме.
Примеры комбинированных препаратов для пищеварения: «Фестал», «Энзистал» и др.
Отдельно можно выделить комбинированные препараты, объединяющие в себе панкреатин, растительные энзимы и витамины, например, «Вобензим» и др.
Также существуют специальные препараты, содержащие ферменты тонкой кишки, способствующие усвоению лактозы, например, «Солгар Лактаза» (БАД. Не является лекарством).
У препаратов имеются противопоказания, перед применением необходимо получение консультации специалиста.
Умные энзимы | Новости | ЗДОРОВЬЕ
Ещё в XIX веке ученые обнаружили молекулы, которые управляют всеми процессами жизнеобеспечения в организме человека. Ими оказались энзимы.
Что такое энзимы?
Это сложные органические вещества, образующиеся в живой клетке и играющие важную роль катализатора всех процессов, которые происходят в организме. Например, существует энзим, который ежеминутно участвует в 36 миллионах реакций! На сегодняшний день открыто примерно три тысячи энзимов. Каждый энзим имеет определённую функцию в организме, которую другие энзимы выполнить не способны.
Например, существует энзим, который ежеминутно участвует в 36 миллионах реакций! На сегодняшний день открыто примерно три тысячи энзимов. Каждый энзим имеет определённую функцию в организме, которую другие энзимы выполнить не способны.
Где их найти?
Энзимы (ферменты) находятся во всём живом – растениях, животных и человеческом организме. Большим источником энзимов служат сырые фрукты и овощи. Много энзимов содержится в таких продуктах, как бананы, манго, авокадо, молодые побеги растений. А вот у людей, которые питаются консервированной и варёной пищей, часто наблюдается недостаток энзимов в межклеточной жидкости и в крови. Термически обработанные продукты лишены энзимов.
Как они работают?
Энзимы отвечают за обновление состарившихся клеток, сражаются с инфекциями, заставляют иммунную систему бороться против болезней. Кроме того, они улучшают текучесть крови, снижают риск тромбообразования, улучшают работу кишечника, уменьшают воспаление, предупреждая нарушения в различных органах и системах организма. Энзимы помогают использовать потребляемую пищу для образования новых нервных, костных, мышечных, кожных тканей и тканей желёз. Один из энзимов способен преобразовать полученные из еды кальций и фосфор в костную ткань. Эти полезные вещества также помогают в устранении токсинов кишечником, почками, лёгкими и кожей.
Энзимы помогают использовать потребляемую пищу для образования новых нервных, костных, мышечных, кожных тканей и тканей желёз. Один из энзимов способен преобразовать полученные из еды кальций и фосфор в костную ткань. Эти полезные вещества также помогают в устранении токсинов кишечником, почками, лёгкими и кожей.
Недостаток поступления энзимов с пищей может стать пусковым механизмом развития целого ряда заболеваний.
Если не хватает ферментов?
Рацион современного человека содержит достаточное количество витаминов, микроэлементов и других питательных веществ. Однако если его питание сбалансировано. Постоянное же переедание и преобладание в рационе высококалорийной, рафинированной, жирной пищи и недостаток растительных продуктов могут провоцировать нарушение баланса энзимов. Рекомендуется отказаться от плотных ночных ужинов. Последний приём пищи должен быть не позднее 19-20 часов. Перейти на сбалансированное питание — с преобладанием в рационе растительной и белковой пищи, временно снизить или отказаться от сладкой, мучной и жирной пищи (под контролем диетолога). Принимать какие-либо лекарства или витамины, с целью профилактики заболеваний, следует только после консультации с врачом. В ряде случаев он может порекомендовать препараты, которые содержат энзимы растительного и животного происхождения.
Принимать какие-либо лекарства или витамины, с целью профилактики заболеваний, следует только после консультации с врачом. В ряде случаев он может порекомендовать препараты, которые содержат энзимы растительного и животного происхождения.
Смотрите также:
Ферменты
Ферменты – специфические белки, выполняющие в организме роль биологических катализаторов. Ферменты содержатся во всех клетках организма, где их концентрация значительно выше, чем в плазме крови.
Нормальные уровни активности ферментов в сыворотке крови отражают соотношение между биосинтезом и высвобождением ферментов, а также их клиренсом из кровотока.
Исследование уровня ферментов в клинической практике применяется для решения следующих задач:
- установление диагноза;
- проведение дифференциальной диагностики;
- оценка динамики течения болезни;
- определение эффективности лечения и степени выздоровления.
В Клинико-диагностической лаборатории выполняется определение сывороточной активности следующих ферментов:
Амилаза
Амилаза – фермент, осуществляющий расщепление полисахаридов. Наиболее богаты этим ферментом поджелудочная и слюнные железы. Определение активности амилазы имеет важное значение в диагностике заболеваний поджелудочной железы.
Наиболее богаты этим ферментом поджелудочная и слюнные железы. Определение активности амилазы имеет важное значение в диагностике заболеваний поджелудочной железы.
Повышение активности амилазы в сыворотке крови в 2 и более раз должно расцениваться как симптом поражения поджелудочной железы. Большей информативностью о функции поджелудочной железы обладает определение активности амилазы в моче.
Амилаза панкреатическая
Панкреатическая амилаза – это биологически активное вещество, участвующее в процессе метаболизма углеводов. В организме человека большая ее часть вырабатывается поджелудочной железой.
В случае заболевания поджелудочной железы или блокировки протока между нею и двенадцатиперстной кишкой амилаза панкреатическая начинает выделяться в кровь, свидетельствуя об имеющемся существенном неблагополучии в состоянии этого важного пищеварительного органа.
Липаза
Липаза — водорастворимый фермент, который катализирует гидролиз нерастворимых эстеров-липидных субстратов, помогая переваривать, растворять и фракционировать жиры.
Липаза вместе с желчью расщепляет жиры и жирные кислоты, а также жирорастворимые витамины A, D, E, K, обращая их в энергию теплопродукции.
АСТ — аспартатаминотрансфераза
АСТ – аспартатаминотрансфераза – фермент, широко распространенный в тканях человека (сердце, печень, скелетная мускулатура, почки, легкие и т.д.).
Активность АСТ в крови повышается при ряде заболеваний, особенно при поражении органов и тканей, богатых этим ферментом.
Наиболее резкие изменения в активности АСТ наблюдают при поражении сердечной мышцы. АСТ также повышается при остром гепатите и других тяжелых поражениях клеток печени.
АЛТ — аланинаминотрансфераза
АЛТ – аланинаминотрансфераза – фермент, содержащийся в скелетных мышцах, печени, сердце. В миокарде его значительно меньше, чем АСТ. Самых больших концентраций АЛТ достигает в печени.
В клинической практике широко применяется одновременное определение в крови активности АСТ и АЛТ; оно несет гораздо больше информации о локализации и глубине поражения, активности патологического процесса; позволяет прогнозировать исход заболевания.
ЩФ — Щелочная фосфатаза
ЩФ – щелочная фосфатаза – широко распространена в тканях человека, особенно в слизистой оболочке кишечника, остеобластах, стенках желчных протоков печени. Увеличение активности ЩФ сопровождает рахит любой этиологии, костные изменения, связанные с гиперпаратиреозом.
Быстро растет активность фермента при остеогенной саркоме, метастазах рака в кости, миеломной болезни, лимфогранулематозе с поражением костей.
Значительное увеличение активности ЩФ наблюдается при холестазе. Повышение ее наблюдается у 90% больных первичным раком печени и при метастазах в печень. Резко возрастает ее активность при отравлениях алкоголем на фоне хронического алкоголизма. Она может повышаться при лекарственных назначениях, проявляющих гепатотоксический эффект.
ГГТ — гамма-глутамилтранспептидаза
ГГТ – гамма-глутамилтранспептидаза – обнаружена в печени, поджелудочной железе, почках.
В других тканях – в небольших количествах. Изменение ее активности в сыворотке имеет большое диагностическое значение при заболеваниях печени и гепатобилиарного тракта. Этот фермент более чувствителен к нарушениям в клетках печени, чем АЛТ, АСТ, ЩФ и т.д.
Этот фермент более чувствителен к нарушениям в клетках печени, чем АЛТ, АСТ, ЩФ и т.д.
ЛДГ — общая лактатдегидрогеназа.
ЛДГ – общая лактатдегидрогеназа – наибольшая активность обнаружена в почках, миокарде, скелетной мускулатуре и печени. В физиологических условиях повышенная активность ЛДГ наблюдается у беременных, у лиц после интенсивной физической нагрузки.
Из патологических состояний повышение активности ЛДГ вызывают инфаркт миокарда, застойные явления в печени, инфаркт легкого, миопатии, карциномы печени или метастазы рака в печень, мегалобластная и гемолитическая анемия, острые и обострение хронических заболеваний почек.
Энзимный пилинг: преимущества, показания и противопоказания
Энзимный пилинг – процедура, которая позволяет отодвинуть наступление старости. С этой целью косметологи используют ферменты, которые ускоряют обновление эпидермиса. При регулярном прохождении процедуры можно не только омолодить кожу. Препараты используются для устранения угрей и пигментных пятен.
Преимущества
По мере взросления кожа становится дряблый и тусклой. Ситуация усугубляется высоким риском образование угрей. Женщины сталкиваются с воспалительными процессами.
Ускорить обновление эпидермиса можно за счёт ферментов, который помогают отшелушивать отмерший эпителий. Энзимный пилинг позволяет избавиться от различных дефектов, которые возникают на коже. При этом можно не опасаться ожогов, так как ферменты не нарушают целостность покровов.
Можно выделить несколько достоиств процедуры:
- В отличие от фруктовых кислот ферменты не раздражают кожу.
- В составе косметологических препаратов для пилинга отсутствуют абразивные частицы. Поэтому процедуру можно проходить даже при повышенной чувствительности кожи.
- Положительный эффект наступает практически сразу. Женщины могут не беспокоиться о болезненном периоде восстановления.
- Энзимный пилинг в СПб проводят специально обученные косметологи.
 Воздействие ферментов позволяет снизить пористость кожи, улучшить рельеф и добиться снижения глубины морщин.Состав оказывает увлажняющее воздействие и повышает тонус.
Воздействие ферментов позволяет снизить пористость кожи, улучшить рельеф и добиться снижения глубины морщин.Состав оказывает увлажняющее воздействие и повышает тонус.
Как проводится процедура
Энзимы считаются катализаторами, которые ускоряют химические реакции. После нанесения ферментов на кожу происходит разрушение химических связей между клетками.
Причем состав оставляют лишь на несколько минут. Краткосрочное воздействие снижает вероятность возникновения побочных эффектов. Использование энзимного пилинга позволяет очистить кожу щадящим методом.
Процедуру энзимного пилинга можно разбить на несколько этапов:
- Сначала проводится индивидуальное тестирование, которая позволяет определить наличие аллергии на компоненты препарата.
- После этого кожу очищают от макияжа и загрязнений. Для этого используются лосьон или гель для умывания с учетом типа эпидермиса.
- Лицо и шею обрабатывают специальным предпилинговым раствором.

- Косметолог наносит препарат легкими массажными движениями.
- Через 20 минут производится удаление средства.
- Кожу просушивают и наносят увлажняющую сыворотку.
Показания к процедуре
Перед посещением косметолога необходимо уточнить несколько вопросов: как проводится энзимный пилинг, цена процедуры и возможные побочные эффекты.
Специалисты отмечают несколько положительных моментов, которых можно добиться за счет пилинга:
- уменьшение морщин;
- устранение излишней пигментации;
- очищение пор и повышение упругости;
- улучшение внешнего вида кожи;
- лечение угревой сыпи.
Противопоказания
Воздействие энзимов может нанести вред в нескольких случаях:
- Появление проблем с кожей связано с инфекционными заболеваниями.
- От пилинга нужно отказаться людям, страдающим от диабета и гормональных нарушений.
- Процедуру нельзя проводить во время беременности.

В составе препаратов присутствуют вещества, которые оказывают влияние на скорость биохимических реакций. Энзимы принимают участие в расщеплении белковых соединений и жиров. Благодаря пилингу можно увеличить скорость регенерации эпителия.
Как часто можно проходить процедуру
Женщины с нормальной кожей могут делать пилинг 1 раз в неделю. Для достижения положительных результатов необходимо пройти около 5-8 процедур. Чтобы избавиться от проблем на жирной коже процедуру нужно проходить 2 раза в неделю.
Чтобы избежать побочных эффектов нужно пройти тест на наличие аллергии. Косметолог должен нанести пилинговый препарат на внутреннюю поверхность предплечья. Для повышения активности ферментов обработанные участки нужно накрыть тканью.
Во время процедуры энзимного пилинга может возникать легкое покалывание и жжение. Симптомы проходят в течение 30 минут после смывания состава.
Какие виды ферментов используются для энзимного пилинга
Чаще всего косметологи отдают предпочтение препаратам, в которых присутствует ретинол. В качестве исходного материала могут использоваться ферменты растительного происхождения:
В качестве исходного материала могут использоваться ферменты растительного происхождения:
- папаин;
- бромелайн;
- фицин;
- актинидин;
- арбутин.
К энзимам животного происхождения можно отнести:
- пепсин;
- панкреатин;
- трипсин;
- химотрипсин.
Благотворное воздействие на кожу оказывает молочные энзимы, которые добавляют в пилинги и маски. Пилинг позволяет бережно очистить кожу от омертвевших клеток. С помощью состава можно быстро удалить выделения сальных и потовых желез. Процедура способствует восстановлению здорового цвета кожи.
Риск возникновения раздражения минимален, так как энзимы не разрушают эпидермис. Период восстановления после нанесения состава проходит безболезненно. Состав борется с угревой сыпью. Пилинг позволят избавиться от пигментных пятен, которые появляются в процессе старения.
Что такое ферменты, поджелудочная железа, пищеварение и функция печени
Что такое ферменты?
Ферменты — это белки, которые помогают ускорить обмен веществ или химические реакции в нашем организме. Они строят одни вещества и разрушают другие. Все живые существа имеют ферменты.
Они строят одни вещества и разрушают другие. Все живые существа имеют ферменты.
Наш организм естественным образом вырабатывает ферменты. Но ферменты есть и в промышленных продуктах и продуктах питания.
Что делают ферменты?
Одной из наиболее важных функций ферментов является помощь в пищеварении.Пищеварение – это процесс превращения пищи, которую мы едим, в энергию. Например, в нашей слюне, поджелудочной железе, кишечнике и желудке есть ферменты. Они расщепляют жиры, белки и углеводы. Ферменты используют эти питательные вещества для роста и восстановления клеток.
Ферменты также помогают при:
- Дыхание.
- Наращивание мышечной массы.
- Нервная функция.
- Избавляем наш организм от токсинов.
Какие существуют типы ферментов?
В организме существуют тысячи отдельных ферментов.Каждый тип фермента выполняет только одну работу. Например, фермент сахараза расщепляет сахар, называемый сахарозой. Лактаза расщепляет лактозу, разновидность сахара, содержащуюся в молочных продуктах.
Лактаза расщепляет лактозу, разновидность сахара, содержащуюся в молочных продуктах.
Некоторые из наиболее распространенных пищеварительных ферментов:
- Карбогидраза расщепляет углеводы до сахаров.
- Липаза расщепляет жиры до жирных кислот.
- Протеаза расщепляет белок на аминокислоты.
Части ферментов
Из каких частей состоит фермент?
Каждый фермент имеет «активный центр».Эта площадь имеет уникальную форму. Вещество, над которым работает фермент, является субстратом. Подложка также имеет уникальную форму. Фермент и субстрат должны работать вместе.
Как температура и pH влияют на ферменты?
Ферментам нужны правильные условия для работы. Если условия не подходят, ферменты могут изменить форму. Затем они больше не подходят к субстратам, поэтому работают некорректно.
Каждый фермент имеет идеальную температуру и pH:
- pH: Ферменты чувствительны к кислотности и щелочности.
 Они не работают должным образом, если среда слишком кислая или щелочная. Например, фермент в желудке, называемый пепсином, расщепляет белки. Если в желудке недостаточно кислоты, пепсин не может функционировать оптимально.
Они не работают должным образом, если среда слишком кислая или щелочная. Например, фермент в желудке, называемый пепсином, расщепляет белки. Если в желудке недостаточно кислоты, пепсин не может функционировать оптимально. - Температура: Ферменты работают лучше всего при нормальной температуре тела, около 98,6°F (37°C). С повышением температуры усиливаются ферментативные реакции. Но если температура становится слишком высокой, фермент перестает работать. Вот почему высокая температура может нарушить функции организма.
Общие состояния и расстройства
К каким заболеваниям могут привести проблемы с ферментами?
Метаболические нарушения часто являются результатом недостатка определенного фермента. Родители могут передать их своим детям через гены (по наследству). Некоторые примеры наследственных нарушений обмена веществ включают:
- Болезнь Фабри препятствует выработке организмом ферментов (альфа-галактозидаза А), расщепляющих жиры (липиды).

- Болезнь Краббе (глобоидно-клеточная лейкодистрофия) поражает ферменты, необходимые для защитного покрытия (миелина) нервных клеток (центральной нервной системы).
- Заболевание мочи, вызванное кленовым сиропом , влияет на ферменты, необходимые для расщепления определенных аминокислот с разветвленной цепью.
Другие состояния здоровья, связанные с дисбалансом ферментов, включают:
Как тесты на ферменты используются для диагностики состояния здоровья?
Ваш лечащий врач может использовать различные анализы крови на ферменты и белки для выявления определенных заболеваний. Например, повышенный уровень ферментов печени может быть признаком заболевания печени.
Уход за ферментами
Нужно ли мне принимать ферментные добавки?
Люди без хронических заболеваний обычно могут получать необходимые им ферменты из здорового питания.Но если у вас есть определенные проблемы со здоровьем, ваш лечащий врач может порекомендовать вам принимать ферментные добавки. Например, многие люди с ЭНПЖ могут принимать пищеварительные ферменты перед едой. Это помогает их телам усваивать питательные вещества из пищи. Поговорите со своим лечащим врачом, прежде чем принимать какие-либо ферментные добавки.
Например, многие люди с ЭНПЖ могут принимать пищеварительные ферменты перед едой. Это помогает их телам усваивать питательные вещества из пищи. Поговорите со своим лечащим врачом, прежде чем принимать какие-либо ферментные добавки.
Могут ли лекарства влиять на уровень ферментов?
Некоторые лекарства влияют на уровень ферментов. Например, антибиотики могут убивать определенные бактерии, необходимые для того, чтобы некоторые ферменты работали наилучшим образом.По этой причине антибиотики могут вызывать диарею. Чтобы убить бактерии, из-за которых вы заболеваете, они также уничтожают важные полезные бактерии, которые помогают пищеварению.
Статины (препараты, снижающие уровень холестерина) могут повышать уровень печеночных и мышечных ферментов. Они могут увеличить риск повреждения печени или мышц.
Когда звонить врачу
Когда мне следует обратиться к врачу по поводу проблемы с ферментами?
Без анализа крови вы не узнаете, есть ли у вас проблемы с ферментами. Обратитесь к врачу, если у вас возникли какие-либо из следующих проблем:
Обратитесь к врачу, если у вас возникли какие-либо из следующих проблем:
Записка из клиники Кливленда
Ферменты помогают облегчить биохимические реакции в нашем организме. Они помогают во всем, от дыхания до пищеварения. Слишком мало или слишком много определенного фермента может привести к проблемам со здоровьем. Некоторым людям с хроническими заболеваниями может потребоваться прием ферментных добавок, чтобы помочь их телу работать должным образом. Принимайте ферментные добавки только под наблюдением врача.
резюмеферментов | Britannica
фермент , Вещество, которое действует как катализатор в живых организмах, регулируя скорость, с которой протекают химические реакции жизни, не изменяясь при этом. Ферменты снижают энергию активации, необходимую для запуска этих реакций; без них большинство таких реакций не протекало бы с полезной скоростью. Поскольку энзимы не расходуются, требуется лишь небольшое их количество. Ферменты катализируют все аспекты клеточного метаболизма, включая переваривание пищи, при котором большие молекулы питательных веществ (включая белки, углеводы и жиры) расщепляются на более мелкие молекулы; сохранение и преобразование химической энергии; и строительство ячеистых материалов и компонентов.Почти все ферменты являются белками; многие зависят от небелкового кофактора, либо слабо связанного органического соединения (например, витамин; см. кофермент), либо прочно связанного иона металла (например, железа, цинка) или органической (часто металлсодержащей) группы. Комбинация фермент-кофактор обеспечивает активную конфигурацию, обычно включающую активный центр, в который может вписаться вещество (субстрат), участвующее в реакции. Многие ферменты специфичны к одному субстрату. Если конкурирующая молекула блокирует активный центр или меняет его форму, активность фермента подавляется.Если конфигурация фермента нарушена ( см. денатурация), его активность утрачивается.
Ферменты катализируют все аспекты клеточного метаболизма, включая переваривание пищи, при котором большие молекулы питательных веществ (включая белки, углеводы и жиры) расщепляются на более мелкие молекулы; сохранение и преобразование химической энергии; и строительство ячеистых материалов и компонентов.Почти все ферменты являются белками; многие зависят от небелкового кофактора, либо слабо связанного органического соединения (например, витамин; см. кофермент), либо прочно связанного иона металла (например, железа, цинка) или органической (часто металлсодержащей) группы. Комбинация фермент-кофактор обеспечивает активную конфигурацию, обычно включающую активный центр, в который может вписаться вещество (субстрат), участвующее в реакции. Многие ферменты специфичны к одному субстрату. Если конкурирующая молекула блокирует активный центр или меняет его форму, активность фермента подавляется.Если конфигурация фермента нарушена ( см. денатурация), его активность утрачивается. Ферменты классифицируют по типу реакции, которую они катализируют: (1) окисление-восстановление, (2) перенос химической группы, (3) гидролиз, (4) отщепление или присоединение химической группы, (5) изомеризация ( см. изомер ; изомерия) и (6) связывание между собой звеньев субстрата (полимеризация). Большинство названий ферментов оканчиваются на -аза . Ферменты являются хиральными катализаторами, дающими большую часть или только один из возможных стереоизомерных продуктов ( см. оптическая активность).Брожение вина, заквашивание хлеба, свертывание молока в сыр и варка пива — все это ферментативные реакции. Использование ферментов в медицине включает уничтожение болезнетворных микроорганизмов, ускорение заживления ран и диагностику некоторых заболеваний.
Ферменты классифицируют по типу реакции, которую они катализируют: (1) окисление-восстановление, (2) перенос химической группы, (3) гидролиз, (4) отщепление или присоединение химической группы, (5) изомеризация ( см. изомер ; изомерия) и (6) связывание между собой звеньев субстрата (полимеризация). Большинство названий ферментов оканчиваются на -аза . Ферменты являются хиральными катализаторами, дающими большую часть или только один из возможных стереоизомерных продуктов ( см. оптическая активность).Брожение вина, заквашивание хлеба, свертывание молока в сыр и варка пива — все это ферментативные реакции. Использование ферментов в медицине включает уничтожение болезнетворных микроорганизмов, ускорение заживления ран и диагностику некоторых заболеваний.
Центральная роль ферментов как биологических катализаторов — клетка
Основная задача белков — действовать как ферменты — катализаторы, увеличивающие скорость практически всех химических реакций внутри клетки. Хотя РНК способны катализировать некоторые реакции, большинство биологических реакций катализируются белками.В отсутствие ферментативного катализа большинство биохимических реакций протекают настолько медленно, что не могли бы протекать в мягких условиях температуры и давления, совместимых с жизнью. Ферменты ускоряют скорость таких реакций более чем в миллион раз, поэтому реакции, которые без катализа заняли бы годы, могут протекать за доли секунд, если их катализирует соответствующий фермент. Клетки содержат тысячи различных ферментов, и их активность определяет, какие из многих возможных химических реакций действительно происходят внутри клетки.
Хотя РНК способны катализировать некоторые реакции, большинство биологических реакций катализируются белками.В отсутствие ферментативного катализа большинство биохимических реакций протекают настолько медленно, что не могли бы протекать в мягких условиях температуры и давления, совместимых с жизнью. Ферменты ускоряют скорость таких реакций более чем в миллион раз, поэтому реакции, которые без катализа заняли бы годы, могут протекать за доли секунд, если их катализирует соответствующий фермент. Клетки содержат тысячи различных ферментов, и их активность определяет, какие из многих возможных химических реакций действительно происходят внутри клетки.
Каталитическая активность ферментов
Как и все другие катализаторы, ферменты характеризуются двумя фундаментальными свойствами. Во-первых, они увеличивают скорость химических реакций, но сами не поглощаются и не изменяются в результате реакции. Во-вторых, они увеличивают скорость реакции, не нарушая химического равновесия между реагентами и продуктами.
Эти принципы ферментативного катализа проиллюстрированы в следующем примере, в котором молекула под действием фермента (называемая субстратом [ S ]) превращается в продукт ( P ) в результате реакции.В отсутствие фермента реакция может быть записана следующим образом:
Химическое равновесие между S и P определяется законами термодинамики (как обсуждается далее в следующем разделе этой главы) и представлено отношением скоростей прямой и обратной реакции ( S → P и P → S соответственно). В присутствии соответствующего фермента превращение S в P ускоряется, но равновесие между S и P не изменяется.Следовательно, фермент должен одинаково ускорять и прямую, и обратную реакции. Реакция может быть записана следующим образом:
Обратите внимание, что фермент ( E ) не изменяется в результате реакции, поэтому химическое равновесие остается неизменным, определяемым исключительно термодинамическими свойствами S и P .
Влияние фермента на такую реакцию лучше всего иллюстрируется энергетическими изменениями, которые должны происходить при превращении S в P ().Равновесие реакции определяется конечными энергетическими состояниями S и P , на которые не влияет ферментативный катализ. Однако для того, чтобы реакция шла, субстрат должен быть сначала преобразован в более высокое энергетическое состояние, называемое переходным состоянием . Энергия, необходимая для достижения переходного состояния (энергия активации), представляет собой барьер для протекания реакции, ограничивая скорость реакции. Ферменты (и другие катализаторы) действуют, уменьшая энергию активации, тем самым увеличивая скорость реакции.Повышенная скорость одинакова как в прямом, так и в обратном направлении, поскольку оба должны пройти через одно и то же переходное состояние.
Рисунок 2.22
Энергетические диаграммы для катализируемых и некаталитических реакций. Проиллюстрированная реакция представляет собой простое превращение субстрата S в продукт P. Поскольку конечное энергетическое состояние P ниже, чем у S , реакция протекает слева направо. Для (подробнее…)
Поскольку конечное энергетическое состояние P ниже, чем у S , реакция протекает слева направо. Для (подробнее…)
Каталитическая активность ферментов заключается в связывании их субстратов с образованием комплекса фермент-субстрат ( ES ).Субстрат связывается с определенной областью фермента, называемой активным центром. Связанный с активным центром субстрат превращается в продукт реакции, который затем высвобождается из фермента. Таким образом, катализируемая ферментами реакция может быть записана следующим образом:
Обратите внимание, что E не изменяется в обеих частях уравнения, поэтому равновесие не изменяется. Однако фермент обеспечивает поверхность, на которой реакции превращения S в P могут происходить более легко.Это результат взаимодействий между ферментом и субстратом, которые снижают энергию активации и способствуют образованию переходного состояния.
Механизмы ферментативного катализа
Связывание субстрата с активным центром фермента представляет собой очень специфическое взаимодействие. Активные центры представляют собой щели или бороздки на поверхности фермента, обычно состоящие из аминокислот из разных частей полипептидной цепи, объединенных в третичную структуру свернутого белка.Субстраты первоначально связываются с активным центром посредством нековалентных взаимодействий, включая водородные связи, ионные связи и гидрофобные взаимодействия. Как только субстрат связывается с активным центром фермента, несколько механизмов могут ускорить его превращение в продукт реакции.
Активные центры представляют собой щели или бороздки на поверхности фермента, обычно состоящие из аминокислот из разных частей полипептидной цепи, объединенных в третичную структуру свернутого белка.Субстраты первоначально связываются с активным центром посредством нековалентных взаимодействий, включая водородные связи, ионные связи и гидрофобные взаимодействия. Как только субстрат связывается с активным центром фермента, несколько механизмов могут ускорить его превращение в продукт реакции.
Хотя в простом примере, описанном в предыдущем разделе, задействована только одна молекула субстрата, большинство биохимических реакций включают взаимодействие между двумя или более различными субстратами. Например, образование пептидной связи предполагает соединение двух аминокислот.Для таких реакций связывание двух или более субстратов с активным центром в правильном положении и ориентации ускоряет реакцию (1). Фермент обеспечивает матрицу, на которой реагенты собираются вместе и должным образом ориентируются, чтобы способствовать образованию переходного состояния, в котором они взаимодействуют.
Рисунок 2.23
Ферментативный катализ реакции между двумя субстратами. Фермент обеспечивает матрицу, на которой два субстрата соединяются вместе в правильном положении и ориентации для взаимодействия друг с другом.
Ферменты ускоряют реакции также путем изменения конформации их субстратов, приближая их к конформации переходного состояния. Простейшей моделью взаимодействия фермент-субстрат является модель типа «замок-ключ» , в которой субстрат точно помещается в активный центр (). Однако во многих случаях конфигурации как фермента, так и субстрата модифицируются за счет связывания субстрата — процесс, называемый индуцированным соответствием . В таких случаях конформация субстрата изменяется так, что она больше напоминает переходное состояние.Напряжение, создаваемое таким искажением подложки, может дополнительно способствовать ее переходу в переходное состояние за счет ослабления критических связей. Более того, переходное состояние стабилизируется его прочным связыванием с ферментом, что снижает необходимую энергию активации.
Рисунок 2.24
Модели фермент-субстратного взаимодействия. (A) В модели «замок-ключ» субстрат точно соответствует активному центру фермента. (B) В модели индуцированного соответствия связывание субстрата искажает конформации как субстрата, так и фермента.Это искажение (подробнее…)
Помимо объединения нескольких субстратов и искажения конформации субстратов для приближения к переходному состоянию, многие ферменты непосредственно участвуют в каталитическом процессе. В таких случаях специфические боковые цепи аминокислот в активном центре могут реагировать с субстратом и образовывать связи с промежуточными продуктами реакции. Кислотные и основные аминокислоты часто участвуют в этих каталитических механизмах, как показано в последующем обсуждении химотрипсина как примера ферментативного катализа.
Химотрипсин относится к семейству ферментов (сериновых протеаз), которые расщепляют белки, катализируя гидролиз пептидных связей. Реакция может быть записана следующим образом:
Различные представители семейства сериновых протеаз (включая химотрипсин, трипсин, эластазу и тромбин) обладают различной субстратной специфичностью; они преимущественно расщепляют пептидные связи, расположенные рядом с разными аминокислотами. Например, в то время как химотрипсин расщепляет связи рядом с гидрофобными аминокислотами, такими как триптофан и фенилаланин, трипсин расщепляет связи рядом с основными аминокислотами, такими как лизин и аргинин.Однако все сериновые протеазы сходны по структуре и используют один и тот же механизм катализа. Активные центры этих ферментов содержат три критически важные аминокислоты — серин, гистидин и аспартат, — которые управляют гидролизом пептидной связи. Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли остатка серина.
Например, в то время как химотрипсин расщепляет связи рядом с гидрофобными аминокислотами, такими как триптофан и фенилаланин, трипсин расщепляет связи рядом с основными аминокислотами, такими как лизин и аргинин.Однако все сериновые протеазы сходны по структуре и используют один и тот же механизм катализа. Активные центры этих ферментов содержат три критически важные аминокислоты — серин, гистидин и аспартат, — которые управляют гидролизом пептидной связи. Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли остатка серина.
Субстраты связываются с сериновыми протеазами путем встраивания аминокислоты рядом с сайтом расщепления в карман в активном центре фермента ().Природа этого кармана определяет субстратную специфичность различных членов семейства сериновых протеаз. Например, связывающий карман химотрипсина содержит гидрофобные аминокислоты, которые взаимодействуют с гидрофобными боковыми цепями его предпочтительных субстратов. Напротив, связывающий карман трипсина содержит отрицательно заряженную кислую аминокислоту (аспартат), которая способна образовывать ионную связь с остатками лизина или аргинина своих субстратов.
Рисунок 2.25
Связывание субстрата сериновыми протеазами.Аминокислота, примыкающая к расщепляемой пептидной связи, вставляется в карман в активном центре фермента. У химотрипсина карман связывает гидрофобные аминокислоты; связывающий карман трипсина содержит (подробнее…)
Связывание субстрата позиционирует расщепляемую пептидную связь рядом с активным центром серина (). Затем протон этого серина переносится в активный центр гистидина. Конформация активного центра способствует переносу протона, поскольку гистидин взаимодействует с отрицательно заряженным аспартатным остатком.Серин реагирует с субстратом, образуя тетраэдрическое переходное состояние. Затем пептидная связь расщепляется, и С-концевая часть субстрата высвобождается из фермента. Однако N-концевой пептид остается связанным с серином. Эта ситуация разрешается, когда молекула воды (второй субстрат) входит в активный центр и обращает предшествующие реакции. Протон молекулы воды переносится на гистидин, а его гидроксильная группа – на пептид, образуя второе тетраэдрическое переходное состояние. Затем протон переносится с гистидина обратно на серин, а пептид высвобождается из фермента, завершая реакцию.
Затем протон переносится с гистидина обратно на серин, а пептид высвобождается из фермента, завершая реакцию.
Рисунок 2.26
Каталитический механизм химотрипсина. Три аминокислоты в активном центре (Ser-195, His-57 и Asp-102) играют решающую роль в катализе.
Этот пример иллюстрирует некоторые особенности ферментативного катализа; специфичность фермент-субстратных взаимодействий, расположение различных молекул субстрата в активном центре и участие остатков активного центра в формировании и стабилизации переходного состояния.Хотя тысячи ферментов в клетках катализируют множество различных типов химических реакций, в их работе применяются одни и те же основные принципы.
Коэнзимы
Помимо связывания своих субстратов, активные центры многих ферментов связывают другие малые молекулы, участвующие в катализе. Простетические группы представляют собой небольшие молекулы, связанные с белками, в которых они играют важную функциональную роль. Например, кислород, переносимый миоглобином и гемоглобином, связан с гемом, простетической группой этих белков. Во многих случаях ионы металлов (например, цинка или железа) связаны с ферментами и играют центральную роль в каталитическом процессе. Кроме того, различные низкомолекулярные органические молекулы участвуют в специфических типах ферментативных реакций. Эти молекулы называются коферментами, потому что они работают вместе с ферментами, увеличивая скорость реакции. В отличие от субстратов коферменты не изменяются необратимо в результате реакций, в которых они участвуют. Скорее, они перерабатываются и могут участвовать во множестве ферментативных реакций.
Во многих случаях ионы металлов (например, цинка или железа) связаны с ферментами и играют центральную роль в каталитическом процессе. Кроме того, различные низкомолекулярные органические молекулы участвуют в специфических типах ферментативных реакций. Эти молекулы называются коферментами, потому что они работают вместе с ферментами, увеличивая скорость реакции. В отличие от субстратов коферменты не изменяются необратимо в результате реакций, в которых они участвуют. Скорее, они перерабатываются и могут участвовать во множестве ферментативных реакций.
Коэнзимы служат переносчиками нескольких типов химических групп. Ярким примером кофермента является никотинамидадениндинуклеотид ( НАД + ), который функционирует как переносчик электронов в окислительно-восстановительных реакциях (). НАД + может принимать ион водорода (Н + ) и два электрона (е — ) с одного субстрата, образуя НАДН. Затем NADH может отдавать эти электроны второму субстрату, повторно образуя NAD + . Таким образом, НАД + переносит электроны с первого субстрата (который окисляется) на второй (который восстанавливается).
Таким образом, НАД + переносит электроны с первого субстрата (который окисляется) на второй (который восстанавливается).
Рис. 2.27
Роль НАД + в окислительно-восстановительных реакциях. (A) Никотинамидадениндинуклеотид (НАД + ) действует как переносчик электронов в окислительно-восстановительных реакциях, принимая электроны (е — ) с образованием НАДН. (B) Например, NAD + может принимать электроны от одного субстрата (подробнее…)
Несколько других коферментов также действуют как переносчики электронов, а третьи участвуют в переносе множества дополнительных химических групп (e .g., карбоксильные группы и ацильные группы; ). Одни и те же коферменты действуют вместе с множеством различных ферментов, катализируя перенос определенных химических групп между широким спектром субстратов. Многие коферменты тесно связаны с витаминами, которые частично или полностью составляют структуру кофермента. Витамины не требуются бактериям, таким как E. coli , но являются необходимыми компонентами рациона человека и других высших животных, которые утратили способность синтезировать эти соединения.
coli , но являются необходимыми компонентами рациона человека и других высших животных, которые утратили способность синтезировать эти соединения.
Регулирование активности ферментов
Важной особенностью большинства ферментов является то, что их активность не постоянна, а может модулироваться. То есть активность ферментов можно регулировать так, чтобы они функционировали надлежащим образом для удовлетворения различных физиологических потребностей, которые могут возникнуть в течение жизни клетки.
Одним из распространенных типов регуляции ферментов является ингибирование по принципу обратной связи, при котором продукт метаболического пути ингибирует активность фермента, участвующего в его синтезе.Например, аминокислота изолейцин синтезируется серией реакций, начиная с аминокислоты треонина (). Первый этап пути катализируется ферментом треониндезаминазой, которая ингибируется изолейцином, конечным продуктом пути. Таким образом, достаточное количество изолейцина в клетке ингибирует треониндезаминазу, блокируя дальнейший синтез изолейцина. Если концентрация изолейцина снижается, ингибирование по принципу обратной связи снимается, треониндезаминаза больше не ингибируется и синтезируется дополнительный изолейцин.Регулируя таким образом активность треониндезаминазы, клетка синтезирует необходимое количество изолейцина, но избегает затрат энергии на синтез большего количества изолейцина, чем необходимо.
Если концентрация изолейцина снижается, ингибирование по принципу обратной связи снимается, треониндезаминаза больше не ингибируется и синтезируется дополнительный изолейцин.Регулируя таким образом активность треониндезаминазы, клетка синтезирует необходимое количество изолейцина, но избегает затрат энергии на синтез большего количества изолейцина, чем необходимо.
Рисунок 2.28
Подавление обратной связи. Первый этап превращения треонина в изолейцин катализируется ферментом треониндезаминазой. Активность этого фермента ингибируется изолейцином, конечным продуктом пути.
Ингибирование по принципу обратной связи является одним из примеров аллостерической регуляции, при которой активность фермента контролируется путем связывания небольших молекул с регуляторными участками фермента ().Термин «аллостерическая регуляция» происходит от того факта, что регуляторные молекулы связываются не с каталитическим сайтом, а с отдельным сайтом на белке ( алло = «другой» и стерический = «сайт»). Связывание регуляторной молекулы изменяет конформацию белка, что, в свою очередь, изменяет форму активного центра и каталитическую активность фермента. В случае треониндезаминазы связывание регуляторной молекулы (изолейцина) ингибирует ферментативную активность. В других случаях регуляторные молекулы служат активаторами, стимулируя, а не ингибируя ферменты-мишени.
Связывание регуляторной молекулы изменяет конформацию белка, что, в свою очередь, изменяет форму активного центра и каталитическую активность фермента. В случае треониндезаминазы связывание регуляторной молекулы (изолейцина) ингибирует ферментативную активность. В других случаях регуляторные молекулы служат активаторами, стимулируя, а не ингибируя ферменты-мишени.
Рис. 2.29
Аллостерическая регуляция. В этом примере активность фермента ингибируется связыванием регуляторной молекулы с аллостерическим сайтом. В отсутствие ингибитора субстрат связывается с активным центром фермента, и реакция протекает. Связывание (подробнее…)
Активность ферментов также можно регулировать путем их взаимодействия с другими белками и ковалентными модификациями, такими как добавление фосфатных групп к остаткам серина, треонина или тирозина.Фосфорилирование является особенно распространенным механизмом регуляции активности ферментов; добавление фосфатных групп либо стимулирует, либо ингибирует активность многих различных ферментов (). Например, мышечные клетки реагируют на эпинефрин (адреналин), расщепляя гликоген на глюкозу, тем самым обеспечивая источник энергии для повышения мышечной активности. Расщепление гликогена катализируется ферментом гликогенфосфорилазой, который активируется путем фосфорилирования в ответ на связывание адреналина с рецептором на поверхности мышечной клетки.Фосфорилирование белков играет центральную роль в контроле не только метаболических реакций, но и многих других клеточных функций, включая рост и дифференцировку клеток.
Например, мышечные клетки реагируют на эпинефрин (адреналин), расщепляя гликоген на глюкозу, тем самым обеспечивая источник энергии для повышения мышечной активности. Расщепление гликогена катализируется ферментом гликогенфосфорилазой, который активируется путем фосфорилирования в ответ на связывание адреналина с рецептором на поверхности мышечной клетки.Фосфорилирование белков играет центральную роль в контроле не только метаболических реакций, но и многих других клеточных функций, включая рост и дифференцировку клеток.
Рис. 2.30
Фосфорилирование белков. Некоторые ферменты регулируются добавлением фосфатных групп к ОН-группам боковых цепей остатков серина (как показано здесь), треонина или тирозина. Например, фермент гликогенфосфорилаза, катализирующий превращение (далее…)
Ферменты — обзор | Темы ScienceDirect
2.1 Введение
Ферменты – это активные белки (кроме РНКазы), которые могут катализировать биохимические реакции. Это биомолекулы, необходимые как для синтеза, так и для реакций распада живых организмов. Все живые организмы строятся и поддерживаются этими ферментами, которые на самом деле называются биологическими катализаторами, обладающими способностью превращать определенное соединение (в качестве субстрата) в продукты с более высокой скоростью реакции. Как и химические катализаторы, ферменты увеличивают скорость реакции за счет снижения ее энергии активации ( E a ), следовательно, продукты образуются быстрее, и реакции быстрее достигают своего равновесного состояния.Скорость большинства ферментативных реакций в миллионы раз выше скорости некаталитических реакций. Они могут выполнять преобразования за минуты или даже секунды, на что в противном случае могут уйти сотни лет (Dalby, 2003; Otten and Quax, 2005). Известно, что ферменты катализируют около 4000 биохимических реакций в живых существах (Bairoch, 2000). Например, лактаза представляет собой гликозидгидролазу, которая способна гидролизовать лактозу (молочный сахар) на составляющие ее мономеры галактозу и глюкозу.
Все живые организмы строятся и поддерживаются этими ферментами, которые на самом деле называются биологическими катализаторами, обладающими способностью превращать определенное соединение (в качестве субстрата) в продукты с более высокой скоростью реакции. Как и химические катализаторы, ферменты увеличивают скорость реакции за счет снижения ее энергии активации ( E a ), следовательно, продукты образуются быстрее, и реакции быстрее достигают своего равновесного состояния.Скорость большинства ферментативных реакций в миллионы раз выше скорости некаталитических реакций. Они могут выполнять преобразования за минуты или даже секунды, на что в противном случае могут уйти сотни лет (Dalby, 2003; Otten and Quax, 2005). Известно, что ферменты катализируют около 4000 биохимических реакций в живых существах (Bairoch, 2000). Например, лактаза представляет собой гликозидгидролазу, которая способна гидролизовать лактозу (молочный сахар) на составляющие ее мономеры галактозу и глюкозу. Он вырабатывается различными микроорганизмами, а также в тонком кишечнике человека и других млекопитающих, помогая полностью переваривать молоко.Ферменты также являются энантиоселективными катализаторами, которые можно использовать как при выделении энантиомеров из рацемической смеси, так и при синтезе хиральных соединений.
Он вырабатывается различными микроорганизмами, а также в тонком кишечнике человека и других млекопитающих, помогая полностью переваривать молоко.Ферменты также являются энантиоселективными катализаторами, которые можно использовать как при выделении энантиомеров из рацемической смеси, так и при синтезе хиральных соединений.
Люди осознали важность ферментов тысячи лет назад; осветление и фильтрация вин и пива — самые ранние примеры применения промышленных ферментов. Ферменты использовались в пивоварении, выпечке и производстве алкоголя с доисторических времен; однако они не называли их ферментами. Одно из самых ранних письменных упоминаний ферментов встречается в греческих эпических поэмах Гомера, датируемых примерно 800 г. до н.э., где упоминается, что ферменты использовались при производстве сыра.Японцы также использовали природные ферменты в производстве ферментированных продуктов, таких как саке, японский шнапс, сваренный из риса, уже более тысячи лет. Некоторые ферменты были созданы природой для образования сложных молекул из более простых, в то время как другие были созданы для расщепления сложных молекул на более простые, а также некоторые модифицируют молекулы. Эти реакции включают создание и разрыв химических связей в компонентах. Благодаря своей «специфичности», свойству фермента, которое позволяет ему распознавать конкретный субстрат, для которого они предназначены, они полезны в промышленных процессах и способны катализировать реакцию между определенными химическими веществами, даже если они присутствуют в смесях. со многими химическими веществами.Эти ферменты экологически безопасны, натуральны и очень безопасно применяются в пищевой и даже фармацевтической промышленности. Тем не менее, ферменты — это белки, которые, как и любой белок, могут вызывать и вызывали в прошлом аллергические реакции, поэтому при их производстве и применении необходимы защитные меры.
Эти реакции включают создание и разрыв химических связей в компонентах. Благодаря своей «специфичности», свойству фермента, которое позволяет ему распознавать конкретный субстрат, для которого они предназначены, они полезны в промышленных процессах и способны катализировать реакцию между определенными химическими веществами, даже если они присутствуют в смесях. со многими химическими веществами.Эти ферменты экологически безопасны, натуральны и очень безопасно применяются в пищевой и даже фармацевтической промышленности. Тем не менее, ферменты — это белки, которые, как и любой белок, могут вызывать и вызывали в прошлом аллергические реакции, поэтому при их производстве и применении необходимы защитные меры.
Технология ферментов — это постоянно развивающаяся отрасль науки и техники. Благодаря вмешательству и влиянию биотехнологии и биоинформатики постоянно появляются новые или улучшенные области применения ферментов.Вместе с новыми приложениями одновременно возникает потребность в ферментах с улучшенными свойствами. Разработка коммерческих ферментов является специализированным бизнесом, которым обычно занимаются компании, обладающие высокой квалификацией в следующих областях:
Разработка коммерческих ферментов является специализированным бизнесом, которым обычно занимаются компании, обладающие высокой квалификацией в следующих областях:
- ●
Скрининг новых и улучшенных ферментов
- ●
Селекция микроорганизмов и улучшение штаммов для качественного и количественного улучшения
- ●
- ●
ферментация ферментации для производства фермента
- ●
крупномасштабные ферментные чистики
5 ●Процедактирование ферментов на продажу
Enzyme Technology предлагает отрасли и потребителям возможность заменить процессы использование агрессивных химикатов с мягкими и экологически безопасными ферментными процессами.Известно около 3000 ферментов, из которых только 150–170 используются в промышленности. В настоящее время только 5% химических продуктов производится биологическим путем в эту зеленую эру. Однако в качестве альтернативы физико-химическим и механическим процессам появляются экономически целесообразные и экологически безопасные ферментативные процессы. В зависимости от различных областей применения промышленные ферменты можно разделить на: (1) ферменты в пищевой промышленности, (2) ферменты для технологических добавок, (3) ферменты в качестве промышленных биокатализаторов, (4) ферменты в генной инженерии и (5) ) Ферменты в косметике.
В зависимости от различных областей применения промышленные ферменты можно разделить на: (1) ферменты в пищевой промышленности, (2) ферменты для технологических добавок, (3) ферменты в качестве промышленных биокатализаторов, (4) ферменты в генной инженерии и (5) ) Ферменты в косметике.
Сегодня ферменты рассматриваются как основа биотехнологии, потому что они являются основными инструментами для нескольких биотехнологических методов (рестрикция генов, лигирование и клонирование и т. д.), биопроцессов (ферментация и культивирование клеток), а также для аналитики в организме человека. и анималотерапия в качестве лекарств или мишеней для лекарств. Кроме того, они находят применение в ряде других отраслей, таких как производство продуктов питания и кормов, текстильная промышленность, обработка сточных вод и отходов, бумажная, кожевенная, хлебопекарная, пивоваренная, молочная, фармацевтическая, кондитерская и т. д.(Панди и др., 2006).
Используемые в настоящее время ферменты также обнаружены у животных (пепсин, трипсин, панкратин и химозин) и растений (папаин, бромелаин и фицин), но большинство из них микробного происхождения, такие как глюкоамилаза, α-амилаза, пектиназы и т. д. Преимуществом использования микробов для производства ферментов является их более высокая способность к росту, более высокая производительность и более легкая генетическая манипуляция для увеличения производства ферментов и т. д. Ферменты, полученные из микробов, называются микробными ферментами.Микробы в основном используются в промышленности для производства ферментов. Кроме того, микробные ферменты поставляются, хорошо стандартизированы и продаются несколькими конкурирующими компаниями по всему миру. В зависимости от типа процесса ферменты могут быть использованы в растворимой форме (животные протеазы и липазы в кожевенном производстве) и в иммобилизованной форме (изомеризация глюкозы во фруктозу глюкозоизомеразой).
д. Преимуществом использования микробов для производства ферментов является их более высокая способность к росту, более высокая производительность и более легкая генетическая манипуляция для увеличения производства ферментов и т. д. Ферменты, полученные из микробов, называются микробными ферментами.Микробы в основном используются в промышленности для производства ферментов. Кроме того, микробные ферменты поставляются, хорошо стандартизированы и продаются несколькими конкурирующими компаниями по всему миру. В зависимости от типа процесса ферменты могут быть использованы в растворимой форме (животные протеазы и липазы в кожевенном производстве) и в иммобилизованной форме (изомеризация глюкозы во фруктозу глюкозоизомеразой).
Ферменты: принципы и применение в биотехнологии
Кинетика ферментов
Кинетика ферментов изучает факторы, определяющие скорость реакций, катализируемых ферментами.В нем используются некоторые математические уравнения, которые могут сбить с толку учащихся, когда они впервые сталкиваются с ними. Однако теория кинетики логична и проста, и необходимо развить понимание этого предмета, чтобы иметь возможность оценить роль ферментов как в обмене веществ, так и в биотехнологии.
Однако теория кинетики логична и проста, и необходимо развить понимание этого предмета, чтобы иметь возможность оценить роль ферментов как в обмене веществ, так и в биотехнологии.
Анализы (измерения) ферментативной активности могут выполняться как в периодическом, так и в непрерывном режиме. Прерывистые методы включают смешивание субстрата и фермента вместе и измерение продукта, образующегося через заданный период времени, поэтому эти методы, как правило, просты и быстры в выполнении.В общем, мы будем использовать такие прерывистые анализы, когда мы мало знаем о системе (и проводим предварительные исследования) или, наоборот, когда мы много знаем о системе и уверены, что выбранный нами временной интервал является подходящим.
В непрерывных ферментативных анализах мы обычно изучаем скорость реакции, катализируемой ферментом, путем смешивания фермента с субстратом и непрерывного измерения внешнего вида продукта с течением времени. Конечно, с тем же успехом мы могли бы измерить скорость реакции, измерив исчезновение субстрата с течением времени. Помимо фактического направления (одно увеличение и одно уменьшение), два значения будут идентичными. В экспериментах по кинетике ферментов для удобства мы очень часто используем искусственный субстрат, называемый хромогеном, который дает ярко окрашенный продукт, что позволяет легко отслеживать реакцию с помощью колориметра или спектрофотометра. Однако на самом деле мы могли бы использовать любое доступное аналитическое оборудование, способное измерять концентрацию либо продукта, либо субстрата.
Помимо фактического направления (одно увеличение и одно уменьшение), два значения будут идентичными. В экспериментах по кинетике ферментов для удобства мы очень часто используем искусственный субстрат, называемый хромогеном, который дает ярко окрашенный продукт, что позволяет легко отслеживать реакцию с помощью колориметра или спектрофотометра. Однако на самом деле мы могли бы использовать любое доступное аналитическое оборудование, способное измерять концентрацию либо продукта, либо субстрата.
Почти во всех случаях мы также добавляем в смесь буферный раствор.Как мы увидим, на активность ферментов сильно влияет рН, поэтому важно установить рН на определенном уровне и поддерживать его постоянным на протяжении всего эксперимента.
Таким образом, наш первый эксперимент по кинетике ферментов может включать смешивание раствора субстрата (хромогена) с буферным раствором и добавление фермента. Затем эту смесь помещали в спектрофотометр и измеряли внешний вид окрашенного продукта. Это позволило бы нам проследить быструю реакцию, которая через несколько секунд или минут может начать замедляться, как показано на рис.
Это позволило бы нам проследить быструю реакцию, которая через несколько секунд или минут может начать замедляться, как показано на рис.
Образование продукта в реакции, катализируемой ферментами, в зависимости от времени.
Распространенной причиной такого замедления скорости (скорости) реакции является то, что субстрат в смеси израсходован и, таким образом, становится лимитирующим. В качестве альтернативы может быть, что фермент нестабилен и денатурирует в ходе эксперимента, или может быть, что pH смеси меняется, поскольку многие реакции либо потребляют, либо выделяют протоны. По этим причинам, когда нас просят указать скорость реакции, мы делаем это сразу после добавления фермента и когда ни одно из вышеупомянутых ограничений не применимо.Мы называем эту начальную быструю скорость начальной скоростью ( v 0 ). Измерение скорости реакции на этой ранней стадии также довольно просто, так как скорость фактически линейна, поэтому мы можем просто провести прямую линию и измерить градиент (путем деления изменения концентрации на временной интервал), чтобы оценить реакцию. ставка за этот период.
ставка за этот период.
Теперь мы можем провести ряд аналогичных анализов ферментов, чтобы оценить, как изменяется начальная скорость при изменении концентрации субстрата или фермента или при изменении рН.Эти исследования помогут нам охарактеризовать свойства изучаемого фермента.
Зависимость между концентрацией фермента и скоростью реакции обычно проста. Если мы повторим только что описанный опыт, но добавим на 10% больше фермента, то реакция пойдет на 10% быстрее, а если мы удвоим концентрацию фермента, реакция пойдет вдвое быстрее. Таким образом, существует простая линейная зависимость между скоростью реакции и количеством фермента, способного катализировать реакцию.
Зависимость между концентрацией фермента и скоростью реакции, катализируемой ферментом.
Это соотношение применимо как к ферментам in vivo , так и к ферментам, используемым в биотехнологических приложениях, где регулирование количества присутствующего фермента может контролировать скорость реакции.
Когда мы проводим серию анализов ферментов с использованием одной и той же концентрации фермента, но с диапазоном различных концентраций субстрата, возникает несколько более сложная взаимосвязь, как показано на рис.Первоначально при увеличении концентрации субстрата скорость реакции значительно увеличивается. Однако по мере дальнейшего увеличения концентрации субстрата влияние на скорость реакции начинает снижаться, пока не будет достигнута стадия, когда увеличение концентрации субстрата оказывает незначительное дальнейшее влияние на скорость реакции. В этот момент считается, что фермент приближается к насыщению субстратом и демонстрирует максимальную скорость ( V max ). Обратите внимание, что эта максимальная скорость на самом деле является теоретическим пределом, который не может быть действительно достигнут ни в одном эксперименте, хотя мы можем подойти к нему очень близко.
Связь между концентрацией субстрата и скоростью реакции, катализируемой ферментом.
Описанное здесь соотношение довольно распространено, и математик сразу определил бы его как прямоугольную гиперболу. Уравнение, описывающее такую связь, выглядит следующим образом:
Таким образом, две константы a и b позволяют нам описать эту гиперболическую зависимость, как и линейную зависимость ( y = m x + c ), которую можно выразить двумя константами м (склон) и c (пересечение).
Фактически мы уже определили константу a — это V max . Константа b немного сложнее, так как это значение по оси x дает половину максимального значения y . В энзимологии мы называем это константой Михаэлиса ( K m ), которая определяется как концентрация субстрата, дающая половину максимальной скорости.
Наше окончательное уравнение, обычно называемое уравнением Михаэлиса-Ментен, таким образом, принимает следующий вид:
Начальная скорость реакции(v0)=Vmax×Концентрация субстратаКонцентрация субстрата+Km
В 1913 г. Леонор Михаэлис и Мод Ментен впервые показали, что на самом деле можно математически вывести это уравнение из первых принципов с некоторыми простыми предположениями о способ взаимодействия фермента с субстратом с образованием продукта.Центральное место в их выводах занимает концепция, согласно которой реакция протекает через образование комплекса ES, который после образования может либо диссоциировать (продуктивно) с высвобождением продукта, либо диссоциировать в обратном направлении без образования продукта. Таким образом, реакцию можно представить следующим образом, где k 1 , k -1 и k 2 являются константами скорости трех отдельных стадий реакции:
Леонор Михаэлис и Мод Ментен впервые показали, что на самом деле можно математически вывести это уравнение из первых принципов с некоторыми простыми предположениями о способ взаимодействия фермента с субстратом с образованием продукта.Центральное место в их выводах занимает концепция, согласно которой реакция протекает через образование комплекса ES, который после образования может либо диссоциировать (продуктивно) с высвобождением продукта, либо диссоциировать в обратном направлении без образования продукта. Таким образом, реакцию можно представить следующим образом, где k 1 , k -1 и k 2 являются константами скорости трех отдельных стадий реакции:
Вывод Михаэлиса–Ментен требует двух важных предположений.Первое предположение состоит в том, что мы рассматриваем начальную скорость реакции ( v 0 ), когда концентрация продукта будет пренебрежимо мала (т.е. [S] ≫ [P]), так что мы можем игнорировать возможность любой продукт, превращающийся в субстрат. Второе предположение заключается в том, что концентрация субстрата значительно превышает концентрацию фермента (т. е. [S] ≫ [E]).
Второе предположение заключается в том, что концентрация субстрата значительно превышает концентрацию фермента (т. е. [S] ≫ [E]).
Вывод начинается с уравнения для выражения начальной скорости, скорости образования продукта, как скорости, с которой комплекс ES диссоциирует с образованием продукта.Это основано на константе скорости k 2 и концентрации комплекса ES следующим образом:
Поскольку ES является промежуточным продуктом, его концентрация неизвестна, но мы можем выразить ее через известные значения. В стационарном приближении можно считать, что хотя концентрация субстрата и продукта изменяется, концентрация самого комплекса ЭС остается постоянной. Следовательно, скорость образования комплекса ЭС и скорость его распада должны уравновешиваться, где:
Скорость образования комплекса ES = k 1 [E][ S ]
а также
Скорость распада комплекса ЭС = ( k −1 + k 2 )[ЭС]
Следовательно, в установившемся режиме:
k 1 [E][S] = k −1 + k 2 [ES]
Это уравнение можно преобразовать следующим образом:
Постоянная Михаэлиса K m может быть определена следующим образом:
Таким образом, уравнение 2 можно упростить до:
Поскольку концентрация субстрата значительно превышает концентрацию фермента (т.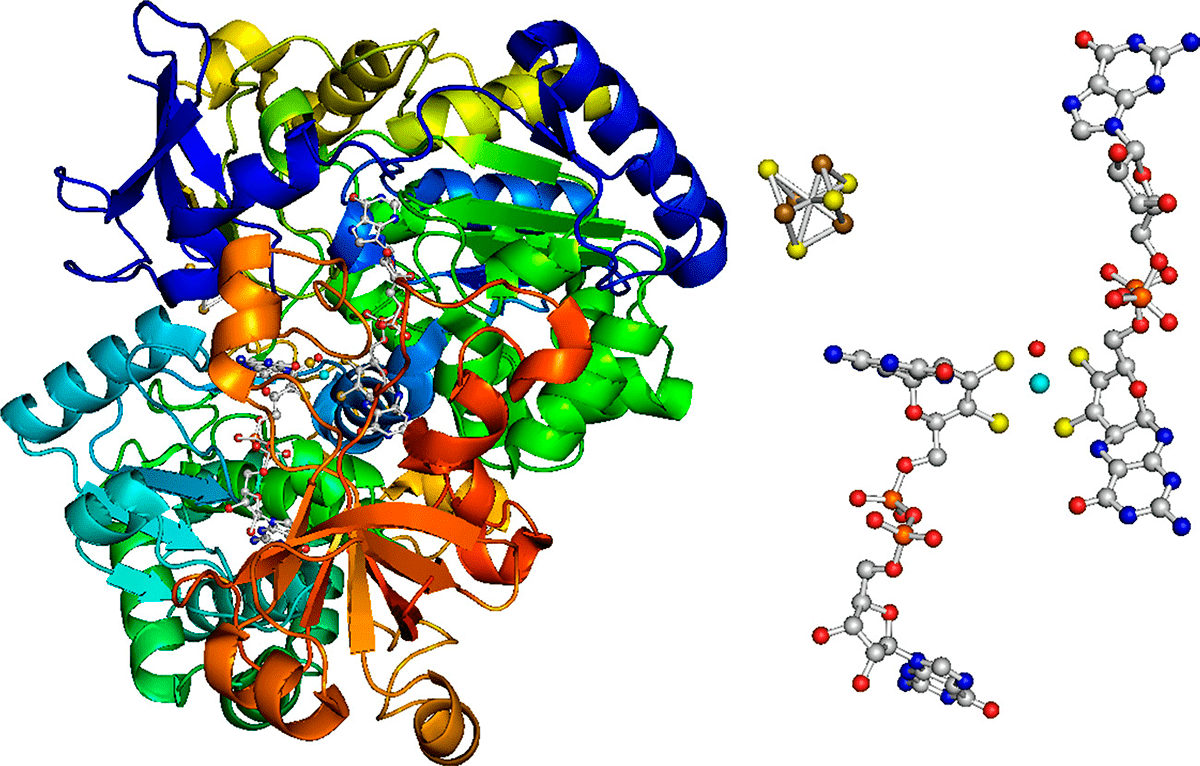 е. [S] ≫ [E]), концентрация несвязанного субстрата [S] практически равна общей концентрации субстрата. Концентрация несвязанного фермента [E] равна общей концентрации фермента [E] T за вычетом концентрации в сочетании с субстратом [ES]. Введение этих членов в уравнение 3 и решение для ES дает нам следующее:
е. [S] ≫ [E]), концентрация несвязанного субстрата [S] практически равна общей концентрации субстрата. Концентрация несвязанного фермента [E] равна общей концентрации фермента [E] T за вычетом концентрации в сочетании с субстратом [ES]. Введение этих членов в уравнение 3 и решение для ES дает нам следующее:
Затем мы можем ввести этот член в уравнение 1, чтобы получить:
Термин k 2 [E] T фактически представляет V max , максимальную скорость.Таким образом, Михаэлис и Ментен смогли вывести свое окончательное уравнение как:
Более подробный вывод уравнения Михаэлиса–Ментен можно найти во многих учебниках по биохимии (см. раздел 4 раздела «Рекомендуемая литература»). Есть также несколько очень полезных веб-учебников по этому вопросу.
Константы Михаэлиса были определены для многих широко используемых ферментов и обычно находятся в нижнем миллимолярном диапазоне ().
Таблица 5.

Типовой диапазон значений константы Михаэлиса.
| Фермент + | К м (ммоль л -1 ) | |
|---|---|---|
| карбоангидразы | 26 | |
| химотрипсин 15 | ||
| рибонуклеазы 8 | ||
| Тирозил-ТРНК Синтетаза | 0.9 | |
| Pepsin | ||
| 0.3 | 0.3 |
Следует отметить, что ферменты, которые катализируют ту же реакцию, но которые получают из разных организмов, могут широко различаться К м значений.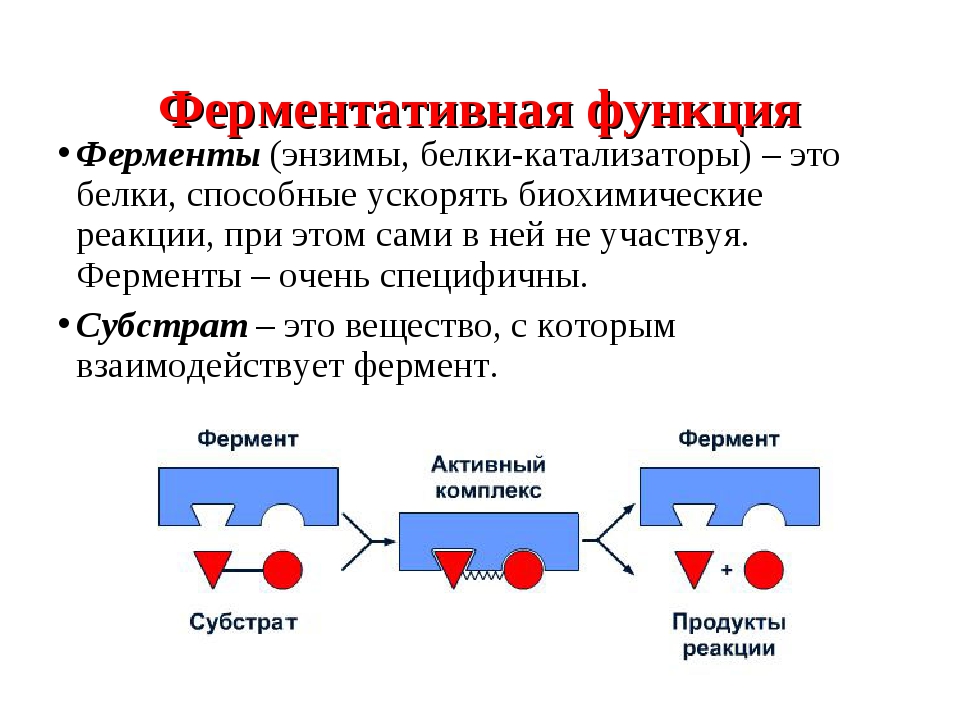 Кроме того, фермент с несколькими субстратами может иметь совершенно разные значения K m для каждого субстрата.
Кроме того, фермент с несколькими субстратами может иметь совершенно разные значения K m для каждого субстрата.
Низкое значение K m указывает на то, что для насыщения ферменту требуется лишь небольшое количество субстрата. Поэтому максимальная скорость достигается при относительно низких концентрациях субстрата. Высокое значение K m указывает на необходимость высоких концентраций субстрата для достижения максимальной скорости реакции.Таким образом, мы обычно ссылаемся на K m как на меру сродства фермента к его субстрату — на самом деле это обратная мера, где высокое значение K m указывает на низкое сродство, и наоборот.
Значение K m говорит нам несколько важных вещей о конкретном ферменте.
Фермент с низким значением K m по отношению к физиологической концентрации субстрата, вероятно, всегда будет насыщен субстратом и, следовательно, будет действовать с постоянной скоростью, независимо от изменений концентрации субстрата в физиологический диапазон.

Фермент с высоким значением K m по отношению к физиологической концентрации субстрата не будет насыщаться субстратом, поэтому его активность будет варьироваться в зависимости от концентрации субстрата, поэтому скорость образования продукта будет зависеть от наличия субстрата.
Если фермент действует на несколько субстратов, субстрат с наименьшим значением K m часто считается «естественным» субстратом этого фермента, хотя это может быть не так во всех случаях.
Если два фермента (со схожими V max ) в разных метаболических путях конкурируют за один и тот же субстрат, то, зная значения K m для двух ферментов, мы можем предсказать относительную активность два пути. По сути, путь, который имеет фермент с более низким значением K m , вероятно, будет «предпочтительным путем», и в большинстве условий по этому пути будет проходить больше субстрата.
 Например, фосфофруктокиназа (ФФК) является ферментом, который катализирует первую стадию гликолитического пути, который генерирует энергию в форме АТФ для клетки, тогда как глюкозо-1-фосфат уридилилтрансфераза (ГУТ) является ферментом на ранней стадии пути. что приводит к синтезу гликогена (молекулы для хранения энергии).Оба фермента используют монофосфаты гексозы в качестве субстрата, но K m PFK для его субстрата ниже, чем у GUT для его субстрата. Таким образом, при более низких концентрациях гексозофосфата в клетках PFK будет активна, а GUT будет в значительной степени неактивен. При более высоких концентрациях гексозофосфата оба пути будут активны. Это означает, что клетки запасают гликоген только в периоды избытка и всегда отдают предпочтение пути производства АТФ, который является более важной функцией.
Например, фосфофруктокиназа (ФФК) является ферментом, который катализирует первую стадию гликолитического пути, который генерирует энергию в форме АТФ для клетки, тогда как глюкозо-1-фосфат уридилилтрансфераза (ГУТ) является ферментом на ранней стадии пути. что приводит к синтезу гликогена (молекулы для хранения энергии).Оба фермента используют монофосфаты гексозы в качестве субстрата, но K m PFK для его субстрата ниже, чем у GUT для его субстрата. Таким образом, при более низких концентрациях гексозофосфата в клетках PFK будет активна, а GUT будет в значительной степени неактивен. При более высоких концентрациях гексозофосфата оба пути будут активны. Это означает, что клетки запасают гликоген только в периоды избытка и всегда отдают предпочтение пути производства АТФ, который является более важной функцией.
Очень часто невозможно оценить значения K m по прямому графику зависимости скорости от концентрации субстрата (как показано на ), потому что мы не использовали достаточно высокие концентрации субстрата, чтобы даже близко приблизиться к оценке максимальной скорости, и поэтому мы не может оценить полумаксимальную скорость и, таким образом, K м . К счастью, мы можем построить наши экспериментальные данные немного по-другому, чтобы получить эти значения.Наиболее часто используемой альтернативой является график Лайнуивера-Берка (часто называемый графиком двойной взаимности). Этот график линеаризует зависимость гиперболической кривой, и полученную линию легко экстраполировать, что позволяет оценить V max и K m . Например, если бы мы получили только первые семь точек данных в , нам было бы трудно оценить V max по прямому графику, как показано на а.
К счастью, мы можем построить наши экспериментальные данные немного по-другому, чтобы получить эти значения.Наиболее часто используемой альтернативой является график Лайнуивера-Берка (часто называемый графиком двойной взаимности). Этот график линеаризует зависимость гиперболической кривой, и полученную линию легко экстраполировать, что позволяет оценить V max и K m . Например, если бы мы получили только первые семь точек данных в , нам было бы трудно оценить V max по прямому графику, как показано на а.
(а) Прямой участок.(б) График Лайнуивера-Берка тех же кинетических данных.
Однако, как показано на рис. b, если эти семь точек нанести на график зависимости 1/скорость от 1/концентрация субстрата (т. е. график двойной обратной зависимости), данные линеаризуются, и линию можно легко экстраполировать на слева, чтобы обеспечить точки пересечения как по оси y , так и по оси x , из которых V max и K m соответственно могут быть оценены.
Одним из существенных практических недостатков использования графика Лайнуивера-Берка является чрезмерное влияние, которое он оказывает на измерения, выполненные при самых низких концентрациях субстрата.Эти концентрации вполне могут быть наиболее подвержены ошибкам (из-за трудностей при многократном разведении) и приводят к скорости реакции, которая, поскольку она низкая, также может быть наиболее подвержена ошибкам измерения. Часто, как показано на , такие точки при преобразовании на графике Лайнуивера-Берка оказывают значительное влияние на линию наилучшего соответствия, оцененную по данным, и, следовательно, на экстраполированные значения как V max , так и K м . Два набора точек, показанных на рисунке, идентичны, за исключением единственной точки в правом верхнем углу, которая отражает (из-за двойного взаимного характера графика) единственную точку, полученную из очень низкой концентрации субстрата и низкой скорости реакции.Однако эта единственная точка может оказать огромное влияние на линию наилучшего соответствия и сопутствующие оценки кинетических констант.
График Лайнуивера-Берка сходных кинетических данных, отличающихся только одним. (Конечная точка данных (a) 1/v 0,03 при 1/S 0,2 и (b) 1/v 0,031 при 1/S 0,18).
На самом деле можно использовать и другие кинетические графики, в том числе график Иди-Хофсти, график Хейнса и график Эйзенталя-Корниша-Боудена, которые менее подвержены таким проблемам.Однако график Лайнуивера-Берка по-прежнему является наиболее часто описываемым кинетическим графиком в большинстве учебников по энзимологии и, таким образом, сохраняет свое влияние в студенческом образовании.
Ферменты зависят от pH и температуры
Различные факторы окружающей среды могут влиять на скорость катализируемых ферментами реакций посредством обратимых или необратимых изменений в структуре белка. Влияние pH и температуры, как правило, хорошо изучено.
Большинство ферментов имеют характерный оптимальный рН, при котором скорость катализируемой реакции максимальна, а выше и ниже этого значения скорость снижается ().
РН-профиль β-глюкозидазы.
Профиль pH зависит от ряда факторов. При изменении pH ионизация групп как в активном центре фермента, так и на субстрате может изменяться, влияя на скорость связывания субстрата с активным центром. Эти эффекты часто обратимы. Например, если мы возьмем фермент с оптимальным pH (pH opt ) 7,0 и поместим его в среду с pH 6,0 или 8,0, свойства заряда фермента и субстрата могут быть субоптимальными, так что связывание и, следовательно, скорость реакции снижается.Если затем изменить рН до 7,0, свойства оптимального заряда и, следовательно, максимальная активность фермента часто восстанавливаются. Однако если мы поместим фермент в более экстремально кислую или щелочную среду (например, при рН 1 или 14), хотя эти условия могут фактически не привести к изменениям в очень стабильной ковалентной структуре белка (т. е. его конфигурации), они могут хорошо вызывают изменения в конформации (форме) белка, так что, когда он возвращается к pH 7,0, исходная конформация и, следовательно, полная каталитическая активность фермента не восстанавливаются.
Следует отметить, что оптимальный рН фермента может не совпадать с рН его нормальной внутриклеточной среды. Это указывает на то, что локальный рН может оказывать контролирующее влияние на активность фермента.
Влияние температуры на активность ферментов довольно сложное, и его можно рассматривать как две силы, действующие одновременно, но в противоположных направлениях. С повышением температуры скорость движения молекул и, следовательно, скорость реакции увеличивается, но в то же время происходит прогрессирующая инактивация, вызванная денатурацией белка-фермента.Это становится более выраженным по мере повышения температуры, так что наблюдается кажущийся температурный оптимум (T opt ) ().
Влияние температуры на активность ферментов.
Термическая денатурация зависит от времени, и для фермента термин «оптимальная температура» не имеет реального значения, если не зафиксирована продолжительность воздействия этой температуры. Термическую стабильность фермента можно определить, сначала подвергая белок воздействию диапазона температур в течение фиксированного периода времени, а затем измеряя его активность при одной благоприятной температуре (например,грамм. 25°С).
25°С).
Температура, при которой денатурация становится важной, варьируется от одного фермента к другому. В норме он незначителен ниже 30°C и становится заметным выше 40°C. Как правило, ферменты, полученные из микробных источников, демонстрируют гораздо более высокую термостабильность, чем ферменты, полученные из млекопитающих, и ферменты, полученные из чрезвычайно термофильных микроорганизмов, таких как термолизин (протеаза из Bacillus thermoproteolyticus ) и Taq-полимераза (ДНК-полимераза из Thermus aquaticus). ), может быть полностью термостабильным при 70°C и все еще сохранять значительный уровень активности даже при 100°C.
Аллостерические регуляторы и контроль активности ферментов
Потратив время на изучение кинетики ферментов и зависимости Михаэлиса-Ментен, часто приходится смущаться, обнаружив, что некоторые из наиболее важных ферментов на самом деле не обладают такими свойствами. Аллостерические ферменты являются ключевыми регуляторными ферментами, которые контролируют активность метаболических путей, реагируя на ингибиторы и активаторы. Эти ферменты на самом деле показывают сигмоидальную (S-образную) зависимость между скоростью реакции и концентрацией субстрата (), а не обычную гиперболическую зависимость.) и неаллостерические (•) ферменты с одинаковым сродством и максимальной скоростью.
Эти ферменты на самом деле показывают сигмоидальную (S-образную) зависимость между скоростью реакции и концентрацией субстрата (), а не обычную гиперболическую зависимость.) и неаллостерические (•) ферменты с одинаковым сродством и максимальной скоростью.
Большинство аллостерических ферментов являются полимерными, то есть они состоят как минимум из двух (а часто и из многих) отдельных полипептидных цепей. У них также есть несколько активных центров, где субстрат может связываться. Большая часть нашего понимания функции аллостерических ферментов основана на исследованиях гемоглобина, который, хотя и не является ферментом, связывает кислород аналогичным кооперативным образом и, таким образом, также демонстрирует эту сигмоидальную зависимость.Аллостерические ферменты изначально имеют низкое сродство к субстрату, но когда связывается одна молекула субстрата, это может привести к разрыву некоторых связей внутри фермента и тем самым изменить форму белка, так что оставшиеся активные центры смогут связываться с более высоким сродством. Поэтому аллостерические ферменты часто описываются как переходящие из напряженного состояния или Т-состояния (низкая аффинность), в котором субстрат не связан, в расслабленное состояние или R-состояние (высокая аффинность), когда субстрат связывается. Другие молекулы также могут связываться с аллостерическими ферментами в дополнительных регуляторных сайтах (т.е. не на активном сайте). Таким образом, молекулы, которые стабилизируют белок в его Т-состоянии, действуют как аллостерические ингибиторы, тогда как молекулы, переводящие белок в его R-состояние, действуют как аллостерические активаторы или промоторы.
Поэтому аллостерические ферменты часто описываются как переходящие из напряженного состояния или Т-состояния (низкая аффинность), в котором субстрат не связан, в расслабленное состояние или R-состояние (высокая аффинность), когда субстрат связывается. Другие молекулы также могут связываться с аллостерическими ферментами в дополнительных регуляторных сайтах (т.е. не на активном сайте). Таким образом, молекулы, которые стабилизируют белок в его Т-состоянии, действуют как аллостерические ингибиторы, тогда как молекулы, переводящие белок в его R-состояние, действуют как аллостерические активаторы или промоторы.
Хорошим примером аллостерического фермента является аспартатранскарбамоилаза (ATCase), ключевой регуляторный фермент, который катализирует первую обязательную стадию в последовательности реакций, производящих пиримидиновые нуклеотиды, которые являются важными компонентами ДНК и РНК. Реакция выглядит следующим образом:
Конечный продукт метаболического пути, пиримидиннуклеотид цитидинтрифосфат (CTP), является активным аллостерическим ингибитором фермента ATCase. Следовательно, когда в клетке имеется высокая концентрация CTP, это оказывает обратное воздействие и ингибирует фермент ATCase, снижая его активность и, таким образом, снижая скорость производства дополнительных пиримидиновых нуклеотидов. По мере снижения концентрации CTP в клетке происходит ингибирование ATCase, и в результате повышение активности фермента приводит к продукции большего количества пиримидиновых нуклеотидов. Это торможение с отрицательной обратной связью является важным элементом биохимического гомеостаза внутри клетки.Однако для синтеза ДНК и РНК клетке требуются не только пиримидиновые нуклеотиды, но и пуриновые нуклеотиды, причем примерно в равных пропорциях. Синтез пуринов происходит по другому пути, но, что интересно, конечный продукт, пуриновый нуклеотид аденозинтрифосфат (АТФ), является мощным активатором фермента АТСазы. Это логично, поскольку, когда клетка содержит высокие концентрации пуриновых нуклеотидов, ей потребуются столь же высокие концентрации пиримидиновых нуклеотидов, чтобы эти два типа нуклеотидов объединились с образованием полимеров ДНК и РНК.
Следовательно, когда в клетке имеется высокая концентрация CTP, это оказывает обратное воздействие и ингибирует фермент ATCase, снижая его активность и, таким образом, снижая скорость производства дополнительных пиримидиновых нуклеотидов. По мере снижения концентрации CTP в клетке происходит ингибирование ATCase, и в результате повышение активности фермента приводит к продукции большего количества пиримидиновых нуклеотидов. Это торможение с отрицательной обратной связью является важным элементом биохимического гомеостаза внутри клетки.Однако для синтеза ДНК и РНК клетке требуются не только пиримидиновые нуклеотиды, но и пуриновые нуклеотиды, причем примерно в равных пропорциях. Синтез пуринов происходит по другому пути, но, что интересно, конечный продукт, пуриновый нуклеотид аденозинтрифосфат (АТФ), является мощным активатором фермента АТСазы. Это логично, поскольку, когда клетка содержит высокие концентрации пуриновых нуклеотидов, ей потребуются столь же высокие концентрации пиримидиновых нуклеотидов, чтобы эти два типа нуклеотидов объединились с образованием полимеров ДНК и РНК. Таким образом, ATCase способна регулировать производство пиримидиновых нуклеотидов в клетке в соответствии с клеточной потребностью, а также обеспечивать синхронизацию синтеза пиримидиновых нуклеотидов с синтезом пуриновых нуклеотидов — элегантный биохимический механизм регуляции чрезвычайно важного метаболического процесса.
Таким образом, ATCase способна регулировать производство пиримидиновых нуклеотидов в клетке в соответствии с клеточной потребностью, а также обеспечивать синхронизацию синтеза пиримидиновых нуклеотидов с синтезом пуриновых нуклеотидов — элегантный биохимический механизм регуляции чрезвычайно важного метаболического процесса.
Известны некоторые редкие, хотя и важные случаи мономерных ферментов, которые имеют только один сайт связывания субстрата, но способны демонстрировать сигмоидальную кинетику реакции, характерную для аллостерических ферментов.Особого внимания в этом контексте заслуживает мономерный фермент глюкокиназа (также называемый гексокиназой IV), который катализирует фосфорилирование глюкозы до глюкозо-6-фосфата (который затем может либо метаболизироваться гликолитическим путем, либо использоваться в синтезе гликогена). Было высказано предположение, что такое кинетическое поведение является результатом того, что отдельные молекулы глюкокиназы существуют в одной из двух форм — в форме с низким сродством и в форме с высоким сродством. Низкоаффинная форма фермента реагирует со своим субстратом (глюкозой), затем превращается в высокоаффинную форму и остается в этом состоянии в течение короткого времени, прежде чем медленно вернуться к исходной низкоаффинной форме (демонстрируя так называется медленным переходом).Следовательно, при высоких концентрациях субстрата фермент, вероятно, будет реагировать со второй молекулой субстрата вскоре после первой (т. е. все еще в своей высокоаффинной форме), тогда как при более низких концентрациях субстрата фермент может перейти обратно в свою низкоаффинную форму до того, как он реагирует с последующими молекулами субстрата. Это приводит к его характерной сигмоидальной кинетике реакции.
Низкоаффинная форма фермента реагирует со своим субстратом (глюкозой), затем превращается в высокоаффинную форму и остается в этом состоянии в течение короткого времени, прежде чем медленно вернуться к исходной низкоаффинной форме (демонстрируя так называется медленным переходом).Следовательно, при высоких концентрациях субстрата фермент, вероятно, будет реагировать со второй молекулой субстрата вскоре после первой (т. е. все еще в своей высокоаффинной форме), тогда как при более низких концентрациях субстрата фермент может перейти обратно в свою низкоаффинную форму до того, как он реагирует с последующими молекулами субстрата. Это приводит к его характерной сигмоидальной кинетике реакции.
Что такое пищеварительные ферменты: природные источники и добавки
Пищеварительные ферменты играют ключевую роль в расщеплении пищи, которую вы едите.Эти белки ускоряют химические реакции, которые превращают питательные вещества в вещества, которые ваш пищеварительный тракт может усвоить.
Ваша слюна содержит пищеварительные ферменты. Некоторые из ваших органов, включая поджелудочную железу, желчный пузырь и печень, также выделяют их. Клетки на поверхности вашего кишечника тоже их хранят.
Различные типы ферментов Цель Отличные питательные вещества:
- Amylase ломается углеводы и крахмалы
- Протеазы
- Протеазы Работы на белках
- Липаза ручки жиров
Природные источники пищеварительных ферментов
Фрукты, овощи, и другие продукты имеют естественные пищеварительные ферменты.Их употребление может улучшить пищеварение.
- Мед, особенно сырой, содержит амилазу и протеазу.
- Манго и бананы содержат амилазу, которая также способствует созреванию фруктов.
- Папайя содержит тип протеазы, называемый папаином.
- Авокадо содержит пищеварительный фермент липазу.
- Квашеная капуста, или квашеная капуста, в процессе брожения собирает пищеварительные ферменты.

Если ваш организм не вырабатывает достаточно пищеварительных ферментов, он не может хорошо переваривать пищу.Это может означать боли в животе, диарею, газы или другие болезненные симптомы.
Некоторые расстройства пищеварения препятствуют выработке организмом достаточного количества ферментов, например:
Непереносимость лактозы. Это когда в тонком кишечнике не вырабатывается достаточное количество фермента лактазы, расщепляющего природный сахар в молоке, называемый лактозой. При нехватке лактазы лактоза в молочных продуктах, которые вы едите, попадает прямо в толстую кишку, а не всасывается в организм. Затем он соединяется с бактериями и вызывает неприятные желудочные симптомы.
Существует три вида непереносимости лактозы:
Первичная. Вы рождены с геном, делающим вас непереносимым лактозой. Ген чаще всего встречается у людей африканского, азиатского или латиноамериканского происхождения. В детстве уровень лактазы резко падает. Тогда вы больше не сможете так легко переваривать молочные продукты. Это наиболее распространенный тип непереносимости лактозы.
Тогда вы больше не сможете так легко переваривать молочные продукты. Это наиболее распространенный тип непереносимости лактозы.
Среднее. Ваш тонкий кишечник вырабатывает меньше лактазы после болезни, травмы или операции.Это также может быть симптомом как целиакии, так и болезни Крона.
Врожденный или развившийся. С момента вашего рождения ваше тело не вырабатывает лактазу. Это редкость. Вы должны унаследовать ген этого как от матери, так и от отца.
Людям с непереносимостью лактозы необходимо часто опорожнять кишечник, у них возникают газы и вздутие живота после еды или употребления молочных продуктов, таких как молоко и мороженое. Некоторые люди могут справиться с симптомами, употребляя меньше молочных продуктов.Другие полностью избегают молочных продуктов или выбирают безлактозные продукты и напитки.
Экзокринная недостаточность поджелудочной железы (ЭНПЖ). Это может произойти, когда другое заболевание повреждает поджелудочную железу. К частым причинам ЭНПЖ относятся:
К частым причинам ЭНПЖ относятся:
Для лечения ЭНПЖ врач может предложить изменить образ жизни, например:
- Если вы курите, бросьте курить
- Избегайте употребления алкоголя
- Соблюдайте диету с низким содержанием жиров
- Принимайте витамины и минеральные таблетки
Лекарства, отпускаемые по рецепту, также могут облегчить ваши симптомы.
Ферментные добавки
Возможно, вы заметили пилюли, порошки и жидкости, содержащие пищеварительные ферменты, в проходах аптек или магазинов товаров для здоровья и питания. Эти добавки могут облегчить симптомы расстройства пищеварения. Ваш возраст, вес и другие факторы определяют правильную дозу. Но помните, что безрецептурные ферментные добавки не регулируются FDA так же, как отпускаемые по рецепту лекарства. Производители этих продуктов не должны доказывать, что они эффективны.
Всегда консультируйтесь со своим врачом, прежде чем пробовать какие-либо добавки.Необходимы дополнительные исследования, чтобы изучить, насколько они безопасны и насколько хорошо они работают. Но безрецептурные добавки лактазы помогают многим людям с непереносимостью лактозы, и есть добавка, которая помогает людям переваривать сахара, содержащиеся в бобах.
Но безрецептурные добавки лактазы помогают многим людям с непереносимостью лактозы, и есть добавка, которая помогает людям переваривать сахара, содержащиеся в бобах.
Эксперты не рекомендуют добавки лактазы для детей в возрасте до 4 лет. Кроме того, поговорите со своим врачом о плюсах и минусах, если вы беременны или кормите грудью.
В настоящее время большинство ферментных продуктов производится на животной основе. Исследователи предсказывают, что в будущем продукты на основе растений и бактерий могут стать более распространенными.
Что такое ферменты? — Определение и объяснение — Видео и стенограмма урока
Структура и функция
Как и все белки, ферменты состоят из одной или нескольких длинных цепочек взаимосвязанных аминокислот. Каждый фермент обладает уникальной последовательностью аминокислот, которая заставляет его складываться в характерную форму. Аминокислотная последовательность фермента определяется определенным геном в ядре клетки. Это гарантирует, что каждая копия фермента будет такой же, как и все остальные.![]()
На поверхности каждого фермента есть специальная щель, называемая активным центром , которая обеспечивает место, где реагенты могут «встречаться» и взаимодействовать. Подобно замку и ключу, активный центр фермента вмещает только определенные реагенты, и данный фермент может катализировать только один тип химической реакции.
Например, при производстве гемоглобина (переносящего кислород пигмента в красных кровяных тельцах) один атом железа должен быть вставлен в центр молекулы, чтобы сделать ее функциональной.Феррохелатаза соединяет реагенты (железо и пустую молекулу), катализирует их соединение и высвобождает железосодержащую молекулу. Это единственная реакция, катализируемая феррохелатазой. Имейте в виду, что ферменты могут объединять реагенты (как при синтезе гемоглобина), они могут расщеплять один реагент на несколько продуктов или просто превращать один реагент в один продукт, который выглядит иначе, чем исходный реагент.
Когда реагенты попадают в активный центр фермента, фермент претерпевает временное изменение формы, что способствует взаимодействию между реагентами. По завершении химической реакции из активного центра высвобождается специфический продукт, фермент восстанавливает исходную конформацию, и реакция может начаться снова с новыми реагентами.
По завершении химической реакции из активного центра высвобождается специфический продукт, фермент восстанавливает исходную конформацию, и реакция может начаться снова с новыми реагентами.
Многие ферменты включены в метаболические пути. Метаболический путь представляет собой серию химических реакций, которые превращают один или несколько реагентов в конечный продукт, необходимый клетке. Ферменты в метаболическом пути — подобно тому, как люди передают ведро с водой через бригаду ведер — перемещают реагент до тех пор, пока не будет произведен конечный продукт.Метаболический путь может быть очень коротким или состоять из многих стадий и множества ферментов. Метаболический путь, который превращает триптофан (аминокислота, содержащаяся в пищевом белке) в серотонин (химическое вещество, необходимое для нормальной работы мозга), состоит всего из двух шагов.
Для того, чтобы функционировать, многие ферменты нуждаются в помощи кофакторов или коферментов. Кофакторы часто представляют собой ионы металлов, таких как цинк, медь, железо или магний. Магний, один из наиболее распространенных кофакторов, активирует сотни ферментов, в том числе те, которые производят ДНК, и многие из тех, которые помогают метаболизировать углеводы.
Магний, один из наиболее распространенных кофакторов, активирует сотни ферментов, в том числе те, которые производят ДНК, и многие из тех, которые помогают метаболизировать углеводы.
Многие коферменты получают из витаминов. На самом деле, одна из основных причин, по которой вам нужны витамины в вашем рационе, заключается в том, что они являются сырьем для необходимых коферментов. Например, витамин С необходим ферменту, который вырабатывает коллаген и строит здоровую кожу, кофермент, полученный из витамина В12, необходим для синтеза изоляции вокруг нервных клеток, а кофермент на основе витамина В6 жизненно важен для производства серотонина.
Коэнзимы и кофакторы связываются с активными центрами ферментов и участвуют в катализе, но обычно не считаются реагентами и не становятся частью продукта(ов) реакции.Во многих случаях кофакторы и коферменты выполняют функцию промежуточных переносчиков электронов, специфических атомов или функциональных групп, переносимых в ходе общей реакции.
Зачем нужны ферменты?
Один из непреложных законов природы гласит, что для запуска химической реакции требуется энергия. В конце концов, если вы хотите что-то изменить, вам придется приложить к этому определенные усилия. Для каждой химической реакции энергия активации — определенное количество энергии — должна быть приложена к реагентам, прежде чем реакция пойдет.Энергия активации подобна холму между реагентами и продуктом, и реагенты должны быть сброшены с этого холма, прежде чем реакция сможет продолжиться.
Вот где на помощь приходят ферменты: они снижают энергетический «холм», поэтому химические реакции могут начаться легче и протекать в условиях, «благоприятных для клеток». Ферменты метаболического пути также могут разделить одну высокоэнергетическую химическую реакцию на множество стадий, каждая из которых требует лишь части энергии, необходимой для всего процесса.Наконец, ферменты могут увеличить скорость реакции в миллионы раз, что очень важно для клеток, которым часто требуется большое количество определенного продукта всего за несколько секунд.
Регулирование ферментативной активности
Хотя ваши клетки не могут функционировать без ферментов, их каталитическую активность нельзя просто так оставить бесконтрольной. Это привело бы к ненужному потреблению сырья и откачиванию энергии из других важных процессов. И наоборот, ваши клетки должны быть в состоянии быстро производить больше копий данного фермента, когда метаболические потребности возрастают.Чтобы справиться с такими ситуациями, ваши клетки включают и выключают ферменты, регулируя их активность (подавление обратной связи) или увеличивая или уменьшая их доступность (генетический контроль).
Ингибирование по принципу обратной связи замедляет активность фермента, когда его продукт (или конечный продукт метаболического пути) начинает накапливаться. Ингибирование с обратной связью может осуществляться как конкурентно, так и неконкурентно.
- В конкурентном ингибировании активность фермента замедляется или останавливается, когда конечный продукт его метаболического пути присоединяется к активному центру фермента и предотвращает его взаимодействие с его обычными реагентами.
 Другими словами, ингибитор напрямую конкурирует за активный центр, «отталкивая» реагенты с дороги.
Другими словами, ингибитор напрямую конкурирует за активный центр, «отталкивая» реагенты с дороги. - При неконкурентном ингибировании ингибитор связывается со вторым сайтом фермента, называемым аллостерическим сайтом. Это изменяет форму активного центра фермента и предотвращает его взаимодействие с реагентами.
Генетический контроль — это сложный процесс, которым управляет ядро клетки. Когда требуется больше продуктов определенного фермента, регуляторные белки связываются с ДНК клетки и «включают» гены, которые производят этот фермент.И наоборот, когда определенный фермент или метаболический путь начинает производить слишком много продукта, различные регуляторные белки останавливают производство фермента, прикрепляясь к ДНК клетки и отключая те же самые гены.
Маркировка
Ученые постоянно открывают новые ферменты. Недавно открытые ферменты названы в соответствии с реагентом, на который они действуют, а затем действием, которое они выполняют. Суффикс -аза добавляется к названию, чтобы идентифицировать его как фермент. Каждый раз, когда вы видите -ase в конце длинного названия химического вещества, вы можете поспорить, что имеете дело с ферментом.Таким образом, сахараза — пищеварительный фермент, расщепляющий сахарозу (столовый сахар), а алкогольдегидрогеназа — фермент, обезвреживающий алкоголь путем удаления из него атомов водорода.
Суффикс -аза добавляется к названию, чтобы идентифицировать его как фермент. Каждый раз, когда вы видите -ase в конце длинного названия химического вещества, вы можете поспорить, что имеете дело с ферментом.Таким образом, сахараза — пищеварительный фермент, расщепляющий сахарозу (столовый сахар), а алкогольдегидрогеназа — фермент, обезвреживающий алкоголь путем удаления из него атомов водорода.
Резюме урока
Проще говоря, ферменты представляют собой белки, которые действуют как катализаторы в живых клетках. Ферменты обеспечивают энергию, необходимую нам для функционирования. Каждая живая клетка содержит сотни или даже тысячи ферментов, все они взаимодействуют в скоординированном танце, поддерживающем эффективное функционирование клетки, а в случае многоклеточных организмов, таких как человек, работающие вместе на благо всего организма.
Примечания по ферментам
- Ферменты — это белки, которые служат катализаторами и снижают потребность в специфических химических реакциях внутри клетки
- Ферменты часто являются частью метаболических путей
- Коэнзимы или кофакторы иногда необходимы для функционирования фермента
- Ферменты контролируются конкурентным или неконкурентным ингибированием по принципу обратной связи
Результаты обучения
Если вы дочитаете этот урок до конца, то сможете выполнить следующие задачи:
- Объяснить роль ферментов в клетках
- Вспомните, какие входы нужны ферментам для участия в реакциях
- Опишите, как контролируются или поощряются действия ферментов





 Воздействие ферментов позволяет снизить пористость кожи, улучшить рельеф и добиться снижения глубины морщин.Состав оказывает увлажняющее воздействие и повышает тонус.
Воздействие ферментов позволяет снизить пористость кожи, улучшить рельеф и добиться снижения глубины морщин.Состав оказывает увлажняющее воздействие и повышает тонус.

 Они не работают должным образом, если среда слишком кислая или щелочная. Например, фермент в желудке, называемый пепсином, расщепляет белки. Если в желудке недостаточно кислоты, пепсин не может функционировать оптимально.
Они не работают должным образом, если среда слишком кислая или щелочная. Например, фермент в желудке, называемый пепсином, расщепляет белки. Если в желудке недостаточно кислоты, пепсин не может функционировать оптимально.

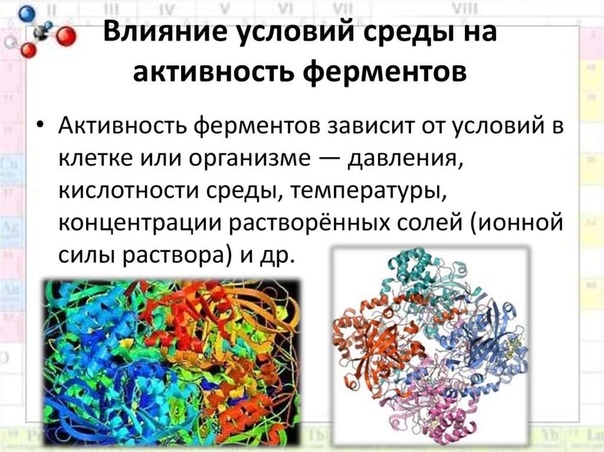 Например, фосфофруктокиназа (ФФК) является ферментом, который катализирует первую стадию гликолитического пути, который генерирует энергию в форме АТФ для клетки, тогда как глюкозо-1-фосфат уридилилтрансфераза (ГУТ) является ферментом на ранней стадии пути. что приводит к синтезу гликогена (молекулы для хранения энергии).Оба фермента используют монофосфаты гексозы в качестве субстрата, но K m PFK для его субстрата ниже, чем у GUT для его субстрата. Таким образом, при более низких концентрациях гексозофосфата в клетках PFK будет активна, а GUT будет в значительной степени неактивен. При более высоких концентрациях гексозофосфата оба пути будут активны. Это означает, что клетки запасают гликоген только в периоды избытка и всегда отдают предпочтение пути производства АТФ, который является более важной функцией.
Например, фосфофруктокиназа (ФФК) является ферментом, который катализирует первую стадию гликолитического пути, который генерирует энергию в форме АТФ для клетки, тогда как глюкозо-1-фосфат уридилилтрансфераза (ГУТ) является ферментом на ранней стадии пути. что приводит к синтезу гликогена (молекулы для хранения энергии).Оба фермента используют монофосфаты гексозы в качестве субстрата, но K m PFK для его субстрата ниже, чем у GUT для его субстрата. Таким образом, при более низких концентрациях гексозофосфата в клетках PFK будет активна, а GUT будет в значительной степени неактивен. При более высоких концентрациях гексозофосфата оба пути будут активны. Это означает, что клетки запасают гликоген только в периоды избытка и всегда отдают предпочтение пути производства АТФ, который является более важной функцией.
 Другими словами, ингибитор напрямую конкурирует за активный центр, «отталкивая» реагенты с дороги.
Другими словами, ингибитор напрямую конкурирует за активный центр, «отталкивая» реагенты с дороги.