2. Вода и её роль в жизнедеятельности клетки
Вода (h3O) — важнейшее неорганическое вещество клетки. В клетке в количественном отношении вода занимает первое место среди других химических соединений. Вода входит в состав цитоплазмы, она придаёт клетке объём и упругость, участвует во всех химических реакциях. Все биохимические реакции происходят в водных растворах. Чем интенсивнее протекает в клетке обмен веществ, тем выше в ней содержание воды.
Вода заполняет пространства между клетками, она составляет основу клеточного сока в вакуолях. Транспорт веществ в живых организмах осуществляется в виде водных растворов.
У воды имеется ряд свойств, которые обуславливают её значение для живых организмов.
Структура молекулы воды
Особые свойства воды связаны со строением её молекулы.
Связи между атомами водорода и кислорода в молекуле воды полярные. Из-за большей электроотрицательности атома кислорода электроны общих электронных пар сдвинуты к нему. Поэтому на атоме кислорода имеется частичный отрицательный заряд, а на атомах водорода — частичные положительные заряды. Так как молекула воды имеет угловое строение, разные заряды в ней находятся у разных полюсов. Молекула полярная, она является диполем.
Поэтому на атоме кислорода имеется частичный отрицательный заряд, а на атомах водорода — частичные положительные заряды. Так как молекула воды имеет угловое строение, разные заряды в ней находятся у разных полюсов. Молекула полярная, она является диполем.
Рис. \(1\). Молекула воды
Полярные молекулы воды взаимодействуют между собой с образованием водородных связей, обуславливающих многие особенности физических и химических свойств вещества.
Рис. \(2\). Водородные связи
Свойства воды
Вода — полярный растворитель, в ней растворяются другие полярные вещества. Такие вещества называют гидрофильными. К этой группе относятся многие соли, моно- и дисахариды, аминокислоты, минеральные кислоты. В растворённом состоянии молекулы или ионы веществ могут свободно двигаться, и они легче вступают в химические реакции.
Вещества, нерастворимые в воде, называются гидрофобными. К ним относятся жиры, многие белки и нуклеиновые кислоты. Гидрофобность некоторых веществ имеет важное значение для живых организмов (например, из таких веществ формируются клеточные мембраны)
К ним относятся жиры, многие белки и нуклеиновые кислоты. Гидрофобность некоторых веществ имеет важное значение для живых организмов (например, из таких веществ формируются клеточные мембраны)
Важное свойство воды — способность растворять газообразные вещества (O2, CO2 и др.).
У воды высокая теплоёмкость, т. е. способностью поглощать много тепла при незначительном возрастании собственной температуры. Высокая теплоёмкость сглаживает температурные колебания и защищает организмы от быстрого и сильного охлаждения или нагревания.
Вода имеет высокую теплоту парообразования, для её испарения необходима довольно большая энергия. Использование значительного количества энергии на разрыв водородных связей при испарении воды способствует её охлаждению. Это свойство воды предохраняет организмы от перегрева. Примеры: испарение воды листьями растений и выделение пота у животных.
У воды также высокая теплопроводность, которая обеспечивает быстрое распределение тепла по всему организму.
Вода не сжимается. Она создаёт тургорное давление и поддерживается упругость тканей и органов. У некоторых беспозвоночных (например, у круглых червей) полостная жидкость выполняет функцию гидростатического скелета.
У воды высокое поверхностное натяжение. Поэтому кровь движется по капиллярам у животных и поднимается по сосудам в растениях.
Функции воды
1. Вода является универсальным растворителем. Благодаря разной растворимости веществ в воде формируются плазматические мембраны.
2. Вода выполняет в живых организмах транспортную функцию. Вещества поступают в клетки и организмы, а также переносятся внутри них в виде водных растворов.
3. Вода участвует в биохимических реакциях, протекающих в клетке (гидролиз веществ), является источником кислорода и водорода при фотолизе в световую фазу фотосинтеза.
4. Вода играет важную роль в осуществлении теплорегуляции.
5. Вода является составной частью слизей, образующихся в органах дыхания и пищеварения, а также секретов некоторых желез и органов: пищеварительных соков, желчи, слюны, пота, слёз и т. д.
Источники:
Рис. 1. Молекула воды © ЯКласс.
Рис. 2. Водородные связи. Автор: chris 論 (vectorisation), Raimund Apfelbach — File:Wasserstoffbrückenbindungen Wasser.png, Общественное достояние, https://commons.wikimedia.org/w/index.php?curid=8973461. 07.09.2021.
|
||
Свойства питьевой воды | Доставка питьевой воды Аквалайн
Физиологически полноценная питьевая вода (47;78) с уровнем минерализации 150-350 мг/л по праву может считаться эталоном качества питьевой воды для Санкт-Петербурга и Ленинградской области. Именно такую воду добывает и доставляет потребителям наша компания.
Именно такую воду добывает и доставляет потребителям наша компания.
Немного истории
В конце 90-х годов прошлого столетия в Санкт Петербурге начинал формироваться рынок бутилированной питьевой воды, переработанной из водопровода по западной технологии – очистка воды обратным осмосом. Этот метод вызывал большие сомнения в целесообразности его применения, так как вода при очистке делается близкой к дистиллированной, которая не содержит солей и при длительном использовании способна разбалансировать работу организма человека.
Годин В.Ю. выбрал направление на исследование, поиск и использование подземных физиологически полноценных питьевых вод, отвечающих в полной мере потребностям интересам населения региона. В результате продолжительных исследований в 2008 году им была открыта природная физиологически полноценная артезианская питьевая вода – ФППВ (47;78). На это ушло более 10 лет непрерывной, напряженной научно-исследовательской и практической работы. В ходе этой работы был проведён анализ отечественной и зарубежной литературы в области оценки влияния водного фактора на здоровье человека, изучены свойства невской воды и дан её сравнительный анализ с подземными питьевыми водами г.Санкт-Петербурга и Ленинградской области. По результатам исследований химического состава и удельных дебитов основных водоносных гидрогеологических подразделений на территории Ленинградской области в границах административных районов в соответствии с нормативами физиологически полноценных питьевых вод (ФППВ) издана монография Годин В.Ю., Воронюк Г.Ю. «Гидрогеологичес
В ходе этой работы был проведён анализ отечественной и зарубежной литературы в области оценки влияния водного фактора на здоровье человека, изучены свойства невской воды и дан её сравнительный анализ с подземными питьевыми водами г.Санкт-Петербурга и Ленинградской области. По результатам исследований химического состава и удельных дебитов основных водоносных гидрогеологических подразделений на территории Ленинградской области в границах административных районов в соответствии с нормативами физиологически полноценных питьевых вод (ФППВ) издана монография Годин В.Ю., Воронюк Г.Ю. «Гидрогеологичесдля регионов № 47 (Ленинградская область) и 78 (Санкт-Петербург).

ФППВ(47; 78;) по своим химическим, микробиологическим и физическим параметрам полностью соответствует основным научным критериям действительно полезной питьевой воды. Именно такая вода может нести полноценную, здоровую жизнь, в том случае, если она местная, энергетически и информационно чиста, биологически активна и с оптимальным для организма составом.
Несмотря на то, что в регионе воды много, по-настоящему полезной питьевой воды мало. Это подтверждается продолжительными исследованиями и многочисленными комплексными анализами подземных вод. Только в четырёх районах Ленинградской области есть физиологически полноценные подземные питьевые воды и их дебит позволяет производить розлив для питьевых целей. Это уникальные подземные воды — химический состав и энергоинформацио Комплекс хорошо защищен от поверхностных загрязнений толстым слоем глины (от 70 до 100 м).
Комплекс хорошо защищен от поверхностных загрязнений толстым слоем глины (от 70 до 100 м).
В естественной природной среде подземные воды структурируются путем длительной фильтрации с поверхности земли до места коптажа в подземной толще водоносного горизонта, пронизываясь энергетическими потоками земли и космическими излучениями, что обеспечивает природную чистоту и первозданность воды.
Места расположения водоисточников отличаются особыми природными свойствами – это районы чистых озер, родников и больших лесных массивов.
Информационное насыщение питьевой воды происходит под воздействием уникального ландшафта местности – это озерная гладь, капелька росы на веточке сосны, листочках, журчанье ручья, свежесть и умиротворение. В таких водах сохранена энергия жизни. Энерго-информаци
Русский врач-терапевт М. Мудров в XVIII веке писал: «Зная взаимные действия друг на друга души и тела, долгом считаю заметить, что есть и душевные лекарства, кои врачуют тело». Таким лекарством обладает слово (энергоинформаци
В настоящее время факт существования энергоинформацио
По минеральному составу и микро и макроэлементам ФППВ ( 47: 87) идеально подходит для организма человека. Питьевая вода мягкая. Очень жесткая или очень мягкая вода одинаково не подходят для нормального функционирования клеток организма. Диаметр молекул воды ФППВ (47;78) позволяет легко проходить сквозь мембрану клеток организма, поэтому химические реакции в организме протекают быстрее и обмен веществ активизируется.
ФППВ (47; 78) биологически доступна, легкоусваиваема, имеет максимальную проникающую способность через мембраны клеток организма, основные физические и физиологические характеристики сравнимые с внутриклеточной средой.
Содержание основных жизненно важных биогенных элементов ФППВ (47; 78): кальций — 15 мг/л, магний — 10 мг/л, калий — 5 мг/л, бикарбонаты — 100-300 мг/л, фторид-ионы — 0,5-1,0 мг/л, йодид-ионы — 5-100 мкг/л, Ph — 7,4–8,3, общая жесткость — 1,5-2,5 мг-экв/л. Вода мягкая, в ней хорошо заваривается чай, кофе. Жёсткой считается вода, в которой содержатся в больших концентрациях соли кальция и магния. Мягкая вода – это вода, которая содержит мало солей. Жесткую воду не рекомендуется использовать в питьевых целях, т.к. содержащиеся в них в избыточном количестве минеральные соли плохо усваиваются организмом и они откладываются в суставах, хрящах, на стенках сосудов. В отличие от жесткой, мягкая вода, в основном выступает в роли оздоровительного фактора.
Вода мягкая, в ней хорошо заваривается чай, кофе. Жёсткой считается вода, в которой содержатся в больших концентрациях соли кальция и магния. Мягкая вода – это вода, которая содержит мало солей. Жесткую воду не рекомендуется использовать в питьевых целях, т.к. содержащиеся в них в избыточном количестве минеральные соли плохо усваиваются организмом и они откладываются в суставах, хрящах, на стенках сосудов. В отличие от жесткой, мягкая вода, в основном выступает в роли оздоровительного фактора.
ФППВ (47; 78) благодаря стерильности, свежести, естественной минерализации, биологической активности, обусловленными кругооборотом воды в природе, несёт жизненную энергию и является главным профилактическим средством заболеваний и средством немедикаментозного оздоровления населения. Вода имеет собственную биоэнергетику, задаваемую её природным свойством — это фрактальная, диссиметричная питьевая вода.
Употребление ФППВ(47; 78) снижает опасность возникновения артрита, атеросклероза. Эта вода полезна для людей, предрасположенны
Эта вода полезна для людей, предрасположенны
Утверждение о том, что энергию организму поставляет пища за счет образования аденозинтрифосфа Вода приводит в действие натриево-калиевы
Вода приводит в действие натриево-калиевы
ФППВ (47; 78) способствует поддержанию в организме условий, которые препятствуют развитию патологий в организме. Вода безопасна в бактериологическом отношении и отличается великолепными органолептическими свойствами.
Эталоном питьевой воды в Санкт-Петербурге по праву может считать физиологически полноценная питьевая вода Аквалайн Природная Премиум, которую можно заказать на нашем сайте!
Строение, свойства и функции воды
Цель урока: сформировать представление о целостной картине мира на примере вещества воды, осуществив интеграцию знаний учащихся, полученных в курсах физики, химии и биологии.
Задачи урока:
- Образовательные: усвоение всеми учащимися стандартного минимума фактических сведений о строении и функциях воды на всех уровнях организации живого.

- Развивающие: совершенствование надпредметных умений сравнивать и анализировать, устанавливать причинно-следственные связи; переводить информацию в графический вид (таблицу), постановки и решения проблем; оперировать понятиями и связывать с ранее полученными знаниями в курсах ботаники, зоологии, анатомии; рассуждать по аналогии, развивать память, произвольное внимание.
- Воспитательные: развивать интерес к окружающим явлениям, умение работать в парах и в коллективе, вести диалог, слушать товарищей, оценивать себя и других, формировать культуру речи.
Планируемые результаты: умение характеризовать функции вещества на основе строения и свойств; обобщение полученных знаний о функциях воды на разных уровнях организации живого в форме таблицы.
Тип урока: изучение нового материала и первичное закрепление знаний.
Методы обучения: беседа, рассказ учителя, показ иллюстраций, презентации, индивидуальная работа с текстом, контроль знаний.
Формы организации учебной деятельности: работа в парах (составление обобщающей таблицы), индивидуальная, фронтальная, эксперимент.
Оборудование: фотографии, компьютер, мультимедийный проектор, на столах учащихся раздаточный материал для урока, демонстрационные опыты.
Ход урока
Организационный момент (2 мин.): поздороваться, представиться детям.
Введение (5 мин.):
Вода – самое распространенное и удивительное на Земле вещество (например, расширяется при охлаждении, замерзает уже при 0 0С, кипит при 100 0С, выполняет множество функций и даже может хранить информацию). Ею заполнены океаны, моря, озера и реки; пары воды входят и в состав воздуха. Вода содержится в клетках всех живых организмов (животных, растений, грибов, бактерий) в значительных количествах: организме млекопитающих массовая доля воды составляет примерно 70%, а в огурцах и арбузах ее около 90%, в костях человека – 45 %, а в мозге до 90 %.
Цели урока: почему воды больше всего в составе живых организмов? Почему вода покрывает большую часть суши? Как вода сохраняет информацию? На эти вопросы нам с вами предстоит ответить в конце урока.
Как будем работать: беседуем, я рассказываю, показываю иллюстрации и схемы (Презентация), в процессе объяснения заполняем пропущенные слова в распечатках (Приложение 1). В конце урока я проконтролирую, как вы меня поняли. Мы заполним обобщающую таблицу, а я оценю ваши старания.
Демонстрационные опыты:
Опыт № 1:
Цель опыта: доказать растворимость веществ в воде.
Ход опыта: насыпать в колбу с водой соль или сахар. Размешать.
Результат: соль (сахар) полностью растворились.
Вывод: вода – хороший растворитель.
Опыт № 2
Цель опыта: доказать способность воды передвигаться по сосудам стебля за счет корневого давления и присасывающей силы испарения.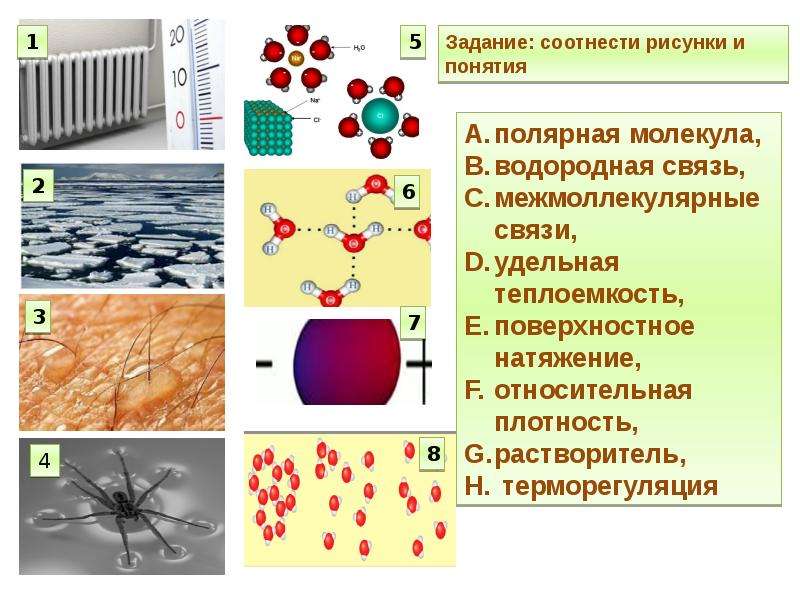
Ход опыта: поставить на сутки укоренившийся побег бальзамина в раствор чернил.
Результат: стебель и некоторые листья бальзамина окрасились в синий цвет.
Вывод: вода передвигается по сосудам стебля за счет сил сцепления между молекулами при помощи корневого давления и присасывающей силы испарения..
Опыт № 3:
Цель опыта: доказать способность воды двигаться в область меньшей концентрации растворителя.
Ход опыта: в две чашки Петри поместить одинаковые кусочки картофеля. В одну чашку налить воду, в другую – концентрированный раствор соли.
Результат: картофель в простой воде набух, а в концентрированном растворе соли сморщился.
Вывод: молекулы воды двигаются в область меньшей концентрации растворителя.
Объяснение нового материала (20 мин.):
Проводится в форме беседы. Изучаем вещества по определенному плану (пишу на доске): строение – свойства – функции на системных уровнях организации живого.
Строение молекулы и межмолекулярные связи | Свойства |
|---|---|
Молекула воды имеет угловую форму: атомы водорода по отношению к кислороду образуют угол, равный примерно 105 0. Поэтому молекула воды – диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород – отрицательно. |
Вода – хороший растворитель. Растворы образуются путем взаимодействия растворенного вещества с частицами растворителя. Процесс растворения твердых веществ в жидкостях можно представить так: под влиянием растворителя от поверхности твердого вещества постепенно отрываются отдельные ионы или молекулы и равномерно распределяются по всему объему растворителя. |
|
Вода – реагент в реакциях гидролиза (разрушение сложных химических веществ под действием воды до более простых с новыми свойствами) и ряде других реакций |
Водородные связи между молекулами воды |
Растворы ряда веществ образуются за счет водородных связей между веществом и молекулами растворителя (сахара, газы) |
Водородных связей много, поэтому необходимо много энергии для их разрыва.
|
Вода обладает хорошей теплопроводностью и большой теплоемкостью. Вода медленно нагревается и медленно остывает. |
Водородные связи слабые |
Молекулы воды подвижны относительно друг друга |
Силы межмолекулярного сцепления образуют пространства между молекулами |
Вода практически не сжимается |
Образование водородных связей между молекулами воды и других веществ |
Вода характеризуется оптимальным для биологических систем значением силы поверхностного натяжения, текучесть воды Опыт № 2 |
Вода замерзает при 0 0С, при замерзании образуется много водородных связей, возникают пространства между молекулами |
Максимальная плотность воды при 4 С° равна 1 г/см3, лед имеет меньшую плотность, и всплывает на ее поверхность. |
| Функции на системных уровнях организации живого |
|---|
Вода обеспечивает диффузию — пассивный транспорт веществ в клетку и из нее в область меньшей концентрации (осмос) и пиноцитоз, а также транспорт веществ из клетки. |
|
Гидрофильные вещества проникают внутрь клетки. |
Вода – терморегулятор. |
«Смазочный материал» в суставах, плевральной полости и околосердечной сумке. |
|
Капиллярный кровоток, движение веществ в капиллярах почвы, восходящий и нисходящий ток растворов в растениях. |
Лед защищает водоемы от промерзания. |
Вода может хранить информацию (Приложение 2).
Закрепление (13 мин.):
Биологические задачи:
- Показать синюю или зеленую хризантему. Как создают такие растения? Являются ли они результатом селекционной работы?
- Почему кожа на пальцах при длительном купании сморщивается?
- Почему сморщивается яблоко, лежащее в тепле?
Разделить класс на три группы (по рядам). Первая группа выписывает в тетрадь функции воды на уровне живой клетки. Вторая группа – на уровне живого организма. Третья группа – на уровне экосистем и биосферы. В конце работы оценить себя по количеству найденных функций. Работа ведется по парам.
Первая группа выписывает в тетрадь функции воды на уровне живой клетки. Вторая группа – на уровне живого организма. Третья группа – на уровне экосистем и биосферы. В конце работы оценить себя по количеству найденных функций. Работа ведется по парам.
Функции воды
| В живой клетке | В живом организме | В экосистемах и биосфере |
|---|---|---|
1. Транспорт веществ в клетке. |
1. Охлаждение организмов. |
1. Дыхание и фотосинтез водных организмов. |
2. Основная среда всех биохимических процессов. |
2. «Смазочный материал» в суставе, плевральной полости, околосердечной сумке, глазном яблоке. |
2. Регуляция температуры на планете. |
3. |
3. Гидростатический скелет. |
3. Благоприятная среда обитания для живых организмов. |
4. Сохранение структуры клетки. |
4. Защита плода млекопитающих. |
4. Защита водоемов от промерзания. |
5. Тургорное давление. |
5. Капиллярный кровоток, нисходящий и восходящий ток в растениях. |
5. Часть среды обитания животных. |
|
|
6. Подъем почвенных растворов по капиллярам почвы. |
Подведение итогов урока, оценка работы (2 мин.)
Словарик (Приложение 2)
Вода свойства и биологические функции
Невозможно, конечно, учесть любые изменения степени взаимодействия между цепью и растворителями, например, когда цепь имеет тенденцию выдвигаться в окружающую среду, чтобы стать более сольватированной, или сокращаться для удаления элементов цепи из раствора. Поэтому результаты расчетов соответствуют таким условиям ( 0-точка ), при которых полимерная цепь является невозмущенной и тенденции выдвигаться или сокращаться строго сбалансированы. Условия в 6-точке обычно не отвечают условиям, наиболее способствующим проявлению биологических функций молекулы или ее свойств, представляющих технологический интерес. Следует отметить также, что математические методы для расчета энергий взаимодействия внутри цепи все еще весьма неточны, и поэтому их можно успешно применять для предсказания лишь общих тенденций. Однако в этом направлении достигнут некоторый успех [21]. Наиболее интересным общим свойством углеводных цепей в неупорядоченном состоянии является способность связывать воду и ионы, а также включать другие полимерные цепи в свой домен или исключать из него [1]. Связывание воды объясняется тем, что движущая сила этого процесса, конформационная энтропия, делает предпочтительной конформацию ста- [c.290]
Поэтому результаты расчетов соответствуют таким условиям ( 0-точка ), при которых полимерная цепь является невозмущенной и тенденции выдвигаться или сокращаться строго сбалансированы. Условия в 6-точке обычно не отвечают условиям, наиболее способствующим проявлению биологических функций молекулы или ее свойств, представляющих технологический интерес. Следует отметить также, что математические методы для расчета энергий взаимодействия внутри цепи все еще весьма неточны, и поэтому их можно успешно применять для предсказания лишь общих тенденций. Однако в этом направлении достигнут некоторый успех [21]. Наиболее интересным общим свойством углеводных цепей в неупорядоченном состоянии является способность связывать воду и ионы, а также включать другие полимерные цепи в свой домен или исключать из него [1]. Связывание воды объясняется тем, что движущая сила этого процесса, конформационная энтропия, делает предпочтительной конформацию ста- [c.290]
Книга начинается с глав, посвященных структуре клеток и важнейшим принципам органической химии, относящимся к биомолекулам материал, изложенный в этих главах, может оказаться полезным для тех, кто недостаточно подготовлен по биологии и органической химии.
 После рассмотрения свойств воды подробно описываются структура и биологические функции белков. На примере гемоглобина детально показано, как аминокислотная последовательность определяет его конформацию и как конформация белковых макромолекул может влиять на структуру и функцию клеток. Далее подробно рассматриваются ферменты и способы регуляции их активности, причем постоянно подчеркивается значение трехмерной структуры белка и для иллюстрации приводится целая галерея структур ферментов. [c.8]
После рассмотрения свойств воды подробно описываются структура и биологические функции белков. На примере гемоглобина детально показано, как аминокислотная последовательность определяет его конформацию и как конформация белковых макромолекул может влиять на структуру и функцию клеток. Далее подробно рассматриваются ферменты и способы регуляции их активности, причем постоянно подчеркивается значение трехмерной структуры белка и для иллюстрации приводится целая галерея структур ферментов. [c.8] Типичные биомолекулы, используемые в качестве строительных блоков, возникли самопроизвольно на ранних этапах истории Земли из атмосферных газов и воды под воздействием энергии. Эти процессы, в совокупности называемые химической эволюцией, можно воспроизвести в лабораторных условиях. Современные биомолекулы (строительные блоки), по-видимому, были отобраны на ранних этапах биологической эволюции благодаря тому, что они оказались лучше других приспособленными для выполнения биологических функций. Число таких биомолекул относительно невелико, однако они обладают весьма разнообразными свойствами и каждая из них может вьшолнять в клетках самые разные функции. [c.76]
Число таких биомолекул относительно невелико, однако они обладают весьма разнообразными свойствами и каждая из них может вьшолнять в клетках самые разные функции. [c.76]
Кодовый словарь далеко не случаен. Имеется определенная корреляция между строением кодонов и природой аминокислотных остатков. Генетически закодирована пространственная структура белковой молекулы, находящейся в водном окружении, и тем самым ее биологическая функция. Природа генов непосредственно связана со специфическими свойствами жидкой воды [c.296]
Липидами называют жиры и жироподобные вещества (липоиды) животного и растительного происхождения (от греч. Проз —> жир). Несмотря на разнообразие их химического состава, они обладают общими физико-химическими свойствами и биологическими функциями. Общим свойством всех липидов является их гидрофобность, т. е. они не растворяются в воде, но растворяются в органических растворителях (эфире, хлороформе, бензоле, бензине, спирте, ацетоне и др. ). Характерная особенность липидов и их растворителей обусловливается наличием в их составе большого числа гидрофобных радикалов и группировок —СН2—, —СН- и СНз-групп. Липиды классифицируются по-разному. Их можно разделить на две основные группы жиры (нейтральные жиры) и липоиды — жироподобные соединения. [c.101]
). Характерная особенность липидов и их растворителей обусловливается наличием в их составе большого числа гидрофобных радикалов и группировок —СН2—, —СН- и СНз-групп. Липиды классифицируются по-разному. Их можно разделить на две основные группы жиры (нейтральные жиры) и липоиды — жироподобные соединения. [c.101]
Для жизнедеятельности организмов очень важна роль воды. Немецкий физиолог Э. Дюбуа-Реймон заметил, что человек — это одушевленная вода . И действительно, на две трети наш организм состоит из воды. Даже в головном мозге, этом командном пункте, управляющем всеми нашими помыслами и поступками, содержится около 80 % воды. По выражению А. А. Покровского, вода является основной средой, а во многих случаях — участником бесчисленных химических реакций, лежащих в основе жизни . В этой среде протекают все сложные процессы превращения веществ, все процессы обмена. Причины уникальной роли воды для жизни следует искать в ее особых физико-химических свойствах, которые как нельзя лучше соответствуют биологическим функциям клеток (см.
 главу 15). [c.29]
главу 15). [c.29]Сведения о белках, их составе, строении и биологических функциях начали формироваться еще в ХУП —XIX вв. На этом этапе в разнообразных природных объектах (семена и соки растений, мышцы, хрусталик глаза, кровь, молоко и др.) в достаточно больших количествах были обнаружены вещества, при сжигании которых ощущался запах паленой шерсти и аммиака. Эти вещества растворялись в воде с образованием вязких, клейких растворов при испарении воды из этих растворов получалась роговидная масса, свертывающаяся при нагревании. Именно из-за этих специфических свойств данные соединения получили название белки, поскольку аналогичными свойствами обладает яичный белок. [c.35]
ВОДА СВОЙСТВА И БИОЛОГИЧЕСКИЕ ФУНКЦИИ [c.448]
Обоснуйте взаимосвязь физико-химических свойств и биологических функций воды. [c.455]
Как указывалось, в настоящее время известны биологические функции некоторых гликопротеинов лишь в некоторых случаях выяснена взаимосвязь между их молекулярной структурой и биологической функцией в других случаях, например для гонадотропина, пока еще неясно, каким образом содержащиеся в его молекуле углеводы влияют на гормональные свойства. Функции большинства гликопротеинов, в том числе и многих гликопротеинов плазмы, пока не установлены. Некоторые из этих веществ, несомненно, выполняют определенные функции в клетке. Например, они могут быть связаны с переносом воды или других соединений через клеточные мембраны. Эту функцию могут выполнять, очевидно, и многие кислые гликопротеины. [c.296]
Функции большинства гликопротеинов, в том числе и многих гликопротеинов плазмы, пока не установлены. Некоторые из этих веществ, несомненно, выполняют определенные функции в клетке. Например, они могут быть связаны с переносом воды или других соединений через клеточные мембраны. Эту функцию могут выполнять, очевидно, и многие кислые гликопротеины. [c.296]
Следовательно, кроме традиционных методов оценки качества питьевых вод, подвергнувшихся внешним воздействиям, особое значение при ее биологическом функционировании имеет анализ структуры воды. Однако проблемы взаимосвязи строения и биологических свойств воды оказались наименее изученными в гигиеническом аспекте. В следующих разделах работы более детально рассмотрены вопросы взаимосвязи физикохимических свойств, структурных особенностей различных питьевых вод и их биологических функций. [c.212]
Попадающие в воду пестициды не только ухудшают ее вкусовые качества, воздействуя на органолептические свойства воды прямо или косвенно, нарушая биологическое равновесие водоемов, но и отрицательно влияют на ряд жизненно важных функций человеческого организма. [c.963]
[c.963]
Комплексообразователи широко используются в процессах, когда необходимо удалить или замедлить осаждение катиона металла из водного раствора. Эти соединения могут использоваться в следующих случаях поверхностно-активные и моющие составы в текстильной промышленности, очистка металла и удаление окалины, полировка металла, для производства пластиков и резины, при производстве бумаги при обработке нефтяных скважин, как хелатообразователи в биологических системах. Важным свойством этих соединений является их способность связывать Ре (II). При обводнении нефтяного пласта использованную воду, содержащую некоторое количество Ре II) и Н,5, часто смешивают со свежей водой. Если эти несовместимые воды смешивать, то образуется осадок Ре5,который может закупорить водопроницаемый слой в «нагнетательной» скважине. Другой функцией хелатообразующих соединений является способность предотвращать гелеобразование и выпадение осадков гидроксидов железа в скважине и в вытекающей отработанной воде. Следующие примеры показывают методь приготовления этих соединений. [c.80]
Следующие примеры показывают методь приготовления этих соединений. [c.80]
Превращение золя в гель связано с возникновением особой внутренней структуры в этой системе. Частицы коллоидных веществ, соприкасаясь друг с другом, как бы склеиваются и образуют своеобразный каркас, в ячейках которого оказывается включенным значительное количество воды. Наличие этой структуры придает гелю характерные механические (вязкоэластические) свойства. Образование тончайшей сети переплетающихся нитей во многих гелях можно наблюдать при помощи электронного микроскопа, дающего увеличение в 30 000—40 ООО раз. Такую сеть, состоящую из переплетающихся нитей гидрофильного коллоида, можно, в частности, видеть на электронных микрофотографиях мышечных белков. Интересную электронную микрофотографию (рис. 4) дает мышечный белок — актин, биологическое значение и биохимические функции которого рассматриваются в главе Мышечная ткань . [c.16]
Суставной хрящ представляет собой ткань, которая покрывает эпифизы костей, образующих сустав.
 Будучи полимерным материалом, ОН представляет интерес в качестве объекта для исследования особой роли воды в полимерах. В биологическом смысле его основная физиологическая функция состоит в том, чтобы воспринимать нагрузки, возникающие при работе сустава. Если не касаться патологических изменений, то хрящ способен противостоять разнообразным видам напряжений, прилагаемых к нему в течение жизни человека. Несмотря на то что он обладает относительно небольшой способностью к восстановлению [1], он почти не подвергается сколь-нибудь заметному износу. Можно полагать, что его способность выдерживать большие нагрузки и обеспечивать быструю релаксацию напряжения обусловливает такую высокую степень его износостойкости. Настоящее исследование было предпринято с целью выяснить механизм поведения хряща при нагружении, а также его свойства в отношении релаксации напряжения. В конечном счете автор надеялся связать эти механизмы с уникальным химическим составом и ультраструктурой этой ткани. [c.
Будучи полимерным материалом, ОН представляет интерес в качестве объекта для исследования особой роли воды в полимерах. В биологическом смысле его основная физиологическая функция состоит в том, чтобы воспринимать нагрузки, возникающие при работе сустава. Если не касаться патологических изменений, то хрящ способен противостоять разнообразным видам напряжений, прилагаемых к нему в течение жизни человека. Несмотря на то что он обладает относительно небольшой способностью к восстановлению [1], он почти не подвергается сколь-нибудь заметному износу. Можно полагать, что его способность выдерживать большие нагрузки и обеспечивать быструю релаксацию напряжения обусловливает такую высокую степень его износостойкости. Настоящее исследование было предпринято с целью выяснить механизм поведения хряща при нагружении, а также его свойства в отношении релаксации напряжения. В конечном счете автор надеялся связать эти механизмы с уникальным химическим составом и ультраструктурой этой ткани. [c. 386]
386] Известно, что ароматическим углеводородам присущи черты неэлектролитного действия при попадании в организм. Это наркотики, вызывающие угнетение функций центральной нервной системы, оказывающие местное раздражающее действие на слизистые и кожу и обладающие гемолитическими свойствами. С ростом молекулярного веса в гомологическом ряду усиливаются наркотические свойства, а также местное раздражающее действие, но до определенного предела падение летучести и растворимости в воде ограничивает возможность создания наркотических концентраций в воздухе и крови, в результате чего пары высших алкилбензолов в нормальных условиях не оказывают сколько-нибудь заметного биологического действия. Этими физико-химическими свойствами объясняется малая токсичность интересующих нас соединений по данным, почерпнутым из литературных источников. Так, Джерард [1] сообщает о слабой токсичности додецилбензола и дурола при введении в желудок крысы (доза 5 мл и 5 г кг не была смертельной для животных), автор предполагает раздражающее действие паров и аэрозолей на органы дыхания и указывает на возможность местного раздражения кожи. Псевдокумол по данным, собранным тем же автором, токсичнее от дозы 5 лл//сг погибло [c.179]
Псевдокумол по данным, собранным тем же автором, токсичнее от дозы 5 лл//сг погибло [c.179]
Одно из самых значительных достижений рентгеноструктурного анализа белков последних лет, которое не может не повлиять на дальнейшее развитие биологии и становление ее новой области -молекулярной биологии клетки, состоит в начавшейся расшифровке трехмерных структур первых мембранных белков. Перед обсуждением полученных здесь результатов целесообразно кратко сообщить о том, что было известно об этих белках до исследования их с помощью рентгеновской дифракции. Если основные структурные особенности биологических мембран определяются молекулами липидного бислоя, то специфические функции мембран выполняются главным образом белками. Они ответственны за процессы превращения энергии, выступают в качестве рецепторов и ферментов, образуют каналы активного и пассивного транспорта молекул и ионов различных веществ через мембраны, охраняют организм от проникновения чужеродных антигенов и стимулируют иммунный ответ клеточного типа. В обычной плазматической мембране белок составляет около 50% ее массы. Однако в некоторых мембранах, например во внутренних мембранах митохондрий и хлоропластов, его содержание поднимается до 75%, а в других, например миелиновой мембране, снижается до 25%. Многие мембранные белки пронизывают липидный бислой насквозь и контактируют с водной средой по обеим сторонам мембраны. Молекулы этих белков, называемых трансмембранными, как и окружающие их молекулы липидов, обладают амфипатическими свойствами, поскольку содержат гидрофобные участки, взаимодействующие внутри бислоя с гидрофобными хвостами липидов, и гидрофильные участки, обращенные к воде с обеих сторон мембраны. Другая группа мембранных белков соприкасается с водой только с одной стороны бислоя [234, 235]. Одни из них погружены только во внешний или во внутренний слой мембраны, другие ассоциированы за счет невалентных взаимодействий с трансмембранными белками, третьи прикреплены к мембране с помощью ковалентно связанных с ними цепей жирных кислот, внедренных в липидный слой.
В обычной плазматической мембране белок составляет около 50% ее массы. Однако в некоторых мембранах, например во внутренних мембранах митохондрий и хлоропластов, его содержание поднимается до 75%, а в других, например миелиновой мембране, снижается до 25%. Многие мембранные белки пронизывают липидный бислой насквозь и контактируют с водной средой по обеим сторонам мембраны. Молекулы этих белков, называемых трансмембранными, как и окружающие их молекулы липидов, обладают амфипатическими свойствами, поскольку содержат гидрофобные участки, взаимодействующие внутри бислоя с гидрофобными хвостами липидов, и гидрофильные участки, обращенные к воде с обеих сторон мембраны. Другая группа мембранных белков соприкасается с водой только с одной стороны бислоя [234, 235]. Одни из них погружены только во внешний или во внутренний слой мембраны, другие ассоциированы за счет невалентных взаимодействий с трансмембранными белками, третьи прикреплены к мембране с помощью ковалентно связанных с ними цепей жирных кислот, внедренных в липидный слой. [c.56]
[c.56]
Плоские липидные мембраны, наряду с липосомами, широко используются в качестве моделей для изучения электрических свойств мембраны, их проницаемости и других научных исследований. С помощью модельных мембран изучают ряд функций биологических мембран, а том числе, барьерную (например, селективность проницаемости — хорошую проницаемость для воды и плохую для ионов). Можно моделировать биологический транспорт, вводя в модельную мембрану молекулы-переносчики. [c.30]
Природная целлюлоза состоит из мономеров глюкозы, соединенных между собой посредством Р(1 4)-гликозидной связи. Благодаря Р-связям остатки глюкозы образуют вытянутую пйлимерную цепь (см. рис. 11-16). Между нисколькими параллельными цепями возникают межмолекулярные водородные связи, в результате чего формируются длинные жесткие нерастворимые волокна. Гликоген также состоит из остатков глюкозы, но они соединены друг с другом а(Г -> 4)-связями. Такая а-связь между остатками глюкозы вызывает изгиб цепи и препятствует образованию длинных нитей. Кроме того, гликоген сильно разветвлен (рис. 11-15). Эти структурные свойства обеспечивают высокую степень гидратации гликогена, поскольку многие гидроксильные группы обращены к воде. Поэтому гликоген можно экстрагировать в диспергированном виде горячей водой. Физические свойства этих двух полимеров хорошо подходят для выполнения ими их биологической функции. Целлюлоза служит структурным материалом в растениях, что согласуется с ее способностью агрегировать с образованием нерастворимых волокон. Гликоген играет роль запасного горючего в организме животных. Сильно гидратированные и незащищенные гранулы гликогена быстро гидролизуются гликогенфосфорилазой до глюкозо-1-фосфата. Этот фермент действует только на нередуцирующие концы, поэтому высокая степень разветвления полимера обеспечивает наличие в нем множества мест, доступных действию гликогенфосфорилазы. [c.358]
Кроме того, гликоген сильно разветвлен (рис. 11-15). Эти структурные свойства обеспечивают высокую степень гидратации гликогена, поскольку многие гидроксильные группы обращены к воде. Поэтому гликоген можно экстрагировать в диспергированном виде горячей водой. Физические свойства этих двух полимеров хорошо подходят для выполнения ими их биологической функции. Целлюлоза служит структурным материалом в растениях, что согласуется с ее способностью агрегировать с образованием нерастворимых волокон. Гликоген играет роль запасного горючего в организме животных. Сильно гидратированные и незащищенные гранулы гликогена быстро гидролизуются гликогенфосфорилазой до глюкозо-1-фосфата. Этот фермент действует только на нередуцирующие концы, поэтому высокая степень разветвления полимера обеспечивает наличие в нем множества мест, доступных действию гликогенфосфорилазы. [c.358]
Специфическим свойством эволюционно отобранной аминокислотной последовательности является способность принимать в физиологических условиях вполне определенную, уникальную конформацию, которая определяет биологическую функцию белка. Такой способностью белки обладают, несмотря на значительную конформационную свободу аминокислотных остатков и малые значения барьеров вращения вокруг ординарных связей основной и боковых цепей. Плотная, глобулярная структура белковой молекулы непосредственно доказывается малой вязкостью белков в растворе и большей их плотностью по сравнению с синтетическими полипептидами. Молекулы последних образуют в тех же условиях рыхлые клубки с открытой структурой, в которых растворитель занимает до 99% всего объема. Отсюда сравнительно большие линейные размеры клубков и значительная вязкость белков в этом состоянии. Молекулы нативных белков содержат в несколько раз меньшее количество связанной воды (-30% по массе), они малы по линейным размерам и незначительно загущают раствор. На это указывает вся совокупность результатов исследования белка и синтетических полипептидов методами седиментации, диффузии, светорассеяния, рентгеноструктурного анализа, нейтронографии, рассеяния рентгеновских лучей под малыми углами, электронной микроскопии.
Такой способностью белки обладают, несмотря на значительную конформационную свободу аминокислотных остатков и малые значения барьеров вращения вокруг ординарных связей основной и боковых цепей. Плотная, глобулярная структура белковой молекулы непосредственно доказывается малой вязкостью белков в растворе и большей их плотностью по сравнению с синтетическими полипептидами. Молекулы последних образуют в тех же условиях рыхлые клубки с открытой структурой, в которых растворитель занимает до 99% всего объема. Отсюда сравнительно большие линейные размеры клубков и значительная вязкость белков в этом состоянии. Молекулы нативных белков содержат в несколько раз меньшее количество связанной воды (-30% по массе), они малы по линейным размерам и незначительно загущают раствор. На это указывает вся совокупность результатов исследования белка и синтетических полипептидов методами седиментации, диффузии, светорассеяния, рентгеноструктурного анализа, нейтронографии, рассеяния рентгеновских лучей под малыми углами, электронной микроскопии.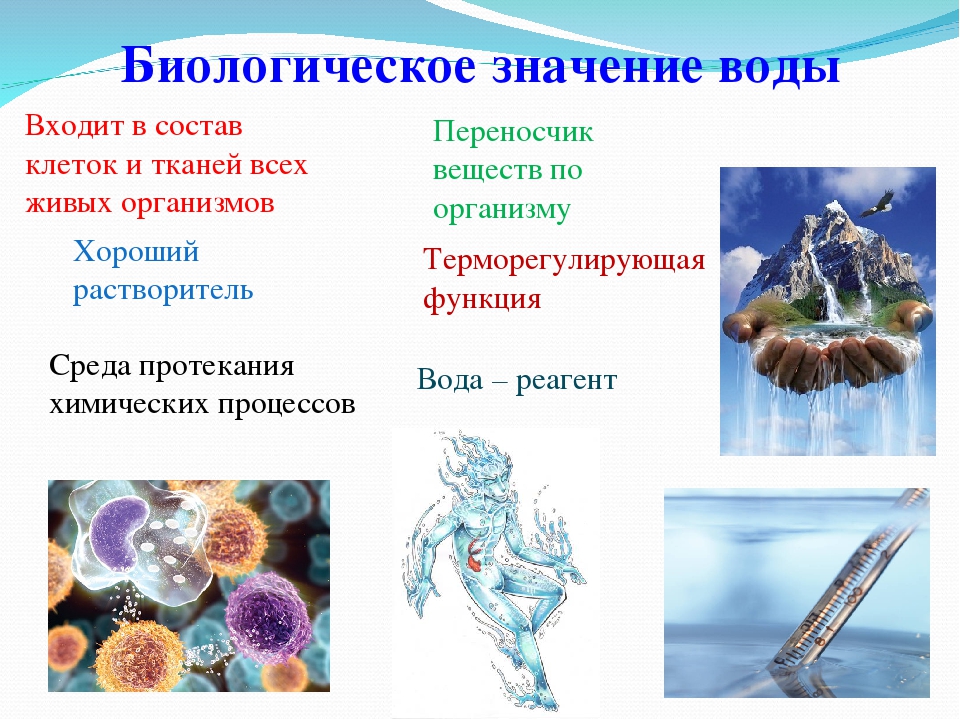 [c.231]
[c.231]
К настоящему времени накоплено множество данных по проявлению золотого сечения в физических и биологических системах. Установлены ранее неизвестные связи золотого сечения со свойствами различных объектов, проявляющихся в физических свойствах воды, громкости, частоты звука, спектре видимого света, физико-механических свойствах твердых тел, физиологических функциях организма и т.п. Последние исследования фрактальных структур показали, что самоподобие фуллеренов, как геометрических, так и природных, контролируется золотой пропорцией или ее производными, связанными с обобщенной золотой пропорцией. Закон обобщенной золотой пропорции отвечает уравнению [c.164]
В процессе свободного окисления вследствие особенностей используемых цепей передачи электронов не происходит образования АТФ биологическая роль этих процессов заключается в метаболизме ряда природных и ксенобиотических субстратов. В последнем случае свободное окисление выполняет важную функцию модификации чужеродных соединений. К последним относятся лекарственные средства, гербициды, продукты загрязнения окружающей среды, в возрастающем количестве попадающие в организм с водой, пищей и атмосферным воздухом. Как правило, они имеют гидрофобные свойства. Многие из них являются канцерогенными. Их гидроксилирование в ходе свободного окисления облегчает последующую деструкцию и выведение из организма (см. главу 12 и 13). [c.314]
К последним относятся лекарственные средства, гербициды, продукты загрязнения окружающей среды, в возрастающем количестве попадающие в организм с водой, пищей и атмосферным воздухом. Как правило, они имеют гидрофобные свойства. Многие из них являются канцерогенными. Их гидроксилирование в ходе свободного окисления облегчает последующую деструкцию и выведение из организма (см. главу 12 и 13). [c.314]
Мембранология как самостоятельная наука, изучающая строение, свойства, механизмы функционирования биологических мембран, сформировалась сравнительно недавно (1950—1970 гг.). Однако сам термин мембрана используется вот уже почти 150 лет для обозначения клеточной фаницы, служащей, с одной стороны, барьером между содержимым клетки и внешней средой, а с другой — полупроницаемой перегородкой, через которую могут проходить вода и растворенные в ней вещества. Однако мембраны представляют собой не только статически организованные поверхности раздела. Быстрое развитие биохимии мембран и прежде всего широкое исследование мембранных белков и липидов обусловили прогресс в понимании структуры и функций биологических мембран. [c.301]
[c.301]
Как модели, липосомы значительно ближе к биологическим мембранам, чем бислойные липидные пленки. Как и биологические мембраны, они предстввляют собой замкнутые системы, что делает их пригодными для изучения пассивного транспорта ионов и малых молекул через липидный бислой. В отличие от БЛМ, липосомы достаточно стабильны и не содержат органических растворителей. Состав липидов в липосомах можно произвольно варьировать и таким образом направленно изменять свойства мембраны. В настоящее время хорошо разработаны методы включения функционально-активных мембранных белков в липосомы. Такие искусственные белково-лнпидные структуры обычно называются протеолипо-сомами (рис. 310). Благодаря возможности реконструкции мембраны из ее основных компонентов удается моделировать ферментативные. транспортные и рецепторные функции клеточных мембран. В липосомы можно авести антигены, а также ковалентно присоединить антитела (рис. 311) и использовать их в иммунологических исследованиях. Они представляют собой удобную модель для изучения действия многих лекарственных веществ, витаминов, гормонов, антибиотиков и т. д. Как уже отмечалось, при образовании липосом водорастворимые вещества захватываются вместе с водой и попадают во внутреннее пространство липосом. Таким путем можно начинять липосомы различными веществами, включая [c.579]
Они представляют собой удобную модель для изучения действия многих лекарственных веществ, витаминов, гормонов, антибиотиков и т. д. Как уже отмечалось, при образовании липосом водорастворимые вещества захватываются вместе с водой и попадают во внутреннее пространство липосом. Таким путем можно начинять липосомы различными веществами, включая [c.579]
Описание данных по качеству воды. Модуль качества воды WQ включает в себя четыре информационные компоненты. Первая группа данных получается в результате решения гидродинамической модели речной системы (модуль ПВ), поэтому модуль WQ всегда запускаются после модуля НВ. Для определения параметров несупдего потока используются полученные в НВ расходы и скорости как функции от времени для всех расчетных точек. Вторая группа данных содержит информацию о конвективной диффузии. Здесь перечисляются наименования компонент, единицы измерения концентрации для них, коэффициенты дисперсии (диффузия), начальные условия, коэффициенты распада (неконсервативности) несуш,его потока, открытые и закрытые граничные условия.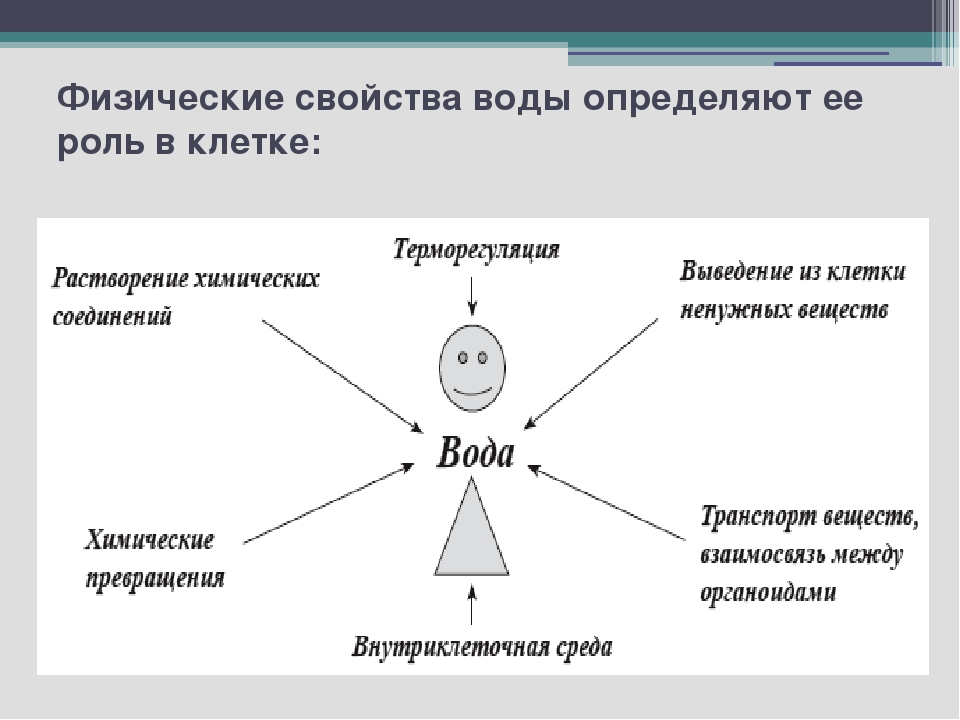 Третья группа данных содержит информацию о граничных условиях для каждого загрязнителя (граничное условие и привязка к руслу речной системы). Четвертая группа описывает процессы взаимодействия биологически активных веш,еств (БПК, нитраты, аммоний) с кислородом. В этих данных указываются основные параметры этого взаимодействия с окружаюш,ей средой и свойства несуш,его потока реки (тепловая радиация, реаэрация, респирация, фотосинтез, температурные процессы и т.д.). Только наличие всех четырех типов данных позволяет произвести корректный расчет качества воды в речной системе. [c.316]
Третья группа данных содержит информацию о граничных условиях для каждого загрязнителя (граничное условие и привязка к руслу речной системы). Четвертая группа описывает процессы взаимодействия биологически активных веш,еств (БПК, нитраты, аммоний) с кислородом. В этих данных указываются основные параметры этого взаимодействия с окружаюш,ей средой и свойства несуш,его потока реки (тепловая радиация, реаэрация, респирация, фотосинтез, температурные процессы и т.д.). Только наличие всех четырех типов данных позволяет произвести корректный расчет качества воды в речной системе. [c.316]
Токсическое действие. С. изменяет органолептические свойства воды, придавая ей выраженный землистый запах при концентрациях выше 1,0 мг/л. Пороговые концентрации С. по влиянию на органолептические свойства воды находятся в диапазоне 0,001-0,1 мг/л концентрация 2,5 мг/л — пороговая по влиянию на общесанитарный режим водоемов. В токсических дозах С. обладает политропным действием. Угнетает активность групп — 8Н ряда ферментов, нарушая ферментативные реакции, подавляет процессы биологического окисления и фосфорилирования, вызывает извращение фосфорно-кальциевого обмена, снижение интенсивности белкового обмена, нарушение функций печени и почек. С. и его соединения вызывают изменения иммунобиологической реактивности организма, нарушают условнорефлекторную деятельность, а также приводят к патоморфологическим изменениям некоторых внутренних органов. Помимо общетоксического действия, ингибирование групп — 8П ферментов позволяет относить С. к тиоловым ядам. Имеются указания на то, что С. обладает иммунотоксическим, эмбриотоксическим, тератогенным эффектами, угнетает митотическую активность и репродуктивную функцию. [c.490]
С. и его соединения вызывают изменения иммунобиологической реактивности организма, нарушают условнорефлекторную деятельность, а также приводят к патоморфологическим изменениям некоторых внутренних органов. Помимо общетоксического действия, ингибирование групп — 8П ферментов позволяет относить С. к тиоловым ядам. Имеются указания на то, что С. обладает иммунотоксическим, эмбриотоксическим, тератогенным эффектами, угнетает митотическую активность и репродуктивную функцию. [c.490]
Вода играет важную роль в живых системах и в значительной степени определяет структуру и функции биологических полимеров, таких, как белки. Однако в этом сообщении мы сконцентрируем внимание в первую очередь не на том, как влияет вода на биополимеры, а на влиянии биополимеров на воду, которая с ними взаимодействует. Представляют интерес изменения структурных, энергетических и динамических свойств молекул воды. В результате изучения вращательной подвижности молекул воды на поверхности белков молекулы растворителя были поделены на три группы [1]. Первая группа включает быстро реориентируемые молекулы с временем вращательной релаксации (тг) не более 10 » с. В следующую группу входят частицы, имеющие время вращательной релаксации пример,но 10 с они предположительно идентифицируются как молекулы воды, связанные сильной связью с ионными остатками. Третья группа имеет Тг порядка 10- с эти молекулы растворителя считаются связанными с макромолекулами связями, запрещающими вращение примером могут служить четыре молекулы воды, распо- [c.31]
Первая группа включает быстро реориентируемые молекулы с временем вращательной релаксации (тг) не более 10 » с. В следующую группу входят частицы, имеющие время вращательной релаксации пример,но 10 с они предположительно идентифицируются как молекулы воды, связанные сильной связью с ионными остатками. Третья группа имеет Тг порядка 10- с эти молекулы растворителя считаются связанными с макромолекулами связями, запрещающими вращение примером могут служить четыре молекулы воды, распо- [c.31]
Равновесие 2К5Н- — /гОг = — ЗН + НгО сильно сдвинуто вправо, если раствор нейтрален или содержит неболь-щие количества щелочей в кислых растворах, наоборот, устойчивы сульфгидрильные группы 5Н. Связи — 5 —5 — могут быть внутримолекулярными или связывать мономерные единицы белка (например, сывороточный альбумин) в одну крупную частицу. В стабилизации формы молекулы играют роль и гидрофобные связи. Гидрофобные связи возникают за счет сил взаимодействия между углеводородными частями молекул белка. Углеводородные группы белковых частиц, находящихся в водной среде, ориентированы во внутренние зоны частицы, а гидрофильные группы (ОН, СООН) находятся на внещней стороне, которая обращена к воде. Вследствие этого внутри молекулы белка возникает углеводородное ядро, причем для того, чтобы его разрушить и перевести углеводородные группы в водную среду, надо затратить работу. Это и означает, что между углеводородными частями молекулы действуют силы притяжения. Кроме водородных, дисуль-фидных и гидрофобных связей, в поддержании формы молекулы белка принимают участие и другие факторы имеет значение возникновение солевых мостиков, действие сил Ван-дер-Ваальса особенно большое влияние оказывают молекулы воды. Сохранение определенной формы молекулы важно с биологической точки зрения. Оно обеспечивает, в частности, такое взаимное расположение групп атомов на поверхности молекулы, которое необходимо для проявления каталитической активности белка, его гормональных функций и т. д. Поэтому устойчивость глобул, так же как и многие особенности структур биологически активных молекул, не случайное свойство, а одно из средств стабилизации организма.
Углеводородные группы белковых частиц, находящихся в водной среде, ориентированы во внутренние зоны частицы, а гидрофильные группы (ОН, СООН) находятся на внещней стороне, которая обращена к воде. Вследствие этого внутри молекулы белка возникает углеводородное ядро, причем для того, чтобы его разрушить и перевести углеводородные группы в водную среду, надо затратить работу. Это и означает, что между углеводородными частями молекулы действуют силы притяжения. Кроме водородных, дисуль-фидных и гидрофобных связей, в поддержании формы молекулы белка принимают участие и другие факторы имеет значение возникновение солевых мостиков, действие сил Ван-дер-Ваальса особенно большое влияние оказывают молекулы воды. Сохранение определенной формы молекулы важно с биологической точки зрения. Оно обеспечивает, в частности, такое взаимное расположение групп атомов на поверхности молекулы, которое необходимо для проявления каталитической активности белка, его гормональных функций и т. д. Поэтому устойчивость глобул, так же как и многие особенности структур биологически активных молекул, не случайное свойство, а одно из средств стабилизации организма. [c.57]
[c.57]
Необратимое свертывание белка яиц при нагревании — явление хорошо известное. Подобное изменение в состоянии указанного белка может быть вызвано и действием ряда других физических и химических агентов сильным встряхиванием, облучением ультрафиолетовыми лучами, действием ультразвуковых волн, кислот, щелочей, органических растворителей, солей тяжелых металлов, мочевины, гуанидина, салицилатов и многих других веществ. При всех этих воздействиях белок теряет свою первоначальную растворимость и в большинстве случаев становится нерастворимым при изоэлектрической точке. В отличие от других белков коллаген при нагревании в воде растворяется. Измененные под влиянием всех указанных воздействий нативные белки получили название денатурированных белков. часто сопровождается потерей биологической активности белков. Так, например, ферменты теряют свою каталитическую активность, гормоны — физиологическую функцию, антитела — способность соединяться с антигеном. Эти изменения не всегда протекают параллельно изменениям физико-химических свойств белков. Денатурация, очевидно, представляет собой комплексное явление. Вряд ли можно думать, что действие столь различных соединений, как мочевина и серная кислота, а также влияние нагревания обусловливают одно и то же изменение белков. Нельзя поэтому просто говорить о денатурации белков, например яичного альбумина необходимо всегда указывать, какой именно агент вызвал денатурацию. [c.147]
Денатурация, очевидно, представляет собой комплексное явление. Вряд ли можно думать, что действие столь различных соединений, как мочевина и серная кислота, а также влияние нагревания обусловливают одно и то же изменение белков. Нельзя поэтому просто говорить о денатурации белков, например яичного альбумина необходимо всегда указывать, какой именно агент вызвал денатурацию. [c.147]
Наряду с этим мы не обнаружили нарушений функции центральной нервной системы и симптомов поражения печени, характерных при воздействии других представителей этой группы. Очевидно, некоторыми различиями в физико-химических свойствах отдельных представителей галогенопроизводдых спиртов жирного ряда, в частности их способностью растворяться в жирах, обусловлены степень их токсичности и некоторые качественные различия в их токсикодинамических свойствах. Установлено, что этиленхлор — гидрин и эпихлор-гидрин, хорошо растворимые в жирах, обладают почти одинаковой токсичностью как нри нанесении на кожу, так и при введении их через рот. В то же время дихлоргидрин, нерастворимый в жирах, не проникает через неповрежденную кожу и не оказывает общетоксического действия. Можно предположить, что в силу незначительности липотропных свойств МХГ и ДХГ ограничивается их накопление в клетках центральной нервной системы, богатых липидами. Наряду с этим вследствие хорошей растворимости этих соединений в воде, а следовательно, и биологических жидкостях они способны быстро выводиться из организма. [c.138]
В то же время дихлоргидрин, нерастворимый в жирах, не проникает через неповрежденную кожу и не оказывает общетоксического действия. Можно предположить, что в силу незначительности липотропных свойств МХГ и ДХГ ограничивается их накопление в клетках центральной нервной системы, богатых липидами. Наряду с этим вследствие хорошей растворимости этих соединений в воде, а следовательно, и биологических жидкостях они способны быстро выводиться из организма. [c.138]
Изучение физико-химических свойств мембран удобно проводить на моделях монослоев, которые получаются при нанесении липидов на поверхность воды. Повышение давления и уплотнение монослоя приводят к тому, что подвижность углеводородных цепочек уменьшается, их взаимодействие друг с другом растет, а полярные головки фиксируются на поверхности раздела фаз. В пределе происходит такое уплотнение монослоя, где плошадь поперечного сечения молекулы липида не зависит от длины углеводородной цепи. Монослой представляет собой лишь половину липидного бислоя мембраны, и более удобной моделью служат различные искусственные бислойные липидные мембраны (БЛМ). Плоские ламеллярные структуры, могут сливаться, образуя замкнутые везикулярные частицы (липосомы), в которых липидные бислои отделяют внутреннюю водную фазу от наружного раствора. В везикулярные частицы можно встраивать белковые молекулы и другие компоненты биологических мембран для изучения механизмов их функционирования в биомембранах. Плоские БЛМ используются для изучения барьерных функций, электромеханических характеристик, а также межмолекулярных взаимодействий в мембранах. Электростатические взаимодействия осуществляются между заряженными группами либо в пределах одного полуслоя (латеральные), либо между разными слоями (трансмембранные). Дисперсионные вандерваальсовы взаимодействия между поверхностями мембран обнаруживаются на расстояниях до 1000 А. Это значительно превышает расстояния, где проявляется [c.131]
Плоские ламеллярные структуры, могут сливаться, образуя замкнутые везикулярные частицы (липосомы), в которых липидные бислои отделяют внутреннюю водную фазу от наружного раствора. В везикулярные частицы можно встраивать белковые молекулы и другие компоненты биологических мембран для изучения механизмов их функционирования в биомембранах. Плоские БЛМ используются для изучения барьерных функций, электромеханических характеристик, а также межмолекулярных взаимодействий в мембранах. Электростатические взаимодействия осуществляются между заряженными группами либо в пределах одного полуслоя (латеральные), либо между разными слоями (трансмембранные). Дисперсионные вандерваальсовы взаимодействия между поверхностями мембран обнаруживаются на расстояниях до 1000 А. Это значительно превышает расстояния, где проявляется [c.131]
Почему же эти минералы и простое химическое соединение вода оказываются настолько близкими по своим свойствам к живым организмам, не обладая генами, которые обеспечивают постоянство строения и обусловливают изменчивость Ответ прост гены имеют к этим двум существенным качествам весьма отдаленное отношение. Такая констатация должна, казалось бы, уязвить мое самолюбие генетика во всяком случае она йгорчительна для тех, кто пытается решать все проблемы биологии, основываясь исключительно на функциях генов. У воды н кальцита генов нет, и однако в них уже заключены те механизмы, которые в настоящее время считаются главными атрибутами генов. В дальнейшем мы увидим, какова именно функция гена и насколько вторична его роль в биологических процессах. [c.103]
Такая констатация должна, казалось бы, уязвить мое самолюбие генетика во всяком случае она йгорчительна для тех, кто пытается решать все проблемы биологии, основываясь исключительно на функциях генов. У воды н кальцита генов нет, и однако в них уже заключены те механизмы, которые в настоящее время считаются главными атрибутами генов. В дальнейшем мы увидим, какова именно функция гена и насколько вторична его роль в биологических процессах. [c.103]
Одновременно с химическими методами, хотя и не так интенсивно, арсенал методов исследования биологических мембран пополнялся физическими методами. Так, измерение осмотических свойств клетки (Пфеффер, 1877), скорости процесса, вызывающего вторичное сокращение мышцы (Гельмгольц, 1850), некоторые опыты в исследованиях Э. Дюбуа-Реймона, В. Оствальда, X. де Фриза и Э. Рейда можно с уверенностью классифицировать как физические. А опыты Р. Чамберса по изучению проникновения веществ в клетку и их диффузии внутри клетки (1922), измерению электрической емкости и электрического сопротивления эритроцитов (Фрике, 1925 Хёбер, 1926), изменению поверхностного натяжения на границе липид — вода в зависимости от добавок различных веществ, которые провели Д. Даниэлли и X. Давсон в 1935 г., являются истинно физическими методами, одними из самых плодотворных в изучении структуры и функции мембран. Так, Даниэлли и Давсон, приняв во внимание, что уменьшение поверхностного натяжения на границе липид—протоплазма может быть следствием взаимодействия белковых и липидных молекул, а также используя данные и идеи преды- [c.5]
Даниэлли и X. Давсон в 1935 г., являются истинно физическими методами, одними из самых плодотворных в изучении структуры и функции мембран. Так, Даниэлли и Давсон, приняв во внимание, что уменьшение поверхностного натяжения на границе липид—протоплазма может быть следствием взаимодействия белковых и липидных молекул, а также используя данные и идеи преды- [c.5]
За более чем столетнюю историю витаминологии (науки о витаминах и их биологической роли) выделено и исследовано около 30 соединений, обладающих витаминной функцией. При изучении витаминов им сначала давали названия по имени того заболевания, которое вызывает недостаток или отсутствие данного витамина в пище. При этом к названию болезни добавляли приставку анти-. Позже их стали обозначать латинскими буквами. Таким образом, в настоящее время витамины имеют буквенные обозначения, химические названия и названия, характеризующие их физиологическое действие. Они также классифицируются по химической природе или физикохимическим свойствам. Последняя классификация наиболее известна. Так, по физико-химическим свойствам витамины делятся на водо- и жирорастворимые. К водорастворимым относятся аскорбиновая кислота, тиамин, рибофлавин, пантотеновая кислота, пиридоксин, фолиевая кислота, цианкоболамин, никотинамид, биотин к жирорастворимым — ретинол, кальциферолы, токоферолы, филлохиноны. К витаминоподобным соединениям принадлежат некоторые флавоноиды, липоевая, оротоновая, пагмановая кислоты, холин, инозит. [c.93]
Последняя классификация наиболее известна. Так, по физико-химическим свойствам витамины делятся на водо- и жирорастворимые. К водорастворимым относятся аскорбиновая кислота, тиамин, рибофлавин, пантотеновая кислота, пиридоксин, фолиевая кислота, цианкоболамин, никотинамид, биотин к жирорастворимым — ретинол, кальциферолы, токоферолы, филлохиноны. К витаминоподобным соединениям принадлежат некоторые флавоноиды, липоевая, оротоновая, пагмановая кислоты, холин, инозит. [c.93]
Вопросу состояния воды и ее роли в биологических системах посвящено большое количество работ [ 10,11,38-42]. Основываясь на литературных данных, H.A. Аскоченская [36] указывает, что полифункциональность воды в живом субстрате базируется на выявленной структурной ассоциативной множественности ее в биологических системах. Авторы [43] отмечают, что в биологических объектах вода находится в двух состояниях свободная, обладающая всеми параметрами чистой воды, и связанная — с измененными свойствами, обусловливающая устойчивость организма к неблагоприятным условиям. Но свойства и той, и другой воды постоянно меняются. Обобщая результаты работ ряда исследователей, Ю.В. Новиков и соавторы [4] отмечают, что вода, связанная с клеточной протоплазмой, и вода, входящая в состав межклеточной жидкости и других образований организма, принимает структуру, напоминающую структуру льда. При этом структурированная вода более важна для сохранения функций и жизнеспособности тканей. А.К. Гуман [10] заключает, что конфигурация пустот ледяной решетки такова, что биомолекулы включаются в пустоты без всякого повреждения, с сохранением способности к проявлению жизненных функций, тогда как в плотноупакованной структуре они не могут войти в оптимальный контакт с водой. Используя метод рентгено-структурного анализа, авторы [44] приходят к выводу, что внутриклеточная вода эритроцита образует сложную пространственную сеть, в петлях которой расположены молекулы гемоглобина. И.М. Медведев и Т.П. Фисанович [45] считают, что структурированная вода является защитным фактором клетки, в частности эритроцита.
Но свойства и той, и другой воды постоянно меняются. Обобщая результаты работ ряда исследователей, Ю.В. Новиков и соавторы [4] отмечают, что вода, связанная с клеточной протоплазмой, и вода, входящая в состав межклеточной жидкости и других образований организма, принимает структуру, напоминающую структуру льда. При этом структурированная вода более важна для сохранения функций и жизнеспособности тканей. А.К. Гуман [10] заключает, что конфигурация пустот ледяной решетки такова, что биомолекулы включаются в пустоты без всякого повреждения, с сохранением способности к проявлению жизненных функций, тогда как в плотноупакованной структуре они не могут войти в оптимальный контакт с водой. Используя метод рентгено-структурного анализа, авторы [44] приходят к выводу, что внутриклеточная вода эритроцита образует сложную пространственную сеть, в петлях которой расположены молекулы гемоглобина. И.М. Медведев и Т.П. Фисанович [45] считают, что структурированная вода является защитным фактором клетки, в частности эритроцита. По данным ряда авторов, вода с квазикристаллической структурой является катализатором ряда биохимических реакций [46-49]. [c.208]
По данным ряда авторов, вода с квазикристаллической структурой является катализатором ряда биохимических реакций [46-49]. [c.208]
Учебная программа лечебного факультета
Содержание предмета биохимия. Биохимия белка. Строение, физико–химические и химические свойства протеиногенных аминокислот и белков. Классификации белков. Функции белков и пептидов. Биосинтез белка. Конформация белковой молекулы. Механизмы взаимодействия белок–лиганд. Денатурация белка. Методы исследования белков. Энзимология. Строение и механизмы функционирования ферментов. Классификация, индексация и номенклатура ферментов. Особенности ферментов в качестве биологических катализаторов. Кинетика ферментативного катализа. Уровни регуляции ферментов. Понятие о метаболических путях. Катаболизм и анаболизм. Энзимодиагностика и энзимотерапия. Типы и механизмы биологического окисления. Митохондриальное окисление: субстраты, цепи транспорта электронов, сопряжение с процессом окислительного фосфорилирования. Виды внемитохондриального окисления, их роль. Активные формы кислорода. Антиоксидантная система. Биологически важные углеводы человека. Переваривание и всасывание углеводов. Метаболические пути обмена углеводов, связанные с получением энергии в виде АТФ. Структурные углеводы, их синтез. Роль ГАГ, протеогликанов, углеводных компонентов гликопротеинов и гликолипидов. Источники глюкозы в крови, регуляция ее концентрации. Механизмы гликирования и гликозилирования биомолекул. Липиды организма человека: определение, классификация. Переваривание и всасывание липидов. Строение и функции триглицеридов. Синтез и распад триглицеридов. Кетоновые тела: их синтез, утилизация и роль в организме человека. Мембранные липиды: строение, свойства, роль. Синтез и распад мембранных липидов. Системы транспорта липидов. Фракции липопротеинов, методы их исследования. Биологически активные продукты катаболизма липидов. Многообразие белков организма человека. Механизмы посттрансляционной модификации белка. Азотистый баланс.
Виды внемитохондриального окисления, их роль. Активные формы кислорода. Антиоксидантная система. Биологически важные углеводы человека. Переваривание и всасывание углеводов. Метаболические пути обмена углеводов, связанные с получением энергии в виде АТФ. Структурные углеводы, их синтез. Роль ГАГ, протеогликанов, углеводных компонентов гликопротеинов и гликолипидов. Источники глюкозы в крови, регуляция ее концентрации. Механизмы гликирования и гликозилирования биомолекул. Липиды организма человека: определение, классификация. Переваривание и всасывание липидов. Строение и функции триглицеридов. Синтез и распад триглицеридов. Кетоновые тела: их синтез, утилизация и роль в организме человека. Мембранные липиды: строение, свойства, роль. Синтез и распад мембранных липидов. Системы транспорта липидов. Фракции липопротеинов, методы их исследования. Биологически активные продукты катаболизма липидов. Многообразие белков организма человека. Механизмы посттрансляционной модификации белка. Азотистый баланс. Пищевая ценность белков. Переваривание белков в желудочно–кишечном тракте, всасывание аминокислот. Этапы катаболизма белка. Протеолиз. Роль тотального и ограниченного протеолиза. Регуляция протеолитических систем. Трансаминирование и дезаминирование аминокислот. Синтез заменимых аминокислот. Пути образования и обезвреживания аммиака. Пути образования и обезвреживания биологически активных продуктов аминокислотного обмена. Синтез, распад и роль креатина. Роль аминокислот в синтезе гемма и нуклеиновых кислот. Строение и функции нуклеиновых кислот. Функции нуклеотидов. Биохимические основы синтеза нуклеиновых кислот. Посттранскрипционная модификации РНК. Синтез и распад нуклеотидов. Строение и классификация гемопротеинов. Молекулярные формы и производные гемоглобина. Синтез и распад гема. Прямой и непрямой билирубин. Обмен воды и минеральный веществ и их регуляция. Состав плазмы крови. Белковые фракции крови. Функции белковых и небелковых компонентов крови. Система свертывания крови и фибринолиза.
Пищевая ценность белков. Переваривание белков в желудочно–кишечном тракте, всасывание аминокислот. Этапы катаболизма белка. Протеолиз. Роль тотального и ограниченного протеолиза. Регуляция протеолитических систем. Трансаминирование и дезаминирование аминокислот. Синтез заменимых аминокислот. Пути образования и обезвреживания аммиака. Пути образования и обезвреживания биологически активных продуктов аминокислотного обмена. Синтез, распад и роль креатина. Роль аминокислот в синтезе гемма и нуклеиновых кислот. Строение и функции нуклеиновых кислот. Функции нуклеотидов. Биохимические основы синтеза нуклеиновых кислот. Посттранскрипционная модификации РНК. Синтез и распад нуклеотидов. Строение и классификация гемопротеинов. Молекулярные формы и производные гемоглобина. Синтез и распад гема. Прямой и непрямой билирубин. Обмен воды и минеральный веществ и их регуляция. Состав плазмы крови. Белковые фракции крови. Функции белковых и небелковых компонентов крови. Система свертывания крови и фибринолиза. Белки иммунной системы. Системы регуляции сосудистого тонуса. Особенности химического состава и метаболизма эритроцитов и лейкоцитов. Состав миоцитов. Механизм мышечного сокращения. Источники энергии для мышечной ткани. Особенности химического состава и метаболизма нервной ткани. Химическая классификация нейромедиаторов. Функции почек. Биохимические механизмы экскреторной и гомеостатичской функций почек. Гормоны почки. Гормональная регуляция мочеобразования. Химический состав мочи человека.
Белки иммунной системы. Системы регуляции сосудистого тонуса. Особенности химического состава и метаболизма эритроцитов и лейкоцитов. Состав миоцитов. Механизм мышечного сокращения. Источники энергии для мышечной ткани. Особенности химического состава и метаболизма нервной ткани. Химическая классификация нейромедиаторов. Функции почек. Биохимические механизмы экскреторной и гомеостатичской функций почек. Гормоны почки. Гормональная регуляция мочеобразования. Химический состав мочи человека.
Биологические свойства воды
Как растительные, так и животные микро- и макроорганизмы, населяющие водоемы, называются биоценозом. Кроме рыб, речных и морских животных, относящихся к так называемому нектону, все водные организмы разделяются на планктон и бентос. Организмы, которые, находясь во взвешенном состоянии, самостоятельно или пассивно перемещаются в воде, называются планктоном, а организмы, связанные с дном водоема и с поверхностью различных подводных предметов (камней, свай и пр. ), называются бентосом. По населяющим воду видам организмов можно судить о санитарных свойствах воды. В зависимости от качества водной среды в ней живут определенные, более или менее типичные (индикаторные) представители зоопланктона и фитопланктона.
), называются бентосом. По населяющим воду видам организмов можно судить о санитарных свойствах воды. В зависимости от качества водной среды в ней живут определенные, более или менее типичные (индикаторные) представители зоопланктона и фитопланктона.
Всех водных организмов по степени приспособленности их к загрязнению воды делят на полисапробов, мезосапробов, олигосапробов и катаробов.
Полисапробная группа организмов развивается в коде, сильно загрязненной органическими веществами, и не нуждается в свободном кислороде. Представители этой группы: бесцветные жгутиковые, инфузории и огромное количество бактерий, особенно анаэробов и серных.
Альфа-мезосапробная группа организмов обитает в воде, загрязненной органическими веществами, в которой уже идут окислительные процессы и присутствует кислород. Количество микроорганизмов в 1 мл поды составляет сотни тысяч. Это бактерии, грибы, простейшие и водоросли (диатомовые и сине-зеленые).
Бета-мезосапробная группа организмов обитает в водах, в которых протекают окислительные процессы; эти организмы питаются минеральными веществами и нуждаются в свободном кислороде. Количество микроорганизмов в 1 мл такой воды исчисляется десятками тысяч. Эту группу составляют бактерии, инфузории, жгутиковые, водоросли различных видов, ракообразные, коловратки и рыбы.
Количество микроорганизмов в 1 мл такой воды исчисляется десятками тысяч. Эту группу составляют бактерии, инфузории, жгутиковые, водоросли различных видов, ракообразные, коловратки и рыбы.
Олигосапробная группа организмов характерна для чистой воды, пригодной для водоснабжения, свободной от загрязнения и богатой кислородом. Количество микроорганизмов исчисляется тысячами в 1 мл вода. Представители данной группы: водоросли зеленые, диатомовые, коловратки, губки, ракообразные, рыбы и водяные цветковые растения.
Катаробкая группа организмов — показатель совершенно чистой воды.
Таким образом, представители планктона и бентоса, очищая водоемы от органических веществ, являются в то же время показателями степени загрязнения воды. Определенные заключения могут быть сделаны и по выживаемости в водоеме некоторых пород рыб, из которых особенно чувствительны к загрязнению форель, стерлядь и др., а наиболее выносливые — тука, окунь, плотва, линь, карась и карп.
Во всех природных водах, за исключением глубоких подземных, имеется большое количество микроорганизмов как свойственных воде (водных), так и случайных, пребывающих в ней временно.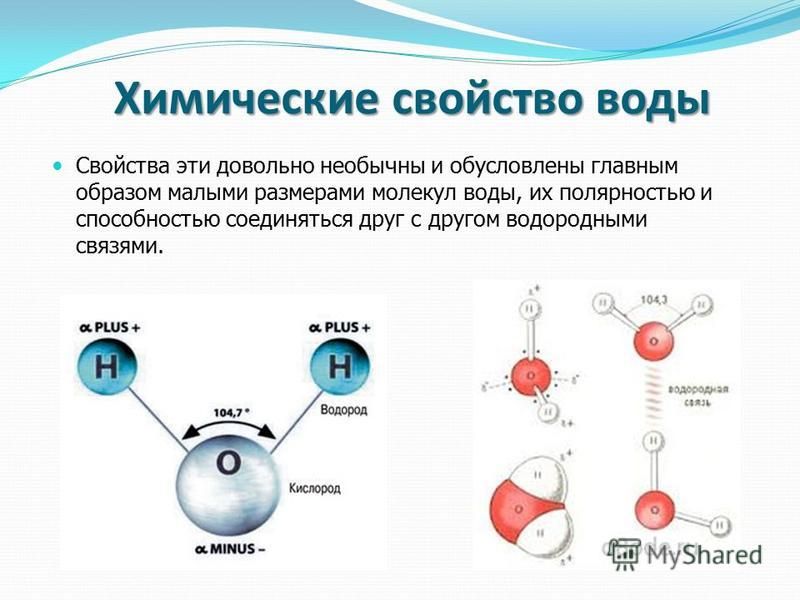 В незагрязненной органическими веществами воде содержится много кислорода, а потому населяют ее аэробные микроорганизмы. В воде, загрязненной органическими веществами, бедной кислородом, находятся анаэробные микроорганизмы. Однако количество микроорганизмов имеет общеориентирующее значение для характеристики качества воды. Согласно ГОСТ, в 1 мл хорошей воды допустимо не более 100-1000 бактерий.
В незагрязненной органическими веществами воде содержится много кислорода, а потому населяют ее аэробные микроорганизмы. В воде, загрязненной органическими веществами, бедной кислородом, находятся анаэробные микроорганизмы. Однако количество микроорганизмов имеет общеориентирующее значение для характеристики качества воды. Согласно ГОСТ, в 1 мл хорошей воды допустимо не более 100-1000 бактерий.
При загрязнении водоемов отбросами животного происхождения (навозом, мочой, сточными водами промышленных предприятий, перерабатывающих животное сырье) не исключена возможность заражения воды патогенными микроорганизмами и яйцами гельминтов. В этих случаях вода может явиться источником заражения животных инфекционными и инвазионными болезнями.
К таким инфекциям в первую очередь можно отнести сибирскую язву, паратиф, туберкулез, бруцеллез, туляремию, рожу, листереллез, инфекционную анемию, инфекционный гепатит утят и некоторые другие.
Известно также, что через воду могут передаваться холера, брюшной тиф, паратиф, дизентерия, лептоспироз, туляремия, полиомиелит и некоторые другие инфекционные болезни человека (Л. В. Громашевский).
В. Громашевский).
Данные разных исследований о сроках возможного выживания патогенных бактерий в воде довольно противоречивы. Так, в экспериментальных условиях возбудители разных инфекционных болезней могут проявлять жизнеспособность и вирулентность в течение недель, нескольких месяцев и больше (П. А. Муханцев, В. И. Полтев, И. А. Каркалиновская, П. Ф. Милявская и др.). В естественных условиях поступающие в водоемы патогенные бактерии подвергаются большому разведению, противоставляются огромному числу их антагонистов — сапрофитов и скоро погибают. Последнее, однако, не снимает опасности воды в возникновении инфекционных заболеваний животных в результате постоянного или значительного инфицирования водоисточников.
При бактериологическом исследовании воды наиболее важным было бы непосредственное определение в ней наличия патогенных микробов. Однако выявить в воде патогенные микроорганизмы весьма трудно. Иногда заведомо в инфицированной воде их не удается обнаружить, поэтому при бактериологическом контроле за качеством воды обычно пользуются косвенным методом, при котором определяют показатели фекального загрязнения. Основным показателем фекального загрязнения воды служит кишечная палочка (В. coli) — постоянный обитатель кишечника животных и человека. Чем больше вода загрязнена кишечной палочкой, тем больше вероятности встретить патогенных микроорганизмов и зародышей гельминтов, так как путь их попадания в воду один и тот же. При сильных загрязнениях воды отбросами животного происхождения кишечная палочка обнаруживается в небольших объемах ее, а в чистой воде кишечную палочку удается найти лишь в большом объеме воды.
Основным показателем фекального загрязнения воды служит кишечная палочка (В. coli) — постоянный обитатель кишечника животных и человека. Чем больше вода загрязнена кишечной палочкой, тем больше вероятности встретить патогенных микроорганизмов и зародышей гельминтов, так как путь их попадания в воду один и тот же. При сильных загрязнениях воды отбросами животного происхождения кишечная палочка обнаруживается в небольших объемах ее, а в чистой воде кишечную палочку удается найти лишь в большом объеме воды.
Поэтому по степени загрязненности воды и пригодности ее для поения животных судят также по коли-титру (титру кишечной палочки) и коли-индексу.
Коли-титром называется тот наименьший объем исследуемой воды в миллилитрах, в котором обнаруживается кишечная палочка. Хорошая питьевая вода по стандарту должна иметь коли-титр не ниже 200—300 мл.
Коли-индексом называется число кишечных палочек, содержащихся в 1 л исследуемой воды.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Биологическое значение воды | A-Level (A2/AS) Biology Revision Notes
Введение- Вода является основой жизни на нашей планете. Он существует в различных физических состояниях – твердом, жидком и газообразном – и составляет 70 % поверхности Земли, плюс 65 – 90 % веса всех живых организмов. Вода также играет важную роль во всех процессах жизнедеятельности живых организмов.
- Молекула воды H 2 O состоит из одного атома кислорода и двух атомов водорода.Эти атомы связаны ковалентно (ковалентной связью). В молекуле воды водород несет положительный молекулярный заряд, а кислород несет отрицательный молекулярный заряд. Таким образом, молекула воды является «полярной» молекулой, поскольку она имеет как положительные, так и отрицательные полюса.
- Близкие молекулы воды притягиваются друг к другу за счет относительно слабого электрического притяжения (отрицательные атомы водорода притягивают положительные атомы кислорода в других молекулах).
 Эта связь называется «водородной связью». Вода обладает уникальными свойствами благодаря своей полярности и водородным связям между ее молекулами.
Эта связь называется «водородной связью». Вода обладает уникальными свойствами благодаря своей полярности и водородным связям между ее молекулами.
- Вода считается «общим растворителем» или «универсальным растворителем» из-за полярности ее молекул.
Для например , когда хлорид натрия (NaCl) растворяется в воде, образуются положительные ионы натрия и отрицательные ионы хлора. Положительные атомы кислорода в воде притягивают отрицательные ионы хлора, а отрицательные атомы водорода притягивают положительные ионы натрия. Все полярные вещества (вещества, содержащие ионы) могут растворяться в полярных растворителях, например в воде. - Все необходимые для живых организмов вещества (витамины, соли, аминокислоты, газы, глюкоза) транспортируются в организме в виде растворенных в воде растворенных веществ. Эти вещества принимают участие в метаболических реакциях внутри клеток.

- Это означает, что вода обладает способностью диссоциировать молекулы, необходимые для жизни, на положительные и отрицательные ионы (вода может делать это из-за полярности своих молекул).
Например, , поджелудочная железа секретирует бикарбонат натрия (NaHCO 3). Это соединение ионизируется в воде на положительные ионы водорода и отрицательные ионы бикарбоната, что делает среду щелочной и, таким образом, пригодной для работы ферментов.
- Удельная теплоемкость – это количество теплоты, необходимое для повышения температуры одного грамма вещества на 1 градус Цельсия.
- Вода имеет самую высокую удельную теплоемкость на Земле из-за водородных связей между ее молекулами.
- В результате высокой удельной теплоемкости воде требуется большое количество энергии для повышения ее температуры, и она теряет большое количество энергии при понижении температуры.
 Это помогает живым организмам иметь постоянную температуру, которая необходима для жизненных процессов, происходящих в их телах. Клетки содержат много воды, чтобы поддерживать постоянную температуру.
Это помогает живым организмам иметь постоянную температуру, которая необходима для жизненных процессов, происходящих в их телах. Клетки содержат много воды, чтобы поддерживать постоянную температуру. - Животные и растения теряют воду в результате процессов потоотделения и транспирации, что снижает их температуру.
- Высокая удельная теплоемкость воды обеспечивает живые организмы температурами, подходящими для жизни на Земле.
- Вода составляет почти 70% поверхности Земли. Если бы воды не было в таком большом количестве, температура Земли резко понизилась бы, так как вещества, образующие земную кору, имеют низкую удельную теплоемкость.
- Вода, из которой состоят океаны, поглощает большое количество солнечных лучей утром и распространяет их в атмосферу ночью, чтобы поддерживать температуру Земли, пригодную для живых организмов.
- Поверхностное натяжение – это сцепление молекул на поверхности жидкости с целью занять наименьший возможный объем.
 Вязкость – это сопротивление жидкости течению.
Вязкость – это сопротивление жидкости течению. - Вода имеет низкую вязкость и высокое поверхностное натяжение благодаря водородным связям между ее молекулами; эти условия подходят для жизни.
1- Они влияют на сцепление клеточных веществ.
2- Замедляет потерю влаги листьями растений через поры.
3- Некоторые насекомые могут ходить по воде из-за сцепления молекул на ее поверхности.
5- Плотность воды уменьшается ниже 4 ◦ C.
- Вода расширяется, когда ее температура становится ниже 4 ◦ C (вместо сжатия). Это уменьшает его плотность и делает его плавающим. В замерзших озерах мы находим лед на поверхности, а под ним — жидкую воду.
- Это свойство обусловлено наличием водородных связей между молекулами воды.
- Это важное свойство, поскольку оно позволяет живым организмам жить в океанах и морях. Без этого свойства в лед превратятся все океаны и моря, а не только поверхность.
 Поверхностное замерзание действует как изолятор, предотвращая замерзание остальной воды.
Поверхностное замерзание действует как изолятор, предотвращая замерзание остальной воды.
6- Температура замерзания воды снижается, если в ней растворены вещества.
- Это свойство очень важно для живых организмов, так как предотвращает замерзание воды в клетках при воздействии температуры ниже 0◦C.
7- Вода может превращаться в пар при температуре ниже точки кипения (100°C).
- Водяной пар, образующийся на поверхности океанов, переносится конвекционными течениями в холодные слои атмосферы. Это превращается в облака, которые обеспечивают живые организмы дождем и водой.
8- Подъем воды в капиллярах.
- Вода способна подниматься по капиллярам без перекачки и в противовес внешним силам, таким как гравитация.Это свойство способствует переносу воды от корней дерева ко всем его частям.
Практика делает совершенным! Посетите сайты exampapersplus. co.uk и pretestplus.co.uk для подготовки к конкурсным экзаменам CAT, ISEB PRETEST, CEM SELECT и UKiset в школах Великобритании и других стран. Если вам нравится время, сэкономленное на пересмотре химии для A-Level, загляните на другие наши сайты, включая History, A-level Chemistry и Computer Science. Чтобы узнать о тысячах других вопросов викторины и пользовательских тестов, посетите HelpTeaching.
co.uk и pretestplus.co.uk для подготовки к конкурсным экзаменам CAT, ISEB PRETEST, CEM SELECT и UKiset в школах Великобритании и других стран. Если вам нравится время, сэкономленное на пересмотре химии для A-Level, загляните на другие наши сайты, включая History, A-level Chemistry и Computer Science. Чтобы узнать о тысячах других вопросов викторины и пользовательских тестов, посетите HelpTeaching.
Сохр.
Сохр.
Биологическая роль воды: Почему вода необходима для жизни?
Молли Сарген
фигурки Дэниела Аттера
Вода составляет 60-75% массы тела человека. Потеря всего 4% всей воды тела приводит к обезвоживанию, а потеря 15% может быть фатальной. Точно так же человек может прожить месяц без еды, но не проживет и трех дней без воды. Эта решающая зависимость от воды в целом управляет всеми формами жизни.Очевидно, что вода жизненно необходима для выживания, но почему она так необходима?
Молекулярный состав воды Многие роли воды в поддержании жизни обусловлены ее молекулярной структурой и некоторыми особыми свойствами. Вода представляет собой простую молекулу, состоящую из двух небольших положительно заряженных атомов водорода и одного большого отрицательно заряженного атома кислорода. Когда атомы водорода связываются с кислородом, образуется асимметричная молекула с положительным зарядом на одной стороне и отрицательным зарядом на другой стороне (рис. 1).Эта разность зарядов называется полярностью и определяет, как вода взаимодействует с другими молекулами.
Вода представляет собой простую молекулу, состоящую из двух небольших положительно заряженных атомов водорода и одного большого отрицательно заряженного атома кислорода. Когда атомы водорода связываются с кислородом, образуется асимметричная молекула с положительным зарядом на одной стороне и отрицательным зарядом на другой стороне (рис. 1).Эта разность зарядов называется полярностью и определяет, как вода взаимодействует с другими молекулами.
Вода как полярная молекула лучше всего взаимодействует с другими полярными молекулами, например с самой собой.Это происходит из-за явления, при котором противоположные заряды притягиваются друг к другу: поскольку каждая отдельная молекула воды имеет как отрицательную, так и положительную часть, каждая сторона притягивается к молекулам с противоположным зарядом. Это притяжение позволяет воде образовывать относительно прочные связи, называемые связями, с другими полярными молекулами вокруг нее, включая другие молекулы воды. В этом случае положительный водород одной молекулы воды свяжется с отрицательным кислородом соседней молекулы, чьи собственные атомы водорода притянутся к следующему кислороду, и так далее (рис. 1).Важно отметить, что эта связь заставляет молекулы воды слипаться друг с другом в свойстве, называемом когезией. Сплоченность молекул воды помогает растениям поглощать воду своими корнями. Сплоченность также способствует высокой температуре кипения воды, что помогает животным регулировать температуру тела.
Это притяжение позволяет воде образовывать относительно прочные связи, называемые связями, с другими полярными молекулами вокруг нее, включая другие молекулы воды. В этом случае положительный водород одной молекулы воды свяжется с отрицательным кислородом соседней молекулы, чьи собственные атомы водорода притянутся к следующему кислороду, и так далее (рис. 1).Важно отметить, что эта связь заставляет молекулы воды слипаться друг с другом в свойстве, называемом когезией. Сплоченность молекул воды помогает растениям поглощать воду своими корнями. Сплоченность также способствует высокой температуре кипения воды, что помогает животным регулировать температуру тела.
Более того, поскольку большинство биологических молекул имеют некоторую электрическую асимметрию, они также полярны, и молекулы воды могут образовывать связи с положительными и отрицательными областями и окружать их. Окружая полярные молекулы другого вещества, вода проникает во все закоулки и закоулки между молекулами, эффективно разрушая его на части и растворяя. Вот что происходит, когда вы кладете кристаллы сахара в воду: и вода, и сахар полярны, что позволяет отдельным молекулам воды окружать отдельные молекулы сахара, разрушая сахар и растворяя его. Подобно полярности, некоторые молекулы состоят из ионов или противоположно заряженных частиц. Вода также разрушает эти ионные молекулы, взаимодействуя как с положительно, так и с отрицательно заряженными частицами. Вот что происходит, когда вы кладете соль в воду, потому что соль состоит из ионов натрия и хлора.
Вот что происходит, когда вы кладете кристаллы сахара в воду: и вода, и сахар полярны, что позволяет отдельным молекулам воды окружать отдельные молекулы сахара, разрушая сахар и растворяя его. Подобно полярности, некоторые молекулы состоят из ионов или противоположно заряженных частиц. Вода также разрушает эти ионные молекулы, взаимодействуя как с положительно, так и с отрицательно заряженными частицами. Вот что происходит, когда вы кладете соль в воду, потому что соль состоит из ионов натрия и хлора.
Обширная способность воды растворять множество молекул принесла ей название «универсальный растворитель», и именно эта способность делает воду такой бесценной жизненно важной силой. На биологическом уровне роль воды в качестве растворителя помогает клеткам транспортировать и использовать такие вещества, как кислород или питательные вещества. Растворы на водной основе, такие как кровь, помогают доставлять молекулы в нужные места. Таким образом, роль воды как растворителя облегчает перенос молекул, таких как кислород, для дыхания и оказывает большое влияние на способность лекарств достигать своих целей в организме.
Вода также играет важную структурную роль в биологии. Визуально вода заполняет клетки, помогая сохранять форму и структуру (рис. 2). Вода внутри многих клеток (в том числе и тех, из которых состоит тело человека) создает давление, противодействующее внешним силам, подобно надуванию воздуха в воздушном шаре. Однако даже некоторым растениям, которые могут поддерживать свою клеточную структуру без воды, для выживания все же требуется вода. Вода позволяет всему внутри клеток иметь правильную форму на молекулярном уровне.Поскольку форма имеет решающее значение для биохимических процессов, это также одна из самых важных ролей воды.
Рис. 2: Вода влияет на форму клетки. Вода создает внутри клетки давление, которое помогает ей сохранять форму. В гидратированной клетке (слева) вода выталкивается наружу, и клетка сохраняет круглую форму. В обезвоженной клетке меньше воды выталкивается наружу, поэтому клетка становится морщинистой.
Вода также способствует образованию мембран, окружающих клетки. Каждая клетка на Земле окружена мембраной, большая часть которой состоит из двух слоев молекул, называемых фосфолипидами (рис. 3).Фосфолипиды, как и вода, имеют два отдельных компонента: полярную «голову» и неполярный «хвост». Из-за этого полярные головы взаимодействуют с водой, а неполярные хвосты стараются избегать воды и вместо этого взаимодействуют друг с другом. Стремясь к этим благоприятным взаимодействиям, фосфолипиды спонтанно образуют бислои с головками, обращенными наружу к окружающей воде, и хвостами, обращенными внутрь, исключая воду. Двойной слой окружает клетки и избирательно позволяет таким веществам, как соли и питательные вещества, входить и выходить из клетки.Взаимодействия, участвующие в формировании мембраны, достаточно сильны, чтобы мембраны образовывались спонтанно и их нелегко было разрушить. Без воды клеточные мембраны не имели бы структуры, а без надлежащей структуры мембран клетки не могли бы удерживать важные молекулы внутри клетки и вредные молекулы снаружи клетки.
Помимо влияния на общую форму клеток, вода также влияет на некоторые фундаментальные компоненты каждой клетки: ДНК и белки. Белки производятся в виде длинной цепочки строительных блоков, называемых аминокислотами, и для правильного функционирования им необходимо сворачиваться в определенную форму. Вода управляет свертыванием аминокислотных цепей, поскольку различные типы аминокислот ищут и избегают взаимодействия с водой. Белки обеспечивают структуру, принимают сигналы и катализируют химические реакции в клетке. Таким образом, белки являются рабочими лошадками клеток.В конечном итоге белки управляют сокращением мышц, общением, перевариванием питательных веществ и многими другими жизненно важными функциями. Без правильной формы белки не смогли бы выполнять эти функции, и клетка (не говоря уже о целом человеке) не смогла бы выжить. Точно так же ДНК должна иметь определенную форму, чтобы ее инструкции можно было правильно расшифровать. Белки, которые считывают или копируют ДНК, могут связываться только с ДНК определенной формы. Молекулы воды окружают ДНК упорядоченным образом, чтобы поддерживать ее характерную конформацию двойной спирали.Без этой формы клетки не смогли бы следовать подробным инструкциям, закодированным в ДНК, или передавать инструкции будущим клеткам, что сделало бы человеческий рост, размножение и, в конечном счете, выживание невозможными.
Точно так же ДНК должна иметь определенную форму, чтобы ее инструкции можно было правильно расшифровать. Белки, которые считывают или копируют ДНК, могут связываться только с ДНК определенной формы. Молекулы воды окружают ДНК упорядоченным образом, чтобы поддерживать ее характерную конформацию двойной спирали.Без этой формы клетки не смогли бы следовать подробным инструкциям, закодированным в ДНК, или передавать инструкции будущим клеткам, что сделало бы человеческий рост, размножение и, в конечном счете, выживание невозможными.
Вода принимает непосредственное участие во многих химических реакциях по созданию и разрушению важных компонентов клетки. Фотосинтез, процесс в растениях, который создает сахара для всех форм жизни, требует воды. Вода также участвует в построении более крупных молекул в клетках.Молекулы, такие как ДНК и белки, состоят из повторяющихся звеньев более мелких молекул. Соединение этих небольших молекул происходит в результате реакции, в результате которой образуется вода. И наоборот, вода требуется для обратной реакции, которая расщепляет эти молекулы, позволяя клеткам получать питательные вещества или перепрофилировать части больших молекул.
И наоборот, вода требуется для обратной реакции, которая расщепляет эти молекулы, позволяя клеткам получать питательные вещества или перепрофилировать части больших молекул.
Кроме того, вода защищает клетки от опасного воздействия кислот и щелочей. Сильнокислотные или щелочные вещества, такие как отбеливатель или соляная кислота, вызывают коррозию даже самых прочных материалов.Это связано с тем, что кислоты и основания выделяют избыточный водород или поглощают избыточный водород, соответственно, из окружающих материалов. Потеря или приобретение положительно заряженных атомов водорода нарушает структуру молекул. Как мы узнали, белкам для правильного функционирования требуется определенная структура, поэтому важно защищать их от кислот и щелочей. Вода делает это, действуя одновременно и как кислота, и как основание (рис. 4). Хотя химические связи внутри молекулы воды очень стабильны, молекула воды может отдать водород и стать ОН–, действуя, таким образом, как основание, или принять другой водород и стать h4O+, действуя таким образом как кислота. Эта приспособляемость позволяет воде бороться с резкими изменениями pH из-за кислых или щелочных веществ в организме в процессе, называемом буферизацией. В конечном счете, это защищает белки и другие молекулы в клетке.
Эта приспособляемость позволяет воде бороться с резкими изменениями pH из-за кислых или щелочных веществ в организме в процессе, называемом буферизацией. В конечном счете, это защищает белки и другие молекулы в клетке.
В заключение хочу сказать, что вода необходима для жизни. Его универсальность и адаптируемость помогают выполнять важные химические реакции. Его простая молекулярная структура помогает поддерживать важные формы внутренних компонентов клеток и внешней мембраны.Ни одна другая молекула не может сравниться с водой по уникальным свойствам, поддерживающим жизнь. Интересно, что исследователи продолжают устанавливать новые свойства воды, такие как дополнительные эффекты ее асимметричной структуры. Ученым еще предстоит определить физиологическое воздействие этих свойств. Удивительно, как простая молекула универсально важна для организмов с разнообразными потребностями.
Молли Сарген — аспирантка первого курса программы биологических и биомедицинских наук Гарвардской медицинской школы.
Дэн Аттер — аспирант пятого курса органической и эволюционной биологии Гарвардского университета.
Для получения дополнительной информации:- Чтобы узнать больше о важности растворимости лекарств, см. эту статью.
- Ознакомьтесь с этими статьями для получения дополнительной информации о белках и о том, как вода влияет на их свертывание.
- Узнайте больше о фосфолипидах здесь.
- Узнайте больше о влиянии воды на структуру ДНК здесь.
- Узнайте больше о кислотах и основаниях здесь.
- Ознакомьтесь с уникальными свойствами воды на этой странице или недавно открытыми свойствами воды в этой статье.
Эта статья является частью нашего специального выпуска о воде. Чтобы узнать больше, посетите нашу домашнюю страницу специального выпуска!
2.
 2 Вода – Концепции биологии – 1-е канадское издание
2 Вода – Концепции биологии – 1-е канадское изданиеК концу этого раздела вы сможете:
- Описать свойства воды, имеющие решающее значение для поддержания жизни
Посмотрите видео о том, зачем нам нужен кислород и как он создает проблемы для живых существ.
Вы когда-нибудь задумывались, почему ученые тратят время на поиски воды на других планетах? Это потому, что вода необходима для жизни; даже мельчайшие следы его на другой планете могут указывать на то, что жизнь могла существовать или существовала на этой планете. Вода — одна из наиболее распространенных молекул в живых клетках и наиболее важная для жизни, какой мы ее знаем. Примерно 60–70 процентов вашего тела состоит из воды. Без него жизни просто не было бы.
Атомы водорода и кислорода в молекулах воды образуют полярные ковалентные связи.Общие электроны проводят больше времени, связанного с атомом кислорода, чем с атомами водорода. У молекулы воды нет общего заряда, но есть небольшой положительный заряд на каждом атоме водорода и небольшой отрицательный заряд на атоме кислорода. Из-за этих зарядов слегка положительные атомы водорода отталкиваются друг от друга и образуют уникальную форму. Каждая молекула воды притягивает другие молекулы воды из-за положительных и отрицательных зарядов в разных частях молекулы.Вода также притягивает другие полярные молекулы (например, сахара), образуя водородные связи. Когда вещество легко образует водородные связи с водой, оно может растворяться в воде и называется гидрофильным («водолюбивым»). Водородные связи нелегко образуются с неполярными веществами, такими как масла и жиры. Эти неполярные соединения являются гидрофобными («водобоязненными») и не растворяются в воде.
Из-за этих зарядов слегка положительные атомы водорода отталкиваются друг от друга и образуют уникальную форму. Каждая молекула воды притягивает другие молекулы воды из-за положительных и отрицательных зарядов в разных частях молекулы.Вода также притягивает другие полярные молекулы (например, сахара), образуя водородные связи. Когда вещество легко образует водородные связи с водой, оно может растворяться в воде и называется гидрофильным («водолюбивым»). Водородные связи нелегко образуются с неполярными веществами, такими как масла и жиры. Эти неполярные соединения являются гидрофобными («водобоязненными») и не растворяются в воде.
Водородные связи в воде позволяют ей поглощать и выделять тепловую энергию медленнее, чем многие другие вещества. Температура является мерой движения (кинетической энергии) молекул. Чем больше движение, тем выше энергия и, следовательно, выше температура. Вода поглощает большое количество энергии, прежде чем ее температура повысится. Повышенная энергия разрушает водородные связи между молекулами воды. Поскольку эти связи могут создаваться и разрушаться быстро, вода поглощает увеличение энергии и изменения температуры лишь в минимальной степени.Это означает, что вода смягчает изменения температуры внутри организмов и в окружающей их среде. По мере поступления энергии баланс между образованием и разрушением водородных связей смещается в сторону разрушения. Больше связей разрывается, чем образуется. Этот процесс приводит к высвобождению отдельных молекул воды на поверхности жидкости (например, водоема, листьев растения или кожи организма) в процессе, называемом испарением . Испарение пота, состоящего на 90 процентов из воды, позволяет охлаждать организм, так как разрыв водородных связей требует затрат энергии и отводит тепло от тела.
Чем больше движение, тем выше энергия и, следовательно, выше температура. Вода поглощает большое количество энергии, прежде чем ее температура повысится. Повышенная энергия разрушает водородные связи между молекулами воды. Поскольку эти связи могут создаваться и разрушаться быстро, вода поглощает увеличение энергии и изменения температуры лишь в минимальной степени.Это означает, что вода смягчает изменения температуры внутри организмов и в окружающей их среде. По мере поступления энергии баланс между образованием и разрушением водородных связей смещается в сторону разрушения. Больше связей разрывается, чем образуется. Этот процесс приводит к высвобождению отдельных молекул воды на поверхности жидкости (например, водоема, листьев растения или кожи организма) в процессе, называемом испарением . Испарение пота, состоящего на 90 процентов из воды, позволяет охлаждать организм, так как разрыв водородных связей требует затрат энергии и отводит тепло от тела.
И наоборот, по мере уменьшения молекулярного движения и снижения температуры выделяется меньше энергии для разрыва водородных связей между молекулами воды. Эти связи остаются неповрежденными и начинают формировать жесткую решетчатую структуру (например, лед) (рис. 2.8 a ). В замороженном виде лед менее плотный, чем жидкая вода (молекулы находятся дальше друг от друга). Это означает, что лед плавает на поверхности водоема (рис. 2.8 b ). В озерах, прудах и океанах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения от замерзания в воде.Если бы этого не произошло, растения и животные, живущие в воде, замерзли бы в глыбе льда и не могли бы свободно передвигаться, что сделало бы жизнь при низких температурах затруднительной или невозможной.
Эти связи остаются неповрежденными и начинают формировать жесткую решетчатую структуру (например, лед) (рис. 2.8 a ). В замороженном виде лед менее плотный, чем жидкая вода (молекулы находятся дальше друг от друга). Это означает, что лед плавает на поверхности водоема (рис. 2.8 b ). В озерах, прудах и океанах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения от замерзания в воде.Если бы этого не произошло, растения и животные, живущие в воде, замерзли бы в глыбе льда и не могли бы свободно передвигаться, что сделало бы жизнь при низких температурах затруднительной или невозможной.
Поскольку вода полярна, имеет небольшие положительные и отрицательные заряды, ионные соединения и полярные молекулы могут легко растворяться в ней. Таким образом, вода — это то, что называют растворителем — веществом, способным растворять другое вещество. Заряженные частицы будут образовывать водородные связи с окружающим слоем молекул воды. Это называется сферой гидратации и служит для разделения или диспергирования частиц в воде. В случае поваренной соли (NaCl), смешанной с водой, ионы натрия и хлорида разделяются или диссоциируют в воде, и вокруг ионов образуются сферы гидратации. Положительно заряженный ион натрия окружен частично отрицательно заряженными атомами кислорода в молекулах воды.Отрицательно заряженный ион хлора окружен частично положительными зарядами атомов водорода в молекулах воды. Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных ролях в живых системах.
Таким образом, вода — это то, что называют растворителем — веществом, способным растворять другое вещество. Заряженные частицы будут образовывать водородные связи с окружающим слоем молекул воды. Это называется сферой гидратации и служит для разделения или диспергирования частиц в воде. В случае поваренной соли (NaCl), смешанной с водой, ионы натрия и хлорида разделяются или диссоциируют в воде, и вокруг ионов образуются сферы гидратации. Положительно заряженный ион натрия окружен частично отрицательно заряженными атомами кислорода в молекулах воды.Отрицательно заряженный ион хлора окружен частично положительными зарядами атомов водорода в молекулах воды. Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных ролях в живых системах.
Вы когда-нибудь наполняли стакан водой до самого верха, а затем медленно добавляли еще несколько капель? Прежде чем перелиться через край, вода на самом деле образует куполообразную форму над краем стакана. Эта вода может оставаться над стеклом благодаря свойству когезии . При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-воздух (газ), хотя в стекле больше нет места. Когезия порождает поверхностное натяжение , способность вещества выдерживать разрыв при растяжении или напряжении. Когда вы бросаете небольшой клочок бумаги на каплю воды, бумага плавает поверх капли воды, хотя объект плотнее (тяжелее), чем вода.Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Когезия и поверхностное натяжение удерживают молекулы воды неповрежденными, а предмет плавает на поверхности. Можно даже «поплавать» стальной иглой поверх стакана с водой, если поместить ее осторожно, не нарушая поверхностного натяжения.
Эта вода может оставаться над стеклом благодаря свойству когезии . При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-воздух (газ), хотя в стекле больше нет места. Когезия порождает поверхностное натяжение , способность вещества выдерживать разрыв при растяжении или напряжении. Когда вы бросаете небольшой клочок бумаги на каплю воды, бумага плавает поверх капли воды, хотя объект плотнее (тяжелее), чем вода.Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Когезия и поверхностное натяжение удерживают молекулы воды неповрежденными, а предмет плавает на поверхности. Можно даже «поплавать» стальной иглой поверх стакана с водой, если поместить ее осторожно, не нарушая поверхностного натяжения.
 Обратите внимание на углубление в воде вокруг иглы.
Обратите внимание на углубление в воде вокруг иглы.Эти когезионные силы также связаны со свойством воды адгезии или притяжением между молекулами воды и другими молекулами. Это наблюдается, когда вода «поднимается» по соломинке, помещенной в стакан с водой. Вы заметите, что вода кажется выше по бокам соломинки, чем в середине. Это происходит потому, что молекулы воды притягиваются к соломинке и поэтому прилипают к ней.
Силы сцепления и сцепления важны для поддержания жизни.Например, из-за этих сил вода может течь от корней к верхушкам растений, чтобы питать растение.
Концепция в действии
Чтобы узнать больше о воде, посетите Геологическую службу США «Наука о воде для школ: все о воде»! Веб-сайт.
pH раствора является мерой его кислотности или щелочности. Вы, вероятно, использовали лакмусовую бумагу , бумагу, обработанную натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH, чтобы проверить, сколько кислоты или основания (щелочность) существует в растворе. Возможно, вы даже использовали его, чтобы убедиться, что вода в открытом бассейне правильно очищена. В обоих случаях этот тест pH измеряет количество ионов водорода, присутствующих в данном растворе. Высокие концентрации ионов водорода приводят к низкому pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Общая концентрация ионов водорода обратно пропорциональна его рН и может быть измерена по шкале рН (рис. 2.11). Следовательно, чем больше ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше рН.
Возможно, вы даже использовали его, чтобы убедиться, что вода в открытом бассейне правильно очищена. В обоих случаях этот тест pH измеряет количество ионов водорода, присутствующих в данном растворе. Высокие концентрации ионов водорода приводят к низкому pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Общая концентрация ионов водорода обратно пропорциональна его рН и может быть измерена по шкале рН (рис. 2.11). Следовательно, чем больше ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше рН.
Шкала рН колеблется от 0 до 14. Изменение на одну единицу по шкале рН соответствует изменению концентрации ионов водорода в 10 раз, изменение на две единицы соответствует изменению концентрации ионов водорода в коэффициент 100. Таким образом, небольшие изменения pH представляют большие изменения концентрации ионов водорода. Чистая вода нейтральна. Он не является ни кислым, ни основным, и имеет рН 7,0. Все, что ниже 7,0 (в диапазоне от 0,0 до 6,9), является кислым, а все, что выше 7. 0 (от 7,1 до 14,0) – щелочной. Кровь в ваших венах слабощелочная (pH = 7,4). Среда в желудке очень кислая (pH = 1–2). Апельсиновый сок слабокислый (pH = примерно 3,5), тогда как пищевая сода имеет щелочную реакцию (pH = 9,0).
0 (от 7,1 до 14,0) – щелочной. Кровь в ваших венах слабощелочная (pH = 7,4). Среда в желудке очень кислая (pH = 1–2). Апельсиновый сок слабокислый (pH = примерно 3,5), тогда как пищевая сода имеет щелочную реакцию (pH = 9,0).
Кислоты представляют собой вещества, которые обеспечивают ионы водорода (H + ) и снижают pH, тогда как основания обеспечивают ионы гидроксида (OH – ) и повышают pH.Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота и лимонный сок очень кислые и легко отдают H + при добавлении к воде. И наоборот, основания — это те вещества, которые легко отдают OH — . Ионы OH – объединяются с H + с образованием воды, которая повышает pH вещества. Гидроксид натрия и многие бытовые чистящие средства очень щелочные и быстро выделяют OH – при попадании в воду, тем самым повышая pH.
Большинство клеток в нашем организме функционируют в очень узком интервале шкалы рН, обычно в диапазоне от 7,2 до 7,6. Если pH тела выходит за пределы этого диапазона, дыхательная система работает со сбоями, как и другие органы тела. Клетки больше не функционируют должным образом, а белки разрушаются. Отклонение за пределы диапазона pH может вызвать кому или даже смерть.
Так как же мы можем глотать или вдыхать кислотные или основные вещества и не умирать? Буферы — это ключ. Буферы легко поглощают избыток H + или OH – , тщательно поддерживая pH тела в вышеупомянутом узком диапазоне. Углекислый газ является частью важной буферной системы в организме человека; он поддерживает pH в нужном диапазоне. Эта буферная система включает анион угольной кислоты (H 2 CO 3 ) и бикарбоната (HCO 3 – ). Если в организм попадает слишком много H + , бикарбонат соединяется с H + , образуя угольную кислоту и ограничивая снижение pH. Аналогичным образом, если в систему ввести слишком много ОН – , угольная кислота быстро диссоциирует на бикарбонат и ионы Н + . Ионы H + могут соединяться с ионами OH – , ограничивая увеличение pH. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, потому что угольная кислота высвобождается из организма в виде углекислого газа каждый раз, когда мы дышим. Без этой буферной системы рН в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Аналогичным образом, если в систему ввести слишком много ОН – , угольная кислота быстро диссоциирует на бикарбонат и ионы Н + . Ионы H + могут соединяться с ионами OH – , ограничивая увеличение pH. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, потому что угольная кислота высвобождается из организма в виде углекислого газа каждый раз, когда мы дышим. Без этой буферной системы рН в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Вода обладает многими свойствами, которые имеют решающее значение для поддержания жизни. Он полярен, что позволяет образовывать водородные связи, которые позволяют ионам и другим полярным молекулам растворяться в воде. Таким образом, вода является отличным растворителем. Водородные связи между молекулами воды придают воде способность удерживать тепло лучше, чем многие другие вещества. По мере повышения температуры водородные связи между водой постоянно разрываются и восстанавливаются, что позволяет общей температуре оставаться стабильной, хотя в систему добавляется повышенная энергия.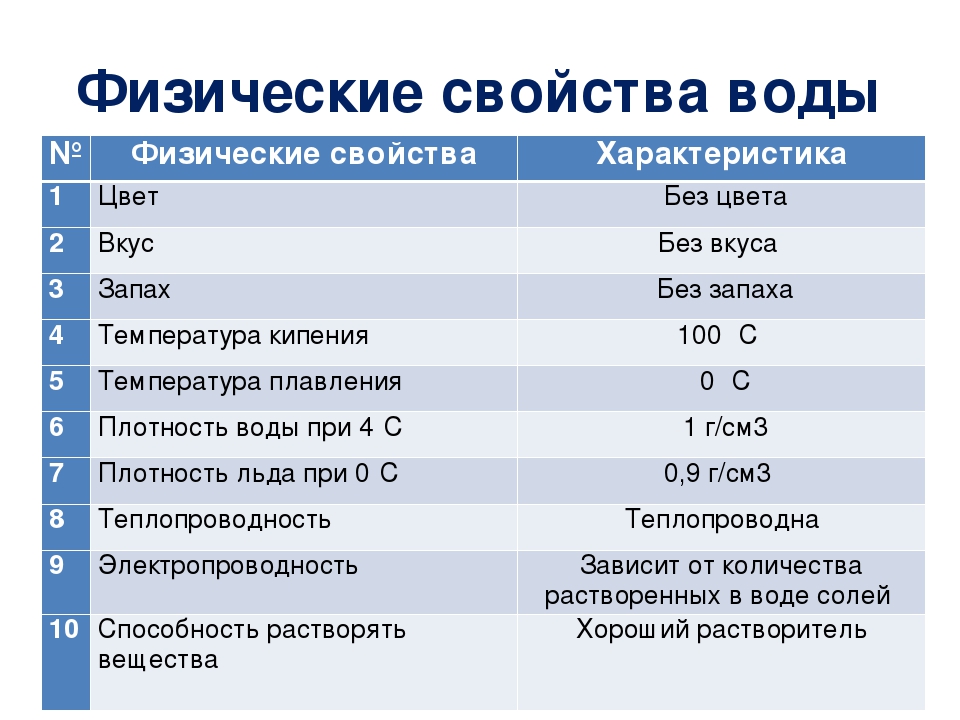 Силы сцепления воды учитывают свойство поверхностного натяжения. Все эти уникальные свойства воды важны в химии живых организмов.
Силы сцепления воды учитывают свойство поверхностного натяжения. Все эти уникальные свойства воды важны в химии живых организмов.
рН раствора является мерой концентрации ионов водорода в растворе. Раствор с большим количеством ионов водорода является кислым и имеет низкое значение рН. Раствор с большим количеством гидроксид-ионов является основным и имеет высокое значение рН. Шкала рН колеблется от 0 до 14, при этом рН 7 является нейтральным. Буферы представляют собой растворы, которые смягчают изменения pH при добавлении в буферную систему кислоты или основания.Буферы важны в биологических системах из-за их способности поддерживать постоянный уровень рН.
кислота: вещество, которое отдает ионы водорода и поэтому снижает pH
адгезия: притяжение между молекулами воды и молекулами другого вещества
основание: вещество, которое поглощает ионы водорода и поэтому повышает рН
буфер: раствор, устойчивый к изменению pH за счет поглощения или выделения ионов водорода или гидроксида
когезия: межмолекулярные силы между молекулами воды, вызванные полярной природой воды; создает поверхностное натяжение
испарение: высвобождение молекул воды из жидкой воды с образованием водяного пара
гидрофильный: описывает вещество, которое растворяется в воде; водолюбивый
гидрофобный: описывает вещество, которое не растворяется в воде; боящийся воды
лакмусовая бумага: фильтровальная бумага, обработанная натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH
Шкала pH: шкала от 0 до 14, которая измеряет приблизительную концентрацию ионов водорода в веществе
растворитель: вещество, способное растворять другое вещество
поверхностное натяжение: сила сцепления на поверхности тела жидкости, которая предотвращает разделение молекул
температура: мера молекулярного движения
Ссылки
Хамфри, В. , Dalke, A. и Schulten, K., «VMD-Visual Molecular Dynamics», J. Molec. Графика , 1996, вып. 14, стр. 33-38. http://www.ks.uiuc.edu/Research/vmd/
, Dalke, A. и Schulten, K., «VMD-Visual Molecular Dynamics», J. Molec. Графика , 1996, вып. 14, стр. 33-38. http://www.ks.uiuc.edu/Research/vmd/
Атрибуция СМИ
- Рисунок 2.7 Гаутам Догра
- Рисунок 2.8
- ледяная решетка Джейн Уитни
- (б) Карлоса Понте
- Рисунок 2.10 Кори Занкера
- Рисунок 2.11 Эдварда Стивенса
Биологическое значение воды — Online Biology Notes
Некоторое биологическое значение воды;
1.
Вода в качестве биологического растворителя:- Вода является отличным растворителем полярных веществ. К ним относятся ионные вещества, такие как соли, которые содержат заряженные частицы, и некоторые неионные вещества, такие как сахар, которые содержат полярные группы (слегка отрицательно заряженные гидроксильные группы)
- Когда полярное вещество растворяется в воде, ионы и полярные группы окружаются молекулами воды, которые разделяют ионов или молекул друг от друга.

- Когда вещество находится в растворе, его молекулы или ионы могут свободно двигаться, что делает его более химически активным, чем если бы оно было твердым.Таким образом, большинство биохимических реакций в клетках протекают в водном растворе.
- Неполярные молекулы, такие как липиды, отталкиваются водой и обычно группируются вместе, образуя объемные молекулы. Таким образом, эти неполярные молекулы известны как гидрофобные.
- Вода как среда для диффузии
2.
Вода как транспортная среда:- Растворяющая способность воды делает ее прекрасной транспортной средой в крови, лимфатической системе, пищеварительном тракте, ксилеме и флоэме растений.
3.
Состав ячейки:- 70-95% типичной клетки содержит воду
4.
Различные биологические функции воды r:- Вода способствует рассеиванию семян, гамет и личиночных стадий водных организмов, а также оплодотворению плавающими гаметами
- Она также способствует прорастанию семян путем набухания и вскрытия тесты и дальнейшего развития в росте клеток
- Помогает в транспирации у растений
- Помогает в осморегуляции у животных, такой как охлаждение путем испарения, например, потоотделение и одышка
- Вода также помогает в поддерживающем механизме, например, у кольчатых червей вода действует как гидростатический скелет
- Вода также помогает в защите.
 Например, слезная жидкость, слизь
Например, слезная жидкость, слизь
5.
Высокая теплоемкость воды:- Теплоемкость воды – это количество теплоты, необходимое для повышения температуры 1 кг воды на 1°C.
- Вода обладает высокой теплоемкостью. Это означает, что для повышения относительно небольшой температуры требуется большое количество тепла. Это связано с тем, что большая часть энергии расходуется на разрыв водородных связей, которые ограничивают движение молекул.
- Изменение температуры воды сведено к минимуму благодаря ее высокой теплоемкости.Таким образом, биохимические процессы протекают в меньшем диапазоне температур, протекают с более постоянной скоростью и с меньшей вероятностью будут тормозиться экстремальными температурами.
- Вода также обеспечивает очень постоянную внешнюю среду для многих клеток и организмов
6.
Вода имеет высокую теплоту парообразования:- Скрытая теплота парообразования — это мера тепловой энергии, необходимой для испарения жидкости, чтобы преодолеть силы притяжения между ее молекулами, чтобы они могли выйти в виде газа.

- Для испарения воды требуется относительно большое количество тепловой энергии. Это связано с водородной связью. В результате вода имеет необычно высокую температуру кипения для такой маленькой молекулы.
- Энергия, передаваемая молекулам воды, чтобы затем испариться, приводит к потере энергии из их окружения, таким образом происходит охлаждение. Потоотделение и тяжелое дыхание млекопитающих, открывание рта некоторыми рептилиями, такими как крокодил, и испарение листьев способствуют охлаждению тела.
- Высокая теплота парообразования означает, что большое количество тепла может быть потеряно при минимальной потере воды из тела.
7.
Вода имеет высокую теплоту плавления:- Скрытая теплота плавления является мерой тепловой энергии, необходимой для плавления твердого тела.
- Из-за высокой теплоемкости воды для таяния льда требуется относительно большое количество тепла.
- И наоборот, жидкая вода должна терять относительно большое количество тепловой энергии, чтобы замерзнуть.

- Содержимое клеток и окружающая их среда менее подвержены замерзанию. Кристаллы льда особенно опасны, если они развиваются внутри клеток.
8.
Плотность и свойство замерзания воды:- Плотность воды уменьшается ниже 4°C, поэтому лед плавает в воде.
- Поскольку лед плавает, он сначала образуется на поверхности, а в последнюю очередь на дне. Если бы водоемы промерзали снизу вверх, пресноводные организмы не могли бы существовать в арктическом климате.
- Лед изолирует воду под ним, тем самым увеличивая шансы организма на выживание в воде.
- Также лед быстрее тает на поверхности.
- Вода с температурой ниже 4°C имеет тенденцию подниматься вверх, что способствует циркуляции воды, что приводит к круговороту питания и заселению воды на большую глубину.
9.
Высокое поверхностное натяжение и сцепление:- Когезия — это сила, благодаря которой отдельные молекулы слипаются.

- На поверхности жидкости между молекулами существует сила, называемая поверхностным натяжением, в результате силы сцепления между молекулами. Это приводит к тому, что поверхность жидкости занимает наименьшую возможную площадь поверхности.
- Поверхностное натяжение воды выше, чем у любой другой жидкости. Высокая когезия молекулы воды важна в клетках и в перемещении воды через ксилему в растениях.
- Многие мелкие организмы полагаются на поверхностное натяжение воды, чтобы оседать на воде или кататься на коньках по ее поверхности.
10.
Вода в качестве реагента:- Вода является биологически важным метаболитом для биохимических реакций в клетке.
- Вода является источником водорода в процессе фотосинтеза и используется в реакции гидролиза.
Биологическое значение воды
Каковы некоторые примеры свойств воды?
Основными свойствами воды являются ее полярность, когезия, адгезия, поверхностное натяжение, высокая удельная теплоемкость и охлаждение при испарении.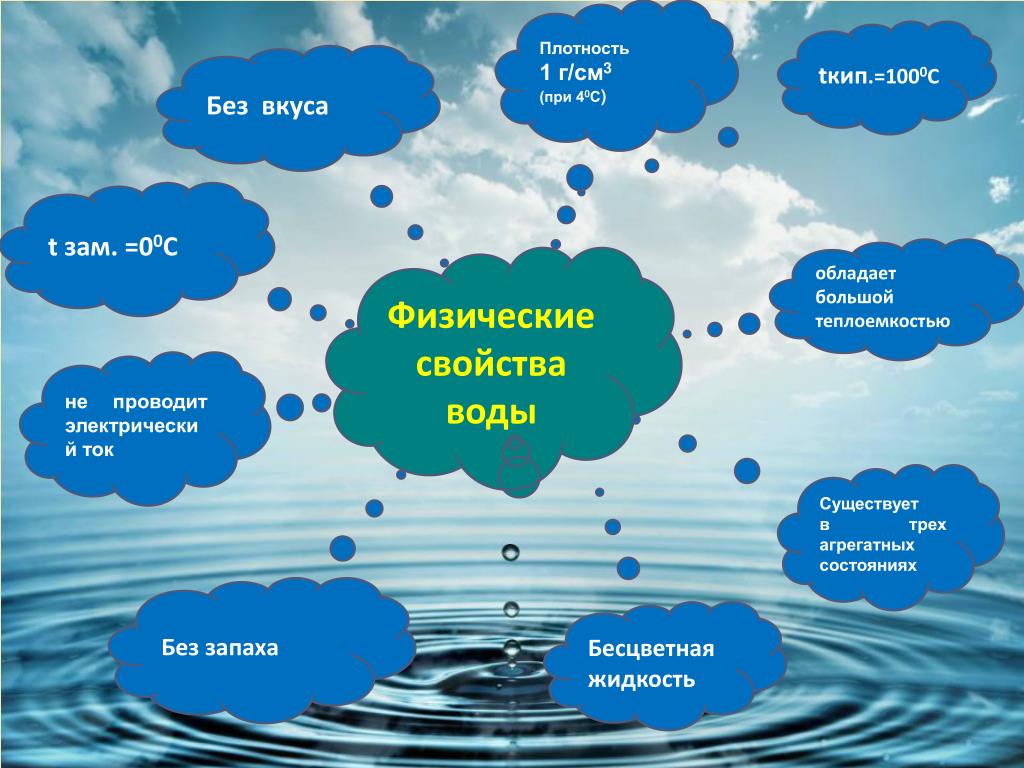
Полярность
Молекула воды слегка заряжена с обоих концов. Это связано с тем, что кислород более электроотрицательный, чем водород.
Посмотрите видео, где изгибается струя воды — в демонстрации используется пластиковая линейка.Поток воды изгибается из-за полярности молекул воды.
Видео от: Ноэль Пауллер
Когезия
Водородные связи удерживают молекулы воды вместе, как показано на рисунке выше. Когезия создает поверхностного натяжения , поэтому, если вы наполните ложку водой, капля за каплей, объем воды на самом деле будет больше, чем поверхность ложки, прежде чем вода упадет.
Вот видео, показывающее, как скрепка может «плавать» по воде — на самом деле она удерживается водородными связями, образующимися между молекулами воды, которые придают воде ее поверхностное натяжение.
Видео от: Ноэль Пауллер
Адгезия
Подобно когезии, но адгезия возникает, когда водородные связи в воде позволяют молекулам воды удерживаться на другом веществе.
Высокая удельная теплоемкость
Удельная теплоемкость – это количество тепла, поглощаемое или теряемое при изменении температуры на 1°C 1 г, что в случае воды довольно велико. Это позволяет происходить испарительному охлаждению , когда тепловая энергия передается молекулам воды, а испаряющаяся вода удаляет много тепловой энергии из организма (например,когда мы потеем)
Другими важными характеристиками воды являются то, что она является универсальным растворителем , наряду с ее необычной плотностью . Вода, в отличие от любой другой твердой жидкости, более плотная в жидкой форме, чем в твердом состоянии, поэтому лед плавает, и это позволяет существовать целым средам обитания под слоями льда, плавающими в океанах. Его нейтральный pH (7) также является важной характеристикой.
Его нейтральный pH (7) также является важной характеристикой.
Определение воды и примеры — Биологический онлайн-словарь
Вода
n., множественное число: воды
[ˈwɔtəɹ]
Определение: молекула, состоящая из двух атомов водорода, связанных ковалентной связью с центральным атомом кислорода
Вода Определение
(1) ( биохимия ) Химическое вещество с химической формулой H 2 O, прозрачная, бесцветная жидкость без запаха и вкуса, которая также может встречаться в различных формах, таких как газ (водяной пар) и твердое тело (лед)
(2) Водный раствор вещества, например, аммиачная вода , сточные воды
(3) Водоем, такой как моря, реки и озера, а также природная вода, такая как минеральная вода
(4) Амниотическая жидкость, как в воды беременной женщины
Вода (химическая формула: H 2 O) относится к химическому веществу, состоящему из двух атомов водорода, присоединенных ковалентной связью к центральному атому кислорода. Эта конфигурация приводит к молекуле, которая является полярной . Поскольку молекула воды поляризована, электроположительный водород одной молекулы воды электростатически притягивается к электроотрицательному атому кислорода соседней молекулы воды. Электростатическое диполь-дипольное взаимодействие между молекулами воды называется водородной связью .
Эта конфигурация приводит к молекуле, которая является полярной . Поскольку молекула воды поляризована, электроположительный водород одной молекулы воды электростатически притягивается к электроотрицательному атому кислорода соседней молекулы воды. Электростатическое диполь-дипольное взаимодействие между молекулами воды называется водородной связью .
Преходящие водородные связи между молекулами воды образуют прозрачную бесцветную жидкость без запаха и вкуса.Помимо жидкости, вода может также существовать в других формах, таких как газ (как водяной пар ) и твердое тело (как лед). Водородные связи между молекулами воды ответственны за отличительные свойства воды, такие как высокая температура кипения (100 °C), высокое поверхностное натяжение, удельная теплоемкость, и теплота парообразования . 1
Свойства воды
Вода считается универсальным растворителем в первую очередь благодаря своим химическим и физическим свойствам. Это одно из основных неорганических соединений, имеющих биологическое значение; другие — углекислый газ, кислород и минеральные вещества и соли . Некоторые отличительные свойства воды перечислены ниже.
Это одно из основных неорганических соединений, имеющих биологическое значение; другие — углекислый газ, кислород и минеральные вещества и соли . Некоторые отличительные свойства воды перечислены ниже.
Вода является жидкостью при стандартных условиях. Это жидкость без вкуса и почти без запаха при температуре окружающей среды и давлении. Он также прозрачен, что позволяет обитать в нем водным растениям, поскольку через него может проникать солнечный свет. Вода в твердом состоянии называется льдом.Вода расширяется (а не сжимается) при температуре менее 4 °C. Таким образом, при замерзании он становится менее плотным. Это заставляет затвердевшую воду (лед) плавать над поверхностью. Следовательно, организмы все еще могут жить под ледяной поверхностью океанов и морей. Вода имеет высокую теплоту парообразования и ее газообразное состояние называется водяным паром. Водяной пар на Земле переносится конвекцией в атмосферу. Это приводит к образованию облаков. Облака, в свою очередь, обеспечивают дождевой водой живые организмы.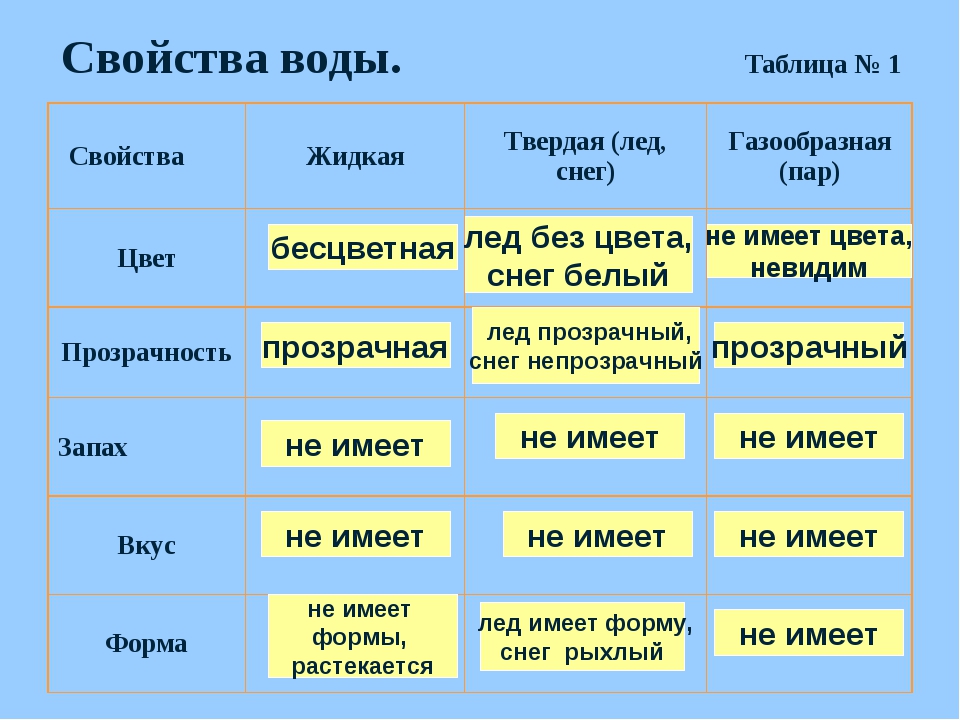
Полярная молекула
Молекула воды состоит из одного центрального атома кислорода и двух связанных с ним атомов водорода относительно меньшего размера. Каждый из этих атомов водорода связан с кислородом ковалентной связью. Это приводит к частично положительному полюсу и частично к отрицательному полюсу (таким образом, делая молекулу воды полярной). Помимо ковалентной связи, он образует временную водородную связь с соседней молекулой воды. Молекулы воды прилипают друг к другу водородной связью.
Вода является полярной молекулой из-за того, что кислород имеет небольшой отрицательный заряд , а ее водороды имеют небольшой положительный заряд .Его полярность делает его отличным растворителем для многих веществ. Слегка отрицательный кислород притягивает катионы, тогда как слегка положительный водород притягивает анионы. Таким образом, вода обладает способностью диссоциировать и ионизировать молекулы.
Высокое поверхностное натяжение
Вода имеет относительно высокое поверхностное натяжение. Это означает, что молекулы воды имеют большее притяжение друг к другу (из-за сцепления ), чем с молекулами воздуха (из-за сцепления ).Вода имеет низкую вязкость, а это означает, что она имеет низкое сопротивление течению. Эти свойства важны для растений, так как замедляют потерю воды из устьиц листьев. Насекомым, способным ходить по воде, помогает высокое поверхностное натяжение воды.
Это означает, что молекулы воды имеют большее притяжение друг к другу (из-за сцепления ), чем с молекулами воздуха (из-за сцепления ).Вода имеет низкую вязкость, а это означает, что она имеет низкое сопротивление течению. Эти свойства важны для растений, так как замедляют потерю воды из устьиц листьев. Насекомым, способным ходить по воде, помогает высокое поверхностное натяжение воды.
Адгезионные свойства
Вода обладает высокими адгезионными свойствами. Из-за этого вода обладает способностью к капиллярному действию, тенденции двигаться вверх по узкой трубке против силы тяжести, свойству, на которое полагаются сосудистые растения, такие как деревья.
Удельная теплоемкость
Вода имеет вторую по величине удельную теплоемкость (после аммиака). Удельная теплоемкость относится к количеству энергии (в калориях или джоулях), необходимой для повышения температуры одного грамма чистого вещества на 1 градус Цельсия. Высокая удельная теплоемкость воды помогает поддерживать температуру на Земле, пригодную для жизни. Например, океан днем поглощает большую часть солнечного излучения, а ночью рассеивает его в атмосферу.
Например, океан днем поглощает большую часть солнечного излучения, а ночью рассеивает его в атмосферу.
Биологическое значение
Вода является одним из веществ, необходимых для жизни. Биомолекулы (например, ДНК, белки и полисахариды), газы, витамины и т. д. растворяются в воде. Вода может действовать как транспортная среда для доставки этих веществ к различным частям тела. Он также действует как важный реагент в некоторых биохимических процессах.
Биомолекулы (например, ДНК, белки и полисахариды), газы, витамины и т. д. растворяются в воде. Вода может действовать как транспортная среда для доставки этих веществ к различным частям тела. Он также действует как важный реагент в некоторых биохимических процессах.
Вода необходима растениям для фотосинтеза.Поскольку молекулы воды полярны , они могут образовывать между собой временные водородные связи и тем самым способствовать образованию биомолекулярных структур, таких как ДНК и белки. Также из-за полярности воды она может взаимодействовать с ионами и другими полярными молекулами.
Вода также играет важную роль в диссоциации соединений на ионы. Таким образом, он помогает регулировать уровень pH. Молекулы или вещества, легко растворимые в воде, описываются как гидрофильные . И наоборот, те, которые плохо растворяются в воде, описываются как гидрофобные .Говорят, что они неполярны и вода не растворяет их легко. Взаимодействие воды с полярными и неполярными молекулами имеет решающее значение для функции и структуры липидно-бислойной плазматической мембраны. Молекула воды является самой распространенной молекулой внутри клетки, на ее долю приходится около 70% или более от общей массы клетки. 2 В цитозоле клетки содержится вода (вместе с ионами, растворенными веществами и другими молекулами).
Молекула воды является самой распространенной молекулой внутри клетки, на ее долю приходится около 70% или более от общей массы клетки. 2 В цитозоле клетки содержится вода (вместе с ионами, растворенными веществами и другими молекулами).
Вода, содержащаяся в организме человека, обозначается как вода тела .Это происходит в тканях, таких как кости, мышцы, жировая ткань, кровь и практически везде. Тело среднего взрослого человека состоит примерно на 50-60 % из воды. Тело новорожденного содержит более высокий процент воды (до 93% массы тела). Вода тела у человека (да и у животных тоже) содержится в различных жидкостях организма, т.е. внеклеточной жидкости и внутриклеточной жидкости.
Внеклеточная жидкость — это жидкость, которая содержится в областях тела вне клеток и составляет 1/3 воды тела. внутриклеточные жидкости находятся внутри клеток. Они составляют около 2/3 воды организма.
Воды на земле тоже предостаточно. Он существует в твердом, жидком или газообразном состоянии. Около 70% поверхности Земли составляет вода. Водоемы на Земле служат важной средой обитания для водных организмов и источником воды для наземных живых существ. Три основных типа водной среды обитания: морская вода, пресная вода и солоноватая вода.
Он существует в твердом, жидком или газообразном состоянии. Около 70% поверхности Земли составляет вода. Водоемы на Земле служат важной средой обитания для водных организмов и источником воды для наземных живых существ. Три основных типа водной среды обитания: морская вода, пресная вода и солоноватая вода.
Использование термина
Помимо того, что он определяется как химическое вещество с химической формулой H 2 O, этот термин может также относиться к водоему, такому как море, реки и озера, а также к природным вода типа минеральная вода .Это может также относиться к водному раствору вещества, например, аммиачная вода , сточные воды . Это также разговорный термин для амниотической жидкости , которая представляет собой подтекание жидкости до или в начале родов, до разрыва амниона.
Читать:
Ссылки:
- Rae-Dupree, J. & DuPree, P. (2019, 1 января). 4 типа химических связей – муляжи.
 Получено с сайта ://www.dummies.com/education/science/anatomy/4-types-of-chemical-bonds/ Ссылка
Получено с сайта ://www.dummies.com/education/science/anatomy/4-types-of-chemical-bonds/ Ссылка - Cooper, G.М. (2000, 1 января). Молекулярный состав клеток. Получено с сайта ://www.ncbi.nlm.nih.gov/books/NBK9879/ Ссылка
© Biology Online. Контент предоставлен и модерируется онлайн-редактором Biology Online Editors
. СледующийСвойства воды
УЗНАТЬ О СВОЙСТВАХ ВОДЫ
Структура молекулы воды создает слабое притяжение между кислородным концом
одной молекулы и водородными концами других молекул воды.Хотя эти
«полярные» связи относительно слабы и постоянно рвутся и восстанавливаются, их
существование приводит к многим особым свойствам воды по сравнению с другими веществами
на земле.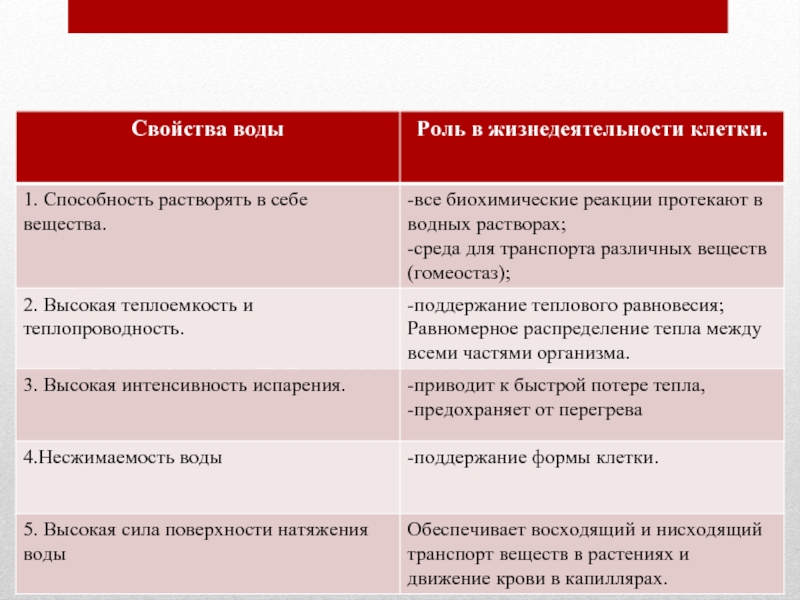 Эти свойства воды в значительной степени ответственны за жизнь на Земле.
Эти свойства воды в значительной степени ответственны за жизнь на Земле.
Ниже приведены естественные свойства воды, на которые человек может существенно повлиять. виды деятельности: химические, физические и биологические.
ХИМИЧЕСКИЕ СВОЙСТВА
Природные воды всегда содержат растворенные соли, микроэлементы, некоторые металлы и газы. На самом деле в воде растворяется так много веществ, что ее иногда (ошибочно) называют как «Универсальный растворитель». Хотя большинство этих веществ важны для здоровья водные экосистемы, по мере увеличения концентрации они могут оказывать негативное воздействие и мы думаем о них как о загрязнителях.
ФИЗИЧЕСКИЕ СВОЙСТВА
БИОЛОГИЧЕСКИЕ СВОЙСТВА
Растения
Водные растения — это фотосинтезирующие организмы, приспособленные к жизни в воде. Наземные растения
в основном «сосудистые» растения, имеющие корни, которые поглощают и транспортируют воду и питательные вещества.
к листьям, где происходит фотосинтез. Многие водные растения имеют более простое строение.
Этим «макрофитам» не нужно транспортировать воду, так как они живут в воде, и
как правило, они могут получать питательные вещества непосредственно из воды. Тип и форма, которые
водные растения принимают в зависимости от глубины воды и от того, течет ли вода
(реки и ручьи) или неподвижные (озера, пруды или водно-болотные угодья.)
Наземные растения
в основном «сосудистые» растения, имеющие корни, которые поглощают и транспортируют воду и питательные вещества.
к листьям, где происходит фотосинтез. Многие водные растения имеют более простое строение.
Этим «макрофитам» не нужно транспортировать воду, так как они живут в воде, и
как правило, они могут получать питательные вещества непосредственно из воды. Тип и форма, которые
водные растения принимают в зависимости от глубины воды и от того, течет ли вода
(реки и ручьи) или неподвижные (озера, пруды или водно-болотные угодья.)
Бактерии
С точки зрения качества воды нас больше всего беспокоит роль бактерий в развитии болезней. Бактерии и родственные им одноклеточные организмы
все более признается за их важность в разложении органических материалов, обработке
минералы и питательные вещества, а в некоторых случаях преобразование углекислого газа в новый растительный материал.
Бактерии и родственные им одноклеточные организмы
все более признается за их важность в разложении органических материалов, обработке
минералы и питательные вещества, а в некоторых случаях преобразование углекислого газа в новый растительный материал.
ДРУГИЕ ВОЗДЕЙСТВИЯ
.





 Воннегута
«Колыбелька для кошки» см.
тут.
Воннегута
«Колыбелька для кошки» см.
тут.


 Дождитесь снегопада и подсчитайте количество снежинок разных типов,
зафиксировав при этом погодные условия, в которых проводилось
исследование (можно перевести
инструкцию по проведению наблюдений и
таблицу для подсчета типов снежинок).
Дождитесь снегопада и подсчитайте количество снежинок разных типов,
зафиксировав при этом погодные условия, в которых проводилось
исследование (можно перевести
инструкцию по проведению наблюдений и
таблицу для подсчета типов снежинок).





 Участвует в ряде химических реакций.
Участвует в ряде химических реакций.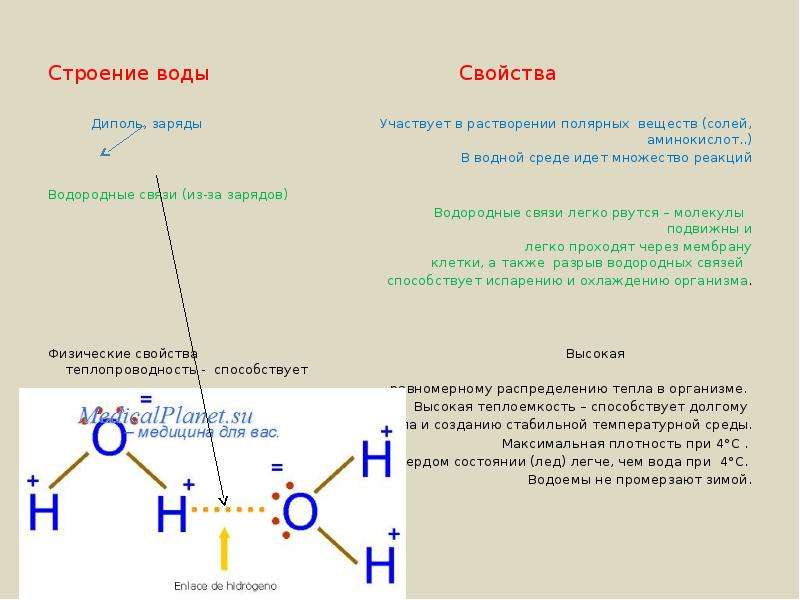 Эта связь называется «водородной связью». Вода обладает уникальными свойствами благодаря своей полярности и водородным связям между ее молекулами.
Эта связь называется «водородной связью». Вода обладает уникальными свойствами благодаря своей полярности и водородным связям между ее молекулами.
 Это помогает живым организмам иметь постоянную температуру, которая необходима для жизненных процессов, происходящих в их телах. Клетки содержат много воды, чтобы поддерживать постоянную температуру.
Это помогает живым организмам иметь постоянную температуру, которая необходима для жизненных процессов, происходящих в их телах. Клетки содержат много воды, чтобы поддерживать постоянную температуру. Вязкость – это сопротивление жидкости течению.
Вязкость – это сопротивление жидкости течению. Поверхностное замерзание действует как изолятор, предотвращая замерзание остальной воды.
Поверхностное замерзание действует как изолятор, предотвращая замерзание остальной воды.
 Например, слезная жидкость, слизь
Например, слезная жидкость, слизь


 Получено с сайта ://www.dummies.com/education/science/anatomy/4-types-of-chemical-bonds/ Ссылка
Получено с сайта ://www.dummies.com/education/science/anatomy/4-types-of-chemical-bonds/ Ссылка